Галина Михайловна Савельева
Акушерство и гинекология
Предисловие
Настоящий учебник по акушерству отличается от предыдущих аналогичных изданий тем, что впервые в его написании принял участие коллектив ведущих отечественных ученых, имеющих большой опыт педагогической работы.Благодаря техническому прогрессу в медицине изменились представления о многих патофизиологических процессах, происходящих в организме матери, плода и новорожденного, разработаны современные подходы к диагностике, терапии и профилактике различных осложнений беременности и родов. Все это выдвигает новые требования к обучению и соответственно к учебной литературе. Наряду с включением во все разделы учебника современных сведений о научных достижениях сохранена основа классического акушерства, представленная в учебниках и учебных пособиях, изданных в предыдущие годы (авторы Г.Г.Гентер, К.К.Скробанский, М.С.Малиновский, И.Ф.Жорданиа, В.И.Бодяжина, К.Н.Жмакин и др.). Широко использованы материалы монографий отечественных и зарубежных авторов последних лет.
Наряду с основополагающими направлениями акушерской науки, принятыми в нашей стране, высказывается точка зрения авторов иностранных учебников по акушерству. Знание особенностей преподавания отдельных разделов акушерства за рубежом позволит учащимся и врачам легче ориентироваться в мировой научной и практической литературе.
В данном учебнике существенный акцент сделан на достижениях в области перинатологии, что объясняется современной направленностью акушерства на охрану здоровья будущих поколений.
В отличие от предшествующих учебник содержит разделы, которые раньше либо отсутствовали, либо содержание их носило справочный характер. К таковым относятся "Плацентарная недостаточность", "Медико-генетическое консультирование и пренатальная диагностика", "Изосерологическая несовместимость крови матери и плода", "Внутриутробная инфекция", "Септический шок", "Геморрагический шок", "Планирование семьи" и др. Вопросы организации акушерской помощи в нашей стране представлены в конце учебника, что связано с необходимостью манипулирования акушер-скими терминами и понятиями, которые учащиеся узнают только к концу обучения.
Учебник составлен в соответствии с программой, утвержденной МЗ РФ, и рассчитан на студентов медицинских вузов, ординаторов, аспирантов.
Все замечания и пожелания авторы воспримут с благодарностью и постараются их учесть в дальнейшей работе.
Зав. кафедрой акушерства и гинекологии педиатрического факультета РГМУ академик РАМН профессор Г.М.Савельева
Глава 1. Основные этапы развития акушерства. перинатология
Основные этапы развития акушерства
Акушерство (франц. accoucher – помогать при родах) – область клинической медицины, изучающая физиологические и патологические процессы, происходящие в организме женщины, связанные с зачатием, беременностью, родами и послеродовым периодом, а также разрабатывающая методы родовспоможения, профилактики и лечения осложнений беременности и родов, заболеваний плода и новорожденного.Зарождение акушерской практики.
Акушерство в первобытном обществе. Акушерство зародилось на заре человечества. Исторические исследования позволяют предположить, что уже в период каменного века (неолита) существовала помощь в родах, которую оказывали старшие, опытные женщины, колдуны и шаманы. Акушерская помощь наряду с рациональными приемами, безусловно имевшими место, сочеталась с использованием амулетов, заклинаний, специальных средств народной медицины, в том числе лекарственных трав.
Акушерство древних цивилизаций – Вавилона и Египта – опиралось на многовековой опыт эпохи неолита. К сожалению, воссоздать состояние акушерской практики в этот период невозможно из-за отсутствия достоверных письменных источников.
Акушерство в Древней Греции и Древнем Риме.
Древняя Греция дала миру выдающихся представителей не только философского учения и искусства, но и медицины. Высокий уровень древнегреческой медицины был признан другими народами, и на протяжении двух тысячелетий медицина, изложенная в Сборнике Гиппократа, была основой медицины в Европе.
Высокий уровень медицинских знаний, изложенных в текстах Сборника Гиппократа, свидетельствует о том, что к моменту окончания этого труда медицина Древней Греции, в частности акушерство, прошла долгий путь развития.
В Сборнике указывалась истинная продолжительность беременности: 280 дней (4 раза по 10 нед, или 10 раз по 4 нед), хотя допускались и другие сроки (210 дней, или 3 раза по 10 нед). Единственно правильным положением плода в матке в конце беременности считалось головное предлежание. Поперечное, косое и тазовое предлежания рассматривались как ненормальное. Полагали, что до 7 мес беременности плод в матке находится в тазовом предлежании, а затем поворачивается головкой вниз вследствие силы тяжести и в результате разрыва тяжей, удерживающих его в положении головкой вверх. Главной причиной наступления родов считалось то, что ребенок, испытывая голод, упирается ножками в дно матки и за счет активных Движений рождается на свет. Однако нужно отметить, что некоторое значение в процессе родов последователями Гиппократа придавалось также сократительной деятельности матки и брюшному прессу. Достаточно подробно рассматривались вопросы, посвященные диагностике и диететике беременности.
В Сборнике описывались такие виды патологии беременности и родов, как привычное невынашивание, пузырный занос, кровотечения, эклампсия, преждевременное излитие околоплодных вод, выпадение и обвитие пуповины, аномалии положения плода в матке. Впервые было представлено подробное описание или упоминание о многих акушерских операциях. При полном ножном предлежании предлагалось не тянуть за ножки и дожидаться самопроизвольного рождения плода. Если при этом головка застревала в родовых путях, считалось целесообразным производить декапитацию и краниотомию. При ягодичном предлежании рекомендовался поворот на головку, при выпадении ручки – вправление ручки, при поперечных и косых положениях – операция эмбриотомии, при задержке плаценты в матке – ее ручное удаление.
Большое внимание в Сборнике уделено патологии послеродового периода. Упоминаются повреждения половых органов, воспалительные процессы, изменения положения матки, послеродовые параличи, эклампсия. Особое значение в происхождении осложнений послеродового периода придавалось задержке лохий, многие лечебные и профилактические мероприятия были направлены на устранение этой патологии.
Выдающимся врачом древнегреческой медицины, внесшим огромный вклад в развитие акушерства, был С оран Эфесский (начало II века до н.э.). Он оставил после себя труд по акушерству и гинекологии, состоящий из четырех книг.
Соран впервые в истории акушерства описал такой акушерский прием, как зашита промежности, а среди осложнений послеродового периода – задержку последа в матке, которую он связывал либо с плотным прикреплением плаценты, либо со спазмом матки.
Гален (129-199) уделял большое внимание проблемам, связанным с акушерством. Основные заслуги Галена в истории акушерства состоят в анатомическом описании половых органов и таза, в развитии эмбриологии, которой он увлекался всю жизнь. Гален первым описал в общих чертах анатомию таза.
Акушерство в средние века.
Состояние акушерства в раннее средневековье во многом отражает состояние медицины в целом. Книги по акушерству в основном представляли собой разделы из учений античных авторов, но именно этому периоду мы обязаны тем, что до нас дошли многие медицинские тексты.
Постепенное возрождение медицины в Европе началось в Салерно (XI-ХП века). В это время здесь вышла книга по акушерству под названием "Тротула", которая представляла собой антологию трудов античных авторов, но при этом имела и самостоятельное значение. В ней подчеркивалось, что главная роль в рождении плода принадлежит не активным движениям плода, а сокращениям матки. Кроме того, в этой книге содержалось описание разрывов промежности.
В XIII-XV веках появились сообщения о кесаревом сечении на мертвых, описывались отдельные случаи акушерской патологии, давались рекомендации по диететике женщин во время беременности и в послеродовом периоде.
Акушерство в XV-XVI веках.
Начало этого времени ознаменовалось коренным пересмотром многих анатомических воззрений Галена, на протяжении нескольких веков считавшихся незыблемой истиной.
Андрей Везалий (1515-1564) отверг господствовавшее на протяжении многих веков учение о расхождении лонного сочленения в родах и точно описал различия мужского, женского и детского таза. Кроме того, он подробно описал строение мускулатуры матки и связи матки с соседними органами. Везалий первым указал на то, что, кроме двух зародышевых листков плодного яйца (хориона и амниона), существует еще "первая и самая наружная оболочка", имеющая характерное железистое строение, т.е. децидуальная оболочка. В 1566 г. Везалий дополнил анатомическое описание половых органов точным описанием девственной плевы и сыровидной смазки, покрывающей тело плода.
Габриэле Фаллопий (1523-1562) впервые отметил, что влагалище является отдельным от матки органом. Он же гораздо подробнее, чем его предшественники, описал яйцеводы у женщины, которые он назвал маточными трубами. Фаллопий точно описал анатомию круглых маточных связок, а в яичниках он наблюдал "пузырьки либо с водянистым, либо с желтоватым, либо с мутным содержимым", т.е. фолликулы и желтые тела. Он первым употребил термин "плацента". Ученик Везалия Джулио Чезаре Аранцио подробно описал многие детали фетоплацентарного кровообращения и строение плода.
В XVI веке центром развития акушерства стала Франция. Ученые Франции возродили поворот плода на ножку и первыми указали на возможность проведения операции кесарева сечения на живой женщине.
Акушерство в XVII веке.
В истории акушерства XVII век занимает особое место. Если предыдущее столетие дало много нового в области анатомии родовых путей и плода, то в XVII столетии продолжает развиваться учение о физиологии беременности. Именно в этот период был сделан важный вывод о том, что "плод в матке живет не душой матери, а своей собственной жизнью".
Значительные успехи в XVII веке были достигнуты в изучении яичников. Нильс Стенсен (Николай Стеной, 1638-1686), профессор из Копенгагена, был первым, кто однозначно высказался за то, что "женские яички" содержат яйца и что матка у женщины выполняет функцию, аналогичную функции яйцеводов у яйцекладущих млекопитающих. Подробное описание яичников и маточных труб оставил голландец Ренье де Грааф.
В XVII веке впервые была четко сформулирована концепция существования у женщины яйцеклетки, созревающей в яичнике.
Центром развития клинического акушерства в этот период оставалась Франция, где были заложены основы классического оперативного акушерства.
Представительницей французской школы акушерства являлась Луиза Буржуа, работы которой появились в 1609-1642 гг. и были переведены на многие языки. Она была первой, кто подробно описал роды в лицевом предлежании, случаи выпадения пуповины, определила показания к применению поворота плода на ножку и др.
Франсуа Морисо был первым французским хирургом, который занимался почти исключительно акушерством. Его труд "Болезни беременных женщин и родильниц и т.д." (1668), переведенный на многие языки и выдержавший большое число изданий, стал настольной книгой для многих поколений врачей и акушерок во всем мире. Морисо первым описал ручное пособие при тазовых предлежаниях по освобождению головки плода.
Еще одной страной, много сделавшей для развития акушерства в XVII веке, была Голландия. Особо следует отметить заслугу Гендрика ван Девентера, который одним из первых начал изучение узкого таза, в том числе и плоского. Ван Девентер подчеркивал, что оценка размеров таза должна быть неотъемлемой частью акушерского исследования.
Акушерство в Англии в XVII веке в целом существенно отставало от французского. Однако англичане сыграли значительную роль в области использования акушерских щипцов. Так, Чемберлен (1670) специально ездил в Париж, чтобы ознакомить Морисо с акушерскими щипцами, но Морисо предложил Чемберлену заведомо неподходящий для наложения щипцов вариант родов у карлицы с абсолютно узким тазом. В результате женщина погибла, а внедрение акушерских щипцов в широкую практику в Европе (кроме Англии и Голландии) было заторможено на несколько десятилетий.
Акушерство в XVIII веке.
XVIII век ознаменовался важным изменением в статусе акушерства: произошло соединение двух дисциплин – акушерства и медицины. До этого периода акушерство было практически целиком в руках повивальных бабок и хирургов. Практически во всех европейских странах стали открываться так называемые родовспомогательные заведения, родильные дома для бедных, соединенные со школами для акушерок. Было положено начало системе специальной подготовки акушерских кадров по стандартным программам.
В широкую практику вошло применение операции наложения акушерских щипцов. Быстрое развитие медицины привело к образованию национальных научных школ акушерства в Европе, хотя лидерство в этой области продолжало принадлежать Франции.
Знаменитым французским акушером XVIII века был Андре Левре (1703-1780). Левре принадлежат большие заслуги в создании учения о женском тазе и о механизме родов. Он первым предложил термины "вход" и "выход" в малом тазе, выделил косые размеры таза, предложил определение "ось малого таза". Им был предложен способ борьбы с атоническими кровотечениями введением руки акушера в полость матки. Модель щипцов, предложенная Левре, стала основой классических французских акушерских щипцов.
Крупнейшим французским акушером рубежа XVIII-XIX веков был Жан Луи Боделок (1746-1810). Боделок известен своим учебником "Принципы повивального искусства", ставшего настольной книгой нескольких поколений врачей всего мира. Боделок предложил проводить наружное и внутреннее тазоизмерение, усовершенствовал модель акушерских щипцов.
Мировую славу английскому акушерству принес Вильям Смелли (1697-1763), внедрив тазоизмерение в повседневную акушерскую практику. Смелли внес большой вклад в изучение механизма родов и подробно описал плоскорахитический таз.
Бурное развитие акушерства в XVIII веке затронуло и Германию. Реформатором немецкого акушерства стал знаменитый Иоганн Георг Редерер (1726-1763) – профессор анатомии, хирургии и повивального искусства Геттингенского университета. Редерер много занимался изучением анатомии родовых путей, механизма родов. Он предложил разделение механизма родов на пять моментов, первым обратил внимание на важность наружного акушерского исследования.
Акушерство в XIX веке.
В этот период развитие смежных дисциплин, таких, как гистология и физиология, в свою очередь связанных с развитием химии, физики и техники, обогатило акушерство новыми сведениями о строении и функции генеративных органов женщины, развитии плода.
Значительные успехи были достигнуты в XIX веке в области физиологии беременности. Открытие в 1827 г. К.М.Бэром яйцеклетки у человека знаменовало собой ряд исследований самых ранних этапов беременности: оплодотворения, транспорта оплодотворенного яйца, имплантации.
Огромное значение для клинического акушерства имела разработка метода аускультации плода. Хотя существование сердечных тонов плода было известно еще в XVII веке, только в 1818 г. "женский" хирург Ф.Й. Майор указал, что если приложить ухо к животу беременной, то по сердцебиению плода можно определить, жив он или нет.
Во второй половине XIX века появилось учение о нижнем маточном сегменте. М.Дункан (1869) высказал идею о том, что верхняя часть шейки матки в течение беременности, раскрываясь, становится частью плодовместилища. Эта концепция была поддержана Карлом Шредером (1867) и Петером Мюллером (1868). Систематическое учение о наружном акушерском исследовании было разработано Г.Леопольдом и представителями его школы.
В XIX веке было значительно развито учение о женском тазе. Этим мы прежде всего обязаны таким исследователям, как Ф.К. Негеле (1825), братья Э. и Г. Веберы (1836), Г.А. Михаэлис (1851), К.К.Т. Литцман (1861). Благодаря исследованиям этих авторов были изучены строение женского таза, размеры нормального таза в разных плоскостях, направление проводной оси таза.
Настоящей революцией в акушерстве стало введение в практику антисептики и асептики. Предыстория этого связана с Англией. Здесь врачи, исходя из учения о контагиозности послеродовой лихорадки, призывали акушеров, бывших в контакте с инфекционными и лихорадящими больными, тщательно мыть руки и менять одежду, чтобы не перенести "заразное начало" здоровым роженицам. Й.Ф. Земмельвейс (1847) был первым, кто понял истинную причину послеродовой лихорадки (те же факторы, которые вызывают сепсис) и предложил эффективный способ профилактики послеродовой лихорадки с помощью мытья рук хлорной водой. К сожалению, коллеги подвергли учение Земмельвейса острой критике, и только после работ Луи Пастера, Дж.Листера и Р.Коха, которые подвели научную основу под во многом интуитивное учение Й.Ф.Земмельвейса, антисептика вошла в акушерство обходным путем через хирургию.
Большое значение имело введение Дж. Симпсоном (1847) в акушерскую практику наркоза. Вначале для этого применяли хлороформ, а затем – эфир.
Развитие асептики и хирургической техники к концу XIX века привело к возрождению операции кесарева сечения. Была детально разработана техника так называемого классического корпорального кесарева сечения. Усовершенствование техники операции, применение наркоза и соблюдение принципов асептики привели к тому, что к концу XIX века смертность от кесарева сечения значительно снизилась.
Очень большое влияние на акушерскую тактику оказало открытие в середине XX века антибиотиков, применение которых стало одним из главных факторов резкого снижения материнской смертности в начале 60-х годов.
История акушерства в России.
Долгое время в России акушерская помощь осуществлялась повитухами. Со второй половины XVII века, особенно начиная с Петровского времени, в России появляется большое число иностранных врачей с докторскими дипломами известных западных университетов. Эти врачи обслуживали не только царскую семью, как это было в допетровское время, но и многих богатых людей.В 1707 г. по указу Петра I в Москве в Немецкой слободе была создана Госпитальная школа при Генеральном госпитале. Госпитальная школа была первым высшим медицинским учебным заведением в России, немало сделавшим для развития медицины в нашей стране.
Необходимость реформ медицинского образования и акушерской помощи хорошо осознавалась в России. Реформы были разработаны директором Медицинской канцелярии Павлом Захаровичем Кондоиди и осуществлены в царствование Елизаветы Петровны и Екатерины П. П.3.Кондоиди составил определение медицинской канцелярии об учреждении и организации школ для бабнчьего дела (как тогда называли акушерство) в Москве и Петербурге и 2) марта 1754 г. представил его на рассмотрение Приятельствующего Сената. Этот проект предусматривал подготовку собственных русских акушерок Курс учения длился 6 лет. Для преподавания повивального искусства в каждой школе назначались "профессор бабичьего дела" и его помощник – лекарь или акушер.
Правительствующий Сенат 5 мая 1754 г. утвердил представление Медицинской канцелярии и ассигновал кредит в 3000 руб. на первоначальное учреждение бабичьего дела. В то время это были очень большие деньги. После такого материального обеспечения акушерских школ можно было приступать к их открытию, что Кондоиди и сделал немедленно, почти одновременно в Москве и Петербурге. В Московской школе был избран профессором Иоганн Фридрих Эразмус с титулом "доктор бабичьего дела".
Таким образом, с 1758 г. в Москве существовала акушерская школа (впоследствии преобразованная в Повивальный институт при Московском императорском воспитательном доме), руководимая профессором-акушером. В первые десятилетия существования этой школы (до открытия Повивального института в 1801 г.) занятия с акушерками проводились на дому у профессора акушерства. И.Ф.Эразмус проводил занятия с городскими акушерками в своей квартире на Новой Басманной улице. Он руководил Московской акушерской школой вплоть до своей смерти.
И.Ф.Эразмус был опытным врачом-практиком и прекрасным педагогом, автором первого в России учебника по повивальному искусству, академиком одной из научных академий, профессором, который впервые в России применил акушерские щипиы н произвел операцию кесарева сечения.
Выдающимся деятелем русского акушерства XVIII века был Нестор Максимович Максимович Амбодик (1744-1812). Он обучался в Петербургской госпитальной школе и в 1770 г. был направлен по особой (Голицынской) стипендии на медицинский факультет Страсбургского университета. По возвращении в Петербург Н.М.Максимович-Амбодик преподавал в госпитальной школе и одновременно в обоих петербургских госпиталях. С самого начала своей педантической деятельности он значительно видоизменил и улучшил преподавание, введя занятия на фантоме. Для этого он заказал по собственным моделям и рисункам фантом женского таза с деревянным ребенком, акушерские щипцы ("клещи") с деревянными рукоятками, серебряный катетер и пр.
За большие заслуги Медицинская коллегия в 1782 г. присвоила Н.М-Максимовичу-Амбодику звание профессора повивального искусства. Им было написано первое русское оригинальное руководство по акушерству под названием "Искусство повивания, или Наука о бабичьем деле" (1784 – 1786).
Систематическое преподавание акушерства в Московском университете было начато в 1790 г. Вильгельмом Михайловичем Рихтером. С 1801 по 1807 г. В.М.Рихтер был директором созданного им Повивального института при Московском императорском воспитательном доме.
Открытие факультетских клиник Московского университета на Рождественке в 1846 г. знаменовало собой важный этап в жизни медицинского факультета. Отныне клинический метод преподавания стал основой всего учебного процесса. В результате этого медицинский факультет Московского университета встал в один ряд с лучшими медицинскими учебными заведениями Европы и появилась возможность подготовки большого числа хорошо обученных врачей, столь необходимых России.
В 1851 г. клиника Московского университета в связи с отставкой В.М.Рихтера по выслуге лет перешла под руководство бывшего ассистента Дерптского университета, а затем адъюнкта московской клиники профессора Владимира Ивановича Коха, одновременно являвшегося директором родовспомогательного заведения при Московском императорском воспитательном доме. В.И.Кох был первым профессором акушерства в Москве, начавшим читать лекции на русском языке. Он значительно изменил и сам метод преподавания. Лекции В. И Коха служили образцом по богатству научного содержания, ясности изложения, прекрасной литературной обработке материала. При В.И.Кохе началась защита первых написанных порусски диссертаций.
Новый период в жизни клиники наступил в 1874 г., когда ею стал заведовать Александр Матвеевич Макеев. Он ввел антисептику в акушерстве. С первых же дней своей педагогической деятельности он учил студентов, что "родильная горячка" – не эпидемия, а эндемия и сепсис. В клинике широко пользовались различными антисептическими средствами (йодоформ, сулема, карболовая кислота, креолин).
А.П. Матвеев предложил профилактику офтальмобленнореи введением в конъюнктивальные мешки новорожденных 2 % раствора ляписа, что способствовало почти полной ликвидации этого опасного заболевания.
К 70-м годам XIX века клиника на Рождественке перестала удовлетворять требованиям современного акушерства. Новая акушерская клиника, открытая в 1889 г. на Девичьем поле, начала успешно справляться с этой задачей.
В конце 70-х – начале 80-х годов XIX века прогресс в области акушерства распространяется и на другие регионы России. Благодаря деятельности земства возникают благоустроенные родильные дома, приюты и школы для повивальных бабок. Акушерские клиники русских университетов начинают давать стране не только образованных специалистов-практиков, но и научных исследователей. Создаются акушерско-гинекологические общества, созыпаются съезды акушеров и гинекологов, выходят специальные акушерские журналы. В это время в России возникают специальные учреждения, имеющие целью усовершенствование врачей в области акушерства и гинекологии. С открытием Высших женских медицинских курсов русским женщинам открылся доступ к полноправной врачебной деятельности, в том числе в области акушерства.
В Петербургской академии кафедру акушерства в 1848 г. занял талантливый ученик Н.И.Пирогова А.А. Кит ер (1813-1879). В 1858 г. на этом посту его заменил выдающийся русский акушер А.Я. Крассовский (1821 – 1898). В 1872 г. он покинул академию и занял должность директора Петербургского родовспомогательного заведения, которым руководил до конца жизни. Он реорганизовал систему родовспомогательного и лечебного дела, предоставил широкую возможность усовершенствования врачам с периферии, развернул большую научно-исследовательскую работу. Благодаря введенной А.Я.Крассовским системе строгих профилактических мероприятий смертность родильниц снизилась с 4 до 0,2 %. А.Я.Крассовский оставил после себя два фундаментальных руководства: "Курс практического акушерства" и "Оперативное акушерство с включением учения о неправильностях женского таза". А.Я.Крассовский внес большой вклад в развитие учений об узком тазе и о механизме родов.
В 1876 г. кафедра акушерства и детских болезней Петербургской медико-хирургической академии разделилась на детскую и две акушерские – академическую и госпитальную. Во главе последних находились такие крупные ученые и педагоги, как М.И. Горвиц, К.Ф. Славянский, А.И. Лебедев, Г.Е. Рейн и др.
Большую роль в деле развития акушерства в России сыграла акушерская клиника Казанского университета. Научно-преподавательская и лечебная деятельность казанской кафедры особенно ярко проявилась в период пребывания на ней с 1885 по 1899 г. выдающегося русского акушера Н.Н. Феном енова (1855-1918). Им был предложен ряд новых методов акушерских и гинекологических операций, изобретены новые инструменты. В 1892 г. вышло руководство Н.Н.Феноменова "Оперативное акушерство", которое выдержало несколько изданий.
Дальнейший расцвет казанской школы связан с деятельностью крупнейшего представителя отечественного акушерства B.C. Груздева (1866-1938). Он был автором фундаментального руководства "Курс акушерства и женских болезней" (1919-1922; 1928; 1930), в котором отражен опыт русских акушеров-гинекологов за предыдущие полтора столетия.
Петербургский Клинический повивальный институт претерпел значительную реорганизацию после 1893 г., когда его директором был назначен выдающийся акушер-гинеколог Дмитрий Оскарович Отт (1855- 1923). Д.О.Отт организовал в институте широкую подготовку специализирующихся по акушерству и гинекологии врачей. В 1904 г. под руководством Отта были построены новые клинические и учебные корпуса института.
В XIX веке акушерские клиники при медицинских факультетах университетов открылись во многих городах России. В акушерской клинике Харьковского университета работал выдающийся русский акушер И.П. Лазаревич (1829-1902). В 1869 г. он организовал в Харькове Повивальный институт для подготовки акушерок. И.П.Лазаревич написал известное двухтомное руководство "Курс акушерства" (1877, 1892); он усовершенствовал многие акушерские инструменты. Особую известность приобрела его модификация акушерских щипцов – щипцы с прямыми ложками.
После переезда акушерской клиники Московского университета на Девичье поле среди молодых ученых клиники быстро выдвинулся талантливый врач Н.И. Побединский, создавший в 90-е годы XIX века новое хирургическое направление в акушерстве, которое поставило московскую акушерскую клинику в один ряд с крупными клиническими учреждениями России и Европы. Важными направлениями его научных исследований были проблемы асептики, антисептики и лечения послеродовых септических заболеваний. Диссертация Н.И.Побединского о предлежании плаценты получила известность и за пределами России. Большое внимание Н.И.Побединский уделял проблемам женского образования в России.
В 1923 г. акушерская и гинекологическая клиники Московского университета были объединены под руководством Михаила Сергеевича Малиновского. М.С.Малиновский успешно разрабатывал физиологическое направление в акушерстве. Он является автором известного руководства для студентов и врачей "Оперативное акушерство", выдержавшего несколько изданий.
В научной и педагогической работе принимал большое участие проф. В.В. Строганов, получивший известность благодаря предложенной им системе лечения эклампсии.
Крупным акушером-гинекологом советского периода был К. К. Скробанский (1874-1946), возглавлявший кафедру акушерства и гинекологии 1-го Ленинградского медицинского института. К.К.Скробанскнм был написан ряд трудов по акушерству, в том числе ставший классическим учебник акушерства. Ученый много занимался проблемами обезболивания родов.
Большой вклад в разработку таких проблем акушерства, как учение о биомеханизме родов и узкий таз, внес заведующий кафедрой акушерства 2-го Московского медицинского института И.Ф. Жорданиа. Он является автором известного учебника акушерства для студентов.
К.Н. Жмакин заведовал кафедрой акушерства и гинекологии 1-го Московского медицинского института с 1948 по 1967 г. Вместе с В.И.Бодяжиной он написал учебник акушерства, выдержавший несколько изданий. К.Н.Жмакин и его многочисленные ученики с успехом изучали такие актуальные проблемы, как оперативное акушерство, узкий таз и др.
Большой вклад в развитие отечественного акушерства внесли также Н.А. Цовьянов, Б.А. Архангельский (1890-1934), И.Е. Кватер, А.Э. Мандельштам, И.И. Яковлев, И.Л. Брауде (1882- I960) и др.
В.И. Бодяжина, прекрасный лектор и соавтор К.Н Жмакина по Учебнику акушерства для студентов, внесла большой вклад в разработку многих проблем акушерства (критические периоды внутриутробного развития плода, гипоксия плода и др.).
С именами академика АМН СССР Л.С. Персианинова и его учеников связана успешная разработка таких важнейших проблем акушерства, как регуляция сократительной деятельности матки, борьба с акушерским травматизмом, обезболивание родов. Л.С.Персианинову принадлежит также заслуга развития нового направления в акушерстве – антенатальной охраны плода, внедрение в акушерскую практику современных методов диагностики: электрои фонокардиографии плода, ультразвукового исследования, амнноцентеза и др. Л.С.Персианинов является автором двухтомного "Акушерского семинара", повторно переиздававшегося в 1973 и 1974 г.
Большим достижением акушерства советского периода было создание единой государственной системы охраны здоровья матери и ребенка. 28 декабря 1917 г. при Наркомате государственного призрения был сформирован отдел по охране младенчества, впоследствии преобразованный в отдел по охране материнства и младенчества. С 1920 г. этот отдел перешел в ведение Наркомата здравоохранения. В годы разрухи и гражданской войны этот отдел развернул широкую пропаганду идей охраны матери и ребенка среди широки* масс населения. Работа отдела в тот период состояла в составлении декретов, разработке инструкций и положений, созыве различных совещаний, конференций и т.д.
После окончания гражданской войны Наркомздрав приступил к широкой реорганизации акушерской помощи в стране. Основной задачей этого этапа было создание сети государственных акушерско-гинекологических учреждений, доступных для всего женского населения. Такими учреждениями стали фельдшерско-акушерские пункты, сельские родильные дома и женские консультации. К 1939 г число акушерских коек в сельских больницах и родильных домах было доведено в РСФСР до 26 795, а число коек в колхозных родильных домах – до 16 800.
Большую роль в развитии акушерской помощи сыграли всесоюзные съезды и совещания по охране материнства и младенчества, в работе которых принимали участие все ведущие акушеры-гинекологи страны.
В годы Великой Отечественной войны советские акушеры-гинекологи в тяжелых условиях продолжали оказывать помощь женщинам. Так, проф. К.К.Скробанский работал в осажденном Ленинграде в течение всего периода блокады.
В послевоенный период система охраны здоровья матери и ребенка продолжала развиваться. Родильные дома и женские консультации были укомплектованы высококвалифицированными специалистами. Качество и объем оказываемой акушерской помощи неуклонно повышались. Значительную роль в этом сыграла большая методическая работа, проводимая Министерствами здравоохранения СССР и РСФСР и ведущими специализированными институтами, в частности Научным центром акушерства, гинекологии и перинатологии РАМН (Москва), НИИ акушерства и гинекологии (Санкт-Петербург) и др.
Перинатология
Перинатологня – раздел медицины, прицельно направленный на изучение периода жизни человека, начиная с 28 нед беременности (масса плода 1000 г) и включая первые 7 дней после рождения. Название перинатологии происходит от трех слов: peri (греч.) – вокруг, около; natus (лат.) – рождение; logos (лат.) – учение.Перинатальный период включает время до родов – антенатальный, во время родов – интранатальный и после родов – неонатальный периоды. Перинатальный период является чрезвычайно важным для развития человека в последующем, так как к концу беременности заканчивается внутриутробное формирование плода, в процессе родов плод подвергается воздействию многих факторов, а в течение первых 7 дней проходит адаптацию к внеутробной жизни. Число плодов и новорожденных, погибших в анте-, интраили постнатальном периодах, определяет показатель перинатальной смертности, а появляющиеся в этот период заболевания – перинатальной заболеваемости. Предложение выделить анте-, интраи постнатальные периоды жизни человека связано с именем известного немецкого акушера Э.Залинга. Он указывал на необходимость тщательного изучения перинатального периода жизни человека с привлечением различных специалистов для снижения перинатальной заболеваемости и смертности. Это диктовалось наблюдавшимся в 50-70-е годы нашего столетия во многих странах Европы снижением рождаемости и одновременно высокими показателями перинатальной и младенческой (после 7 дней жизни) смертности. Идею Залинга поддержали многие ученые, и в 1976 г. было создано Европейское научное общество перинатологов. Перинатология начала бурно развиваться во всем мире.
В нашей стране основоположниками перинатологии явились НЛ.Гармашова (Санкт-Петербург), Л.С.Персианинов (Москва) и их ученики и последователи: Н.Н.Константинова, Г.М.Савельева, И.В.Ильин, В.М.Сидельникова, А.Н.Стрижаков, А.П.Кирющенков, М.В.Федорова и др.
По мере развития перинатологии временные параметры перинатального периода расширились – стали выделять пренатальное (дородовое) развитие зародыша и плода, начиная с процессов оплодотворения до 28 нед беременности. Таким образом, перинатология стала включать все периоды внутриутробного развития человека.
В настоящее время начало антенатального (дородового) периода относится к 22-23-й неделе гестации (масса плода 500 г), так как начиная с этого срока беременности возможно выживание родившегося плода в условиях адекватной терапии.
Уже на начальном этапе развития перинатологии возникло тесное сотрудничество акушеров и неонатологов, так как последним были необходимы сведения об особенностях течения беременности и родов, влиянии состояния матери на адаптацию новорожденного в первые 7 дней жизни и последующее его развитие. Акушеры в свою очередь проводили научные изыскания по взаимосвязи материнского, плодового организмов и новорож-денного. В дальнейшем к исследованиям были привлечены генетики, эмбриологи, биохимики, эндокринологи, анестезиологи-реаниматологи и др. В перинатологии возникли такие направления, как кардиология плода, фармакология, эндокринология. Научные исследования в этих направлениях позволили более адекватно оценивать патофизиологические процессы в организме плода и новорожденного » более направленно проводить корригирующую терапию. В практику акушерства и неонатологии все шире начали внедряться новейшие методы исследования. Фонография плода позволила более точно определять частоту сердечных сокращений, продолжительность систолы и диастолы, а также фиксировать сердечные шумы. Позднее была доказана возможность получать ЭКГ плода через переднюю брюшную стенку матери или влагалищным методом во время родов, после вскрытия плодного :п/зыря, когда электроды накладываются на предлежащую часть плода.
Регистрация сердечной деятельности плода с помощью наружной электрокардиографии и фонографии сменилась кардиомониторным наблюдением за изменением частоты сердечных сокращений на основании определения продолжительности каждого сердечного цикла. Было показано, что наибольшую значимость в оценке состояния плода как во время беременности так и во время родов имеет оценка фиксируемой частоты сердечных сокращений в определенный промежуток времени. Мониторный контроль за сердечной деятельностью плода позволяет определять ранние отклонения от нормы, т.е. выявлять страдание плода, которое чаще всего возникает в результате кислородной недостаточности вследствие самых различных осложнений беременности и родов.
Использование аппаратов, позволяющих в микродозах крови определить насыщение и напряжение кислорода, а также кислотно-основное состояние (КОС), дает возможность глубже изучить патогенез гипоксических состояний плода и новорожденного. Было показано, что для нормального состояния плода характерным является метаболический ацидоз, степень которого нарастает под влиянием гипоксии. Недоокисленные продукты обмена могут вызывать тканевую гипоксию – неспособность тканей усваивать кислород. Э.Залинг предложил для определения показателей КОС с целью выявления гипоксии плода во время родов проводить забор крови из предлежащей части плода. Для этой же цели возможно использование крови пуповины.
Для выявления кислородной недостаточности плода, нарушений его развития предложено исследование биохимического состава околоплодных вод, получаемых путем амниоцентеза – прокола передней стенки живота, матки и забора околоплодной жидкости. В последние годы большое значение приобретает кордоцентез – пункция вены пуповины с целью взятия проб крови для анализа и при необходимости введения лекарственных средств или крови.
Подлинную революцию в акушерстве произвело широкое внедрение в практику ультразвукового исследования (УЗИ). Безвредность и доступность, высокая информативность метода делают УЗИ незаменимым при обследовании беременных. УЗИ является единственным неинвазивным методом оценки состояния плода при различных видах акушерской патологии, особенно в ранние сроки беременности. УЗИ позволяет установить наличие беременности, в том числе многоплодной (2,5-3 нед), диагностировать некоторые врожденные пороки развития плода, следить за его ростом и развитием, состоянием плаценты, количеством околоплодных вод (см. главу 4).
Большие диагностические возможности открыло использование в акушерстве лопплерометрического исследования кровотока в системе мать- плацента-плод. Важным этапом в развитии эхографии в акушерстве стало использование цветного допплеровского картирования (ЦДК). Оно позволяет визуализировать и идентифицировать мельчайшие сосуды, в том числе микроииркуляторного русла, и тем самым открывает новые перспективы для ранней диагностики акушерских осложнений, связанных с формирова-нием плацентарной недостаточности. Следует подчеркнуть еще одно немаловажное значение применения УЗИ при проведении инвазивных процедур – под контролем УЗИ осуществляют кордоцентез для взятия крови плода и внутриутробных гемотрансфузий; амниоцентез; биопсию хориона; шунтирование при обструкции мочевыводящих путей и гидроцефалии у плода; дренаж кистозных образований, асцита или плеврального ныпога у плода
Широкое использование в оценке внутриутробного состояния получил биофизический профиль плода (БФПП›, основанный на данных УЗИ и регистрации сердечной деятельности плода, включающий оценку б параметров: данных нестрессового теста – НСТ. дыхательных движений плода – ДДП, двигательной активности – ДА, тонуса – Т плода, объема околоплодных вод – ООВ, степени зрелости плаценты – СЗП.
С помощью УЗИ головного мозга (кейросонографии) и допплерометрического исследования кровотока в церебральных сосудах у новорожденного стало возможным раннее выявление пороков развития головного мозга, внутричерепных кровоизлияний различной локализации, трансформации желудочковой системы, отека головного мозга и др.
Важное значение имеет внедрение в практику генетических методов исследования, основанных не только на генеалогическом методе определения кариотипа родителей, но и на исследовании клеток плодового происхождения. Благодаря внедрению в практику цитогенетики стало возможным определение синдрома множественных пороков, задержки развития мозга, нарушения формирования пола и др. Особенно большие достижения в определении генетических повреждений стали возможны после разработки методов молекулярной генетики.
Определение материнских сывороточных метаболитов (а-фетопротеина, хорионического гонадотропина, эстриола) помогает в диагностике различных нарушений в организме как матери, так и плода. Повышение содержанияа-фетопротеина в крови матери позволяет предположить наличие пороков развития нервной трубки.
Материалом для определения кариотипа плода являются клетки плодного происхождения, получаемые при биопсии хориона на ранних стадиях развития зародыша. В последующем в более поздние сроки беременности при исследовании околоплодных вод и поверхностных клеток кожи плода, полученных путем амниои кордоцентеза, появилась возможность выявления врожденной и наследственной патологии. Многие пороки развития плода диагностируются и при УЗИ Своевременная диагностика врожденной и наследственной патологии, прерывание беременности в ранние сроки в случае выявления порока развития, не совместимого с жизнью, позволили снизить перинатальную заболеваемость и смертность.
Во многих крупных родовспомогательных учреждениях нашей страны, так же как и в других развитых странах мира, созданы кабинеты медикогенетического консультирования, куда обращаются супружеские пары, либо родившие детей с пороками развития, либо при наличии таковых в семье, либо в связи с возрастом супругов. За рубежом широко проводится скрининговое генетическое исследование у беременных группы высокого риска, в частности у женщин старше 35 лет вне зависимости от паритета.
Начиная с ранних этапов развития перинатологии, акушеры пытались сопоставить состояние новорожденного с исходным состоянием матери, с особенностями течения беременности и родов Возникло представление о Группах риска беременных, у которых можно ожидать осложнений во время как гестации, так и родового акта. Упорядочение в оценке степени риска матери привело к более тщательному наблюдению за этим контингентом беременных. Достижения науки дали возможность более глубоко изучать осложнения, связанные с беременностью, их этиологию, патогенез, а следовательно, совершенствовать профилактику, диагностику и методы терапии, что в свою очередь благоприятно отразилось на состоянии плода и новорожденного. Были введены понятия "фетоплацентарный комплекс", "системамать-плацента-плод", "плацентарная недостаточность". Все они отражают направленное изучение взаимосвязи материнского и плодового организмов.
Особое значение имели исследования по иммунологической взаимосвязи организмов матери и плода. Достигнуты определенные успехи по изучению иммунного конфликта при резуси групповой несовместимости между организмами матери и плода. На этом основании были изучены этиология и патогенез гемолитической болезни плода и новорожденного, которые в прошлом приводили либо к смерти, либо к инвалидизации детей. В настоящее время возможны как профилактика, так и лечение этих состояний.
В результате исследований физиологии и патофизиологии плода и новорожденного, технических разработок диагностической и лечебной аппаратуры появилась возможность выхаживания детей, родившихся незрелыми, начиная с массы тела 500-600 г (22-23 нед). Повысилась выживаемость и снизилась заболеваемость среди детей, родившихся с массой тела 1000-1500 и 1500-2000 г. Выхаживание детей, родившихся с малой массой тела, важно из-за увеличения числа преждевременных родов, связанного с урбанизацией, увеличением числа беременных, имеющих вредные привычки (курение, алкоголизм, наркомания).
В течение последних двух десятилетий появилось особое направление в перинатологии – интенсивная терапия новорожденных, которая предусматривает комплекс лечебных мероприятий при рождении ребенка с явлениями кислородной недостаточности (асфиксии), направленных на восстановление сердечной деятельности, дыхания, кровотока, метаболизма во всех жизненно важных органах. Создана специальная аппаратура для слежения за основными функциями организма, для создания оптимального режима выхаживания новорожденных с нарушением адаптации и явлениями асфиксии.
В последние годы в связи с достижениями в области микробиологии и созданием соответствующей диагностической аппаратуры появилась возможность изучения внутриутробной инфекции. Доказано, что в инфицировании, а иногда и в инфекционном заболевании плода и новорожденного играют определенную роль не только септическая флора, но и многочисленные вирусы. Большое значение уделяется ВИЧ-инфекции. Однако многие вопросы в отношении инфицирования плода (внутриутробная диагностика, терапия, прогнозирование, ведение беременности) остаются недостаточно изученными.
Большое значение в развитии перинатологии имеет подготовка врачебных кадров – перинатологов. В течение длительного времени ученые дискутировали о том, из кого следует готовить перинатолога – из акушера или неонатолога. В настоящее время не существует врача или ученого, занимающегося только перинатологией. Это либо акушер, разрабатывающий проблему, связанную с перинатальным периодом жизни ребенка, либо педиатр.
Практически мероприятия по антеи интранатальной охране здоровья плода осуществляют акушеры. В постнатальном периоде наблюдение за состоянием новорожденных и проведение у них лечебных мероприятий проводят неонатологи.
В настоящее время во всех странах мира перинатология продолжает развиваться, все более углубляясь в изучение патофизиологии организмов матери, плода, новорожденного. Создаются системы диагностических и лечебных мероприятий, включая фетоскопию и внутриутробную хирургию плода.
Развитие перинатологии в течение последних 20 лет привело к снижению перинатальной смертности во многих развитых странах Европы; самый низкий показатель в Швеции – менее 1 %. Однако перинатальная смертность, равно как и перинатальная заболеваемость, определяется не только научными достижениями в области перинатологии, но и техническим обеспечением учреждений, подготовкой кадров. Не меньшее, если не большее, значение имеют и социальные факторы: заболевания матери, неблагоприятные экологические и производственные факторы, психологические стрессы, несбалансированное питание и т.д.
Глава 2. Анатомия и физиология женской репродуктивной системы
Анатомия женских половых органов
Женская половая система состоит из внутренних половых органов (внутренние гениталии), расположенных в полости малого таза, и наружных половых органов (наружные гениталии), находящихся вне костного таза. К внутренним половым органам относятся матка, яичники, маточные трубы и влагалище. Наружные половые органы включают лобок, большие и малые половые губы, преддверие влагалища и клитор. Полость таза ограничивается костными структурами. Дном для внутренних половых и смежных с ними органов служит диафрагма таза, состоящая из мышц и фасций.Женский таз
Таз (см. раздел 2.1.3) состоит из четырех костей: двух тазовых (или безымянных), крестца и копчика.Тазовая кость (os coxae) до 16-18 лет состоит из трех костей, соединенных хрящами: подвздошной, лобковой и седалищной. После окостенения хрящей указанные кости срастаются между собой, образуя тазовую (безымянную) кость.
Подвздошная кость (os ilium) состоит из двух частей: тела и крыла. Тело – это короткая утолщенная часть кости, участвующая в образовании вертлужной впадины. Крыло представляет собой широкую пластинку с вогнутой внутренней и выпуклой наружной поверхностью. Наиболее утолщенный свободный край крыла образует гребень подвздошной кости (crista iliaca). Спереди гребень начинается верхней передней подвздошной остью, или выступом (spina iliaca anterior superior), ниже располагается нижняя передняя ость (spina iliaca anterior inferior).
Гребень подвздошной кости сзади заканчивается верхней задней подвздошной остью (spina iliaca posterior superior), ниже которой располагается второй выступ – нижняя задняя подвздошная ость (spina iliaca posterior inferior). На внутренней поверхности подвздошной кости в области перехода крыла в тело располагается гребневый выступ, который образует дугообразную, или пограничную, или безымянную, линию (linea arcuata, s.terminalis, s.innominata). Эта линия идет от крестца поперек всей подвздошной кости, спереди переходят на верхний край лонной кости.
Седалищная кость (os ischii) состоит из тела, участвующего в образовании вертлужной впадины, и двух ветвей: верхней и нижней. Верхняя ветвь идет от тела книзу и заканчивается седалищным бугром (tuber ischiadicum). На задней поверхности нижней ветви имеется выступ – седалищная ость (spina ischiadica). Нижняя ветвь направляется кпереди и кверху и соединяется с нижней ветвью лонной кости.
Лобковая кость (os pubis) образует переднюю стенку таза. Она состоит из тела и двух ветвей: верхней (горизонтальной) и нижней (нисходящей). Короткое тело лобковой кости составляет часть вертлужной впадины, нижняя ветвь соединяется с соответствующей ветвью седалищной кости.
Верхние и нижние ветви обеих лобковых костей спереди соединяются друг с другом посредством малоподвижного лобкового сочленения – симфиза (symphisis). Обе лобковые кости соединяются в симфизе промежуточным хрящом, в котором нередко бывает маленькая щелевидная полость, заполненная жидкостью. Нижние ветви лобковых костей образуют под симфизом угол, который называется лобковой дугой. Соединяющие ветви лобковой и седалищной костей ограничивают довольно обширное запирательное отверстие (foramen obturatorium).
Крестец (os sacrum) состоит из пяти сросшихся позвонков. Величина крестцовых позвонков уменьшается по направлению книзу, поэтому крестец имеет форму усеченного конуса. Широкая его часть – основание крестца – обращена вверх, узкая часть – верхушка крестца – вниз. Задняя поверхность крестца выпуклая, передняя – вогнутая, она образует крестцовую впадину. Основание крестца (поверхность I крестцового позвонка) сочленяется с V поясничным позвонком; на середине передней поверхности основания крестца образуется выступ – крестцовый мыс (promontorium).
Копчик (os coccygis) состоит из 4-5 рудиментарных сросшихся копчиковых позвонков, представляет собой небольшую кость, суживающуюся книзу.
Кости таза соединяются посредством симфиза, крестцово-подвздошных и крестцово-копчикового сочленений. В сочленениях таза располагаются хрящевые прослойки. Сочленения таза укреплены прочными связками.
Наружные и внутренние половые органы
Наружные половые органы (genitalia externa, s. vulva), имеющие собирательное название "вульва", или "пудендум", находятся ниже лобкового симфиза (рис. 2.1). К ним относятся лобок, большие и малые половые губы, клитор и преддверие влагалища. В преддверие влагалища открываются наружное отверстие мочеиспускательного канала (уретра) и протоки больших желез преддверия (бартолиновы железы).Лобок (mons pubis), пограничный участок брюшной стенки, представляет собой округлое срединное возвышение, лежащее спереди от лобкового симфиза и лобковых костей. После полового созревания он покрывается волосами, а его подкожная основа в результате интенсивного развития приобретает вид жировой подушечки.
Большие половые губы (labia pudendi majora) – широкие продольные складки кожи, содержащие большое количество жировой клетчатки и фиброзные окончания круглых маточных связок. Спереди подкожная жировая клетчатка большой половой губы переходит в жировую подушечку на лобке, а сзади соединена с седалищно-прямокишечной жировой клетчаткой. После достижения половой зрелости кожа наружной поверхности больших половых губ пигментируется и покрывается волосами. В коже больших половых губ находятся потовые и сальные железы. Внутренняя поверхность их гладкая, не покрыта волосами и насыщена сальными железами. Соединение больших половых губ спереди называют передней спайкой, сзади – спайкой половых губ, или задней спайкой. Узкое пространство перед задней спайкой половых губ называют ладьевидной ямкой.
 Рис. 2.1. Наружные половые органы.
I – лобок; 2 – передняя спайка; 3 – большая половая губа; 4 – малая половая губа; 5 – задняя стенка влагалища; 6 – ямка преддверия влагалища; 7 – задняя спайка (спайка половых губ); 8 – задний проход; 9 – промежность; 10 – вход во влагалище;
II – свободный край девственной плевы; 12 – наружное отверстие мочеиспуска-тельного канала; 13 – уздечка клитора; 14 – клитор.
Рис. 2.1. Наружные половые органы.
I – лобок; 2 – передняя спайка; 3 – большая половая губа; 4 – малая половая губа; 5 – задняя стенка влагалища; 6 – ямка преддверия влагалища; 7 – задняя спайка (спайка половых губ); 8 – задний проход; 9 – промежность; 10 – вход во влагалище;
II – свободный край девственной плевы; 12 – наружное отверстие мочеиспуска-тельного канала; 13 – уздечка клитора; 14 – клитор.
Малые половые губы (labia pudendi minora). Толстые складки кожи меньших размеров, называемые малыми половыми губами, находятся медиально от больших половых губ. В отличие от больших половых губ они не покрыты волосами и не содержат подкожной жировой клетчатки. Между ними находится преддверие влагалища, которое становится видимым только при разведении малых половых губ. Спереди, где малые половые губы подходят к клитору, они делятся на две небольшие складки, которые сли-ваются вокруг клитора. Верхние складки соединяются над клитором и образуют крайнюю плоть клитора; нижние складки соединяются на нижней стороне клитора и образуют уздечку клитора.
Клитор (clitoris) находится между передними концами малых половых губ под крайней плотью. Он является гомологом пещеристых тел мужского полового члена и способен к эрекции. Тело клитора состоит из двух пещеристых тел, заключенных в фиброзную оболочку. Каждое пещеристое тело начинается ножкой, прикрепленной к медиальному краю соответствующей седалищно-лобковой ветви. Клитор прикрепляется к лобковому симфизу с помощью поддерживающей связки. На свободном конце тела клитора находится небольшое возвышение эректильной ткани, которое называется головкой.
Луковицы преддверия (bulbi vestibuli) – венозные сплетения, расположенные в глубине малых половых губ и подковообразно охватывающие преддверие влагалища. Рядом с преддверием влагалища вдоль глубокой, стороны каждой малой половой губы расположена масса эректильной ткани овальной формы, называемая луковицей преддверия. Она представлена густым сплетением вен и соответствует губчатому телу полового члена у мужчин. Каждая луковица прикрепляется к нижней фасции мочеполовой диафрагмы' и покрыта бульбоспонгиозной (бульбокавернозной) мышцей.
Преддверие влагалища (vestibulum vaginae) расположено между малыми половыми губами, где влагалище открывается в виде вертикальной щели. Раскрытое влагалище (так называемое отверстие) обрамляют узлы фиброзной ткани изменяющихся размеров (гименальные бугорки). Спереди от влагалищного отверстия приблизительно на 2 см ниже головки клитора по средней линии располагается наружное отверстие мочеиспускательного канала в виде небольшой вертикальной щели. Края наружного отверстия уретры обычно приподняты и образуют складки. С каждой стороны наруж-ного отверстия мочеиспускательного канала есть миниатюрные отверстия протоков желез мочеиспускательного канала (ductus paraurethrals). Небольшое пространство в преддверии влагалища, находящееся сзади влагалищного отверстия, называется ямкой преддверия влагалища. Здесь на обеих сторонах открываются протоки больших желез преддверия, или бартолиновых желез (glandulae vestibulares majorus). Железы представляют собой небольшие дольковые тела размером с горошину и находятся у заднего края луковицы преддверия. Эти железы наряду с многочисленными малыми преддверными железами также открываются в преддверие влагалища.
Внутренние половые органы (genitalia interna).
К внутренним половым органам относят влагалище, матку и ее придатки – маточные трубы и яичники (рис. 2.2).Влагалище
Влагалище (vagina s. colpos) простирается от половой щели до матки, проходя кверху с задним наклонением через мочеполовую и тазовую диафрагмы (рис. 2.3). Длина влагалища около 10 см. Оно расположено главным образом в полости малого таза, где и заканчивается, сливаясь с шейкой матки. Передняя и задняя стенки влагалища обычно соединяются Друг с другом в нижней части, имея форму буквы Н в поперечном сечении. Верхний отдел называют сводом влагалища, так как просвет образует карманы, или своды, вокруг влагалищной части шейки матки. Поскольку влагалище находится под углом 90° к матке, задняя стенка значительно длиннее, чем передняя, а задний свод глубже, чем передний и боковые своды. Боковая стенка влагалища прикрепляется к кардиальной связке матки и к диафрагме малого таза. Стенка состоит в основном из гладкомышечной и плотной соединительной ткани со множеством эластических волокон. Наружный слой содержит соединительную ткань с артериями, нервами и нервными сплетениями. Слизистая оболочка имеет поперечные и продольные складки. Передняя и задняя продольные складки называются столбами складок. Многослойный плоский эпителий поверхности претерпевает циклические изменения, которые соответствуют менструальному циклу.
 Рис. 2.2. Внутренние половые органы.
1 – влагалище; 2 – влагалищная часть шейки матки; 3 – шеечный канал; 4 – перешеек; 5 – полость матки; 6 – дно матки; 7 – стенка матки; 8 – маточная труба; 9 – яичник; 10 – интерстициальная часть трубы; 11 – истмическая часть трубы; 12 – ампулярная часть трубы; 13 – фимбрии трубы; 14 – крестцово-маточная связка; 15 – собственная связка яичника; 16 – воронкотазовая связка; 17 -широкая связка; 18 – круглая связка; 19 – срез яичника с фолликулами и желтым телом; 20 – паровариум.
Рис. 2.2. Внутренние половые органы.
1 – влагалище; 2 – влагалищная часть шейки матки; 3 – шеечный канал; 4 – перешеек; 5 – полость матки; 6 – дно матки; 7 – стенка матки; 8 – маточная труба; 9 – яичник; 10 – интерстициальная часть трубы; 11 – истмическая часть трубы; 12 – ампулярная часть трубы; 13 – фимбрии трубы; 14 – крестцово-маточная связка; 15 – собственная связка яичника; 16 – воронкотазовая связка; 17 -широкая связка; 18 – круглая связка; 19 – срез яичника с фолликулами и желтым телом; 20 – паровариум.
Передняя стенка влагалища прилегает к мочеиспускательному каналу и основанию мочевого пузыря, причем конечная часть мочеиспускательного канала вдается в его нижнюю часть. Тонкий слой соединительной ткани, отделяющей переднюю стенку влагалища от мочевого пузыря, называется пузырно-влагалищной перегородкой. Спереди влагалище косвенно соединяется с задней частью лобковой кости с помощью фасциальных утолщений у основания мочевого пузыря, известных как лобково-пузырные связки. Сзади нижняя часть стенки влагалища отделена от заднепроходного канала перинеальным телом. Средняя часть примыкает к прямой кишке, а верхняя – к прямокишечно-маточному углублению (дугласово пространство) перитонеальной полости, от которой она отделена только тонким слоем брюшины.
 Рис. 2.3. Соотношение органов малого таза (сагиттальный срез). 1 – матка; 2 – прямокишечно-маточное углубление; 3 – шейка матки; 4 – прямая кишка; 5 – влагалище; 6 – мочеиспускательный канал; 7 – мочевой пузырь; 8 – симфиз; 9 – круглые связки матки; 10 – яичники; 11 – маточные трубы; 12 – воронкотазовая связка; 13 – крестцовый мыс; 14 – крестец.
Рис. 2.3. Соотношение органов малого таза (сагиттальный срез). 1 – матка; 2 – прямокишечно-маточное углубление; 3 – шейка матки; 4 – прямая кишка; 5 – влагалище; 6 – мочеиспускательный канал; 7 – мочевой пузырь; 8 – симфиз; 9 – круглые связки матки; 10 – яичники; 11 – маточные трубы; 12 – воронкотазовая связка; 13 – крестцовый мыс; 14 – крестец.
Матка
Матка (uterus) вне беременности расположена по средней линии таза или вблизи нее между мочевым пузырем спереди и прямой кишкой сзади (см. рис. 2.3). Матка имеет форму перевернутой груши с плотными мышечными стенками и просветом в виде треугольника, узким в сагиттальной плоскости и широким – во фронтальной. В матке различают тело, дно, шейку и перешеек. Линия прикрепления влагалища разделяет шейку на влагалищный (вагинальный) и надвлагалищный (суправагинальный) сегменты. Вне беременности выгнутое дно направлено кпереди, причем тело образует тупой угол по отношению к влагалищу (наклонено вперед) и согнуто кпереди. Передняя поверхность тела матки плоская и примыкает к верхушке мочевого пузыря. Задняя поверхность выгнута и обращена сверху и сзади к прямой кишке.
Шейка матки направлена книзу и кзади и соприкасается с задней стенкой влагалища. Мочеточники подходят непосредственно латерально к шейке матки сравнительно близко.
Тело матки, включая ее дно, покрыто брюшиной. Спереди, на уровне перешейка, брюшина загибается и переходит на верхнюю поверхность мочевого пузыря, образуя неглубокое пузырно-маточное углубление. Сзади брюшина продолжается вперед и вверх, покрывая перешеек, суправагинальную часть шейки матки и задний свод влагалища, а затем переходит на переднюю поверхность прямой кишки, образуя глубокое прямокишечно-маточное углубление. Длина тела матки в среднем равна 5 см. Общая длина перешейка и шейки около 2,5 см, их диаметр 2 см. Соотношение длины тела и шейки матки зависит от возраста и числа родов и в среднем составляет 2:1.
Стенка матки состоит из тонкого наружного слоя брюшины – серозной оболочки (периметрии), толстого промежуточного слоя гладких мышц и соединительной ткани – мышечной оболочки (миометрий) и внутренней слизистой оболочки (эндометрий). Тело матки содержит множество мышечных волокон, количество которых уменьшается книзу по мере приближения к шейке. Шейка состоит из равного количества мышц и соединительной ткани. В результате своего развития из слившихся частей парамезонефральных (мюллеровых) протоков расположение мышечных волокон в стенке матки сложное. Наружный слой миометрия содержит в основном вертикальные волокна, которые идут латерально в верхней части тела и соединяются с наружным продольным мышечным слоем маточных труб. Средний слой включает в себя большую часть маточной стенки и состоит из сети спиралевидных мышечных волокон, которые соединены с внутренним круговым мышечным слоем каждой трубы. Пучки гладкомышечных волокон в поддерживающих связках переплетаются и сливаются с этим слоем. Внутренний слой состоит из круговых волокон, которые могут выполнять функцию сфинктера у перешейка и у отверстий маточных труб.
Полость матки вне беременности представляет собой узкую щель, при этом передняя и задняя стенки тесно прилегают друг к другу. Полость имеет форму перевернутого треугольника, основание которого находится сверху, где оно с обеих сторон соединено с отверстиями маточных труб; вершина находится снизу, где полость матки переходит в шеечный канал. Шеечный канал в области перешейка сжат и имеет длину 6-10 мм. Место, где канал шейки матки переходит в полость матки, называется внутренним зевом. Цервикальный канал немного расширяется в своей средней части и открывается во влагалище наружным отверстием.
Придатки матки.
К придаткам матки относят маточные трубы и яичники, а некоторые авторы – и связочный аппарат матки.
Маточные трубы (tubae uterinae). С обеих сторон тела матки латерально находятся длинные, узкие маточные трубы (фаллопиевы трубы). Трубы занимают верхнюю часть широкой связки и изгибаются дугой латерально над яичником, затем идут вниз над задней частью медиальной поверхности яичника. Просвет, или канал, трубы проходит от верхнего угла полости матки к яичнику, постепенно увеличиваясь в диаметре латерально по его ходу. Вне беременности труба в растянутом виде имеет длину 10 см. Различают четыре ее отдела: интрамуральный участок находится внутри стенки матки и соединен с полостью матки. Его просвет имеет самый маленький диаметр (1 мм или менее). Узкий участок, идущий латерально от наружной границы матки, называется перешейком (istmus); далее труба расширяется и становится извилистой, образуя ампулу, и заканчивается вблизи яичника в виде воронки. По периферии на воронке находятся фимбрии, которые окружают брюшное отверстие маточной трубы; одна или две фимбрии соприкасаются с яичником. Стенка маточной трубы образована тремя слоями: наружный слой, состоящий в основном из брюшины (серозной оболочки), промежуточный гладкий мышечный слой (миосальпинкс) и слизистая оболочка (эндосальпинкс). Слизистая оболочка представлена реснитчатым эпителием и имеет продольные складки.
Яичники (ovarii). Женские гонады предсташгены яичниками овальной или миндалевидной формы. Яичники расположены медиально к загнутой части маточной трубы и немного расплющены. В среднем их размеры составляют; ширина 2 см, длина 4 см и толщина 1 см. Яичники, как правило, серовато-розового цвета с морщинистой, неровной поверхностью. Продольная ось яичников почти вертикальная, с верхней крайней точкой у маточной трубы и с нижней крайней точкой ближе к матке. Задняя часть яичников свободна, а передняя фиксирована к широкой связке матки с помощью двухслойной складки брюшины – брыжейки яичника (mesovarium). Через нее проходят сосуды и нервы, которые достигают ворот яичников. К верхнему полюсу яичников прикреплены складки брюшины – связки, подвешивающие яичники (воронкотазовые), в которых содержатся яичниковые сосуды и нервы. Нижняя часть яичников прикреплена к матке с помощью фиброзно-мышечных связок (собственные связки яичников). Эти связки соединяются с латеральными краями матки под углом чуть ниже того места, где маточная труба подходит к телу матки.
Яичники покрыты зародышевым эпителием, под которым находится слой соединительной ткани – белочная оболочка. В яичнике различают наружный корковый и внутренний мозговой слои. В соединительной ткани мозгового слоя проходят сосуды, нервы. В корковом слое среди соединительной ткани находится большое количество фолликулов на разных стадиях развития.
Связочный аппарат внутренних женских половых органов.
Положение в малом тазе матки и яичников, а также влагалища и смежных органов зависит главным образом от состояния мышц и фасций тазового дна, а также от состояния связочного аппарата матки (см. рис, 2.2). В нормальном положении матку с маточными трубами и яичники удерживают подвешивающий аппарат (связки), закрепляющий аппарат (связки, фиксирующие подвешенную матку), опорный, или поддерживающий, аппарат (тазовое дно).
Подвешивающий аппарат внутренних половых органов включает следующие связки. 1. Круглые связки матки (ligg. teres uteri). Они состоят из гладких мышц и соединительной ткани, имеют вид шнуров длиной 10-12 см. Эти связки отходят от углов матки, идут под передним листком широкой связки матки к внутренним отверстиям паховых каналов. Пройдя паховый канал, круглые связки матки веерообразно разветвляются в клетчатке лобка и больших половых губ. Круглые связки матки притягивают дно матки кпереди (наклонение кпереди). 2. Широкие связки матки (ligg. latae uteri). Это дупликатура брюшины, идущая от ребер матки до боковых стенок таза. В верхних отделах широких связок матки проходят маточные трубы, на задних листках расположены яичники, между листками – клетчатка, сосуды и нервы. 3. Собственные связки яичников (ligg. ovarii proprii, s. ligg. suspensorii ovarii) начинаются от дна матки сзади и ниже места отхождения маточных труб и идут к яичникам. 4. Связки, подвешивающие яичники, или воронкотазовые связки (ligg. suspensorium ovarii, s.infundibulopelvicum), являются продолжением широких маточных связок, идут от маточной трубы до стенки таза.
Закрепляющий аппарат матки представляет собой соедини-тельнотканные тяжи с примесью гладкомышечных волокон, которые идут от нижнего отдела матки: 1. кпереди – к мочевому пузырю и далее к симфизу (lig. pubovesicale, lig. vesicouterinum); к боковым стенкам таза – основные связки (lig. cardinal); 2. кзади – к прямой кишке и крестцу (lie. sacrouterinum).
Крестцово-маточные связки отходят от задней поверхности матки в области перехода тела в шейку, охватывают с обеих сторон прямую кишку и прикрепляются на передней поверхности крестца. Эти связки притягивают шейку матки кзади.
Опорный, или поддерживающий, аппарат составляют мышцы и фасции тазового дна. Тазовое дно имеет огромное значение в удержании внутренних половых органов в нормальном положении. При повышении внутрибрюшного давления шейка матки опирается на тазовое дно, как на подставку; мышцы тазового дна препятствуют опусканию вниз половых органов и внутренностей. Тазовое дно образовано кожей и слизистой оболочкой промежности, а также мышечно-фасциальной диафрагмой.
Промежность
Промежность (perineum) – это ромбовидная область между бедрами и ягодицами, где находятся мочеиспускательный канал, влагалище и заднепроходное отверстие. Спереди промежность ограничена лобковым симфизом, сзади – концом копчика, латерально-седалищными буграми. Кожа ограничивает промежность снаружи и снизу, а диафрагма таза (тазовая фасция), образованная нижней и верхней фасциями, ограничивает промежность глубоко сверху (рис. 2.4).Тазовое дно с помощью воображаемой линии, соединяющей два седалищных бугра, разделяют анатомически на две треугольные области: спереди – мочеполовая область, сзади – анальная область. В центре промежности между заднепроходным отверстием и входом во влагалище имеется фиброзно-мышечное образование, называемое сухожильным центром промежности. Этот сухожильный центр является местом прикрепления нескольких групп мышц и фасциальных слоев.
Мочеполовая область.
В мочеполовой области между нижними ветвями седалищных и лобковых костей находится мышечно-фасциальное образование, которое называется "мочеполовая диафрагма" (diaphragma urogenitale). Через эту диафрагму проходят влагалище и мочеиспускательный канал. Диафрагма служит основанием для фиксации наружных половых органов. Снизу мочеполовая диафрагма ограничена поверхностью беловатых коллагеновых волокон, образующих нижнюю фасцию мочеполовой диафрагмы, которая делит мочеполовую область на два плотных анатомических слоя, имеющих важное клиническое значение, – поверхностный и глубокий отделы, или карманы промежности.
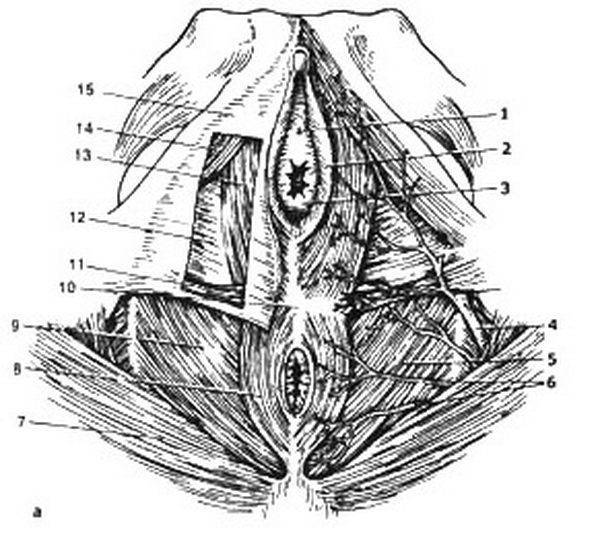
 Рис. 2.4. Женская промежность.
а – поверхностный срез мочеполовой диафрагмы: 1 – наружное отверстие мочеиспускательного канала, 2 – малая половая губа, 3 – девственная плева, 4 – внутренняя половая артерия, 5 – мышцы, поднимающие задний проход, 6 – нижняя геморроидальная артерия, 7 – большая ягодичная мышца, 8 – наружный сфинктер заднего прохода, 9 – нижняя фасция диафрагмы таза, 10 – сухожильный центр промежности, 11 – наружная поперечная мышца промежности, 12 -нижняя фасция мочеполовой диафрагмы, 13 – луковично-губчатая мышца, 14 – седалищно-пешеристая мышца, 15 – поверхностная фасция промежности; б*- глубокий срез мочеполовой диафрагмы: 1 – клитор: А – тело, Б – головка, В – ножка; 2 – урогенитальная диафрагма, 3 – тазовая диафрагма, 4 – мышца наружного сфинктера заднего прохода, 5 – нижняя геморроидальная артерия, 6 – внутренняя запирательная мышца, 7 – внутренняя половая артерия, 8 – артерия промежности, 9 – большая железа преддверия, 10 – преддверно-луковичная артерия, 11 – стенка влагалища, 12 – луковица преддверия, 13 – мочеиспускательный канал.
Рис. 2.4. Женская промежность.
а – поверхностный срез мочеполовой диафрагмы: 1 – наружное отверстие мочеиспускательного канала, 2 – малая половая губа, 3 – девственная плева, 4 – внутренняя половая артерия, 5 – мышцы, поднимающие задний проход, 6 – нижняя геморроидальная артерия, 7 – большая ягодичная мышца, 8 – наружный сфинктер заднего прохода, 9 – нижняя фасция диафрагмы таза, 10 – сухожильный центр промежности, 11 – наружная поперечная мышца промежности, 12 -нижняя фасция мочеполовой диафрагмы, 13 – луковично-губчатая мышца, 14 – седалищно-пешеристая мышца, 15 – поверхностная фасция промежности; б*- глубокий срез мочеполовой диафрагмы: 1 – клитор: А – тело, Б – головка, В – ножка; 2 – урогенитальная диафрагма, 3 – тазовая диафрагма, 4 – мышца наружного сфинктера заднего прохода, 5 – нижняя геморроидальная артерия, 6 – внутренняя запирательная мышца, 7 – внутренняя половая артерия, 8 – артерия промежности, 9 – большая железа преддверия, 10 – преддверно-луковичная артерия, 11 – стенка влагалища, 12 – луковица преддверия, 13 – мочеиспускательный канал.
Поверхностный отдел промежности.
Поверхностный отдел находится над нижней фасцией мочеполовой диафрагмы и содержит на каждой стороне большую железу преддверия влагалища, ножку клитора с лежащей сверху седалишно-пещеристой мышцей, луковицу преддверия с лежащей сверху луковичко-губчатой (луковично-пещер истой) мышцей и небольшую поверхностную поперечную мышцу промежности. Седалищно-пещеристая мышца покрывает ножку клитора и играет значительную роль в сохранении его эрекции, так как прижимает ножку к седалищно-лобковой ветви, задерживая отток крови из эректальной ткани. Луковично-губчатая мышца начинается от сухожильного центра промежности и наружного сфинктера заднего прохода, затем проходит сзади вокруг нижней части влагалища, покрывая луковицу преддверия, и входит в перинеальное тело. Мышца может действовать в качестве сфинктера для сжатия нижней части влагалища. Слабо развитая, имеющая вид тонкой пластинки поверхностная поперечная мышца промежности начинается от внутренней поверхности седалищной кости около седалищного бугра и идет поперечно, входя в перинеальное тело. Все мышцы поверхностного отдела покрыты глубокой фасцией промежности.
Глубокий отдел промежности.
Глубокий отдел промежности находится между нижней фасцией мочеполовой диафрагмы и неотчетливо выраженной верхней фасцией мочеполовой диафрагмы. Мочеполовая диафрагма состоит из двух слоев мышц. Мышечные волокна в мочеполовой диафрагме в основном располагаются поперечно, отходят от седалищно-лобковых ветвей каждой стороны и соединяются по средней линии. Эта часть мочеполовой диафрагмы называется глубокой поперечной мышцей промежности (m. transversa perinei profundus). Часть волокон сфинктера мочеиспускательного канала поднимается дугой над мочеиспускательным каналом, тогда как другая часть расположена вокруг него циркулярно, образуя наружный сфинктер уретры. Мышечные волокна сфинктера мочеиспускательного канала также проходят вокруг влагалища, концентрируясь там, где располагается наружное отверстие мочеиспускательного канала. Мышца играет важную роль в сдерживании процесса мочеиспускания при наполненном мочевом пузыре и является произвольным сжимателем мочеиспускательного канала. Глубокая поперечная мышца промежности входит в перинеальное тело позади влагалища. При билатеральном сокращении эта мышца поддерживает, таким образом, промежность и висцеральные структуры, проходящие через нее.
Вдоль переднего края мочеполовой диафрагмы сливаются две ее фасции, образуя поперечную связку промежности. Спереди этого фасциального утолщения находится дугообразная лобковая связка, проходящая вдоль нижнего края лобкового симфиза.
Заднепроходная (анальная) область.
Заднепроходная (анальная) область включает в себя задний проход (arms), наружный сфинктер заднего прохода и седалищно-прямокишечную ямку. Задний проход расположен на поверхности промежности. Кожа заднего прохода пигментирована и содержит сальные и потовые железы. Сфинктер заднего прохода состоит из поверхностной и глубокой частей поперечно-полосатых мышечных волокон. Подкожная часть является самой поверхностной и окружает нижнюю стенку прямой кишки, глубокая часть состоит из круговых волокон, которые сливаются с мышцей, поднимающей задний проход (m.levator ani). Поверхностная часть сфинктера состоит из мышечных волокон, идущих в основном вдоль анального канала и пересекающихся под прямым углом впереди и позади заднепроходного отверстия, которые затем попадают спереди в промежность, а сзади – в слабо выраженную фиброзную массу, называемую анально-копчиковым телом, или анально-копчикоаой связкой. Задний проход внешне представляет собой продольное шелевидное отверстие, что объясняется, возможно, переднезадним направлением многих мышечных волокон наружного сфинктера заднею прохода.
Седалищно-прямокишечная ямка представляет собой клиновидное пространство, наполненное жиром, которое снаружи ограничено кожей. Кожа образует основу клина. Вертикальная боковая стенка ямки образована внутренней запирательной мышцей. Наклонная супрамедиальная стенка содержит мышцу, поднимающую задний проход. Седалищно-прямокишечная жировая клетчатка позволяет прямой кишке и анальному каналу расширяться во время дефекации. Ямка и содержащаяся в ней жировая клетчатка располагаются кпереди и глубоко кверху до мочеполовой диафрагмы, но ниже мышцы, поднимающей задний проход. Эта зона называется передним карманом. Сзади жировая клетчатка в ямке проходит глубоко до большой ягодичной мышцы в зоне крестцово-бугорной связки. Латерально ямка ограничена седалищной костью и запирательной фасцией, покрывающей нижнюю часть внутренней запирательной мышцы.
Кровоснабжение, лимфоотток и иннервация половых органов.
Кровоснабжение (рис. 2.5, 2.6) наружных половых органов в основном осуществляется внутренней половой (срамной) артерией и лишь частично веточками бедренной артерии.Внутренняя половая артерия (a.pudenda interna) является главной артерией промежности. Она представляет собой одну из ветвей внутренней подвздошной артерии (a.iliaca interna). Покидая полость малого таза, она проходит в нижней части большого седалищного отверстия, затем огибает седалищную ость и идет по боковой стенке седалищно-ректальной ямки, поперечно пересекая малое седалищное отверстие. Первой ее ветвью является нижняя прямокишечная артерия (a.rectalis inferior). Проходя через седалищно-ректальную ямку, она снабжает кровью кожу и мышцы вокруг заднего прохода. Промежностная ветвь снабжает структуры поверхностного отдела промежности и продолжается в виде задних ветвей, идущих к большим и малым половым губам. Внутренняя половая артерия, входя в глубокий промежностный отдел, разветвляется на несколько фрагментов и кровоснабжает луковицу преддверия влагалища, большую железу преддверия и мочеиспускательного канала. Заканчиваясь, она разделяется на глубокую и дорсальную артерии клитора, подходящие к нему около лобкового симфиза.
Наружная (поверхностная) половая артерия (r.pudenda externa, s.superficialis) отходит от медиальной стороны бедренной артерии (a.femoralis) и кровоснабжает переднюю часть больших половых губ. Наружная (глубокая) половая артерия (r.pudenda externa, s.profunda) также отходит от бедренной артерии, но более глубоко и дистальнее. Пройдя широкую фасцию на медиальной стороне бедра, она входит в латеральную часть большой половой Губы. Ее ветви переходят в передние и задние лабиальные артерии.
Вены, проходящие через промежность, являются в основном ветвями внутренней подвздошной вены. Большей частью они сопровождают артерии. Исключение составляет глубокая дорсальная вена клитора, которая отводит кровь из эректильной ткани клитора через шель ниже лобкового симфиза в венозное сплетение вокруг шейки мочевого пузыря. Наружные половые вены отводят кровь от большой половой губы, проходя латерально и входя в большую подкожную вену ноги.
 Рис. 2.5. Кровоснабжение половых органов.
1 – маточная труба; 2 – яичник; 3 – яичниковая вена; 4 – яичниковая артерия; 5 – анастомозы маточных и яичниковых сосудов; 6 – мочеточник; 7 – маточная артерия; 8 – маточная вена; 9 – стенка мочевого пузыря; 10 – шейка матки; 11 – тело матки; 12 – круглая связка матки.
Рис. 2.5. Кровоснабжение половых органов.
1 – маточная труба; 2 – яичник; 3 – яичниковая вена; 4 – яичниковая артерия; 5 – анастомозы маточных и яичниковых сосудов; 6 – мочеточник; 7 – маточная артерия; 8 – маточная вена; 9 – стенка мочевого пузыря; 10 – шейка матки; 11 – тело матки; 12 – круглая связка матки.
Кровоснабжение внутренних половых органов осуществляется в основном из аорты (система общей и внутренней подвздошной артерий).
Основное кровоснабжение матки обеспечивается маточной артерией (a.uterina), которая отходит от внутренней подвздошной (подчревной) артерии (a.iliaca interna). Примерно в половине случаев маточная артерия самостоятельно отходит от внутренней подвздошной артерии, но она может начинаться и от пупочной, внутренней половой и поверхностной пузырной артерий.
Маточная артерия направляется вниз к боковой тазовой стенке, затем проходит вперед и медиально, располагаясь над мочеточником, к которому может давать самостоятельную ветвь. У основания широкой маточной связки она поворачивает медиально по направлению к шейке матки. В параметрии артерия соединяется с сопровождающими ее венами, нервами, мочеточником и кардинальной связкой. Маточная артерия подходит к шейке матки и снабжает ее с помощью нескольких извилистых проникающих ветвей. Затем маточная артерия разделяется на одну большую очень извилистую восходящую ветвь и одну или несколько мелких нисходящих ветвей, снабжающих верхнюю часть влагалища и прилегающую часть мочевого пузыря. Главная восходящая ветвь идет вверх вдоль латерального края матки, посылая дугообразные ветви к ее телу. Эти дугообразные артерии окружают матку под серозным слоем. С определенными промежутками от них отходят радиальные ветви, которые проникают в переплетающиеся мышечные волокна миометрия. После родов мышечные волокна сокращаются и, действуя как лигатуры, сжимают радиальные ветви. Дугообразные артерии быстро уменьшаются в размере по ходу к средней линии, поэтому при срединных разрезах матки наблюдается меньшее кровотечение, чем при латератьных. Восходящая ветвь маточной артерии подходит к маточной трубе, поворачивая латерально в ее верхней части, и разделяется на трубную и яичниковую ветви. Трубная ветвь идет латерально в брыжейке маточной трубы (mesosalpinx). Яичниковая ветвь направляется к брыжейке яичника (mesovarium), где она анастомозирует с яичниковой артерией, отходящей непосредственно от аорты.
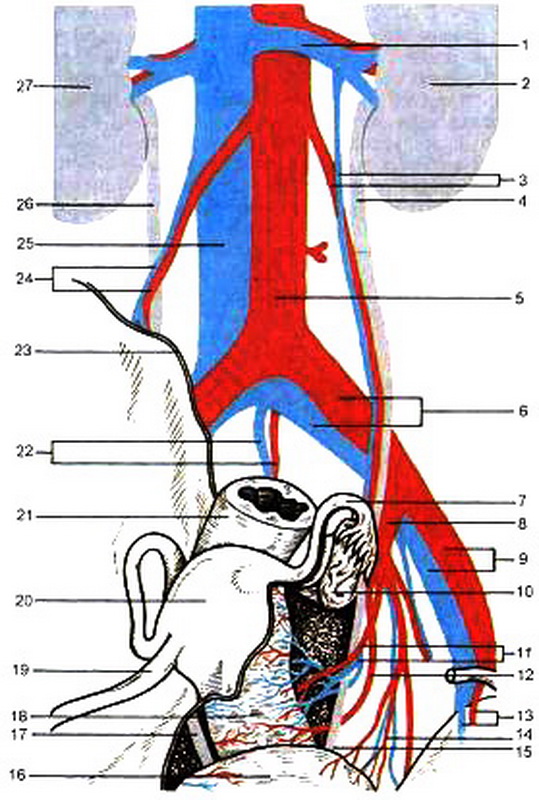 Рис. 2.6. Взаимоотношение внутренних половых органов, мочеточников и сосудов малого таза.
1 – левая почечная вена; 2 – левая почка; 3 – левые яичниковые вена и артерия; 4 – левый мочеточник; 5 – брюшная часть аорты; 6 – общие подвздошные артерия и вена; 7 – маточная труба; 8 – внутренняя подвздошная артерия; 9 – наружные подвздошные артерия и вена; 10 – левый яичник; 11 – маточные артерия и вена; 12 – нижняя пузырная артерия (влагалищная ветвь); 13 – нижние надчревные артерия и вена; 14 -верхняя мочепузырная артерия; 15 -левый мочеточник; 16 – мочевой пузырь; 17 -правый мочеточник; 18 – влагалище; 19 – круглая связка матки; 20 – тело матки; 21 – прямая кишка; 22 – средние крестцовые вена и артерия; 23 – край париетальной брюшины (в разрезе); 24 – правые яичниковые артерия и вена; 25 – нижняя полая вена; 26 – правый мочеточник; 27 – правая почка.
Рис. 2.6. Взаимоотношение внутренних половых органов, мочеточников и сосудов малого таза.
1 – левая почечная вена; 2 – левая почка; 3 – левые яичниковые вена и артерия; 4 – левый мочеточник; 5 – брюшная часть аорты; 6 – общие подвздошные артерия и вена; 7 – маточная труба; 8 – внутренняя подвздошная артерия; 9 – наружные подвздошные артерия и вена; 10 – левый яичник; 11 – маточные артерия и вена; 12 – нижняя пузырная артерия (влагалищная ветвь); 13 – нижние надчревные артерия и вена; 14 -верхняя мочепузырная артерия; 15 -левый мочеточник; 16 – мочевой пузырь; 17 -правый мочеточник; 18 – влагалище; 19 – круглая связка матки; 20 – тело матки; 21 – прямая кишка; 22 – средние крестцовые вена и артерия; 23 – край париетальной брюшины (в разрезе); 24 – правые яичниковые артерия и вена; 25 – нижняя полая вена; 26 – правый мочеточник; 27 – правая почка.
Яичники кровоснабжаются из яичниковой артерии (a.ovarica), отходящей от брюшной аорты слева, иногда от почечной артерии (a.renalis). Спускаясь вместе с мочеточником вниз, яичниковая артерия проходит по связке, подвешивающей яичник, к верхнему отделу широкой маточной связки, отдает ветвь для яичника и трубы; конечный отдел яичниковой артерии анастомозирует с концевым отделом маточной артерии.
В кровоснабжении влагалища, кроме маточной и половой артерий, участвуют также ветви нижней мочепузырной и средней прямокишечной артерии. Артерии половых органов сопровождаются соответствующими венами.
Венозная система половых органов развита очень сильно; общая протяженность венозных сосудов значительно превышает протяженность артерий в связи с наличием венозных сплетений, широко анастомозирующих между собой. Венозные сплетения находятся в области клитора, у краев луковиц преддверия, вокруг мочевого пузыря, между маткой и яичниками.
Лимфатическая система половых органов состоит из густой сети извилистых лимфатических сосудов, сплетений и множества лимфатических узлов. Лимфатические пути и узлы располагаются преимущественно по ходу кровеносных сосудов.
Лимфатические сосуды, отводящие лимфу от наружных половых органов и нижней трети влагалища, идут к паховым лимфатическим узлам. Лимфатические пути, отходящие от средней верхней трети влагалища и шейки матки, идут к лимфатическим узлам, располагающимся по ходу подчревных и подвздошных кровеносных сосудов.
Интрамуральные сплетения несут лимфу из эндометрия и миометрия в субсерозное сплетение, из которого лимфа оттекает по эфферентным сосудам. Лимфа из нижней части матки поступает в основном в крестцовые, наружные подвздошные и общие подвздошные лимфатические узлы; часть лимфы также поступает в нижние поясничные узлы вдоль брюшной аорты и в поверхностные паховые узлы.Большая часть лимфы из верхней части матки оттекает в латеральном направлении в широкой связке матки, где она соединяется с лимфой, собирающейся из маточной трубы и яичника. Далее через связку, подвешивающую яичник, по ходу яичниковых сосудов лимфа поступает в лимфатические узлы вдоль нижнего отдела брюшной аорты. Из яичников лимфа отводится по сосудам, располагающимся вдоль яичниковой артерии, и идет к лимфатическим узлам, лежащим на аорте и нижней полой вене. Между указанными лимфатическими сплетениями существуют связи – лимфатические анастомозы.
В иннервации половых органов женщины участвуют симпатическая и парасимпатическая части вегетативной нервной системы, а также спинномозговые нервы.
Волокна симпатической части вегетативной нервной системы, иннервирующие половые органы, берут начало от аортального и чревного ("солнечного") сплетений, направляются вниз и на уровне V поясничного позвонка образуют верхнее подчревное сплетение (plexus hypogastricus superior). От него отходят волокна, образующие правое и левое нижние подчревные сплетения (plexus hypogastricus sinister et dexter inferior). Нервные волокна от этих сплетений идут к мощному маточно-влагалищному, или тазовому, сплетению (plexus uterovaginalis, s.pelvicus).
Маточно-влагалищные сплетения располагаются в параметральной клетчатке сбоку и сзади от матки на уровне внутреннего зева и шеечного канала. К этому сплетению подходят ветви тазового нерва (n.pelvicus), относящегося к парасимпатической части вегетативной нервной системы. Симпатические и парасимпатические волокна, отходящие от маточно-влагалищного сплетения, иннервируют влагалище, матку, внутренние отделы маточных труб, мочевой пузырь.
Яичники иннервируются симпатическими и парасимпатическими нервами из яичникового сплетения (plexus ovaricus).
Наружные половые органы и тазовое дно в основном иннервируются половым нервом (n.pudendus).
Тазовая клетчатка. Кровеносные сосуды, нервы и лимфатические пути органов малого таза проходят в клетчатке, которая расположена между брюшиной и фасциями тазового дна. Клетчатка окружает все органы малого таза; на одних участках она рыхлая, на других в виде волокнистых тяжей. Различают следующие пространства клетчатки: околоматочное, преди околопузырное, около кишечное, влагалищное. Тазовая клетчатка служит опорой для внутренних половых органов, и все ее отделы связаны между собой.
Таз с акушерской точки зрения
Большой таз для рождения ребенка существенного значения не имеет. Костную основу родового канала, представляющего препятствие рождающемуся плоду, составляет малый таз. Однако по размерам большого таза можно косвенно судить о форме и величине малого таза. Внутреннюю поверхность большого и малого таза выстилают мышцы.Полостью малого таза называется пространство, заключенное между стенками таза, сверху и снизу ограниченное плоскостями входа и выхода таза. Она имеет вид цилиндра, усеченного спереди назад, причем передняя часть, обращенная к лону, почти в 3 раза ниже задней, обращенной к крестцу. В связи с такой формой полости малого таза различные ее отделы имеют неодинаковую форму и размеры. Этими отделами являются воображаемые плоскости, проходящие через опознавательные пункты внутренней поверхности малого таза. В малом тазе различают следующие плоскости: плоскость входа, плоскость широкой части, плоскость узкой части и плоскость выхода (табл. 2.1; рис. 2.7).
 Рис. 2.7. Женский таз (сагиттальный срез).
1 – анатомическая конъюгата; 2 – истинная конъюгата; 3 – прямой размер плоскости широкой части полости малого таза; 4 – прямой размер плоскости узкой части полости малого таза; 5 – прямой размер выхода малого таза при обычном положени копчика; 6 – прямой размер выхода малого таза при отогнутом кзади копчике; 7 – проводная ось таза.
Рис. 2.7. Женский таз (сагиттальный срез).
1 – анатомическая конъюгата; 2 – истинная конъюгата; 3 – прямой размер плоскости широкой части полости малого таза; 4 – прямой размер плоскости узкой части полости малого таза; 5 – прямой размер выхода малого таза при обычном положени копчика; 6 – прямой размер выхода малого таза при отогнутом кзади копчике; 7 – проводная ось таза.
Рис. 2.8. Размеры плоскости входа в малый таз. 1 – прямой размер (истинная конъюгата); 2 – поперечный размер; 3 – косые размеры.
Плоскость входа в малый таз проходит через верхневнутренний край лонной дуги, безымянные линии и вершину мыса. В плоскости входа различают следующие размеры (рис. 2.8).
Прямой размер – кратчайшее расстояние между серединой верхневнутреннего края лонной дуги и самой выдающейся точкой мыса. Это расстояние называется истинной конъюгатой (conjugata vera); она равняется 11 см. Принято также различать и анатомическую конъюгату – расстояние от середины верхнего края лонной дуги до той же точки мыса; она на 0,2-0,3 см длиннее истинной конъюгаты (см. рис. 2.7).
Поперечный размер – расстояние между наиболее отдаленными точками безымянных линий противоположных сторон. Он равен?13,5 см. Этот размер пересекает под прямым углом истинную конъюгату эксцентрично, ближе к мысу.
Косые размеры – правый и левый. Правый косой размер идет от правого крестцово-подвздошного сочленения до левого подвздошно-лонного бугорка, а левый косой размер – соответственно от левого крестцовоподвздошного сочленения до правого подвздошно-лонного бугорка. Каждый из этих размеров равен 12 см.
Как видно из приведенных размеров, плоскость входа имеет поперечноовальную форму.
Плоскость широкой части полости малого таза проходит спереди через середину внутренней поверхности лонной дуги, с боков – через середину гладких пластинок, расположенных под ямками вертлужных впадин (lamina acetabuli), и сзади – через сочленение между II и III крестцовыми позвонками.
В плоскости широкой части различают следующие размеры.
Прямой размер – от середины внутренней поверхности лонной дуги до сочленения между II и III крестцовыми позвонками; он равен 12,5 см.,
Поперечный размер, соединяющий наиболее отдаленные точки пластинок вертлужных впадин той и другой стороны равен 12,5 см.
Плоскость широкой части по своей форме приближается к кругу.
Плоскость узкой части полости малого таза проходит спереди через нижний край лонного сочленения, с боков – через седалищные ости, сзади – через крестцово-копчиковое сочленение.
В плоскости узкой части различают следующие размеры.
Прямой размер – от нижнего края лонного сочленения к крестцово-копчиковому сочленению. Он равен 11 см.
Поперечный размер – между внутренней поверхностью седалищных остей. Он равен 10,5 см.
Плоскость выхода малого таза в отличие от других плоскостей малого таза состоит из двух плоскостей, сходящихся под углом по линии, соединяющей седалищные бугры. Она проходит спереди через нижний край лонной дуги, по бокам – через внутренние поверхности седалищных бугров и сзади – через верхушку копчика.
В плоскости выхода различают следующие размеры.
Прямой размер – от середины нижнего края лонного сочленения до верхушки копчика. Он равен 9,5 см (рис. 2.9). Прямой размер выхода благодаря некоторой подвижности копчика может удлиняться в родах при прохождении головки плода на 1-2 см и достигать 11,5 см (см. рис. 2.7).
 Рис. 2.9. Прямой размер выхода таза (измерение).
Рис. 2.9. Прямой размер выхода таза (измерение).
 Рис. 2.10. Измерение поперечного размера выхода таза.
Рис. 2.10. Измерение поперечного размера выхода таза.
Поперечный размер – между наиболее отдаленными точками внутренних поверхностей седалищных бугров. Он равен 11 см (рис. 2.10).
Эта классическая система плоскостей, в разработке которой приняли участие основоположники русского акушерства, особенно А.Я.Крас совский, позволяет правильно ориентироваться в продвижении предлежащей части плода по родовому каналу и совершаемых ею при этом поворотах.
Все прямые размеры плоскостей малого таза сходятся в области лонного сочленения, в области же крестца расходятся. Линия, соединяющая середины всех прямых размеров плоскостей малого таза, представляет собой дугу, вогнутую спереди и выгнутую сзади. Эта линия называется проводной осью малого таза. Прохождение плода по родовому каналу совершается по этой линии (см. рис. 2.7).
Угол наклонения таза – пересечение плоскости его входа с плоскостью горизонта (рис. 2.11) – при поло-жении женщины стоя может быть различным в зависимости от телосложения и ко-леблется от 45 до 55°. Он может быть уменьшен, если попросить женщину, ле-жащую на спине, сильно притянуть к животу бедра, что приводит к приподниманию лона, или, наоборот, увеличен, если подложить под поясницу валикообразную жесткую подушку, что приведет к отклонению лона вниз. Уменьшение угла на-клонения таза достигается также в том случае, если женщина принимает положение полусидя или положение на корточках.
 Рис. 2.11. Угол наклонения таза.
Рис. 2.11. Угол наклонения таза.
Физиология женской репродуктивной системы. менструальный цикл
Репродуктивная функция женщин осуществляется прежде всего благодаря деятельности яичников и матки, так как в яичниках созревает яйцеклетка, а в матке под влиянием гормонов, выделяемых яичниками, происходят изменения по подготовке к восприятию оплодотворенного плодного яйца. Репродуктивный период характеризуется способностью организма женщины к воспроизводству потомства; продолжительность данного периода от 17-18 до 45-50 лет. Репродуктивному, или детородному, периоду предшествуют следующие этапы жизни женщины: внутриутробный; новорожденное™ (до 1 года); детства (до 8-10 лет); препубертатного и пубертатного возраста (до 17-18 лет). Репродуктивный период переходит в климактерический, в котором различают пременопаузу, менопаузу и постменопаузу.Менструальный цикл – одно из проявлений сложных биологических процессов в организме женщины. Менструальный цикл характеризуется циклическими изменениями во всех звеньях репродуктивной системы, внешним проявлением которых является менструация.
Менструации – это кровянистые выделения из половых путей женщины, периодически возникающие в результате отторжения функционального слоя эндометрия в конце двухфазного менструального цикла. Первая менструация (menarhe) наблюдается в возрасте 10-12 лет, но в течение 1-1,5 года после этого менструации могут быть нерегулярными, а затем устанавливается регулярный менструальный цикл.
Первый день менструации условно принимается за первый день мен-струального цикла. Следовательно, продолжительность цикла составляет время между первыми днями двух последующих менструаций. Для 60 % женщин средняя продолжительность менструального цикла составляет 28 дней с колебаниями от 21 до 35 дней. Величина кровопотери в менструальные дни 40-60 мл, в среднем 50 мл. Продолжительность нормальной менструации от 2 до 7 дней.
Яичники.
Во время менструального цикла в яичниках происходит рост фолликулов и созревание яйцеклетки, которая в результате становится готовой к оплодотворению. Одновременно в яичниках вырабатываются половые гормоны, обеспечивающие изменения в слизистой оболочке матки, способной воспринять оплодотворенное яйцо.
Половые гормоны (эстрогены, прогестерон, андрогены) являются сте-роидами, в их образовании принимают участие гранулезные клетки фолликула, клетки внутреннего и наружного слоев. Половые гормоны, синтезируемые яичниками, влияют на ткании органы-мишени. К ним относятся половые органы, в первую очередь матка, молочные железы, губчатое вещество костей, мозг, эндотелий и гладкие мышечные клетки сосудов, миокард, кожа и ее придатки (волосяные фолликулы и сальные железы) и др. Прямой контакт и специфическое связывание гормонов на клетке-мишени является результатом взаимодействия его с соответствующими рецепторами.
Биологический эффект дают свободные (несвязанные) фракции эстрадиола и тестостерона (1 %). Основная масса яичниковых гормонов (99 %) находится в связанном состоянии. Транспорт осуществляется специальными белками – стероидосвязывающими глобулинами и неспецифическими транспортными системами – альбуминами и эритроцитами.
Эстрогенные гормоны способствуют формированию половых органов, развитию вторичных половых признаков в период полового созревания. Андрогены оказывают влияние на появление оволосения на лобке и в подмышечных впадинах. Прогестерон контролирует секреторную фазу менструального цикла, подготавливает эндометрий к имплантации. Половые гормоны играют важную роль в процессе развития беременности и родов.
Циклические изменения в яичниках включают три основных процесса: 1. Рост фолликулов и формирование доминантного фолликула. 2. Овуляция. 3. Образование, развитие и регресс желтого тела.
При рождении девочки в яичнике находятся 2 млн фолликулов, 99 % которых подвергаются атрезии в течение всей жизни. Под процессом атрезии понимается обратное развитие фолликулов на одной из стадий его развития. Ко времени менархе в яичнике содержится около 200-400 тыс. фолликулов, из которых созревают до стадии овуляции 300-400.
 Рис. 2.12. Этапы развития доминантного фолликула.
а – примордиальный фолликул; б – преантральный фолликул; в – антральный фол-ликул; г – преовуляторный фолликул: 1 – овоцит, 2 – гранулезные клетки (зернистая зона), 3 – тека-клетки, 4 – базальная мембрана.
Рис. 2.12. Этапы развития доминантного фолликула.
а – примордиальный фолликул; б – преантральный фолликул; в – антральный фол-ликул; г – преовуляторный фолликул: 1 – овоцит, 2 – гранулезные клетки (зернистая зона), 3 – тека-клетки, 4 – базальная мембрана.
Принято выделять следующие основные этапы развития фолликула (рис. 2.12): примордиальный фолликул, преантральный фолликул, антральный фолликул, преовуляторный фолликул.
Примордиальный фолликул состоит из незрелой яйцеклетки, которая расположена в фолликулярном и гранулезном (зернистом) эпителии. Снаружи фолликул окружен соединительной оболочкой (тека-клетки). В течение каждого менструального цикла от 3 до 30 примордиальных фолликулов начинают расти, и из них формируются преантральные, или первичные, фолликулы.
Преантральный фолликул. С началом роста примордиальный фолликул прогрессирует до преантральной стадии, а овоцит увеличивается и окружается мембраной, называемой блестящей оболочкой (zona pellucida). Клетки гранулезного эпителия подвергаются размножению, а слой теки образуется из окружающей стромы. Этот рост характеризуется повышением продукции эстрогенов. Клетки гранулезного слоя преантрального фолликула способны синтезировать стероиды трех классов, при этом эстрогенов синтезируется гораздо больше, чем андрогенов и прогестерона.
Антральный, или вторичный, фолликул. Характеризуется дальнейшим ростом: увеличивается число клеток гранулезного слоя, продуцирующих фолликулярную жидкость. Фолликулярная жидкость накапливается в межклеточном пространстве гранулезного слоя и образует полости. В этот период фолликулогенеза (8-9-й день менструального цикла) отмечается синтез половых стероидных гормонов, эстрогенов и андрогенов.
Согласно современной теории синтеза половых гормонов, в тека-клетках синтезируются андрогены – андростендион и тестостерон. Затем андрогены попадают в клетки гранулезного слоя, и в них ароматизируются в эстрогены.
Доминантный фолликул. Как правило, один такой фолликул образуется из множества антральных фолликулов (к 8-му дню цикла). Он является самым крупным, содержит наибольшее число клеток гранулезного слоя и рецепторов к ФСГ, ЛГ. Доминантный фолликул имеет богато васкуляризированный тека-слой. Наряду с ростом и развитием доминантного преовуляторного фолликула в яичниках параллельно происходит процесс атрезии остальных (90 %) растущих фолликулов.
Доминантный фолликул в первые дни менструального цикла имеет диаметр 2 мм, который в течение 14 дней к моменту овуляции увеличивается в среднем до 21 мм. За это время происходит ШО-кратное увеличение объема фолликулярной жидкости. В ней резко возрастает содержание эстрадиола и ФСГ, а также определяются факторы роста.
Овуляция – разрыв преовулярного доминантного (третичного) фолликула и выход из него яйцеклетки. Ко времени овуляции в овоците происходит процесс мейоза. Овуляция сопровождается кровотечением из разрушенных капилляров, окружающих те каклетки. Полагают, что овуляция происходит через 24-36 ч после формирования преовуляторного пика эстрадиола. Истончение и разрыв стенки преовуляторного фолликула происходят под влиянием фермента коллагеназы. Определенную роль играют также простагландины F2a и Е2, содержащиеся в фолликулярной жидкости; протеолитические ферменты, образующиеся в гранулезных клетках; окситоцин и релаксин.
После выхода яйцеклетки в полость фолликула быстро врастают образующиеся капилляры. Гранулезные клетки подвергаются лютеинизации: в них увеличивается объем цитоплазмы и образуются липидные включения. Л Г, взаимодействуя с белковыми рецепторами гранулезных клеток, стимулирует процесс их лютеинизации. Этот процесс приводит к образованию Желтого тела.
Желтое тело – транзиторная эндокринная железа, которая функционирует в течение 14 дней независимо от продолжительности менструального цикла. При отсутствии беременности желтое тело регрессирует.?
Таким образом, s яичнике синтезируются основные женские половые стероидные гормоны – эстрадиол и прогестерон, а также андрогены.
В I фазу менструального цикла, который длится от первого дня менструации до момента овуляции, организм находится под влиянием эстрогенов, а во II (от овуляции до начала менструации) к эстрогенам присоединяется прогестерон, выделяющийся кчетками желтого тела. Первая фаза менструального цикла называется также фолликулиновой, или фолликулярной, вторая фаза цикла – лютеиновой.
В течение менструального цикла в периферической крови отмечаются два пика содержания эстрадиола: первый -выраженный преовуляторный цикл, и второй, менее выраженный, -в середине второй фазы менструального цикла. После овуляции во второй фазе цикла основным является прогестерон, максимальное количество которого синтезируется на 4-7-й день после овуляции (рис. 2.13).
Циклическая секреция гормонов в яичнике определяет изменения в слизистой оболочке матки.
 Циклические изменения в слизистой оболочке матки (эндометрии). Эндометрий состоит из следующих слоев.
1. Базальный слой, который не отторгается во время менструации. Из его клеток в течение менструального цикла образуется слой эндометрия.
2. Поверхностный слой, состоящий из компактных эпителиальных клеток, которые выстилают полость матки.
3. Промежуточный, или спонгиозный, слой.
Циклические изменения в слизистой оболочке матки (эндометрии). Эндометрий состоит из следующих слоев.
1. Базальный слой, который не отторгается во время менструации. Из его клеток в течение менструального цикла образуется слой эндометрия.
2. Поверхностный слой, состоящий из компактных эпителиальных клеток, которые выстилают полость матки.
3. Промежуточный, или спонгиозный, слой.
 Рис. 2.13. Содержание гормонов в плазме крови в течение менструального цикла.
Рис. 2.13. Содержание гормонов в плазме крови в течение менструального цикла.
Дни менструального цикла
Последние два слоя составляют функциональный слой, подвергающийся основным циклическим изменениям в течение менструального цикла и отторгающийся в период менструации.? В I фазе менструального цикла эндометрий представляет собой тонкий слой, состоящий из желез и стромы. Выделяют следующие основные фазы изменения эндометрия в течение цикла: 1. фаза пролиферации; 2. фаза секреции; 3. менструация.
Фаза пролиферации. По мере увеличения секреции эстрадиола растущими фолликулами яичников эндометрий претерпевает пролиферативные изменения. Происходит активное размножение клеток базального слоя. Образуется новый поверхностный рыхлый слой с вытянутыми трубчатыми железами. Этот слой быстро утолщается в 4 – 5 раз. Трубчатые железы, выстланные цилиндрическим эпителием, удлиняются.
Фаза секреции. В лютеиновую фазу яичникового цикла под влиянием прогестерона увеличивается извилистость желез, а просвет их постепенно расширяется. Клетки стромы, увеличиваясь в объеме, приближаются друг к другу. Секреция желез усиливается. В просвете желез находят обильное количество секрета. В зависимости от интенсивности секреции железы либо остаются сильно извитыми, либо приобретают пилообразную форму. Отмечается усиленная васкуляризация стромы. Различают раннюю, среднюю и позднюю фазы секреции.
Менструация. Это отторжение функционального слоя эндометрия. Тонкие механизмы, лежащие в основе возникновения и процесса менструации, неизвестны. Установлено, что эндокринной основой начала менструации является выраженное снижение уровней прогестерона и эстрадиола вследствие регрессии желтого тела.
Существуют следующие основные локальные механизмы, принимающие участие в менструации: 1. изменение тонуса спиральных артериол; 2. изменение механизмов гемостаза в матке; , 3. изменения в лизосомной функции клеток эндометрия; 4. регенерация эндометрия.
Установлено, что началу менструации предшествует интенсивное сужение спиральных артериол, приводящее к ишемии и десквамации эндометрия.
В течение менструального цикла изменяется содержание лизосом в клетках эндометрия. Лизосомы содержат ферменты, некоторые из которых участвуют в синтезе простагландинов. В ответ на снижение уровня прогестерона усиливается выделение этих ферментов.
Регенерация эндометрия наблюдается с са2мого начала менструации. К концу 24-го часа менструации отторгается /з функционального слоя эндометрия. Базальный слой содержит эпителиальные клетки стромы, являющиеся основой для регенерации эндометрия, которая обычно к 5-му Дню цикла полностью завершается. Параллельно завершается ангиогенез с восстановлением целости разорванных артериол, вен и капилляров.
Изменения в яичниках и матке происходят под влиянием двухфазной Деятельности регулирующих менструальную функцию систем: кора большого мозга, гипоталамус, гипофиз. Таким образом, выделяются 5 основных звеньев репродуктивной системы женщины: кора большого мозга, гипоталамус, гипофиз, яичник, матка (рис. 2.14). Взаимосвязь всех звеньев репродуктивной системы обеспечивается наличием в них рецепторов как к половым, так и к гонадотропным гормонам.
О роли ЦНС в регуляции функции репродуктивной системы известно давно. Об этом свидетельствовали нарушения овуляции при различных острых и хронических стрессах, нарушение менструального цикла при перемене климатогеографических зон, ритма работы; хорошо известно прекращение менструаций в условиях военного времени.У психически неуравновешенных женщин, страстно желающих иметь ребенка, менструации также могут прекратиться.
В коре большого мозга ив экстрагипоталамических церебральных структурах (лимбической системе, гиппокампе, миндалине и др.) выявлены специфические рецепторы для эстрогенов, прогестерона и андрогенов. В этих структурах происходят синтез, выделение и метаболизм нейропептидов, нейротрансмиттеров и их рецепторов, которые в свою очередь избирательно влияют на синтез и выделение рилизинг-гормона гипоталамуса.
 Рис. 2.14. Функция репродуктивной системы (схема).
РГЛГ – рилизинг-гормоны; ОК. – окситоиин; Прл – пролактин, ФСГ – фолликулостимулирующий гормон; П – прогестерон; Э – эстрогены; А – андрогены; Р – релаксин; И – ингибин; ЛГ – лютеинизируюший гормон.
Рис. 2.14. Функция репродуктивной системы (схема).
РГЛГ – рилизинг-гормоны; ОК. – окситоиин; Прл – пролактин, ФСГ – фолликулостимулирующий гормон; П – прогестерон; Э – эстрогены; А – андрогены; Р – релаксин; И – ингибин; ЛГ – лютеинизируюший гормон.
Во взаимосвязи с половыми стероидами функционируют нейротрансмиттеры: норадреналин, дофамин, гамма-аминомасляная кислота, ацетилхолин, серотонин и мелатонин. Норадреналин стимулирует выброс гонадотропинрилизинг-гормона (ГТРГ) из нейронов переднего гипоталамуса. Дофамин и серотонин уменьшают частоту и снижают амплитуду выработки ГТРГ в различные фазы менструального цикла. Нейропептиды (эндогенные опиоидные пептиды, нейропептид Y, кортикотропин-рилизинг-фактор и галанин) также влияют на функцию репродуктивной системы, а следовательно, на функцию гипоталамуса. Эндогенные опиоидные пептиды трех видов (эндорфины, энкефалины и динорфины) способны связываться с опиатными рецепторами мозга. Эндогенные опиоидные пептиды (ЭОП) модулируют влияние половых гормонов на содержание ГТРГ по механизму обратной связи, блокируют секрецию гипофизом гонадотропных гормонов, особенно ЛГ, посредством блокады секреции ГТРГ в гипоталамусе.
Взаимодействие нейротрансмиттеров и нейропептидов обеспечивает в организме женщины репродуктивного возраста регулярные овуляторные циклы, влияя на синтез и выделение ГТРГ гипоталамусом.
В гипоталамусе имеются пептидергические нейронные клетки, которые секретируют стимулирующие (либерины) и блокирующие (статины) нейрогормоны – нейросекреция. Эти клетки обладают свойствами как нейронов, так и эндокринных клеток, и отвечают как на сигналы (гормоны), поступающие из кровотока, так и на нейротрансмиттеры и нейропептиды мозга. Нейрогормоны синтезируются в рибосомах цитоплазмы нейрона, а затем транспортируются по аксонам к терминалям.
Гонадотропин-рилизинг-гормон (либерин) – нейрогормон, регулирующий гонадотропную функцию гипофиза, где синтезируются ФСГ и ЛГ. Рилизинг-гормон ЛГ (люлиберин) выделен, синтезирован и подробно описан. Выделить и синтезировать рилизинг-фолликулостимулирующий гормон, или фоллиберин, до настоящего времени не удалось.
Секреция гонадолиберина имеет пульсирующий характер: пики усиленной секреции гормона продолжительностью несколько минут сменяются 1 – 3-часовыми интервалами относительно низкой секреторной активности. Частоту и амплитуду секреции гонадолиберина регулирует уровень эстрогенов.
Нейрогормон, который контролирует секрецию пролактина аденогипофизом, называется пролактинингибирующим гормоном (фактором), или дофамином.
Важным звеном в системе репродукции является передняя доля гипофиза – аденогипофиз, в котором секретируются гонадотропные гормоны, фолликулостимулирующий гормон (ФСГ, фоллитропин) лютеинизирующий гормон (ЛГ, лютропин) и пролактин (Прл), регулирующие функцию яичников и молочных желез. Все три гормона являются белковыми веществами (полипептидами). Железой-мишенью гонадотропных гормонов является яичник.
В передней доле гипофиза синтезируются также тиреотропный (ТТГ) и адренокортикотропный (АКТГ) гормоны, а также гормон роста.
ФСГ стимулирует рост и созревание фолликулов яичника, способствует образованию рецепторов ФСГ и ЛГ на поверхности гранулезных клеток яичника, увеличивает содержание ароматаз в зреющем фолликуле и, стимулируя процессы ароматизации, способствует превращению андрогенов в эстрогены, стимулирует продукцию ингибина, активина и инсулиноподобного фактора роста-1, которые играют ингибирующую и стимулирующую роль в росте фолликулов.
ЛГ стимулирует: 1. образование андрогенов в тека-клетках; 2. овуляцию совместно с ФСГ; 3. ре моделирование гранулезных клеток в процессе лютеинизации; 4. синтез прогестерона в желтом теле.
 Рис. 2.15. Циклические изменения в органах репродуктивной системы в течение менструального цикла.
I – гонадотропная регуляция функции яичников: ПДГ – передняя доля гипофиза, остальные обозначения те же, что на рис. 2.14; II – содержание в эндометрии рецепторов к эстрадиолу – РЭ (1,2,3; сплошная линия) и прогестерону – РП (2,4,6; пунктирная линия); III – циклические изменения эндометрия; ГУ – цитология эпи-телия влагалища; V – базальная температура; VI – натяжение цервикальной слизи.
Рис. 2.15. Циклические изменения в органах репродуктивной системы в течение менструального цикла.
I – гонадотропная регуляция функции яичников: ПДГ – передняя доля гипофиза, остальные обозначения те же, что на рис. 2.14; II – содержание в эндометрии рецепторов к эстрадиолу – РЭ (1,2,3; сплошная линия) и прогестерону – РП (2,4,6; пунктирная линия); III – циклические изменения эндометрия; ГУ – цитология эпи-телия влагалища; V – базальная температура; VI – натяжение цервикальной слизи.
Пролактин стимулирует рост молочных желез и лактацию, контролирует секрецию прогестерона желтым телом путем активации образования в них рецепторов к ЛГ.
Синтез пролактина аденогипофизом находится под тоническим блокирующим контролем дофамина, или пролактинингибирующего фактора. Ингибиция синтеза пролактина прекращается во время беременности, лактации. Основным стимулятором синтеза пролактина является тиролиберин, синтезируемый в гипоталамусе.
Циклические изменения в гипоталамо-гипофизарной системе и в яичниках взаимосвязаны и моделируются по типу обратной связи.
Выделяют следующие типы обратной связи: 1. "длинная петля" обратной связи – между гормонами яичника и ядрами гипоталамуса; между гормонами яичника и гипофизом; 2. "короткая петля" – между передней долей гипофиза и гипоталамусом; 3. "ультракороткая петля" – между ГТРГ и нервными клетками гипоталамуса.
Взаимосвязь всех указанных структур определяется наличием в них рецепторов к половым гормонам.
У женщины репродуктивного возраста имеется как отрицательная, так и положительная обратная связь между яичниками и гипоталамо-гипофизарной системой. Примером отрицательной обратной связи является усиление выделения Л Г передней долей гипофиза в ответ на низкий уровень эстрадиола в раннюю фолликулярную фазу цикла. Примером положительной обратной связи является выброс ЛГ в ответ на овуляторный максимум содержания эстрадиола в крови.
О состоянии репродуктивной системы можно судить по оценке тестов функциональной диагностики: базальная температура, симптом зрачка и кариопикнотеческий индекс (рис. 2.15).
Базальная температура измеряется в прямой кишке утром, до подъема с постели. При овуляторном менструальном цикле базальная температура повышается в лютеиновую фазу цикла на 0,4-0,6 °С и держится в течение всей второй фазы (рис. 2.16). В день менструации или за день до нее базальная температура снижается. При берешннвйтИ повышение базальной температуры объясняется возбуждением терморегулирующего центра гипоталамуса под влиянием прогестерона.
 Рис. 2.16. Ректальная температура при двухфазном цикле. М – менструация; О В – овуляция.
Рис. 2.16. Ректальная температура при двухфазном цикле. М – менструация; О В – овуляция.
Симптом зрачка отражает изменения в слизи шейки матки. Под влиянием эстрогенов в шейке матки накапливается прозрачная стекловидная слизь, что обусловливает расширение наружного отверстия шейки матки. Максимальное количество слизи наблюдается в предовуляторные дни цикла, наружное отверстие становится темным, напоминает зрачок. Во вторую фазу цикла под влиянием прогестерона количество слизи уменьшается или же она полностью исчезает. Слизь имеет глыбчатое строение. Различают 3 степени симптома зрачка: +, + + , + + + .
Кариопикнотический индекс. Под влиянием гормонов яичников также происходят циклические изменения в слизистой оболочке влагалища, особенно в его верхней трети. В мазке из влагалища могут встречаться следующие виды клеток плоского многослойного эпителия: а) ороговевающие, б) промежуточные, в) базальные, или атрофические. Клетки первого типа начинают преобладать по мере нарастания секреции яичниками эстрогенов. На основании определения количественных соотношений клеточных элементов можно судить о степени насыщенности организма эстрогенными гормонами или об их недостаточности. Максимальное число ороговевающих клеток выявляется в предо вуляторные дни – 80-88 %, в раннюю фазу пролиферации – 20-40 %, в позднюю фазу секреции – 20-25 %.
Глава 3. Физиология беременности
Оплодотворение. ранний эмбриогенез
Оплодотворение
Оплодотворением называется процесс слияния зрелых мужской (сперматозоид) и женской (яйцеклетка) половых клеток, в результате чего возникает зигота, несущая генетическую информацию как отца, так и матери.Процесс созревания мужских и женских половых клеток очень сложен. Сперматогенез совершается в извитых семенных канальцах мужских гонад. Он завершается в период половой зрелости образованием зрелых сперматозоидов, обладающих способностью к оплодотворению. Полному созреванию предшествует процесс редукционного деления, в результате которого в ядре сперматозоида содержится гаплоидный набор хромосом.
Сперматозоиды бывают двух видов: носители половых Хи Y-хромосом. При слиянии с яйцеклеткой сперматозоида, являющегося носителем половой Х-хромосомы, из образующейся зиготы развивается эмбрион женского пола, при слиянии сперматозоида, имеющего половую Y-хромосому, возникает зародыш мужского пола (яйцеклетка всегда является носительницей половой Х-хромосомы).
Зрелый сперматозоид имеет длину до 50-60 мкм и состоит из головки, шейки и хвостовой части. Головка сперматозоида, имеющая овальную форму, содержит ядро, окруженное тонким слоем протоплазмы. Шейка имеет протоплазму, содержащую видоизмененную центросому, которая способствует процессу дробления оплодотворенной яйцеклетки. Хвостик состоит из протоплазмы и выполняет двигательные функции, В результате колебательных движений хвостовой части сперматозоиды способны совершать самостоятельные движения в половом тракте женщины со скоростью 2-3 мм/мин. Способность к движениям сперматозоиды получают после их контакта с секретом семенных пузырьков и предстательной железы. Такая смесь носит название семенной жидкости, или спермы. При половом сношении во влагалище женщины изливается в среднем около 3-5 мл спермы, в которой содержится 300-500 млн сперматозоидов. Использование электронной микроскопии позволило установить весьма сложную структуру сперматозоида (рис. 3.1).
Семенная жидкость имеет сложный состав и содержит фруктозу, белковые вещества, протеазы, кислую фосфатазу, лимонную кислоту и биологически активные вещества – простагландины. Семенная жидкость обладает выраженной антигенной активностью, при этом антигены обнаружены как в самих сперматозоидах, так и в жидкой части спермы. Полагают, что число антигенных компонентов в семенной жидкости достигает 12. В процессе оплодотворения происходит нейтрализация антигенов сперматозоидов.
Развитие яйцектеток связано с ростом и развитием первичных фолликулов, находящихся в корковом слое яичников. Созревание яйцеклетки условно можно разделить на созревание ядра и созревание цитоплазмы. Под созреванием ядра понимают совокупность процессов, переводящих ядро из стадии динлотена I (или стадии герминативного пузырька) до метафазы второго мейотического деления. Созревание ядра не включает в себя завершение мейоза, так как только проникновение сперматозоида внутрь яйцеклетки вызывает завершение второго редукционного деления.
 Рис .3.1. Строение сперматозоида человека (электронно-микроскопическая схема), 1 – акросома; 2 – ядро; 3 – шейка; 4 – митохондрии; 5 – осевые нити.
Рис .3.1. Строение сперматозоида человека (электронно-микроскопическая схема), 1 – акросома; 2 – ядро; 3 – шейка; 4 – митохондрии; 5 – осевые нити.
От периода наступления полового созревания до менопаузы у женщины в каждом менструальном цикле обычно созревает одна яйцеклетка. Овоцит первого порядка пре-вращается в овоцит второго порядка при отщеплении первого полярного тельца. В мо-мент овуляции овоцит второго порядка оказывается блокированным на стадии метафазы второго мейотического деления. Созревание яйцеклеток стало известно в деталях благодаря возможности культивирования яйцеклеток in vitro, что в настоящее время широко используют при экстракорпоральном оплодотворении.
Зрелая яйцеклетка состоит из ядра, цитоплазмы, окружена блестящей оболочкой и клетками лучистого венца, представляющего собой остатки гранулезных клеток фоллику-ла (рис. 3.2). Женская половая клетка, как и мужская, обладает антигенными свойствами. Особенно богата различными антигенами ее блестящая оболочка.
Прежде чем анализировать механизмы оплодотворения, т.е. процесс слияния яйцеклетки со сперматозоидом, следует осветить вопросы транспорта гамет. В первую очередь это касается продвижения сперматозоидов по каналам репродуктивной системы женщины. При нормальной эякуляции во влагалище попадает в среднем около 100 млн сперматозоидов, некоторые из которых имеют те или иные морфологические либо функциональные отклонения. Часть сперматозоидов, в том числе и неполноценных, остается во влагалище и подвергается фагоцитозу, Вместе со сперматозоидами во влагалище попадают и другие составные части спермы, при этом особая роль принадлежит проста гланд инам. Под их влиянием происходит активация сократительной активности матки и маточных труб, что очень важно для нормального транспорта гамет.
 Рис. 3.2. Зрелая яйцеклетка, окру-женная клетками лучистого венца.
Рис. 3.2. Зрелая яйцеклетка, окру-женная клетками лучистого венца.
Из влагалища, имеющего у здоровой женщины кислую среду (кислая среда неблагоприятна для жизнедеятельности сперматозоидов), последние быстро поступают в цервикальную слизь, которая во время полового акта под влиянием сокращений мышц шейки матки выделяется из цервикального канала. Наличие слабощелочной реакции цервикальной слизи способствует повышению двигательной активности сперматозоидов.
Оптимальный состав цервикальной слизи формируется к моменту овуляции в основном под влиянием эстрогенных гормонов яичников. В этот период мицелии слизи располагаются в виде своеобразных цепочек, ориентированных по силовым линиям магнитного поля земли. Сперматозоиды продвигаются по мицелиям слизи по направлению к матке, но лишь при определенной архитектонике цепочек мицелл. Турбулентные движения сперматозоидов наиболее выражены в пристеночных областях шейки матки, при этом часть сперматозоидов на некоторое время может депонироваться в криптах шейки матки, создавая тем самым своеобразный резерв спермы, откуда в дальнейшем может происходить дополнительное их поступление вверх по каналам репродуктивной системы.
В верхних отделах полового тракта женщины начинается процесс, называемый капацитацией спермы, – приобретение ею благодаря сложным изменениям способности к оплодотворению. В результате капацитации сперматозоиды приобретают способность к акросомальной реакции. Помимо этого, капацитация выражается в изменениях движений хвостовых частей сперматозоидов (наличие сверхактивной подвижности). Тонкие механизмы капацитации до настоящего времени полностью не изучены. Время капацитации различно у разных сперматозоидов, что, по-видимому, является важной приспособительной реакцией для процесса оплодотворения. Капацитированные сперматозоиды очень активны, однако продолжительность их жизни меньше, чем некапацитированных. Капацитированные сперматозоиды обладают повышенной способностью пенетрировать ткани, что имеет решающее значение в процессе оплодотворения яйцеклетки.
Транспорт сперматозоидов в матку, а затем и в маточные трубы в основном обеспечивается сокращениями гладкой мускулатуры этих органов. Полагают также, что трубно-маточные сфинктеры являются своеобразными дозаторами поступления сперматозоидов из полости матки в просветы маточных труб.
Наряду с сократительной способностью маточных труб, которые находятся под сложным гормональным воздействием (эстрогены, андрогены, окситоцин), а также под влиянием простагландинов, большое значение в продвижении сперматозоидов, помимо их собственной высокой кинетической активности, принадлежит таким факторам, как движения микроворсин реснитчатого эпителия эндоцервикса и ток жидкости в просвете маточной трубы. Таким образом, перемещение сперматозоидов по каналам репродук-тивной системы женщины представляет собой чрезвычайно сложный многокомпонентный процесс.
Результаты современных научных исследований свидетельствуют о наличии двухфазности процесса транспорта сперматозоидов по маточным трубам. В первую (короткую) фазу сперматозоиды начинают быстро поступать ампулу трубы. Эта фаза длится всего несколько минут и регулируется сократительной активностью матки и маточных труб. Данная фаза сменяется более длительной второй фазой, в течение которой сперматозоиды со значительно меньшей скоростью транспортируются к месту оплодотворения.
В ампулярной части маточной трубы нормальное количество сперматозоидов в длительной фазе транспорта сохраняется на определенном уровне благодаря непрерывному возмещению уходящих в брюшную полость сперматозоидов за счет тех половых клеток, которые депонированы в нижних отделах полового тракта (крипты шейки матки и др.).
Большое значение в транспорте гамет и оплодотворении имеет так называемый захват яйцеклетки ампулярным отделом маточной трубы. Этот процесс заключается в том, что ампулярный отдел трубы своими фимбриями как бы накрывает яичник в том месте, где произошла овуляция; при этом значительно облегчается перемещение зрелой яйцеклетки в ампулу маточной трубы. Механизм этого феномена окончательно еще не исследован.
Существенным является вопрос о выживаемости сперматозоидов в половых путях женщины. Некоторые авторы полагают, что жизнеспособность спермы сохраняется в течение нескольких (до 5) дней. Однако следует учитывать, что сохранение подвижности сперматозоидов не обязательно свидетельствует об их оплодотворяющей способности.
А в наиболее благоприятных условиях, когда мужские половые клетки находятся в цервикальной слизи на фоне высокого содержания эстрогенов в организме, оплодотворяющая способность сперматозоидов держится до 2 сут после эякуляции во влагалище. В связи с этим принято считать, что для достижения беременности оптимальная частота половых сношений в период до и после овуляции должна быть каждые 2 дня. При более частых половых сношениях фертильность спермы снижается.
Перед оплодотворением зрелая яйцеклетка со всех сторон окружена лучистым венцом (corona radiata). Отчетливо заметна блестящая оболочка (zona pellucida). Уже через несколько минут после разрыва фолликула (овуляции) яйцеклетка попадает в полость маточной трубы. Этому процессу способствует ряд факторов: "захват" ее фимбриями маточной трубы со стороны яичника, в котором произошла овуляция, направление тока фолликулярной жидкости при разрыве фолликула и др. Этим факторам принадлежит очень важная роль в первоначальном транспорте яйцеклетки, которая лишена самостоятельной подвижности. Способность яйцеклетки к оплодотворению в среднем составляет 24 ч. Современные методы диагностики (ультразвуковое исследование, лапароскопия) позволяют не только наблюдать за процессом овуляции, но и фиксировать этот процесс на фотопленку.
Яйцеклетка, попавшая в ампулярный отдел маточной трубы, быстро окружается большим количеством сперматозоидов, являющихся носителями как Х-, так и Y-половых хромосом. Под микроскопом сперматозоиды с Х-хромосомой имеют несколько более крупные размеры, чем несущие Y-хромосому. Сперматозоиды, окружающие яйцеклетку, начинают пенегрировать в клетки лучистого венца. Процесс пенетрации обусловлен наличием ряда ферментов, которые содержатся как в головке сперматозоида, так и в трубной жидкости (рис.3.3).
Сразу же после слияния мембран половых клеток происходит кортикальная реакция яйцеклетки, являющаяся составной частью обеспечения блока полиспермии. После этого хромосомы зиготы вступают в первое митотическое деление, которое наступает через 24 ч после начала оплодотворения. Ядро оплодотворенной яйцеклетки (зиготы) содержит диплоидный набор хромосом (46). Таким образом, новый организм является носителем генетической информации обоих родителей.
 Рис. 3.3. Пенетрация сперматозоидов в яйцеклетку в ампулярном отделе маточной трубы (схема).
Рис. 3.3. Пенетрация сперматозоидов в яйцеклетку в ампулярном отделе маточной трубы (схема).
После оплодотворения (через 24 ч) начинается дробление оплодотворенной яйцеклетки. Первоначально дробление имеет синхронный характер. Через 12 ч от начала возникновения 2 бластомеров возникают 4 бластомера и т.д. К 96 ч от момента слияния ядра сперматозоида с ядром яйцеклетки зародыш состоит из 16-32 бластомеров (стадия морулы). На этой стадии оплодотворенное яйцо (зигота) попадает в матку.
Поскольку дробящаяся яйцеклетка не обладает самостоятельной подвижностью, ее транспорт определяется взаимодействием сократительной активности маточной трубы (основной фактор), движениями цилиарного эпителия эндосальпинкса и капиллярным током жидкости в направлении от ампулярного конца маточной трубы к матке.
Транспорт яйцеклетки по маточной трубе находится под воздействием гормонов. Как известно, после овуляции на месте лопнувшего фолликула образуется новая эндокринная железа – желтое тело. Оно выделяет как прогестерон, так и эстрогенные гормоны. Именно этим двум половым гормонам принадлежит ведущая роль в обеспечении кинетики маточных труб. Под влиянием относительно низкого содержания прогестерона и более высокой концентрации в крови эстрогенов (что имеет место непосредственно после овуляции) повышается тонус ампулярно-перешеечного отдела трубы. В результате яйцеклетка задерживается в ампулярном отделе, где происходит ее оплодотворение и начинается процесс клеточного деления с образованием бластомеров. В дальнейшем происходит постепенное продвижение оплодотворенной яйцеклетки по перешейку маточной трубы к матке. Под влиянием нарастающих концентраций прогестерона желтого тела сократительная функция маточных труб приобретает перистальтический характер, при этом волны сокращений направлены в сторону матки. Происходит расслабление трубно-маточного соединения, и яйцеклетка из маточной трубы попадает в полость матки.
 Рис. 3.4. Транспорт оплодотворенной яйцеклетки по маточной трубе вплоть до имплантации (схема).
1 – яйцеклетка в ампуле маточной трубы; 2 – оплодотворение; 3-7 – различные стадии образования бластомеров; 8 – морула; 9, 10 – бластоциста; И – импланта-ция.
Рис. 3.4. Транспорт оплодотворенной яйцеклетки по маточной трубе вплоть до имплантации (схема).
1 – яйцеклетка в ампуле маточной трубы; 2 – оплодотворение; 3-7 – различные стадии образования бластомеров; 8 – морула; 9, 10 – бластоциста; И – импланта-ция.
Анализируя механизмы гормональной регуляции кинетики маточных труб, следует подчеркнуть, что только определенное соотношение между концентрациями в крови прогестерона и эстрогенов обеспечивает описанное выше четкое физиологическое взаимодействие различных отделов маточной трубы и своевременный транспорт плодного яйца в полость матки. Наряду с прогестероном и эстрогенами в осуществлении физиологической кинетики маточных труб в ранние сроки беременности известное значение отводится таким гормонам, как тестостерон и кортизол. Однако роль этих гормонов изучена в настоящее время еще недостаточно.
Имплантация плодного яйца.
Проделав путь по маточной трубе в течение 4 сут, плодное яйцо на стадии морулы попадает в матку, где превращается в бластоцисту (рис. 3.4). Стадия бластоцисты характеризуется тем, что бластомеры подвергаются определенным изменениям. Часть бластомеров, более крупных по своим размерам, образует так называемый эмбриобласт, из которого в дальнейшем развивается эмбрион. Другая часть клеток, более мелких и располагающихся по периферии плодного яйца, образует питательную оболочку – трофобласт. В дальнейшем наиболее развитая часть трофобласта превращается в плаценту. В полости матки бластоциста приближается к месту имплантации (нидации) (рис. 3.5, а,б). Локализация имплантации имеет свои закономерности и, по-видимому, в значительной степени определяется местными особенностями эндометрия. Обычно бластоциста имплантируется в области передней или задней стенки матки.Затем начинается погружение бластоцисты в эндометрий, который к этому времени превращается в децидуальную оболочку (рис. 3.5, в,г).
 Рис. 3.5. Имплантация.
а бластоциста перед имплантацией; б начальный контакт бластоцисты с децидуальной оболочкой матки; в погружение бластоцисты в децидуальную оболочку, г – завершение имплантации.
Рис. 3.5. Имплантация.
а бластоциста перед имплантацией; б начальный контакт бластоцисты с децидуальной оболочкой матки; в погружение бластоцисты в децидуальную оболочку, г – завершение имплантации.
Децидуальная оболочка представляет собой видоизмененный функциональный слой эндометрия. К моменту имплантации оплодотворенной яйцеклетки слизистая оболочка матки находится в секреторной фазе, железы пилообразно изменены и заполнены секретом, клетки стромы имеют округлый вид и содержат большое количество гликогена, липидов, нейтральных мукополисахаридов, солей и микроэлементов, ферментов и их ингибиторов, иммуноглобулинов и многие другие биологически активные соединения, необходимые для жизнедеятельности зародыша.
Процесс имплантации в первую очередь связан с гормональными факторами. Ведущая роль принадлежит половым (стероидным) гормонам. Во время беременности происходит развитие и активное функционирование желтого тела яичника, возникшего на месте лопнувшего фолликула. Желтое тело секретирует большое количество прогестерона и несколько меньшее – эстрогенов. Эти половые гормоны через специфические стероидные рецепторы, находящиеся в эндометрии, оказывают выраженное воздействие на секреторные преобразования слизистой оболочки матки и процессы ее децидуализации. Кроме стероидных, определенную роль в имплантации играют и некоторые другие гормоны (пролактин, глюкокортикоиды).
Децидуальная ткань как своеобразный эндокринный орган имеет прямое отношение к имплантации и дальнейшим стадиям постимплантационного развития зародыша. Установлено, что эндометрий женщины вырабатывает иммунореактивный пролактин. Он начинает секретироваться с 9-го дня после овуляции, при этом во время беременности продукция тканевого пролактина значительно повышается, поэтому в настоящее время некоторые исследователи склонны рассматривать децидуальную ткань как своеобразный эндокринный орган.
Процесс имплантации, который в среднем продолжается около 2 дней, сопровождается не только значительными изменениями клеточных элементов желез и стромы эндометрия, но и выраженными гемодинамическими сдвигами местного характера. Вблизи места имплантации бластоцисты отмечается расширение кровеносных сосудов и образование синусоидов, представляющих собой расширенные капилляры и венулы. Этим процессам принадлежит большая роль в процессах обмена между материнским организмом и зародышем.
Ранний эмбриогенез
После имплантации происходит быстрое развитие как зародыша, так и его оболочек. На трофобласте образуются ворсинки, которые на ранних стадиях онтогенеза равномерно покрывают всю поверхность бластоцисты. Первичные ворсины являются бессосудистыми образованиями. Постепенно наружный слой трофобласта утрачивает клеточные границы, превращаясь в синцитий (симпласт). Внутренний слой трофобласта сохраняет клеточное строение и называется цитотрофобластом. Более подробно дальнейшие процессы дифференциации трофобласта описаны в следующем разделе (см. раздел 3.2).Одновременно с трофобластом развивается и эмбриобласт. Этот процесс особенно активизируется после имплантации. Клетки эмбриобласта диффе-ренцируются в два узелка: эктобластический и эндобластический. Вскоре в центральных частях этих узелков образуются полости, в результате чего эктобластический узелок превращается в эктобластический пузырек, а эндобластический узелок – в эндобластический пузырек (рис. 3.6). Эктобластический пузырек затем превращается в амниотическую полость, а эндобластический – в желточный мешок. Из клеточных скоплений эктобласта и эндобласта, расположенных между амниотическим и желточным пузырьком, образуется зародышевый щиток (зародыш).
На ранних стадиях развития происходит и дифференцировка мезенхимы. С одной стороны клетки мезенхимы оттесняются на периферию – к трофобласту. С другой стороны происходит скопление мезенхимальных клеток вокруг амниотического и желточного пузырьков, а также около зародыша. В результате этого стенки пузырьков становятся двухслойными, а сам зародыш дифференцируется в экто-, эндои мезодерму. Эти три зародышевых листка служат исходным материалом для формирования в дальнейшем всех органов и тканей эмбриона и плода.
По мере дальнейшего внутриутробного развития происходит быстрое увеличение размеров амниотического пузырька, который превращается в амниотическую полость. В полости наблюдается быстрое накопление прозрачной жидкости (амниотическая жидкость), при этом стенка амниотического пузырька приближается к ворсинчатой оболочке и, наконец, сливается с ней. Зародыш начинает вворачиваться в полость амниона, а желточный пузырек атрофируется.
Одновременно с развитием плодных оболочек из каудального отдела первичной кишки зародыша образуется выпячивание – аллантоис. По аллантоису сосуды зародыша "подрастают" к ворсинчатой оболочке, врастая затем в каждую ворсину. В результате этого бессосудистый хорион васкуляризируется.
После завершения начальных этапов онтогенеза эмбрион окружен амниотической жидкостью и тремя оболочками: децидуальной, ворсинчатой и водной.
 Рис. 3.6. Ранние стадии развития эмбриона. 1 – эктобластический пузырек (амнион); 2 – эндобластический пузырек (желточный мешок); 3 – ворсины трофобласта.
Рис. 3.6. Ранние стадии развития эмбриона. 1 – эктобластический пузырек (амнион); 2 – эндобластический пузырек (желточный мешок); 3 – ворсины трофобласта.
Децидуальная оболочка представляет собой трансформированный в связи с беременностью функциональный слой эндометрия. К моменту имплантации эндометрий находится в секреторной фазе. Он состоит из двух слоев: компактного и спонгиозного. Компактный слой, обращенный в полость матки, содержит выводные протоки маточных желез и клетки стромы эндометрия, превратившиеся во время беременности в децидуальные. Спонгиозный слой в основном состоит из желез.?
В соответствии с локализацией плодного яйца в децидуальной оболочке можно различить три части: 1. выстилающая полость матки (decidua parietalis); 2. покрывающая плодное яйцо со стороны полости матки (decidua capsularis); 3. расположенная между плодным яйцом и стенкой матки (decidua basalis). Указанные взаимоотношения различных частей децидуальной оболочки представлены на рис. 3.7.
В процессе роста плодного яйца decidua parietalis и decidua capsularis растягиваются, истончаются и приближаются друг к другу. На 4-5-м месяце беременности плодное яйцо занимает уже всю полость матки, и decidua parietalis сливается с decidua capsularis. Наоборот, decidua basalis значительно гипертрофируется и превращается в материнскую часть плаценты. В этой части плаценты находятся многочисленные ворсины хориона, вокруг которых формируется межворсинчатое пространство.
Децидуальная оболочка является для плода питательным и защитным слоем: трофическая функция ее в основном осуществляется на ранних этапах внутриутробного развития, защитная роль наиболее полно проявляется высокой фагоцитарной активностью. Децидуальная ткань лизирует микроорганизмы и инактивирует их токсины, принимает также участие в синтезе углеводов, липидов и белков. В ней происходит синтез пролактина и простагландинов. Таким образом, децидуальной оболочке принадлежит очень важная роль в имплантации и дальнейшем развитии эмбриона и плода.
Амнион (водная оболочка) обращена к плоду. Она выстилает плаценту и переходит на пуповину, сливаясь в области пупочного кольца с кожей плода. Макроскопически амнион представляет собой тонкую полупрозрачную мембрану. В процессе эмбриогенеза амнион развивается из эктобластического пузырька. Из эктодермы формируется эпителий амниона, из мезодермы – соединительнотканная основа.
 Рис. 3.7. Беременность малого срока. 1 – decidua parietalis; 2 – decidua basalis; 3, 9 – decidua capsularis; 4 – эмбрион в амниотическом мешке; 5 – chorion frondosum; 6 – желточный мешок; 7 – цервикальный канал; 8 – целомическая полость; 10 – ворсины хориона.
Рис. 3.7. Беременность малого срока. 1 – decidua parietalis; 2 – decidua basalis; 3, 9 – decidua capsularis; 4 – эмбрион в амниотическом мешке; 5 – chorion frondosum; 6 – желточный мешок; 7 – цервикальный канал; 8 – целомическая полость; 10 – ворсины хориона.
На ранних стадиях развития эпителий амниона представлен крупными полигональными клетками, с 3-го месяца беременности он становится кубическим. Эпителиальные клетки амниона содержат липиды, полисахариды, протеины, фосфорные соединения, а также ряд ферментов, участвующих в процессах метаболизма и обмене стероидных гормонов.
Амнион вместе с гладким хорионом принимает активное участие в обмене околоплодных вод, а также в параплацентарном обмене. По своим физическим свойствам плодные оболочки отличаются друг от друга. Так как амниотическая оболочка очень плотная и выдерживает давление в несколько раз большее, чем гладкий хорион, в родах разрыв гладкого хориона наступает раньше, чем амниона.
Плацента
Плацента человека имеет гемохориальный тип строения. Этот тип плацентации характеризуется наличием непосредственного контакта материнской крови с хорионом вследствие нарушения целостности децидуальной оболочки матки со вскрытием ее сосудов.Возникновение гемохориальной плаценты в эволюции является высшей стадией. В ней отражены сложнейшие взаимоотношения функциональных систем матери и плода.
Развитие и функции плаценты
Основной частью плаценты являются ворсины хориона – производные трофобласта. На ранних этапах онтогенеза трофобласт образует протоплазматические выросты, состоящие из клеток цитотрофобласта (первичные ворсины). Первичные ворсины не имеют сосудов, и поступление питательных веществ и кислорода к организму зародыша из окружающей их материнской крови происходит по законам относительно простых законов осмоса и диффузии. К концу 2-й недели беременности в первичные ворсины врастает соединительная ткань и образуются вторичные ворсины. Их основу составляет соединительная ткань, а наружный покров представлен эпителием (трофобласт). Как первичные, так и вторичные ворсины равномерно распределяются по поверхности плодного яйца.
Эпителий вторичных ворсин состоит из двух слоев: слоя цитотрофобласта (слой Лангханса) и синцития (симпласта). Слой цитотрофобласта состоит из клеток округлой формы со светлой цитоплазмой. Ядра клеток крупные. В синцитии границы клеток практически неразличимы, цитоплазма темная, зернистая, с щеточной каймой. Ядра относительно небольших размеров, шаровидной или овальной формы.
С 3-й недели развития зародыша начинается очень важный процесс развития плаценты, который заключается в васкуляризации ворсин и превращении их в третичные, содержащие сосуды. Формирование сосудов плаценты происходит как из ангиобластов зародыша, так и из пупочных сосудов, растущих из аллантоиса.
Сосуды аллантоиса врастают во вторичные ворсины, в результате чего каждая вторичная ворсина получает васкуляризацию. Так осуществляется важнейший процесс внутриутробного развития – васкуляризация хориона. Установление аллантоидного кровообращения обеспечивает интенсивный обмен между организмами плода и матери.
А Превращение вторичных ворсин в третичные рассматривается как важнейший критический период эмбрионального развития, так как аллантоис обладает очень высокой чувствительностью к действию повреждающих факторов окружающей среды. Его повреждение сопровождается гибелью сосудов, в результате чего прекращается важнейший процесс – васкуляризация хориона, а это в свою очередь приводит к гибели зародыша на самых ранних сроках.
На ранних стадиях внутриутробного развития ворсины хориона равномерно покрывают всю поверхность плодного яйца. Однако начиная со 2-го месяца онтогенеза на большей поверхности плодного яйца ворсины атрофируются, в то же время пышно развиваются ворсины, обращенные к базальной части децидуальной оболочки. Так формируются гладкий и ветвистый хорион.
Дальнейшее развитие и дифференцировка хориона характеризуются сле-дующими основными моментами. При сроке беременности 5-6 нед толщина синцитиотрофобласта превосходит толщину слоя Лангханса, а, начиная со срока 9-10 нед синцитиотрофобласт постепенно истончается и количество ядер в нем увеличивается. На свободной поверхности синцитиотрофобласта, обращенной к межворсинчатому пространству, становятся хорошо заметными длинные тонкие цитоплазматические выросты (микроворсины), которые значительно увеличивают резорбционную поверхность плаценты. В начале II триместра беременности происходит интенсивное превращение цитотрофобласта в синцитий, в результате чего на многих участках слой Лангханса полностью исчезает.
В конце беременности в плаценте начинаются инволюционно-дистрофические процессы, которые иногда называют старением плаценты. Из крови, циркулирующей в межворсинчатом пространстве, начинает выпадать фибрин (фибриноид), который откладывается преимущественно на поверхности ворсин. Выпадение этого вещества способствует процессам микротромбообразования и гибели отдельных участков эпителиального покрова ворсин. Ворсины, покрытые фибриноидом, в значительной степени выключаются из активного обмена между организмами матери и плода.
Происходит выраженное истончение плацентарной мембраны с 25 мкм в начале беременности до 5 мкм в конце ее. Строма ворсин становится более волокнистой и гомогенной. Наблюдается некоторое утолщение эндотелия капилляров. В участках дистрофии нередко откладываются соли извести. Все эти изменения отражаются на основных функциях плаценты (дыхательной, трофической, обменной, эндокринной и др.).
Наряду с процессами инволюции в плаценте на протяжении беременности наблюдаются и явления противоположного свойства. Происходит увеличение молодых ворсин, которые в значительной мере компенсируют функцию утраченных. Однако развитие молодых ворсин лишь частично улучшает функцию плаценты в целом. В результате этого в конце беременности наблюдается снижение функции плаценты.
Строение зрелой плаценты (рис. 3.8). Макроскопически зрелая плацента очень напоминает толстую мягкую лепешку. Масса плаценты составляет 500-600 г, диаметр 15-18 см, толщина 2-3 см. Плацента имеет две поверхности: материнскую, обращенную к стенке матки, и плодовую – в сторону плода.

Материнская поверхность плаценты имеет серовато-красный цвет и пред-ставляет собой остатки базальной части децидуальной оболочки.
Плодовая поверхность сверху покрыта блестящей амниотической оболочкой, под которой к хориону подходят сосуды, идущие от места прикрепления пуповины к периферии плаценты. Основная часть плодовой плаценты представлена многочисленными ворсинами хориона, которые объединяются в дольчатые образования – котиледоны, или дольки. Их число достигает 15-20. Дольки плаценты образуются в результате разделения ворсин хориона перегородками (септами), исходящими из базальной пластинки. К каждой из таких долек подходит свой крупный сосуд.
Микроскопическое строение зрелой ворсины.
Принято различать два вида ворсин: свободные и закрепляющие (якорные). Свободные ворсины, а таких большинство, погружены в межворсинчатое пространство децидуальной оболочки и "плавают" в материнской крови. В противоположность им якорные ворсины прикреплены к базальной децидуальной оболочке и обеспечивают фиксацию плаценты к стенке матки. В третьем периоде родов связь таких ворсин с децидуальной оболочкой нарушается и под влиянием маточных сокращений плацента отделяется от стенки матки.
При микроскопическом изучении строения зрелой ворсины удается дифференцировать следующие образования (рис. 3.9 ): 1. синцитий, не имеющий четких клеточных границ; 2. слой (или остатки) цитотрофобласта; 3. строму ворсины; 4. эндотелий капилляра, в просвете которого хорошо заметны элементы крови плода.
При электронной микроскопии ворсин хориона было установлено, что синцитий имеет на своей поверхности многочисленные микроворсины, которые значительно увеличивают обменную поверхность плаценты.
Маточно-плацентарное кровообращение.
При наличии плаценты гемохориального типа кровоток и матери и кровоток плода разделены между собой следующими структурными единицами ворсин хориона: 1. эпителиальный слой (синцитий, цитотрофобласт); 2. строма ворсин; 3. эндотелий капилляров.
Кровоток в матке осуществляется с помощью 150-200 материнских спиральных артерий, которые открываются в обширное межворсинчатое простран-ство. Спиральные артерии имеют своеобразное строение, их стенки лишены мышечного слоя, а устья не способны сокращаться и расширяться.
Спиральные артерии обладают низким сосудистым сопротивлением току крови. В противоположность маточным артериям, в которых выраженное снижение сосудистого сопротивления наблюдается с 12-13 нед беременности, в спиральных артериях, как это было установлено с помощью допплерометрии, этот процесс имеет место уже с 6 нед беременности. Наиболее выраженное снижение сосудистого сопротивления в спиральных артериях наблюдается в 13-14 нед беременности, что морфологически отражает завершение процесса инвазии ворсин трофобласта в децидуальную оболочку.
Описанные особенности гемодинамики имеют очень большое значение в осуществлении бесперебойного транспорта артериальной крови от организма матери к плоду. Излившаяся артериальная кровь омывает ворсины хориона, отдавая при этом в кровь плода кислород, необходимые питательные вещества, многие гормоны, витамины, электролиты и другие химические вещества, а также микроэлементы, необходимые плоду для его правильного роста и развития. Кровь, содержащая С02 и другие продукты метаболизма плода, изливается в венозные отверстия материнских вен, общее число которых превышает 180.
Кровоток в межворсинчатом пространстве в конце беременности достаточно интенсивен и в среднем составляет 500-700 мл крови в минуту.
 Рис. 3.9. Микроскопическое строение ворси-ны (схема поперечного среза). 1 – синцитий; 2 – цитотрофобласт; 3 – строма ворсины; 4 – плодовый капилляр.
Рис. 3.9. Микроскопическое строение ворси-ны (схема поперечного среза). 1 – синцитий; 2 – цитотрофобласт; 3 – строма ворсины; 4 – плодовый капилляр.
Особенности кровообращения в системе мать-плацента-плод. Артериальные сосуды плаценты после отхождения от пуповины делятся радиально в соответствии с числом долек плаценты (котиледонов). В результате дальнейшего разветвления артериальных сосудов в конечных ворсинах образуется сеть капилляров, кровь из которых собирается в венозную систему. Вены, в которых течет артериальная кровь, собираются в более крупные венозные стволы и наконец впадают в вену пуповины (рис. 3.10).
 Рис. 3.10. Кровообращение в системе мать – плацента – плод.
1 – миометрий; 2 – свободные ворсины; 3 – якорная ворсина; 4 – децидуальная оболочка; 5 – межворсинчатре пространство; 6 – спиральные артерии; 7 – хориальная пластинка; 8 – хориальный эпителий; 9 – амнйотический эпителий; 10 – пуповина; 11 – вена пуповины; 12 – артерии пуповины; 13 – отложение фибриноида.
Рис. 3.10. Кровообращение в системе мать – плацента – плод.
1 – миометрий; 2 – свободные ворсины; 3 – якорная ворсина; 4 – децидуальная оболочка; 5 – межворсинчатре пространство; 6 – спиральные артерии; 7 – хориальная пластинка; 8 – хориальный эпителий; 9 – амнйотический эпителий; 10 – пуповина; 11 – вена пуповины; 12 – артерии пуповины; 13 – отложение фибриноида.
Кровообращение в плаценте поддерживается сердечными сокращениями матери и плода. Важная роль в стабильности этого кровообращения также принадлежит механизмам саморегуляции маточно-плацентарного кровообращения.
Основные функции плаценты.
Плацента выполняет следующие основные функции: дыхательную, выделительную, трофическую, защитную и инкреторную. Она выполняет также функции антигенобразования и иммунной защиты. Большую роль в осуществлении этих функций играют плодные оболочки и околоплодные воды.Переход через плаценту химических соединений определяется различными механизмами: ультрафильтрацией, простой и облегченной диффузией, активным транспортом, пиноцитозом, трансформацией веществ в ворсинах хориона. Большое значение имеют также растворимость химических соединений в липидах и степень ионизации их молекул.
Процессы ультрафильтрации зависят от величины молекулярной массы химического вещества. Этот механизм имеет место в тех случаях, когда молекулярная масса не превышает 100. При более высокой молекулярной массе наблюдается затрудненный трансплацентарный переход, а при молекулярной массе 1000 и более химические соединения практически не проходят через плаценту, поэтому их переход от матери к плоду осуществяется с помощью других механизмов.
Процесс диффузии заключается в переходе веществ из области большей концентрации в область меньшей концентрации. Такой механизм характерен для перехода кислорода от организма матери к плоду и С02 от плода в организм матери. Облегченная диффузия отличается от простой тем, что равновесие концентраций химических соединений по обе стороны плацентарной мембраны достигается значительно быстрее, чем этого можно было ожидать на основании законов простой диффузии. Такой механизм доказан для перехода от матери к плоду глюкозы и некоторых других химических веществ.
Пиноцитоз представляет собой такой тип перехода вещества через плаценту, когда ворсины хориона активно поглощают капельки материнской плазмы вместе с содержащимися в них теми или иными соединениями.
Наряду с этими механизмами трансплацентарного обмена большое значение для перехода химических веществ от организма матери к плоду и в обратном направлении имеет растворимость в липидах и степень ионизации молекул химических агентов. Плацента функционирует как липидный барьер. Это означает, что химические вещества, хорошо растворимые в липидах, более активно переходят через плаценту, чем плохо растворимые. Роль ионизации молекул химического соединения заключается в том, что недиссоциированые и неионизированные вещества переходят через плаценту более быстро.
Величина обменной поверхности плаценты и толщина плацентарной мембраны также имеют существенное значение для процессов обмена между организмами матери и плода.
Несмотря на явления так называемого физиологического старения, проницаемость плаценты прогрессивно возрастает вплоть до 32-35-й недели беременности. Это в основном обусловлено увеличением числа вновь образованных ворсин, а также прогрессирующим истончением самой плацентарной мембраны (с 33-38 мкм в начале беременности до 3-6 мкм в конце ее).
Степень перехода химических соединений от организма матери к плоду зависит не только от особенностей проницаемости плаценты. Большая роль в этом процессе принадлежит и организму самого плода, его способности избирательно накапливать именно те агенты, которые в данный момент особенно необходимы ему для роста и развития. Так, в период интенсивного гемопоэза возрастает потребность плода в железе, которое необходимо для синтеза гемоглобина. Если в организме матери содержится недостаточное количество железа, то у нее возникает анемия. При интенсивной оссификации костей скелета увеличивается потребность плода в кальции и фосфоре, что вызывает усиленный трансплацентарный переход их солей. В этот период беременности у матери особенно ярко выражены процессы обеднения ее организма данными химическими соединениями.
Дыхательная функция.
Газообмен в плаценте осуществляется путем проникновения кислорода к плоду и выведения из его организма СОгЭти процессы осуществляются по законам простой диффузии. Плацента не обладает способностью к накоплению кислорода и С02, поэтому их транспорт происходит непрерывно. Обмен газов в плаценте аналогичен газообмену в легких. Значительную роль в выведении С 02 из организма плода играют околоплодные воды и параплацентарный обмен.
Трофическая функция.
Питание плода осуществляется путем транспорта продуктов метаболизма через плаценту.
Белки. Состояние белкового обмена в системе мать-плод обусловлено многими факторами: белковым составом крови матери, состоянием белоксинтезирующей системы плаценты, активностью ферментов, уровнем гормонов и рядом других факторов. Плацента обладает способностью дезаминировать и переаминировать аминокислоты, синтезировать их из других предшественников. Это обусловливает активный транспорт аминокислот в кровь плода. Содержание аминокислот в крови плода несколько превышает их концентрацию в крови матери. Это указывает на активную роль плаценты в белковом обмене между организмами матери и плода. Из аминокислот плод синтезирует собственные белки, отличные в иммунологическом отношении от белков матери.
Липиды. Транспорт липидов (фосфолипиды, нейтральные жиры и др.) к плоду осуществляется после их предварительного ферментативного расщепления в плаценте. Липиды проникают к плоду в виде триглицеридов и жирных кислот. Липиды в основном локализуются в цитоплазме синцития ворсин хориона, обеспечивая тем самым проницаемость клеточных мембран плаценты.
Глюкоза. Переходит через плаценту согласно механизму облегченной диффузии, поэтому ее концентрация в крови плода может быть выше, чем у матери. Плод также использует для образования глюкозы гликоген печени. Глюкоза является основным питательным веществом для плода. Ей принадлежит также очень важная роль в процессах анаэробного гликолиза.
Вода. Через плаценту для пополнения экстрацеллюлярного пространства и объема околоплодных вод проходит большое количество воды. Вода накапливается в матке, тканях и органах плода, плаценте и амниотической жидкости. При физиологической беременности количество околоплодных вод ежедневно увеличивается на 30-40 мл. Вода необходима для правильного обмена веществ в матке, плаценте и в организме плода. Транспорт воды может осуществляться против градиента концентрации.
Электролиты. Обмен электролитов происходит трансплацентарно и через амниотическую жидкость (параплацентарно). Калий, натрий, хлориды, гидрокарбонаты свободно проникают от матери к плоду и в обратном направлении. Кальций, фосфор, железо и некоторые другие микроэлементы способны депонироваться в плаценте.
Витамины. Весьма важную роль плацента играет в обмене витаминов. Она способна накапливать их и осуществляет регуляцию их поступления к плоду. Витамин А и каротин депонируются в плаценте в значительном количестве. В печени плода каротин превращается в витамин А. Витамины группы В накапливаются в плаценте и затем, связываясь с фосфорной кислотой, переходят к плоду. В плаценте содержится значительное количество витамина С. У плода этот витамин в избыточном количестве накапливается в печени и надпочечниках. Содержание витамина D в плаценте и его транспорт к плоду зависят от содержания витамина в крови матери. Этот витамин регулирует обмен и транспорт кальция в системе мать-плод. Витамин Е, как и витамин К, не переходит через плаценту. Следует иметь в виду, что синтетические препараты витаминов Е и К переходят через плаценту и обнаруживаются в крови пуповины.
Ферменты.Плацента содержит многие ферменты, участвующие в обмене веществ. В ней обнаружены дыхательные ферменты (оксидазы, каталаза, дегидрогеназы и др.). В тканях плаценты имеется сукцинатдегидрогеназа, которая участвует в процессе переноса водорода при анаэробном гликолизе. Плацента активно синтезирует универсальный источник энергии АТФ.
Из ферментов, регулирующих углеводный обмен, следует указать амилазу, лактазу, карбоксилазу и др. Белковый обмен регулируется с помощью таких ферментов, как НАДи НАДФдиафоразы. Специфическим для плаценты является фермент – термостабильная щелочная фосфотаза (ТЩФ). На основании показателей концентрации этого фермента в крови матери можно судить о функции плаценты во время беременности. Другим специ-фическим ферментом плаценты является окситоциназа. В плаценте содержится ряд биологически активных веществ системы гистамин-гнетам и наза, ацетилхолин-ходинэстераза и др. Плацента также богата различными факторами свертывания крови и фибринолиза.
Эндокринная функция.
При физиологическом течении беременности существует тесная связь между гормональным статусом материнского организма, плацентой и плодом. Плацента обладает избирательной способностью переносить материнские гормоны. Так, гормоны, имеющие сложную белковую структуру (соматотропин, тиреотропный гормон, АКТГ и др.), практически не переходят через плаценту. Проникновению окситоцина через плацентарный барьер препятствует высокая активность в плаценте фермента окситоциназы. Переходу инсулина от организма матери к плоду, по-видимому, препятствует его высокая молекулярная масса.
В противоположность этому стероидные гормоны обладают способностью переходить через плаценту (эстрогены, прогестерон, андрогены, глюкокортикоиды). Тиреоидные гормоны матери также проникают через плаценту, однако трансплацентарный переход тироксина осуществляется более медленно, чем трийодтиронина.
Наряду с функцией по трансформации материнских гормонов плацента сама превращается во время беременности в мощный эндокринный орган, который обеспечивает наличие оптимального гормонального гомеостаза как у матери, так и у плода.
Одним из важнейших плацентарных гормонов белковой природы является плацентарныйлактоген (ПЛ). По своей структуре ПЛ близок к гормону роста аденогипофиза. Гормон практически целиком поступает в материнский кровоток и принимает активное участие в углеводном и липидном обмене. В крови беременной ПЛ начинает обнаруживаться очень рано – с 5-й недели, и его концентрация прогрессивно возрастает, достигая максимума в конце гестации (рис. 3.11, а). ПЛ практически не проникает к плоду, а в амниотической жидкости содержится в низких концентрациях. Этому гормону уделяется важная роль в диагностике плацентарной недостаточности.
Другим гормоном плаценты белкового происхождения является хорионический гонадотропин (ХГ). По своему строению и биологическому действию ХГ очень сходен с лютеинизирующим гормоном аденогипофиза. При диссоциации ХГ образуются две субъединицы (а и р). Наиболее точно функцию плаценты отражает р-ХГ. ХГ в крови матери обнаруживают на ранних стадиях беременности, максимальные концентрации этого гормона отмечаются в 8-10 нед беременности (рис. 3.11, б). В ранние сроки бере-менности ХГ стимулирует стероидогенез в желтом теле яичника, во второй половине – синтез эстрогенов в плаценте. К плоду ХГ переходит в ограниченном количестве. Полагают, что ХГ участвует в механизмах половой дифференцировки плода. На определении ХГ в крови и моче основаны гормональные тесты на беременность: иммунологическая реакция, реакция Ашгейма – Цондека, гормональная реакция на самцах лягушек и др. (см. Диагностика беременности).
Плацента наряду с гипофизом матери и плода продуцирует пролактин. Физиологическая роль плацентарного пролактина сходна с таковой ПЛ гипофиза.
Кроме белковых гормонов, плацента синтезирует половые стероидные гормоны (эстрогены, прогестерон, кортизол).
Эстрогены (эстрадиол, эстрон, эстриол) продуцируются плацентой в возрастающем количестве, при этом наиболее высокие концентрации этих гормонов наблюдаются перед родами (рис. 3.12). Около 90% эстрогенов плаценты представлены эстриолом. Его содержание служит отражением не только функции плаценты, но и состояния плода. Дело в том, что эстриол в плаценте образуется из андрогенов надпочечников плода, поэтому концентрация эстриола в крови матери отражает состояние как плода, так и плаценты. Эти особенности продукции эстриола легли в основу эндокринной теории о фетоплацентарной системе.
Прогрессирующим увеличением концентрации во время беременности характеризуется также эстрадиол. Многие авторы считают, что именно этому гормону принадлежит решающее значение в подготовке организма беременной к родам.
Важное место в эндокринной функции плаценты принадлежит синтезу прогестерона (рис. 3.13). Продукция этого гормона начинается с ранних сроков беременности, однако в течение первых 3 мес основная роль в синтезе прогестерона принадлежит желтому телу и лишь затем эту роль берет на себя плацента. Из плаценты прогестерон поступает в основном в кровоток матери и в значительно меньшей степени в кровоток плода.
В плаценте вырабатывается глюкокортикоидный стероид кортизол. Этот гормон также продуцируется в надпочечниках плода, поэтому концентрация кортизола в крови матери отражает состояние как плода, так и плаценты (фетоплацентарной системы).
До настоящего времени открытым остается вопрос о продукции АКТГ и ТТТ плацентой.
Иммунная система плаценты.
Плацента представляет собой своеобразный иммунный барьер, разделяющий два генетически чужеродных организма (мать и плод), поэтому при физиологически протекающей беременности иммунного конфликта между организмами матери и плода не возникает. Отсутствие иммунологического конфликта между организмами матери и плода обусловлено следующими механизмами: 1. отсутствие или незрелость антигенных свойств плода; 2. наличие иммунного барьера между матерью и плодом (плацента); 3. иммунологические особенности организма матери во время беременности (см. Иммунная система матери и плода).
Барьерная функция плаценты.
Понятие "плацентарный барьер" включает в себя следующие гистологические образования: синцитиотрофобласт, цитотрофобласт, слой мезенхимальных клеток (строма ворсин) и эндотелий плодового капилляра. Плацентарный барьер в какой-то степени можно уподобить гематоэнцефалическому барьеру, который регулирует проникновение различных веществ из крови в спинномозговую жидкость. Однако в отличие от гематоэнцефалического барьера, избирательная проницаемость которого характеризуется переходом различных веществ только в одном направлении (кровь – цереброспинальная жидкость), плацентарный барьер регулирует переход веществ и в обратном направлении, т.е. от плода к матери.
 Рис. 3.12. Уровень эстрогенов в крови во время беременности. 1 – суммарные эстрогены; 2 – эстриол; 3 – эстрон; 4 – эстрадиол.
Рис. 3.12. Уровень эстрогенов в крови во время беременности. 1 – суммарные эстрогены; 2 – эстриол; 3 – эстрон; 4 – эстрадиол.
Трансплацентарный переход веществ, постоянно находящихся в крови матери и попавших в нее случайно, подчиняется разным законам. Переход от матери к плоду химических соединений, постоянно присутствующих в крови матери (кислород, белки, липиды, углеводы, витамины, микроэлементы и др.), регулируется достаточно точными механизмами, в результате чего одни вещества содержатся в крови матери в более высоких концентрациях, чем в крови плода, и наоборот. По отношению к веществам, случайно попавшим в материнский организм (агенты химического производства, лекарственные препараты и т.д.), барьерные функции плаценты выражены в значительно меньшей степени.
Проницаемость плаценты непостоянна. При физиологической беременности проницаемость плацентарного барьера прогрессивно увеличивается вплоть до 32-35-й недели беременности, а затем несколько снижается. Это обусловлено особенностями строения плаценты в различные сроки беременности, а также потребностями плода в тех или иных химических соединениях.
Ограниченные барьерные функции плаценты в отношении химических веществ, случайно попавших в организм матери, проявляются в том, что через плаценту сравнительно легко переходят токсичные продукты химического производства, большинство лекарственных препаратов, никотин, алкоголь, пестициды, возбудители инфекций и т.д. Это создает реальную опасность для неблагоприятного действия этих агентов на эмбрион и плод.?
Барьерные функции плаценты наиболее полно проявляются только в физиологических условиях, т.е. при неосложненном течении беременности. Под воздействием патогенных факторов (микроорганизмы и их токсины, сенсибилизация организма матери, действие алкоголя, никотина, наркотиков) барьерная функция плаценты нарушается, и она становится проницаемой даже для таких веществ, которые в обычных физиологических условиях через нее переходят в ограниченном количестве.
Околоплодные воды
Околоплодные воды, или амниотическая жидкость, являются биологически активной средой, окружающей плод. На протяжении всей беременности околоплодные воды выполняют самые разнообразные функции, обеспечивая нормальное функционирование системы мать-плацента-плод. Амниотический мешок появляется на 8-й неделе беременности как производное эмбриобласта. В дальнейшем по мере роста и развития плода происходит прогрессивное увеличение объема амниотической полости за счет накопления в ней околоплодных вод.Амниотическая жидкость в основном представляет собой фильтрат плазмы крови матери. В ее образовании важная роль принадлежит также секрету амниотического эпителия. На более поздних стадиях внутриутробного развития в продукции амниотической жидкости принимают участие почки и легочная ткань плода.
Объем околоплодных вод зависит от срока беременности. Нарастание объема происходит неравномерно. Так, в 10 нед беременности объем амниотической жидкости составляет в среднем 30 мл, в 13-14 нед – 100 мл, в 18 нед – 400 мл и т.д. Максимальный объем отмечается к 37-38 нед беременности, в среднем составляя 1000-1500 мл. К концу беременности количество вод может уменьшиться до 800 мл. При перенашивании бере-менности (41 – 42 нед) наблюдается уменьшение объема амниотической жидкости (менее 800 мл).
Околоплодные воды характеризуются высокой скоростью обмена. При доношенной беременности в течение 1 ч обменивается около 500 мл вод. Полный обмен околоплодных вод совершается в среднем за 3 ч. В процессе обмена Уз амниотической жидкости проходит через плод, который заглатывает приблизительнооколо 20 мл вод в 1 ч. В III триместре беременности в результате дыхательных движений плода через его легкие диффундирует 600 – 800 мл жидкости в сутки. До 24 нед беременности обмен амниотической жидкости осуществляется также через Кожные покровы плода, а позже, когда происходит ороговение эпидермиса, кожа плода становится почти непроницаемой для жидкой среды.
Плод не только поглощает окружающую его жидкую среду, но и сам является источником ее образования. Доказано, что в конце беременности плод продуцирует около 600-800 мл мочи в сутки. Моча плода является важной составной частью амниотической жидкости.
Обмен околоплодных вод совершается через амнион и хорион. Наряду с этим важная роль в обмене вод принадлежит так называемому параплацентарному пути, т.е. через внеплацентарную часть плодных оболочек.
В начале беременности околоплодные воды представляют собой бесцветную прозрачную жидкость, которая в дальнейшем изменяет свой вид и свойства. Из прозрачной она становится мутноватой вследствие попадания в нее отделяемого сальных желез кожи плода, пушковых волосков, чешуек десквамированного эпителия, капелек жира и некоторых других веществ. С химической точки зрения околоплодные воды представляют собой коллоидный раствор сложного химического состава. Кислотно-основный состав амниотической жидкости изменяется в динамике беременности. Следует отметить, что рН амниотической жидкости коррелирует с рН крови плода.
В околоплодных водах в растворенном виде содержатся кислород и СО2, в них имеются все электролиты, которые присутствуют в крови матери и плода. В амниотической жидкости также обнаружены белки, липиды, углеводы, гормоны, ферменты, разнообразные биологически активные вещества, витамины. Важное диагностическое значение имеет обнаружение в амниотической жидкости фосфолипидов, которые входят в состав сурфактанта. Для физиологически протекающей доношенной беременности характерным является оптимальное соотношение между концентрацией в водах лецитина и сфингомиелина, равное 2 (концентрация лецитина в 2 раза выше, чем концентрация сфингомиелина). Такое соотношение этих химических агентов характерно для плода, имеющего зрелые легкие. В этих условиях они легко расправляются при первом внеутробном вдохе, обеспечивая тем самым становление легочного дыхания.
Важное диагностическое значение имеет также определение концентрации а-фетопротеина в амниотической жидкости. Этот белок вырабатывается в печени плода, а затем вместе с мочой попадает в околоплодные воды. Высокая концентрация этого белка свидетельствует об аномалиях развития плода, главным образом со стороны нервной системы.
Наряду с этим известное диагностическое значение имеет определение в околоплодных водах содержания креатинина, которое отражает степень зрелости почек плода.
В околоплодных водах имеются факторы, влияющие на свертывающую систему крови. К ним относятся тромбопластин, фибринолизин, а также факторы X и XIII. В целом амниотическая жидкость обладает относительно высокими коагулирующими свойствами.
Околоплодные воды выполняют и важную механическую функцию. Они создают условия для осуществления свободных движений плода, защищают организм плода от неблагоприятных внешних воздействий, предохраняют пуповину от сдавления между телом плода и стенками матки. Плодный пузырь способствует физиологическому течению первого периода родов.
Пупочный канатик и послед
Пупочный канатик (пуповина).
Формируется из амниотической ножки, соединяющей зародыш с амнионом и хорионом. В амниотическую ножку из энтодермы задней кишки зародыша врастает аллантоис, несущий фетальные сосуды. В состав зачатка пуповины входят остатки желточного протока и желточного мешка. На III месяце внутриутробного развития желточный мешок перестает функционировать как орган кроветворения и кровообращения, редуцируется и остается в виде небольшого кистозного образования У основания пуповины. Аллантоис полностью исчезает на V месяце внутриутробной жизни.
На ранних стадиях онтогенеза пуповина содержит 2 артерии и 2 вены.
В дальнейшем обе вены сливаются в одну. По вене пуповины течет артериальная кровь от плаценты к плоду, по артериям – венозная кровь от плода к плаценте. Сосуды пуповины имеют извилистый ход, поэтому пупочный канатик как бы скручен по длине.
Сосуды пуповины окружены студенистым веществом (вартонов студень), которое содержит большое количество гиалуроновой кислоты. Клеточные элементы представлены фибробластами, тучными клетками, гистиоцитами и др. Стенки артерий и вены пуповины имеют различную проницаемость, что обеспечивает особенности обмена веществ. Вартонов студень обеспечивает упругость пупочного канатика. Он не только фиксирует сосуды пуповины и предохраняет их от сдавления и травмы, но и играет как бы роль vasa vasomm, обеспечивая питание сосудистой стенки, а также осуществляет обмен веществ между кровью плода и амниотической жидкостью. Вдоль сосудов пуповины располагаются нервные стволы и нервные клетки, поэтому сдавление пупочного канатика опасно не только с точки зрения нарушения гемодинамики плода, но и в плане возникновения отрицательных нейрогенных реакций.
Имеется несколько вариантов прикрепления пуповины к плаценте. В одних случаях она прикрепляется в центре плаценты (центральное прикрепление), в других – сбоку (боковое прикрепление). Иногда пуповина прикрепляется к плодным оболочкам, не доходя до самой плаценты (оболочечное прикрепление пуповины). В этих случаях сосуды пуповины подходят к плаценте между плодными оболочками.
Длина и толщина пуповины изменяются в процессе внутриутробного развития. При доношенной беременности длина пуповины в среднем соответствует длине плода (50 см). Чрезмерно короткая (35-40 см) и очень длинная пуповина могут представлять опасность для плода.
Послед.
Послед состоит из плаценты, плодных оболочек и пуповины. Послед изгоняется в третьем периоде родов после рождения ребенка.
Физиология плода
Развитие плода совершается согласно генетическому коду, однако сами процессы роста и развития находятся в тесном взаимодействии с материнским организмом. Во время внутриутробной жизни у плода формируются его собственные регуляторные механизмы, обеспечивающие его адаптацию к изменяющимся условиям окружающей среды, которой для него является материнский организм.Во внутриутробном развитии человека условно принято различать следующие периоды: предымплантационное развитие, имплантацию, органогенез и плацентацию и плодный период. Выделение этих периодов очень важно с точки зрения ответных реакций эмбриона и плода на воздействие повреждающих факторов окружающей среды.
Предымплантационное развитие.
Начинается с момента оплодотворения яйцеклетки и продолжается вплоть до внедрения бластоцисты в децидуальную оболочку матки (на 5-6-й день после оплодотворения). В течение этого периода оплодотворенная яйцеклетка последовательно проходит стадии морулы, бластулы и бластоцисты.
Для бластомеров зародыша преды мплантационного периода развития характерны признаки полипотентности и высокая способность к регенерации. Это означает, что в случае повреждения отдельных бластомеров оставшиеся клетки полностью восстанавливают функцию утраченных. Поэтому при наличии повреждающих факторов окружающей среды зародыш в этот период развития либо переносит их воздействие без отрицательных последствий, либо погибает, если значительное количество бластомеров оказались поврежденными и полная их регенерация невозможна.
Имплантация, органогенез и плацентация.
Эти периоды охватывают первые 3 мес внутриутробного периода, причем наиболее чувствительной фазой являются первые 3-6 нед органогенеза (критический период развития).
Под понятием "критический период развития" имеют в виду определенные фазы внутриутробного развития, когда эмбрион обладает особенно высокой чувствительностью к повреждающему действию окружающей среды. Такая высокая чувствительность обусловлена в первую очередь активной дифференцировкой органов и тканей зародыша, а также интенсивно протекающими процессами биосинтеза нуклеиновых кислот, цитоплазматических и мембранных белков и липидов. Поэтому имплантацию и органо-генез можно считать критическими периодами внутриутробного развития. Именно в эти периоды онтогенеза под воздействием повреждающих факторов окружающей среды эмбрион может погибнуть (эмбриолеталъный эффект) или же у него возникают аномалии развития {тератогенный эффект).
Наряду с органогенезом плацентацию (развитие сосудистой плаценты) также можно отнести к критическому периоду развития. Многие повреждающие факторы окружающей среды обладают способностью нарушать нормальное развитие аллантоиса и тесно связанную с этим процессом васкуляризацию хориона.
Плодный (фетальный) период.
Этот период развития продолжается от 12 до 40 нед беременности.
В плодный период практически все органы и системы плода находятся в физиологическом состоянии функциональной незрелости, что и определяет своеобразие ответных реакций плода на внешние воздействия.
Согласно теории системогенеза, предложенной известным физиологом П.КАнохиным, развитие отдельных систем у плода происходит неравномерно, при этом избирательно и ускоренно развиваются те функциональные системы, которые в первую очередь необходимы для адаптации его организма к условиям внеутробной жизни. Эта закономерность становится отчетливо заметной при рассмотрении особенностей внутриутробного развития нервной, сердечно-сосудистой, кроветворной, эндокринной и других систем.
Нервная система.
Эта система закладывается очень рано. Образование нервной трубки и мозговых пузырей отмечается уже в течение первых недель онтогенетического развития, что можно идентифицировать на эхограммах с 8-9 нед беременности, на 2-м месяце внутриутробной жизни формируются элементы рефлекторной дуги. С этого времени появляются первые двигательные рефлексы, которые хорошо заметны при ультразвуковом исследовании с 7-8 нед беременности. В дальнейшем двигательная активность плода принимает закономерный характер, в среднем составляя около трех движений за 10 мин. К 20-22 нед заканчивается период локальных проявлений рефлекторных реакций (при раздражении определенных участков тела) и появляются рефлексы более сложного характера. Например, на 21-й неделе внутриутробного развития у плода возникают первые спонтанные сосательные движения. Приблизительно в этот же период удается фиксировать появление первых электрических потенциалов мозга. К 24-й неделе двигательная активность плода внешне уже напоминает движения новорожденного ребенка.
К рефлекторным реакциям следует также отнести дыхательные движения плода. Некоторые авторы считают, что в результате дыхательных движений, которые отчетливо заметны при ультразвуковом исследовании, улучшается кровообращение плода, так как периодически возникающее понижение внутрибрюшного давления способствует притоку крови в полые вены и усилению работы сердца. Дыхательные движения плода не имеют постоянного характера, они обычно сочетаются с периодами апноэ. Нельзя полностью исключить и такого предположения, что дыхательные движения плода являются подготовкой дыхательного аппарата к осуществлению его основной функции после рождения ребенка.
К концу внутриутробного периода в основном заканчивается формирование важнейших отделов центральной и периферической нервной системы плода. Однако кортикальные функции развиваются у ребенка после его рождения.
Эндокринная система.
Становление и развитие эндокринной системы плода необходимо рассматривать в тесном взаимодействии с эндокринной системой материнского организма и плаценты. Лишь в отдельных случаях эндокринная система плода функционирует изолированно от соответствующих систем матери и плаценты. Типичным примером в этом отношении является продукция плодом соматотропного гормона гипофиза.
Продукция соматотропного гормона гипофиза плода автономна, поскольку плацента является барьером для материнского гормона. Начальную продукцию этого гормона у эмбриона можно отметить, начиная с 7-8-й недели внутриутробной жизни. Возрастание концентрации этого гормона в крови плода наблюдается до 20-24 нед беременности, что коррелирует с показателями роста плода. Однако на более поздних стадиях беременности эта тенденция не сохраняется, вследствие чего считают, что рост плода не полностью контролируется продукцией данного гормона.
Продукция гипофизом гонадотропных гормонов происходит в такой последовательности; фолликулостимулирующий гормон (ФСГ) синтезируется гипофизом с 13-й недели онтогенеза, лютеинизирующий (ЛГ) – с 18-й, пролактин (ПЛ) – с 19-й. Окситоцин и вазопрессин начинают синтезироваться задней долей гипофиза с 23-й недели внутриутробной жизни. Наивысшие концентрации окситоцина у плода обнаруживают в конце внутриутробного развития и в родах.
Половые гормоны женских (эстрогены) и мужских (тестостерон) гонад образуются в антенатальном периоде в незначительном количестве. Этим гормонам принадлежит важная роль в процессах дифференцировки наружных и внутренних половых органов.
На 9-й неделе развития у плода можно отметить первые признаки продукции АКТГ. АКТГ стимулирует функцию коркового вещества надпочечников с образованием кортизола и дегидроэпиакдростерона. Кортизол плода играет важную роль в синтезе сурфактантной системы, которая способствует созреванию легочной ткани. При недостаточной продукции кортизола наблюдается недостаточное созревание легочной ткани плода.
Дегидроэпиандростерон из надпочечников плода поступает в плаценту, где из него синтезируется гормон эстриол. Он является основным эстрогеном плаценты {90 % эстрогенов в крови матери представлены эстриолом). Следовательно, содержание эстриола в крови матери отражает состояние не только плода, но и плаценты (фетоплацентарной системы), что имеет очень важное диагностическое значение.
Продукция тиреотропного гормона (ТТГ) гипофиза начинается приблизительно на 12-й неделе внутриутробной жизни, что сопровождается началом образования тиреоидных гормонов ( Т 3 и Т 4 ) . ТТГ, как и Т 4 , матери не переходят через плаценту. Переход Т3 от матери к плоду ограничен. Вследствие этого система ТТГ – щитовидная железа плода функционирует в значительной степени изолированно от соответствующей системы матери. Тиреоидные гормоны плода играют очень важную роль в процессах фетального роста и развития, особенно в оссификации костей скелета и зубов, а также в формировании нервной системы.
Развитие поджелудочной железы у эмбриона человека начинается на 3-4-й неделе онтогенеза. К 17-й неделе отмечается высокая концентрация фетального инсулина. У плода инсулин играет роль гормона роста, в то время как в материнском организме инсулин обеспечивает надлежащий уровень глюкозы как у матери, так и у плода. Инсулин, образующийся в организме матери, не переходит через плаценту к плоду; равным образом инсулин плодового происхождения не переходит в материнский кровоток, что, по-видимому, обусловлено высокой молекулярной массой данного гормона. Поэтому предположение о том, что сахарный диабет у беременных протекает легче, чем у небеременных, в результате компенсации за счет плода, в настоящее время считается необоснованным.
Кроветворение.
Особого внимания заслуживают вопрос о фетальных эритроцитах и фетальном гемоглобине, поскольку эритроцитам принадлежит ведущая роль в транспорте кислорода от матери к плоду. В крови зрелого плода эритроцитов больше, чем у новорожденного ребенка первой недели жизни (после рождения плода начинается процесс физиологического гемолиза части эритроцитов). Наличие физиологической эритремии обусловливает бесперебойный транспорт кислорода плода. Фетальный гемоглобин в противоположность гемоглобину взрослого человека обладает повышенным сродством к кислороду. В период внутриутробного развития наблюдается сдвиг кривой диссоциации оксигемоглобина слева направо. Это означает, что по мере роста и развития плода способность его крови связывать кислород несколько снижается. Следовательно, на более ранних стадиях развития эритроциты плода обладают способностью связывать кислород в достаточном количестве при наличии относительно низкого парциального давления кислорода в крови. Эти закономерности имеют очень большое физиологическое значение и свидетельствуют о том, что в ранние сроки беременности, когда плод особенно чувствителен к действию гипоксии, фетальный гемоглобин обеспечивает наиболее полную утилизацию кислорода из материнской крови. Некоторое снижение диссоциации оксигемоглобина, наблюдаемое у плода в конце беременности, в значительной степени компенсируется повышением концентрации гемоглобина крови по мере развития плода.
Кровообращение.
2 период внутриутробного развития кровообращение плода проходит три последовательные стадии: желточное, аллантоидное и плацентарное.
Желточный период развития системы кровообращения у человека очень короткий – от момента имплантации до 2-й недели жизни зародыша. Кислород и питательные вещества поступают к зародышу непосредственно через клетки трофобласта, которые в этот период эмбриогенеза еще не имеют сосудов. Значительная часть питательных веществ скапливается в желточном мешке, который имеет также собственные скудные запасы питательных веществ. Из желточного мешка кислород и необходимые питательные вещества по первичным кровеносным сосудам поступают к зародышу. Так осуществляется желточное кровообращение, присущее самым ранним этапам онтогенетического развития.
Аллантоидное кровоообращение начинает функционировать при-близительно с конца 8-й недели беременности и продолжается в течение 8 нед, т.е. до 15-16-й недели беременности. Аллантоис, представляющий собой выпячивание первичной кишки, постепенно подрастает к бессосудистому трофобласту, неся вместе с собой фетальные сосуды. При соприкосновении аллантоиса с трофобластом фетальные сосуды врастают в бессосудистые ворсины трофобласта, и хорион становится сосудистым. Установление аллантоидного кровообращения является качественно новой ступенью внутриутробного развития эмбриона, поскольку оно дает возможность более широкого транспорта кислорода и необходимых питательных веществ от матери к плоду. Нарушения аллантоидного кровообращения (нарушения васкуляризации трофобласта) лежат в основе причин гибели зародыша.
Плацентарное кровообращение приходит на смену аллантоилному. Оно начинается на 3-4-м месяце беременности и достигает расцвета в конце беременности. Формирование плацентарного кровообращения сопровождается развитием плода и всех функций плаценты (дыхательной, выделительной, транспортной, обменной, барьерной, эндокринной и др.). Именно при гемохориапьном типе плацентации возможен наиболее полный и адекватный обмен между организмами матери и плода, а также осуществление адаптационных реакций системы мать-плод.
Система кровообращения плода во многом отличается от таковой новорожденного (рис. 3.14а; 3.146). Это определяется как анатомическими, так и функциональными особенностями организма плода, отражающими его адаптационные процессы в период внутриутробной жизни.
Анатомические особенности сердечно-сосудистой системы плода прежде всего заключаются в существовании овального отверстия между правым и левым предсердиями и артериального протока, соединяющего легочную артерию с аортой. Это позволяет значительной массе крови миновать нефункционирующие легкие. Кроме того, имеется сообщение между правым и левым желудочками сердца. Кровообращение плода начинается в сосудах плаценты, откуда кровь, обогащенная кислородом и содержащая все необходимые питательные вещества, поступает в вену пуповины.
 Рис. 3.14а. Кровообращение у плода.
Рис. 3.14а. Кровообращение у плода.
Затем артериальная кровь через венозный (аранциев) проток попадает в печень. Печень плода представляет собой своеобразное депо крови. В депонировании крови наибольшую роль играет ее левая доля. Из печени через тот же венозный проток кровь поступает в нижнюю полую вену, а оттуда – в правое предсердие. В правое предсердие поступает также кровь из верхней полой вены. Между местом впадения нижней и верхней полых вен находится заслонка нижней полой вены, которая разделяет оба кровотока. Эта заслонка направляет ток крови нижней полой вены из правого предсердия в левое через функционирующее овальное отверстие. Из левого предсердия кровь поступает в левый желудочек, а оттуда – в аорту. Из восходящей дуги аорты кровь попадает в сосуды головы и верхней части туловища.
 Рис. 3.146. Кровообращение у новорожденного.
Рис. 3.146. Кровообращение у новорожденного.
Венозная кровь, поступающая в правое предсердие из верхней полой вены, оттекает в правый желудочек, а из него – в легочные артерии. Из легочных артерий только небольшая часть крови поступает в нефункционирующие легкие. Основная масса крови из легочной артерии через артериальный (боталлов) проток направляется в нисходящую дугу аорты. Кровь нисходящей дуги аорты снабжает нижнюю половину туловища и нижние конечности. После этого кровь, бедная кислородом, через ветви подвздошных артерий поступает в парные артерии пуповины и через них – в плаценту.
Объемные распределения крови в фетальном кровообращении выглядят следующим образом: приблизительно половина общего объема крови из правых отделов сердца поступает через овальное отверстие в левые отделы сердца, 30 % через артериальный (боталлов) проток сбрасывается в аорту, 12 % попадает в легкие. Такое распределение крови имеет очень большое физиологическое значение с точки зрения получения отдельными органами плода крови, богатый кислородом, а именно чисто артериальная кровь содержится только в вене пуповины, в венозном протоке и сосудах печени; смешанная венозная кровь, содержащая достаточное количество кислорода, находится в нижней полой вене и восходящей дуге аорты, поэтому печень и верхняя часть туловища у плода снабжаются артериальной кровью лучше, чем нижняя половина тела. В дальнейшем по мере прогрессирования беременности происходит небольшое сужение овального отверстия и уменьшение размеров нижней полой вены. Вследствие этого во второй половине беременности дисбаланс в распределении артериальной крови несколько уменьшается.
Физиологические особенности кровообращения плода важны не только с точки зрения снабжения его кислородом. Не меньшее значение феталыше кровообращение имеет и для осуществления важнейшего процесса выведения из организма плода СО2 и других продуктов обмена. Описанные выше анатомические особенности кровообращения плода создают предпосылки к осуществлению очень короткого пути выведения С02 и продуктов обмена: аорта – артерии пуповины – плацента.
Сердечно-сосудистая система плода обладает выраженными адаптационными реакциями на острые и хронические стрессовые ситуации, обеспечивая тем самым бесперебойное снабжение крови кислородом и необходимыми питательными веществами, а также выведение из его организма С02 и конечных продуктов обмена веществ. Это обеспечивается наличием различных механизмов нейрогенного и гуморального характера, которые регулируют частоту сердечных сокращений, ударный объем сердца, перифери-ческую констрикцию и дилатацию артериального протока и других артерий. Кроме того, система кровообращения плода находится в тесной взаимосвязи с гемодинамикой плаценты и матери. Эта взаимосвязь отчетливо видна, например, при возникновении синдрома сдавления нижней полой вены. Сущность этого синдрома заключается в том, что у некоторых женщин в конце беременности происходит сдавление маткой нижней полой вены и, по-видимому, частично аорты. В результате этого в положении женщины на спине у нее происходит перераспределение крови, при этом большое количество крови задерживается в нижней полой вене, а артериальное давление в верхней части туловища снижается. Кпинически это выражается в возникновении головокружения и обморочного состояния. Сдавление нижней полой вены беременной маткой приводит к нарушениям кровообращения в матке, что в свою очередь немедленно отражается на состоянии плода (тахикардия, усиление двигательной активности). Таким образом, рассмотрение патогенеза синдрома сдавления нижней полой вены наглядно демонстрирует наличие тесной взаимосвязи сосудистой системы матери, гемодинамики плаценты и плода.
Сердечная деятельность. Сердце эмбриона закладывается рано (на 2-й неделе онтогенеза), а его формирование в основном завершается на 7-й неделе внутриутробной жизни. Таким образом, на 7-8-й неделе жизни у зародыша уже имеется типично сформированное сердце с двумя предсердиями и двумя желудочками. Приблизительно в это же время формируются магистральные сосуды, а несколько позже – и периферическая сосудистая сеть. С помощью современных ультразвуковых приборов сравнительно рано удается установить сердечную деятельность плода – с 4-5-й недели беременности.
На самых ранних стадиях развития сердечный ритм у зародыша замедленный, так как в регуляции сердечной деятельности еще не принимает участие периферическая иннервация. Однако после сформирования симпатической и парасимпатической иннервации частота сердечных сокращений (ЧСС) увеличивается. Использование ультразвукового сканирования позволило детально проследить динамику ЧСС в различные периоды беременности. Так, с 6 до 9 нед беременности ЧСС быстро нарастает от 125 до 177 в минуту. В последующем она снижается и к 14-й неделе беременности в среднем составляет 158 в минуту. В дальнейшем ЧСС плода составляет 120-160 в минуту. С помощью акушерского стетоскопа сердечную деятельность плода удается определить с 18-20-й недели беременности.
Дыхательная система.
В период внутриутробной жизни внешнее (легочное) дыхание у плода отсутствует. Дыхательная функция целиком осуществляется плацентой.
Закладка легких, бронхов и трахеи происходит на 4-й неделе эмбрионального развития. В дальнейшем наблюдается дифференцировка этих систем и развитие сосудистой сети. С 26-й недели внутриутробного развития отмечается дифференцировка альвеолярного эпителия. Клетки I типа представляют собой покровный эпителий альвеол, клетки II типа содержат гранулы и продуцируют особый липопротеид сурфактант, который в дальнейшем при рождении способствует расправлению легочной ткани. Известно, что пленка, образованная сурфактантами на поверхности водных рас-творов, меняет поверхностную активность в зависимости от увеличения или уменьшения поверхности, на которой эта пленка распределяется. При вдохе, когда поверхность легких сокращается, сурфактанты становятся более активными и уменьшают поверхностное натяжение до очень малых величин и для расправления легких требуется очень малое давление.
Благодаря сурфактантам в легких остается значительная часть воздуха перед следующим вдохом. Если же имеется дефицит сурфактантов, то при вдохе легкие спадаются (коллапс), что значительно затрудняет следующий вдох. Одно из основных веществ, определяющих свойство сурфактантов, – лецитин. Другим является сфингомиелин, Сурфактантная система является зрелой только при определенном соотношении между этими химическими веществами. Поэтому определение соотношения лецитин/сфингомиелин является важным показателем зрелости легочной ткани плода на различных стадиях его внутриутробной жизни.
Синтез сурфактантов происходит под воздействием кортикостероидов и гормонов щитовидной железы. Следовательно, зрелость легких и их способность расправляться и правильно функционировать в период внеутробной жизни во многом определяются эндокринным статусом плода.
Во внутриутробном периоде плод совершает нерегулярные дыхательные движения, которые с помощью ультразвукового исследования можно наблюдать начиная с 11-й недели беременности. По мере увеличения срока беременности частота дыхательных движений плода возрастает, составляя 30 – 70 в минуту. Дыхательные движения грудной клетки являются показателем хорошего функционального состояния плода.
Внутриутробные дыхательные движения плода имеют большое физиологическое значение. Эти движения способствуют притоку крови к сердцу плода, попаданию амниотической жидкости в трахеобронхиальное дерево и легкие плода, что является одним из важных механизмов обмена околоплодных вод.
Дыхательные движения плода нельзя сравнивать с внеутробным дыханием. При дыхательных экскурсиях легкие плода не расправляются, а голосовая щель находится при этом в полусомкнутом состоянии.
Основным органом, осуществляющим дыхательную функцию плода, является плацента. Она осуществляет как транспорт кислорода от матери к плоду, так и выведение С02 в обратном направлении.
К факторам, способствующим интенсивному переходу кислорода от матери к плоду, следует отнести высокую концентрацию фетального гемоглобина, который обладает большей способностью поглощать кислород, чем гемоглобин матери. Несмотря на существование механизмов, облегчающих диффузию кислорода через плацентарную мембрану, парциальное давление кислорода в крови плода относительно низкое.
В отличие от кислорода С02 в крови матери и плода имеет приблизительно одинаковые кривые диссоциации. Градиент для перехода С02 от плода к матери увеличивается вследствие того, что при беременности парциальное давление С02 уменьшается в результате гипервентиляции легких, вызываемой прогестероном. Большая часть С02 в крови плода находится в виде гидрокарбоната, через плаценту свободно переходит только растворенный СО-}. Молекула же гидробикарбоната проходит через плаценту с трудом.
В связи с низким содержанием кислорода в крови плода в его организме, помимо окислительных процессов, возникает анаэробный гликолиз, который способствует сохранению жизнедеятельности органов и тканей в условиях дефицита кислорода.
Обмен веществ.
В ранние сроки беременности важнейшими органами обмена веществ плода являются трофобласт и плацента. На более поздних этапах внутриутробного развития в этих процессах все заметнее становится роль печени.
Углеводы. Основным источником энергии в период онтогенетического развития является глюкоза. В физиологических условиях содержание углеводов в крови плода составляет приблизительно 60-75 % от соответствующих концентраций в крови матери. К сроку беременности 8 нед плацента сама начинает синтезировать гликоген, а с 12-15 нед в этом процессе начинает участвовать печень плода.
Глюкозе принадлежит важнейшая роль как в тканевом дыхании (цикл трикарбоновых кислот, или цикл Кребса), так и в процессах осуществления физиологического метаболического ацидоза – важнейшей формы обмена плода. Именно процессы анаэробного гликолиза лежат в основе физиологической защиты плода от кислородного голодания и предохраняют все его жизненно важные органы и ткани от гипоксического состояния.
Белки. Большим своеобразием отличается белковый обмен плода. Обмен белка у плода совершается значительно быстрее, чем у взрослого человека. Большинство аминокислот переходят от матери к плоду благодаря механизму активного транспорта, вследствие чего их концентрация в фетальной крови всегда выше, чем в крови матери. Некоторые аминокислоты (глутаминовая кислота, аланин) синтезируются в плаценте и не адсорбируются из крови матери. Концентрация аминокислот в плаценте в 5 раз выше, чем в материнской крови. Таким образом, особенности белкового обмена плода характерны для анаболического метаболизма и обусловливают высокие показатели роста плода в период его антенатального развития.
Липиды. У плода обмен липидов тесно связан с соответствующим обменом матери. Свободные жирные кислоты активно проникают через плацентарный барьер, их содержание в крови плода находится приблизительно на таком же уровне, что и у матери. Начиная с Ш триместра беременности некоторые жирные кислоты синтезируются в организме самого плода. В настоящее время пересматривается точка зрения, согласно которой основным источником энергии в период онтогенеза являются углеводы. Установлено, что в этом процессе участвуют и липиды плода. Кроме того, роль липидов заключается в том, что они необходимы для развития головного мозга и легких.
Витамины, микроэлементы и вода. Витамины активно переходят через плаценту и накапливаются в организме плода. В первую очередь это относится к водорастворимым витаминам. Плацента ограниченно проницаема для витаминов А и D. Активно переходят через плаценту железо, кальций, калий, натрий, магний, а также различные микроэлементы (медь, кобальт, цинк и др.). Вода переходит через плаценту путем диффузии.
Таким образом, рост и развитие плода практически целиком зависят от питательных веществ, поступающих к нему из организма матери. Поэтому рациональное, сбалансированное питание матери имеет очень большое значение не только для ее организма, но и для растущего плода.
Выделительная система.
Ультразвуковая визуализация почек плода возможна уже в 10-12 нед беременности, когда их средний диаметр составляет 0,4 см (в этот период длина плода составляет 5,35 см). К концу I триместра беременности нефроны обладают некоторой способностью экскреции мочи путем гломерулярной фильтрации, хотя сами почки плода остаются функционально незрелыми на протяжении всего периода внутриутробной жизни.
При ультразвуковом исследовании мочу плода почти всегда удается обнаружить в мочевом пузыре. Средняя скорость продукции мочи у 30-недельного плода составляет 10 мл/ч и достигает в конце антенатального периода 27 мл/ч. Назначение диуретиков матери повышает диурез плода, в связи с чем эту методику используют для диагностики некоторых форм патологии мочевыделительной системы плода.
Моча плода выделяется в амниотическую жидкость, откуда транси параплацентарным путем выделяется в материнский кровоток. Из крови матери продукты метаболизма плода выделяются с ее мочой.
Иммунная система.
На протяжении всего внутриутробного развития собственный активный иммунитет плода находится на низком уровне. Приблизительно на сроке гестации 10- 12 нед у плода появляются первые признаки синтеза иммуноглобулина М (IgM), продукция которого постепенно возрастает с увеличением срока беременности. Примерно в эти же сроки отмечаются начальные признаки синтеза иммуноглобулинов классов G и Е.
Клеточное звено иммунитета плода отличается низкой активностью.
Первые лимфоциты появляются в вилочковой железе плода на 8-9-й неделе антенатального развития. В-лимфоциты обнаруживают в печени плода на 9-й неделе развития, а в костном мозге и периферической крови – на 10-й неделе. Фагоцитарная активность лейкоцитов на протяжении всего периода внутриутробного развития остается низкой.
Иммунологические особенности организма плода определяют и его реакцию на инфекцию. Она заключается в том, что в ответ на проникновение возбудителей инфекции у плода не возникает характерных ответных воспалительных реакций, а сама инфекция нередко принимает не местный, а генерализованный характер, при этом в пораженных тканях преобладают не типичные воспалительные, а дистрофические процессы. Это является следствием выраженного дефицита как гуморального, так и клеточного звеньев иммунитета.
Система гемостаза.
Во время физиологической беременности системы гемостаза матери и плода функционируют относительно автономно, при этом плацента оказывает лишь опосредованное влияние на обе системы гемостаза. Если система гемостаза матери характеризуется явлениями физиологической гиперкоагуляции, то аналогичная система у плода имеет все признаки гипокоагуляции. В период внутриутробного развития в прокоагулянтном звене системы гемостаза плода происходят выраженные изменения. Первые белки-прокоагулянты появляются у плода на 12-й неделе онтогенеза, а фибриноген удается обнаружить еще раньше (на 5-й неделе). Способность крови эмбриона к свертыванию появляется на 12-й неделе развития. В период 12-24 нед активность факторов II, VII и X составляет всего 20 – 23 %, а фактора IX- 14-40 % от аналогичных показателей взрослых. На сравнительно низком уровне находятся также и показатели агрегации тромбоцитов.
Система гемостаза новорожденного характеризуется также признаками гипокоагуляции. Это касается как плазменного, так и клеточного звена данной системы. Только в постнатальном периоде наблюдается постепенное увеличение показателей свертывающей системы крови и ее приближение к параметрам взрослого.
Кислотно-основное состояние крови.
Кислотно-основное состояние (КОС) крови плода характеризуется всеми признаками физиологического метаболического ацидоза. Ацидоз обусловлен накоплением в организме плода недоокисленных продуктов обмена веществ, прежде всего углеводов. Ацидоз отражает также особенности газообмена в антенатальном периоде развития.
Ацидоз плода имеет метаболический характер. О метаболическом характере ацидоза свидетельствует отсутствие повышения показателей парциального давления С02 (Рсо ) при значительном накоплении кислых продуктов обмена веществ (BE). Это подтверждается также изменениями показателей буферной системы крови, что находит свое выражение в снижении щелочных резервов крови (ВВ, SB, общее содержание СО2).
Состояние физиологического метаболического ацидоза отражает в основном преобладание в организме плода процессов анаэробного гликолиза, при котором энергии выделяется меньше, чем при аэробном, однако этого вполне достаточно для внутриутробной жизни.
По мере приближения срока родов у плода нарастает физиологический метаболический ацидоз, в связи с чем повышается возбудимость мезэнцефактического ядра тройничного нерва, ретикулярной формации и некоторых других центров гомеостаза. Это в свою очередь приводит к резкому повышению возбудимости всех центральных структур регуляции дыхательной системы плода, включая и бульбарный дыхательный центр. Так создаются важнейшие предпосылки к первым внеутробным дыхательным движениям.
Таким образом, состояние физиологического метаболического ацидоза плода не свидетельствует о его патологии. Оно является выражением весьма своеобразного физиологического состояния плода и его адаптации к внутриутробному существованию.
Плод в отдельные периоды внутриутробного развития
Средняя продолжительность беременности составляет 280 дней (40 нед, или 10 акушерских месяцев). За этот период совершается сложнейший процесс превращения оплодотворенной яйцеклетки в сформированный зрелый плод, способный перейти от внутриутробной жизни к внеутробной.В течение I месяца внутриутробного развития совершаются процессы дробления оплодотворенной яйцеклетки, возникают морула, бластула и бластоциста. На стадии бластоцисты происходит имплантация зародыша в депидуальную оболочку матки, после чего начинаются закладка и дифференцировка важнейших органов и систем эмбриона, а также образование зародышевых оболочек.
С помощью метода транс вагинальной эхографии плодное яйцо всегда может быть визуализировано со срока беременности 2-3 нед В этот срок диаметр плодного яйца достигает 2-4 мм. Самая ранняя структура, которая идентифицируется в плодном яйце, – это желточный мешок. Он определяется в ультразвуковом изображении в виде кольцевого образования диаметром 4 мм. Приблизительно с этого же срока возможно определение сердечных сокращений эмбриона. На 7-й неделе внутриутробного развития длина эмбриона достигает 5-9 мм, к концу 7-й недели возможна визуализация нервной трубки.
К концу 8-й недели онтогенеза диаметр плодного яйца достигает 22 мм, объем целомической (внезародышевой) полости все еще превышает размеры амниотической, размеры желточного мешка прогрессивно увеличиваются. Определяются конечности и сердечные сокращения (112-136 ударов в минуту). Четкая идентификация эмбриона (головка, туловище, конечности и пр.) возможна со срока беременности 8-9 нед.
Десятая неделя беременности является своего рода поворотным пунктом развития, с 11-й недели эмбрион называется плодом. С этого периода становится возможной ультразвуковая биометрия плода, т.е. измерение бипариетального размера головки, ее окружности, а также окружности живота. На всем протяжении можно четко проследить конечности, отметить их активные движения. Приблизительно в этот же период при ультразвуковом исследовании становятся заметны некоторые мозговые структуры, сосудистые сплетения желудочков мозга, частично заметны лицевые кости и глазницы.
В конце 111 месяца развития (12 нед) длина плода составляет 6-7 см, масса тела 20-25 г. При ультразвуковом исследовании видно, что плодное яйцо почти полностью выполняет полость матки, заметен спавшийся желточный мешок, который исчезает в 13 нед. ко!да происходит полная облитерация иеломической полости Четко определяются конечности, пальцы рук и ног, в большинстве костей появляются первые ядра окостенения, возможна визуализация четырехкамерного сердца.
К концу 16-й недели гестации длина плода достигает 12 см, а масса тела – 100 г. Этот срок является важным в соноэмбриологии в связи с тем, что к этому периоду почти все органы могут более или менее четко дифференцироваться при ультразвуковом исследовании. Срок беременности 16 нед является оптимальным временем ультразвукового скрининга беременных для исключения возможной патологии плода.
К концу V месяца (20 нед)развития длина плода составляет уже 25-26 см, масса 280-300 г. Кожные покровы имеют выраженный красный цвет и обильно покрыты пушковыми волосами и так называемой сыровидной смазкой, являющейся продуктом деятельности сальных желез. В кишечнике начинает образовываться первородный кал (меконий).
На 20-й неделе беременности первородящие впервые начинают ощущать движения плода (повторнородящие ощущают движения плода обычно на 2 нед раньше). С помощью акушерского стетоскопа в эти же сроки беременности удается впервые выслушать слабые сердцебиения плода.
В конце VI месяца развития длина плода составляет около 30 см, масса 600-680 г. Такой плод может родиться живым, совершать внеутробные дыхательные движения и даже выжить при условии содержания его в специальных кювезах, при наличии искусственной вентиляции легких и использовании соответствующих средств интенсивной терапии и реанимации. Согласно приказу Министерства здравоохранения РФ "О перехоле на рекомендованные Всемирной организацией здравоохранения критерии живорождения и мертворождения" (1992) все новорожденные, родившиеся с массой тела от 500 до 999 г, если они прожили более 168 ч (7 сут) после рождения, так же как и дети с большей массой тела, подлежат регистрации в органах ЗАГС.
В конце VII месяца (28 нед) длина плода составляет 35 см, масса тела 1000-1200 г. У такого плода при рождении отмечаются выраженные признаки недоношенности: слабое развитие подкожной жировой клетчатки, морщинистая кожа, обильная сыровидная смазка, выраженное развитие пушковых волос, покрывающих все тело. Хрящи носа и ушей мягкие, ногти не доходят до конца пальцев рук и ног У мальчиков яички еще не опущены в мошонку, у девочек малые половые губы не прикрыты большими.
С 28-й недели внутриутробного развития, когда масса тела плода составляет 1000 г и более, начинается перинатальный период Он охватывает все последующие недели беременности, роды и последующие 7 дней (168 ч) жизни новорожденного (см. Перинатология).
В конце VIII месяца внутриутробной жизни длина плода достигает 40-42 см, масса тела 1500-1700 г. К концу IX месяца эти показатели соответственно составляют 45-48 см и 2400-2500 г. В конце X месяца у плода исчезают все признаки недоношенности и имеются все показатели, присущие зрелому плоду. Однако в ряде случаев доношенный плод может иметь ряд симптомов незрелости и наоборот. Таким образом, понятия "доношенность" и "зрелость" не являются идентичными.
Зрелость новорожденного характеризуется следующими признаками: 1. масса тела составляет 2600-5000 г, длина (рост) 48-54 см; 2. грудь выпуклая, пупочное кольцо находится на середине между лобком и мечевидным отростком; 3. кожа бледно-розового цвета, подкожная основа развита достаточно, на коже имеются только остатки сыровидной смазки, пушковые волосы почти отсутствуют, длина волос на головке достигает 2 см, ногти на ногах и руках доходят до кончиков пальцев; 4. хрящи ушных раковин и носа упругие; 5. у мальчиков яички опущены в мошонку, у девочек малые половые губы прикрыты большими; 6. новорожденный производит активные движения, громко кричит, глаза открыты, при прикладывании к груди активно сосет.
При характеристике плода как объекта родов наряду с указанными выше признаками, характерными для различных этапов внутриутробного развития, необходимо также знание анатомии и размеров головки доношенного плода.
Плод как объект родов
Череп плода состоит из двух лобных, двух теменных, двух височных, одной затылочной, клиновидной и решетчатой костей (рис. 3.15).Наибольшее значение в акушерской практике имеют следующие швы: 1. сагиттальный (стреловидный) шов соединяет правую и левую теменные кости; спереди шов переходит в передний (большой) родничок, сзади – в малый (задний); 2. лобный шов находится между лобными костями (у новорожденного лобные кости еще не срослись между собой). А венечный шов соединяет лобные кости с теменными и располагается перпендикулярно к стреловидному и лобному швам. Венечный шов соединяет лобные кости с теменными и проходит перпендикулярно к стреловидному и лобному швам; 3. ламбдовидный (затылочный) шов соединяет затылочную кость с теменными.
В местах соединения швов располагаются роднички. Практическое значение имеют передний и задний роднички.
Передний (большой) родничок располагается на месте соединения сагиттального, лобного и венечного швов. Он имеет ромбовидную форму и от него отходят четыре шва: кпереди – лобный, кзади – сагиттальный, вправо и влево – венечные швы.
Задний (малый) родничок представляет собой небольшое углубление, в котором сходятся сагиттальный и ламбдовидный швы. Он имеет треугольную форму. От заднего родничка отходят три шва: кпереди – сагиттальный, вправо и влево – соответствующие отделы ламбдовидного шва.?
Для практического акушерства также важно знать бугры, которые рас-полагаются на головке: затылочный, два теменных и два лобных.
Знание топографоанатомических особенностей костной головки плода очень важно для практического акушерства, так как на эти опознавательные пункты врач ориентируется при производстве влагалищного исследования в родах.
Не меньшее значение, чем швы и роднички, имеют размеры головки зрелого и доношенного плода – каждому моменту механизма родов соответствует определенный размер головки плода, при котором она проходит родовые пути.
Малый косой размер идет от подзатылбчной ямки (эта ямка располагается под затылочным бугром) до переднего угла большого родничка и равен 9,5 см. Окружность головки, соответствующая этому размеру, наименьшая из всех окружностей головки – 32 см.
Средний косой размер – от подзатылочной ямки до передней границы волосистой части головы – равен 10,5 см, окружность головки по этому размеру 33 см.
Прямой размер – от переносья (glabella) до затылочного бугра – равен 12 см, окружность головки по прямому размеру 34 см.
Большой косой размер – от подбородка до наиболее выступающей части головки на затылке – равен 13-13,5 см, окружность головки по большому косому размеру 38-42 см.
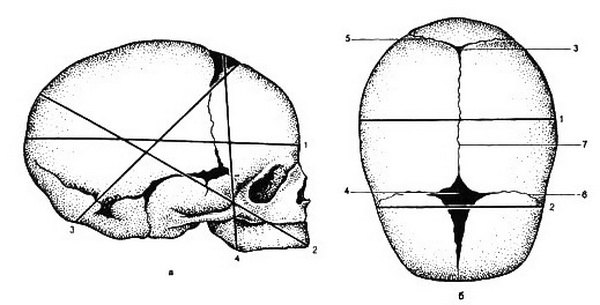 Рис. 3.15. Череп новорожденного.
а – вид сбоку: 1 – прямой размер, 2 – большой косой размер, 3 – малый косой размер, 4 – вертикальный размер; б – вид сверху: 1 – большой поперечный размер, 2 – малый поперечный размер, 3 – задний (малый) родничок, 4 – передний (большой) родничок, 5 – ламбдовидный шов, 6 – венечный шов, 7 – сагиттальный шов.
Рис. 3.15. Череп новорожденного.
а – вид сбоку: 1 – прямой размер, 2 – большой косой размер, 3 – малый косой размер, 4 – вертикальный размер; б – вид сверху: 1 – большой поперечный размер, 2 – малый поперечный размер, 3 – задний (малый) родничок, 4 – передний (большой) родничок, 5 – ламбдовидный шов, 6 – венечный шов, 7 – сагиттальный шов.
Вертикальный размер – от верхушки темени (макушки) до подъязычной кости – равен 9,5 см. Окружность, соответствующая этому размеру, 32 см.?
Большой поперечный размер – наибольшее расстояние между теменными буграми – равен 9,25 см.
Малый поперечный размер – расстояние между наиболее отдаленными точками венечного шва – равен 8 см.
Обычно после рождения ребенка наряду с размерами головки измеряют также размеры плечевого пояса. В среднем размер плечиков (поперечник плечевого пояса) равен 12 см, а их окружность составляет 35 см.
Сегменты головки.
В акушерстве принято различать сегменты головки – большой и малый.
Большим сегментом головки называется та ее наибольшая окружность, которой она в процессе родов проходит через различные плоскости малого таза. Само понятие "большой сегмент" является условным и относительным. Условность его обусловлена тем, что наибольшая окружность головки, строго говоря, является не сегментом, а окружностью плоскости, условно рассекающей головку на два сегмента (большой и малый). Относительность понятия состоит в том, что в зависимости от предлежания плода наибольшая окружность головки, проходящая через плоскости малого таза, различна. Так, при согнутом положении головки (затылочное предлежание) большим ее сегментом является окружность, проходящая в плоскости малого косого размера. При умеренном разгибании (переднеголовное предлежание) окружность головки проходит в плоскости прямого размера, при максимальном разгибании (лицевое предлежание) – в плоскости вертикального размера.
Любой сегмент головки, меньший по своему объему, чем большой, является малым сегментом головки.
Изменения в организме женщины при беременности
Возникновение и развитие беременности связано со становлением новой функциональной системы мать-плод. Создание концепции функциональной системы мать-плод дало возможность с новых позиций оценить все многообразие изменений, которые совершаются в организме матери и плода при физиологически протекающей беременности.В результате многочисленных экспериментальных и клинических исследований установлено, что изменения состояния матери во время беременности активно влияют на развитие плода. В свою очередь состояние плода небезразлично для материнского организма. В разные периоды внутриутробного развития от плода исходят многочисленные сигналы, которые воспринимаются соответствующими органами и системами организма матери и под влиянием которых изменяется их деятельность. Следовательно, под названием "функциональная система мать-плод" понимают совокупность двух самостоятельных организмов, объединенных общей целью обеспечения правильного, физиологического развития плода. Поэтому вся деятельность материнского организма во время беременности должна быть направлена на максимальное обеспечение нормального роста плода и поддержание необходимых условий, обеспечивающих его развитие по генетически закодированному плану.
Основным звеном, связывающим организмы матери и плода, является плацента. Однако этот орган, имеющий как материнское, так и плодовое происхождение, нельзя рассматривать как самостоятельную функциональную систему. На определенной стадии развития мать и плод могут существовать независимо от плаценты, однако сама плацента не может существовать вне системы мать-плод. Тем не менее в литературе до настоящего времени существует понятие "фетоплацентарная система".
Для более наглядного и детального представления о том, как во время физиологически протекающей беременности функционирует система матьплод или мать-плацента-плод, следует прежде всего отдельно рассмотреть важнейшие процессы, которые совершаются в организме матери, плаценте и организме плода, а затем проследить, каким образом происходит их взаимодействие.
Во время физиологически протекающей беременности в связи с развитием плода и плаценты в материнском организме наблюдаются значительные изменения функции всех важнейших органов и систем. Эти изменения носят выраженный адаптационно-приспособительный характер и направлены на создание оптимальных условий для роста и развития плода.
Эндокринная система.
Возникновение и развитие беременности сопровождаются эндокринными изменениями материнского организма. Сложность изменений определяется тем, что на деятельность желез внутренней секреции матери очень большое влияние оказывают гормоны плаценты, а также плода.
Передняя доля гипофиза увеличивается при беременности в 2-3 раза, при этом масса аденогипофиза к концу беременности достигает 100 мг. При гистологическом исследовании в передней доле гипофиза выявляются крупные ацидофильные клетки, получившие название "клетки беременности". Характер базофильных клеток существенно не изменяется. Полагают, что появление "клеток беременности" обусловлено стимулирующим влиянием половых стероидных гормонов плаценты.
Морфологические изменения передней доли гипофиза отражаются на функции этого органа. Прежде всего это выражается в резком угнетении продукции фолликулостимулирующего (ФСГ) и лютеинизирующего (ЛГ) гормонов. Продукция пролактина (Прл) во время беременности, наоборот, возрастает и увеличивается к ее окончанию в 5-10 раз по сравнению с показателями, характерными для небеременных женщин. В послеродовом периоде содержание в сыворотке крови ФСГ и ЛГ повышается параллельно снижению продукции Прл.
Во время физиологически протекающей беременности содержание в крови соматотропного гормона (СТГ) практически не изменено, лишь в конце беременности отмечается небольшое его повышение.
Наблюдаются значительные изменения продукции тиреотропного гормона (ТТГ). Уже вскоре после наступления беременности в крови матери отмечается повышение его содержания. В дальнейшем по мере прогрессирования беременности оно значительно увеличивается и достигает своего максимума перед родами.
Во время беременности наблюдается повышенная секреция адренокортикотропного гормона (АКТГ), что, по-видимому, связано с гиперпродукЦией кортикостероидов надпочечниками.
Задняя доля гипофиза, в отличие от передней доли, во время беременности не увеличивается. Образующийся в гипоталамусе окситоцин накапливается в задней доле гипофиза. Синтез окситоцина особенно возрастает в конце беременности и в родах. Полагают, что его выброс в конце доношенной беременности является пусковым механизмом начала родовой деятельности.
Возникновение и развитие беременности связаны с функцией новой железы внутренней секреции – желтого тела беременности . В желтом теле продуцируются половые гормоны (прогестерон и эстрогены), которым принадлежит огромная роль в имплантации и дальнейшем развитии беременности. С 3-4-го месяца беременности желтое тело подвергается инволюции и его функцию целиком берет на себя плацента. Стимуляция желтого тела осуществляется хорионическим гонадотропином.
Блокада секреции ФСГ и ЛГ аденогипофиза сопровождается естественным торможением созревания фолликулов в яичниках; процесс овуляции также прекращается.
У большинства женщин во время беременности наблюдается увеличение размеров щитовидной железы. Это обусловлено ее гиперплазией и активной гиперемией. Количество фолликулов увеличивается, содержание коллоида в них возрастает. Эти морфологические изменения отражаются на функции щитовидной железы: повышаются концентрации в крови связанных с белками тироксина (Т4) и трийодтиронина (Т3). Повышение тироксинсвязывающей способности сывороточных глобулинов, по-видимому, обусловлено влиянием гормонов фетоплацентарной системы.
Функция околощитовидных желез нередко несколько снижена, что сопровождается нарушениями обмена кальция. Это в свою очередь может сопровождаться возникновением у некоторых беременных судорожных явлений в икроножных и других мышцах.
Значительные изменения во время беременности претерпевают надпочечники. Наблюдаются гиперплазия коры надпочечников и усиление в них кровотока. Это находит свое выражение в усиленной продукции глюкокортикоидов и минералокортикоидов. Характерно, что во время беременности возрастает не только продукция глюкокортикоидов, но и усиливается синтез специфического глобулина – гранскортина. Транскортин, связывая свободный гормон, существенно удлиняет его период полувыведения. Повышенное содержание в сыворотке крови беременной кортикостероидов, по-видимому, связано не только с активацией функции коры надпочечников, но и с переходом кортикостероидов плода в материнский кровоток. Морфологических изменений в мозговом веществе надпочечников во время беременности не обнаружено.
Нервная система.
Эта система матери играет ведущую роль в восприятии многочисленных импульсов, поступающих от плода. При беременности рецепторы матки первыми начинают реагировать на импульсы, поступающие от растущего плодного яйца. Матка содержит большое количество разнообразных нервных рецепторов: сенсорных, хемо-, баро-, механо-, осморецепторов и др. Воздействие на эти рецепторы приводит к изменению деятельности центральной и автономной (вегетативной) нервной системы матери, направленных на обеспечение правильного развития будущего ребенка.
Значительные изменения во время беременности претерпевает функция центральной нервной системы (ЦНС). С момента возникновения беременности в ЦНС матери начинает поступать возрастающий поток импульсации, что вызывает появление в коре большого мозга местного очага повышенной возбудимости – гестационной доминанты. Вокруг гестационной доминанты по физиологическим законам индукции создается поле торможения нервных процессов. Клинически этот процесс проявляется в некотором заторможенном состоянии беременной, преобладании у нее интересов, непосредственно связанных с рождением и здоровьем будущего ребенка. В то же время другие интересы как бы отходят на второй план. При возникновении различных стрессовых ситуаций (испуг, страх, сильные эмоциональные переживания и др,) в ЦНС беременной могут наряду с гестационной доминантой возникать и другие очаги стойких возбуждений. Это в значительной степени ослабляет действие гестационной доминанты и нередко сопровождается патологическим течением беременности. Именно исходя из этого всем беременным необходимо по возможности создать условия психического покоя как на работе, так и в домашних условиях.
На протяжении беременности состояние ЦНС изменяется. До 3-4-го месяца беременности возбудимость коры большого мозга в целом снижена, а затем постепенно повышается. Возбудимость нижележащих отделов ЦНС и рефлекторного аппарата матки понижена, что обеспечивает расслабление матки и нормальное течение беременности. Перед родами возбудимость спинного мозга и нервных элементов матки повышается, что создает благоприятные условия для начала родовой деятельности.
Во время физиологически протекающей беременности изменяется тонус вегетативной нервной системы, в связи с чем у беременных нередко наблюдаются сонливость, плаксивость, повышенная раздражительность, иногда головокружения и другие вегетативные расстройства. Эти нарушения обычно характерны для раннего периода беременности, а затем постепенно исчезают.
Сердечно-сосудистая система.
Во время беременности происходят значительные изменения в деятельности сердечно-сосудистой системы матери. Эти изменения позволяют обеспечить необходимую для плода интенсивность доставки кислорода и разнообразных питательных веществ и удаления продуктов метаболизма.
Сердечно-сосудистая система функционирует при беременности с повышенной нагрузкой. Это повышение нагрузки обусловлено усилением обмена веществ, увеличением массы циркулирующей крови, развитием маточно-плацентарного круга кровообращения, прогрессирующим нарастанием массы тела беременной и рядом других факторов. По мере увеличения размеров матки ограничивается подвижность диафрагмы, повышается внутрибрюшное давление, изменяется положение сердца в грудной клетке (оно располагается более горизонтально), на верхушке сердца у некоторых женщин возникает нерезко выраженный функциональный систолический шум.
Среди многочисленных изменений сердечно-сосудистой системы, присущих физиологически протекающей беременности, в первую очередь следует отметить увеличение объема циркулирующей крови (ОЦК). Увеличение этого показателя отмечается уже в I триместре беременности и в дальнейшем он все время возрастает, достигая максимума к 36-й неделе. Увеличение ОЦК составляет 30-50 % от исходного уровня (до беременности).
Гиперволемия происходит в основном за счет увеличения объема плазмы крови (на 35-47 %), хотя и объем циркулирующих эритроцитов также возрастает (на 11-30 %). Поскольку процентное увеличение объема плазмы превышает увеличение объема эритроцитов, возникает так называемая физиологическая анемия беременных. Она характеризуется снижением гематокритного числа (до 3 0%) и концентрации гемоглобина со )35-140 до 110-120 г/л. Так как при беременности наблюдается снижение гематокритного числа, то происходит и снижение вязкости крови. Все эти изменения, имеющие выраженный адаптационный характер, обеспечивают поддержание в течение беременности и родов оптимальных условий микроциркуляции (транспорта кислорода) в плаценте и в таких жизненно важных органах матери, как ЦНС, сердце и почки.
При нормально протекающей беременности систолическое и диастолическое артериальное давление снижается во II триместре на 5-15 мм рт.ст. Периферическое сосудистое сопротивление также обычно бывает снижено. Это связано в основном с образованием маточного круга кровообращения, имеющего низкое сосудистое сопротивление, а также с воздействием на сосудистую стенку эстрогенов и прогестерона плаценты. Снижение периферического сосудистого сопротивления вместе со снижением вязкости крови значительно облегчает процессы гемоциркуляции.
Венозное давление, измеренное на руках у здоровых беременных, существенно не изменяется.
Во время беременности наблюдается физиологическая тахикардия. Частота сердечных сокращений достигает максимума в III триместре беременности, когда этот показатель на 15-20 в минуту превышает исходные данные (до беременности). Таким образом, в норме частота сердечных сокращений у женщин в поздние сроки беременности составляет 80-95 в минуту.
Наиболее значительным гемодинамическим сдвигом при беременности является увеличение сердечного выброса. Максимальное увеличение этого показателя в состоянии покоя составляет 30-40 % его величины до беременности. Сердечный выброс начинает возрастать с самых ранних сроков беременности, при этом максимальное его изменение отмечается на 20-24-й неделе. В первой половине беременности увеличение сердечного выброса в основном обусловлено нарастанием ударного объема сердца, позже – некоторым повышением частоты сердечных сокращений. Минутный объем сердца возрастает частично вследствие воздействия на миокард плацентарных гормонов (эстрогенов и прогестерона), частично в результате образования маточно-плацентарного круга кровообращения.
Электрокардиография, проведенная в динамике беременности, позволяет обнаружить стойкое отклонение электрической оси сердца влево, что отражает смещение сердца в эту сторону. По данным эхокардиографии. отмечается увеличение массы миокарда и размеров отдельных отделов сердца. При рентгенологическом исследовании находят изменения контуров сердца, напоминающие митральную конфигурацию.
На процессы гемодинамики во время беременности большое влияние, как уже было отмечено, оказывает новый маточно-плацентарный круг кровообращения. Хотя кровь матери и плода между собой не смешивается, изменения гемодинамики в матке тотчас отражаются на кровообращении в плаценте и в организме плода и наоборот. В отличие от почек, ЦНС, миокарла и скелетной мускулатуры, матка и плацента не способны поддер-живать свой кровоток на постоянном уровне при изменениях системного артериального давления. Сосуды матки и плаценты обладают низким сопротивлением и кровоток в них регулируется пассивно в основном за счет колебаний системного артериального давления. В поздние сроки беременности сосуды матки максимально расширены. Механизм нейрогенной регуляции маточного кровотока в основном связан с адренерги чески ми вли-яниями. Стимуляция альфа-адренергических рецепторов вызывает сужение сосудов и снижение маточного кровотока. Сокращение объема полости матки (дородовое излитие околоплодных вод, появление схваток) сопровождается снижением маточного кровотока.
Несмотря на существование раздельных кругов кровообращения в матке и плаценте (на пути двух кровотоков находится плацентарная мембрана), гемодинамика матки теснейшим образом связана с системой кровообращения плода и плаценты. Участие капиллярного русла плаценты в кровообращении плода заключается в ритмичном активном пульсировании капилляров хориона, находящихся в постоянном перистальтическом движении. Эти сосуды с меняющимся объемом крови вызывают попеременное удлинение и сокращение ворсин и их ветвей. Такое движение ворсин оказывает существенное влияние не только на кровообращение плода, но и на циркуляцию материнской крови через межворсинчатое пространство. Поэтому капилляр-ное русло плаценты совершенно справедливо можно рассматривать как "периферическое сердце" плода. Все эти особенности гемодинамики матки и плаценты принято объединять под названием "маточно-плацентарное кровообращение".
Дыхательная система.
Существенные изменения, имеющие выраженный адаптационный характер, происходят во время беременности и с органами дыхания. Наряду с системой кровообращения органы дыхания обеспечивают непрерывное снабжение плода кислородом, которое во время беременности возрастает более чем на 30-40 %.
При увеличении размеров матки органы брюшной полости постепенно смешаются, вертикальный размер грудной клетки уменьшается, что, однако, компенсируется увеличением ее окружности и усилением экскурсии диафрагмы. Однако ограничение экскурсии диафрагмы во время беременности несколько затрудняет вентиляцию легких. Это выражается в некотором учащении дыхания (на 10 %) и в постепенном увеличении к концу беременности дыхательного объема легких (на 30-40 %) . В результате этого минутный объем дыхания возрастает с 8 л/мин в начале беременности до 11 л/мин в конце се.
Увеличение дыхательного объема легких происходит за счет снижения резервного объема, при этом жизненная емкость легких остается неизменной и даже несколько возрастает. Во время беременности увеличивается работа дыхательных мыши, хотя сопротивление дыхательных путей к концу беременности становится меньше. Все эти изменения функции дыхания обеспечивают создание оптимальных условий газообмена между организмами матери и плода.
Пищеварительная система.
У многих женщин в ранние сроки беременности наблюдаются тошнота, рвота по утрам, изменяются вкусовые ощущения, появляется непереносимость отдельных пищевых продуктов. По мере увеличения срока беременности эти явления постепенно исчезают.
Беременность оказывает тормозящее воздействие на секрецию желудочного сока и его кислотность. Все отделы желудочно-кишечного тракта находятся в состоянии гипотонии, обусловленной изменениями топографоанатомических отношений в брюшной полости вследствие увеличения беременной матки, а также нейрогормональных изменений, присущих беременности. Здесь особенно важное значение принадлежит воздействию про-гестерона плаценты на гладкую мускулатуру желудка и кишечника. Этим объясняются частые жалобы беременных на запоры.
Значительным изменениям подвергается функция печени. Отмечается значительное снижение запасов гликогена в этом органе, что зависит от интенсивного перехода глюкозы от организма матери к плоду. Усиление процессов гликолиза не сопровождается гипергликемией, поэтому у здоровых беременных характер гликемических кривых существенно не изменяется. Изменяется интенсивность липидного обмена. Это выражается развитием липемии, более высоким содержанием в крови холестерина. Значительно возрастает и содержание в крови эфиров холестерина, что указывает на повышение синтетической функции печени.
При физиологическом течении беременности изменяется и белковообразовательная функция печени, что направлено прежде всего на обеспечение растущего плода необходимым количеством аминокислот, из которых он синтезирует собственные белки. В начале беременности содержание общего белка в крови беременных находится в пределах нормальных величин, характерных для небеременных женщин. Однако начиная со второй половины беременности концентрация общего белка в плазме крови начинает несколько снижаться. Выраженные сдвиги наблюдаются и в белковых фракциях крови (снижение концентрации альбуминов и повышение уровня глобулинов). Это, по-видимому, обусловлено повышенным выходом мелкодисперсных альбуминов через стенки капилляров в ткани матери, а также с их усиленным расходованием растущим организмом плода.
Важным показателем функции печени у беременных является ферментный спектр сыворотки крови. Установлено, что в процессе физиологически протекающей беременности происходит увеличение активности аспартатаминотрансферазы (ACT), щелочной фосфатазы (ЩФ), особенно ее термостабильной фракции. Несколько меньшие изменения претерпевают другие ферменты печени.
Во время беременности в печени усиливаются процессы инактивации эстрогенов и других стероидных гормонов, продуцируемых плацентой. Дезинтоксикационная функция печени во время беременности несколько снижена. Пигментный обмен при беременности существенно не изменяется. Лишь в конце беременности содержание билирубина в сыворотке крови несколько повышается, что указывает на повышение процесса гемолиза в организме беременных.
Мочевыделительная система.
Во время беременности почки матери функционируют с повышенной нагрузкой, выводя из ее организма не только продукты его обмена, но и продукты метаболизма плода.
Существенные изменения претерпевают процессы кровоснабжения почек. Особенностью почечного кровотока является его увеличение в I триместре беременности и постепенное уменьшение в дальнейшем. Такое снижение почечного кровотока может рассматриваться как своеобразная приспособительная реакция, которая дает возможность другим органам в конце беременности получать дополнительное количество крови. Снижение почечного кровотока может лежать в основе активации юкстагломерулярного аппарата почек с гиперсекрецией ренина и ангиотензина. Параллельно изменениям кровоснабжения почек меняется и клубочковая фильтрация, которая значительно возрастает в I триместре беременности (на 30-50 %), а затем постепенно снижается. Фильтрационная способность почек во время беременности возрастает, в то время как канальцевая реабсорбция на всем протяжении беременности остается без существенных изменений.
Такое уменьшение клубочковой фильтрации при почти неизменной канальцевой реабсорбции воды и электролитов способствует задержке жидкости в организме беременной, что проявляется пастозностью тканей на нижних конечностях в конце беременности.
Изменения функции почек оказывают выраженное влияние на весь водно-солевой обмен при беременности. Происходит увеличение общего содержания жидкости в организме, главным образом за счет ее внеклеточной части. В целом к концу беременности количество жидкости в организме беременной может увеличиться на 7 л.
При физиологически протекающей беременности концентрация натрия и калия в крови и выделение этих электролитов с мочой находятся в пределах нормы. В конце беременности происходит задержка натрия во внеклеточной жидкости, что повышает ее осмолярность. Однако поскольку содержание натрия в плазме крови беременных равно таковому у небеременных, осмотическое давление остается без существенных колебаний. Калий в противоположность натрию в основном находится внутри клеток. Увеличенное содержание калия способствует пролиферации тканей, что особенно важно для таких органов, как матка.
У некоторых женщин во время неосложненной беременности наблюдается ортостатическая протеинурия. Это может быть обусловлено сдавлением печенью нижней полой вены и маткой вен почек. Иногда во время беременности возникает глюкозурия. Глюкозурия беременных не является признаком сахарного диабета, поскольку у таких женшин нарушения углеводного обмена отсутствуют и содержание глюкозы в крови находится на нормальном уровне. Скорее всего, причиной глюкозурии беременных явля-ется увеличение клубочковой фильтрации глюкозы. Наряду с глюкозурией может наблюдаться и лактозурия, обусловленная повышением концентрации лактозы в крови матери. Необходимо отметить, что лактоза, в отличие от глюкозы, не поглощается канальцами почек.
Беременность оказывает выраженное влияние на топографию и функцию смежных с маткой органов. В первую очередь это касается мочевого пузыря и мочеточников. По мере увеличения размеров матки происходит сдавление мочевого пузыря. К концу беременности основание мочевого пузыря перемещается кверху за пределы малого таза. Стенки мочевого пузыря гипертрофируются и находятся в состоянии повышенной гиперемии. Мочеточники гипертрофируются и несколько удлиняются. Иногда наблю-дается развитие гидроуретера, который чаще возникает справа. Причиной более частого правостороннего гидроуретера является то обстоятельство, что беременная матка несколько поворачивается вправо, сдавливая при этом правый мочеточник и прижимая его к безымянной линии.
Дилатация мочевых путей начинается в I триместре и достигает максимума к 5-8-му месяцу беременности. В основе этих изменений лежат гормональные факторы (продукция прогестерона плацентой); в меньшей степени это связано с механическим сдавлением мочевыводящих путей беременной маткой. Необходимо отметить, что эти физиологические изменения мочевы водя щей системы являются фактором, способствующим развитию инфекции во время беременности (пиелонефрит).
Органы кроветворения.
В течение беременности изменяется не только количество, но также размер и форма эритроцитов. Объем эритроцитов особенно заметно возрастает во II и III триместрах беременности. Определенная роль в этом процессе принадлежит системной гипоосмолярности и увеличению в эритроцитах концентрации натрия. Возросший объем эритроцитов повышает их агрегацию и изменяет реологические свойства крови в целом. Начиная с ранних сроков беременности наблюдается повышение вязкости крови. Однако этот процесс нивелируется гиперплазией и соответствующими изменениями гемодинамики. Все эти разнонаправленные процессы приводят к тому, что в конце беременности реологические свойства крови улучшаются.
Таким образом, при физиологически протекающей беременнос1т2и средние показатели красной крови следующие: эритроциты 3,5-5,010 /л, гемоглобин 110-120 г/л, гематокритное число 0,30-0,35 л/л.
Концентрация сывороточного железа во время беременности снижается по сравнению с таковой у небеременных (в конце беременности до 10,6 мкмоль/л). Снижение концентрации железа в основном обусловлено физиологической гиповолемией, а также повышенными потребностями в этом элементе плаценты и плода.
При беременности наблюдается также активация белого ростка крови. В результате возрастает количес9тво лейкоцитов. К концу беременности лейкоцитоз повышается до 10 10 /л, а количество нейтрофилов достигает 70 %. Отмечается также повышение СОЭ (до 40-50 мм/ч).
Иммунная система.
Большого внимания заслуживает состояние во время беременности иммунной системы матери и плода. Эмбрион и плод человека получают от отца 50 % генетической информации, которая чужеродна для организма матери. Другая половина генетической информации плода является обшей для него и матери. Таким образом, плод всегда является генетически "полусовместимым трансплантатом" по отношению к организму матери.
В процессе развития беременности между организмами матери и плода возникают и формируются очень сложные иммунологические взаимоотношения, основанные на принципе прямой и обратной связи. Эти взаимоотношения обеспечивают правильное, гармоничное развитие плода и препятствуют отторжению плода как своеобразного аллотрансплантата.
Антигенная активность плода возникает и развивается постепенно. Самым ранним иммунным барьером является блестящая оболочка, которая образует защитный слой вокруг яйцеклетки и в дальнейшем сохраняется от момента оплодотворения почти до стадии имплантации. Установлено, что блестящая оболочка непроницаема для иммунных клеток, вследствие чего антитела матери, которые могли бы образоваться в оплодотворенной яйцеклетке и эмбрионе на ранних стадиях развития, не могут пройти через этот барьер. В дальнейшем иммунная защита эмбриона и плода начинает осу-ществляться другими сложными механизмами, обусловленными изменениями в материнском организме и плаценте.
Антигены трофобласта возникают приблизительно на 5-й неделе внутриутробного развития, а антигены плода – на 12-й неделе. Именно с этого периода начинается и прогрессирует иммунная "атака" плода. Каким же образом материнский организм реагирует на эту прогрессирующую иммунологическую атаку? Каковы важнейшие механизмы защиты плода от иммунологической агрессии матери, что в конечном итоге способствует неотторжению плодного яйца как аллотрансплантата? Необходимо отметить, что эти вопросы, несмотря на значительное количество клинических и экспе-риментальных исследований, изучены до настоящего времени недостаточно, а полученные данные нередко носят противоречивый характер.
Важнейшим фактором защиты плода является иммунологическая толерантность материнского организма к антигенам плода отцовского происхождения, обусловленная различными механизмами. Известно, что реакции антиген-антитело регулируются гуморальными и клеточными механизмами. При физиологическом развитии беременности гуморальное зверю иммунитета, оцениваемое на основании уровня в крови иммуноглобулинов классов А, М и G, существенно не изменяется, за исключением концент-рации иммуноглобулина G, которая в конце беременности несколько снижается в результате перехода IgG через плаценту к плоду. Не претерпевает значительных изменений во время беременности и такая важнейшая составная часть иммунной системы, как система комплемента. Следовательно, организм беременной не только адекватно отвечает на антигенную стимуляцию плода, но и вырабатывает антитела, связывающие антигены отцовского происхождения.
Во время беременности соотношение Т-, В-лимфоцитов, Т-хелперов и Т-супрессоров существенно не меняется, хотя абсолютное количество этих клеток подвержено определенным колебаниям. Повышение количества лимфоцитов, характерное при беременности, не имеет существенного значения в процессах иммуномодуляции. Следовательно, для физиологически протекающей беременности характерна известная иммунологическая толерантность материнского организма к антигенам плода отцовского генеза. Эта толерантность обусловлена рядом факторов. Большую роль играют гормоны и специфические белки плаценты.
Выраженными иммунодепрессивными свойствами обладает хорионический гонадотропин, который продуцируется трофобластом с самых ранних стадий беременности. Аналогичными свойствами обладает плацентарный лактоген. Наряду с этими гормонами известную роль в процессах иммуносупрессии играют также глюкокортикоиды, прогестерон и эстрогены, которые в возрастающем количестве вырабатываются плацентой на протяжении беременности. Кроме гормонов, подавлению реакций иммунитета материн-ского организма способствуют альфа-фетопротеин – белок, продуцируемый эмбриональными клетками печени, а также некоторые белки плаценты зоны беременности (оЛ-гликопротеин и трофобластический (Зр-гликопротеид). Эти белки плаценты в совокупности с хорионическим гонадотропином и плацентарным лактогеном создают как бы зону биологической зашиты фетоплацентарного комплекса от действия клеточных и гуморальных компонентов иммунной системы матери.
Большую роль в иммунной защите плода играет плацента. Наличие трофобластического, а затем и плацентарного барьеров, разделяющих организм матери и плода, обусловливает выраженные защитные функции. Установлено, что трофобласт резистентен к иммунному отторжению. Кроме того, трофобласт со всех сторон окружен слоем аморфною фибриноилного вещества, состоящего из мукополисахаридов. Этот слон надежно защищает плод от иммунологической агрессии организма матери. Известная роль в подавлении иммунных реакций в плаценте принадлежит также Ти В-лимфоцитам, макрофагам, гранулоцитам и некоторым другим клеточным элементам, которые обнаруживают в тканях плаценты. Таким образом, иммунологические взаимоотношения системы мать-плод являются физиологическим процессом, направленным на создание и обеспечение необходимых условий для нормального развития плода. Нарушение этого процесса нередко приводит к развитию патологии беременности (невынашивание, гестозы и др.).
Система гемостаза.
Физиологически протекающая беременность и физиологические ролы сопряжены с адаптацией системы гемостаза, которая характеризуется определенными качественными сдвигами в различных звеньях данной системы. Они характеризуются существенным (до 150-200 %) повышением содержания всех плазменных факторов (кроме фактора XIII) свертывания крови, снижением активности (но не содержания) естественных ингибиторов свертывания крови – антитромбина III, протеина С, угнетением активности фибринолиза и незначительным увеличением адгезивно-агрегационных свойств тромбоцитов. Однако это, как правило, не сочетается с патологической гипертромбинемией и внутрисосудистым свертыванием крови.
Системы гемостаза матери и плода во время беременности функционируют относительно раздельно; плацента оказывает лишь опосредованное влияние на гемостаз матери и плода. На функцию спиральных аргериол, с помощью которых осуществляется кровоснабжение плаценты, воздействует система гемостаза материнского организма, в первую очередь тромбоцитарное звено. Тромбоциты осуществляют регуляцию кровотока в спиральных артериолах путем взаимодействия их тромбоксангенерирующей системы и простациклингенерирующей системы эндотелия. Местные процессы активации гемостаза в маточно-плацентарном кровотоке с интраи экстравазальным отложением фибрина вызывают слабовыраженное потребление факторов свертывания крови. Повышение гемостатического потенциала во время беременности обеспечивает физиологический гемостаз при отделении плаценты, который вместе с сокращением гладких мышц останавливает кровотечение из сосудов плацентарной площадки. Таким образом, измене-ния свертывающей системы крови во время беременности заключаются в постоянном снижении фибринолитической активности и повышении коагуляции крови. Эти изменения имеют выраженный адаптационный характер и направлены прежде всего на снижение объема физиологической кровопотери в родах.
Обмен веществ.
С наступлением беременностисущественные изменения происходят в обмене веществ. Эти изменения имеют адаптационный характер и направлены на обеспечение правильного развития эмбриона и плода. Основной обмен и потребление кислорода значительно возрастают, что особенно заметно во второй половине беременности.
Существенные изменения наблюдаются в белковом, углеводном и липидном обмене. По мере развития беременности в организме жен шины происходит накопление белковых веществ, что необходимо для удовлетворения потребности растущего плода в аминокислотах. Изменения углеводного обмена характеризуются накоплением гликогена в клетках печени, мышечной ткани, матке и плаценте. При физиологическом течении бере-менности в крови матери отмечается некоторое повышение концентрации нейтрального жира, холестерина и липидов.
Разнообразные изменения претерпевает минеральный и водный обмен. Во время беременности в организме женщины наблюдается задержка солей кальция и фосфора. Оба этих элемента переходят через плаценту и расходуются на построение костей плода. От матери к плоду переходит также железо, которое используется при синтезе фетального гемоглобина. При тяжелой железодефицитной анемии матери у плода также отмечается развитие анемии, поэтому в диете беременных должно быть всегда достаточное количество кальция, фосфора и железа. Наряду с этими элементами в организме матери происходит также задержка калия, натрия, магния, меди и некоторых других электролитов. Все эти вещества переходят через плаценту и активно участвуют в процессах обмена веществ.
Существенные изменения касаются водного обмена. Повышение онкотического и осмотического давления в тканях, прежде всего обусловленное задержкой альбуминов и солей натрия, создает условия для увеличения гидрофильности тканей в основном в результате накопления межтканевой жидкости. Этот процесс имеет очень большое физиологическое значение, обусловливая размягчение тканей и связок и облегчая тем самым прохождение плода по родовому каналу во время родов. В регуляции водного обмена при беременности важная роль принадлежит альдостерону надпочечников, прогестерону желтого тела и плаценты, антидиуретическому гормону гипофиза и некоторым другим факторам. Таким образом, для физиологического течения беременности характерной является задержка жидкости в организме. При срыве компенсаторных механизмов, регулирующих водный обмен, у беременных сравнительно легко возникают отеки, что уже свидетельствует о возникновении патологии (гестоз).
Во время беременности значительно возрастает потребность в витаминах. Витамины необходимы как для физиологического течения обменных процессов в материнском организме, так и для правильного развития плода. Интенсивность использования железа для синтеза гемоглобина зависит от достаточного поступления в организм матери витаминов С, B1 В2, В12, РР и фолиевой кислоты. Витамин Е способствует правильному развитию беременности и при его дефиците может произойти самопроизвольное преры-вание беременности. Велика также роль при беременности и других витаминов: A, D, С, РР и др. Большинство витаминов в той или иной степени переходят через плаценту и используются плодом в процессе его роста и развития. Необходимо подчеркнуть, что витамины не образуются в организме, а поступают извне с пищей. Отсюда становится понятным, насколько велика при беременности роль снабжения витаминами организмов матери и плода. Нередко в продуктах питания содержится недостаточное количество витаминов, что имеет место в зимние и весенние месяцы года из-за сезонного дефицита овощей и фруктов. В таких случаях показано назначение поливитаминов в виде лекарственных препаратов.
Определенные адаптационные изменения при физиологически протекающей беременности наблюдаются в кислотно-основном состоянии (КОС). Установлено, что у беременных возникает состояние физиологического метаболического ацидоза и дыхательного алкалоза.
Опорно-двигательный аппарат.
При физиологическом течении беременности выраженные изменения происходят во всем опорно-двигательном аппарате женщины. Отмечается серозное пропитывание и разрыхление связок, хрящей и синовиальных оболочек лобкового и крестцово-подвздошных сочленений. В результате наблюдается некоторое расхождение лонных костей в стороны (на 0,5-0,6 см). При более выраженном расхождении и появлении болевых ощущений в этой области говорят о симфизиопатии. Это патологическое состояние требует проведения соответствующей терапии.
Изменения в суставах, характерные для беременности, приводят к некоторому увеличению прямого размера входа в малый таз, что положительно сказывается во время родов. Грудная клетка расширяется, реберные дуги располагаются более горизонтально, нижний конец грудины несколько отходит от позвоночника. Все эти изменения накладывают отпечаток на всю осанку беременной.
Кожа.
Своеобразным изменениям подвергается кожа. У многих беременных на лице, сосках, околососковых кружках откладывается коричневый пигмент, что обусловлено изменениями функции надпочечников. По мере увеличения срока беременности происходит постепенное растяжение передней брюшной стенки. Появляются так называемые рубцы беременности, которые образуются в результате расхождения соединительнотканных и эластических волокон кожи. Рубцы беременности имеют вид розовых или сине-багровых полос дугообразной формы. Чаще всего они располагаются на коже живота, реже – на коже молочных желез и бедер. После родов эти рубцы теряют свою розовую окраску и приобретают вид белых полос. При последующих беременностях на фоне старых рубцов беременности могут возникать новые, имеющие характерную розовую окраску.
Пупок во второй половине беременности сглаживается, а позднее выпячивается. В ряде случаев при беременности на коже лица, живота, бедер отмечается рост волос, что обусловлено повышенной продукцией андрогенов надпочечниками и частично плацентой. Гипертрихоз имеет временный характер и постепенно исчезает после родов.
Масса тела.
Увеличение массы тела беременной обусловлено рядом факторов: ростом матки и плода, накоплением амниотической жидкости, увеличением объема циркулирующей крови, задержкой жидкости в организме, увеличением слоя подкожной основы (жировой клетчатки). Масса тела наиболее интенсивно увеличивается во второй половине беременности, когда еженедельная прибавка составляет 250-300 г. При более значительных темпах увеличения массы тела речь может идти сначала о скрытых, а затем и о явных отеках (гестоз). На протяжении всей беременности масса тела женщины в среднем увеличивается на 9-12 кг в зависимости от конституции.
Молочные железы.
Железистая ткань молочной железы представляет собой комплекс трубчато-альвеолярных желез, которые состоят из древовидной системы протоков, дренирующих скопления мешкоподобных структур, называемых альвеолами, или анинусами. Эти альвеолы образуют основную структурную единицу секретирующей системы. Каждая альвеола окружена сетью миоэпителиальных клеток и густой капиллярной сетью. Альвеолы образуют дольки, состоящие из 10-100 альвеол. Группа из 20-40 долек образует более крупные доли, каждая из которых имеет общий молочный проток. Общее число молочных протоков колеблется от 15 до 20. Молочные протоки выходят на поверхность в области соска.
Молочная железа имеет обильное кровоснабжение и развитую иннервацию, представленную чувствительными и вегетативными нервными волокнами. В клеточных элементах молочных желез имеются многочисленные рецепторы к белковым и стероидным гормонам.
С наступлением и развитием беременности в тканях молочных желез происходят выраженные изменения, которые являются подготовительными к последующей лактации. Значительно возрастает кровоснабжение молочных желез; под влиянием гормональных изменений происходит активная клеточная пролиферация как протоков, так и ацинозных структур (маммогенез). Пролиферативные изменения молочных протоков начинаются раньше, чем ацинозных частей. Пролиферативные процессы обычно наблюдаются с 3-4-й недели беременности и несколько уменьшаются во второй ее половине.
Активные пролиферативные процессы в эпителии выводных протоков и ацинусов приводят к значительному увеличению размеров долек молочных желез за счет процессов гиперплазии и гипертрофии. Со второй половины беременности на фоне снижения пролиферации начинается подготовка молочных желез к их важнейшей функции – секреции молока. В протоплазме клеток образуются жировые включения, альвеолы начинают заполняться бел ко во подобными веществами, состоящими из десквамиро ванных эпителиальных клеток и лейкоцитов. Тем не менее во время беременности в альвеолярные мешки из альвеол еще не поступают ни липиды, ни белки, которые являются основными составными частями будущего молока. В конце беременности при надавливании на соски из них начинает выделяться молозиво.
Наряду с изменениями эпителиальных структур молочных желез происходит активация гладкой мускулатуры сосков. В результате всех этих физиологических процессов значительно возрастает масса молочных желез со 150-250 г (до беременности) до 400-500 г (в конце ее).
Функция молочных желез в основном зависит от гормональных факторов. В начале процесса маммогенеза важная роль принадлежит овариальным гормонам (прогестерону и эстрогенам желтого тела беременности). Затем функция желтого тела переходит к плаценте, которая выделяет постоянно увеличивающееся количество как эстрогенов, так и прогестерона. Большую роль в процессах маммогенеза во время беременности играет плацентарный лактоген. Велика также роль гормонов щитовидной железы и надпочечни-ков. Совокупное воздействие всех этих гормонов на соответствующие рецепторы молочных желез осуществляет сложнейшие процессы подготовки к лактации.
Половая система.
Во время беременности наиболее выраженные изменения происходят в половой системе и особенно в матке.
Матка увеличивается в размерах в течение всей беременности, однако это увеличение асимметрично, что в значительной степени зависит от места имплантации. В течение первых нескольких недель беременности матка имеет форму груши. В конце 2-го месяца беременности размеры матки увеличиваются приблизительно в 3 раза и она имеет округлую форму. В течение второй половины беременности матка сохраняет свою округлую форму, а в начале третьего триместра приобретает яйцевидную форму.
По мере роста матки ввиду ее подвижности происходит некоторая ее ротация, чаще вправо. Полагают, что этот процесс обусловлен давлением на нее сигмовидной кишки, находящейся на левой задней стороне полости таза.
В конце беременности масса матки достигает в среднем 1000 г (до беременности 50-100 г). Объем полости матки в конце беременности возрастает более чем в 500 раз. Увеличение размеров матки происходит благодаря прогрессирующим процессам гипертрофии и гиперплазии мышечных элементов. Процессы гипертрофии преобладают над процессами гиперплазии, о чем свидетельствует слабая выраженность митотических процессов в миоцитах. В результате гипертрофии каждое мышечное волокно удлиняется в 10 раз и утолщается приблизительно в 5 раз. Наряду с гипертрофией и гиперплазией увеличивается количество гладких мышечных клеток. Новые мышечные клетки берут свое начало от соответствующих элементов стенок маточных сосудов (артерий и вен).
Параллельно изменениям гладкой мускулатуры происходят сложные процессы по преобразованию соединительной ткани матки. Отмечается гиперплазия соединительной ткани, которая составляет сетчато-волоки истый и аргирофильный остов матки. В результате этого матка приобретает возбудимость и сократимость, столь характерные для этого органа в процессе беременности. Существенные изменения происходят и в слизистой оболочке матки, которая превращается в развитую децидуальную оболочку.
По мере прогрессирования беременности происходят значительные изменения сосудистой системы матки. Наблюдается выраженное удлинение сосудистой, особенно венозной системы, ход сосудов делается штопорообразным, что позволяет им максимально адаптироваться к изменившемуся объему матки. Сосудистая сеть матки увеличивается не только в результате удлинения и расширения венозной и артериальной сети, но и вследствие новообразования сосудов. Все эти изменения способствуют усилению кровообращения в матке. По своему кислородному режиму беременная матка приближается к таким жизненно важным органам, как сердце, печень и мозг. Некоторые ученые склонны считать матку во время беременности "вторым сердцем". Характерно, что маточный круг кровообращения, тесно связанный с плацентарным и плодовым, обладает относительной независимостью от общей гемодинамики и характеризуется известным постоянством. Эти особенности маточного кровообращения имеют принципиальное значение в бесперебойном обеспечении плода кислородом и различными питательными веществами.
Во время беременности изменяются нервные элементы матки, увеличивается количество различных рецепторов (чувствительных, баро-, осмо-, хемои др.). Они имеют очень важное значение в восприятии разнообразных нервных импульсов, которые поступают от плода к матери. С возбуждением ряда этих рецепторов связывают начало родовой деятельности.
Особого рассмотрения заслуживают биохимические и электростатические изменения в миометрии, которые готовят матку к родовой деятельности. Матка богата различными мышечными белками. К основным белкам относят миозин, актин и актомиозин. Основным комплексом сократительных белков является актомиозин – соединение актина и миозина. Миозин является глобулином и составляет около 40 % от всех мышечных белков. Миозин обладает свойствами фермента, катализирующего гидролиз аденозинтрифосфорной кислоты (АТФ) и неорганического фосфора.
Актин является вторым белком сократительного комплекса и составляет приблизительно 20 % фибриллярных белков. Соединение актина и миозина – сложный биохимический процесс, имеющий решающее значение в сократительных свойствах миометрия. С наступлением беременности и в процессе ее развития количество актомиозина значительно возрастает.
Наряду с сократительными белками в миометрии содержатся также саркоплазматические белки, участвующие в процессах метаболизма мышечной клетки. К ним относятся миоген, миоглобулин и миоглобин. Этим белкам принадлежит важная роль в липидном и углеводном обмене.
При физиологически протекающей беременности в миометрии накапливаются различные фосфорные соединения, а также такие важные в энергетическом отношении соединения, как креатинфосфат и гликоген. Отмечается возрастание активности ферментных систем, среди которых наибольшее значение имеет АТФаза актомиозина. Этот фермент имеет прямое отношение к сократительным свойствам миометрия. Активность этого фермента особенно заметно возрастает в конце беременности.
Сократительная способность миометрия зависит и от интенсивности обменных процессов в матке. Основными показателями обмена веществ мышечной ткани является интенсивность окислительных и гликолитических процессов. Эти процессы обусловливают накопление в мышце матки различных химических высокоэнергетических соединений (гликоген, макроэргические фосфаты), мышечных белков, а также электролитов (ионов кальция, натрия, калия, магния, хлора и др.).
С наступлением беременности резко возрастает активность окислительных процессов при одновременном угнетении активности гликолитического (неэкономичного) метаболизма.
Возбудимость и механическая активность нервно-мышечного аппарата матки находится в определенной зависимости от ионного состава внеклеточной среды и проницаемости отдельных электролитов через протоплазматическую мембрану. Возбудимость и сократительная активность гладкой мышечной клетки (миоцита) зависят от проницаемости ее мембраны для ионов. Изменение проницаемости совершается под влиянием потенциала покоя или потенциала действия. В состоянии покоя (поляризация мембраны) К находится внутри клетки, a Na – на наружной поверхности мембраны клетки и в межклеточной среде. При такой ситуации на поверхности клетки и в окружающей ее среде создается положительный заряд, а внутри клетки – отрицательный.
При возникновении возбуждения происходят деполяризация клеточной мембраны, которая вызывает потенциал действия (сокращение мышечной клетки), при этом К выходит из клетки, a Na, наоборот, входит внутрь клетки. Мощным активатором процессов возбуждения мышечной клетки является Са . При физиологическом течении беременности эстрогены и прогестерон плаценты, а также биологически активные вещества поддерживают оптимальное ионное равновесие и обеспечивают распространение потока электрических зарядов в необходимом направлении.
Большая роль в возбудимости и сократительное™ миометрия принадлежит альфаи бета-адренорецепторам, которые располагаются на мембране гладкой мышечной клетки. Возбуждение альфа-адренорецепторов приводит к сокращениям матки, возбуждение бета-адренорецепторов сопровождается противоположным эффектом. Таковы важнейшие механизмы, обеспечивающие во время беременности физиологическое состояние миометрия, а именно: в начале беременности наблюдается низкая возбудимость матки, с увеличением срока беременности возбудимость возрастает, достигая наивысшей степени к началу родов.
Наряду с маткой существенные изменения во время беременности претерпевают и другие отделы половой системы женщины.
Маточные трубы утолщаются, кровообращение в них значительно усиливается. Изменяется и их топография (к концу беременности они свисают по ребрам матки).
Яичники несколько увеличиваются в размерах, хотя циклические процессы в них прекращаются. В течение первых 4 мес беременности в одном из яичников существует желтое тело, которое в дальнейшем подвергается инволюции. В связи с увеличением размеров матки меняется топография яичников, которые располагаются вне малого таза.
Связки матки значительно утолщаются и удлиняются. Это в особенности касается круглых и крестцово-маточных связок.
Влагалище. Во время беременности происходит гиперплазия и гипертрофия мышечных и соединительнотканных элементов этого органа. Усиливается кровоснабжение его стенок, наблюдается выраженное серозное пропитывание всех его слоев. Вследствие этого стенки влагалища становятся легкорастяжимыми. Слизистая оболочка влагалища вследствие застойного венозного полнокровия приобретает характерную синюшную окраску. Усиливаются процессы транссудации, вследствие чего возрастает жидкая часть влагалищного содержимого, В протоплазме многослойного плоского эпителия откладывается много гликогена, что создает оптимальные условия для размножения лактобацилл. Выделяемая этими микроорганизмами молочная кислота поддерживает кислую реакцию влагалищного содержимого, что является важным сдерживающим фактором на пути восходящей инфекции.
Наружные половые органы во время беременности разрыхляются, слизистая оболочка входа во влагалище имеет отчетливую синюшную окраску. Иногда на наружных половых органах возникает варикозное расширение вен.
Другие внутренние органы. Наряду с мочевыделительной системой значительные изменения в связи с беременностью наблюдаются также в органах брюшной полости. Тощая, подвздошная и слепая кишка, червеобразный отросток смещаются беременной маткой вверх и вправо. В конце беременности червеобразный отросток может располагаться в области правого подреберья, что следует учитывать при операции аппендэктомии, производимой в конце беременности. Сигмовидная кишка смещается кверху и может в конце беременности быть прижатой к верхнему краю таза. Одновременно наблюдается сдавление брюшной аорты, нижней полой вены, что может приводить к варикозному расширению вен нижних конечностей и прямой кишки (геморрой).?
Глава 4. Диагностика и ведение беременности
Диагностика беременности
Установление наличия беременности чрезвычайно важно, поскольку определяет своевременную адекватную тактику ведения пациенток. Определение факта беременности имеет большое значение не только у женщин репродуктивного возраста, но и у пациенток климактерического периода, у девочек до наступления менархе, когда при нерегулярных менструациях или при их отсутствии не исключается возможность наступления беремен-ности.Ранняя диагностика беременности очень важна не только для акушеров-гинекологов, но и для врачей различных специальностей, так как гормональные, физиологические и анатомические изменения, сопровождаю щие беременность, могут существенно влиять на течение экстрагенитальных заболеваний (см. главу 13).
Диагностика беременности, особенно в ранние сроки, иногда представляет определенные трудности. Некоторые эндокринные заболевания, стрессы, а также прием фармакологических препаратов могут имитировать состояние беременности, вводя в заблуждение и женщину, и врача.
В связи с беременностью происходит перестройка функций всех органов и систем женщины, что сказывается на ее самочувствии (субъективный характер) и сопровождается объективно определяемыми изменениями.
Наиболее характерные признаки беременности могут быть по значимости для диагностики разделены на три группы: сомнительные, вероятные и достоверные.
Предположительные (сомнительные) признаки беременности. К этим признакам относятся различного рода субъективные ощущения. 1. Тошнота, рвота, особенно по утрам, изменение аппетита (отвращение к мясу, рыбе и др.). 2. Изменение обонятельных ощущений (отвращение к духам, табачному дыму и др.). 3. Нарушения функции нервной системы: недомогание, раздражительность, сонливость, неустойчивость настроения, головокружение и др. 4. Пигментация кожи на лице, по белой линии живота, в области сосков, появление полос беременности (рис. 4.1). 5. Учащение мочеиспускания. 6. Увеличение объема живота, ощущение нагрубания молочных желез.
 Рис. 4.1. Полосы беременности
Рис. 4.1. Полосы беременности
 Рис.4.2. Признаки беременности Горвица-Гегара
Рис.4.2. Признаки беременности Горвица-Гегара
Вероятные признаки беременности.
К данной группе относят объективные признаки, определяемые в половых органах, молочных железах, положительные биологические иммунологические тесты на беременность. 1. Прекращение менструаций (аменорея) у здоровой женщины репро-дуктивного возраста. 2. Увеличение молочных желез, их напряженность, появление молозива из открывающихся на соске молочных ходов при надавливании на молочные железы (у первобеременных). 3. Синюшность (цианоз) слизистой оболочки влагалища и шейки матки. 4. Изменение величины, формы и консистенции матки.
Из признаков, указывающих на изменение формы и консистенции матки в связи с беременностью, важнейшими являются следующие. 1. Увеличение матки. Определяется начиная с 5-6-й недели беременности: матка увеличивается в переднезаднем размере (становится шарообразной), позднее – и в поперечном размере. К концу 2-го месяца беременности размеры матки соответствуют размерам гусиного яйца, в конце 3-го – дно матки находится на уровне или несколько выше симфиза. 2. Симптом Горвица – Гегара. Беременная матка при исследовании мягкая, размягчение особенно выражено в области перешейка. Пальцы обеих рук при двуручном исследовании соприкасаются в области перешейка почти без сопротивления (рис. 4.2). Признак характерен для ранних сроков беременности и четко определяется через 6 – 8 нед от начала последней менструации. • Признак Снегирева. Для беременной матки характерна изменчивость консистенции. Мягкая беременная матка под влиянием механического раздражения во время двуручного исследования уплотняется и сокращается. После прекращения раздражения матка вновь приобретает мягкую консистенцию. • Признак Пискачека. Для ранних сроков беременности характерна асимметрия матки, обусловленная куполообразным выпячиванием правого или левого ее угла, что соответствует месту имплантации плодного яйца. По мере роста плодного яйца эта асимметрия постепенно исчезает (рис. 4.3). • Признак Губарева и Гауса. Указывает на легкую подвижность шейки матки в ранние сроки беременности, что связано со значительным размягчением перешейка. • Признак Гентера. Вследствие размягчения перешейка в ранние сроки беременности возникают перегиб матки кпереди и гребневидное утолщение на передней поверхности матки по средней линии. Однако это утолщение определяется не всегда (рис. 4.4).
 Рис. 4.3. Признак беременности Пискачека.
Рис. 4.3. Признак беременности Пискачека.
 Рис. 4.4. Признак беременности Гентера.
Рис. 4.4. Признак беременности Гентера.
Вероятные признаки беременности выявляют следующим образом: 1. путем пальпации молочных желез и выдавливания молозива; 2. при осмотре наружных половых органов и слизистой оболочки входа во влагалище; 3. при исследовании с помощью зеркал; 4. путем влагалищного и двуручного влагалищно-абдоминального ис-следования.
Осмотр наружных половых органов производят в стерильных резиновых перчатках на гинекологическом кресле или кушетке; женщина лежит на спине, ноги согнуты в тазобедренных и коленных суставах и разведены; под крестец подкладывают валик. Наружные половые органы обрабатывают одним из антисептических растворов. Большие и малые половые губы разводят II и I пальцами левой руки и осматривают (наружные половые органы (вульву), слизистую оболочку входа во влагали1ще, наружное отверстие мочеиспускательного канала, выводные протоки I больших желез преддверия и промежность.
Исследования с помощью зеркал. После осмотра наружных половых органов и слизистой оболочки входа во влагалище приступают к исследованию с помощью влагалищных зеркал (рис. 4.5). Данный метод (исследования позволяет выявить цианоз шейки матки и слизистой оболочки I влагалища, а также заболевания шейки матки и влагалища. Можно пользоI ваться створчатыми и ложкообразными зеркалами. Створчатое зеркало вво[дят до свода влагалища в сомкнутом виде, затем створки раскрывают, и 1шейка матки становится доступной для осмотра. Стенки влагалища осматривают при постепенном выведении зеркала из влагалища. После осмотра шейки матки и стенок влагалища зеркала извлекают и приступают к влагалищному исследованию.
Влагалищное (пальцевое) исследование беременной. Пальщами левой руки раздвигают большие и малые половые губы; пальцы правой руки (II и III) вводят во влагалище, I палец отводится кверху, IV и V прижаты к ладони, упираясь в промежность. Исследуется состояние мышц. I тазового дна, стенок влагалища (складчатость, растяжимость, разрыхление), [сводов влагалища, шейки матки (длина, форма, консистенция) и наружного зева шейки матки (закрыт, открыт, форма круглая или щелевидная).
Двуручное (бимануальное) исследование беременной. После пальпации шейки матки приступают к двуручному исследованию (рис. 4.6). Пальцами левой руки бережно надавливают на брюшную стенку по направлению к полости малого таза навстречу пальцам правой руки, находящимся в переднем своде влагалища. Сближая пальцы обеих исследующих рук, пальпируют тело матки и определяют ее положение, форму, величину и консистенцию, после чего приступают к исследованию маточных труб и яичников. Для этого пальцы обеих рук постепенно перемещают от угла матки к боковым стенкам таза. Для определения вместимости и формы таза исследуют внутреннюю поверхность костей таза, крестцовой впадины, боковых стенок таза и симфиза.
Достоверные признаки
Достоверные, или несомненные, признаки беременности – это признаки,, появляющиеся во второй половине беременности и свидетельствующие о наличии плода в полости матки.
1. Пальпирующиеся части плода. Во второй половине беременности при пальпации живота определяются головка, спинка и мелкие части (конечности) плода; чем больше срок беременности, тем лучше прощупываются части плода. 2. Ясно слышимые сердечные тоны плода. С помощью акушерского стетоскопа (рис. 4.7) сердечные тоны плода выслушиваются с начала второй половины беременности в виде ритмичных ударов, повторяющихся 120-140 раз в минуту. Иногда удается уловить сердцебиение плода с 18-19 нед. беременности. Регистрация сердечных сокращений плода возможна и в более ранние сроки с помощью эхокардиографии (через 48 дней после .первого дня последней менструации) и эхографии (с 5-6 нед беременшости). 3. Движения плода, ощущаемые врачом при обследовании беременной. Движения плода обычно определяются во второй половине беременности. Сами беременные ощущают движение плода – первородящие с 20-й недели, а повторнородящие с 18-й недели, но эти ощущения к достоверным признакам беременности не относятся, так как они могут быть ошибочными – женщина может принять за движение плода перистальтику кишечника.)
 Рис. 4.5. Влагалищные зеркала. а – створчатое; б – ложкообразное.
Рис. 4.5. Влагалищные зеркала. а – створчатое; б – ложкообразное.
 Рис. 4.6. Двуручное влагалищно-абдоминальное исследование.
Рис. 4.6. Двуручное влагалищно-абдоминальное исследование.
Наиболее достоверную информацию при диагностике беременности получают при ультразвуковом исследовании (УЗИ). При трансабдоминальном сканировании наличие беременности можно установить с 4-5 нед, а при трансвагинальной эхографии – на 1 – 1,5 нед раньше. В ранние сроки диагноз беременности устанавливают на основании определения в полости матки плодного яйца, желточного мешка, эмбриона и его сердечных сокращений, в более поздние сроки – благодаря визуализации плода (или плодов при многоплодной беременности).
Распознавание беременности требует всестороннего обследования пациентки: лишь тщательно собрав анамнез, выслушав субъективные жалобы, произведя осмотр и пальпацию живота, молочных желез, исследование наружных и внутренних половых органов, врач может на основании всей суммы предположительных и вероятных признаков поставить диагноз беременности. Кроме того, в сомнительных случаях наличие беременности уточняют при УЗИ (достоверный признак).
Диагноз беременности является точным даже при наличии только одного достоверного признака.
После установления факта наличия беременности необходимо провести тщательное обследование пациентки,
Обследование беременной
Опрос
При обращении в женскую консультацию заводят карту беременной, в которой отражают данные опроса, объективного и инструментально-лабораторного обследования беременной по определенному плану (при поступлении в родильный дом заводят историю родов). 1. Паспортные данные (фамилия, имя, отчество, возраст, место работы и профессия, место жительства). Большое внимание уделяется возрасту беременной, особенно первородящей. У "пожилых" (старше 30 лет) и "юных" (до 18 лет) первородящих чаще наблюдаются осложнения в течении беременности и родов. Вне зависимости от паритета возраст беременной старше 35 лет указывает на вероятность врожденной и наследственной патологии у детей. 2. Причины, заставившие женщину обратиться за медицинской помощью (жалобы). Беременные обычно обращаются впервые по поводу прекращения менструаций и подозрения на беременность; нередко они отмечают изменение вкуса, тошноту, рвоту и другие расстройства, встречающиеся в ранние сроки беременности. Бывают жалобы на кровяные выделения из влагалища, что является симптомом многих осложнений (самопроизвольный выкидыш, внематочная беременность, трофобластическая болезнь, аномалии расположения плаценты, заболевания шейки матки и др.). Иногда отмечаются признаки, указывающие на наличие гестоза, заболеваний сердечно-сосудистой системы, органов дыхания, пищеварения и др. Все жалобы беременной следует внимательно выслушать и учесть при постановке акушерского диагноза. 3. Условия труда и быта. Выясняют очень подробно, так как вредные факторы промышленности и сельского хозяйства могут отрицательно сказываться на течении беременности и развитии плода. Иногда профессия беременной связана с вибрацией, работой на компьютере, длительным стоянием на ногах и др., что также неблагоприятно для беременности. Обязательно следует отметить наличие вредных привычек: алкоголизм, курение, наркомания. Необходимо принять меры к созданию для беременной благо-приятных условий труда и быта. 4. Наследственность и перенесенные заболевания. Наследственные заболевания представляют интерес потому, что они могут оказать неблагоприятное влияние на развитие плода. Необходимо выяснить, не было ли в семье беременной и ее мужа передающихся наследственным путем психических заболеваний, болезней крови, нарушения обмена веществ, генетически обусловленных аномалий развития и др. Важно получить сведения обо всех ранее перенесенных заболеваниях. Большой интерес представляют заболевания детского возраста. Например, перенесенный в детстве рахит ведет к деформации таза, которая осложняет течение родов. Поэтому всегда выясняют, имел ли место рахит (поздно прорезались зубы, поздно начала ходить, наличие деформаций скелета и др.). Корь, краснуха, туберкулез, а также ревматизм, тонзиллит, повторяющиеся ангины и другие инфекционные заболевания нередко вызывают отставание физического и полового развития и могут послужить причиной развития общего и генитального инфантилизма. Дифтерия вульвы и влагалища может сопровождаться образованием Рубцовых сужений. Заболевания почек, нередко возникающие после скарлатины, частых ангин, отягощают течение беременности и часто служат показанием к ее прерыванию. Выясняются также перенесенные в зрелом возрасте неинфекционные, инфекционные, в том числе гинекологические, заболевания. Перенесенные ранее заболевания сердечно-сосудистой системы, печени, легких, почек и других органов могут отразиться на течении беременности и родов. Кроме того, беременность и роды могут вызывать новые вспышки затихших заболеваний сердца, почек и других органов. 5. Менструальная функция. При опросе выясняют: * в каком возрасте появилась первая менструация (менархе), через какой промежуток времени установились регулярные менструации; * тип и характер менструаций (длительность менструального цикла, продолжительность менструаций, количество теряемой крови, болезненность и пр.); * изменился ли характер менструации после начала половой жизни, родов, абортов; * когда была последняя менструация. Менструальная функция характеризует состояние половых органов и всего организма женщины. Появление первой менструации в возрасте 14- 15 лет и старше, длительный срок от первой менструации до установления нормального цикла (более 6 мес), болезненность менструации характерны Для генитального инфантилизма. Нарушение менструальной функции после начала половой жизни, абортов, родов чаще всего является признаком воспалительного заболевания внутренних половых органов или нарушения функции яичников и других желез внутренней секреции; возможны и другие гинекологические заболевания, которые могут отразиться на течении беременности, родов и послеродовом периоде (миома матки, опухоли яичников и др.). 6. Секреторная функция. Выясняют, нет ли выделений из половых путей. Патологические выделения (обильные, гнойные, слизистые или водянистые с примесью гноя и т.д.) свидетельствуют о наличии воспалительного процесса; причинами его возникновения могут быть полип, эрозия, рак шейки матки и др. 7. Половая функция. Выясняют, в каком возрасте началась половая жизнь, какой брак по счету, нет ли болей и кровяных выделений при половых сношениях. Важен также срок от тчла регулярной половой жизни до наступления первой беременности. Необходимо выяснить, использовались ли контрацептивы и какие. Внутриматочные противозачаточные средства могут оставаться в матке во время беременности. Отсутствие беременности в течение 1 года после начала регулярной половой жизни без применения противозачаточных средств может свидетельствовать о тех или иных заболеваниях половых органов. Половая жизнь в первые недели беременности, а также в конце ее может быть причиной инфицирования половых путей, самопроизвольного прерывания беременности или преждевременных родов. 8. Сведения о муже. Состояние здоровья мужа, его возраст, профессия, возможные вредные привычки (алкоголизм, наркомания), наследственные заболевания должны быть отражены в карте беременной и в истории родов. 9. Детородная функция.
В детородной функции опроса выясняют следующее. * Какая по счету настоящая беременность. Большое значение имеет число предыдущих беременностей, достигших срока жизнеспособности плода (а не только число родившихся детей). В зарубежной литературе различают следующие понятия. 1. Niltigraviia – женщина, не беременная в настоящее время и не имевшая беременности в анамнезе. 2. Gravida – женщина, беременная в настоящее время или имевшая беременности раньше, вне зависимости от их исхода. При первой беременности женщину характеризуют как первобеременную (primigmik), а при следующих беременностях – как повторнобеременную (miltigrivili). 3. Nullipara – женщина, никогда не имевшая беременности, достигшей срока жизнеспособного плода; ранее у нее могли быть или не быть беременности, закончившиеся абортом в более ранние сроки. 4. Frimipm – женщина, доносившая одну беременность (одноили многоплодную) до срока жизнеспособного плода. 5. Multipara – женщина, имеющая в анамнезе несколько беременностей, доношенных до срока жизнеспособного плода (22 нед беременности, масса плода 500 г. рост 32-34 см). Паритет (от лат. pario) – наличие родов в анамнезе, или число родов в прошлом. * Течение предыдущих беременностей: не было ли раннего токсикоза и гестоза (слюнотечение, рвота, отеки и др.), заболеваний сердечнососудистой системы, почек и других органов. В случае наличия указанных заболеваний в прошлом необходимо особенно внимательно наблюдать за женщиной при настоящей беременности. Необходимо получить подробные сведения о течении каждой беременности, родов и послеродовых периодов. Если у женщины имелись выкидыши, то следует установить их характер: самопроизвольный или ис-кусственный, на каком месяце произошел выкидыш, заболевания после него и их характер. Преждевременные роды и самопроизвольные аборты свидетельствуют о генитальном инфантилизме или наличии заболеваний, которые неблагоприятно влияют на течение беременности (эндокринные нарушения, инфекционные заболевания, повреждения шейки и перешейка матки и др.). При самопроизвольных и искусственных выкидышах нередко развиваются воспа-лительные заболевания половых органов, возникает склонность к преждевременному прерыванию беременности, наблюдаются неправильная родовая деятельность и кровотечения во время родов. * Характер предыдущих родов (своевременные, запоздалые или преждевременные), их течение. Правильное течение предыдущих родов свидетельствует о хорошем здоровье беременной и отсутствии отклонений от нормы в родовых путях. Осложнения и хирургические вмешательства при предыдущих родах, мертворождения или смерть ребенка после рождения свидетельствуют о возможных аномалиях родовых путей, осложнениях беременности, заболеваниях беременной. Патологические роды в прошлом (отягощенный акушерский анамнез) дают основание ожидать развития осложнений при данной беременности и родах. Следует выявить, наблюдались ли ранее послеродовые заболевания, так как они могут вызвать серьезные осложнения при последующих родах (аномалии родовой деятельности, приращение плаценты, кровотечения, разрыв матки, в том числе по рубцу, если предыдущие роды закончились операцией кесарева сечения, а послеоперационный период протекал с осложнениями).
Объективное обследование
После ознакомления с анамнезом пациентки приступают к объективному исследованию, который начинают с осмотра.
Осмотр беременной. Осмотр нередко позволяет получить очень ценные данные для диагноза. При осмотре обращают внимание на рост беременной, телосложение, упитанность, состояние кожных покровов, видимых слизистых оболочек, молочных желез, величину и форму живота.
Рост. Рост беременной необходимо точно измерить. При низком росте (150 см и ниже) у женщин нередко наблюдаются признаки инфантилизма (сужение таза, недоразвитость матки и др.). У женщин высокого роста наблюдаются другие особенности таза (широкий, мужского типа).
Телосложение. Деформация позвоночника и нижних конечностей, анкилозы суставов и другие изменения в костной системе свидетельствуют о возможном изменении формы таза и его сужении. Изменения в костях и суставах нередко появляются вследствие рахита, полиомиелита, туберкулеза, которые могли оказать отрицательное влияние на другие органы и системы. При осмотре выявляются дополнительные видимые признаки инфантилизма (недоразвитие молочных желез, недостаточное развитие волос в области наружных половых органов), недостаточная половая дифференцировка (широкие плечи, узкий таз, рост волос по мужскому типу) и прочие особенности развития, при которых беременность нередко протекает с осложнениями. Выраженное истощение или ожирение нередко являются признаком нарушения обмена веществ, эндокринных и других заболеваний. Возникновение [этих нарушений может быть обусловлено нерациональным питанием и режимом. Осложнения беременности и родов возникают у таких женщин чаще, чем обычно.
Кожные покровы. Пигментация лица, белой линии, сосков и око-лососковых кружков, полосы беременности позволяют предполагать наличие беременности. Бледность кожи и видимых слизистых оболочек, синюшность губ, желтушность кожи и склер, отеки являются признаками ряда серьезных заболеваний.
Молочные железы. Оценивают их развитие, состояние сосков (нор-мальные, плоские, втянутые), наличие отделяемого (молозива) из сосков.
Осмотр живота. Во второй половине беременности осмотр иногда позволяет выяснить отклонения от нормального ее течения. При нормальной беременности и правильном положении плода живот имеет овоидную (яйцевидную) форму; при многоводии он шарообразен, увеличивается очень 'резко, не соответственно сроку беременности; при поперечном положении плода живот приобретает форму поперечного овала. Форма живота может изменяться при узком тазе.
Исследование внутренних органов. После осмотра проводят исследование, сердечно-сосудистой системы, легких, органов пищеварения, нервной, мочевой и других систем по общепринятой методике (аускультация, перкуссия, пальпация и др.). Исследование сердца, легких, почек и других органов у беременных необходимо для своевременного выявления заболеваний, при которых беременность противопоказана.
У беременной в обязательном порядке измеряют артериальное давление, массу тела и рост, исследуют мочу и кровь (морфологическая картина, СОЭ), определяют группу крови, резус-принадлежность, производят серологические и другие исследования латентных инфекций (сифилис, ВИЧ,, вирусный гепатит, токсоплазмоз и др.). У всех беременных исследуют выделения из шейки матки, цервикального канала, влагалища для выявления [трихомоноза, гонореи, хламидиоза, микоплазмоза, бактериальной флоры. Во [Второй половине беременности измерение артериального давления, определение массы тела, исследование крови и мочи производят систематически., (После применения всех указанных методов исследования приступают к специальному акушерскому обследованию.
Измерение. При обследовании беременной, помимо определения её: роста, строения таза (его размеров и формы), необходимо измерять окружность живота и высоту стояния дна матки. При этом пользуются тазомером и сантиметровой лентой.
Измерение живота. Определяют сантиметровой лентой наибольшую его окружность на уровне пупка (в конце беременности она обычно равна 90-100 см) (рис. 4.8). Окружность живота больше 100 см обычно наблюдается при многоводии, многоплодии, крупном плоде, поперечном положении плода и ожирении.
 Рис. 4.8. Измерение окружности живота сантиметровой лентой.
Рис. 4.8. Измерение окружности живота сантиметровой лентой.
 Рис. 4.9. Измерение высоты стояния дна матки над лонным сочленением сантиметровой лентой.
Рис. 4.9. Измерение высоты стояния дна матки над лонным сочленением сантиметровой лентой.
Затем измеряют высоту стояния дна матки над лонным сочленением (рис. 4.9). В последние 2 – 3 нед беременности эта высота равна 36-37 см, а к началу родов, когда дно матки опускается – 34-35 см.
Высоту стояния дна матки над лонным сочленением можно определить и тазомером, с помощью которого может быть также определен и размер головки плода.
Исследование таза. В акушерстве исследование таза очень важно, так как строение и размеры таза имеют решающее значение для течения и исхода родов. Наличие нормального таза является одним из главных условий правильного течения родов. Отклонения в строении таза, особенно уменьшение его размеров, затрудняют течение родов или представляют неопреодолимые препятствия для них.
Исследование таза производят путем осмотра, ощупывания и измерения. При осмотре обращают внимание на всю область таза, но особое значение придают крестцовому ромбу (ромб Михаэлиса), форма которого в совокупности с другими данными позволяет судить о строении таза (рис. 4.10).
Крестцовый ромб представляет собой площадку на задней поверхности крестца: верхний угол ромба составляет углубление между остистым отростком V поясничного позвонка и началом среднего крестцового гребня; боковые углы соответствуют задневерхним остям подвздошных костей, нижний – верхушке крестца. При исследовании большого таза производят пальпацию остей и гребней подвздошных костей, симфиза и вертелов бедренных костей.
Измерение таза имеет наиболее важное значение из всех методов исследования таза. Зная размеры таза, можно судить о течении родов, о возможных осложнениях при них, о допустимости самопроизвольных родов при данной форме и размерах таза. Большинство внутренних размеров таза недоступны для измерения, поэтому обычно измеряют наружные размеры таза и по ним приблизительно судят о величине и форме малого таза.
Измерение таза производят специальным инструментом – тазомером. Тазомер имеет форму циркуля, снабженного шкалой, на которой нанесены сантиметровые и полусантиметровые деления. На концах ветвей тазомера имеются пуговки; их прикладывают к местам, расстояние между которыми подлежит измерению. Для измерения поперечного размера выхода таза сконструирован тазомер с перекрещивающимися ветвями.
При измерении таза женщина лежит на спине с обнаженным животом, ноги вытянуты и сдвинуты вместе. Врач становится справа от беременной лицом к ней. Ветви тазомера берут в руки таким образом, чтобы большие и указательные пальцы держали пуговки. Шкала с делениями обращена кверху. Указательными пальцами прощупывают пункты, расстояние между которыми измеряют, прижимая к ним пуговки раздвинутых ветвей тазомера, и отмечают по шкале величину искомого размера.
 Рис. 4.10. Крестцовый ромб
Рис. 4.10. Крестцовый ромб
Обычно измеряют четыре размера таза: три поперечных и один прямой. 1. Distantia spinarum – расстояние между передневерхними остями под-вздошных костей. Пуговки тазомера прижимают к наружным краям передневерхних остей. Размер этот обычно равняется 25-26 см (рис. 4.11, а). 2. Distantia chstarum – расстояние между наиболее отдаленными точками гребней подвздошных костей. После измерения distantia spinarum пуговки тазомера передвигают с остей по наружному краю гребня подвздошны› костей до тех пор, пока не определят наибольшее расстояние; это расстояние и есть distantia cristarum; оно в среднем равняется 28-29 см (рис. 4.11, б). 3. Distantia trochanferica – расстояние между большими вертелами бедренных костей. Отыскивают наиболее выдающиеся точки больших вертело! и прижимают к ним пуговки тазомера. Этот размер равен 31-32 см (рис 4.11, в). Имеет значение также соотношение между поперечными размерами Например, в норме разница между ними равна 3 см; разница менее 3 а указывает на отклонение от нормы в строении таза. 4. Conjugata externa – наружная конъюгата, т.е. прямой размер таза Женщину укладывают на бок, нижележащую ногу сгибают в тазобедреннои и коленном суставах, вышележащую вытягивают. Пуговку одной ветви тазомера устанавливают на середине верхнена ружного края симфиза, другой конец прижи мают к надкрестцовой ямке, которая находите между остистым отростком V поясничного пс звонка и началом среднего крестцового гребн (надкрестцовая ямка совпадает с верхним угло: крестцового ромба).


 Рис.4.11. Измерение поперечных размеров таза.
а – distantia spinarum; б – distantia cristarum; в – distantia trochanterica.
Рис.4.11. Измерение поперечных размеров таза.
а – distantia spinarum; б – distantia cristarum; в – distantia trochanterica.
Верхненаружный край симфиза определя ется легко; для уточнения расположения нал крестцовой ямки скользят пальцами по остис тым отросткам поясничных позвонков по на правлению к крестцу; ямка легко определяете осязанием под выступом остистого отростк последнего поясничного позвонка. Наружна конъюгата в норме равна 20-21 см (рис. 4.12) 1. Наружная конъюгата имеет важное зна чение – по ее величине можно судить размере истинной конъюгаты. Для опре деления истинной конъюгаты из длит наружной конъюгаты вычитают 9 сл Например, если наружная конъюгат равна 20 см, то истинная конъюгат равна 11 см; если наружная конъюгат имеет длину 18 см, то истинная равна см и т.д. Разница между наружной и истинной конъюгатой зависит от толщин! крестца, симфиза и мягких тканей. Толщина костей и мягких тканей женщин различна, поэтому разница между размером наружной и истинно] конъюгат не всегда точно соответствует 9 см. Истинную конъюгату мож№ более точно определить по диагональной конъюгате. Диагональной конъюгатой (conjugata diagonalis) называется расстояние о нижнего края симфиза до наиболее выдающейся точки мыса крестца. Диа тональную конъюгату определяют при влагалищном исследовании женщи ны, которое производят с соблюдением всех правил асептики и антисептики II и III пальцы вводят во влагалище, IV и V сгибают, тыл их упирается промежность. Введенные во влагалище пальцы фиксируют на верхушк мыса, а ребром ладони упираются в нижний край симфиза (рис. 4.13, а,б) После этого II пальцем другой руки отмечают место соприкосновение исследующей руки с нижним краем симфиза. Не отнимая II пальца о намеченной точки, руку, находящуюся во влагалище, извлекают, и ассистен измеряет тазомером или сантиметровой лентой расстояние от верхушки II пальца до точки, соприкасающейся с нижним краем симфиза. 2. Диагональная конъюгата при нормальном тазе равняется в среднее 12,5-13 см. Для определения истинной конъюгаты из размера диаго налъной конъюгаты вычитают 1,5-2 см.
 Рис.4.12. Измерение наружной конъюгаты (conjugata externa).
Рис.4.12. Измерение наружной конъюгаты (conjugata externa).
Измерить диагональную конъюгату удается не всегда, потому что npi нормальных размерах таза мыс не достигается или прощупывается с трудом.
 Рис. 4.13. Измерение диагональной конъюгаты (а, б).
Рис. 4.13. Измерение диагональной конъюгаты (а, б).
Если концом вытянутого пальца мыса нельзя достигнуть, объем данного таза можно считать нормальным или близким к норме. Поперечные размеры таза и наружную конъюгату измеряют у всех без исключения беременных и рожениц.
Если при обследовании женщины возникает подозрение на сужение выхода таза, то определяют размеры данной полости.
Размеры выхода таза определяют следующим образом. Женщина лежит на спине, ноги согнуты в тазобедренных и коленных суставах, разведены в сторону и подтянуты к животу.
Прямой размер выхода таза измеряют обычным тазомером. Одну пуговку тазомера прижимают к середине нижнего края симфиза, другую – к верхушке копчика. Полученный размер (11 см) больше истинного. Для определения прямого размера выхода таза следует из этой величины вычесть 1,5 см (учитывая толщину тканей). В нормальном тазу прямой размер равен 9,5 см.
Поперечный размер выхода таза измеряют сантиметровой лентой или тазомером с перекрещивающимися ветвями. Прощупывают внутренние поверхности седалищных бугров и измеряют расстояние между ними. К полученной величине нужно прибавить 1 – 1,5 см, учитывая толщину мягких тканей, находящихся между пуговками тазомера и седалищными буграми. Поперечный размер выхода нормального таза составляет 11 см.
Известное клиническое значение имеет определение формы лобкового угла. При нормальных размерах таза он равен 90-100°. Форму лобкового угла определяют следующим приемом. Женщина лежит на спине, ноги согнуты и подтянуты к животу. Ладонной стороной большие пальцы прикладывают вплотную к нижнему краю симфиза. Расположение пальцев позволяет судить о величине угла лобковой дуги.
Косые размеры таза приходится измерять при кососуженном тазе. Для; выявления асимметрии таза измеряют следующие косые размеры: 1. расстояние от передневерхней ости подвздошной кости одной стороны до задневерхней ости другой стороны и наоборот; 2. расстояние от верхнего края симфиза до правой и левой задневерхних остей; 3. расстояние от надкрестцовой ямки до правой или левой передневерхних остей.
Косые размеры одной стороны сравнивают с соответствующими косыми размерами другой. При нормальном строении таза величина парных косых1 размеров одинакова. Разница, превышающая 1 см, указывает на асимметрию таза.
При необходимости получить дополнительные данные о размерах таза,соответствии его величине головки плода, деформациях костей и их соединений проводят рентгенологическое исследование таза (по строгим показаниям). Рентгенопельвиометрию осуществляют в положении женщины лежа на спине и на боку, что позволяет установить форму крестца, лобковых и других костей; специальной линейкой определяют поперечные и прямые размеры таза. Измеряют также головку плода и на этом основании судят о соответствии ее величины размерам таза. О размерах таза и соответствии его величине головки можно судить по результатам ультразвукового исследования.
 Рис. 4.14. Измерение окружности запястья в области лучезапястного сустава (индекс Соловьева).
Рис. 4.14. Измерение окружности запястья в области лучезапястного сустава (индекс Соловьева).
При наружном тазоизмерении трудно учесть толщину костей таза. Известное значение имеет измерение сантиметровой лентой окружности лучезапястного сустава беременной (индекс Соловьева; рис. 4.14). Средняя величина этой окружности 14 см. Если индекс больше, можно предположить, что кости таза массивные и размеры его полости меньше, чем можно было бы ожидать по данным измерения большого таза.
Пальпация живота является одним из основных методов акушерского исследования. Она производится в положении беременной на спине с ногами, согнутыми в тазобедренных и коленных суставах. Этим устраняется напряжение брюшной стенки и облегчается прощупывание органов брюшной полости, особенно матки и расположенного в ней плода. Врач сидит справа от беременной лицом к ней.
Пальпацию живота начинают с определения состояния и эластичности брюшной стенки, состояния прямых мышц живота (нет ли их расхождения, грыжевых выпячиваний и пр.). Анатомическое и особенно функциональное состояние брюшной стенки играет большую роль в нормальном течении родов.
Затем переходят к определению величины матки, ее функционального состояния (тонус, напряжение при исследовании и пр.) и положения плода в полости матки.
Выяснение положения плода в полости матки имеет исключительное значение для ведения беременности и родов. При исследовании беременных и рожениц определяют членорасположение, положение, позицию, вид, предлежание плода.
Членорасположение плода (habitus) – отношение его конечностей к головке и туловищу. При типичном нормальном членорасположении туловище согнуто, головка наклонена к грудной клетке, ножки согнуты в тазобедренных и коленных суставах и прижаты к животу, ручки скрещены на грудной клетке. При нормальном сгибательном типе членорасположения плод имеет форму овоида, длина которого при доношенной беременности равна в среднем 25-26 см. Широкая часть овоида (тазовый конец плода) располагается в дне матки, узкая часть (затылок) обращена ко входу в малый таз. Движения плода приводят к кратковременному изменению положения конечностей, но не нарушают характерного членорасположения. Нарушение типичного членорасположения (разгибание головки и др.) встречается в 1-2 % родов и затрудняет их течение.
Положение плода (situs) – отношение продольной оси плода к продольной оси (длиннику) матки.
Различают следующие положения: 1. продольное (situs longitudinalis; рис. 4.15, а,б,в) – продольная ось плода и продольная ось матки совпадают, ось плода – линия, проходящая от затылка до ягодиц; 2. поперечное (situs transversus; рис. 4.16) – продольная ось плода пересекает продольную ось матки под прямым углом; 3. косое (situs obliquus) – продольная ось плода образует с продольной осью матки острый угол.
Продольное положение плода является нормальным, оно бывает в 99,5 % всех родов. Поперечное и косое положения патологические, встречаются в 0,5 % родов. При поперечном и косом положениях возникают непреодолимые препятствия для рождения плода.
Позиция плода (positio) – отношение спинки плода к правой или левой стороне матки. Различают две позиции: первую и вторую. При первой позиции спинка плода обращена к левой стороне матки, при второй – к правой. Первая позиция встречается чаще, чем вторая, что объясняется поворотом матки левой стороной кпереди. Спинка плода не всегда обращена вправо или влево, она обычно несколько повернута кпереди или кзади, поэтому различают вид позиции.
Вид позиции (visus) – отношение спинки плода к передней или задней стенке матки. Если спинка обращена кпереди, говорят о переднем виде позиции, если кзади – о заднем виде.
Предлежание плода (ргаesentatio) – отношение крупной части плода (головки или ягодиц) ко входу в малый таз. Если над входом в таз матери находится головка плода – предлежание головное, если тазовый конец – предлежание тазовое. Головное предлежание встречается в 96 % родов, тазовое – в 3,5 %.
При поперечных и косых положениях плода позиция определяется не по спинке, а по головке: головка слева – первая позиция, справа – вторая позиция.
Предлежащей частью (pars praevia) называется та часть плода, которая расположена у входа в малый таз и первой проходит через родовые пути.
 Рис. 4.16. Поперечное положение, первая позиция, передний вид.
Рис. 4.16. Поперечное положение, первая позиция, передний вид.
При головном предлежании ко входу в малый таз могут быть обращены затылок (затылочное предлежание), темя (переднелобное), лоб (лобное), личико (лицевое предлежание) плода. Типичным является затылочное предлежание (сгибательный тип). При переднеголовном, лобном и лицевом предлежаниях головка находится в различной степени разгибания. Разгибательный тип предлежания встречается в 1 % всех продольных положений плода.
При тазовом предлежании ко входу в таз матери могут быть обращены ягодицы плода (чистое ягодичное предлежание), ножки плода (ножное предлежание), ягодицы вместе с ножками (смешанное ягодично-ножное предлежание).
При пальпации живота пользуются так называемыми наружными приемами акушерского исследования (приемы Леопольда). Леопольд (1891) ввел пальпацию живота в систему и предложил типические приемы пальпации, получившие всеобщее признание.
Первый прием наружного акушерского исследования (рис. 4.17). Цель его – определить высоту стояния дна матки и часть плода, находящуюся в ее дне.
Методика исследования. Ладонные поверхности обеих рук располагают на матке таким образом, чтобы они плотно охватывали ее дно с прилегающими областями углов матки, а пальцы были обращены ногтевыми фалангами друг к другу. Чаще всего в конце беременности (в 96 % случаев) в дне матки определяются ягодицы. Обычно отличить их от головки нетрудно по менее выраженной округлости и сферичности, меньшей плотности и менее гладкой поверхности (см. далее).
Первый наружный прием акушерского исследования дает возможность судить о сроке беременности (по высоте стояния дна матки), о положении плода (если одна из крупных его частей в дне матки – значит, имеется продольное положение) и о предлежании (если в дне матки ягодицы – значит предлежащей частью является головка).
Второй прием наружного акушерского исследования (рис. 4.18). Цель его – определить позицию плода, о которой судят по месту нахождения спинки и мелких частей плода (ручек, ножек).
Методика исследования. Руки спускают со дна матки на правую и левую ее стороны до уровня пупка и ниже. Бережно надавливая ладонями и пальцами обеих рук на боковые стенки матки, определяют, в какую сторону обращены спинка и мелкие части плода. Спинка при этом распознается по ее широкой и изогнутой поверхности. При надавливании на крупную часть, находящуюся в дне матки, в сторону лона туловище плода сгибается, вследствие чего спинка становится более доступной для исследования. Мелкие части плода определяются с противоположной стороны в виде мелких, подвижных бугров. У многорожавших женщин вследствие дряблости брюшной стенки и мускулатуры матки мелкие части плода прощупываются легче. Иногда их движение видно на глаз.
Второй наружный прием акушерского исследования позволяет также определить состояние круглых маточных связок, их болезненность, толщину, напряженность, симметричность правой и левой связок, их расположение по отношению к матке. При этом, если связки сходятся кверху, плацента расположена на задней стенке матки, если они расходятся или идут параллельно друг к другу, плацента расположена на передней стенке матки.
Далее определяют реакцию различных отделов матки (правой и левой ее половины, тела и нижнего сегмента) на физическое раздражение: осторожно надавливая на матку пальцами обеих рук, следят за силой вызванных этим приемом сокращений мускулатуры матки и ее болезненности. Эти данные, позволяющие судить о функциональном состоянии мышцы матки, играют особую роль во время родов.
Пальпаторно обнаруживаемая флюктуация в матке при больших размерах живота свидетельствует о многоводии.
По тому, в какую сторону обращена спинка плода, распознается его позиция: спинка влево – первая позиция, спинка вправо – вторая позиция.
Если при этом исследовании удалось ощутить движение мелких частей плода, можно считать, что плод жив.
Третий прием наружного акушерского исследования (рис. 4.19). Цель его – определить характер предлежащей части и ее отношение к малому тазу.
Методика исследования. Одной, обычно правой, рукой охватывают предлежащую часть, после чего осторожно производят движения этой рукой вправо и влево. Этот прием позволяет определить характер предлежащей части (головка или ягодицы), отношение предлежащей части ко входу в малый таз (если она подвижна, то находится над входом в таз, если же неподвижна, – то во входе в таз или в более глубоких отделах малого таза).
Четвертый прием наружного акушерского исследования (рис. 4.20). Цель его – определить предлежащую часть (головка или ягодицы), место нахождения предлежащей части (над входом в малый таз, во входе или глубже, где именно), в каком положении находится предлежащая головка (в согнутом или разогнутом).
Методика исследования. Исследующий становится лицом к ногам беременной или роженицы и кладет руки плашмя по обе стороны нижнего отдела матки. Пальцами обеих рук обращенными ко входу в таз, он осторожно и медленно проникает между предлежащей частью и боковыми отделами входа в таз и пальпирует доступные участки предлежащей части.
В случае, если предлежащая часть подвижна над входом в таз, пальцы обеих рук почти целиком могут быть подведены под нее, особенно у многорожавших женщин. При этом определяется также наличие или отсутствие симптома баллотирования, характерного для головки. Для этого кисти обеих исследующих рук плотно прижимают ладонными поверхностями к боковым отделам головки; затем правой рукой производят толчок в области правой половины головки. При этом головка отталкивается влево и передает толчок противоположной – левой руке (простое баллотирование). После этого, быстро возвращаясь в исходное положение, головка сообщает иногда толчок правой руке (двойное баллотирование).
При головном предлежании следует стремиться получить представление о размерах головки и плотности костей черепа, о месте нахождения затылка, лба и подбородка, а также об их отношении друг к другу (характер предлежания).
С помощью четвертого приема можно определить наличие или отсутстт" вие угла между затылком и спинкой плода (чем выше подбородок при фиксированной во входе головке, тем яснее выражено сгибание и тем более сглажен угол между затылком и спинкой, и наоборот, чем ниже расположен подбородок, тем сильнее разогнута головка), позицию и вид плода – по тому, куда обращены затылок, лоб, подбородок. Например, затылок обращен влево и кпереди – первая позиция, передний вид; подбородок обращен влево и кпереди – вторая позиция, задний вид и т.д.
При головном предлежании необходимо также определить, в какой полости таза расположена головка своим большим сегментом.
Степень вставления головки плода в малый таз рекомендуется определять следующим образом. Проникнув при четвертом наружном приеме акушерского исследования пальцами обеих рук возможно глубже в таз и надавливая на головку, производят скользящее по ней движение в направлении к себе. При высоком стоянии головки плода, когда она подвижна над входом, можно при наружном исследовании подвести под нее пальцы обеих рук и даже отодвинуть ее от входа (рис. 4.21). Если при этом пальцы рук расходятся, головка находится во входе в малый таз малым сегментом (рис. 4.22). Если скользящие по головке кисти рук сходятся, то головка либо расположена большим сегментом во входе, либо прошла через вход и опустилась в более глубокие отделы (плоскости) таза (рис. 4.23). Если же головка плода настолько глубоко проникает в полость малого таза, что полностью выполняет ее, то обычно прощупать головку наружными приемами уже не удается.
Аускультация. Выслушивание живота беременной и роженицы производится обычно акушерским стетоскопом. Акушерский стетоскоп отличается от обычного широкой воронкой, которая прикладывается к обнаженному животу женщины.
При аускультации живота определяются сердечные тоны плода. Кроме того, можно уловить другие звуки, исходящие из организма матери; биение брюшной аорты, совпадающие с пульсом женщины; "дующие" маточные шумы, которые возникают в крупных кровеносных сосудах, проходящих в боковых стенках матки (совпадают с пульсом женщины); неритмичные кишечные шумы.
К звуковым явлениям, исходящим от плода, относятся сердечные тоны плода, шум сосудов пуповины, глухие неритмичные толчкообразные движения плода. Аускультацию производят главным образом для определения сердечных тонов плода, которые служат достоверным признаком беременности. Путем выслушивания сердечных тонов также выясняют состояние плода, что имеет особо важное значение во время родов.
Сердечные тоны плода прослушиваются стетоскопом с начала второй половины беременности (реже с 18-20 нед) и с каждым месяцем становятся отчетливее. Сердечные тоны плода прослушиваются в той стороне живота, куда обращена спинка плода, ближе к головке (рис. 4.24, а). Только при лицевых предлежаниях сердцебиение плода отчетливее выслушивается со стороны его грудной клетки. Это связано с тем, что при лицевом предлежании головка максимально разогнута и грудка прилегает к стенке матки ближе, чем спинка (рис. 4.24, б).
При затылочном предлежании сердцебиение хорошо прослушивается ниже пупка, слева – при первой позиции, справа – при второй (рис. 4.24, в). При тазовом предлежании сердцебиение выслушивается на уровне или выше пупка.
При поперечных положениях сердцебиение прослушивается на уровне пупка ближе к головке плода.
При многоплодной беременности сердцебиение плодов обычно выслушивается отчетливо в разных отделах матки.
Во время родов при опускании головки плода в полость таза и ее рождении сердцебиение лучше прослушивается ближе к симфизу, почти по средней линии живота.
 Рис. 4.21. Затылочное предлежание. Головка над входом в малый таз (пальцы обеих рук могут быть подведены под головку).
Рис. 4.21. Затылочное предлежание. Головка над входом в малый таз (пальцы обеих рук могут быть подведены под головку).
 Рис. 4.22. Затылочное предлежание. Головка во входе в малый таз малым сегментом (пальцы обеих рук, скользящие по головке, расходятся по направлению стрелок).
Рис. 4.22. Затылочное предлежание. Головка во входе в малый таз малым сегментом (пальцы обеих рук, скользящие по головке, расходятся по направлению стрелок).
 Рис. 4.23. Затылочное предлежание. Головка во входе в малый таз большим сегментом (пальцы обеих рук, скользящие по головке, сходятся по направлению стрелок).
Рис. 4.23. Затылочное предлежание. Головка во входе в малый таз большим сегментом (пальцы обеих рук, скользящие по головке, сходятся по направлению стрелок).
 Рис. 4.24. Выслушивание сердеч-ных тонов плода.
а – со стороны спинки; б – со стороны грудной клетки; в – в зависимости от предлежания плода и его позиции: 1 – первая позиция, передний вид затылочного предлежания, 2 – вторая позиция, передний вид затылочного предлежания, 3 – первая позиция, передний вид тазового предлежания, 4 – вторая позиция, передний вид тазового предлежания.
Рис. 4.24. Выслушивание сердеч-ных тонов плода.
а – со стороны спинки; б – со стороны грудной клетки; в – в зависимости от предлежания плода и его позиции: 1 – первая позиция, передний вид затылочного предлежания, 2 – вторая позиция, передний вид затылочного предлежания, 3 – первая позиция, передний вид тазового предлежания, 4 – вторая позиция, передний вид тазового предлежания.
Самым достоверным методом определения жизни и смерти плода является УЗИ. Оценка жизнедеятельности эмбриона в ранние сроки основывается на регистрации его сердечной деятельности и двигательной активности. Определение сердечной деятельности эмбриона (пульсации сердца) возможно с 3-4 нед. Сердечную деятельность плода в ранние сроки удается определить у 50 % женщин до 6-7 нед беременности, у 95 % – на 8-й неделе и у 100 % – после 8-й недели беременности.
Используют и другие методы определения характера сердечных тонов плода: фонокардиография и кардиотокография (см. раздел 4.5).
Определение срока беременности.
Предоставление листка нетрудоспособности беременным и родильницам
Определение срока беременности. Для определения срока беременности и родов имеют значение сведения из анамнеза о времени последней менструации и первого шевеления плода.
О сроке беременности можно судить на основании учета времени, прошедшего с первого дня последней менструации до момента, когда определяется срок. Для этого определяют срок овуляции, с которым обычно совпадает начало беременности. Для того чтобы определить это время, врачу необходимо иметь сведения о дне ожидавшейся, но не наступившей менструации. От первого дня ожидавшейся (не наступившей) менструации отсчитывают назад 14-16 дней и таким образом определяют возможное время овуляции.
При определении срока беременности и родов учитывают время первого шевеления плода, которое ощущается первородящими с 20-й недели, т.е. с середины беременности, повторнородящими – примерно на 2 нед раньше. Первое шевеление плода – признак субъективный и значительно менее важный, чем дата последней менструации. Женщина нередко забывает срок первого шевеления плода или ошибочно определяет эту дату, приняв за движение плода перистальтику кишечника. Время шевеления плода учитывается только как вспомогательный признак.
Для ускорения подсчета срока беременности по менструации, овуляции и первому движению плода имеются специальные акушерские календари и линейки.
Для распознавания срока беременности и выяснения даты родов большое значение имеют данные объективного обследования: определение величины матки, объема живота и высоты дна матки, длины плода и размеров головки.
Величина матки и высота ее стояния в различные сроки беременности (рис. 4.25). В конце 1-го акушерского месяца беременности (4 нед) величина матки достигает приблизительно размера куриного яйца.
В конце 2-го акушерского месяца беременности (8 нед) величина матки приблизительно соответствует размерам гусиного яйца.
В конце 3-го акушерского месяца (12 нед) размер матки достигает величины головки новорожденного, ее асимметрия исчезает, матка заполняет верхнюю часть полости таза, дно ее доходит до верхнего края лобковой дуги.
Начиная с 4-го месяца беременности дно матки прощупывается через брюшную стенку, и о сроке беременности судят по высоте стояния дна матки. При этом следует помнить, что на высоту стояния дна матки могут влиять размер плода, избыточное количество околоплодных вод, многоплодие, неправильное положение плода и другие особенности течения беременности. Поэтому высота стояния дна матки при определении срока беременности учитывается в совокупности с другими признаками (дата последней менструации, первого шевеления плода и др.).
 Рис. 4.25. Высота стояния дна матки при различных сроках беременности.
Рис. 4.25. Высота стояния дна матки при различных сроках беременности.
В конце 4-го акушерского месяца (16 нед) дно матки располагается на середине расстояния между лобком и пупком (на 4 поперечных пальца выше симфиза).
В конце 5-го акушерского месяца (20 нед) дно матки на 2 поперечных пальца ниже пупка; заметно выпячивание брюшной стенки.
В конце 6-го акушерского месяца (24 нед) дно матки находится на уровне пупка.
В конце 7-го акушерского месяца (28 нед) дно матки определяется на 2-3 пальца выше пупка.
В конце 8-го акушерского месяца (32 нед) дно матки стоит посередине между пупком и мечевидным отростком. Пупок начинает сглаживаться. Окружность живота на уровне пупка 80-85 см.
В конце 9-го акушерского месяца (38 нед) дно матки поднимается до мечевидного отростка и реберных дуг – это наивысший уровень стояния дна беременной матки, окружность живота 90 см. Пупок сглажен.
В конце 10-го акушерского месяца (40 нед) дно матки опускается до уровня, на котором оно находилось в конце 8-го месяца, т.е. до середины расстояния между пупком и мечевидным отростком. Пупок выпячивается. Окружность живота 95-98 см, головка плода опускается, у первобеременных прижимается ко входу в малый таз или стоит малым сегментом во входе в малый таз.
Эхографическое определение срока беременности.
Большое значение в определении срока беременности имеет эхография. В I триместре беременности, когда эмбрион еще не виден или нечетко визуализируется, определение срока беременности основывается на измерении плодного яйца, его среднего внутреннего диаметра. После 5-6 нед беременности, когда с помощью трансабдоминальной эхографии возможна визуализация эмбриона (при трансвагинальном сканировании верифицировать эмбрион удается с 3_4 нед беременности от момента зачатия), основным параметром для точного ультразвукового определения срока беременности является копчико-теменной размер (КТР) эмбриона. Во II и III триместрах беременности срок беременности устанавливается на основании определения различных фетометрических параметров: бипариетального размера (БПР) и окружности головки (ОГ), средних диаметров грудной клетки и живота, окружности живота (ОЖ), длины бедренной кости. Из всех возможных измерений во II триместре беременности БПР и окружность головки наиболее информативны для определения гестационного возраста плода. Чем больше срок беременности, тем меньше точность определения гестационного возраста плода вследствие вариабельности его размеров. Оптимальным для определения срока беременности считается ультразвуковое исследование до 24 нед беременности. Численные значения основных фетометрических показателей с учетом срока беременности представлены в табл. 4.1.
Продолжительность беременности и определение даты родов.
Определение истинной продолжительности беременности затруднительно в связи с тем, что сложно установить точный срок овуляции, время передвижения сперматозоидов и оплодотворения. Поэтому данные о продолжительности беременности разноречивы. Описаны случаи рождения зрелых детей при беременности, продолжавшейся 230-240 дней; наряду с этим встречались случаи весьма значительного удлинения срока беременности (переношенная беременность, запоздалые роды); известны наблюдения, когда беременность продолжалась свыше 300 дней (310-320 дней и более). Однако в большинстве случаев беременность продолжается 10 акушерских (лунных, по 28 дней) месяцев, или 280 дней, если исчислять ее начало от первого дня последней менструации.
А Для определения срока родов к первому дню последней менструации прибавляют 280 дней, т.е. 10 акушерских, или 9 календарных, месяцев. Обычно расчет срока родов производят проще: от даты первого дня последней менструации отсчитывают назад 3 календарных месяца и прибавляют 7 дней. Например, если последняя менструация началась 2 октября, то, отсчитав назад 3 мес (2 сентября, 2 августа и 2 июля) и прибавив 7 дней, определяют ожидаемую дату родов – 9 июля; если последняя менструация началась 20 мая, то предполагаемый срок родов 27 февраля и т.д.
Предполагаемый срок родов можно вычислить по овуляции: от первого дня ожидавшейся, но не наступившей менструации отсчитывают назад 14-16 дней и к найденной дате прибавляют 273-274 дня.
При определении срока родов учитывают также время первого шевеления плода. К дате первого шевеления прибавляют 5 акушерских месяцев у первобеременньгх, 5,5 акушерских месяцев у повторнобеременных и получают предполагаемый срок родов. Однако следует помнить, что этот признак имеет лишь вспомогательное значение.
Определить срок родов помогают данные объективного исследования: измерение длины плода и размеров его головки, окружности живота беременной, высоты стояния дна матки, степень ее возбудимости (при пальпации, введении малых доз окситоцина и других раздражениях матка сильно сокращается).
Предоставление листка нетрудоспособности беременным и родильницам.
Беременные в нашей стране пользуются многими льготами.
С момента установления беременности женщины не допускаются к работе, связанной с неблагоприятными условиями труда, к работе в ночное время. Беременные работницы и служащие с 4-го месяца беременности не привлекаются к сверхурочной работе.
При переводе на облегченную работу за беременной сохраняется заработная плата из расчета последних 6 мес.
Предоставляемые льготы способствуют правильному течению беременности и развитию плода в благоприятных условиях. Полное использование беременными всех указанных льгот зависит от своевременного и правильного определения сроков беременности в медицинских учреждениях. Это важно не только в отношении выяснения срока родов, но и для своевременного предоставления дородового отпуска.
Листок нетрудоспособности по беременности и родам выдается врачом акушером-гинекологом, а в его отсутствие – врачом, ведущим прием. 1. Выдача листка нетрудоспособности производится с 30 нед беременности единовременно продолжительностью 140 календарных дней. При многоплодной беременности листок нетрудоспособности по беременности и родам выдается с 28 нед беременности, при этом общая продолжительность дородового и послеродового отпуска составляет 180 дней. 2. При осложненных родах женщинам, в том числе и иногородним, листок нетрудоспособности выдается дополнительно на 16 календарных дней лечебно-профилактическим учреждением, где произошли роды. В этих случаях общая продолжительность дородового и послеродового отпуска составляет 156 календарных дней. 3. При родах, наступивших до 30 нед беременности, и рождении живого ребенка листок нетрудоспособности по беременности и родам выдается лечебно-профилактическим учреждением, где произошли роды, на 156 календарных дней, а в случае рождения мертвого ребенка или его смерти в течение 7 дней после родов – на 86 календарных дней. 4. Листок нетрудоспособности на дородовой отпуск продолжительностью 90 календарных дней выдается женщинам, проживающим в населенных пунктах, подвергшихся радиоактивному загрязнению. Общая продолжительность отпуска по беременности и родам составляет 160 дней. 5. Женщине, усыновившей новорожденного ребенка, листок нетрудо-способности выдает стационар по месту его рождения на 70 календарных дней со дня рождения.
При операции экстракорпорального оплодотворения и "подсадке эмбриона" листок нетрудоспособности выдается оперирующим врачом на период госпитализации до установления факта беременности.?
Признаки предшествующих родов
Определение признаков бывших родов имеет клиническое и судебно-медицинское значение. Этот вопрос решается на основании опроса и объективного исследования женщины. Изменения в организме женщины, связанные с беременностью и родовым актом, исчезают вскоре после родов, остаются только некоторые признаки, позволяющие определить ранее перенесенные беременности и роды.
К признакам бывших беременности и родов относятся: старые (белесоватые) рубцы беременности; понижение тонуса брюшной стенки (особенно после повторных родов); глубокие старые разрывы девственной плевы (carunculae murtiformes); рубцы в области бывших разрывов промежности и зияние половой щели; более широкое влагалище и менее выраженная складчатость его стенок по сравнению с влагалищем у нерожавших.
Очень важным признаком является изменение формы наружного зева шеечного канала и наличие вокруг него старых рубцов. У нерожавших женщин наружное отверстие канала шейки матки округлое, у рожавших – имеет вид поперечно расположенной щели, которая может быть деформирована рубцами (рис. 4.26). Нередко на шейке матки имеются глубокие старые боковые разрывы.
Дополнительные методы исследования в акушерстве и перинатологии
Методы получения информации о сердечной деятельности плода
Сердечная деятельность плода является наиболее точным и объективным показателем состояния плода в антеи интранатальном периодах.
Выслушивание сердцебиения плода применятся с XIX века [Mayer, 1818; Kargarades, 1822], вначале с помощью обычного стетоскопа, а в последующем – специального акушерского стетоскопа с широким раструбом. Однако недостаточная информативность аускультации побудила к разработке и изысканию более точных и объективных методов оценки сердечной деятельности плода.
Фоно- и электрокардиография
 Рис. 4.26. Шейка матки нерожавшей женщины (а) и рожавшей (б)
Рис. 4.26. Шейка матки нерожавшей женщины (а) и рожавшей (б)
Наиболее распространенными методами оценки сердечной деятельности плода являются электрокардиографическое и фонокардиографическое исследования. Этому во многом способствовали работы отечественных и зарубежных ученых (Л.И.Шванг, А.Б.Кречетов, И.В.Ильин, Л.С.Персианинов).
Г.М.Савельева, Т.В.Червакова, К.В.Чачава, M.Hon, О.Hess, S.Larks, C.Sureau и др. выделяют непрямую и прямую электрокардиографию плода.
Непрямую электрокардиографию проводят при наложении электродов на переднюю брюшную стенку беременной (нейтральный электрод расположен на бедре). Этот метод используют преимущественно в антенатальном периоде. В норме на электрокардиограмме (ЭКГ) отчетливо виден желудочковый комплекс QRS, иногда зубец Р. Материнские комплексы легко отдифференцировать при одновременной регистрации ЭКГ матери.
ЭКГ плода можно регистрировать с 11 – 12-й недели беременности, однако в 100 % случаев она может быть зарегистрирована лишь к концу III триместра. Как правило, непрямую электрокардиографию используют после 32 нед беременности.
Прямую электрокардиографию производят непосредственно с головки плода во время родов при открытии шейки матки на 3 см и более. Прямая ЭКГ характеризуется наличием предсердного зубца Р, желудочкового комплекса QRS и зубца Т.
При анализе антенатальной ЭКГ определяют частоту сердечных сокращений, характер ритма, величину и продолжительность желудочкового комплекса, а также его форму. Внорме ритм плода правильный, частота сердечных сокращений колеблется от 120 до 160 в минуту, а зубец Р заострен, продолжительность желудочкового комплекса 0,03-0,07 с, а вольтаж 9-65 мкВ. С увеличением срока беременности отмечается постепенное повышение вольтажа желудочкового комплекса.
Фонокардиограмма (ФКГ) плода регистрируется при наложении микрофона в точку наилучшего прослушивания стетоскопом его сердечных тонов. Она обычно представлена двумя группами осцилляции, которые отражают I и II тоны сердца. Иногда регистрируются III и IV тоны. Колебания продолжительности и амплитуды тонов сердца весьма вариабельны в III триместре беременности и составляют в среднем: I тон – 0,09 с (от 0,06 до 0,13 с), II тон 0,07 с (от 0,05 до 0,09 с).
При одновременной регистрации ЭКГ и ФКГ плода можно рассчитывать продолжительность фаз сердечного цикла: фазы асинхронного сокращения (АС), механической систолы (St), общей систолы (So), диастолы (D). Фаза асинхронного сокращения выявляется между началом зубца Qui тоном, длительность ее 0,02-0,05 с. Механическая систола представляет собой расстояние между началом I и II тона и продолжается от 0,15 до 0,22 с. Общая систола включает механическую систолу и фазу асинхронного сокращения; она составляет 0,17-0,26 с. Диастола, высчитываемая как расстояние между началом II и I тона, составляет 0,15-0,25 с. Важно также вычисление отношения длительности общей систолы к длительности диастолы, которые в конце неосложненной беременности составляют в среднем 1,23.
Однако, несмотря на высокую информативность, метод плодовой электрокардиографии и фонокардиографии является трудоемким, а анализ полученных данных требует длительного времени, что ограничивает их использование для быстрой оценки состояния плода. В связи с этим в настоящее время в акушерской практике широко используется кардиотокография.
 Рис. 4.27. Общий вид кардиомонитора.
Рис. 4.27. Общий вид кардиомонитора.
Кардиотокография
Современные кардиомониторы плода основаны на принципе Допплера. Такие кардиомониторы позволяют регистрировать изменение интервалов между отдельными циклами сердечной деятельности плода. Приборы оснащены также датчиками, позволяющими регистрировать одновременно сократительную деятельность матки и движения плода (рис. 4.27). Различают непрямую (наружную) и прямую (внутреннюю) кардиотокографию. Во время беременности используется только непрямая кардиотокография; она же в настоящее время наиболее распространена и в родах, так как применение наружных датчиков практически не имеет противопоказаний и не вызывает каких-либо осложнений.
Наружный ультразвуковой датчик помещают на переднюю брюшную стенку матери в месте наилучшей слышимости сердечных тонов плода, а наружный тензометрический датчик накладывают в области правого угла матки. При использовании во время родов внутреннего метода регистрации специальный спиралевидный электрод закрепляют на коже головки плода.
Изучение кардиотокограммы (КТГ) начинают с определения базального ритма (рис. 4.28). Под базальным ритмом понимают среднюю величину между мгновенными значениями сердцебиения плода, сохраняющуюся неизменной 10 мин и более, при этом не учитывают акцелерации и децелерации. Нормальный базальный ритм составляет 120-160 уд/мин (в среднем 140-145 уд/мин). Снижение базального ритма ниже 120 уд/мин расценивают как брадикардию, а увеличение более 160 уд/мин – как тахикардию.
При характеристике базального ритма необходимо учитывать его вари-абельность, т.е. частоту и амплитуду мгновенных изменений частоты сердечных сокращений плода (мгновенные осцилляции). Подсчет частоты и амплитуды мгновенных осцилляции проводят в течение каждых последующих 10 мин. Амплитуду осцилляции определяют по величине отклонения от базального ритма, частоту – по количеству осцилляции за 1 мин.
 Рис. 4.28. Кардиотокограмма при неосложненной беременности.
Рис. 4.28. Кардиотокограмма при неосложненной беременности.
В клинической практике наибольшее распространение получила следующая классификация типов вариабельности базального ритма: 1. немой (монотонный) ритм, характеризующийся низкой амплитудой, – 0,5 уд/мин; 2. слегка ундулирующий – 5-10 уд/мин; 3. ундулируюший – 10-15 уд/мин; 4. сальтаторный – 25 – 30 уд/мин.
Вариабельность амплитуды мгновенных осцилляции может сочетаться с изменением их частоты (в норме 7-12 осцилляции в минуту).
Кардиотокография является одним из ведущих методов оценки состояния плода в антенатальном периоде (с 28-30-й недели беременности). Получить стабильную, качественную запись, позволяющую правильно охарактеризовать состояние плода, можно только с 32 нед беременности, так как у плода к 32 нед происходит становление цикла активность – покой. Запись необходимо проводить в положении женщины на левом боку в течение 40-60 мин.
Существуют различные методы визуальной интерпретации КТГ. Для стандартизации оценки данных кардиотокографии следует придерживаться единой классификации, предложенной Международной ассоциацией акушеров-гинекологов в 1985 г.
В антенатальном периоде КТГ следует классифицировать как нормальные, пограничные и патологические.
Критериями нормальной КТГ являются следующие признаки: 1. базальный ритм в пределах 120-160 уд/мин; 2. амплитуда вариабельности базального ритма – 5-25 уд/мин; 3. децелерация отсутствует или отмечаются спорадические, неглубокие и очень короткие денелерации; 4. регистрируются 2 акцелерации и более на протяжении 10 мин записи.
Если такой тип КТГ обнаружен даже за короткий период исследования, то запись можно не продолжать.
Для унификации и упрощения трактовки данных антенатальной КТГ предложена балльная система оценки (табл. 4.2).
Оценка 8-10 баллов свидетельствует о нормальном состоянии плода, 5-7 баллов – указывает на начальные признаки нарушения его жизнедеятельности, 4 балла и менее – на серьезные изменения состояния плода.
Помимо анализа сердечной деятельности плода в покое, с помощью кард иото ко графин можно оценивать реактивность плода во время беременности по изменению его сердечной деятельности в ответ на спонтанные шевеления – нестрессовый тест (НСТ) или стрессовый тест (СТ) на функциональные пробы: введение матери окситоцина или атропина, непродолжительная задержка дыхания на вдохе или выдохе, термическое раздражение кожи живота, физическая нагрузка матери, стимуляция сосков, акустическая стимуляция.
Начинать исследование сердечной деятельности плода целесообразно с применения НСТ.
Нестрессовый тест (НСТ).
Окситоциновый тест. Позднее этот тест стал называться контрактильным стрессовым тестом. Тест основан на реакции сердечно-сосудистой системы плода в ответ на индуцированные сокращения матки. Для проведения теста внутривенно вводят раствор окситоцина, содержащий 0,01 ЕД в 1 мл изотонического раствора натрия хлорида или 5 % раствора глюкозы. Тест можно оценивать, если в течение 10 мин при скорости введения 1 мл/мин наблюдается не менее 3 сокращений матки. При достаточных компенсаторных возможностях фетоплацентарной системы в ответ на сокращение матки наблюдается нерезко выраженная кратковременная акцелерация или ранняя непродолжительная децелерация.
 Рис. 4.29. Положительный нестрессовый тест. Стрелками показаны движения плода.
Рис. 4.29. Положительный нестрессовый тест. Стрелками показаны движения плода.
Противопоказания к проведению окситоцинового теста: патология прикрепления плаценты и ее частичная преждевременная отслойка, угроза прерывания беременности и наличие рубца на матке.
Проба со стимуляцией сосков является более безопасным, простым и экономичным контрактильным тестом. Метод заключается в раздражении одного соска (через одежду) в течение 2 мин или до появления сокращений матки. Если в ответ на раздражение соска не возникает 3 сокращений матки за 10-минутный интервал, проводится повторная стимуляция.
Звуковая стимуляция плода.
Тест разработан на основании наблюдений за изменениями сердцебиения плода в ответ на различные стимулы, включая звук. Наиболее часто используется электронная искусственная "гортань" для генерации звуковых сигналов со средним уровнем давления 82 дБ. Стимулирование производится через переднюю брюшную стенку матери около 3 с. Нормальной реакцией считается учащение сердцебиения плода на 15 ударов в минуту, длящееся не менее 15 с, не менее 2 раз в течение 10-минутного промежутка времени. В отсутствие заметного учащения сердцебиения после первого звукового воздействия производят повторные пробы с интервалом 1 мин (не более 3 стимуляций).
Атропиновый тест.
Возникновение и характер реакции плода на введение беременной атропина зависят от скорости проникновения препарата через плаценту, что связано с функциональным ее состоянием. Для проведения пробы 1,5 мл 0,1 % раствора атропина сульфата в 20 мл 40 % раствора глюкозы или 0,5 % раствора натрия хлорида вводят беременной внутривенно. До введения атропина запись частоты сердечных сокращений (ЧСС) производят в течение 15-20 мин, после введения – до возвращения ЧСС к исходному уровню. Физиологическая реакция сердечной деятельности плода под влиянием атропина проявляется в увеличении ЧСС на 25-35 в минуту и более, которое наступает через 4-10 мин и продолжается до 70 мин. Наряду с этим происходит снижение амплитуды мгновенных осцилляции и уменьшение или полное исчезновение акцелераций и децелераций, возникающих при маточных сокращениях.
Механизм действия атропина заключается в блокаде рецепторов парасимпатической части вегетативной нервной системы и повышении активности симпатико-адреналовой системы, следствием чего является тахикардия. Атропиновый тест применяют редко, так как развитие выраженной тахикардии может быть небезразлично для плода.
Физиологическая проба с задержкой дыхания на вдохе и выдохе.
При нормально протекающей беременности задержка дыхания на вдохе вызывает урежение, а на выдохе – учащение ЧСС. При внутриутробной гипоксии плода во время проведения проб наблюдаются парадоксальные реакции или отсутствие изменений ЧСС плода.
При определении состояния плода в родах преимущественно оценивают следующие параметры кардиотокограммы: базальный ритм частоты сердечных сокращений, вариабельность кривой, а также характер медленных ускорений (акцелерации) и замедлений (децелераций) сердечного ритма, сопоставляя их с данными, отражающими сократительную деятельность матки.
В зависимости от времени возникновения относительно сокращений матки выделяют 4 типа децелераций: dip 0, dip I, dip II, dip III. Наиболее важными параметрами децелераций являются время от начала схватки до возникновения урежения, продолжительность урежения и амплитуда. При исследовании временных соотношений КТГ и гистограмм различают ранние (начало урежения частоты сердцебиений совпадает с началом схватки), поздние (через 30-60 с после начала маточного сокращения) и урежения вне схватки (через 60 с и более).
Dip 0 обычно возникает в ответ на сокращения матки, реже спорадически, продолжается 20-30 с и имеет амплитуду 30 в минуту и более. Во втором периоде родов диагностического значения не имеет.
Dip I (ранняя децелерация) является рефлекторной реакцией сердечнососудистой системы плода в ответ на сдавление головки плода или пуповины во время схватки. Ранняя децелерация начинается одновременно со схваткой или с запаздыванием до 30 с и имеет постепенные начало и конец. Длительность и амплитуда децелераций соответствуют длительности и интенсивности схватки. Dip I одинаково часто встречается при физиологических и осложненных родах.
Dip II (поздняя децелерация) является признаком нарушения маточноплацентарного кровообращения и прогрессирующей гипоксии плода. Поздняя децелерация возникает в связи со схваткой, но значительно запаздывает – до 30-60 с от се начала. Общая продолжительность децелераций обычно составляет более 1 мин. Различают три степени тяжести децелераций: легкую (амплитуда урежения до 15 в минуту), среднюю (16-45 в минуту) и тяжелую (более 45 в минуту). Кроме амплитуды и общей продолжительности поздней децелераций, тяжесть патологического процесса отражает время восстановления базального ритма. По форме различают V-, Uи W-образные децелераций.
Dip III носит название вариабельной децелераций. Ее появление обычно связывают с патологией пуповины и объясняют стимуляцией блуждающего нерва и вторичной гипоксией. Амплитуда вариабельных децелераций колеблется от 30 до 90 в минуту, а общая продолжительность – 30-80 с и более. Вариабельные децелераций очень разнообразны по форме, что значительно затрудняет их классификацию. Тяжесть вариабельных децелераций зависит от амплитуды: легкие – до 60 в минуту, средней тяжести – от 61 до 80 в минуту и тяжелые – более 80 в минуту.
Для практической оценки состояния плода во время родов наиболее удобна оценка его состояния по схеме, предложенной Г.М.Савельевой (1981) (табл. 4.3).
При использовании кардиотокографии во время родов необходим мониторный принцип, т.е. постоянная диагностическая оценка на всем протяжении родов. Диагностическая ценность метода повышается при тщательном сопоставлении данных кардиотокографии с акушерской ситуацией и другими методами оценки состояния плода 4.3.2. Ультразвуковое сканирование (эхография)
В основе ультразвуковой диагностики лежит обратный пьезоэлектрический эффект. Ультразвуковые волны, отражаясь от разнородных структур изучаемого объекта, преобразуются в электрические импульсы и формируют на экране монитора изображение исследуемого объекта. В настоящее время в акушерстве отдано предпочтение ультразвуковым приборам, работающим в режиме реального времени. Преимущество использования данной системы заключается в возможности быстрого выбора плоскости оптимального сечения и непрерывного наблюдения за состоянием изучаемого объекта. В акушерской практике используются в основном линейные датчики частотой 3,5 и 5 МГц.
Ультразвуковое сканирование является высокоинформативным, безвредным методом исследования и позволяет проводить динамическое наблюдение за состоянием плода. Метод не требует специальной подготовки беременной. Только в ранние сроки и при подозрении на предлежание или низкое прикрепление плаценты необходимо достаточное наполнение мочевого пузыря (методика "наполненного" мочевого пузыря при трансабдоминальной эхографии – ТАЭ). Для этого беременной рекомендуют выпить 500-600 мл воды и воздержаться от мочеиспускания в течение некоторого времени. При необходимости экстренного обследования пациентке дают диуретики. Исследование осуществляют в положении беременной лежа на спине, предварительно смазав кожу обследуемого участка (переднюю брюшную стенку) звукопроводящим гелем.
Внедрение в кчиническую практику трансвагинальных акустических преобразователей с высокой разрешающей способностью (с частотой волновых колебаний 6,5 МГц и более) позволило коренным образом пересмотреть аспекты эхографической диагностики беременности, особенно в I триместре. Применение трансвагинальной эхографии (ТВЭ) способствует обнаружению акустических признаков беременности в более ранние сроки; обеспечивает возможность ранней диагностики осложнений беременности уже в I триместре и, следовательно, своевременной их коррекции; позволяет в более ранние сроки и с большей точностью изучить эмбриологию, оценить развитие органов и систем плода, а также обнаружить пороки их развития.
Установление беременности и оценка ее развития в ранние сроки являются важнейшими задачами ультразвуковой диагностики в акушерстве. Ультразвуковое исследование является в настоящее время единственным неинвазивным методом, позволяющим объективно наблюдать за развитием эмбриона с самых ранних этапов его развития.
Диагностика маточной беременности при ультразвуковом исследовании возможна с самых ранних сроков. С 3-й недели в полости матки начинает визуализироваться плодное яйцо в виде эхонегативного образования округлой или овоидной формы диаметром 5-6 мм. В 4-5 нед возможно выявление эмбриона – эхопозитивной полоски размером 6-7 мм. Головка эмбриона идентифицируется с 8-9 нед в виде отдельного анатомического образования округлой формы средним диаметром 10-11 мм. Рост эмбриона происходит неравномерно. Наиболее высокие темпы роста отмечаются в конце I триместра беременности.
Наиболее точным показателем срока беременности в I триместре является коггчико-теменной размер (КТР) (рис. 4.30). Ошибка при использовании копчико-теменного размера в установлении срока беременности в 80 % наблюдений не превышает 1 день, а в 20 % наблюдений – не больше 3 дней. Точность определения срока беременности возрастает при вычислении среднего арифметического трех последовательных измерений КТР. Когда эмбрион еще не виден или выявляется с трудом, целесообразно для определения срока беременности использовать средний внутренний диаметр плодного яйца. Ошибка в установлении срока беременности при этом не превышает 6 дней.
 Рис. 4.30. Определение копчико-теменного размера эмбриона.
Рис. 4.30. Определение копчико-теменного размера эмбриона.
Оценка жизнедеятельности эмбриона в ранние сроки беременности основывается на регистрации его сердечной деятельности и двигательной активности. При УЗИ регистрировать сердечную деятельность эмбриона можно с 4-5-й недели. Частота сердечных сокращений постепенно увеличивается от 150-160 в минуту в 5-6 нед до 175-185 в минуту в 7-8 нед с последующим снижением до 150-160 в минуту к 12 нед. Двигательная активность выявляется с 7-8 нед. Различают 3 вида движений: движения конечностями, туловищем и комбинированные движения. Отсутствие сердечной деятельности и двигательной активности указывает на гибель эмбриона.
Ультразвуковое исследование в I и II триместрах беременности позволяет диагностировать неразвивающуюся беременность, анэмбрионию, различные стадии самопроизвольного выкидыша, пузырный занос, внематочную беременность, аномалии развития матки, многоплодную беременность. Особую ценность имеет ультразвуковой контроль за развитием беременности при миоме матки и опухолях яичников.
При изучении развития плода во II и III триместрах беременности основное внимание следует уделять измерению следующих фетометрических параметров: бипариетальный размер (БПР) и окружность головки, средние диаметры грудной клетки и живота, а также длина бедренной кости. Определение БПР головки плода следует производить только при наилучшей визуализации срединных структур мозга (М-эхо), измеряя расстояние между наиболее удаленными точками на наружной поверхности верхнего контура теменной кости и внутренней поверхности нижнего контура. Измерение среднего диаметра и окружности грудной клетки и живота осуществляют соответственно на уровне створчатых клапанов сердца плода и в месте вхождения пупочной вены в брюшную полость. Для определения длины бедренной кости датчик необходимо сместить на тазовый конец плода и, меняя угол и плоскость сканирования, добиваться наилучшего изображения продольного сечения бедра. Измерять следует наибольшее расстояние между проксимальным и дистальным концами (рис. 4.32).
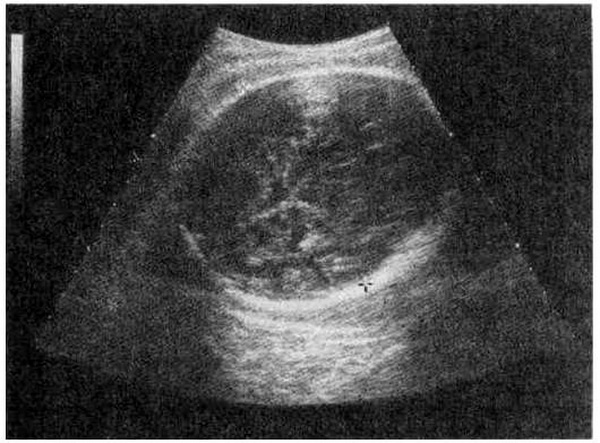 Рис. 4.31. Определение бипариетального размера головки плода.
Рис. 4.31. Определение бипариетального размера головки плода.
Для определения предполагаемой массы плода при ультразвуковом ис-следовании используют формулы, основанные на измерениях БПР и окружности головки и живота плода, длины бедра.
С применением современной ультразвуковой аппаратуры стало возможным проводить оценку деятельности различных органов и систем плода, а также антенатально диагностировать большинство врожденных пороков развития (см. Врожденные пороки развития плода).
В широкой клинической практике при исследовании сердца плода может быть с успехом использован срез сердца, получаемый при строго поперечном сканировании грудной клетки на уровне створчатых клапанов (рис. 4.33). При этом достаточно четко визуализируются правый и левый желудочки, правое и левое предсердия, межжелудочковая и межпредсердная перегородки, створки левого и правого предсердно-желудочковых клапанов и клапан овального отверстия. Необходимо отметить, что с конца II триместра и на протяжении III триместра беременности у плода наблюдается преобладание размеров правого желудочка над левым, что связано с особенностями внутриутробного кровообращения.
Использование эхографии позволяет четко идентифицировать желудок, надпочечники и мочевой пузырь, почки плода. Позвоночник плода визуализируется в виде отдельных эхопозитивных образований, соответствующих телам позвонков. Возможно определение всех отделов позвоночника, включая крестец и копчик.
 Рис. 4.33. Визуализация клапанов сердца плода.
Рис. 4.33. Визуализация клапанов сердца плода.
С 18-20-й недели беременности возможно определение пола плода. Правильность определения мужского пола при достаточном опыте исследователя приближается к 100 96, женского – до 96-98 %. Выявление плода женского пола основано на визуализации в поперечном сечении половых губ в виде двух валиков, мужского – на определении мошонки с яичками и/или полового члена.
 Рис. 4.34. Плацента на передней стенке матки.
Рис. 4.34. Плацента на передней стенке матки.
Использование УЗИ при исследовании плаценты позволяет точно установить ее локализацию, толщину и структуру (рис. 4.34). При сканировании в режиме реального времени, особенно при трансвагинальном исследовании, четкое изображение хориона возможно с 5-6 нед беременности.
Ультразвуковые признаки изменений в плаценте в зависимости от степени ее зрелости представлены в табл. 4.4.
Важным показателем состояния плаценты является ее толщина, которая характеризуется типичной кривой роста по мере прогрессирования беременности. К 36-37 нед рост плаценты прекращается, и в дальнейшем при физиологическом течении беременности толщина плаценты или уменьшается, или остается на том же уровне, составляя 3,3-3,6 см.
Большинством исследователей доказано преимущество массового ультразвукового скрининга беременных перед селективным в плане снижения перинатальной заболеваемости и смертности. Программа массового скрининга подразумевает обязательное трехкратное выполнение ультразвукового исследования у беременных: в 10-12, 20-22 и 30-32 нед.
Определение биофизического профиля плода
Ультразвуковые приборы, работающие в режиме реального времени, позволяют не только осуществлять оценку анатомических особенностей плода, но и получать достаточно полную информацию о его функциональном состоянии. В настоящее время широкое использование в оценке внутриутробного состояния плода получил так называемый биофизический профиль плода (БФПП). Большинство авторов включают в это понятие 6 параметров: нестрессовый тест (НСТ) при кардиотокографии и 5 показателей, определяемых при ультразвуковом сканировании в режиме реального времени; дыхательные движения плода (ДДП); двигательная активность (ДА); тонус (Т) плода; объем околоплодных вод (00В); степень зрелости плаценты (СЗП). Максимальная оценка составляет 12 баллов. Высокие чувствительность и специфичность БФПП объясняются сочетанием маркеров острого (НСТ, ДД, ДА и Т плода) и хронического ( О О В , СЗП) нарушения состояния плода (табл. 4,5). Реактивный НСТ даже без дополнительных данных является показателем удовлетворительного состояния плода, в то время как при наличии нереактивного НСТ особое значение приобретает ультразвуковое исследование остальных биофизических параметров плода.
Сумма баллов 12-8 свидетельствует о нормальном состоянии плода. Оценка БФПП 7-6 баллов указывает на сомнительное состояние плода и возможность развития осложнений. Сумма баллов 5-4 и менее свидетельствует о наличии выраженной внутриутробной гипоксии плода и высоком риске развития перинатальных осложнений.
Определение БФПП для получения объективной информации возможно уже с начала III триместра беременности.
Допплерометрическое исследование кровотока в системе мать-плацента-плод
Высокая информативность, неинвазивность, относительная простота, безопасность и возможность использования на протяжении всей беременности, в том числе и на ранних сроках гестации, делает этот метод исследования кровообращения незаменимым в акушерстве.
Существует два метода оценки допплерограмм кровотока в исследуемом сосуде – количественный и качественный.
Широкое распространение в акушерской практике получил качественный анализ кривых скоростей кровотока, показатели которого не зависят от диаметра сосуда и величины угла инсонации (рис. 4.35). Основное значение при этом имеет не абсолютная величина скорости движения крови, а соотношение между скоростями кровотока в различные фазы сердечного цикла: систола (С), диастола (Д), Наиболее часто используются систолодиастолическое отношение (СДО); пульсационный индекс (ПИ), для вычисления которого дополнительно используется и средняя скорость кровотока (ССК); индекс резистентности (ИР). Для каждого сосуда существуют харак-терные кривые скоростей кровотока.
Повышение сосудистого сопротивления, проявляющееся в первую очередь снижением диастолического компонента кровотока, приводит к повышению численных значений указанных индексов.
Наибольшую практическую ценность во время беременности имеют исследования кровотока в маточных артериях, их ветвях (аркуатных, радиальных) и артерии пуповины. Анализ кровотока в аорте и церебральных сосудах плода при патологических кривых скоростей кровотока в артерии пуповины позволяет судить о степени тяжести нарушений собственно плодовой гемодинамики.?
Одним из направлений использования метода Допплера в акушерской практике является допплерэхокардиография плода. Наибольшее практическое значение допплерэхокардиография имеет при диагностике врожденных пороков сердца.
Новейшим методом, основанным на эффекте Допплера, является цветное допплеровское картирование (ЦДК) – совмещение двухмерной эхоимпульсной информации и цветовой информации о скоростях потоков крови в исследуемых органах. Высокая разрешающая способность используемых приборов позволяет визуализировать и идентифицировать мельчайшие сосуды микроциркуляторного русла, что делает этот метод незаменимым в диагностике сосудистой патологии: выявление ретроплацентарного кровотечения; сосудистых нарушений плаценты (например, ангиома); сосудистых анастомозов в плаценте, приводящих к обратной артериальной перфузии у близнецов; обвития пуповины, оценка пороков развития сердца и внутрисердечных шунтов на основании визуализации тока крови (т.е. из правого желудочка в левый через дефект межжелудочковой перегородки или регургитации через клапан); идентификация анатомии сосудов плода, особенно малого калибра (почечные артерии плода визуализируются для исключения почечной агенезии; виллизиев крут в головном мозге плода), ЦДК обеспечивает возможность исследования кровотока в ветвях маточной артерии (вплоть до спиральных артерий), терминальных ветвях артерии пуповины, межворсинчатом пространстве. Это позволило изучить особенности становления и развития внутриплацентарной гемодинамики и открыло новые перспективы для ранней диагностики акушерских осложнений, связанных с формированием плацентарной недостаточности.
Ультразвуковое исследование головного мозга (нейросонография) новорожденного
Показаниями к нейросонографии у новорожденных в раннем неонатальном периоде являются хроническая кислородная недостаточность во внутриутробный период развития; рождение в тазовом предлежании; оперативное родоразрешение (акушерские щипцы, вакуум-экстракция, извлечение плода за тазовый конец, экстренное кесарево сечение); рождение в результате быстрых или стремительных родов; асфиксия при рождении; большая или малая масса тела при рождении; неврологическая симптоматика.
 Рис. 4.35. Кривая скорости кровотока при допплерометрии (схема). Объяс-нение в тексте.
Рис. 4.35. Кривая скорости кровотока при допплерометрии (схема). Объяс-нение в тексте.
Исследование проводят с использованием секторальных датчиков (3,5 – 7,5 МГц). Специальной медикаментозной подготовки для проведения нейросонографии у детей не требуется. Продолжительность исследования составляет в среднем 10 мин.?
Эхографическое исследование головного мозга проводят по разработанной методике, включающей последовательное получение стандартных сечений в коронарной и сагиттальной плоскостях через большой родничок.
Осуществляется сканирование и через височную кость головы ребенка, что позволяет лучше оценить состояние экстрацеребральных пространств. Церебральный кровоток у детей определяют в основном в передней и средней мозговых артериях. Артерии представляются на экране в виде пульсирующих структур. Визуализация значительно облегчается при использовании цветной допплерометрии. При анализе кривых скоростей кровотока церебральных сосудов у новорожденных рассчитывают систол од иастолическое отношение и индекс резистентности.
Методы исследования околоплодных вод
Для оценки течения беременности и диагностики состояния плода важное значение имеет определение следующих характеристик околоплодных вод: количество, цвет, прозрачность, биохимический, цитологический, гормональный состав.Определение количества околоплодных вод. Определение объема амниоцетической жидкости при УЗИ может быть субъективным или объективным. Опытный специалист может оценить количество околоплодных вод путем визуального осмотра при тщательном продольном сканировании (большое количество жидкости между плодом и передней брюшной стенкой беременной при многоводии, резкое уменьшение количества пространств, свободных от эхоструктур, при маловодий).
Существуют более объективные полуколичественные эхографические критерии для неинвазивного определения количества околоплодных вод. О маловодий свидетельствует наличие свободных участков жидкости глубиной менее 1-2 см, а о многоводии – обнаружение вертикального диаметра кармана околоплодных вод свыше 8 см. Более точным методом определения объема околоплодных вод является вычисление при УЗИ индекса амниотической жидкости (ИАЖ) – суммы максимальных карманов с жидкостью в 4 квадрантах полости матки: 0-5 см – очень низкий индекс (выраженное маловодие), 5,1-8 см – низкий индекс (умеренное маловодие), 8,1-18 см – норматьный индекс, более 18 см – высокий индекс (многоводие).
Амниоскопии – трансцервикатьный осмотр нижнего полюса плодного пузыря. При амниоскопии обращают внимание на цвет и консистенцию околоплодных вод, примесь мекония или крови, наличие и подвижность хлопьев казеозной смазки.
Показаниями к амниоскопии являются подозрение на хроническую гипоксию, перенашивание беременности, изосерологическая несовместимость крови матери и плода.
Для проведения амниоскопии беременную укладывают в гинекологическое кресло и производят влагалищное исследование для определения проходимости канала шейки матки. При необходимости производят осторожное пальцевое расширение его. В асептических условиях по пальцу или после обнажения шейки зеркалами в шеечный канал за внутренний зев вводят тубус с мандреном. Диаметр тубуса подбирают в зависимости от раскрытия шейки (12-20 мм). После извлечения мандрена и включения осветителя тубус располагают таким образом, чтобы была видна преддежащая часть плода, от которой отражается световой луч. Если осмотру мешает слизистая пробка, ее осторожно удаляют с помощью тупфера. При низком расположении плаценты на плодных оболочках четко виден сосудистый рисунок. При предлежании плаценты все поле зрения имеет темно-красный цвет, в этом случае исследование необходимо немедленно прекратить!
Противопоказания к амниоскопии: воспалительные процессы во влагалище и шейке матки, а также предлежание плаценты.
Амниоцентез – операция, целью которой является получение околоплодных вод для биохимического, гормонального, иммунологического, цитологического и генетического исследований, позволяющих судить о состоянии плода.
Показаниями к амниоцентезу являются изосерологическая несо-вместимость крови матери и плода, хроническая гипоксия плода (перенашивание беременности, гестоз, экстрагенитальные заболевания матери и т.д.), установление степени зрелости плода, антенатальная диагностика пола, необходимость кариотипирования при подозрении на пороки развития плода, микробиологическое исследование.
В зависимости от места пункции различают трансвагинальный и транс-абдоминальный амниоцентез. Операцию всегда выполняют под ультразвуковым контролем, выбирая наиболее удобное место пункции в зависимости от расположения плаценты и мелких частей плода.
При трансабдоминальном амниоцентезе (рис. 4.36) после обработки передней брюшной стенки антисептиком производят анестезию кожи, подкожной клетчатки и подапоневротического пространства 0,5 % раствором новокаина. Для выполнения процедуры можно применять иглу, как для спинномозговой пункции. Для исследования берут 10-15 мл околоплодных вод. Непригодными считаются пробы, загрязненные кровью или меконием. У беременных с Rh-сенсибилизацией, когда необходимо исследование оптической плотности билирубина (ОПБ), пробу амниотической жидкости следует быстро перенести в темный сосуд, для того чтобы избежать изменения свойств билирубина под влиянием света. Место пункции на передней брюшной стенке обрабатывают антисептиком и накладывают асептическую наклейку.
 Рис. 4.36. Амниоцентез в III триместре бере-менности, надлобковый доступ.
Рис. 4.36. Амниоцентез в III триместре бере-менности, надлобковый доступ.
Трансвагинальный амниоцентез производят через передний свод влагалища, канал шейки матки или задний свод влагалища. Выбор места введения пункционной иглы зависит от расположения плаценты. После предварительной санации влагалища шейку матки фиксируют пулевыми щипцами, смещают вверх или вниз в зависимости от выбранного метода и производят прокол стенки влагалища под углом к стенке матки. При попадании пункционной иглы в полость матки из нее начинают выделяться околоплодные воды.
Осложнения, возможные при амниоцентезе: преждевременное излитие околоплодных вод (чаще при трансцервикальном доступе), ранение сосудов плода, ранение мочевого пузыря и кишечника матери, хориоамнионит. Осложнениями амниоцентеза также могут быть преждевременный разрыв плодных оболочек, преждевременные роды, отслойка плаценты, ранение плода и повреждение пуповины. Однако благодаря широкому внедрению ультразвукового контроля проведения этой операции осложнения встречаются крайне редко. В связи с этим изменились противопоказания к амниоцентезу: практически единственным противопоказанием к нему является угроза прерывания беременности.
Амниоцентез выполняется только с согласия беременной.
Определение степени зрелости плода. С этой целью проводят цитологическое исследование околоплодных вод. Для получения и исследования осадка околоплодные воды центрифугируют при 3000 об/мин в течение 5 мин, мазки фиксируют смесью эфира и спирта, затем окрашивают по методу Гарраса-Шора, Папаниколау или, чаще, 0,1 % раствором сульфата нильского синего, при этом безъядерные липидсодержащие клетки (продукт сальных желез кожи плода) становятся оранжевого цвета (так называемые оранжевые клетки). Процентное содержание в мазке "оранжевых клеток" соответствует зрелости плода: до 38 нед беременности их количество не превышает 10 %, свыше 38 нед – достигает 50 %.
Для оценки зрелости легких плода определяют концентрацию фосфолипидов в околоплодных водах, в первую очередь соотношения лецитин/сфингомиелин (Л/С). Лецитин, насыщенный фосфатидилхолин, является главным действующим началом сурфактанта. Интерпретация величины соотношения Л/С должна быть следующей: 1. Л/С = 2:1 или более – легкие зрелые. Только 2% новорожденных подвержены риску развития респираторного дистресс-синдрома; 2. Л/С = 1,5-1,9:1 – в 50 % случаев возможно развитие респираторного дистресс-синдрома; 3. Л/С = менее 1,5:1 – в 73 % случаев возможно развитие респираторного дистресс-синдрома.
Практическое применение нашел метод качественной оценки соотношения лецитина и сфингомиелина (пенный тест). С этой целью в пробирку с 1 мл околоплодных вод добавляют 3 мл этилового спирта и в течение 3 мин встряхивают пробирку. Образовавшееся кольцо из пены свидетельствует о зрелости плода (положительный тест), отсутствие пены (отрицательный тест) указывает на незрелость легочной ткани.
Диагностика излития околоплодных вод.
Одним из методов диагностики излития околоплодных вод во время беременности является цитологическое исследование свежих окрашенных препаратов. На предметное стекло наносят каплю влагалищного секрета, добавляют каплю 1 % раствора эозина и накрывают покровным стеклом. Под микроскопом на розовом фоне видны ярко окрашенные эпителиальные клетки влагалища с ядрами, эритроциты, лейкоциты. При отошедших водах видны большие скопления неокрашенных "чешуек" кожи плода.
Кольпоцитологическое исследование
Цитологическая картина отделяемого из влагалища во время беременности имеет особенности в связи с отсутствием циклических изменений в организме, замедлением процесса пролиферации влагалищного эпителия и массивной продукцией гормонов. По количеству поверхностных, ладьевидных, промежуточных и парабазальных клеток, эозинофильному и пикнотическому индексам судят о готовности к родам. При нормальном течении II и III триместров картина мазка постоянна и изменяется только в последние 1-2 нед перед родами. Начиная с 39-й недели беременности выделяют четыре цитологические картины влагалищных мазков: I – поздний срок беременности (за 10-14 дней до родов); II – незадолго до родов (за 6-8 дней до родов); III – срок родов (за 1-5 дней до родов); IV – несомненный срок родов (роды наступают в тот же день или в ближайшие 3 дня).
Рентгенологическое исследование
В настоящее время, учитывая отрицательное воздействие ионизирующей радиации на эмбрион и плод, рентгенологическое исследование применяют редко. В конце беременности радиочувствительность плода снижается, в связи с чем рентгенологические исследования в это время менее опасны. В акушерской практике для уточнения изменений костного таза иногда прибегают к рентгенопельвиометрии.
Определение тканевого рО2 у плода
Напряжение кислорода (Р0 ) в тканях плода можно определить полярографическим методом в процессе родов в отсутствие плодного пузыря. Это позволяет осуществить раннюю диагностику внутриутробной гипоксии (острой и хронической) плода. Можно применять внутрии чрескожный полярографические методы определения Р0 в тканях.
Для внутрикожного определения PQ используют открытые микроэлектроды, которые легко и без осложнений вводят в ткани. Метод внутритканевого полярографического определения Р0 обладает известным преимуществом, так как электроды при этом быстрее реагируют на изменеР(32 обладают меньшей инертностью, чем электроды для чрескожного измерения рО2.
Рабочий игольчатый электрод вводят под кожу головки плода на глубину 0,5-0,6 мм после излития околоплодных вод и открытия шейки матки на 4 см и более, электрод сравнения вводят в задний свод влагалища.
Исследование крови плода и новорожденного
Важнейшую информацию о состоянии плода могут дать результаты непо-средственного исследования его крови, полученной из пуповины или его головки.
 Рис. 4.37. Кордоцентез.
а – схема проведения кордоцентеза: 1 – датчик, 2 – пункционная игла, 3 – пупочная вена, 4 – артерии пуповины; б – выбор направления иглы под контролем УЗИ (пункционная игла).
Рис. 4.37. Кордоцентез.
а – схема проведения кордоцентеза: 1 – датчик, 2 – пункционная игла, 3 – пупочная вена, 4 – артерии пуповины; б – выбор направления иглы под контролем УЗИ (пункционная игла).
Кордоцентез (рис. 4.37).
Методика кордоцентеза представляет собой получение крови из сосудов пуповины путем внутриутробной пункции ее под ультразвуковым контролем.
Показания к кордоцентезу разнообразны и включают в себя диагностику врожденной и наследственной патологии (кариотипирование плода), внутриутробного инфицирования, гипоксии плода, анемии плода при иммуноконфликтной беременности. Помимо широкого спектра диагностических задач, использование кордоцентеза позволяет решить и некоторые важные проблемы внутриутробной терапии при гемолитической болезни плода.
Кордоцентез производят после 18 нед беременности. Операцию забора крови плода начинают с установления локализации плаценты и места отхождения пуповины. В случае расположения плаценты на передней стенке матки иглу для аспирации крови проводят трансплацентарно, в случае заднестеночной локализации плаценты иглу вводят трансамнионально, и пуповину пунктируют вблизи места ее отхождения от плаценты. При высокой двигательной активности плода, мешающей проведению пункции, рекомендуется внутримышечное или внутривенное введение плоду препаратов, обеспечивающих его полное, но кратковременное обездвиживание. Для этого используют мышечный нейроблокатор пипекуроний (ардуан) в количестве 0,025-0,25 мг/кг. Объем пробы крови зависит от показаний к кордоцентезу; обычно требуется не более 2 мл.
Риск развития осложнений при проведении кордоцентеза для беременной невысок. Среди осложнений для плода следует отметить преждевременное излитие вод (0,5 %), кровотечение из пунктируемого сосуда (5-10 %), как правило, не длительное и не опасное для жизни плода. Уровень перинатальных потерь не превышает 1-3 %.
Противопоказания к проведению кордоцентеза такие же, как и к амниоцентезу.
Определение кислотно-основного состояния (КОС) крови. В динамике родового акта капиллярную кровь у плода получают из предлежащей части по методу Saling. С этой целью в родовые пути после излитая околоплодных вод вводится металлический тубус амниоскопа с волоконной оптикой. При этомотчетливо виден участок предлежащей части головки или ягодицы, кожу которой с целью создания гиперемии протирают марлевым тампоном. Специальным скарификатором производят пункцию кожных покровов на глубину до 2 мм, после чего собирают кровь (кроме первой капли) в стерильный гепаринизированный полиэтиленовый ка-пилляр без прослоек воздуха и примеси околоплодных вод. Исследование микродоз крови по методу Saling позволяет быстро получить информацию о состоянии плода, однако этот метод является весьма трудоемким и не всегда выполним.
Для определения КОС крови у новорожденного забор крови производят из сосудов пуповины сразу же после рождения или используют капиллярную кровь из пятки ребенка.
При исследовании КОС крови учитывают следующие показатели: рН – концентрация свободных водородных ионов; BE – дефицит оснований или избыток кислот; Рсо2 ~ парциальное напряжение углекислого газа; Ро2 – парциальное напряжение кислорода.
Биопсия (аспирация) ворсин хориона
Операция, цель которой заключается в получении клеток ворсинчатого хориона для кариотипирования плода и определения хромосомных и генных аномалий (в том числе определение наследственно обусловленных нарушений метаболизма), определения пола плода. Взятие проб проводят трансцервикально или трансабдоминально в сроки от 8 до 12 нед беременности под контролем ультразвука (рис. 4.38). В полость матки вводят стерильный полиэтиленовый гибкий катетер (длиной 26 см и внешним диаметром 1,5 мм) и осторожно, под визуальным контролем, продвигают его к месту локализации плаценты и далее между стенкой матки и плацентарной тканью. Затем шприцем вместимостью до 20 мл, содержащим 3-4 мл питательной среды и гепарин, аспирируют хориальную ткань, которую в дальнейшем исследуют. Возможно взятие проб хориальной ткани и в случаях бихориальной двойни.
Осложнениями биопсии ворсин хориона могут быть внутриматочная инфекция, кровотечения, самопроизвольные выкидыши, образование гематом. К более поздним осложнениям относятся преждевременные роды, малая масса новорожденных (менее 2500 г), пороки развития плода. Перинатальная смертность достигает 0,2-0,9 %.
Противопоказаниями к проведению биопсии хориона могут служить наличие инфекции половых путей и симптомы угрожающего выкидыша.
Фетоскопия
Фетоскопия – непосредственный осмотр плода – используется для выявления врожденной и наследственной патологии. Метод позволяет осмотреть части плода через тонкий эндоскоп, введенный в амниотическую полость, и через специальный канал взять для анализа образцы крови, эпидермиса. Фетоскопия осуществляется как конечный этап генетического обследования при подозрении на врожденную аномалию плода.
Методика введения фетоскопа: после соответствующей обработки кожи под местным обезболиванием в стерильных условиях производят небольшой разрез кожи и троакар, находящийся в канюле, вводят в полость матки. Затем троакар извлекают, получают пробу амниотической жидкости для исследования и в канюлю вводят эндоскоп. При необходимости можно определить глубину введения эндоскопа с помощью ультра-звукового датчика. По достижении плаценты врач может осмотреть сосуды плаценты и произвести забор крови из сосудов пуповины; при невозможности получить пробы крови плода можно взять аспират из плаценты. Ввиду ограниченности поля зрения эндоскопа обычно невозможно осмотреть весь плод за одну процедуру. В связи с этим рекомендуется производить целенаправленный осмотр какой-либо части плода. При необходимости после осмотра плода специальными щипцами производят биопсию нужного участка кожи. По окончании операции инструменты извлекают из матки, проводят кардиомонигорный контроль за состоянием плода и наблюдение за беременной в течение 24 ч.
К осложнениям фетоскопии относятся излитие околоплодных вод, прерывание беременности. Такие осложнения, как кровотечения и развитие инфекции, образование небольших поверхностных гематом на конечностях плода, крайне редки. В связи с возможностью прерывания беременности фетоскопия применяется редко.
Исследование гормонального профиля
Биологические методы диагностики беременности. Среди наиболее распространенных биологических реакций на беременность можно назвать гормональную реакцию Фридмана, Ашгейма – Цондека, гормональную реакцию на лягушках (реакция Галли – Майнини).
Реакция Фридмана. Крольчихе в ушную вену вводят мочу женщины. Если моча содержит ХГ, то через 12 ч после введения мочи у крольчихи происходит овуляция.
Реакция Галли – Майнини, Основана на способности самцов лягушек выделять сперму в эякуляторные протоки под влиянием ХГ, содержащегося в моче беременных женщин.
Тест Ашгейма – Цондека. После инъекции мочи беременной женщины, в которой содержится ХГ, инфантильным самкам мыши массой 6-8 г в их яичниках наблюдают кровоизлияния в фолликулы и формирование желтого тела.
В настоящее время биологические методы диагностики беременности утратили свою ведущую роль и предпочтение отдается иммунологическим методам.
Иммунологические методы диагностики беременности. К иммунологическим методам относятся различные методы определения в сыворотке и в моче хорионического гонадотропина (ХГ) или его р-субъединицы (р-ХГ). Предпочтение отдают радиоиммунологическому методу количественного определения р-ХГ в сыворотке крови, так как он обладает высокой специфичностью и чувствительностью. Положительную оценку заслужили иммуноферментные методы выявления ХГ в моче, а также другие варианты иммунологических тестов (капиллярные, пластиночные). Имеют право на существование такие широко известные серологические методы определения ХГ в моче, как реакция торможения агглютинации эритроцитов или осаждения частии латекса.
Все лабораторные методы диагностики беременности высокоспецифичны: правильные ответы наблюдаются в 92-100 % случаев уже с 9-12-го дня после оплодотворения яйцеклетки. Однако эти методы позволяют установить лишь факт существования беременности без уточнения ее локализации, поэтому не могут быть использованы для дифференциальной диагностики маточной и эктопической беременности.
Агглютинация, или тест фиксации латексными частицами, – метод определения уровня ХГ в моче. ХГ выделяется с мочой уже через 8 дней после оплодотворения. Несколько капель мочи пациентки смешивают с AT и ХГ, затем к этой смеси добавляют латексные частицы, покрытые ХГ. Если ХГ присутствует в моче, он связывается с AT; если ХГ отсутствует, то AT связывается с латексными частицами. Этот экспресс-тест положителен в 95 % случаев, начиная с 28-го дня после оплодотворения.
Радиоиммунологический тест. Исследуемым материалом служит кровь. Определяют количественное содержание бета-субъединиц ХГ в плазме крови.
Радиологический метод. Исследуют кровь. Определяют количество р-субъединиц ХГ, конкурирующего с меченым ХГ за связывание с рецепторами ХГ клеток желтого тела коровы. Эта экспресс-проба достаточно чувствительна, но не столь специфична, как радиоиммунологический тест.
Методы оценки состояния плаценты и плода. В процессе беременности для оценки функции плаценты и состояния плода проводится определение следующих гормонов: хорионического гонадотропина (ХГ), плацентарного лактогена (ПЛ), прогестерона, эстрогенов, пролактина, дегидроэпиандростерона сульфата (ДГЭАС), тиреоидных гормонов и кортикостероидов.
Для определения уровня гормонов используются следующие методы: 1. однократный анализ мочи; 2. анализ суточной мочи (компенсирующий суточные колебания секреции гормонов); 3. исследование крови беременной; 4. определение содержания гормонов в амниотической жидкости.
В настоящее время содержание большинства гормонов в биологических Жидкостях определяется радиоиммунологическим методом. Содержание ХГ в крови и моче можно определять биологическим, иммунологическим и радиологическим методами. Иммунологические (в том числе радиоиммунологические) тесты обладают более высокой специфичностью и чувствительностью, чем биологические методы.
Знание нормальных показателей содержания гормонов (см. Физиология беременности) необходимо для выявления патологии беременности и степени риска развития осложнений для плода. При этом необходимо учитывать суточные колебания уровня гормонов. Дефицит ряда гормонов, необходимых для нормального течения беременности, может быть скорригирован их экзогенным введением.
Ведение беременности
Основы рационального питания беременных
Рациональное питание – одно из основных условий благоприятного течения и исхода беременности, родов, развития плода и будущего ребенка. Оно играет существенную роль в профилактике анемии, гестозов, внутриутробной задержки роста плода, аномалий родовой деятельности и других осложнений.
Под рациональным питанием подразумевается полноценный набор разнообразных пищевых продуктов соответственно сроку беременности и правильное распределение рациона в течение дня. Рацион составляется индивидуально с учетом роста и массы тела беременной, величины плода, характера течения беременности, трудовой деятельности.
При избыточной массе тела женщины рацион следует составлять таким образом, чтобы предупредить нежелательную прибавку массы тела, т.е. уменьшить энергетическую ценность (калорийность) рациона за счет углеводов и жиров. Беременным с пониженной массой тела следует увеличить калорийность рациона с сохранением необходимых соотношений между основными ингредиентами.
Интенсивность основного обмена при беременности возрастае примерно на 10 %, а общие энергетические затраты составляют 2500 ккал в день, что обусловлено повышенным потреблением кислорода и активностью плода. Энергетические затраты связаны с ростом плода, плаценты, матки и молочных желез. С началом беременности количество энергии, необходимое для их роста, постоянно увеличивается до 30-недельного срока, после чего происходит некоторое снижение необходимого количества энергии. Дополнительные затраты, возникающие во время беременности, покрываются в основном за счет жиров (50 %) и углеводов (около 33 %) . Белки используются почти исключительно на формирование тканей плода и лишь около 6,5 % их расходуется на покрытие энергетических затрат.
За время беременности прибавка массы тела женщины составляет 8-11 кг. Большая еженедельная прибавка в первые и последние 3 мес беременности может неблагоприятно сказаться на состоянии плода. В среднем во второй половине беременности прибавка не должна превышать 250-300 г в неделю. Увеличение массы тела у беременных происходит за счет роста плода (3,5 кг), увеличения массы матки и околоплодных вод (1,5 кг), молочных желез (400 г), нарастания объема циркулирующей крови и межкпеточной жидкости (1,2-1,8 кг) и лишь 1,6 кг – за счет жира и других запасов материнского организма.
Неотъемлемым условием рационального питания является соблюдение определенного режима питания, нарушение которого не только наносит вред организму матери, но и неблагоприятно влияет на развитие плода и новорожденного.
В первой половине беременности питание женщины н е должно существенно отличаться от ее питания до беременности. Следует, однако, помнить, что в 1 триместре происходит закладка органов плода (период органогенеза), поэтому в это время особенно важным является достаточное поступление в организм беременной полноценных белков, витаминов, минеральных веществ.
Начиная с ранних сроков и в течение первой половины беременности для женщин низкого роста (длина тела 150 см) и массой тела 50 кг энергетическая ценность суточного рациона должна соответствовать 2100-2300 ккал. Содержание белков в таком рационе составляет 90-100 г, жиров – 55-65 г, углеводов – 290-320 г. Энергетическая ценность рациона для женщин среднего роста (длина тела 155-165 см) и массой тела 55-60 кг должна быть 2400-2700 ккал и рацион должен включать 110 г белка, 75 г жиров и 350 г углеводов. Для беременных более высокого роста (длина тела 170-175 см) энергетическая ценность суточного рациона должна быть 2700-2900 ккал и рацион должен включать 120-125 г белков, 75-85 г жиров и 360-400 г углеводов.
В первой половине беременности физиологически наиболее рационален режим четырехразового питания в установленные часы: первый завтрак – 8.00-9.00; второй завтрак 11.00-12,00; обед 14.00-15.00; ужин18.00-19.00 и в 21.00 стакан кефира.
Первый завтрак должен содержать около 30 %, второй завтрак – 20 %, обед – до 4 0% энергетической ценности всего рациона. Остальные 10 % остаются на ужин. После приема пищи рекомендуется активный отдых. Последний прием пищи должен быть не позднее чем за 2-3 ч до сна.
Во второй половине беременности еще больше увеличивается потребность в белках. Поэтому у беременных с низким ростом энергетическая ценность суточного рациона должна составлять 2400-2600 ккал и рацион должен содержать 100-110 г белков, 70-74 г жиров и 330-360 г углеводов. Количество белков в рационе беременных среднего роста и со средней массой тела увеличивают до 120 г, жиров до 85 г и углеводов до 400 г; общая энергетическая ценность суточного рациона беременной в этот период должна быть увеличена до 2800-3000 ккал в сутки. Для беременных высокого роста энергетическая ценность суточного рациона должна составлять 3000-3300 ккал, содержание белков увеличивают до 120-140 г, жиров – до 85-100 г, углеводов – до 410-440 г.
Особое внимание следует обращать на питание беременных в период дородового отпуска, когда меняются условия труда и понижаются энергозатраты, при этом энергетическая ценность пищи должна быть пониженной.
Во второй половине беременности целесообразно принимать пищу 5-6 раз в день, причем максимальное количество – в первой половине дня. Энергетическая ценность завтрака должна составлять 30 % энергетической ценности суточного рациона, второго завтрака – 15%, обеда -4 0%, полдника – 5 % и ужина – 10 %.
Важным является правильное распределение продуктов на каждый прием пищи. Известно, что продукты, богатые белком, повышают обмен веществ у человека, возбуждают нервную систему, длительное время задерживаются в желудке. Поэтому мясо, рыба, крупы должны входить в меню завтрака и обеда. На ужин следует употреблять молочно-растительную пищу. Обильный прием пищи в вечернее время отрицательно сказывается на здоровье беременной, нарушает нормальный сон и отдых. Пища должна быть хорошо приготовленной, вкусной, свежей и не очень горячей. Если пища долго сохраняется, а потом подогревается, она теряет не только вкусовые качества, но и большое количество витаминов. Пища должна легко усваиваться организмом.
Меню рекомендуется составлять с учетом времени года.
О правильном подборе пищевых продуктов и организации рационального питания можно судить и по прибавке массы тела; за этим следят и сама беременная, и врач, и акушерка.
Если беременная по каким-либо причинам соблюдает постельный режим, энергетическую ценность пищи снижают на 20-40 %.
Ниже приведен примерный набор продуктов, рекомендуемых при составлении суточного рациона во второй половине неосложненной беременности: Хлеб пшеничный 100-120 г Хлеб ржаной 100-120 г Молоко 500 мл Масло сливочное 40 г Масло растительное 30 г Яйцо 1 шт. Сахар 30-40 г Мясо или рыба 200 г Фрукты свежие 150-200 г Фрукты сухие 50 г Картофель 200 г Другие овоши 400-500 г Крупы 50 г Мука 30 г
Существенный ингредиент рациона – белок содержится в продуктах животного и растительного происхождения. Рекомендуется включать в рацион 50 % белка животного происхождения (за счет рыбы и мяса – 25 %, молока и молочных продуктов – 20 %, яиц – 5 %) и 50 % – растительного происхождения (хлеб, крупы, овощи и др.).
Потребность в углеводах удовлетворяется за счет продуктов, богатых растительной клетчаткой (хлеб грубого помола, овощи, фрукты, ягоды), которые содержат также витамины, микроэлементы, минеральные соли.
Рекомендуется употребление жиров (до 40 % общего их количества) – подсолнечного, кукурузного, оливкового масла. Из животных жиров предпочтительно сливочное и топленое масло; не рекомендуются свиной, говяжий, бараний жир, маргарин.
Потребность в витаминах во время беременности возрастает примерно в 2 раза. Эта потребность удовлетворяется за счет употребления продуктов растительного и животного происхождения (хлеб грубого помола, крупы, картофель, бобовые, ягоды, фрукты, мясо, творог, молоко, сливочное масло и др.). Зимой и весной назначают витамины группы В, С, РР, A, D, Е. Рекомендуются препараты поливитаминов и микроэлементов. При этом следует учитывать возможность возникновения аллергических реакций.
С развитием беременности возрастает потребность организма матери и плода в минеральных веществах (калий, кальций, фосфор и др.) и микроэлементах (железо, медь, кобальт и др.). При правильном питании потребность в них полностью удовлетворяется. Особенно важно, чтобы в пище было достаточное количество железа.
Во время беременности особенно полезны продукты, содержащие полноценные белки и незаменимые аминокислоты: молоко, кефир, творог, простокваша, отварные мясо и рыба, неострый сыр. Во второй половине беременности не рекомендуются блюда, содержащие экстрактивные вещества (бульоны, пряности, копчености).
Соленая и острая пища (перец, горчица, уксус, хрен и другие пряные вещества) не рекомендуется. Алкогольные напитки запрещаются: алкоголь быстро переходит через плаценту и отрицательно воздействует на плод. Указанные ограничения в диете необходимы для предупреждения расстройств функции печени, почек и других органов, испытывающих во время беременности повышенную нагрузку.
У беременных нередко наблюдается запор. В таких случаях рекомендуются на ночь простокваша или однодневный кефир (200 г), а натощак утром – сырые овощи, фрукты (100 -150 г чернослива, яблоки, сырая морковь), причем завтракать следует спустя 20-30 мин. В случаях крайней необходимости можно применять клизму.
Поваренная соль. Прием поваренной соли ограничивают во второй половине беременности до 8 г в сутки, что связано со свойствами поваренной соли удерживать воду. Обычная суточная норма составляет 12-15 г.
Жидкость. В начале беременности количество жидкости (вода, супы, компоты, чай, соки, молоко, кисели) не ограничивают: в сутки можно употреблять до 1,5 л жидкости, во второй половине беременности – до 1,2 л. Это вызвано тем, что нередко женщины к концу беременности испытывают сильную жажду и слишком много пьют, что способствует развитию отеков. По этой причине запрещаются соленые, острые, пряные блюда, способст-вующие усиленному потреблению воды.
Кальций. Во время беременности у некоторых женщин портятся зубы – имеется склонность к развитию кариеса. Иногда женщины испытывают желание есть известку, мел, соль и т.п. Это объясняется обеднением организма солями кальция и требует изменения диеты, назначения кальция, витамина D, железа, фосфора и облучения кварцем. Следует помнить, что расход катьция особенно возрастает во второй половине беременности (кальций расходуется на построение скелета и мягких тканей плода). Кал ьций содержится в сыре, яичных желтках, молоке. Употребление молока в количестве от 0,8 до 1,2 л в день обычно полностью обеспечивает потребность беременной в кальции и фосфоре. Суточная доза кальция в первой половине беременности 1 г, в дальнейшем – 1,5 г, а в конце беременности – 2,5 г в день. Во второй половине беременности рекомендуется дополнительный прием кальция в виде глицерофосфата (по 0,3 г 3 раза в день).
Фосфор. Расходуется на формирование скелета, нервной ткани плода. Фосфор содержится в орехах, хлебе, крупе, молоке, мясе, печени. Суточная Доза фосфора 2 г.
Магний, железо, кобальт. Магний необходим для нормальной деятельности сердечно-сосудистой и других систем организма. Он содержится в гречневой, ячменной крупе, морской рыбе. В сутки требуется 0,3 г магния, во второй половине беременности – 0,5 г. Суточная потребность железа для беременной не менее 15-20 мг. Кобальт входит в состав витамина В|2. Источником кобальта являются свекла, горох, клубника, красная смородина.
Витамины. Это биокатализаторы, регулирующие функции многих органов и систем организма человека. Особенно важны витамины для организма беременной.
Витамин А (каротин). Содержится в печени, почках, сливочном масле, молоке, яйцах, моркови, рыбьем жире, абрикосах, сыре.
Суточная доза 500 ME (около 1,5 мг). В последние 2 мес беременности суточная доза может быть повышена до 10 000-20 000 ME. При необходимости беременной назначают витамин А в виде готовых препаратов.
Витамин В1 (тиамин). Им богаты пивные дрожжи, печень, почки, молоко, желтки яиц, ржаной и пшеничный хлеб. Суточная потребность беременной не менее 10-20 мг.
Витамин В2 (рибофлавин). Содержится в дрожжах, печени, почках, мясе, молоке и молочных продуктах. Имеет большое значение для нормального течения беременности и родов. Суточная доза 2-3 мг.
Витамин В6 (пиридоксин). Содержится в хлебе из муки грубого помола. Суточная доза не менее 5 мг.
Витамин В12 (цианокобаламин). Содержится в гречневой крупе, дрожжах, печени. Суточная доза 0,003 мг.
Витамин РР (никотиновая кислота). Содержится в дрожжах, ржаном хлебе, мясе, печени, легких, зернах пшеницы, картофеле Средняя суточная потребность беременной и кормящей женщины 18-23 мг
Витамин С (аскорбиновая кислота). Содержится во многих фруктах, ягодах, овощах. Особенно много его в шиповнике, черной смородине, лимонах, зеленом луке. Суточная потребность беременной и кормящей женщины в витамине С 100-200 мг. Во второй половине беременности потребность в нем значительно возрастает. В зимне-весенний период с профилактической целью беременной и кормящей женщине назначают готовые препараты витамина С (драже, таблетки) или аскорбиновую кислоту с глюкозой (по 0,5 г 3 раза в день).
Витамин Е (токоферол). Способствует предупреждению самопроизвольных выкидышей и преждевременных родов. Недостаток витамина Е в организме беременной может привести к гибели плода и выкидышу. Витамин Е содержится в зародышевой части пшеницы и кукурузы, яйцах, печени, салате, применяется при лечении самопроизвольных выкидышей (назначают токоферол в масляном растворе по 1 чайной ложке 1-2 раза в день). С профилактической целью витамин Е рекомендуется женщинам, у которых в прошлом были самопроизвольные выкидыши и преждевременные роды. Суточная доза для беременных вместо обычных 10 мг повышается до 20-25 мг и еще больше для тех, кто перенес самопроизвольные аборты и преждевременные роды. Витамин D (антирахитический). Содержится в рыбьем жире, мясе, жирных сортах рыб, печени, сливочном масле. Суточная потребность беременной в витамине D 1000 ME.
Режим и личная гигиена беременных
Физиологические изменения, возникающие в период беременности, оказывают благоприятное действие на организм здоровой женщины, способствуя полному развитию важнейших функциональных систем. В этих условиях беременность, как правило, переносится легко. Однако нарушения гигиены, неправильное питание, избыточное психическое и физическое напряжение могут вызвать нарушение физиологических процессов и возникновение осложнений беременности. V женшин с признаками задержки развития половой системы, перенесших аборты, гинекологические и экстрагенитальные заболевания, стрессовые ситуации и другие патологические состояния, нарушение физиологических процессов, присущих беременности, может произойти даже при незначительных нарушениях общего режима и правил гигиены.
Беременная должна соблюдать правила гигиены, способствующие сохранению здоровья, нормальному развитию плода, профилактике осложнений беременности и родов.
При правильном образе жизни беременной нет необходимости вносить существенные изменения в общий режим. Здоровые беременные выполняют привычную физическую и умственную работу, являющуюся потребностью каждого человека. Работа способствует правильному функционированию нервной, сердечно-сосудистой, мышечной, эндокринной и лругих систем, мышц, суставов, связочного аппарата и др. Труд, особенно сопряженный с двигательной активностью, необходим для нормального обмена веществ.
Практика показывает, что гиподинамия беременных способствует ожирению, снижению тонуса мышечной системы, нарушению функции кишечника (запор), слабости родовых сил и другим осложнениям. Следует рекомендовать физические упражнения, оказывающие положительное влияние на течение беременности и родов. В то же время беременная должна избегать повышенных нагрузок, вызывающих физическое и умственное переутомление.
Врач женской консультации следит за выполнением законодательства, охраняющего здоровье будущей матери. Беременных не привлекают к работе в ночное время, к работе сверхурочной, а также связанной с подъемом и перемещением тяжестей, вибрацией, воздействием высокой температуры, радиации, ряда химических вешеств и других агентов, способных оказать вредное влияние на организм матери и плода. Беременным запрещены езда на велосипедах и других вилах транспорта, сопряженная с вибрацией и сотрясением тела, все виды спорта, связанные с бегом, прыжками, резкими движениями и эмоциональным напряжением.
Рекомендуется в любое время года совершать прогулки, а также использовать другие возможности длительного пребывания на свежем воздухе. Продолжительность и темп ходьбы следует соразмерять со степенью тренированности, возрастом и состоянием здоровья беременной
Очень важен хороший сон продолжительностью не менее 8 ч в сутки. В случае нарушений сна предпочтительны гигиенические меры (прогулки перед сном, оптимальная температура и свежий воздух в комнате и др.). Применение снотворных средств нежелательно в связи с возможностью их влияния на плод. По показаниям назначают препараты пустырника и валерианы.
Заслуживают внимания вопросы половой гигиены. Теоретически оправдано воздержание от половой жизни в течение всей беременности, потому что значительные колебания гемодинамики в бассейне сосудов половой системы нельзя признать физиологическими. Более того, они могут способствовать прерыванию беременности, особенно у женщин с признаками инфантилизма, перенесших воспалительные и другие заболевания половых органов, имеющих осложненный акушерский анамнез. Однако полный отказ от половой жизни практически нереален, поэтому следует ограничить ее в течение первых 2-3 мес и прекратить в последние месяцы беременности.
Гиперемия половых органов, разрыхление слизистых оболочек влагалища и шейки матки содействуют развитию воспалительных заболеваний в случае занесения патогенной флоры при половых сношениях. Известно, что указанные изменения содействуют развитию у беременных хламидийного и гонорейного кольпита (в случае инфицирования хламидиями и гонококками), который у небеременных женщин возникает редко в связи с тем, что многослойный плоский эпителий слизистой оболочки влагалища не является благоприятной средой для развития гонорейного и хламидийного воспалительного процесса. Возможно заражение трихомонадами, дрожжеподобными грибами рода Candida, микоплазмами. вирусами, которые вызывают у беременных кольпит и цервицит.
Беременная должна избегать контакта с больными общими и очаговыми инфекционными заболеваниями. Необходимо устранить все очаги инфекции, возникшие до и во время беременности (ангина, тонзиллит, кариес и другие воспалительные заболевания стоматологического профиля, кольпит, фурункулез и др.).
Уход за кожей во время беременности имеет очень большое значение. Для обеспечения сложных функций кожи необходимо следить за ее чистотой (душ, ванны, обтирания). Это способствует осуществлению выделительной, дыхательной и других функций кожи, благотворно действует на сосудистую и нервную систему, регулирует сон и другие виды деятельности организма.
Здоровым беременным рекомендуются воздушные и солнечные ванны. Продолжительность воздушных ванн сначала 5-10 мин, а по мере закаливания – 15-20 мин при температуре воздуха 20-25 °С. При других температурных условиях и в зависимости от степени тренированности режим воздушных ванн меняется (или они не рекомендуются). Солнечные ванны назначает врач в зависимости от климатогеографических условий, но с учетом рационального использования их. Следует избегать интенсивного действия солнечных лучей. В зимнее время желательно общее ультрафиолетовое облучение, проводимое под наблюдением физиотерапевта.
В женской консультации начинается профилактика трещин сосков и маститов. В основном она сводится к ежедневному обмыванию молочных желез водой комнатной температуры с мылом (детским) и последующему обтиранию жестким полотенцем. При сухой коже за 2-3 нед до родов полезно ежедневно смазывать кожу молочных желез, включая ареолу, нейтральным кремом (детский и др.). Воздушные ванны для молочных желез проводят по 10-15 мин несколько раз в день. При плоских и втянутых сосках рекомендуется массаж, которому женщину обучает врач или акушерка. Следует носить удобные бюстгалтеры (желательно хлопчатобумажные), не стесняющие грудную клетку. Во избежание застойных явлений молочные железы должны находиться в приподнятом положении.
С целью профилактики мастита следует выявлять беременных, ранее страдавших этим заболеванием, с наличием гнойной инфекции любой локализации при настоящей беременности, с мастопатией и другой патологией молочных желез. В обменной карте таких беременных отмечается риск возникновения мастита.
Одежда беременной должна быть удобной, не стеснять грудную клетку и живот. Предпочтительны хлопчатобумажные изделия, которые можно часто менять и стирать. Не следует носить одежду из тканей, затрудняющих дыхательную, выделительную, терморегулирующую и другие функции кожи (из ацетатных, вискозных и других волокон). Во второй половине беременности рекомендуется ношение бандажа.
Принципы подготовки беременных к родам
В настоящее время большое значение придается диагностике состояния готовности организма женщины к родам. Последнее может быть выявлено по изменениям половой системы женщины в виде повышения тонуса, возбудимости и сократительной активности матки, а также в виде наступления зрелости шейки матки и изменений в цитологической картине влагалищных мазков. Наиболее ясное представление о степени выраженности готовности организма к родам дает тщательная пальпаторная оценка зрелости шейки матки. Выявленные структурные и функциональные изменения половой системы свидетельствуют о возможности спонтанного начала и физиологического течения родового акта.
В настоящее время разработаны методы как медикаментозного, так и немедикаментозного воздействия с целью формирования готовности женщины к родам.
Умелый подбор и комплексное применение методов подготовки к родам в сочетании с психопрофилактической подготовкой беременных позволит достичь оптимально выраженной биологической готовности, значительно снизить перинатальную и материнскую заболеваемость и смертность.
Физиопсихопрофилактическая подготовка. Она должна включать три компонента воздействия для создания благоприятного эмоционального состояния, обеспечения сознательного отношения к беременности и активного участия в родах: 1. индивидуальные беседы и лекции – психопрофилактическая подготовка; 2. групповые занятия специальной гимнастикой; 3. использование природных факторов (свет, воздух, вода) для укрепления здоровья и применение средств физической терапии.
Психопрофилактическая подготовка. Направлена на устранение отрицательных эмоций и формирование положительных условнорефлекторных связей – снятие у беременной страха перед родами и родовыми болями, привлечение ее к активному участию в родовом акте.
Психопрофилактическая подготовка значительно уменьшает родовые боли, оказывает многостороннее, в частности организующее, влияние на женщину, способствует благоприятному течению беременности и родов.
Метод абсолютно безвреден для матери и плода, а поэтому нет противопоказаний к массовому применению. Недостатком его является необходимость кропотливой, длительной, индивидуальной работы с пациенткой.
Метод психопрофилактической подготовки был предложен в нашей стране И.З.Вельвовским и К.И.Платоновым (1940). Позже метод был усовершенствован G.D.Read (1944), F.Lamaze (1970) и нашел широкое распространение во многих странах мира.
Основная цель психофизиологической подготовки беременных к родам заключается в следующем: 1. выработать у женщины сознательное отношение к беременности, научить воспринимать роды как физиологический процесс; 2. создать хороший эмоциональный фон и уверенность в благоприятном течении беременности и завершении родов; 3. воспитать у беременной умение мобилизовать свою волю для преодоления страха перед родами.
При первом контакте с беременной необходимо выяснить отношение ее к беременности, характер взаимоотношений в семье, образование, профессию, наличие психических травм, установить представление беременной о родах, особенность страха перед ними, боязнь боли. Важно выяснить характерологические особенности беременной, ее эмоциональные и волевые качества. Целесообразно выделить группу беременных с психологическими проблемами, при наличии которых пациентка может быть направлена на консультацию к медицинскому психологу или психотерапевту.
Наряду с индивидуальной психопрофилактической работой, которую акушер-гинеколог проводит при каждом посещении беременной, рекомендуется проведение групповых занятий по психопрофилактической подготовке к родам.
Интерьер кабинета для групповых занятий должен создавать у пациентки психологический комфорт. Необходимо иметь кушетку или удобные кресла, набор рисунков и таблиц, демонстрирующих анатомо-физиологическую характеристику родового акта, рекомендуется иметь слайдоскоп, магнитофон или установку для показа фильмов о процессе родов.
Для проведения занятий по психопрофилактической подготовке целесообразно формировать группы но 6-8 человек, желательно с учетом психоэмоционального статуса пациенток, определенного на основании клинического опыта врача.
Занятия целесообразно начинать с 33-34 нед беременности, проводить их еженедельно в течение месяца (4 занятия), продолжительностью каждого 25-30 мин. Первое занятие может продолжаться около часа.
Первое занятие состоит из вводной и основной частей. Во вводной части останавливаются на возможности обучения беременных управлять своей волей и активностью в родах. Одной из форм такого обучения является аутогенная тренировка. Укреплению воли и снятию психоэмоционального напряжения способствует также и самомассаж определенных биологически активных точек: область крестца, низ живота, внутренняя поверхность верхнего края подвздошной кости. Применение элементов пальцевого самомассажа в родах способствует уменьшению родовой боли, нормализации схваток, иммобилизации родовых усилий.
В основной части сообщаются краткие сведения об анатомическом строении женских половых органов, развитии плода, единой системе матьплацента-плод, подчеркивается, что мать является окружающей средой для плода. Необходимо представить роды как естественный физиологический акт, дать характеристику всем периодам родов, остановить внимание беременных на умении распределять свои силы в родах, выполнять указания медицинского персонала.
Для закрепления полученных навыков беременным рекомендуется повторять занятия дома, продолжительностью 7-10 мин.
На втором занятии врач объясняет физиологию первого периода родов. Излагается механизм схваток, которые способствуют раскрытию шейки матки. Предлагаются приемы для уменьшения болезненности схваток, объясняется, как правильно дышать во время схваток и снимать мышечное напряжение между схватками. Роженица должна применять приемы релаксации и способы снятия боли: поглаживание нижних отделов живота дви-жениями ладоней от средней линии в сторону; при положении на боку надавливанием большими пальцами на крестец; при положении на спине большие пальцы спереди заводятся за гребни большого таза.
На третьем занятии беременных знакомят с течением второго периода родов. Объясняют, что такое потуги и как способствовать правильному рождению ребенка. Информируют о последовом и раннем послеродовом периоде, о кровопотере в родах. Убеждают, как важно выполнять рекомендации акушерки в процессе родов, проводят тренировки с задержкой дыхания и, наоборот, с частым поверхностным дыханием. Рассказывают, как нужно тужиться.
На четвертом занятии повторяют кратко весь курс предыдущих занятий и закрепляют приобретенные навыки и приемы, рекомендованные в родах.
Физические упражнения. Рекомендуется проводить с ранних сроков беременности. Эти упражнения направлены на тренировку дыхания и группы мышц, которым предстоит особо напряженная работа во время родов: брюшной пресс, мышцы тазового дна. Занятия по физической подготовке проводят под руководством инструктора по лечебной физкультуре.
Ультрафиолетовое облучение. Проводится по 10 дней в I, II и III триместре, что повышает функциональное состояние нервной системы и эндокринных желез, увеличивает иммунологическую активность и нормализует обмен веществ в организме. Особенно полезно ультрафиолетовое облучение при недостаточном естественном облучении в зависимости от климата и сезонных колебаний.
Роженицам, прошедшим физиопрофилактическую подготовку к родам, требуется меньшая доза лекарственных средств для обезболивания родов.
Немедикаментозные методы воздействия. Включают в себя интраназальную электростимуляцию, электростимуляцию сосков молочных желез, иглорефлексотерапию.
Интраназальная электростимуляция основана на рефлекторной взаимосвязи верхних дыхательных путей ("назогенитальные зоны" слизистой оболочки носа) и внутренних половых органов. Метод предусматривает раздражение рефлексогенных зон (область tuberculum septi и передний отдел нижней раковины) импульсными токами переменной частоты. Продолжительность каждого сеанса составляет 1 ч. Метод оказывается эффективным в плане созревания шейки матки у 87 % беременных, вероятно, за счет появления большого количества сокращений матки по типу Брекстон-Гикса, вместо малых маточных сокращений типа Альварец.
Электростимуляция сосков молочных желез производится с целью ускорения созревания шейки матки и основана на том, что возникающие импульсы воздействуют на супраоптическую область и паравентрикулярные ядра гипоталамуса, что в свою очередь приводит к высвобождению окситоцина из задней доли гипофиза, возникновению маточных сокращений и созреванию шейки матки. Имеются данные литературы о том, что механическое раздражение сосков и ареолы молочных желез приводит к развитию регулярной родовой деятельности у 45,5 % беременных.
Иглорефлексотерапия применяется для снятия страха и напряжения перед родами, для обезболивания последних и регуляции родовой деятельности. Эффект этого метода объясняется тем, что искусственно вызванный поток афферентных импульсов запускает рефлекторную реакцию.
При выборе точек воздействия учитываются рекомендации классической китайской акупунктуры и принцип сегментарной иннервации органов.
В настоящее время предпочтение оказывается электроакупунктуре (ЭЛАП), которая предусматривает электрическое воздействие с помощью генераторов импульсов на иглы. Показанием к применению ЭЛАП являются как недостаточная готовность к родам родовых путей, так и родовозбуждение при преждевременном отхождении околоплодных вод.
Антенатальная диагностика состояния плода
На современном этапе знаний и технических возможностей наиболее оптимальными антенатальными тестами для оценки состояния плода являются ультразвуковое сканирование, исследование сердечной деятельности плода, определение биофизического профиля плода, допплерометрия кровотока в системе мать-плацента-плод, исследование газового состава пуповинной крови. Одни из них (ультразвуковая фетометрия) позволяют оценить физическое развитие плода, его соответствие предполагаемому сроку беременности, исключить наличие пороков развития плода; другие (ультразвуковая плацентография, исследование маточно-плацентарного кровотока) – получить косвенные признаки плацентарной недостаточности; третьи (изучение биофи-зического профиля плода и плодового кровотока, кардиотокография, исследование пуповинной крови) – оценить функциональное состояние плода.Ультразвуковая фетометрия – наиболее надежный объективный метод оценки роста и развития плода, позволяющий в каждый конкретный срок беременности точно определить соответствие размеров плода гестационному возрасту, а также степень отклонения их от нормальных величин. При изучении развития плода во П и Ш триместрах беременности основное внимание уделяется измерению бипариетального размера головки (БПР), размеров живота, длины бедра, которые увеличиваются по мере прогрессирования беременности. К концу беременности скорость роста биометрических показателей плода постепенно снижается: скорость прироста БПР головки уменьшается с 4 мм/нед в 14-15 нед беременности до 1,3 мм/нед в 39-40 нед; длины бедра – от 4,8 до 1,7 мм/нед. Отношение размеров головки и живота плода в норме во II триместре беременности превышает 1, но после 36 нед гестации меняется за счет превалирования размеров живота плода. Этот показатель имеет важное клиническое значение для диагностики нарушений роста плода.
Ценную информацию о состоянии фетоплацентарной системы дает непосредственное изучение плаценты: определение ее локализации, структуры, а также плацентометрия. Чаще всего плацента располагается на передней или задней поверхности матки с переходом на одну избоковых, реже локализуется на дне матки. Данные о влиянии локализации плаценты на рост и развитие плода очень противоречивы, однако большинством исследований доказано, что расположение плаценты существенно не влияет на внутриутробное развитие плода.
Локализация плаценты в различные сроки беременности нестабильна. Установлено, что в большинстве наблюдений по мере прогрессирования беременности происходит ее "миграция" от нижнего сегмента к дну матки. Поэтому окончательное заключение о расположении плаценты следует делать только в конце беременности. Полагают, что смещение плаценты обусловлено как большей скоростью роста тела матки по сравнению с таковой ее нижнего сегмента, так и возникающей, по-видимому, под влиянием выделяемых шейкой матки специфических протеолитических ферментов частичной атрофией плацентарной ткани, располагающейся в нижнем сегменте.
Толщина плаценты при физиологически протекающей беременности постоянно увеличивается в линейной зависимости от 10,9 мм в 7 нед до 35,6 мм в 36 нед (табл. 4.6). В зависимости от патологии беременности может наблюдаться уменьшение или увеличение толщины плаценты.
 Рис. 4.39. Плацента III степени зрелости при доношенной беременности.
Рис. 4.39. Плацента III степени зрелости при доношенной беременности.
Плацента изменяется по мере прогрессирования беременности, обеспечивая все возрастающие потребности плода. Морфологические особенности ее развития в различные сроки беременности находят свое отражение на эхограммах. При неосложненном течении беременности границы переходного периода степени зрелости от 0 в I соответствуют 27-30 нед беременности, из I во II степень – 32-34 нед, из II в III степень – 35-37 нед беременности. Время развития определенной степени зрелости плаценты не всегда постоянно. В некоторых случаях I или II степень зрелости плаценты может сохраняться до конца беременности и не сопровождаться нарушением состояния плода. Однако преждевременное появление изменений III степени зрелости плаценты (до 36-37 нед беременности), т.е. ее "старение", служит маркером хронического страдания плода (рис. 4.39).
Большое внимание в оценке состояния плода должно уделяться коли-честву околоплодных вод. Как известно, околоплодные воды являются биологически активной окружающей плод средой, продуктом обменных процессов, происходящих в организме матери и плода. Количество амниотической жидкости с ростом беременности прогрессивно увеличивается от 500 мл в 30 нед до 1500 мл в конце беременности.
При ультразвуковом исследовании определяют индекс амниотической. жидкости. Для нормально протекающей беременности характерен индекс от 8,1 до 18,0 см.
Выявлена четкая связь между изменением количества околоплодных вод и увеличением отрицательных перинатальных исходов. В настоящее время определение количества околоплодных вод широко применяется в качествеодного из наиболее информативных параметров при изучении биофизического профиля плода.
Помимо изучения анатомических особенностей фетоплацентарной системы, в клинической практике важное значение имеет оценка функционального состояния плода, в первую очередь его сердечной деятельности. При аускультации в норме частота сердечных сокращений плода 120- 160 уд/мин. Более точную информацию о характере сердечной деятельности плода можно получить на основании ЭКГ, ФКГ, КТГ.
При антенатальной электрокардиографии, помимо частоты сердечных сокращений, удается определить желудочковый комплекс QRS. В норме зубец R заострен, продолжительность желудочкового комплекса составляет 0,03-0,07 с, вольтаж колеблется от 9 до 65 мкВ» с увеличением срока беременности отмечается его постепенное повышение.
При фонокардиографии колебания продолжительности и амплитуды тонов сердца плода весьма вариабельны в III триместре, составляя в среднем: I тон – 0,09 с, II тон – 0,07 с; III и ГУ тоны регистрируются редко. Возможно проведение фазового анализа сердечной деятельности при одновременной регистрации ЭКГ и ФКГ плода. При физиологически протекающей беременности длительность фазы асинхронного сокращения составляет 0,02-0,05 с, механическая систола продолжается 0,15-0,22 с, общая диастола – 0,17-0,26 с, диастола желудочков – 0,15-0,25 с. Отношение длительности общей систолы к длительности общей диастолы в конце неосложненной беременности составляет в среднем 1,23.
В современном акушерстве для оценки состояния плода во время бер-еменности широко используется кардиомониторное наблюдение, или кардиотокография (КТГ). Во время беременности КТГ позволяет осуществлять динамический контроль за состоянием плода, оценивать эффективность проводимой терапии, прогнозировать течение предстоящих родов и выбирать оптимальный способ родоразрешения. При нормально протекающей беременности базальный ритм сердечных сокращений составляет 120-160 уд/мин, амплитуда мгновенных изменений частоты сердечных сокращений – от 10 до 25 уд/мин и их частота – 7-12 осцилляции в минуту. При физиологическом течении беременности наиболее часто отмечаются слегка ундулирующий (5-10 уд/мин) и ундулирующий (10-25 уд/мин) типы вариабельности базального ритма. Особое внимание следует обращать на появление немого и сальтаторного типов вариабельности, особенно в сочетании с тахикардией или брадикардией. При физиологически протекающей беременности немой тип вариабельности базального ритма (0-5 уд/мин) может быть обусловлен воздействием наркотических и седативных средств.
При неосложненной беременности акцелераций наблюдаются почти постоянно с частотой 4-5 и более за 30-минутный интервал, децелерации отсутствуют. Спорадические акцелераций чаще всего связаны с двигательной активностью плода. Снижение частоты акцелераций или их отсутствие, появление децелерации являются неблагоприятным прогностическим признаком.
Большую помощь в оценке состояния плода оказывают функциональные пробы. При нормальном течении беременности в ответ на шевеление плода частота сердечных сокращений в среднем увеличивается на 10 в минуту и более – положительный нестрессовый тест. Более чем в 99 % наблюдений положительный нестрессовый тест является достоверным критерием благополучного состояния плода. Отсутствие реакции сердечной деятельности плода в ответ на движения свидетельствует о внутриутробном страдании его. Тест может быть ложноотрицательным в период физиологического покоя плода, в этом случае требуется повторное исследование.
Для оценки состояния плода во время беременности целесообразно учитывать также двигательную активность плода. Подсчет самой беременной количества движений плода в течение 30 мин в утренние и вечерние часы позволяет оценить состояние плода. В норме средняя частота шевелений плода составляет около 3 за 10 мин; их учащение и усиление, а также резкое уменьшение частоты движений плода могут свидетельствовать о страдании плода и служат основанием для более детального обследования беременной. Наряду с субъективной оценкой движений плода самой беременной возможна их оценка при ультразвуковом исследовании.
Дыхательные движения плода (ДДП), определяемые при ультразвуковом исследовании, являются хотя и косвенной, но достаточно ценной информацией о состоянии центральной нервной системы плода, роль которой в регуляции дыхательной активности убедительно доказана. Считают, что дыхательные движения являются одним из факторов, поддерживающих скорость кровообращения у плода и тем самым регулирующих количество крови, протекающей в единицу времени через сосуды плаценты. С ДДП связывают гемодинамические изменения: повышение артериального давления, учащение пульса, увеличение скорости кровотока в сосудах пуповины, а также кровотока в аорте и нижней полой вене. Некоторые авторы усматривают физиологическое значение внутриутробных ДДП в подготовке дыхательного аппарата к осуществлению дыхательной функции в будущем; полагают, что ДДП необходимы для нормального развития легких у плода.
Главным параметром ДДП считается сам факт наличия или отсутствия дыхательных движений в течение 15-30 мин. К концу неосложненной беременности частота дыхательных движений плода составляет около 50 в 1 мин. В норме ДДП сочетаются с периодами апноэ, длительность которого составляет беи более. Продолжительность ДДП при физиологическом течении беременности составляет в среднем 50-90 % времени исследования. Установлено значительное снижение дыхательной активности у плодов при осложненном течении беременности.
Комбинированная регистрация нескольких биофизических показателей плода (БФПП) позволяет обеспечить достоверную диагностику и значительно улучшает антенатальный мониторинг. Сочетанное определение дыхательной и двигательной активности плода, его сердечной деятельности и мышечного тонуса, т.е. показателей, находящихся под регулирующим влиянием центральной нервной системы плода, с большей достоверностью отражают его функциональное состояние. При этом снижается частота ложноположительных и ложноотрицательных результатов по сравнению с изучением каждого из этих параметров в отдельности. В норме оценка БФПП плода составляет 8-12 баллов.
Так как БФПП является ценным диагностическим критерием внутриутробного состояния плода, его исследование нашло широкое применение при ряде осложнений беременности. При этом степень снижения оценки БФПП зависит не от характера, а от тяжести осложнения беременности.
Одним из наиболее перспективных диагностических методов, применяемых для оценки гемодинамики в системе мать-плацента-плод, является допплерометрия. Кровоток в артериальных сосудах плода и маточной артерии при неосложненном течении беременности характеризуется непрерывными кривыми, отражающими поступательный кровоток на протяжении всего сердечного цикла, без нулевых и отрицательных значений в фазу диастолы. При качественном анализе кровотока в артерии пуповины, аорте плода и маточной артерии на протяжении 111 триместра неосложненной беременности установлено постепенное снижение показателей периферического сосудистого сопротивления, выражающегося уменьшением индексов кровотока (табл. 4.7).
При неосложненном течении беременности значения систолодиастолического отношения (СДО) в маточных артериях после 18-20 нед не должны превышать 2,4. Снижение индексов сосудистой резистентности в артерии пуповины на протяжении 11 и III триместров беременности свидетельствует об уменьшении сосудистого сопротивления плаценты, которое вызвано интенсивным ростом ее терминального русла, связанного с процессами развития и васкуляризации концевых ворсин плаценты.
Для комплексной оценки кровотока в системе мать-плацента-плод необходимо, помимо артерии пуповины, аорты плода, маточной артерии, исследовать кровоток и в мозговых сосудах плода. При сопоставлении кровообращения в плодово-плацентарном звене и мозгового кровотока плода установлена относительная стабильность цереброплацентарного отношения при неосложненной беременности, что указывает на сохранение постоянного уровня кровоснабжения головного мозга плода.
Оценить состояние плода позволяет исследование крови плода, полученной при кордоцентезе. В норме по мере прогрессирования беременности у плода постепенно снижается Р0 в артерии, вене пуповины и сосудах межворсинчатого пространства. Несмотря на снижение Р0 , содержание кислорода в вене пуповины остается постоянным вследствие компенсаторного увеличения концентрации гемоглобина. Содержание С02, гидрокарбонатов, оснований и лактата в вене пуповины повышается по мере увеличения гестационного возраста плода. Величина рН крови плода при физиологически протекаю-щей беременности существенно не изменяется (7,38 + 0,04).
Косвенную информацию о состоянии плода дает исследование околоплодных вод во время беременности. При неосложненном течении беременности при амниоскопии определяется достаточное количество светлых, прозрачных опалесцирующих околоплодных вод с наличием белой сыровидной смазки. При доношенной беремености рН околоплодных вод составляет от 6,98 до 7,23; Р0 варьирует от 120 до 78 мм рт. ст.
Глава 5. Физиология родов
Роды (partus) – физиологический процесс изгнания плодного яйца из матки после достижения плодом жизнеспособности.При современном уровне перинатальных технологий, позволяющих осуществлять интенсивную терапию новорожденных с экстремально малой массой, жизнеспособным считается плод, масса которого составляет 500 г и более, а срок гестации – 22 нед и более (ВОЗ).
Роды могут быть своевременными (partus maturus normalis) при сроке беременности 37-42 нед, преждевременными (partus praematurus) при сроке беременности менее 37 1нед, запоздалыми (partus seretinus) при сроке беременности свыше 42 нед .
Женщину во время родов принято называть роженицей (parturiens); первородящую – primipara, повторнородящую – multipara.
Причины наступления родов
Причины наступления родовой деятельности до настоящего времени не установлены.Теории причин развития родовой деятельности. Для объяснения причин наступления родовой деятельности было выдвинуто немало теорий, многие из которых представляют исторический интерес.
По мнению Гиппократа, роды наступают потому, что плод за счет голода, наступившего в конце беременности, сам выходит из полости матки, упираясь ножками в ее дно (головкой вперед). Согласно теории "инородного тела", роды наступают потому, что нарушается интимная связь между маткой и плодом за счет жирового перерождения тканей плаценты и эндометрия.
В последующем были выдвинуты различные теории наступления родов (механическая, иммунная, плацентарная, химическая, гормональная, эндокринная) .
Сторонники механической теории считали, что причинами возникновения родов являются возбуждение нервных рецепторов, расположенных в нижнем сегменте матки, в результате давления головкой плода.
С развитием учения об иммунитете связано появление иммунной теории, согласно которой в ответ на выделение синцитиотоксинов в
В настоящее время, помимо самопроизвольных родов, выделяют: 1. индуцированные роды – искусственное родовозбуждение по показаниям со стороны либо матери, либо плода; 2. программированные роды предусматривают процесс рождения ребенка в дневное, удобное для врача время. С этой целью в срок предполагаемых родов при полной зрелости плода проводится родовозбуждение.
В плаценте вырабатываются антитела – синцитиолизины. К концу беременности количество синцитиотоксинов возрастает настолько, что не происходит их нейтрализации. За счет этого матка становится легковозбудимой, в ней возникают импульсы, необходимые для сокращения. Однако поиски специфических синцитиотоксинов не увенчались успехом. Возможен другой механизм влияния иммунологических реакций на развитие родовой деятельности. По мнению некоторых ученых, рождение плода может уподобляться реакции отторжения трансплантата.
Согласно плацентарной теории, роды начинаются с возникновением различных изменений в плаценте, которые заключаются в перерождении ворсин и прекращении тормозящего влияния трофобласта на сократительную деятельность матки, а также с появлением в плаценте веществ, вызывающих схватки и начало родового акта. Эта теория не получила подтверждения.
Согласно химической теории, начало родового акта сопряжено с изменением состава неорганических веществ в матке и ионной среды в организме беременной, с накоплением угольной кислоты и других веществ, вызывающих сокращение мышц.
С развитием эндокринологии причины наступления родов стали объяснять изменением гормонального фона перед родами, способствующими повышению сократительной способности матки (эндокринная теория).
Представленный перечень теорий наступления родовой деятельности указывает на сложность изменений, происходящих у беременных перед родами и в родах.
Современные представления о причинах наступления родов. Роды протекают при наличии сформированной "родовой доминанты", представляющей собой единую динамическую систему, объединяющую как высшие центры регуляции (центральная и вегетативная нервная система, гормональная регуляция), так и исполнительные органы (матка и фетоплацентарный комплекс) (рис. 5.1).
Нормальный родовой акт определяется вовлечением в доминантный процесс коры большого мозга, в частности височных долей больших полушарий, а также значительным увеличением межполушарных связей, облегчающих координацию соматических функций.
Важная часть координационных центров родовой деятельности находится в подкорковых структурах мозга: в гипоталамусе – в миндалевидных ядрах лимбического комплекса, гипофизе.
Перед началом родов постепенно усиливаются тормозные процессы в коре большого мозга и повышается возбудимость подкорковых структур, регулирующих родовую деятельность. Одновременно увеличивается возбудимость периферических отделов нервной системы, в частности интерорецепторов, передающих возбуждение с половых органов. Афферентная импульсация от матки, которая формирует безусловные рефлексы, связанные с родовым актом, усиливается за счет зрелости фетоплацентарного комплекса. Перед родами она превышает порог чувствительности воспринимающих подкорковых структур, способствуя наступлению родов.
Выраженность рефлекторных реакций, лежащих в основе родов, зависит от тонуса различных отделов вегетативной нервной системы, иннервируюЩих матку. Все отделы матки (тело, нижний сегмент) имеют двойную вегетативную иннервацию. Адренергическая иннервация преобладает в продольно расположенных мышечных пучках в теле матки. Холинергическая иннервация наблюдается главным образом в циркулярно и спиралеобразно расположенных мышечных волокнах, находящихся преимущественно в нижнем сегменте матки. Там же расположены М-холинорецепторы. Адренорецепторы в матке представлены двумя типами: cqи сЛ-адренорецепторами. Они расположены на мембране гладкой мышечной клетки. арАдренорецепторы вызывают повышение возбудимости, тонуса и сократительной активности миометрия; В2-адренорецепторы оказывают противоположное действие на миометрии. Воздействие на В2-адренорецепторы вызывает снижение тонуса, возбудимости и сократительной активности матки. Перед родами увеличиваются количество и активность арадренорецепторов и Мхолинорецепторов.
 Рис. 5.1. Регуляция сократительной деятельности матки (схема). Сплошные стрелки – активация (стимуляция), пунктирные – угнетение (подавление): а – а-адренорецепторы; р – (3-адренорецепторы; р – М-холинорецепторы.
Рис. 5.1. Регуляция сократительной деятельности матки (схема). Сплошные стрелки – активация (стимуляция), пунктирные – угнетение (подавление): а – а-адренорецепторы; р – (3-адренорецепторы; р – М-холинорецепторы.
Вегетативная регуляция сокращений матки осуществляется через медиаторы, главными из которых являются ацетилхолин, адреналин и норадреналин.
Ацетилхолин оказывает стимулирующий эффект на мышцы матки.
Перед родами и в родах в плазме крови беременных наблюдается высокий уровень активной формы ацетилхолина при одновременно низкой активности ацетилхолинэстеразы.
Катехоламины (адреналин, норадреналин) опосредуют адренергические влияния на миометрий, взаимодействуя с аг и р2-адренорецепторами гладких мышечных клеток. Активирующий эффект катехоламинов в основном реализуется их воздействием на арадренорецепторы гладких мышечных клеток миометрия. Тормозное влияние катехоламинов на миометрий связано с взаимодействием их с рЛ-адренорецепторами гладких мышечных клеток.
Особенности нервной регуляции родовой деятельности сопряжены с изменением гормонального статуса перед родами. Только при наличии определенных гормональных соотношений возможны рефлекторная возбудимость матки и те нейрофизиологические изменения, при которых она способна регулярно сокращаться на протяжении родов. Из всего комплекса регулирующих компонентов, дублирующих друг друга в период подготовки к родам, особое значение имеет повышение синтеза эстрогенов (в основном активной их фракции – эстрадиола) на фоне снижения уровня основного гормона беременности – прогестерона, блокирующего сокращение мышц матки. Перед родами содержание прогестерона и его метаболитов в крови и моче снижается и соотношение в моче эстриол/прегнандиол составляет 1:1 (во время беременности 1:100).
Под действием эстрогенов происходят следующие изменения: 1. увеличивается кровоток в миометрий, интенсивность окислительновосстановительных процессов, синтез сократительных белков миометрия (актомиозин), энергетических соединений (АТФ, гликоген) и утеротонических простагландинов; 2. повышается проницаемость клеточных мембран для ионов (К , Са , Na ), приводящих к снижению мембранного потенциала покоя, увеличению чувствительности клеток миометрия к раздражению; 3. депонируется кальций в саркоплазматической сети; 4. повышается активность фосфолипаз и скорость "арахидонового каскада" с образованием простагландинов.
Подобные изменения способствуют интенсификации сократительной способности матки, ускорению "созревания" ее шейки.
В развитии родовой деятельности, кроме эстрогенов, ключевую роль играют простагландины , которые, по современным представлениям, являются основными стимуляторами начаЛ родовой деятельности. Местом синтеза простагландинов в беременной матке являются плодные (амнион и хорион) и децидуальная оболочки. При этом в амнионе и хорионе образуется простагландин Е (ПГЕ), а в децидуальной оболочке и миометрий синтезируется как ПГЕ, так и PGF2a (материнские). Выработка простагландинов в конце беременности обусловлена процессами старения и дегенерации структурных элементов плаценты, децидуальной оболочки, амниона, поскольку эти процессы сопряжены с активацией фосфолипаз и образованием арахидоновой кислоты, а в последующем – простагландинов. Простагландины стимулируют следующие процессы: 1. образование на мембране а-адренорецепторов и рецепторов к другим утеротоническим соединениям (ацетилхолин, окситоцин, серотонин); 2. обеспечение автоматического сокращения матки (схватки); 3. угнетение продукции окситоциназы.
Наряду с повышением синтеза эстрогенов и простагландинов для начала родов имеет важное значение повышение активности других нейрогуморальных медиаторов и гормонов (окситоцин, серотонин, кинин, гистамин).
Окситоцин является важным регулятором сократительной деятельности матки. Многими авторами он рассматривается как пусковой фактор в развитии родовой деятельности. Окситоцин – это синергист ацетилхолина и простагландинов. Его концентрация в плазме крови возрастает по мере увеличения срока беременности. Действие окситоцина на сократительную деятельность матки зависит от гормонального фона, прежде всего от оптимального уровня эстрогенов, а также функционального состояния матки, ее готовности к спонтанной активности.
Действие окситоцина связано со следующими процессами: 1. усиление мембранного потенциала и повышение возбудимости мышечной клетки; 2. увеличение скорости связывания ацетилхолина рецепторами миометрия и освобождение его из связанного состояния; 3. возбуждение а-адренорецепторов; 4. угнетение активности холинэстеразы.
В результате действия окситоцина повышается тонус матки, стимулируются частота и амплитуда схваток.
Серотонин оказывает выраженное влияние на состояние и функцию клеток миометрия, угнетает активность холинэстеразы и усиливает действие ацетилхолина, способствует передаче возбуждения с двигательного нерва на мышечное волокно.
Действие серотонина на матку может осуществляться двумя путями: непосредственно на миометрии через a-рецепторы и через центральную нервную систему путем усиления выработки окситоцина нейрогипофизом.
Кинины усиливают сократительную способность матки за счет увеличения скорости кровотока в ней.
Определенное значение в развитии родовой деятельности имеет гистамин, способствующий выработке гипофизом окситотических веществ.
Существует предположение, что изменения гормональных взаимоотношений у матери перед родами тесно связаны со степенью зрелости гормональной регуляции у плода, которая генетически детерминирована завершенностью процессов его роста и развития. В первую очередь важное значение имеет зрелость эпифиз-гипоталамо-гипофизарной системы плода.
Влияние гормонов плода на подготовку и начало родов складывается из следующих моментов: 1. при повышении уровня плодового кортикотропина в крови матери увеличивается содержание эстрадиола и уменьшается количество прогестерона, хориогонадотропина и хориомаммотропина (плацентарного лактогена); 2. выделяющийся перед родами у плода окситоцин действует аналогично окситоцину матери; 3. перед родами уровень мелатонина в крови у плода повышается, а у матери – понижается. Указанные изменения концентрации мелатонина способствуют перестройке стероидного гемостаза и формированию эстрогенного фона в организме беременной. Мелатонин изменяет соотношение гтролактин/фоли/лютропин в сторону увеличения двух последних. В результате происходит повышение синтеза эстриола. Наряду с этим снижение уровня мелатонина в крови матери приводит к освобождению лейкотриенов (медленно реагирующих субстанций анафилаксии), что в свою очередь ведет к активации кейлонной активности и торможению дальнейшего увеличения массы плода, его органов и тканей и способствует активации механизмов подготовки организма беременной к родам. Одновременное подавление синтеза иммунодепрессантов пролактина и хориогонадотропина приводит к усилению трансплантационного иммунитета и стимулирует отторжение плода как аллотрансплантата; 4. ишемия оболочек плодного яйца перед родами, обусловленная повышением внутри маточного давления, активизирует "арахидоновый каскад" с выделением утеротонических простагландинов.
Наряду с изменениями в нервной и гуморальной регуляции перед родами существенные изменения происходят в репродуктивной системе, в том числе в матке.
В основе сокращения мышц матки, как и других органов (сердца, сосудов), лежит процесс превращения химической энергии в механическую.
Особое значение для начала родов имеют следующие процессы, происходящие в матке: 1. увеличение в миометрий интенсивности метаболических процессов, скорости потребления кислорода (в 3,5 раза), содержания сократительного белка актомиозина (на 25 %) , гликогена, глутатиона, фосфорных соединений (АТФ, креатинфосфат, фосфокреатинин), играющих большую роль в энергетических процессах мышечной ткани; 2. изменения соотношения между мышечной и соединительной тканью в сторону резкого преобладания первой из них, особенно в теле матки.
В результате изменений, происходящих в мышечных клетках, снижается мембранный потенциал, увеличивается их возбудимость, усиливается спонтанная активность, повышается чувствительность к контрактильным веществам.
С началом родов в матке формируется группа клеток, в которых первично возникает возбуждение, распространяющееся в последующем на всю матку. Эта область называется водителем ритма ("пейсмекер"). Она располагается в дне матки, ближе к правому углу.
Изменения соотношения гормонов и биологически активных веществ, влияющих на возбудимость и сократительную деятельность матки перед родами, проходит в несколько этапов: первый этап характеризуется состоянием зрелости гормональной регуляции плода; второй этап – активацией эстрогенов и изменениями в матке; третий этап – синтезом утеротонических соединений, в первую очередь простагландинов, окситоцина – основных факторов, обеспечивающих развитие родовой деятельности.
Важное значение имеют не только выброс утеротонических соединений перед родами, но и пульсирующий тип их синтеза во время родов, что обеспечивает регулярный характер родовой деятельности.
В результате изменений, происходящих в нервной и гуморальной регуляции, а также в самой матке, формируется попеременное возбуждение центров симпатической и парасимпатической иннервации: 1. под влиянием медиаторов симпатической нервной системы (норадреналин и адреналин) происходит сокращение продольно расположенных мышечных пучков в теле матки миометрия при одновременном активном расслаблении циркулярно (поперечно) расположенных пучков в нижнем сегменте; 2. в ответ на максимальное возбуждение центра симпатической нервной системы и выделение большого количества норадреналина происходит возбуждение центра парасимпатической нервной системы; 3. под влиянием медиатора парасимпатической нервной системы (ацетилхолин) сокращаются циркулярные мышцы при одновременном расслаблении продольных; 4. по достижении максимального сокращения циркулярных мышц наступает максимальное расслабление продольных; 5. после сокращения матки наступает период полного ее расслабления (пауза между схватками), когда происходит восстановительный синтез сократительных белков миометрия.
Предвестники родов
Наступлению родов предшествует ряд клинических симптомов, объединенных в понятие "предвестники (предшественники) родов". Их появление свидетельствует о готовности беременной к родам.О готовности к родам свидетельствуют следующие признаки: 1. перемещение центра тяжести тела беременной кпереди, в связи с чем плечи и голова отводятся назад ("гордая поступь"); 2. "опущение живота" беременной за счет растяжения нижнего сегмента и вставления головки во входе малого таза, отклонения дна матки кпереди в результате некоторого снижения тонуса брюшного пресса и связанного с этим облегчения дыхания (наблюдается за 2-3 нед до родов); 3. выпячивание пупка; 4. необычные для последних месяцев беременности ощущения женщины – повышенная возбудимость или, наоборот, состояние апатии, "приливы" к голове, что объясняется изменениями в центральной и вегетативной нервной системе перед родами (наблюдается за несколько дней до родов); 5. снижение массы тела беременной на 1-2 кг (за 2-3 дня до родов); 6. понижение двигательной активности плода; 7. появление в области крестца и нижней части живота нерегулярных ощущений, сначала тянущего, затем схваткообразного характера; 8. выделение из половых путей густой тягучей слизи (так называемой слизистой пробки). Часто выделение слизистой пробки сопровождается незначительными кровянистыми выделениями из-за неглубоких надрывов краев зева; 9. шейка матки перед родами становится "зрелой". "Зрелость" шейки матки обусловлена в основном морфологическими изменениями коллагена и эластина, размягчением соединительной ткани, повышением ее гидрофильности, "разволокнением" мышечных пучков. За счет этих изменений шейка становится мягкой и растяжимой, т.е. размягчается на всем протяжении, включая область внутреннего зева (размягчающегося обычно последним), влагалищная ее часть укорачивается (до 1,5-2 см и менее). Канал шейки матки выпрямляется, плавно переходя в область внутреннего зева, через своды иногда удается пальпировать швы, роднички или другие опознавательные признаки предлежащей части плода. Шейка после созревания располагается строго по продольной оси таза, наружный зев располагается на уровне седалищных костей.
"Зрелость" шейки матки определяется в баллах. Предложены различные схемы определения "зрелости" шейки матки. За рубежом наибольшее распространение получила шкала Е.Н.Bishop (1964), а также эта шкала в модификации J.E.Burnett (1966).
В нашей стране наиболее распространена шкала M.S.Bnrnhill в модификации Е.А.Чернухи. Согласно этой методике, при влагалищном исследовании определяют консистенцию шейки матки, ее длину, проходимость цервикального канала и расположение шейки матки по отношению к проводной оси таза. Каждый признак оценивают в баллах – от 0 до 2. Суммарная оценка отражает степень "зрелости" шейки матки. При оценке 0-2 балла шейку матки следует считать "незрелой", 3-4 балла – "недостаточно зрелой", 5-8 баллов – "зрелой" (табл. 5.1).
Периоды родов. Изменения в матке во время родов
В клиническом течении родов выделяют три периода: первый период – раскрытие шейки матки; второй период – изгнание плода; третий период – последовый.Продолжительность физиологических родов у первородящих составляет 12-16 ч, у повторнородящих – 8-10 ч. В предыдущих руководствах приводились следующие значения течения нормальных родов: 15-20 и 10-12 ч соответственно.
Первый период – период раскрытия шейки матки. Начинается с появления регулярных маточных сокращений (схваток) и заканчивается полным раскрытием наружного зева шейки матки. У первородящих продолжительность первого периода родов составляет 10-11 ч, у повторнородящих – 7_9 ч. Схватки сначала бывают короткими, слабыми и редкими (через 15-20 мин). В последующем нарастают их продолжительность, сила и частота. Промежуток между двумя смежными схватками называется паузой.
В раскрытии шейки матки имеют значение два механизма: 1. сокращение мышц матки, 2. действие на шейку изнутри плодного пузыря или предлежащей части за счет повышения внутри маточного давления.
Основным механизмом раскрытия шейки матки является сокращение маточной мускулатуры. Характер его сокращения обусловлен особенностями расположения мышечных волокон в теле матки (преимущественно продольное) и нижнем сегменте (преимущественно циркулярное). В силу указанного строения тело матки и нижний сегмент выполняют разные функции: шейка матки раскрывается, а тело сокращается, чтобы раскрыть шейку матки и изгнать плод и плаценту.
Во время каждой схватки в мускулатуре матки происходят одновременно три процесса: 1. сокращение мышечных волокон матки (контракция), 2. взаимное смещение волокон относительно друг друга (ретракция), 3. растяжение мышечных волокон (дистракция).
В теле матки с преобладанием мышечных волокон в основном происходят контракция и ретракция. Во время схваток мышечные элементы, значительно растянутые в длину, при сокращении укорачиваются, смещаются, переплетаются друг с другом. Во время паузы волокна не возвращаются в состояние первоначального расположения, вследствие чего происходит смещение значительной части мускулатуры из нижних отделов матки в верхние. В результате стенки в теле матки прогрессирующе утолщаются. С ретракционной перегруппировкой мышц тесно связан параллельно идущий процесс дистракции шейки матки – растяжение круговой мускулатуры шейки. Продольно расположенные мышечные волокна тела матки в момент контракции и ретракции натягивают и влекут за собой циркулярно расположенные мышечные волокна шейки матки, способствуя раскрытию шейки матки.
Механизм сократительной деятельности матки во время родов детально изучен в 1960 г. Caldeyro-Barcia и Poseiro (Монтевидео, Уругвай). Исследователи вводили в стенку матки женщины на разных уровнях по время родовой деятельности эластичные микробаллончики, реагирующие на сокращение мышц, а в полость матки – катетер, реагирующий на внутриматочное давление. В результате этого регистрировалась гистерограмма – кривая сокращений матки (рис. 5.2).
Зарегистрировав амплитуду сокращения матки в различных ее отделах, а также суммарную волну внутри маточного давления в амнионе, авторы выдвинули положения, которые приняты акушерами всех стран. Первое положение заключается в законе тройного нисходящего градиента, второе – в возможном количественном выражении силы маточных сокращений (единицы Монтевидео, в которых выражают маточную активность). Единица
 Рис. 5.2. Тройной нисходящий градиент (схема) Caldeyro-Barcia R., 19651.
Рис. 5.2. Тройной нисходящий градиент (схема) Caldeyro-Barcia R., 19651.
Монтевидео представляет собой произведение средней амплитуды схватки на количество схваток за 10 мин. В норме эта величина равна 150-300 ЕМ.
Принцип тройного нисходящего градиента заключается в следующем: 1. волна сокращения матки имеет определенное направление – сверху вниз. Сокращение матки начинается в области одного из трубных углов, который называется водителем ритма ("пейсмекер"). Затем волна сокращения распространяется от одного маточного угла к другому, переходит на тело с убывающей продолжительностью и силой вниз к нижнему сегменту. Скорость распространения сокращений матки составляет 2-3 см/с. Через 15-20 с сокращением охватывается вся матка. Несмотря на то что различные отделы матки начинают сокращаться в различное время, максимальное сокращение всех мышц происходит одновременно, что создает оптимальные условия реализации сократительной активности матки; 2. длительность волны сокращения уменьшается по мере ее перемещения от дна матки к нижнему сегменту, обеспечивая более выраженный эффект действия верхних отделов матки; 3. интенсивность (амплитуда) сокращения матки также уменьшается по мере его распространения от верхних отделов матки к нижним. В теле сила сокращения матки создает давление 50-120 мм рт. ст., а в нижнем сегменте – только 25-60 мм рт. ст., т.е. верхние отделы матки сокращаются в 2-3 раза больше, чем нижние, вызывая смещение мышечных волокон тела матки кверху.
 Рис. 5.3. Повышение внутриматочного давления и образование плодного пузыря.
Рис. 5.3. Повышение внутриматочного давления и образование плодного пузыря.
 Рис. 5.4. Родовые пути в период изгнания
1 – Краевая вена; 2 – контракционное кольцо; 3 – мочевой пузырь; 4 – плацента; 5 – заднепроходное отверстие; 6 – наружный зев.
Рис. 5.4. Родовые пути в период изгнания
1 – Краевая вена; 2 – контракционное кольцо; 3 – мочевой пузырь; 4 – плацента; 5 – заднепроходное отверстие; 6 – наружный зев.
При сокращении матки по принципу тройного нисходящего градиента в родах создаются необходимые для открытия шейки матки натяжение циркулярной мускулатуры и повышение внутриматочного давления.
Во время сокращения вследствие равномерного давления со стороны стенок матки околоплодные воды по законам гидравлики устремляются в сторону нижнего сегмента матки (рис. 5.3). В центре нижнего отдела плодовместилища располагается внутренний зев канала шейки матки, в котором отсутствует сопротивление стенок матки. К внутреннему зеву смещаются околоплодные воды под действием повышенного внутриматочного давления. Под напором околоплодных вод нижний полюс плодного яйца отслаивается от стенок матки и внедряется во внутренний зев канала шейки. Эта часть оболочек нижнего полюса яйца, внедряющаяся вместе с околоплодными водами в канал шейки матки, называется плодным пузырем. Во время схваток плодный пузырь натягивается и все глубже вклинивается в канал шейки матки, расширяя ее изнутри.
Таким образом, в механизме раскрытия шейки матки имеет значение действие двух сил, направленных противоположно: 1. влечение снизу вверх поперечно расположенной мускулатуры нижнего сегмента за счет контракции и ретракции продольной мускулатуры тела матки 2. давление сверху вниз за счет плодного пузыря или предлежащей части.
По мере раскрытия шейки матки происходят истончение и окончательное формирование нижнего сегмента из перешейка и шейки матки. Граница между истонченным нижним сегментом и телом матки имеет вид борозды и называется контракционным кольцом (рис. 5.4). Контракционное кольцо является функциональным образованием, свидетельствующим о хорошей сократительной способности матки. Высота стояния контракционного кольца над лонным сочленением коррелирует со степенью раскрытия шейки матки: чем больше раскрывается шейка матки, тем выше располагается контракционное кольцо над лонным сочленением.
Раскрытие шейки матки происходит неодинаково у первородящих и повторнородящих. У первородящих вначале раскрывается внутренний зев, шейка становится тонкой (сглаживается), а затем раскрывается наружный зев (рис. 5.5). У повторнородящих наружный зев раскрывается почти одновременно с внутренним, и в это время происходит укорочение шейки матки (рис. 5.6). Раскрытие шейки матки считается полным, когда зев раскрывается до 10-12 см. Одновременно с раскрытием шейки матки в I периоде, как правило, начинается продвижение предлежащей части плода через родовой канал. Головка плода начинает опускаться в полость таза с началом схваток, находясь к моменту полного раскрытия шейки чаще всего большим сегментом во входе в малый таз или в полости таза.
При головном предлежании по мере продвижения головки плода происходит разделение околоплодных вод на передние и задние, так как головка прижимает стенку нижнего сегмента матки к костной основе родового канала. Место охвата головки стенками нижнего сегмента называется внутренним поясом соприкосновения (прилегания), который делит околоплодные воды на передние, находящиеся ниже пояса соприкосновения, и задние – выше пояса соприкосновения (рис. 5.7).
Плодный пузырь утрачивает свою физиологическую функцию к моменту полного раскрытия шейки матки. Различают плоский пузырь, в котором отсутствуют воды. Такой пузырь не образует выпуклости, и плодные оболочки охватывают головку плода. Плоский плодный пузырь может задерживать течение родов.
После полного или почти полного раскрытия шейки матки оболочка плодного пузыря под влиянием повышенного внутриматочного давления разрывается и передние воды изливаются (своевременное излитие околоплодных вод).
Если плодные оболочки при полном раскрытии зева не разрываются, их необходимо вскрыть.
Если разрыв плодных оболочек происходит до начала родовой деятельности, то говорят о преждевременном, или дородовом, излитии околоплодных вод; если воды изливаются после начала родов, но до полного или почти полного открытия шейки матки, – о раннем излитии вод. При чрезмерной плотности оболочек плодный пузырь разрывается позже наступления полного раскрытия шейки матки – запоздалый разрыв плодного пузыря. Изредка оболочки плодного пузыря не разрываются, и плод рождается покрытый плодными оболочками – рождение в "сорочке". Иногда пузырь рвется не в нижнем полюсе, около наружного зева, а выше ("высокий разрыв"). В таких случаях при вступившей и продвигающейся головке отверстие в плодном пузыре закрывается, и при влагалищном исследовании находят напрягающийся плодный пузырь. После излитая околоплодных водсхватки на некоторое время могут прекращаться или ослабевать, а затем вновь становятся сильными.
Пока плодный пузырь цел, внутриматочное давление на предлежащую часть плода равномерно или почти равномерно. После же вскрытия плодного пузыря создаются совершенно иные условия, так как внутриматочное давление выше, чем внешнее (атмосферное) давление. Это способствует образованию на предлежащей части родовой опухоли.
Полное раскрытие зева, совпадающее обычно со вскрытием плодного пузыря (излитие околоплодных вод), указывает на окончание первого периода родов – периода раскрытия. С окончанием первого периода начинается второй период родов – период изгнания.
Второй период – период изгнания. Это время от момента полного раскрытия маточного зева до рождения плода.
 Рис. 5.5. Изменения в шейке матки при первых родах (схема).
а – шейка сохранена; б – начало сглаживания шейки; в – шейка сглажена;А г – полное открытие шейки матки: 1 – шейка матки, 2 – перешеек, 3 – внутренний зев.
Рис. 5.5. Изменения в шейке матки при первых родах (схема).
а – шейка сохранена; б – начало сглаживания шейки; в – шейка сглажена;А г – полное открытие шейки матки: 1 – шейка матки, 2 – перешеек, 3 – внутренний зев.
 Рис. 5.6. Изменения в шейке матки при повторных родах (схема).
б – одновременное сглаживание и раскрытие шейки; в – полное раскрытие шейки матки: 1 – шейка матки, 2 – перешеек, 3 – внутренний зев.
Рис. 5.6. Изменения в шейке матки при повторных родах (схема).
б – одновременное сглаживание и раскрытие шейки; в – полное раскрытие шейки матки: 1 – шейка матки, 2 – перешеек, 3 – внутренний зев.
Период изгнания продолжается у первородящих от 1 до 2 ч, у повторнородящих имеет весьма различную продолжительность: от 5-10 мин до 1 ч.
После излития околоплодных вод схватки становятся менее интенсивными, объем полости матки значительно уменьшается, стенки матки приходят в тесное соприкосновение с плодом; схватки усиливаются. К сокращению матки присоединяется сокращение брюшного пресса (брюшной стенки), диафрагмы и мышц тазового дна, что характеризует развитие потуг. Потуги являются рефлекторным актом и возникают благодаря давлению предлежащей части плода на нервные окончания, заложенные в шейке матки и в мышцах тазового дна. Желание тужиться непроизвольно и неудержимо. В результате развивающихся потуг внутриматочное давление повышается еще сильнее, чем в периоде раскрытия; их сила направлена на изгнание плода из матки.
Это становится возможным благодаря тому, что матка не только соединена с влагалищем, но и фиксирована к стенкам таза посредством связочного аппарата – широких, круглых и крестцово-маточных связок, соединительнотканной сети, заложенной в клетчатке (retinaculum uteri), и др.
В результате повышения внутриматочного давления плод совершает ряд сложных движений, приближается предлежащей частью к тазовому дну и оказывает на него все возрастающее давление. Рефлекторно возникающие при этом сокращения брюшного пресса усиливают позывы роженицы на потуги, которые повторяются все чаще и чаще – через каждые 5-4-3 мин.
Предлежащая часть плода при этом растягивает половую щель и рождается, за ней рождается туловище. Вместе с рождением плода изливаются задние воды.
После рождения плода начинается третий, последний, период родов – последовый.
 Рис. 5.7. Формирование пояса соприкосновения (заштрихован) за счет прижатия головкой мягких тканей родового канала к стенкам таза (схема).
Рис. 5.7. Формирование пояса соприкосновения (заштрихован) за счет прижатия головкой мягких тканей родового канала к стенкам таза (схема).
Третий период – последовый. Это время от рождения плода до рождения последа. В этот период происходят отслойка плаценты и оболочек от подлежащей маточной стенки и рождение последа (плацента с оболочками и пуповиной). Последовый период продолжается от 5 до 30 мин. В течение нескольких минут после рождения плода матка находится в состоянии тонического сокращения. Дно матки при этом расположено обычно на уровне пупка. Появляющиеся вскоре выраженные ритмические сокращения матки называются последовыми схватками. Начиная с первой последовой схватки отделяется плацента. Отделение плаценты происходит в губчатом слое отпадающей слизистой оболочки на месте ее прикрепления к маточной стенке (плацентарная площадка).
Плацента во время схватки практически не способна к сокращениям в отличие от плацентарной площадки, которая после изгнания плода и резкого уменьшения полости матки значительно уменьшается в размерах. Поэтому плацента приподнимается над плацентарной площадкой в виде складки или бугра, что ведет к нарушению связи между ними и к разрыву маточно-плацентарных сосудов. Изливающаяся при этом кровь образует ретроплацентарную гематому, представляющую собой скопление крови между плацентой и стенкой матки (рис. 5.8, а). Гематома способствует дальнейшей отслойке плаценты, которая выпячивается в сторону полости матки. Сокращения матки и увеличение ретроплацентарной гематомы вместе с силой тяжести плаценты, тянущей ее вниз, приводят к окончательной отслойке плаценты от стенки матки. Плацента вместе с оболочками опускается вниз и при потуге рождается из родовых путей, вывернутая наружу своей плодовой поверхностью, покрытая водной оболочкой. Этот вариант отслойки называется вариантом выделения последа по Шультце.
Наряду с описанным, чаще всего встречающимся вариантом отслойки и рождения последа наблюдается краевое отделение плаценты, которое называется выделением последа по Дункану (рис. 5.8, б). Отделение плаценты начинается не с центра, а с краю. Поэтому кровь, вытекающая из разорвавшихся сосудов, свободно стекает вниз и, отслаивая на своем пути оболочки, не образует при этом ретроплацентарную гематому. Пока плацента полностью не отделится от матки, с каждой новой последовой схваткой происходит отслойка все новых и новых ее участков. Отделению последа способствует собственная масса плаценты, один из краев которой свисает в полость матки. Отслоившаяся плацента опускается вниз и при потуге рождается из родовых путей в сигарообразно сложенном виде, с обращенной наружу материнской поверхностью.
Последовый период сопровождается кровотечением из матки. Количество теряемой при этом крови обычно не превышает 500 мл (0,5 % массы тела).
Остановку маточного кровотечения с момента отделения плаценты от стенки матки обусловливает следующее: 1. смещение и деформация (скручивание, перегибы, растяжение) сосудов в результате сокращения мышцы матки, что является фактором механической остановки кровотечения; 2. своеобразие структуры концевых участков артерий. При отделении плаценты разрыв маточных сосудов происходит на уровне сужения терминальных отделов артерий, спиральное строение которых дает им возможность сокращаться и смещаться в более глубокие слои мышечной ткани, где они подвергаются дополнительному сдавливающему воздействию со стороны сокращающейся мышцы матки; 3. тромбообразование, возникающее как следствие проявления защитных механизмов организма в ответ на травму тканей. Тромбообразование приводит к остановке кровотечения в мелких сосудах, главным образом капиллярах.
 Рис. 5.8. Различные виды и этапы отделения плаценты и изгнания последа. а – отделение плаценты начинается с ее центра (вариант выделения последа по Шультце); б – отделение плаценты начинается с ее края (вариант выделения последа по Дункану).
Рис. 5.8. Различные виды и этапы отделения плаценты и изгнания последа. а – отделение плаценты начинается с ее центра (вариант выделения последа по Шультце); б – отделение плаценты начинается с ее края (вариант выделения последа по Дункану).
При нормальном течении послеродового периода указанные выше факторы проявляются одновременно.
После рождения последа родившая женщина называется родильницей.
Механизм родов
В процессе родов при прохождении через костный канал (малый таз) и мягкие ткани родовых путей роженицы плод совершает совокупность движений, которые называются механизмом (биомеханизмом) Родов. Движения плода в процессе родов определяются формой родового ? Родовой канал образован костями малого таза и мягкими тканями. Костная ос-нова родового канала в процессе родов не меняет пространственных взаимоотношений, тогда как мягкие ткани (развернутый нижний сегмент матки, влагалище, фасции и мышцы, выстилающие внутреннюю поверхность малого таза; мышцы тазового дна, промежности) растягиваются, оказывают сопротивление рождающемуся плоду и принимают активное участие в механизме родов.Костная основа родового канала благодаря крестцовой впадине имеет неодинаковую в различных отделах конфигурацию. Продвижение плода по родовому каналу принято относить к следующим плоскостям таза: 1. входа в таз 2. широкой части полости малого таза 3. узкой части полости малого таза 4. выхода таза.
Естественные движения плода совершаются всегда строго по направлению проводной оси таза. Проводная ось таза – линия, соединяющая середины всех прямых размеров таза (прямой размер плоскости входа, широкой, узкой части полости малого таза и выхода). В связи с изогнутостью крестца и наличием мощного пласта мышц тазового дна и промежности проводная ось таза напоминает форму рыболовного крючка (рис. 5.9).
В механизме родов также принимает участие плод. Под влиянием родовых сил происходит своеобразное формирование плода: позвоночник сгибается, скрещенные ручки плотнее прижимаются к туловищу, плечики поднимаются к головке, и верхняя часть плода приобретает цилиндрическую форму, что способствует его изгнанию из полости матки. Наибольшее значение при прохождении родового канала (при продольном положении плода) имеют размеры головки плода. Кости черепа плода соединены швами и родничками, что позволяет им смещаться относительно друг друга и менять конфигурацию головки. Такая пластичность позволяет головке плода приспосабливаться к форме и размерам родового канала. Шейный отдел плода легко сгибается кпереди, с трудом – вправо и влево. Грудной отдел, как и поясничный, больше изгибается в стороны и меньше – вперед и назад.
Механизм родов определяется вариантом предлежания канала, размерами и формой плода, подвижностью его по-звоночника, родовой деятельно-стью – изгоняющими силами.
 Рис. 5.9. Форма родового канала. Стрелкой указана проводная ось таза.
Рис. 5.9. Форма родового канала. Стрелкой указана проводная ось таза.
При головном предлежании различают сгибательный (передний и задний вид затылочного предлежания), который встречается наиболее часто, и разгибательный (переднеголовное, лобное, лицевое предлежание) тип. Вид предлежания определяется наибольшим размером головки (большой сегмент), которым головка проходит в полости таза. Проводная точка находится на предлежащей части, которая во время продвижения первой следует строго по направлению проводной оси родового канала и первой показывается из половой щели.
 Рис. 5.10. Осевое (синклитическое) вставление головки.
Рис. 5.10. Осевое (синклитическое) вставление головки.
 Рис. 5.11. Внеосевые (асинклитические) вставления головки.
а – передний асинклитизм; б – задний асинклитизм (заднетеменное вставление).
Рис. 5.11. Внеосевые (асинклитические) вставления головки.
а – передний асинклитизм; б – задний асинклитизм (заднетеменное вставление).
В конце беременности дно матки вместе с находящимися в нем ягодицами по мере развития беременности начинает испытывать возрастающее давление со стороны диафрагмы и брюшной стенки. Последняя благодаря свойственной ей упругости, малой податливости, особенно хорошо выраженным у первородящих женщин, препятствует отклонению дна матки вперед. В связи с этим давление со стороны диафрагмы, приложенное к ягодицам плода, распространяется по его позвоночнику и сообщается головке. Головка при этом сгибается и в слегка согнутом состоянии устанавливается стреловидным швом в одном из косых (12 см) или поперечном (13 см) размере, т.е. стреловидный шов головки совпадает либо с косым, либо с поперечным размером таза.?
У повторнородящих женщин давление на дно матки и находящиеся в нем ягодицы, оказываемое диафгмой, также сообщается головке плода и передней брюшной стенке. Однако в отличие от первородящих этому давлению не оказывается должного противодействия со стороны перерастянутой брюшной стенки. Поэтому у повторнородящих с расслабленной передней брюшной стенкой дно матки отклоняется кпереди, а головка остается подвижной над входом в таз до наступления родов и даже в большинстве случаев в первом их периоде.
При вставлении головки в плоскость входа в таз стреловидный шов может располагаться в поперечном или в одном из косых, или в слегка косом размере. По отношению стреловидного шва к лонному сочленению и мысу (promontorium) различают осевые, или синклитические (рис. 5.10), и внеосевые, или асинклитические (рис. 5.11, а,б), вставления головки. При синклитическом вставлении головка стоит перпендикулярно к плоскости входа в малый таз, а стреловидный шов располагается на одинаковом расстоянии от лонного сочленения и мыса. При асинклитическом вставлении вертикальная ось головки плода стоит к плоскости входа в таз не строго перпендикулярно, а стреловидный шов располагается ближе к мысу – передний асинклитизм (вставляется теменная кость, обращенная кпереди) или ближе к лонному сочленению – задний асинклитизм (вставляется теменная кость, обращенная кзади). При нормальных родах наблюдается либо синклитическое вставление головки, либо небольшой передний асинклитизм. В дальнейшем при физиологическом течении родов, когда во время схваток меняется направление давления на плод, асинклитизм устраняется.
Механизм родов при переднем виде затылочного предлежания
Механизм родов начинается в той плоскости таза, в которой плод встречает препятствие по мере продвижения.
Некоторое продвижение головки наблюдается во время беременности. С наступлением родов поступательное движение головки возобновляется при первых схватках. В случае нормальных родов при переходе головки из широкой в узкую часть полости малого таза плод встречает препятствие. Для преодоления головкой встретившегося препятствия недостаточно одних лишь сокращений матки. Для этого необходимы потуги, во время Которых за счет давления плод продвигается по направлению к выходу из родового канала. Несмотря на то что механизм родов может начинаться в периоде раскрытия, чаще он осуществляется в периоде изгнания, при переходе головки из широкой в узкую часть полости малого таза.
В течение всего периода изгнания плод и родовые пути непрерывно воздействуют друг на друга. При этом плод стремится растянуть соответственно своей форме родовые пути, которые стремятся плотно охватить плод с окружающими его задними водами и приспособить к своей форме. В результате взаимодействия плода и родовых путей форма плодного яйца (плод, задние воды, послед) и родового канала постепенно приходят в полное соответствие друг другу. Стенки родового канала плотно охватывают все плодное яйцо, за исключением самого нижнего отрезка (сегмента) головки.


 Рис.5.12. Механизм родов при переднем виде затылочного предлежания.
а – первый момент: 1 – сгибание головки, 2 – вид со стороны выхода таза (сагиттальный шов в поперечном размере таза);
б – второй момент: 1 – внутренний поворот головки, 2 – вид со стороны выхода таза (сагиттальный шов в правом косом размере таза);
в – завершение второго момента: 1 – внутренний поворот головки закончен, 2 – вид со стороны таза (сагиттальный шов стоит в прямом размере таза).?
г – третий момент: разгибание головки после образования точки фиксации (головка областью подзатылочной ямки подошла под лонную дугу); д – четвертый момент: наружный поворот головки, рождение плечиков (переднее плечико задерживается под симфизом); е – рождение плечиков, над промежностью выкатывается заднее плечико.
Рис.5.12. Механизм родов при переднем виде затылочного предлежания.
а – первый момент: 1 – сгибание головки, 2 – вид со стороны выхода таза (сагиттальный шов в поперечном размере таза);
б – второй момент: 1 – внутренний поворот головки, 2 – вид со стороны выхода таза (сагиттальный шов в правом косом размере таза);
в – завершение второго момента: 1 – внутренний поворот головки закончен, 2 – вид со стороны таза (сагиттальный шов стоит в прямом размере таза).?
г – третий момент: разгибание головки после образования точки фиксации (головка областью подзатылочной ямки подошла под лонную дугу); д – четвертый момент: наружный поворот головки, рождение плечиков (переднее плечико задерживается под симфизом); е – рождение плечиков, над промежностью выкатывается заднее плечико.
В результате создаются благоприятные условия для изгнания плода из родового канала.
При переднем виде затылочного предлежания различают четыре основных момента механизма родов (рис. 5.12, а-ж).
Первый момент – сгибание головки (flexio capitis). Под влиянием внут-риматочного и внутрибрюшного давления шейная часть позвоночника сгибается, подбородок приближается к грудной клетке, затылок опускается вниз. По мере опускания затылка малый родничок устанавливается ниже большого, постепенно приближается к срединной (проводной) линии таза и становится наконец наиболее низко расположенной частью головки – проводной точкой.
Сгибание головки позволяет ей пройти через полость малого таза наименьшим или близким к нему размером – малым косым (9,5 см). Однако при нормальном соотношении размеров таза и головки необходимости в максимальном сгибании головки не бывает: головка сгибается настолько, насколько это необходимо для прохождения из широкой в узкую часть полости малого таза.
Второй момент – внутренний поворот головки (rotatio capitis interna). Головка плода при своем поступательном движении в полости малого таза при переходе ее из широкой в узкую часть, встречая препятствие дальнейшему продвижению, одновременно со сгибанием начинает поворачиваться вокруг своей продольной оси. При этом затылок, скользя по боковой стенке таза, приближается к лонному сочленению, передний же отдел головки отходит к крестцу. Это движение легко обнаружить, наблюдая за изменением положения стреловидного шва (см. рис. 4.15, А1, Б1, В1). Стреловидный шов, располагаясь до описываемого поворота в полости малого таза в поперечном или одном из косых размеров, в дальнейшем переходит в прямой размер. Поворот головки заканчивается, когда стреловидный шов устанавливается в прямом размере выхода, а подзатылочная ямка устанавливается под лонным сочленением.
Этот поворот головки является подготовительным к третьему моменту механизма родов, который без этого совершился бы с большим трудом или вовсе не произошел.
Третий момент – разгибание головки (deflexio capitis). Головка плода продолжает продвигаться по родовому каналу и одновременно с этим начинает разгибаться. Разгибание при физиологическом течении родов происходит в выходе таза. Разгибание начинается после того, как подзатылочная ямка упирается в нижний край лонного сочленения, образуя точку фиксации (гипомохлион). Головка вращается своей поперечной осью вокруг точки фиксации (нижнего края лонного сочленения) и в несколько потуг полностью разгибается и рождается. При этом из половой щели последовательно появляются теменная область, лоб, лицо и подбородок. Рождение головки через Бульварное кольцо происходит ее малым косым размером.
Четвертый момент – внутренний поворот туловища и наружный поворот головки (rotatio trunci interna seu rotatio capitis externa). Во время разгибания головки плечики плода вставляются в поперечный размер входа или в один из косых его размеров по мере продвижения головки. В плоскости выхода таза, вслед за ней плечики плода винтообразно продвигаются по тазовому каналу. Они своим поперечным размером переходят из поперечного в косой, а при выходе – в прямой размер таза. Этот поворот передается родившейся головке, при этом затылок плода поворачивается к левому (при первой позиции) или правому (при второй позиции) бедру матери. Переднее плечико поворачивается к лонному сочленению, заднее – к крестцу. Затем рождается плечевой пояс в следующей последовательности: сначала верхняя треть плечика, обращенного кпереди, а затем за счет бокового сгибания позвоночника плечико, обращенное кзади. Далее рождается все туловище плода.
Все перечисленные моменты механизма родов совершаются при посту-пательном движении головки плода, и строгого разграничения между ними нет (рис. 5.13).
Первый момент механизма родов не ограничивается одним лишь сгибанием головки. Он сопровождается также поступательным движением, продвижением ее по родовому каналу, а позднее, когда заканчивается сгибание, – и начинающимся внутренним поворотом головки. Следовательно, первый момент механизма родов состоит из комбинации движений: по-ступательного, сгибательного и вращательного, но наиболее выраженным, определяющим основной характер движения головки, является ее сгибание, поэтому первый момент механизма родов называется "сгибание головки".
Второй момент механизма родов является совокупностью поступательного и вращательного движений. Наряду с этим в начале внутреннего поворота головка заканчивает сгибание, к концу же поворота она начинает разгибаться. Из всех этих движений наиболее выраженным является поворот головки, поэтому второй момент механизма родов называется "внутренний поворот головки".
Третий момент механизма родов слагается из поступательного движения и разгибания головки. Однако наряду с этим головка почти до самого рождения продолжает совершать и внутренний поворот. В этот момент механизма родов наиболее выраженным является разгибание головки, вследствие чего он и носит название "разгибание головки".
Четвертый момент механизма родов слагается из поступательного движения головки и внутреннего поворота плечиков, а также связанного с этим наружного поворота головки. Определяющим этот момент движением является легче всего обнаруживаемый наружный поворот головки. Одновременно с перечисленными выше движениями головки плода, а иногда и предшествуя им, совершаются движения всего его туловища.
Механизм родов у первородящих по существу такой же, как у повтор-нородящих. У повторнородящих он обычно начинается не в период раскрытия, как это чаще происходит у первородящих, а позднее – в периоде изгнания, после излития околоплодных вод. Движение головки по родовому каналу может начаться и в период раскрытия у тех из повторнородящих женщин, у которых, несмотря на перенесенные роды, сохранилось хорошее функциональное состояние мускулатуры матки и брюшного пресса, диафрагмы, брюшной стенки, тазового дна.
 Рис. 5.13. Механизм родов при затылочном предлежании (первая позиция).
1 – вход в таз; 2 – начало ротации в полости таза; 3 – ротация закончена.
Рис. 5.13. Механизм родов при затылочном предлежании (первая позиция).
1 – вход в таз; 2 – начало ротации в полости таза; 3 – ротация закончена.
Каждый из перечисленных выше поворотов головки легко может быть обнаружен при влагалищном исследовании роженицы по смещению стреловидного шва из одного размера полости таза в другой, по взаиморасположению большого и малого родничков. Достаточно ценные данные могут быть получены и методом наружного исследования. Систематически и внимательно производимая пальпация частей плода (спинки, затылка, лба, подбородка, переднего плечика) и кардиомониторирование сердечных тонов позволяют определить изменение их взаиморасположения в отношении как друг с другом, так и с родовым каналом.?
По американской классификации выделяют семь основных движений плода в родах: 1. вставление головки 2. продвижение головки 3. сгибание головки 4. внутренний поворот головки 5. разгибание головки 6. наружный поворот головки и внутренний поворот туловища 7. изгнание плода.
Механизм родов при заднем виде затылочного предлежания
При затылочном предлежании независимо от вида в начале родов, к концу периода изгнания затылок обычно устанавливается под лонным сочленением, и плод рождается в переднем виде (рис. 5.14).
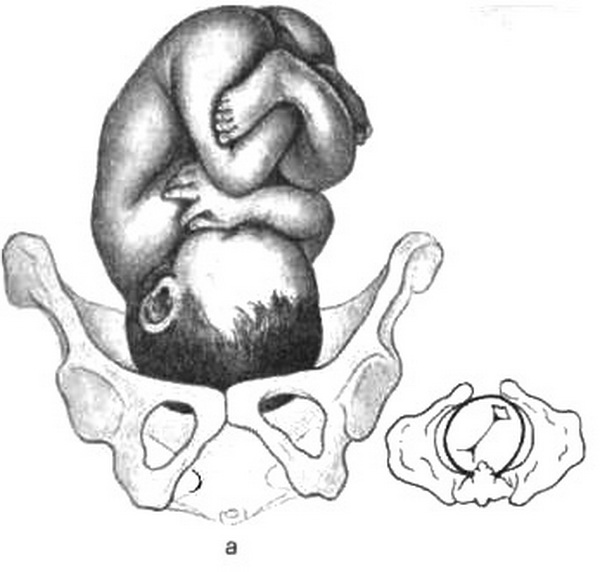

 Рис. 5.14. Механизм родов при заднем виде затылочного предлежания.
а – первый момент: сгибание головки;
б – второй момент: внутренний поворот головки;
в – третий момент: дополнительное сгибание головки.
Рис. 5.14. Механизм родов при заднем виде затылочного предлежания.
а – первый момент: сгибание головки;
б – второй момент: внутренний поворот головки;
в – третий момент: дополнительное сгибание головки.
При исходно заднем виде первой позиции во время внутреннего поворота стреловидный шов вращается против движения часовой стрелки и последовательно переходит из левого косого в поперечный, затем в правый косой и, наконец, в прямой размер. При второй позиции, которая встречается значительно чаще, при заднем виде во время внутреннего поворота головки стреловидный шов вращается по ходу часовой стрелки. При этом он из правого косого переходит сперва в поперечный, затем в левый косой и, наконец, в прямой размер выхода. В связи с этим малый родничок при заднем виде затылочного предлежания описывает большую дугу – около 135° и первоначальный задний вид как при первой, так и при второй позиции превращается в дальнейшем в передний вид.
Однако это происходит не всегда. В некоторых случаях (в 1 % всех затылочных предлежании) плод рождается в заднем виде затылочного предлежания. Роды в заднем виде затылочного предлежания являются вариантом нормы.
Механизм родов при заднем виде затылочного предлежания складывается из следующих моментов.
Первый момент – сгибание головки в плоскости входа в малый таз. Проводной точкой является малый родничок. Головка вставляется во вход в таз чаще в правом косом размере, реже – в левом.
Второй момент заключается во внутреннем повороте головки, при котором стреловидный шов при переходе ее в узкую часть плоскости малого таза располагается в прямом размере. Затылок обращен кзади. Нередко при этом меняется проводная точка, ею становится область между малым и большим родничком.
Третий момент – максимальное сгибание головки – происходит в плоскости выхода таза. При этом образуются две точки фиксации. Первой является передний край большого родничка, который подходит к нижнему краю лона. За счет сильного сгибания рождается затылок и образуется вторая точка фиксации – подзатылочная ямка, которая упирается в область копчика, и происходит разгибание.
В связи с тем что головка в плоскости малого таза несколько разгибается, прорезывание происходит средним размером головки, окружностью, равной 33 см.
Проводной точкой при заднем виде затылочного предлежания во входе в малый таз является малый родничок. В полости таза проводной точкой становится область между малым и большим родничком.
Конфигурация головки при заднем виде затылочного предлежания долихоцефалическая. Родовая опухоль располагается на предлежащей теменной кости ближе к большому родничку.
При ведении родов имеются трудности в определении местонахождения головки по отношению к плоскостям таза. Нередко в случае расположения головки малым сегментом во входе в таз создается впечатление, что она находится уже в полости малого таза. Только при влагалищном исследовании возможно определить точно, в какой плоскости таза находится головка.
С учетом того, что механизм родов при заднем виде включает в себя дополнительный и очень трудный момент – максимальное сгибание головки, период изгнания затягивается. Роды в заднем виде затылочного предлежания отличаются длительностью, сопровождаются чрезмерно большой затратой родовых сил. Тазовое дно и промежность подвергаются большому растяжению и часто разрываются. Длительные роды и повышенное давление со стороны родовых путей, которое испытывает головка при максимальном ее сгибании, нередко приводят к гипоксии плода, нарушению мозгового кровообращения, церебральным поражениям.
Причины образования заднего вида могут быть обусловлены как плодом (небольшие размеры головки, в некоторых случаях трудная сгибаемость шейной части позвоночника и др.), так и состоянием родовых путей роженицы (аномалии формы таза и мышц тазового дна).
Влияние механизма родов на форму головки
В процессе прохождения головки через родовые пути происходит ее при-способление к форме и размерам родового канала (таза матери). Приспо-собляемость головки ограничена известными пределами и зависит от смещаемости костей черепа в области швов и родничков, а также от способностей костей черепа изменять форму (уплощаться, сгибаться) при прохождении через малый таз.
Изменение головки при прохождении ее через родовые пути называется конфигурацией головки. Конфигурация зависит от особенностей головки и родовых путей. Чем шире швы и мягче кости, тем больше способность головки к конфигурации. Кроме того, конфигурация бывает значительной при затруднениях в продвижении головки (сужение таза). Форма головки изменяется в зависимости от механизма родов. В случаях затылочного предлежания (особенно заднего вида) головка вытягивается в направлении затылка, принимая долихоцефалическую форму (рис. 5.15). Если роды нормальные, то конфигурация головки бывает выражена слабо и не отражается на здоровье и развитии новорожденного: изменения формы головки исчезают без следа вскоре после родов.
В родах в период изгнания, кроме изменения формы головки, может появляться родовая опухоль (рис. 5.16). Она представляет собой отек тканей на самом нижнем впереди идущем участке (ведущая точка) предлежащей части. Отек тканей возникает вследствие затруднения оттока венозной крови из того участка предлежащей части, которая располагается ниже пояса соприкосновения.
Родовая опухоль развивается при головных предлежаниях и образуется после излитиявод только у живых плодов. При затылочном предлежании Родовая опухоль располагается ближе к затылку в области правой или левой теменной кости, в зависимости от позиции. При первой позиции большая часть опухоли находится на правой теменной кости, при второй – на левой.
По конфигурации головки родившегося плода и расположению на ней родовой опухоли можно судить о механизме родов, характере вставления головки (синклитическое или асинклитическое), степени ее сгибания и др. При отклонении механизма родов от типичного варианта конфигурация головки и местоположение родовой опухоли меняются.
 Рис. 5.15. Умеренная конфигурация головки при затылочном предлежании. новорожденного
Рис. 5.15. Умеренная конфигурация головки при затылочном предлежании. новорожденного
 Рис. 5.16. Родовая опухоль на головке; .
1 – кожа; 2 – кость; 3 – надкостница; 4 – отек клетчатки (родовая опухоль).
Рис. 5.16. Родовая опухоль на головке; .
1 – кожа; 2 – кость; 3 – надкостница; 4 – отек клетчатки (родовая опухоль).
Родовая опухоль не имеет резких контуров, она переходит через роднички и швы. Чем продолжительнее роды после излития околоплодных вод, тем более выражена родовая опухоль. В отдельных случаях она может быть ошибочно принята (при влагалищном исследовании) за плодный пузырь. Надежным дифференциально-диагностическим признаком является наличие волос и припухлости, определяемых на ощупь при родовой опухоли. В случае нормальных родов родовая опухоль не достигает больших размеров и исчезает через несколько дней после родов.
При затрудненном прохождении головки через родовые пути и оперативном родоразрешении на головке могут возникнуть кровяная опухоль или кефалогематома (рис. 5.17, а, б) – кровоизлияние под надкостницу.
Теории механизма родов
В литературе имеются многочисленные теории, объясняющие сгибательные и вращательные движения плода в процессе родов, которые представляют лишь исторический интерес. В настоящее время считают, что в механизме родов большое значение имеют как физические (пространственные взаимоотношения плода и родового канала), так и биологические (сила внутриматочного давления и мышечное сопротивление отдельных частей плода) факторы. Немалая роль в механизме родов принадлежит мышцам тазового дна. В результате взаимодействия всех указанных факторов отдельные моменты механизма родов могут быть объяснены следующим образом. Головка, слегка согнутая до начала второго периода родов, сгибается под влиянием изгоняющих сил с учетом правила неравномерного рычага. Проявление этого закона возможно потому, что место соединения позвоночника с основанием черепа находится не в центре черепа, а эксцентрично – ближе к затылку, чем к подбородку. В связи с этим большая часть изгоняющих сил сосредоточивается на коротком плече рычага, т.е. на затылке. В то же время длинное плечо рычага, на конце которого находится лицо плода с его наибольшей выпуклой и объемистой частью – лбом, встречает сопротивление со стороны безымянной линии таза. При этом возникают две противодействующие силы. Одна из них давит на затылочную часть головки сверху вниз, т.е. по направлению к выходу таза, и заставляет ее продвигаться вперед, другая, противодействуя этому давлению, задерживает лицевую часть головки (лоб) и не позволяет ей следовать за затылочной частью. Вследствие этого затылок опускается ниже, чем лоб, происходят сгибание головки и одновременно с этим более глубокое ее внедрение в полость малого таза.
Внутреннему повороту головки способствуют следующие факторы: при-способление головки и прохождение ее по наибольшим размерам плоскостей таза, строение тазового дна и сокращение его мышц. При поступательном движении головка, плотно охваченная стенками малого таза, скользит по их поверхностям, представляющим собой систему наклонных плоскостей. При таких условиях головка следует соответственно размерам таза, из которых наибольшим во входе в таз является поперечный, в плоскости таза – косой и в выходе из таза -прямой. Продвигаясь по плотно прилегающим к ней стенкам таза и одновременно находясь под воздействием мышц тазового дна, головка совершает внутренний поворот, приспосабливаясь своими размерами к большим размерам таза.
Для поворота головки затылком кпереди имеют значение также следующие факторы: 1. строение таза, так как передняя стенка его короче задней (крестец), она оказывает наименьшее сопротивление продвигающейся головке; 2. мышцы тазового дна, особенно леваторы, которые, сокращаясь, способствуют повороту затылка кпереди, а затем и разгибанию головки.
Для продвижения головки имеет значение форма головки и таза. Головка как объект родов представляет собой тело почкообразной формы, имеющее два полюса – затылок и подбородок. Оба эти полюса соединяют "линией головной кривизны", которая обращена выпуклостью большого родничка. Родовой канал также имеет вид дуги, выпуклая сторона которой обращена кзади. Головка легко проходит через таз, если головная и тазовая кривизна совпадают. В процессе приспособления головной кривизны к тазовой происходит внутренний поворот.
Внутренний поворот туловища и наружный поворот головки обусловливаются в основном поворотом плечевого пояса. Плечевой пояс, проходя последовательно через плоскость входа в таз (в поперечном разрезе), полость таза – в косом размере и плоскость выхода (в прямом размере), совершает вращательное движение, которое передается родившейся головке.
Клиническое течение родов
Во время родов наблюдаются изменения функции почти всех органов роженицы и особенно матки.Наиболее выраженные изменения у рожениц наблюдаются в гемодинамике, дыхании и обмене веществ. В процессе родов возрастает нагрузка на сердечно-сосудистую систему. Эта нагрузка компенсируется учащением пульса, особенно в период изгнания (90-100 в минуту). Артериальное давление в первом периоде родов у здоровых рожениц не изменяется. В период изгнания отмечается колебание его цифр в физиологических пределах ( + 5 – 15 мм рт.ст.). Во время потуг оно повышается, а в паузах возвращается к исходному уровню. Колебания артериального давления в указанных пределах не отражаются на кровообращении в межворсинчатом пространстве. Наиболее выраженные изменения в гемодинамике возникают после рождения плода, в третьем периоде родов. После изгнания плода внутрибрюшное давление понижается, и сосуды брюшной полости переполняются кровью, приток крови к сердцу уменьшается. В связи с перераспределением крови возникает временная компенсаторная тахикардия. У здоровых женщин компенсация в системе кровообращения наступает быстро после родов.
Во время родов повышается и усиливается обмен веществ, в частности газообмен, особенно во втором периоде родов.При схватках наблюдается некоторое уменьшение экскурсии легких, выравнивающееся в паузах. В начале потуг дыхание задерживается, потом учащается (на 6-8 дыханий в минуту) и становится глубже. Во время потуг несколько снижается (на 2-3 %) степень насыщенности крови кислородом; в паузах эти изменения исчезают. При нормальном течении родов потребность матери и плода в кислороде удовлетворяется полностью.
Функция почек и печени существенным изменениям во время родов не подвергается.
Вследствие интенсивной мышечной работы в процессе родов в организме матери накапливаются недоокисленные продукты обмена, в частности молочная кислота, и при исследовании крови определяется компенсированный метаболический ацидоз (BE -7,32±2,8 мэкв/л, рН 7,41±0,07). Во втором периоде ацидоз нарастает (BE -9,17±3,54 мэкв/л крови), но остается компенсированным (рН 7,38+0,09).
Течение родов в периоде раскрытия
Первый период родов является самым продолжительным. Он начинается с появления регулярных маточных сокращений (схваток) и заканчивается полным раскрытием наружного зева шейки матки. Начало родов характеризуется появлением регулярных схваток (через каждые 20 мин) и типичными изменениями в шейке матки: укорочение, сглаживание, раскрытие. Регулярным схваткам обычно предшествует ряд признаков, являющихся предвестниками родов. Однако возможно наступление родов без выраженных предвестников, особенно у повторнородящих женщин.
Родовые схватки обычно болезненны. Степень болевых ощущений различна. Это в значительной мере зависит от функциональных особенностей нервной системы рожениц. Роженицы отмечают боли в животе, пояснице, крестце, в паховых областях. Боли сильнее выражены к концу периода раскрытия. Иногда роженицы, в основном с неуравновешенным типом высшей нервной деятельности, с самого начала испытывают мучительные боли, приходя при этом в сильное возбуждение. У таких рожениц нередко в родах рефлекторно возникают тошнота и рвота, а иногда развивается и полуобморочное состояние. У женщин с сильным, уравновешенным типом высшей нервной деятельности период раскрытия протекает почти или совершенно безболезненно.
В течении первого периода родов следует различать латентную, активную фазы и фазу замедления.
Латентной фазой называется время от начала регулярных схваток до появления структурных изменений в шейке матки (до открытия маточного зева на 3-4 см). В латентной фазе сократительная деятельность матки хорошо поддается фармакологическому воздействию (токолизу). Длительность латентной фазы у первородящей составляет 4-8 ч, а у повторнородящей – 4 – 6 ч и зависит от состояния зрелости шейки матки, паритета, влияния фармакологических средств и не зависит от массы плода.
Вслед за латентной наступает активная фаза родов, которая характеризуется быстрым открытием маточного зева от 4 до 8 см.
После открытия шейки матки на 8 см, с началом опускания головки начинается фаза замедления. Ее возникновение объясняется захождением шейки матки за головку в конце первого периода родов, когда начинается быстрое опускание головки плода.
С самого начала родов при каждой схватке круглые маточные связки напрягаются и матка приближается дном к передней брюшной стенке. Перемещение дна матки во время схваток кверху и кпереди изменяет взаимоотношение между осью плода и осью родового канала. Движение туловища плода сообщается предлежащей головке, передняя теменная кость которой опускается ниже уровня, на котором она стояла во время паузы. Контракционное кольцо с каждой схваткой становится все более и более выраженным и поднимается вверх над лоном. К концу периода раскрытия дно матки у большинства находится в подреберье, а контракционное кольцо на 5 поперечных пальцев (10 см) выше лонной дуги.
Важным показателем течения родов является темп раскрытия шейки матки. Скорость раскрытия шейки в начале родов (латентная фаза) составляет 0,35 см/ч, в активной фазе – 1,5-2 см/ч у первородящих и 2-2,5 см/ч – у повторнородящих. Нижняя граница нормальной скорости раскрытия маточного зева в активной фазе у первородящих 1,2 см/ч, а у повторнородящих 1,5 см/ч. Раскрытие маточного зева от 8 до 10 см (фаза замедления) проходит более медленно – 1 – 1,5 см/ч. Темпы раскрытия шейки матки зависят от сократительной способности миометрия, резистентности шейки матки и их комбинации.
Раскрытие маточного зева нередко ведет к поверхностным нарушениям целости слизистой оболочки шеечного канала. Из надрывов может выделяться небольшое количество крови, которая вытекает из влагалища вместе с примешивающейся к ней слизью.
Когда схватки становятся особенно сильными и начинают повторяться через каждые 3-4 мин, шейка обычно раскрывается полностью или почти полностью. Плодный пузырь становится напряженным не только во время схваток, но и вне их. Затем на высоте одной из схваток плодный пузырь разрывается, и передние воды изливаются наружу в количестве 100-200 мл. Разрыв плодных оболочек происходит в большинстве случаев в пределах маточного зева. В редких случаях плодные оболочки не разрываются и головка рождается покрытой нижней частью оболочек плодного яйца (рождается в "сорочке"). После полного открытия шейки матки и своевременного излития околоплодных вод возникают потуги, наступает период изгнания.
Течение родов в периоде изгнания
После полного раскрытия шейки матки начинается изгнание плода из полости матки.
Вслед за вскрытием плодного пузыря и излитием околоплодных вод в течение некоторого времени наблюдается ослабление родовой деятельности. Стенки матки плотно обхватывают плод. "Задние воды" оттесняются ко дну матки и выполняют при головном предлежании пространство между ягодицами и стенкой дна матки. Родовая деятельность усиливается через несколько минут. Схватки с нарастающей силой следуют одна за другой через каждые 4-3 и даже 2 мин. На вершине каждой схватки к сокращениям матки присоединяется сокращение мышц брюшного пресса, что знаменует собой появление потуг, сила их направлена на изгнание плода из родовых путей. Контракционное кольцо в период изгнания становится особенно выраженным, однако при физиологическом течении родов уровень его стояния не изменяется: оно продолжает оставаться на 5 поперечных пальцев выше лона (10 см).
Под влиянием схваток и потуг прежде всего предлежащая часть, а затем и плод постепенно проходят через родовой канал. При соприкосновении головки с мышцами тазового дна они начинают рефлекторно сокращаться. Эти сокращения усиливаются по мере продвижения головки. К боли от сокращения матки присоединяется боль от давления головки на нервные крестцовые сплетения. У роженицы появляется непреодолимое желание потужиться и выдавить из родовых путейголовку. Для усиления действия брюшного пресса роженица ищет опоры для рук и ног. Этим она добивается усиления потуг.
Лицо роженицы во время потуг» краснеет, шейные вены вздуваются, кожа становится влажной, иногда появляются судороги икроножных мышц. При наступлении паузы роженица принимает в кровати обычное положение и отдыхает от только что испытанного напряжения.
Под влиянием потуг плод продвигается по родовому каналу в соответствии с направлением его оси, совершая сгибательные, вращательные, разгибательные движения, преодолевая сопротивление сокращающихся мышц тазового дна, а также Бульварного кольца. В норме скорость продвижения головки по родовому каналу зависит от эффективности изгоняющих сил и составляет у первородящих 1 см/ч, а у повторнородящих – 2 см/ч. С момента приближения головки плода к выходу в таз промежность роженицы начинает выпячиваться, вначале только во время потуг, а впоследствии и в паузах между ними. Выпячивание промежности сопровождается расширением и зиянием заднепроходного отверстия. При дальнейших поступательных движениях головки плода начинает раскрываться половая щель. Во время потуги из раскрывающейся половой щели показывается небольшой участок головки, которая вне потуг снова скрывается, половая щель смыкается. Происходит врезывание головки. Врезывание головки указывает на то, что внутренний поворот головки заканчивается и начинается ее разгибание (рис. 5.18, а). С дальнейшим развитием потужной деятельности врезывающаяся головка выступает все больше вперед и уже не скрывается после прекращения потуги, половая щель не смыкается, а широко зияет. Если головка не скрывается после прекращения потуг, говорят о прорезывании головки (рис. 5.18, б).
При затылочном предлежании вначале прорезывается затылочная часть головки плода, а в дальнейшем из половой щели показываются теменные бугры, напряжение промежности в это время достигает наивысшего предела (рис. 5.18, в). Наступает самый болезненный, хотя и кратковременный момент родов. После рождения затылка и темени при сильных потугах из родовых путей освобождаются лоб и личико плода.
Родившаяся головка обращена личиком кзади, личико синеет, из носа и рта выделяется слизь. При потугах, возобновившихся после рождения головки, происходит поворот туловиша плода, в результате которого одно плечико обращается к лонному сочленению, другое – к крестцу. Поворот туловища плода вызывает вращение родившейся головки: при первой позиции личико поворачивается к правому бедру матери (рис. 5.18, г), при второй – к левому.
Рождение плечиков происходит следующим образом: переднее плечико (плечико, обращенное к лонному сочленению) задерживается под лонным сочленением (рис. 5.18, д), над промежностью выкатывается заднее плечико – плечико, обращенное к промежности (рис. 5.18, е), затем рождается весь плечевой пояс. После рождения головки и плечевого пояса без затруднений рождаются туловище и ножки плода, иногда вместе с изливающимися из матки задними водами, смешанными с небольшим количеством крови и сыровидной смазки.
Новорожденный, родившийся слегка синюшным, делает свой первый вздох, издает крик, двигает конечностями и начинает быстро розоветь.
 Рис. 5.18. Период изгнания при нормальных родах.
а – врезывание головки; б – прорезывание головки; в – рождение головки (обра-щена личиком кзади); г – наружный поворот головки личиком к правому бедру матери; д – рождение переднего плечика; е – рождение заднего плечика.
Рис. 5.18. Период изгнания при нормальных родах.
а – врезывание головки; б – прорезывание головки; в – рождение головки (обра-щена личиком кзади); г – наружный поворот головки личиком к правому бедру матери; д – рождение переднего плечика; е – рождение заднего плечика.
Течение родов в последовом периоде
После рождения плода наступает третий, последовый, период родов. Утомленная роженица лежит спокойно и ровно дышит, пульс начинает замедляться. Как реакция на перенесенное большое физическое напряжение возможен непродолжительный озноб. Кожные покровы имеют обычную розовую окраску, температура тела нормальная.
Дно матки сразу после изгнания плода располагается на уровне пупка (рис. 5.19). Последовые схватки слабые и почти не беспокоят роженицу. Они ощущаются преимущественно многорожавшими женщинами. Кровотечение из родовых путей обычно незначительно.
При каждой последовой схватке матка становится плотной, постепенно уплощаясь и поднимаясь вверх и вправо, выпячивая при этом брюшную стенку. Дно ее располагается выше и вправо от пупка. Это указывает на то, что плацента отделилась от плацентарной площадки. При опускании плаценты вместе с ретроплацентарной гематомой в нижний отдел матки контуры ее меняются. В нижней ее части, несколько выше лобка, образуется неглубокая перетяжка, придающая матке форму песочных часов. Нижний отдел матки определяется в виде мягковатого образования. Тело матки в отличие от нижнего ее отдела определяется как округлое плотное образование. Когда послед опускается ниже и начинает давить на первичные крестцовые сплетения, у роженицы появляется позыв на дефекацию и при легкой потуге рождается послед. Одновременно из родовых путей выделяется до 300-500 мл крови (0,5 % массы тела) – результат отслойки плаценты от своего ложа. Кровопотеря больше в тех случаях, когда отделение плаценты начинается не с центра (по Шультце), а с ее края (по Дункану).
После рождения последа матка нахо-дится в состоянии резкого сокращения в срединном положении, выступая через брюшную стенку как плотное округлое образование. Дно ее обычно находится посередине между лоном и пупком.
Ведение родов
Роды, как правило, проводятся в стацио-наре, где создаются все условия для ока-зания квалифицированной помощи. Аку-шерская помощь оказывается в родильных домах и родильных отделениях городских и сельских больниц.Роды ведет врач совместно с акушер-кой. Только в небольших учреждениях ве-дение нормальных родов разрешается аку-шерке, которая вызывает врача при воз-никновении каких-либо осложнений.
В некоторых Европейских странах (особенно в Голландии и Финляндии) принято принимать роды на дому. Роды в домашних условиях проводят в тех си-туациях, когда нет осложнений ни у матери, ни у плода. Роды, как правило, проводит акушерка. Необходимым условием является возможность быстрой транспор-тировки роженицы в стационар.
 Рис. 5.19. Высота стояния дна матки в процессе отделения и рождения последа.
1 – сразу после рождения плода;
2 – после отделения последа; 3 – после рождения последа.
Рис. 5.19. Высота стояния дна матки в процессе отделения и рождения последа.
1 – сразу после рождения плода;
2 – после отделения последа; 3 – после рождения последа.
Ведение родов в периоде раскрытия
Роженицы поступают в родильный дом обычно в периоде раскрытия. У каждой из них имеется на руках обменная карта, куда внесены все сведения о состоянии ее здоровья и результаты обследования в течение всей беременности. При поступлении в родильный дом роженица проходит через санпропускник, где после измерения температуры тела и артериального давления (АД) проводится заполнение паспортной части истории родов. Далее пациентка подвергается санитарной обработке (сбривание волос на промежности, клизма, душ). После этого, надев стерильное белье и халат, она направляется в предродовую палату. При целом плодном пузыре, не очень сильных схватках или при фиксированной ко входу в таз головке плода роженице разрешают стоять и ходить. Лежать лучше на боку, что предупреждает развитие "синдрома сдавления нижней половой вены". Для ускорения родов роженице рекомендуют лежать на том боку, где определяется затылок плода.
Во время родов пациентку не кормят, поскольку в любой момент может встать вопрос об оказании анестезиологического пособия (внутривенная анестезия, интубация, искусственная вентиляция легких). Уход за роженицей в первом периоде родов заключается в обмывании наружных половых органов через каждые 6 ч и, кроме того, после акта дефекации и перед влагалищным исследованием. С этой целью применяют 0,5 % раствор перманганата калия в кипяченой воде. Роженица должна иметь индивидуальное судно, которое после каждого использования тщательно дезинфицируют.
В период раскрытия шейки матки необходимо тщательное наблюдение за общим состоянием роженицы, характером родовой деятельности, состоянием матки, раскрытием шейки матки, продвижением головки.
Контроль за общим состоянием роженицы. При оценке состояния роженицы выясняют ее самочувствие (степень болевых ощущений, наличие головокружения, головной боли, расстройств зрения и др.), выслушивают сердечные тоны роженицы, систематически исследуют пульс и измеряют АД. Необходимо также следить за мочеиспусканием и опорожнением прямой кишки. Переполнение мочевого пузыря и прямой кишки препятствует нормальному течению периода раскрытия и изгнания, выделения последа. Переполнение мочевого пузыря может возникнуть в связи с его атонией и отсутствием позывов к мочеиспусканию, а также в связи с прижатием мочеиспускательного канала к лонному сочленению головкой плода. Для того чтобы избежать этого, роженице предлагают мочиться самостоятельно каждые 2-3 ч; если самостоятельное мочеиспускание невозможно, то прибегают к катетеризации. В периоде раскрытия шейки матки проводится обезболивание.
Оценка сократительной способности матки. При клинической оценке родов следует обращать внимание на сократительную способность матки. Она характеризуется тонусом матки, интервалом между схватками, ритмичностью, частотой. При пальпации трудно судить об интенсивности схваток и тонусе матки. Напряжение матки при сокращении во время схватки определяется с помощью пальпаторных ощущений врача только через не-которое время после начала схватки, а роженица схватку начинает ощущать еще позже. При пальпаторном определении длительности схваток истинная продолжительность их оказывается меньшей, а величина интервалов между ними – увеличенной. Более объективно судить о сократительной деятельности матки можно с помощью гистерографии, реографии или радиотелеметрии. нальная наружная гистерография позволяет получать информацию о сократительной деятельности матки в разных ее отделах.
Для более точного количественного измерения силы сокращения матки используют внутреннюю гистерографию (токографию) определение давления в полости матки с помощью вводимых в нее специальных датчиков. Внутриматочное давление косвенно, но достаточно точно позволяет оценивать как интенсивность (или силу) сокращения матки во время схваток, так и степень расслабления маточной мускулатуры между схватками.
При всех видах регистрации сократительной деятельности матки в первом и втором периодах на кривой регистрируются волны определенной амплитуды и продолжительности, соответствующие сокращениям матки.
Тонус матки, определяемый при гистерографии, повышается по мере развития родового процесса и в норме составляет 8-12 мм рт.ст.
Интенсивность схваток увеличивается по мере развития родов. В норме в первом периоде колеблется от 30 до 50 мм рт.ст. Продолжительность схваток в первом периоде родов по мере их прогрессирования увеличивается с 60 до 100 с.
Интервал между схватками по мере прогрессирования родов уменьшается, составляя 60 с. В норме происходит 4-4,5 схватки за 10 мин.
Для оценки маточной активности предложено множество методов, основанных на комплексной математической оценке длительности схваток, их интенсивности и частоты за определенный промежуток времени (обычно за 10 мин). Наибольшее распространение получила оценка маточной активности в единицах Монтевидео (ЕМ). Единицы Монтевидео представляют собой произведение интенсивности схватки на частоту сокращений матки за 10 мин. В норме маточная активность по мере прогрессирования родов возрастает и составляет 150-300 ЕМ. Для оценки сократительной деятельности матки используются также Александрийские единицы (величина единицы Монтевидео, умноженная на длительность схватки).
Для оценки сократительной деятельности матки можно использовать компьютерную технику, которая дает возможность получать постоянную информацию о сократительной активности матки с учетом многих ее параметров. При этом можно судить об отклонениях в характере родовой деятельности и проводить соответствующую коррекцию под контролем ЭВМ.
Для оценки течения родового процесса E.Friedman (1955) предложил проводить партографию (partus – роды), т.е. графическое изображение течения родов, которое основывается на скорости раскрытия шейки матки. При этом учитывается и продвижение предлежащей части плода (головки, тазового конца) по родовому канату.
Ведение партограммы или карты интенсивного наблюдения позволяет определить, правильно текут роды или нет (рис. 5.20). При этом необходимо учитывать, первые это роды или повторные. Подъем кривой партограммы указывает на эффективность родов: чем более крутой подъем, тем более эффективны роды. Темпы раскрытия шейки матки зависят от сократительной способности миометрия, резистентности шейки матки и комби-нации их.
Состояние матки и находящегося в ней плода можно определить при наружном акушерском обследовании. Оно производится систематически и многократно, записи в истории родов должны производиться не реже чем каждые 4 ч. Круглые связки матки при физиологических родах напрягаются равномерно с обеих сторон. Контракционное кольцо при физиологических родах определяется в виде слабо выраженной поперечно идущей бороздки.
По высоте стояния контракционного кольца над лонным сочленением можно ориентировочно судить о степени раскрытия шейки матки (признак Шатца-Унтербергера). По мере раскрытия шейки матки контракционное кольцо смещается все выше и выше над лонным сочленением: при стоянии кольца на 2 пальца выше лонного сочленения зев открыт на 4 см, при стоянии на 3 пальца зев открыт приблизительно на 6 см, высота стояния на 4-5 пальцев над лонным сочленением соответствует полному раскрытию маточного зева.
Одним из важных моментов в ведении родов является контроль за состоянием плода. Наблюдение за сердцебиением плода в период раскрытия при ненарушенном плодном пузыре производится через каждые 15-20 мин, а после излития околоплодных вод – через 5-10 мин. Необходимо проводить не только аускультацию, но и подсчет сердечных сокращений плода. При аускультации обращают внимание на частоту, ритм и звучность сердечных тонов, В норме частота сердечных сокращений составляет 140±10 в минуту при выслушивании.
По месту наилучшего выслушивания сердцебиения плода можно предположить позицию, предлежание плода, многоплодную беременность, а также разгибательный вариант предлежания головки плода.
Широкое распространение получил метод мониторного наблюдения за сердечной деятельностью плода в процессе родов.
Применение интранатальной кардиотокографии (КТТ) является одной из диагностических процедур, позволяющих контролировать состояние плода и сократительной деятельности матки в процессе родов. Оценка кардиотокограмм в родах имеет некоторые особенности, отличные от антенатальной КТТ. Для проведения исследования наружный ультразвуковой датчик укрепляют на передней брюшной стенке матери в области наилучшей слышимости сердечных тонов плода. Те изометрический датчик для записи сократительной деятельности матки укрепляют в области ее дна. При нормальном состоянии плода базальный ритм частоты его сердцебиений сохраняется в пределах нормы и при головном предлежании в среднем составляет 120-160 в минуту. На протяжении нормальных родов независимо от предлежания плода амплитуда осцилляции частоты сердцебиений плода варьирует и составляет 6-10 в минуту, а их частота – до 6 в минуту. Наличие на кардиотокограмме во время родов акцелерации является наиболее благоприятным признаком, свидетельствующим о нормальном состоянии плода (рис. 5.21). При неосложненном течении родов и физиологическом состоя-нии плода акцелерации регистрируются в ответ на схватку. Амплитуда акцелерации составляет 15-25 в минуту.
 Рис. 5.20. Партограмма.
Рис. 5.20. Партограмма.
 Рис. 5.21. Кардиотокограмма плода в первом периоде родов.
Рис. 5.21. Кардиотокограмма плода в первом периоде родов.
Одними наружными приемами получить исчерпывающие сведения о течении родов и раскрытии шейки матки удается не всегда. Эти сведения могут быть получены при помощи влагалищного исследования роженицы. Влагалищное исследование в первом периоде родов производят при первом обследовании роженицы, после излития околоплодных вод, при возникновении осложнений у матери или плода. Первоначально производят осмотр наружных половых органов (варикозные узлы, рубцы и др.) и промежности (высота, старые разрывы и др.). При влагалищном исследовании выясняют состояние мышц тазового дна (упругие, дряблые), влагалища (широкое, узкое, наличие рубцов, перегородок), шейки матки. Отмечают степень сглаживания шейки (укорочена, сглажена), началось ли раскрытие зева и степень раскрытия (в сантиметрах), состояние краев зева (толстые, тонкие, мягкие или ригидные), наличие в пределах зева участка плацентарной ткани, петли пуповины, мелкой части плода. При целом плодном пузыре определяют степень его напряжения во время схватки и паузы. Чрезмерное его напряжение даже во время паузы указывает на многоводие, уплощение – на маловодие, дряблость – на слабость родовой деятельности. Определяют предлежащую часть плода и опознавательные пункты на ней. При головном предлежании прощупывают швы и роднички и по их отношению к плоскостям и размерам таза судят о позиции, предлежании, вставлении (синклитическое или асинклитическое), наличии сгибания (малый родничок ниже большого) или разгибания (большой родничок ниже малого, лоб, лицо).
Если предлежащая часть расположена высоко над входом в таз и недостаточно достижима для пальцев, находящихся во влагалище, то в таких случаях второй рукой исследующего надавливают через брюшную стенку на предлежащую часть, приближая ее ко входу в малый таз и делая ее, таким образом, доступной для исследования через влагалище. Если распознавание опознавательных пунктов на предлежащей части затруднено (большая родовая опухоль, сильная конфигурация головки, пороки развития) или неясно предлежание, производят исследование "полурукой" (четырьмя пальцами) или всей рукой, смазанной стерильным вазелином.
При влагалищном исследовании, помимо выявления опознавательных пунктов головки, выясняют особенности костной основы родовых путей, исследуют поверхность стенок малого таза (нет ли деформации, экзостозов и др.).
На основании влагалищного исследования определяют отношение головки к плоскостям таза.
Различают следующие положения головки: над входом в таз, малым или большим сегментом во входе в таз; в широкой или узкой части полости малого таза, в выходе таза.
Головка, располагающаяся над входом малого таза (рис. 5.22), подвижна, свободно перемещается при толчках (баллотирует) или прижата ко входу в малый таз. При влагалищном исследовании головка не препятствует ощупыванию безымянных линий таза, мыса (если он достижим), внутренней поверхности крестца и лонного сочленения.
Головка плода малым сегментом во входе в малый таз (рис. 5.23) неподвижна, большая часть ее находится над входом в таз, небольшой сегмент головки – ниже плоскости входа в таз. При применении четвертого приема наружного акушерского исследования концы пальцев сходятся, а основания ладоней расходятся. При влагалищном исследовании крестцовая впадина свободна, к мысу можно "подойти" лишь согнутым пальцем (если мыс достижим). Внутренняя поверхность лонного сочленения доступна исследованию.
Головка плода большим сегментом во входе в малый таз (рис. 5.24) означает, что плоскость, проходящая через большой сегмент головки, совпадает с плоскостью входа в малый таз. При наружном акушерском исследовании, проводимом четвертым приемом, ладони расположены либо параллельно, либо концы пальцев расходятся. При влагалищном исследовании обнаруживается, что головка прикрывает верхнюю треть лонного сочленения и крестца, мыс недостижим, седалищные ости легко прощупываются.
Если головка располагается в широкой части малого таза (рис. 5.25), то плоскость, проходящая через большой сегмент головки, совпадает с плоскостью широкой части таза. При влагалищном исследовании определяют, что головка наибольшей окружностью находится в плоскости широкой части полости таза, две трети внутренней поверхности лонного сочленения и верхняя половина крестцовой впадины заняты головкой. Свободно прощупываются IV и V крестцовые позвонки и седалищные ости, т.е. определяются опознавательные точки узкой части полости малого таза.
Если головка располагается в узкой части малого таза (рис. 5.26), то плоскость большого сегмента головки совпадает с плоскостью узкой части таза. Головка над входом в таз не прощупывается. При влагалищном исследовании обнаруживается, что верхние две трети крестцовой впадины и вся внутренняя поверхность лонного сочленения прикрыты головкой плода, седалищные ости достигаются с трудом.
Головка в выходе малого таза – плоскость большого сегмента головки плода находится в выходе таза. Крестцовая впадина полностью заполнена головкой, седалищные ости не определяются (рис. 5.27).
Американская школа определяет отношение предлежащей части плода к плос-костям малого таза во время ее продвижения по родовым путям, используя понятие уровней" малого таза. Выделяют следующие уровни: 1. плоскость, проходящая через седалищные ости, – уровень 0; 2. плоскости, проходящие на 1, 2 и 3 см выше уровня 0, обозначают соответ-ственно как уровни -1, -2, -3;? 3. плоскости, расположенные на 1, 2 и 3 см ниже уровня 0, обозначают соответственно как уровни +1, +2, +3. При уровне +3 предлежащая часть расположена на промежности.
 Рис. 5.22. Головка плода над входом малого таза
Рис. 5.22. Головка плода над входом малого таза
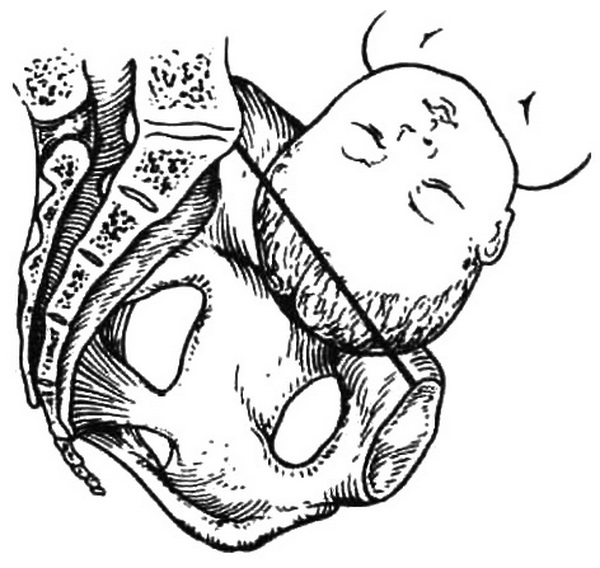 Рис. 5.23. Головка плода малым сегментом во входе в малый таз.
Рис. 5.23. Головка плода малым сегментом во входе в малый таз.

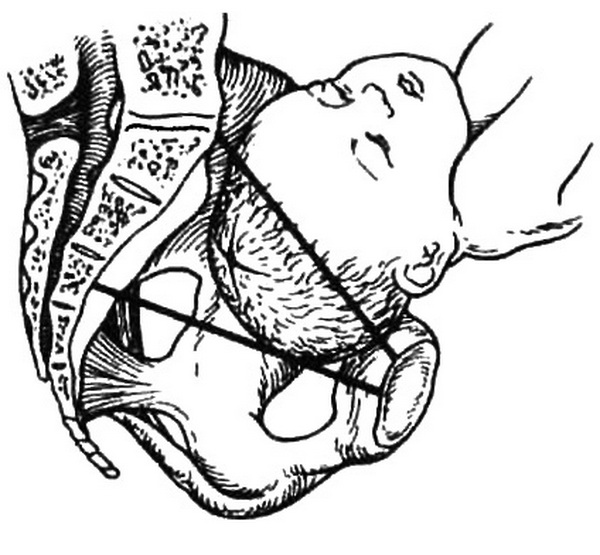 Рис. 5.24. Головка плода большим сегментом во входе в малый таз
Рис. 5.24. Головка плода большим сегментом во входе в малый таз
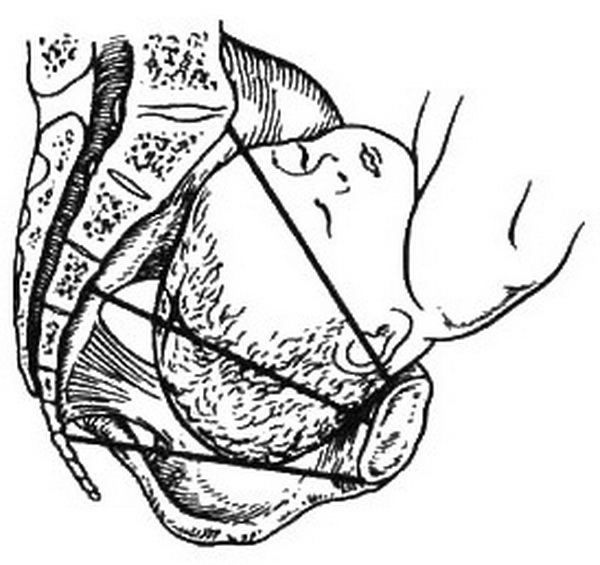 Рис. 5.25. Головка плода в широкой части полости малого таза.
Рис. 5.25. Головка плода в широкой части полости малого таза.
 Рис. 5.26. Головка плода в узкой части полости малого таза
Рис. 5.26. Головка плода в узкой части полости малого таза
 Рис. 5.27. Головка плода в выходе малого таза.
Рис. 5.27. Головка плода в выходе малого таза.
Помимо месторасположения головки, при влагалищном исследовании определяют характер выделений из влагалища – количество, цвет, запах (после выведения из влагалища пальцев).
Ответственный момент родов – разрыв плодного пузыря и излитие околоплодных вод. Он требует особого внимания. В норме околоплодные воды светлые или слегка мутноватые вследствие наличия в них сыровидной смазки, пушковых волос и эпидермиса плода. При физиологических родах в водах не должно содержаться крови и мекония. Примесь мекония к околоплодным водам обычно указывает на начинающуюся гипоксию плода, примесь крови – на разрыв краев зева, отслоение плаценты и другие патологи-ческие процессы.
После проведенного исследования устанавливается диагноз, который излагается в следующем порядке: срок беременности, вариант предлежания, позиция, вид, период родов, осложнения беременности, родов, состояние плода, экстрагенитальные заболевания (если они имеют место). После установления диагноза намечается план ведения родов с учетом варианта предлежания, позиции плода и т.д.
В период раскрытия применяется обезболивание родов.
Ведение родов в периоде изгнания
Второй период родов требует большого напряжения физических сил роженицы. Плод чаще страдает именно в этот период родов, так как происходит сдавливание головки, повышается внутричерепное давление, при сильных и длительных потугах нарушается маточно-плацентарное кровообращение.
Во втором периоде родов необходимо наблюдение за общим состоянием роженицы, характером родовой деятельности (сила, продолжительность, частота потуг), состоянием матки и плода, продвижением его по родовому каналу.
Наблюдение за общим состоянием роженицы заключается в периодическом осведомлении о ее самочувствии, характере, силе и локализации болей, поведении роженицы, в систематическом определении пульса, измерении артериального давления.
Важное значение имеет оценка сократительной деятельности матки. Во втором периоде родов тонус матки возрастает примерно в 2 раза по сравнению с таковым в первом периоде, интенсивность сокращений матки уменьшается, но в связи с присоединением сокращений поперечнополосатой мускулатуры брюшного пресса, промежности (потуги) величина развиваемого давления достигает 100 мм рт. ст., продолжительность потуги составляет примерно 90 с, а интервалы между схватками – около 40 с.
При пачьпации живота определяют степень сокращения матки и расслабление ее вне потуг, напряжение круглых связок, высоту стояния контракционного кольца. Обращают внимание на состояние нижнего сегмента матки – нет ли его истончения и болезненности. Большое значение имеет наблюдение за состоянием наружных половых органов и характером выделений из влагалища. Появление отека наружных половых органов указывает на сдавливание мягких тканей родовых путей. Кровяные выделения могут свидетельствовать о начинающейся отслойке плаценты или о повреждении (разрыв, ссадина) мягких тканей родовых путей. Для выяснения характера продвижения предлежащей части плода по родовому каналу производят повторные наружные и влагалищные исследования. Третьим и четвертым приемом наружного акушерского исследования, а также при влагалищном исследовании определяют отношение головки плода к различным плоскостям малого таза.
Контроль за поступательным движением головки. В период изгнания контроль за прохождением головки по родовым путям осуществляют, помимо акушерского и влагалищного исследования, с помощью метода Пискачека: пальцами правой руки, обернутыми марлей, надавливают на ткани в области латерального края большой половой губы до "встречи" с головкой плода. Это возможно, если головка плода находится в узкой части полости малого таза. Следует учитывать, что при большой родовой опухоли способ не дает достоверного результата.
При нормальном течении родов наблюдается последовательное продвижение головки через родовые пути. Нормальная скорость продвижения головки плода по родовому каналу у первородящих составляет 1 см/ч, а у повторнородящих – 2 см/ч. Скорость опускания головки зависит от эффективности изгоняющих сил. Продолжительное стояние головки свидетельствует о возникновении каких-то препятствий к изгнанию плода или на ослабление родовой деятельности. Длительное стояние головки в одной плоскости приводит к сдавлению мягких тканей родовых путей и мочевого пузыря с нарушением в них кровообращения и возможным последующим образованием свищей.
Во втором периоде родов существует следующее правило: головка в период изгнания большим своим сегментом не должна находиться в одной плоскости малого таза свыше 2 ч у первородящих и I ч – у повторнородящих.
Во втором периоде родов состояние плода определяют посредством выслушивания его сердцебиения, постоянной регистрации частоты сердечных сокращений с помощью кардиомониторов, определения показателей кислотно-основного состояния и напряжения кислорода (PQ ) в крови предлежащей части. Исследование Р0 и кислотно-основного состояния следует осуществлять только у рожениц группы высокого риска развития интранатальной патологии, так как использование дополнительных методов иссле-дования у всех рожениц, по мнению многих авторов, приводит к необоснованному расширению показаний к кесареву сечению.
В отсутствие возможности постоянного наблюдения за сердечной деятельностью плода с использованием кардиомонитора следует выслушивать сердечные тоны и считать, определять число сердечных сокращений плода с помощью акушерского стетоскопа после каждой потуги и не реже чем каждые 10-15 мин.
В периоде изгнания при головном предлежании базальная частота сердцебиения составляет от ПО до 170 в минуту. Ритм сердечных сокращений остается правильным.
В ответ на потуги при головном предлежании чаще регистрируются Ранние децелераций U-образной формы (рис. 5.28) до 80 уд/мин, а также V-образные децелерации до 75-85 уд/мин вне сокращения матки или кратковременные акцелераций до 180 уд/мин.
 Рис. 5.28. Кардиотокограмма плода во втором периоде родов.
Рис. 5.28. Кардиотокограмма плода во втором периоде родов.
рН крови из предлежащей части плода во втором периоде родов должна быть выше 7,24 (метод Saling). Тканевое PQ В коже головки составляет 29,7-12 мм рт.ст. (полярографический метод), что на 11 – 18 мм рт.ст. ниже, чем в середине первого периода родов.
Акушерское пособие при головном предлежании. С момента врезывания головки плода все должно быть готово к приему родов. Во время врезывания головки ограничиваются наблюдением за состоянием роженицы, родовой деятельностью и продвижением головки. Роженице разъясняют, как ей нужно вести себя при оказании пособия, следует научить ее правильно дышать, регулировать потуги по совету врача (акушерки). Для того чтобы усилить потуги и создать возможность их регулирования, роженице рекомендуют держаться за края кровати или за специальные приспособления. Ногами, согнутыми в коленных суставах, она упирается в кровать. В течение всего периода изгнания необходимо неустанно следить за тем, чтобы у роженицы не было ложных потуг, непроизвольно истощающих ее силы. У первородящих врезывание головки продолжается 10-20 мин, у повторнородящих – меньше. Во время прорезывания головки приступают к акушерскому пособию – приему родов. Помощь необходима, так как при прорезывании головка плода оказывает сильное давление на тазовое дно и перерастягивает его. Одновременно головка плода подвергается сдавлению со стороны стенок родового канала. Вследствие этого у роженицы могут быть разрывы промежности, а у плода – нарушение мозгового кровообращения. Правильно оказанное пособие значительно снижает возможность этих осложнений.
Акушерское пособие при головном предлежании ("защита промежности") слагается из манипуляций, совершаемых в определенной последовательности.
В нашей стране и развитых зарубежных странах роды принимают на специальной кровати в положении роженицы на спине, с ногами, согнутыми в тазобедренных и коленных суставах и разведенными в стороны.
Первый момент – профилактика преждевременного разгибания головки. В момент рождения головка должна проходить через вульварное кольцо в согнутом положении. При таких условиях она прорезывается через половую щель окружностью, проведенной через малый косой размер (32 см) вместо прямого размера (35 см), как это бывает при разогнутой головке. При прорезывании в согнутом состоянии головка минимально сдавливается тканями родового канала, и при этом меньше растягиваются мышцы промежности.
Для воспрепятствия преждевременному разгибанию головки акушерка кладет левую руку на лонное сочленение и прорезывающуюся головку. При этом ладонные поверхности плотно прилегающих друг к другу четырех пальцев левой руки располагаются плашмя на головке, бережно задерживая ее разгибание и быстрое продвижение по родовому каналу (рис. 5.29, а).
Эти манипуляции следует строго выполнять ладонной поверхностью пальцев руки, а не кончиками пальцев, так как давление последних может повредить головку. Сгибание головки осуществляется до тех пор, пока подзатылочная ямка не подойдет под лонное сочленение и не образуется точка фиксации.
Второй момент – уменьшение напряжения тканей промежности. Одновременно с задержкой преждевременного разгибания головки необходимо уменьшить силу циркуляторно давящих на нее мягких тканей тазового дна и сделать их более податливыми за счет "заимствования" из области половых губ. Это достигается следующим образом. Правую руку ладонной поверхностью кладут на промежность таким образом, чтобы четыре пальца плотно прилегали к области левой, а максимально отведенный палец – к области правой половой губы (см. рис, 5.29, б). Складка между большим и указательным пальцами располагается над ладьевидной ямкой промежности. Осторожно надавливая концами всех пальцев на мягкие ткани вдоль больших половых губ, низводят их книзу, к промежности, уменьшая при этом ее напряжение. Одновременно ладонь правой руки бережно придавливает к прорезывающейся головке ткани промежности, поддерживая их. Благодаря этим манипуляциям уменьшается напряжение тканей промежности; в них остается нормальным кровообращение, что повышает их сопротивляемость разрывам.
Третий момент – регулирование потуг. Опасность разрыва промежности и чрезмерное сдавление головки сильно возрастают, когда она вставляется в вульварное кольцо теменными буграми. Роженица испытывает в это время непреодолимое желание тужиться. Однако быстрое продвижение головки может привести к разрывам тканей промежности и травме головки. Не менее опасно, когда продвижение головки затягивается или приостанавливается из-за прекращения потуг, в результате чего головка длительное время подвергается сжатию натянутыми тканями промежности.
Для того чтобы избежать вышеперечисленных отрицательных последствий, необходимо умелое регулирование потуг: выключение или ослабление, когда это необходимо. После того как головка установилась теменными буграми в половой щели, а подзатылочная ямка подошла под лонное сочленение, выведение головки желательно продолжить вне потуг. Для этого, роженице предлагают глубоко и часто дышать открытым ртом. В таком, состоянии потужная деятельность невозможна. В это время обеими руками задерживают продвижение головки до окончания потуги. После окончания, потуги правой рукой соскальзывающими движениями снимают ткани с личика плода. Левой же рукой в это время медленно поднимают головку кпереди, разгибая ее. При необходимости роженице предлагают произвольно потужиться с силой, достаточной для полного выведения головки т половой щели.
 Рис. 5.29. Ручное пособие при головном предлежании.
а – предупреждение преждевременного разгибания головки; б – уменьшение напряжения промежности ("защита" промежности); в – выведение переднего плечика'; г – освобождение заднего плечика.
Рис. 5.29. Ручное пособие при головном предлежании.
а – предупреждение преждевременного разгибания головки; б – уменьшение напряжения промежности ("защита" промежности); в – выведение переднего плечика'; г – освобождение заднего плечика.
Четвертый момент – освобождение плечевого пояса и рождение туловища плода. После рождения головки совершается последний момент механизма родов – внутренний поворот плечиков и наружный поворот головки. Для этого роженице предлагают потужиться. Во время потуги головка поворачивается лицом к правому бедру при первой позиции, а при второй позиции к левому бедру. Возможно при этом самостоятельное рождение плечиков. Если этого не происходит, то ладонями захватывают головку за височно-щечные области и осуществляют тракции кзади до тех пор, пока треть переднего плечика не подойдет под лонное сочленение (рис. 5.29, в). После того как плечико подведено под лоно, левой рукой захватывают головку, приподнимая ее вверх, а правой рукой сдвигают ткани промежности с заднего плечика, выводя последнее (рис. 5.29, г). После рождения плечевого пояса в подмышечные впадины со стороны спины вводят указательные пальцы обеих рук и туловище приподнимают кверху, соответственно проводной оси таза. Это способствует бережному и быстрому рождению плода. Освобождение плечевого пояса необходимо произвести очень бережно, не растягивая чрезмерно шейный отдел позвоночника плода, поскольку при этом возможны травмы этого отдела. Нельзя также первой выводить переднюю ручку из-под лонного сочленения, поскольку возможен перелом ее или ключицы.
В тех случаях, когда возникает угроза разрыва промежности, производят ее рассечение – перинеотомию (рис. 5.30) или срединную эпизиотомию (рис. 5.31), так как резаная рана с ровными краями заживает лучше, чем рваная рана с размозженными краями. Перинеотомия может производиться и в интересах плода – для предупреждения внутричерепной травмы при неподатливой промежности.
 Рис. 5.30. Перинеотомия.
Рис. 5.30. Перинеотомия.
 Рис. 5.31. Эпизиотомия
Рис. 5.31. Эпизиотомия
Если после рождения головки вокруг шеи плода видна петля пуповины, то ее следует снять через головку, при невозможности сделать это, особенно если пуповина натягивается и сдерживает движение плода, ее необходимо рассечь между двумя зажимами и быстро извлечь туловище. После рождения состояние ребенка оценивают по шкале Апгар (табл. 5.2) через 1 и 5 мин, после чего приступают к первичному туалету новорожденного. Об удовлетворительном состоянии плода свидетельствует оценка 8-10 баллов.
Первичная обработка новорожденного
При первичном туатете новорожденного очень важно соблюдать мероприятия по профилактике внутриутробных инфекций в акушерских стационарах.
Перед обработкой новорожденного акушерка моет и обрабатывает руки, надевает стерильные маску и перчатки. Для первичной обработки новорожденного применяют стерильный индивидуальный комплект, в который входит стерильный индивидуальный набор для обработки пуповины со скобками Роговина.
Родившегося ребенка помещают на обеззараженный, согретый и покрытый стерильной пеленкой лоток, который кладут между согнутыми и разведенными ногами матери на одном с ней уровне. Ребенка обтирают стерильными салфетками.
Здоровый доношенный ребенок сразу после родов дышит и громко кричит. После рождения приступают к обработке глаз ребенка и профилактике гонобленнореи. Последняя проводится как во время первичного туалета новорожденного, так и повторно, через 2 ч. Для этих целей рекомендуется либо 1 % раствор нитрата серебра, либо 30 % раствор сульфацила натрия (альбуцид). Вначале протирают веки от наружного угла к внутреннему сухим ватным тампоном. Затем приподнимают верхнее и нижнее веко, слегка оттягивая верхнее кверху, а нижнее – книзу, капают на слизистую оболочку нижней переходной складки одну каплю раствора. Растворы для обработки глаз меняют ежедневно.
На пуповину, предварительно обработав ее дезинфицирующим раствором (0,5 % раствором хлоргексидина глюконата в 70 % этиловом спирте), после прекращения пульсации, отступя 10 см от пупочного кольца, накладывают зажим. Второй зажим накладывают, отступя 2 см от первого. Участок между зажимами обрабатывают повторно, после чего пуповину пересекают. Ребенка помещают в стерильных пеленках на пеленальный столик, подогреваемый сверху специальной лампой, после чего его осматривает неонатолог.
Перед обработкой пуповины новорожденного акушерка повторно тщательно обрабатывает, моет, протирает спиртом руки, надевает стерильные перчатки и стерильную маску. Остаток пуповины со стороны ребенка протирают стерильным тампоном, смоченным в 0,5 % растворе хлоргексидина глюконата в 70 % этиловом спирте, затем пуповину отжимают между большим и указательным пальцами. В специальные стерильные щипцы вкладывают стерильную металлическую скобку Роговина и накладывают ее на пуповину, отступя 0,5 см от кожного края пупочного кольца. Щипцы со скобкой смыкают до их защемления. Остаток пуповины отрезают на 0,5- 0,7 см выше края скобки. Пупочную рану обрабатывают раствором 5 % калия перманганата или 0,5 % раствором хлоргексидина глюконата в 70 % этиловом спирте. После наложения скобки на пуповину можно использовать пленкообразующие препараты.
Если ребенок родился при наличии Rh-сенсибилизации у матери, то на пуповину сразу после рождения накладывают зажим, а затем – шелковую лигатуру, отступя 2-2,5 см от кожного края пупочного кольца. Пуповину отсекают стерильными ножницами на 2-2,5 см от лигатуры. Культю пуповины завязывают стерильной марлевой салфеткой. Пуповину в данных ситуациях оставляют для того, чтобы можно было произвести заменное переливание крови через сосуды пуповины.
Обработку кожных покровов новорожденного проводят стерильным ватным тампоном или одноразовой бумажной салфеткой, смоченной стерильным растительным или вазелиновым маслом из индивидуального флакона разового пользования. Удаляют сыровидную смазку, остатки крови. После выполнения первичной обработки измеряют рост ребенка, размеры головки и плечиков, массу тела, на ручки надевают браслеты, на которых написаны имя и отчество матери, номер истории родов, пол ребенка, дата рождения. Затем ребенка завертывают в стерильные пеленки и одеяло. В родильном зале в течение первого получаса после рождения в отсутствие противопоказаний, связанных с осложнениями родов (асфиксия, крупный плод и т.д.), целесообразно прикладывать новорожденного к груди матери. Раннее прикладывание к груди и грудное вскармливание способствуют более быстрому становлению нормальной микрофлоры кишечника, Повышению неспецифической защиты организма новорожденного, становлению лактации и сокращению матки у матери.
После прикладывания ребенка к груди его передают под наблюдение неонатолога.
Ведение последового периода
Последовый период начинается после рождения плода. Являясь самым кратковременным из всех периодов родов, он наиболее опасен из-за возможности кровотечения из матки в процессе отделения плаценты и рождения последа. Эти осложнения возникают чаще от несвоевременных вмешательств, которые нарушают физиологическое течение последового периода.
Большинством акушеров принята выжидательная тактика ведения последового периода, требующая от врача внимательного наблюдения за роженицей, чтобы своевременно распознать возникшие осложнения. В процессе наблюдения врач контролирует общее состояние роженицы, параметры гемодинамики, следит за состоянием мочевого пузыря, а главное – за характером и количеством кровяных выделений из матки, признаками отделения плаценты.
Врач оценивает общее состояние роженицы (цвет кожных покровов,, реакция на окружающую обстановку), пульс, артериальное давление. Пульс должен быть хорошего наполнения, неболее 100 ударов в минуту, а артериальное давление не должно снижаться более чем на 15-20 мм рт.ст. по сравнению с исходным.
В последовом периоде необходимо следить за состоянием мочевого пузыря и опорожнить его, если это не было произведено сразу после родов, поскольку переполнение мочевого пузыря задерживает сокращение матки и нарушает физиологический процесс отслойки плаценты.
Даже при физиологическом течении последового периода возможно выделение крови из половых органов. Появление небольшого кровотечения, указывает на начавшуюся отслойку плаценты. При физиологической кровопотере (300-500 мл; 0,5 % массы тела) и в отсутствие признаков отделения плаценты, при хорошем состоянии роженицы последовый период ведут выжидательно в течение 30 мин.
Активное вмешательство становится необходимым в следующих ситуациях: 1. объем кровопотери при кровотечении превышает 500 мл, или 0,5 Ягмассы тела; 2. при меньшей кровопотере, но ухудшении общего состояния роженицы; 3. при продолжении последового периода свыше 30 мин даже при хорошем состоянии роженицы и в отсутствие кровотечения.
Нередко отделившаяся плацента продолжает оставаться в родовых путях, препятствуя хорошему сокращению матки. Поэтому, если отделившаяся плацента не рождается, ее следует удалить наружными приемами, не дожи-, даясь 30 мин.
Активное вмешательство в третьем периоде родов начинается с определения признаков отделения плаценты.
Для того чтобы установить, отделилась плацента или нет, руководствуй ются следующими, признаками.
Признак Шредера. Если плацента отделилась и опустилась в нижний сегмент или во влагалище, дно матки поднимается вверх и располагается выше и вправо от пупка; матка приобретает форму песочных часов.
Признак Чукалова-Кюстнера. При надавливании ребром кисти руки на надлобковую область при отделившейся плаценте матка приподнимается вверх, пуповина же не втягивается во влагалище, а наоборот, еще больше выходит наружу (рис. 5.32, а,б).
Признак Альфельда. Лигатура, наложенная на пуповину у половой щели роженицы, при отделившейся плаценте опускается на 8-10 см и ниже от Бульварного кольца.
Признак Довженко. Роженице предлагают дышать глубоко: если при выдохе пуповина не втягивается во влагалище, то плацента отделилась.
 Рис. 5.32. Признак отделения плаценты.
а – плацента еще не отделилась: при надавливании ребром кисти на надлобковую область пуповина втягивается во влагалище; б – плацента отделилась: при надавливании ребром кисти на надлобковую область пуповина не втягивается во влагалище.
Рис. 5.32. Признак отделения плаценты.
а – плацента еще не отделилась: при надавливании ребром кисти на надлобковую область пуповина втягивается во влагалище; б – плацента отделилась: при надавливании ребром кисти на надлобковую область пуповина не втягивается во влагалище.
Признак Клейна. Роженице предлагают потужиться: при отделившейся плаценте пуповина остается на месте; если же плацента еще не отделилась, то пуповина после потуг втягивается во влагалище.
Одним из наиболее часто применяемых в практике методов определения отделения плаценты является признак Чукалова-Кюстнера.
 Рис. 5.33. Удаление отделившегося последа по Абуладзе.
Рис. 5.33. Удаление отделившегося последа по Абуладзе.
Ни один из перечисленных признаков не является абсолютным для решения вопроса о совершившемся (или несовершившемся) отделении плаценты. Лишь наличие двух-трех из этих признаков позволяет правильно решить данный вопрос.
При наличии признаков отделения плаценты отделившийся послед удаляют наружными методами. При этом применяют следующие наружные методы удале-ния отделившегося последа.
Способ Абуладзе. После опорожнения мочевого пузыря переднюю брюшную стенку захватывают обеими руками в складку таким образом, чтобы были плотно обхвачены пальцами обе прямые мышцы живота (рис. 5.33). После этого роженице предлагают потужиться. Отделившийся послед при этом легко рождается благодаря устранению расхождения прямых мышц живота и значительному уменьшению объема брюшной полости.
Способ Креде-Лазаревича. Выполняется в определенной последовательности:? 1. опорожняют мочевой пузырь катетером; 2. приводят дно матки в срединное положение; 3. производят легкое поглаживание (не массаж!) матки в целях ее сокращения; 4. обхватывают дно матки кистью той руки, которой акушер лучше владеет, с таким расчетом, чтобы ладонные поверхности четырех ее пальцев располагались на задней стенке матки, ладонь – на самом дне матки, а большой палец – на передней ее стенке (рис. 5.34); 5. одновременно надавливают на матку всей кистью в двух перекрещивающихся направлениях (пальцами – спереди назад, ладонью – сверху вниз) в направлении к лобку до тех пор, пока послед не родится из влагалища.
 Рйс. 5.35. Выделение оболочек. а скручивание в канатик; б – способ Гентера.
Рйс. 5.35. Выделение оболочек. а скручивание в канатик; б – способ Гентера.
Способ Креде-Лазаревича применяют без наркоза. Наркоз необходим лишь в тех случаях, когда предполагают, что отделившийся послед задерживается в матке вследствие спастического сокращения маточного зева.
 Рис. 5.36. Осмотр материнской поверхности плаценты.
Рис. 5.36. Осмотр материнской поверхности плаценты.
 Рис. 5.37. Осмотр плодных оболочек
Рис. 5.37. Осмотр плодных оболочек
Иногда после рождения последа обнаруживается, что оболочки его задержались в матке. Для того чтобы удалить их из матки, родившуюся плаценту берут в руки и, медленно вращая, закручивают оболочки в канатик (рис. 5.35, а). В результате этого оболочки бережно отделяются от стенок матки и выделяются вслед за плацентой. Оболочки могут быть удалены и следующим приемом: после рождения плаценты роженице предлагают поднять таз вверх, опираясь на ступни. Плацента в силу своей тяжести потянет за собой оболочки, которые отслоятся от матки и выделятся наружу (рис. 5.35, б).
 Рис. 5.38. Добавочная долька плаценты, к которой идут сосуды.
Рис. 5.38. Добавочная долька плаценты, к которой идут сосуды.
После полного рождения последа необходимо убедиться в его целости. Для этого послед, обращенный материнской поверхностью вверх, кладут на гладкий поднос или руки акушерки и внимательно осматривают сначала плаценту, а затем оболочки (рис. 5.36, 5.37). Если имеются дефекты дольки или части дольки, срочно под наркозом производят ручное удаление остатков плаценты, вводя руку в полость матки. При осмотре оболочек выясняют их целостность, а также обращают внимание на отдаленность места разрыва от края плаценты, что позволяет определить расположение плацентарной площадки: чем ближе к краю плаценты произошел разрыв оболочек, тем ниже расположение плаценты в матке. Одновременно в оболочках выявляют кровеносные сосуды с целью обнаружения добавочной дольки плаценты (рис. 5.38). Если в оболочках имеются сосуды и на их пути нет дольки плаценты, значит, она задержалась в полости матки. Для ее удаления проводят ручное обследование матки. Если в полости матки задержались оболочки без плацентарной ткани, то необходимо под надзором также удалить их рукой, введенной в полость матки, даже если кровотечение не наблюдается.
Убедившись в целости последа, определяют его массу и размер площади материнской поверхности плаценты. После осмотра последа с помощью градуированного цилиндра определяют количество крови, потерянной роженицей (включая ретроплацентарную кровь). Наружные половые органы, нижнюю часть живота и внутренние поверхности бедер обмывают теплым дезинфицирующим раствором с жидким мылом. После этого осматривают наружные половые органы, включая преддверие влагалища и промежность, чтобы определить их целость, с помощью влагалищных зеркал – стенки влагалища и шейку матки. Осмотр с помощью зеркал производят на гинекологическом кресле или родовой кровати. С использованием обезболивания все обнаруженные разрывы зашивают.
Данными о состоянии последа, родовых путей дополняют записи, внесенные в историю родов. Сведения о целости последа в связи с особой важностью этого вопроса подписывает осмотревший послед врач.
Следует всегда помнить, что роженицы в последовом периоде не-транспортабельны.
После рождения последа родившая женщина называется родильницей.
Первые 2 ч после родов родильницу оставляют в родильном зале, наблюдая за ее общим состоянием, пульсом, артериальным давлением, состоянием матки, характером кровяных выделений. Через 2 ч после родов, если все обстоит благополучно, родильницу переводят из родильного зала в послеродовое отделение.
Глава 6. Физиология послеродового периода
Изменения в организме родильницы
Послеродовым, или пуэрперальным, называется период, в течение которого у родильницы заканчивается обратное развитие (инволюция) тех органов и систем, которые подверглись изменениям в связи с беременностью и родами. Обычно этот период с учетом индивидуальных особенностей течения беременности и родов продолжается 6-8 нед. Исключением являются молочные железы и гормональная система, функция которых достигает в течение первых нескольких дней послеродового периода своего максимального развития и продолжается в течение периода лактации.Состояние гормонального гомеостаза
Эндокринные изменения в послеродовом периоде характеризуются резким понижением уровня плацентарных гормонов и восстановлением функции желез внутренней секреции. Время возобновления циклических гипоталамо-гипофизарно-яичниковых взаимоотношений и менструальной функции колеблется в широких пределах и согласуется в основном с лактацией.
Интервал между родоразрешением и появлением овуляторных циклов составляет примерно 49 дней у некормящих и 112 – у кормящих родильниц.
Для начала лактации требуется воздействие на молочную железу эстрогенов, прогестерона, высокого уровня пролактина (ПРЛ). В последующем секреция молока регулируется гипоталамо-гипофизарной системой и состоит из 2 взаимосвязанных процессов: молокообразования и его выделения. Основными гормонами, ответственными за установление и поддержание лактации, являются пролактин и окситоцин.
Уровень сывороточного пролактина непосредственно после родов обычно высокий, но спустя 48 ч понижается даже у кормящих грудью, а затем постепенно повышается к концу 2-й недели и сохраняется в течение всего периода лактации на высоком уровне.
Выброс в кровь пролактина и окситоцина может обусловливаться раздражением сосков молочной железы. Именно поэтому прикладывание новорожденного к груди в течение первого часа после рождения положительно влияет на становление лактации и сокращение матки.
Максимальное повышение уровня пролактина в ответ на кормление происходит через 30 мин независимо от его исходного значения. На концентрацию пролактина влияет полнота опорожнения молочной железы в результате кормления или сцеживания.
Наряду с изменением уровня половых гормонов в послеродовом периоде постепенно восстанавливается функция всех желез внутренней секреции.
Объем щитовидной железы возвращается к нормальному значению в течение 12 нед послеродового периода, а уровень основных ее гормонов – Т4 и ТЗ – в течение 4 нед.
Одновременно в послеродовом периоде меняется синтез инсулина, глюкокортикоидов и ми нерало корти коидов, что отражается на общих процессах обмена веществ и обратном развитии систем организма, измененных во время беременности.
Половые органы и молочные железы
Матка. Непосредственно после окончания третьего периода родов происходит значительное сокращение матки, которая становится шаровидной, несколько сплющенной в переднезаднем направлении. Ее дно находится на 15-16 см выше лобка. Толщина стенок матки, наибольшая в области дна (4-5 см), постепенно уменьшается по направлению к шейке матки, где толшина мышц всего 0,5 см. В полости матки находится небольшое количество сгустков крови. Поперечный размер матки составляет 12-13 см, длина полости от наружного зева до дна – 15-18 см, масса – около 1000 г. Шейка матки свободно проходима для кисти руки (рис. 6.1, а). Вследствие быстрого уменьшения объема матки стенки полости имеют складчатый характер, а в дальнейшем постепенно разглаживаются. Наиболее выраженные изменения стенки матки отмечаются в месте расположения плаценты – плацентарной площадки, которая представляет собой раневую шероховатую поверхность с тромбами в области сосудов. На других участках обнаруживаются части децидуальной оболочки, остатки желез, из которых впоследствии восстанавливается эндометрий. Сохраняются периодические сократительные движения маточной мускулатуры преимущественно в области дна. Большая подвижность матки обусловлена растяжением и расслаблением ее связочного аппарата и тазового дна, поэтому переполненный мочевой пузырь может значительно поднимать матку вверх. В то же время при надавливании на дно матки при опорожненном мочевом пузыре можно опустить ее шейку до половой щели.
В течение последующей недели за счет инволюции матки масса ее уменьшается до 500 г, к концу 2-й недели – до 350 г, 3-й – до 250 г, к концу послеродового периода, как и во внебеременном состоянии, – 50 г.
Масса матки в послеродовом периоде уменьшается за счет постоянного тонического сокращения мышечных волокон, что способствует снижению кровоснабжения и как следствие – гипотрофии и даже атрофии отдельных волокон. Большая часть сосудов облитерируется.
Инволюция шейки матки происходит несколько медленнее, чем тела. Через 10-12 ч после родов начинает сокращаться внутренний зев, уменьшаясь до 5-6 см в диаметре.
Наружный зев за счет тонкой мышечной стенки остается почти прежним. Канал шейки матки в связи с этим имеет воронкообразную форму. Через сутки канат суживается (рис, 6.1, б). К 10-м суткам внутренний зев практически закрыт. Формирование наружного зева происходит медленнее, поэтому окончательное формирование шейки матки происходит к концу 13-й Недели послеродового периода. Первоначальная форма наружного зева не восстанавливается вследствие происшедших перерастяжения и надрывов в боковых отделах во время родов. Маточный зев имеет вид поперечной щели, Щейка матки имеет цилиндрическую форму, а не коническую, как до родов.
 Рис.6.1. Родовой канал. Состояние верхнего и нижнего сегментов. а – сразу после родов: 1 – граница между верхним и нижним сегментами матки; б – на 2-е сутки после родов.
Рис.6.1. Родовой канал. Состояние верхнего и нижнего сегментов. а – сразу после родов: 1 – граница между верхним и нижним сегментами матки; б – на 2-е сутки после родов.
Эпителизация внутренней поверхности матки заканчивается к концу 10-х суток, за исключением плацентарной площадки, заживление которой происходит к концу 3-й недели. Остатки децидуальной оболочки и сгустки крови под действием протеолитических ферментов отторгаются и расплавляются в послеродовом периоде с 4-го по 10-й день.
В глубоких слоях внутренней поверхности матки, преимущественно в подэпителиальном слое, при микроскопии обнаруживают мел ко клеточную инфильтрацию, образующуюся на 2-4-й день после родов в виде грануляционного вала. Этот барьер преграждает проникновение микроорганизмов в стенку; в полости матки они уничтожаются за счет действия протеолитических ферментов макрофагов, биологически активных веществ и др. В процессе инволюции матки мелкоклеточная инфильтрация постепенно исчезает.
Отделяемое из матки в различные дни послеродового периода имеет различный характер и называется лохиями (от греч. lochia – роды). В первые 2-3 дня после родов – это кровяные выделения (lochia rubra), с 3-4-го дня до конца первой недели лохии становятся серозно-сукровичными (lochia serosa), а с 10-го дня желтовато-белый цвет с большой примесью лейкоцитов (lochia alba), к которым постепенно (с 3-й недели) примешивается слизь из шеечного канала. На 5-6-й неделе выделения из матки прекращаются и имеют такой же характер, как и до беременности.
Общее количество лохий в первые 8 дней послеродового периода достигает 500 -1000 г; у них щелочная реакция, специфический (прелый) запах. Если по каким-либо причинам происходит задержка лохий в полости матки, то образуется лохиометра. В случае присоединения инфекции может развиться воспалительный процесс – эндометрит.
Маточные трубы в течение первых 2 нед освобождаются от избыточного кровенаполнения, отека и приобретают исходный до беременности вид.
Яичники. После прекращения кормления грудью менструальная функция возобновляется. Однако возможно наступление овуляции, а следовательно, и беременности в течение первых месяцев после родов.
Влагалище. Просвет влагачища у первородящих, как правило, не возвращается к своему первоначальному состоянию, а остается шире; складки на стенках влагалища выражены слабее. В первые недели послеродового периода объем влагалища сокращается. Отечность, гиперемия, ссадины влагалища исчезают. От девственной плевы остаются сосочки (carunculae myrtiformis).
Связочный аппарат матки восстанавливается в основном к концу 3-й недели после родов.
Мышцы промежности, если они не травмированы, начинают восстанавливать свою функцию уже в первые дни и приобретают обычный тонус к 10-12-му дню послеродового периода. Мышцы передней брюшной стенки постепенно восстанавливают свой тонус к 6-й неделе послеродового периода.
Молочные железы. В послеродовом периоде в молочных железах происходят следующие процессы: 1. маммогенез – развитие молочной железы; 2. лактогенез – инициация секреции молока; 3. галактопоэз – поддержание секреции молока; 4. галактокинез – удаление молока из железы.
Окончательная дифференцировка молочной железы заканчивается за несколько дней до родов. В течение 48 ч после родов железистые клетки становятся высокими, с обильным содержанием шероховатой эндоплазматической сети, хорошо развитым аппаратом Гольджи (пластинчатый комплекс) и большим количеством микроворсин на апикальной поверхности клеток, хорошо развитой эндоплазматической сетью. Альвеолы наполняются молоком, вследствие чего эпителиальные клетки становятся распластанными и деформированными.
Кровоток в молочной железе значительно увеличивается в течение беременности и в дальнейшем во время лактации. Отмечается тесная корреляция скорости кровотока и скорости секреции молока. Накопленное в альвеолах молоко не может пассивно поступать в протоки. Для этого необходимо сокращение окружающих протоки миоэпителиальных клеток. Они сокращают альвеолы и проталкивают молоко в протоковую систему, что ведет к его выделению, Миоэпителиачьные клетки, подобно клеткам миометрия, имеют специфические рецепторы к окситоцину.
Адекватное выделение молока является важным фактором успешной лактации. Во-первых, при этом альвеолярное молоко доступно для ребенка, и, во-вторых, удаление молока из альвеол необходимо для продолжения его секреции. Поэтому частое кормление и опорожнение молочной железы Улучшают его продукцию.
Увеличение продукции молока обычно достигается путем увеличения частоты кормления, включая кормление в ночное время, а в случае недостаточной сосательной активности у новорожденного – кормлением поочередно то одной, то другой молочными железами. После прекращения лактации молочная железа обычно принимает первоначальные размеры, хотя железистая ткань полностью не регрессирует.
Состав грудного молока. Секрет молочных желез, выделяющийся в первые 2-3 дня после родов, называется молозивом, секрет, вьщеляющийся на 3-4-й день лактации, – переходным молоком, которое постепенно превращается в зрелое грудное молоко.
Молозиво (colostrum). Его цвет зависит от входящих в состав молозива каротиноидов. Относительная плотность молозива 1,034; плотные вещества составляют 12,8 %. В состав молозива входят молозивные тельца, лейкоциты и молочные шарики. Молозивные тельца, происхождение которых неясно, представляют собой большие, крупные, иногда не совсем правильной формы клетки с нечетким и бледно окрашивающимся ядром и мелкими жировыми включениями. Среди лейкоцитов встречаются сегментоядерные лейкоциты и лимфоциты, которые играют большую роль в иммунитете новорожденного. Молозиво богаче зрелого грудного молока белками, жирами и минеральными веществами, но беднее углеводами. Энергетическая ценность молозива очень высокая: в 1-й день лактации составляет 150 ккал/ЮО мл, во 2-й – ПО ккал/100 мл, в 3-й – 80 ккат/100 мл.
Аминокислотный состав молозива занимает промежуточное положение между аминокислотным составом грудного молока и плазмой крови.
Общее содержание в молозиве иммуноглобулинов (являющихся в основном антителами) классов A, G, М и D превышает их концентрацию в грудном молоке, являясь активной защитой организма новорожденного.
В молозиве содержится также большое количество олеиновой и линолевой кислот, фосфолипидов, холестерина, триглицеридов, являющихся необходимыми структурными элементами клеточных мембран, миелинизированных нервных волокон и др. В состав углеводов, кроме глюкозы, входят сахароза, мальтоза и лактоза. На 2-й день лактации отмечено наибольшее количество р-лактозы, которая стимулирует рост бифидобактерий, препятствующих размножению патогенных микроорганизмов в кишечнике, В молозиве в большом количестве представлены также минеральные вещества, витамины, ферменты, гормоны и простагландины.
Грудное молоко является наилучшим видом пищи для ребенка первого года жизни. Количество и соотношение основных ингредиентов, входящих в состав женского молока, обеспечивают оптимальные условия для их переваривания и всасывания в желудочно-кишечном тракте ребенка. Различие между женским и коровьим молоком (наиболее часто используемым для кормления ребенка в отсутствие грудного молока) весьма существенно.
Белки женского молока относятся к идеальным, их биологическая ценность равна 100 %. В состав грудного молока входят белковые фракции, идентичные сыворотке крови. В белках грудного молока значительно больше альбуминов, в то время как в коровьем молоке больше казеиногена.
Изначально содержание белка и солей высокое, но в течение 1-й недели с момента установления секреции молока – оно снижается на 10 – 25% и затем уменьшается более медленно с увеличением периода лактации. Влияние пищевых белков на содержание белка в молоке ограничено. Поступление протеинов с пищей скорее влияет на общее количество продуцируемого молока, чем на содержание в нем белка. Концентрация лактозы быстро увеличивается в течение 1-й недели с последующим снижением.
В молоке при преждевременных родах содержатся более высокие концентрации необходимых длинноцепочечных и полиненасыщенных жирных кислот, чем в молоке при родах в срок, что является достаточным для поддержания роста мозга у преждевременно рожденных детей.
После преждевременных родов концентрация белка и небелкового азота в молоке выше, а концентрация лактозы ниже, чем в молоке у женщин, родивших в срок.
Молочные железы являются также частью иммунной системы, специфически адаптированной для обеспечения иммунной защиты новорожденного от инфекций желудочно-кишечного и респираторного тракта.
Клеточный состав молока представлен в основном моноцитами (70 – 80 %), которые дифференцируются в макрофаги в момент их прохождения через эпителий, около 15 – 20% составляют нейтрофилы и около 10% – лимфоциты, включая 8и Т-лимфоциты. Общее количество лейкоцитов в молоке в первые дни лактации составляет 1-2 млн в 1 мл. Затем их концентрация снижается.
Сердечно-сосудистая система
После родоразрешения объем циркулирующей крови (О ЦК) снижается на 13,1 %, объем циркулирующей плазмы (ОЦП) – на 13 %, объем циркулирующих эритроцитов (ОЦЭ) – на 13,6 %.
Снижение ОЦК в раннем послеродовом периоде в 2-2,5 раза превышает величину кровопотери и обусловлено депонированием крови в органах брюшной полости при снижении внутрибрюшного давления непосредственно после родов.
В последующем ОЦК и ОЦП увеличиваются за счет перехода внеклеточной жидкости в сосудистое русло.
ОЦЭ и содержание циркулирующего гемоглобина остаются сниженными на протяжении всего послеродового периода.
Частота сердечных сокращений (ЧСС), ударный объем и сердечный выброс сразу после родов остаются повышенными и в некоторых случаях более высокими в течение 30-60 мин. В течение первой недели послеродового периода определяются исходные значения этих показателей. До 4-го Дня послеродового периода может наблюдаться транзиторное повышение систолического и диастол ичес ко го давления примерно на 5 %.
Количество тромбоцитов возрастает в течение 2 нед после родов. Фибринолитическая активность повышается в первые 1-4 дня послеродового периода и возвращается к нормальному уровню в течение 1-й недели. Концентрация фибриногена постепенно уменьшается в течение 2 нед. Изменения гемостаза в сочетании с травматизацией сосудов и малой подвижностью женщины представляют высокий риск развития тромбоэмболичесКих осложнений в послеродовом периоде, особенно после оперативного Родоразрешения.
Мочевыделительная система
Сразу после родов наблюдаются гипотония мочевого пузыря и снижение его вместимости. Гипотонию мочевого пузыря усугубляют длительные роды и применение эпидурачьной анестезии. Гипотония мочевого пузыря обусловливает затруднение и нарушение мочеиспускания. Родильница может не ощущать позывов на мочеиспускание или они становятся болезненными.
Клубочковая фильтрация, клиренс эндогенного креатинина, увеличенные во время беременности, возвращаются к нормальным параметрам к 8-й неделе послеродового периода.
Почечный кровоток уменьшается в течение послеродового периода. Нормальный его уровень окончательно устанавливается в среднем к 5-6-й неделе после родов. Причины длительной регрессии почечного кровотока неизвестны.
Органы пищеварения
Аппетит у родильниц обычно хороший. Вследствие некоторой атонии гладкой мускулатуры желудочно-кишечного тракта могут наблюдаться запоры, которые исчезают при рациональном питании и активном образе жизни. Появляющиеся нередко после родов геморроидальные узлы (если они не ущемляются) мало беспокоят родильниц.
Ведение послеродового периода
Основной задачей ведения послеродового периода является профилактика гнойно-септических заболеваний у родильницы и новорожденного. В связи с этим при организации ухода за родильницей особенно важное значение имеет соблюдение правил асептики и антисептики. Проникновение инфекции в половые пути и молочные железы представляет большую опасность для здоровья родильницы и новорожденного.Родильниц с различными признаками инфекции необходимо изолировать во 2-е (обсервационное) акушерское отделение.
Перед заполнением послеродового отделения палаты и мебель тщательно моют дезинфицирующим раствором; матрацы, подушки и одеяла подвергают обработке в дезинфекционной камере. Помещение проветривают и облучают бактерицидными лампами. Кровати застилают стерильным бельем. Все инструменты, материалы и предметы ухода также должны быть стерильными. При каждой койке должно быть продезинфицированное подкладное судно, имеющее тот же номер, что и кровать, для исключения возможного распространения инфекции.
За родильницей ежедневно наблюдают врач и акушерка (медицинская сестра). У родильницы выясняют жалобы, оценивают общее состояние, измеряют пульс, артериальное давление, температуру тела (дважды в день), наблюдают за состоянием наружных половых органов, матки, молочных желез, характером выделений и физиологических отправлений.
При активном ведении послеродового периода здоровые родильницы встают в первые сутки после родов. Здоровые родильницы могут заниматься гимнастикой, должны строго соблюдать правила личной гигиены, ежедневно принимать душ, менять белье. Для этого оборудуются комнаты гигиены. Постельное белье меняют каждые 2-3 дня. Питание кормящей матери должно быть калорийным (3200 ккал), сбалансированным с обязательным включением витаминов и микроэлементов.
При начальных проявлениях инфекции у родильницы или новорожденного их переводят в обсервационное отделение.
Особое внимание врач обращает на характер выделений из половых путей и изменения высоты стояния дна матки.
При оценке лохий необходимо определять их цвет, характер и количество. Лохии в первые 3 дня послеродового периода имеют кровяной характер, с 4-го по 8-9-й дни становятся серозно-сукровичными, а с 10-го дня приобретают вид жидких, светлых выделений. К концу 2-й недели лохии очень скудные, а к 5-6-й неделе выделения из половых путей прекращаются.
Высоту стояния дна матки над лоном измеряют сантиметровой лентой, при этом мочевой пузырь должен быть опорожнен. Величина ее в первый день составляет 15-16 см. Снижаясь ежедневно на 2 см, дно матки к 10-му дню нормального послеродового периода над лоном не определяется. Матка при пальпации, как правило, безболезненная, подвижная, плотная. Регулярное опорожнение мочевого пузыря и кишечника способствует активной инволюции матки. При болезненных схватках можно назначить обезболивающие и спазмолитические средства.
Более достоверную информацию об инволютивных процессах в матке в послеродовом периоде можно получить при ультразвуковом исследовании (трансабдоминальная и трансвагинальная эхография). При этом определяют длину, ширину, переднезадний размер матки.
Отмечаются существенные различия в темпах инволюции отдельных размеров матки в первые дни послеродового периода. В первые 8 сут после родов инволюция матки в основном происходит за счет изменения длины, ширины и в значительно меньшей степени переднезаднего размера матки. Наибольшая скорость уменьшения длины матки установлена со 2-х по 5-е сутки, ширины – со 2-х по 4-е сутки послеродового периода.
При исследовании полости матки оценивают ее размеры и содержимое. Полость матки в первые 3 сут после родов определяется при эхографии в виде структуры щелевидной формы с четкими контурами. На 5-7-е сутки неосложненного послеродового периода полость матки идентифицируется у 66,7 % родильниц после самопроизвольных родов и у 77,8 % – после кесарева сечения. Переднезадний размер полости матки составляет: 1. на 2-3-й сутки – 1,5±0,3 см; 2. на 5-7-е сутки 0,8±0,2 см; 3. на 8-9-е сутки – 0,4+0,1 см.
К 3-м суткам послеродового периода содержание полости матки при Ультразвуковом исследовании характеризуется наличием небольшого количества кровяных сгустков и остатков децидуальной ткани. Наиболее часто Указанные структуры локализуются в верхних отделах полости матки на 1-3-й сутки послеродового периода. В дальнейшем частота обнаружения эхоструктур в полости матки снижается. При этом к 5-7-м суткам послеродового периода они, как правило, локализуются в нижних отделах матки в непосредственной близости к внутреннему зеву.
Ультразвуковая картина послеродовой матки зависит от метода родоразрешения: после кесарева сечения уменьшение матки в длину происходит значительно медленнее, чем при родах через естественные родовые путч. Кроме того, после абдоминального родоразрешения отмечается утолщение передней стенки матки, особенно выраженное в области шва (нижний маточный сегмент). В проекции шва визуализируется зона с неоднородной эхоплотностью, шириной 1,5-2,0 см, в структуре которой идентифициро-вали точечные и линейные сигналы с низким уровнем звукопроводимости – отражение от лигатур.
Состояние молочных желез в послеродовом периоде определяется методом пальпации – в норме они равномерно плотные, безболезненные, при надавливании на сосок в первые 2 дня выделяется молозиво, затем – молоко. Следует тщательно осматривать сосок, на поверхности которого не должно быть трещин.
В послеродовом отделении организуется кормление новорожденных. Перед каждым кормлением матери надевают косынку, моют руки с мылом. Рекомендуется обмывать молочные железы теплой водой с детским мылом не менее 2 раз в сутки или перед и после каждого кормления, начиная от соска и заканчивая подмышечной впадиной, просушивать стерильной ватой или марлей.
После кормления остатки молока необходимо сцедить до полного опорожнения молочной железы для исключения застоя молока (это способствует улучшению лактации и является профилактикой нагрубания и инфицирования желез).
Начиная с 3-х суток родильница пользуется бюстгалтером для предупреждения чрезмерного нагрубания молочных желез. При появлении значительного нагрубания, что бывает нередко на 3-4-е сутки после родов, ограничивают питье, назначают слабительные, диуретические средства, ношпу.
Первое прикладывание здорового ребенка к груди здоровой родильницы рекомендуется сразу после родов. В последующем кормление проводится 6 раз в сутки.
При нормальном течении послеродового периода родильницу и новорожденного выписывают на 4-6-е сутки под наблюдение врача женской консультации.
Глава 7. Беременность и роды при тазовых предлежаниях плода
Тазовые предлежания плода относятся к патологическому акушерству, роды в тазовом предлежании – к патологическим.При тазовом предлежании чаще, чем при головном, наблюдаются травматические повреждения и материнская заболеваемость (разрывы мягких родовых путей и промежности, повреждения лобкового и крестцово-подвздошного сочленений, кровотечения, послеродовые инфекционные заболевания).
Перинатальная заболеваемость и смертность при тазовых предлежаниях плода значительно выше, чем при головных, и обусловлены многими факторами, такими как недоношенность, гипоксия, родовая травма (разрывы мозжечкового намета, кровоизлияния), повреждения органов брюшной полости и спинного мозга, аномалии развития плода и др.
Перинатальные потери при тазовом предлежании при различных методах родоразрешения составляют от 0,5 до 14,3 %, т.е. в 3-5 раз выше по сравнению с этим показателем при родах в головном предлежании. Наибольшие перинатальные потери отмечаются при родах в ножном предлежании.
Во многом перинатальные потери зависят от способа родоразрешения. Основными причинами перинатальных потерь являются преждевременные роды, врожденные аномалии, родовая травма. На аутопсии наиболее часто поражены головной и спинной мозг, печень, надпочечники, селезенка. При влагалищных оперативных родах иногда поражены плечевые сплетения, кивательные мышцы, глотка.
Изучение отдаленных последствий для детей, рожденных в тазовом предлежании, показало, что у них часто имеются дисплазия или вывихи тазобедренных суставов, отставание в психомоторном развитии, энцефалопатии, гидроцефалия и др.
Тазовые предлежания встречаются в 3-5 %.
Классификация
В нашей стране различают следующие разновидности тазовых предлежании: 1. ягодичные предлежания (сгибательные) 2. ножные (разгибательные) предлежания.Ягодичные предлежания в свою очередь подразделяются на чисто ягодичные и смешанные ягодичные предлежания. Некоторые авторы чисто ягодичные предлежания называют неполными, а смешанные ягодичные – полными.
При чисто ягодичных (неполных) предлежаниях ко входу в таз обращены ягодицы: ножки вытянуты вдоль туловища – согнуты в тазобедренных и разогнуты в коленных суставах и стопы расположены в области подбородка и лица (рис. 7.1, а).
 Рис. 7.1. Варианты тазовых предлежании
а – чисто ягодичное предлежание; б – смешанное ягодичное предлежание; в – полное ножное предлежание; г – неполное ножное предлежание.
Рис. 7.1. Варианты тазовых предлежании
а – чисто ягодичное предлежание; б – смешанное ягодичное предлежание; в – полное ножное предлежание; г – неполное ножное предлежание.
При смешанных ягодичных (полных) предлежаниях (рис. 7.1, б) ягодицы обращены ко входу в малый таз вместе с ножками, согнутыми в тазобедренных и коленных суставах, несколько разогнуты в голеностопных суставах, плод в позе на "корточках".
Ножные предлежания разделяют на полные, неполные и коленные. При полных ножных предлежаниях ко входу в таз предлежат обе ножки плода, слегка разогнутые в тазобедренных и согнутые в коленных суставах (рис. 7.1, в). При неполных ножных предлежаниях – предлежит одна ножка, разогнутая в тазобедренном и коленном суставах, а другая, согнутая в тазобедренном и коленном суставе, располагается выше (рис. 7.1, г). При коленных предлежаниях ножки разогнуты в тазобедренных суставах и согнуты в коленных, а коленки предлежат ко входу в таз. Ножные предлежания образуются во время родов.
Среди тазовых предлежании ягодичные встречаются примерно в 30 % случаев и чаще у первородящих. Среди ножных предлежании чаще всего встречаются неполные, которые в 30 % случаев в родах переходят в полное.
Позиции и виды позиций плода при тазовом предлежании определяются, как при головном – по спинке плода.
Этиология тазовых предлежании до настоящего времени остается недо-статочно выясненной. Полагают, что изменения формы матки способствуют формированию неправильного положения плода, в том числе и тазового. Выдвигается предположение о наличии материнских, плодовых, плацентарных факторов, способствующих тазовому предлежанию.
К материнским факторам относятся аномалии развития матки, опухоли матки, узкий таз, опухоли таза, снижение или повышение тонуса матки у многорожавших, рубец на матке после операций, в том числе кесарева сечения и др.
К плодовым факторам относятся недоношенность, многоплодие, задержка внутриутробного развития и врожденные аномалии плода (анэнцефалия, гидроцефалия), неправильное членорасположение плода, особенности вес-тибулярного аппарата у плода и др. Обнаружены значительные цитоморфологические нарушения в нейросекреторных ядрах гипоталамуса при тазовых предлежаниях, гибель большого числа нейронов, повышение функциональной активности нейросекреторных клеток, наличие кровоизлияний. Указанные изменения могут неблагоприятно отразиться на течении острой фазы адаптации новорожденного и дальнейшем развитии ребенка, так как при этом происходит увеличение физиологических концентраций нейрогормонов (окситоцина, вазопрессина), содержащихся в нейросекрете. Установлено, что при тазовых предлежаниях у доношенных новорожденных нервные элементы продолговатого мозга менее зрелые (наряду с нейронами имеются нейробласты) в отличие от детей, рожденных в головном предлежании.
Плацентарные факторы включают предлежание плаценты, расположение ее в области дна или углов матки, маловодие или многоводие и пр.
Среди этиологических факторов наиболее часто встречается недоношенность, малои многоводие, пороки развития гениталий, нарушение тонуса матки у многорожавших, узкий таз.
Заслуживает внимания точка зрения о том, что формирование тазового предлежания плода зависит от зрелости его вестибулярного аппарата, а поэтому чем меньше срок беременности, тем чаще выявляются тазовые предлежания. Так, при сроке беременности 21,-24 нед тазовые предлежания встречаются в\ 33 %, а при доношенной беременности – в 3,5-4,5 %.
Характер "предлежания плода окончательно формируется к 34-36-й неделе беременности.
Диагностика
Распознавание тазсшых предлежании основано главным образом на умении пальпаторно отличйтХголовку плода от ягодиц.При наружном акушерском исследовании следует использовать четыре приема Леопольда.
Первый прием позволяет определить в дне матки округлую, плотную, баллотирующую головку, нередко смещенную от средней линии живота вправо или влево. Дно матки при тазовых предлежаниях стоит выше, чем при головном предлежании, при одном и том же сроке гестации, что обусловлено тем, что тазовый конец плода обычно находится над входом в малый таз до конца беременности и начала родов.
При втором приеме определяют спинку плода, которая обычно располагается с одной стороны живота, а мелкие части – с другой.
При третьем приеме над входом или во входе в таз прощупывается крупная, неправильной формы предлежащая часть мягковатой консистенции, неспособная к баллотированию.
При четвертом приеме уточняется предлежащая часть (она обычно крупная, неправильной формы, мягковатой консистенции) и ее отношение ко входу в малый таз. Тазовый конец плода обычно до конца беременности находится над входом в таз.
Сердцебиение плода при тазовых предлежаниях наиболее отчетливо прослушивается выше пупка, иногда на его уровне, справа или слева (в зависимости от позиции). Позиция и виды позиций определяются по спинке плода (как при головных предлежаниях).
Диагноз тазового предлежания обычно вызывает трудности только при выраженном напряжении мышц передней брюшной стенки и повышенном тонусе матки, при ожирении, двойне, анэнцефатии.
Для уточнения диагноза тазового предлежания и определения его разновидности используют влагалишное исследование.
При влагалищном исследовании во время беременности через передний свод прощупывается объемистая мягковатой консистенции предлежащая часть плода, отличающаяся от головки, которая более плотная и круглая.
Тазовые предлежания без труда диагностируются при ультразвуковом исследовании, которое позволяет определить не только тазовое предлежание, но и пол, вид, массу плода, положение головки (согнута, разогнута), обвитие пуповины, локализацию плаценты, размеры и степень ее зрелости, количество вод, определить аномалии развития плода и др.
При электрокардиографическом исследовании желудочковый комплекс QRS плода обращен книзу, а не кверху, как при головном предлежании.
С успехом можно использовать амниоскопию, при которой устанавливают характер предлежания плода, количество и цвет околоплодных вод, возможное предлежание петель пуповины.
Различают четыре варианта положения головки плода при тазовом предлежании (угол измеряется между позвоночником и затылочной костью головки плода): 1. головка согнута (угол больше 110°), 2. головка слабо разогнута (поза военного) – I степень разгибания (угол от 100 до 110°), 3. головка умеренно разогнута – II степень разгибания (угол от 90 до 100°), 4. чрезмерное разгибание головки ("смотрит на звезды") – Ш степень разгибания (угол меньше 90°).
Клиническими признаками разгибания головки плода являются несоответствие размеров головки плода предполагаемой его массе (размеры головки представляются большими), расположение головки в дне матки, наличие выраженной шей но-затылочной борозды.
Наиболее четко определить положение головки плода можно при ультразвуковом исследовании.
Причины чрезмерного разгибания головки, кроме случаев наличия опухоли в области шеи плода, неясны.
Механизм родов
В конце беременности и начале родов ягодицы своим поперечным размером располагаются над одним из косых размеров входа в таз (при переднем виде, первой позиции – над левым косым размером). Продвижение плода по родовому канату начинается обычно к концу полного раскрытия маточного зева.Принято различать шесть моментов механизма родов при тазовом предлежании плода.
Первый момент – внутренний поворот ягодиц. Он начинается при переходе ягодиц из широкой части полости таза в узкую. Поворот совершается таким образом, что в выходе таза поперечный размер ягодиц оказывается в прямом размере таза. Передняя ягодица подходит под лобковую дугу (между большим вертелом и краем подвздошной кости), образуя точку фиксации, задняя же устанавливается над копчиком. При этом туловище плода подвергается незначительному боковому сгибанию выпуклостью кзади в соответствии с изгибом крестца.
Второй момент – боковое сгибание поясничной части позвоночника плода. Дальнейшее поступательное движение плода приводит к большему боковому сгибанию позвоночника плода. При этом задняя ягодица выкатывается над промежностью и вслед за ней из-под лобкового сочленения окончательно рождается передняя ягодица (рис. 7.2, а). В это время плечики вступают своим поперечным размером в тот же косой размер входа в таз, через который прошли ягодицы.
Третий момент – внутренний поворот плечиков и наружный поворот туловища. Этот поворот завершается установлением плечиков в прямом размере выхода. При этом спинка поворачивается в сторону, переднее плечико плода подходит под лобковую дугу (на границе верхней и средней трети), а заднее Устанавливается впереди копчика над промежностью (рис. 7.2, б).
Четвертый момент – боковое сгибание шейно-грудной части позвоночника. С этим моментом связано рождение плечевого пояса и ручек.
Пятый момент – внутренний поворот головки (затылком кпереди) Головка вступает малым косым размером в косой размер входа в таз, противоположный тому, в котором проходили плечики. При переходе из широкой BJ узкую часть таза головка совершает внутренний поворот, в результате кото-. рого сагиттальный (стреловидный) шов оказывается в прямом размере выхода, а подзатылочная ямка – под лобковым сочленением, где образуется, точка фиксации.
Шестой момент – сгибание головки (рис. 7.2, в). Следствием этого является прорезывание головки (рождение): последовательно выкатываются над. промежностью подбородок, рот, нос, темя и затылок. Головка прорезывается малым косым размером. Реже наблюдается прорезывание головки средним косым размером, что приводит к сильному растяжению промежности и к возможному ее разрыву.
 Рис. 7.2. Механизм родов при тазовом предлежании.
а – боковое сгибание поясничного отдела позвоночника (второй мо-мент); б – внутренний поворот плечиков и наружный поворот туловища' (третий момент); в – сгибание голов-; ки и рождение ее (шестой момент).
Рис. 7.2. Механизм родов при тазовом предлежании.
а – боковое сгибание поясничного отдела позвоночника (второй мо-мент); б – внутренний поворот плечиков и наружный поворот туловища' (третий момент); в – сгибание голов-; ки и рождение ее (шестой момент).
Механизм родов при ножных предлежаниях отличается от описанного]; тем, что первыми из половой щели показываются вместо ягодиц ножки (при полном предлежании). В последнем случае разогнутой (предлежа-L щей) ножкой бывает, как правило, передняя (обращенная к симфизу).
Когда ножка родилась до колена, яголицы вступают в таз. Дальнейший процесс родов происходит по типу ягодичных. Выпадение ножки во влагалище и за пределы половой щели может произойти при неполном раскрытии зева.
Родовая опухоль при ягодичных предлежаниях располагается больше на одной из ягодиц: при первой позиции – на левой ягодице, при второй – на правой. Часто родовая опухоль переходит с ягодиц на наружные половые органы плода, что проявляется отеком мошонки или половых губ.
При ножных предлежаниях родовая опухоль располагается на ножках, которые становятся отечными и сине-багровыми.
Вследствие быстрого рождения последующей головки не происходит ее конфигурация, и она имеет округлую форму.
При нормальном механизме спинка во время рождения туловища вращается кпереди (передний вид). В некоторых случаях спинка плода поворачивается кзади, возникает задний вид, течение родов замедляется. Если головка идет в согнутом состоянии, то область переносицы упирается в симфиз и над промежностью выкатывается затылок. Нередко возникает тяжелое осложнение в связи с разгибанием головки: подбородок задерживается над симфизом, и головка должна родиться в состоянии крайнего разгибания. Без акушерской помощи рождение головки задерживается, и плод гибнет от асфиксии. Головка должна быть освобождена быстро и бережно с помощью специальных приемов.
Течение беременности и родов
Многочисленные патогенетические факторы формирования тазового предлежания плода являются причиной более высокого числа осложнений беременности.Наиболее частыми осложнениями при тазовых предлежаниях плода в первой половине беременности являются угроза прерывания (45 %), которая у каждой пятой беременной протекает с клиническими признаками истмико-цервикальной недостаточности, токсикоз первой половины беременности (27,5 %) и др.
Во второй половине беременности отмечаются следующие осложнения: гестоз различной степени тяжести (35,6 %), угроза прерывания беременности (39,3 %), гипотрофия плода (4,9 %), обвитие пуповиной (40,8 %), маловодие (25,3 %) и др.
Течение родов при тазовых предлежаниях характеризуется большим числом осложнений. В первом периоде родов наиболее частым является раннее или преждевременное излитие околоплодных вод. Особенно часто это осложнение наблюдается при ножных предлежаниях. Тазовый конец меньше головки, при вступлении в таз он не прилегает плотно к родовому каналу. Пояс соприкосновения отсутствует, передние и задние воды не разграничены. При каждой схватке околоплодные воды устремляются в нижний отдел матки, оболочки не выдерживают большого напряжения и разрываются преждевременно. В момент излития вод может произойти выпадение петель пуповины и мелких частей плода. Выпадение петель пуповины при тазовых предлежаниях встречается в 5 раз чаще, чем при головном. Однако и при тазовом предлежании, хотя и реже, чем при головном, может быть сдавление выпавшей петли пуповины, приводящее к гипоксии и гибели плода, если своевременно не оказать помощь.
При тазовых предлежаниях нередко наблюдается слабость родовой деятельности, особенно при раннем и преждевременном излитии околоплодных вод. При этом раскрытие шейки матки происходит медленно, тазовый конец довольно долго остается над входом в таз, роды затягиваются. Несвоевременное излитие вод и затяжные роды ведут к нарушению маточноплацентарного кровообращения и развитию гипоксии у плода, а также способствуют проникновению инфекции в матку. При этом возможно ин-фицирование оболочек, плаценты, матки и плода.
Период изгнания при тазовых предлежаниях имеет свои особенности, связанные с тем, что наиболее крупная часть плода – головка – рождается последней. Первым продвигается по родовому каналу менее объемный тазовый конец, который не может расширить родовые пути до такой степени, которая необходима для бережного прохождения плечевого пояса и головки. Поэтому при вступлении в таз плечевого пояса могут возникнуть осложнения, опасные для плода: запрокидывание ручек и разгибание головки (ущемление головки). При этих осложнениях рождение плечевого пояса и головки задерживается, плоду грозит гипоксия и гибель.
При прохождении через таз верхнего отдела туловища и головки неизбежно возникает сдавление пуповины. Если изгнание туловища и головки затягивается свыше 3-5 мин, возникает тяжелая гипоксия плода, которая может привести к его смерти. Эти осложнения чаще всего встречаются при ножных предлежаниях, потому что ножки при малом их объеме недостаточно расширяют родовые пути.
Одним из грозных осложнений является вколачивание ягодиц в таз при ягодичном предлежании и это часто является проявлением клинического несоответствия плода и таза матери. Серьезное осложнение – поворот плода спинкой кзади, когда подбородок фиксируется под лобковым симфизом, головка разгибается: возникает угроза гипоксии, травмы плода и матери.
При родах в тазовом предлежании нередко возникают травмы у матери в виде разрывов шейки матки, влагалища и промежности.
Нередко в родах наблюдается переход одного типа тазового предлежания в другой. Так, переход неполного ножного предлежания в полное отмечается в 30 % случаев. Такой переход считается неблагоприятным и является основанием для расширения показаний к кесареву сечению.
Ведение беременности и родов
Тазовое предлежание, диагностируемое до 28 нед беременности, требует только выжидательного наблюдения.У 70 % повторнородящих и у 30 % первородящих беременных поворот на головку происходит спонтанно до родов и в небольшом проценте во время родов.
Если учесть, что тазовое предлежание является неблагоприятным для течения родов и их исхода для плода, то при сроке беременности более 29-30 нед многие авторы рекомендовали проводить мероприятия, направленные на изменение тазового предлежания на головное. Большое внимание при этом уделяется комплексу гимнастических упражнений.
Самый простой комплекс упражнений заключается в следующем: беременная, лежа на кушетке, попеременно поворачивается на правый и левый бок и лежит на каждом из них по 10 мин. Процедуру повторяют 3-4 раза. Занятия проводятся 3 раза в день. Поворот плода на головку может произойти в течение первой недели.
Эффективность комплекса гимнастических упражнений обусловлена изменением тонуса мышц передней брюшной стенки и матки в результате раздражения механои барорецепторов матки, воздействия на вестибулярный аппарат плода. Доказано, что с помощью гимнастических упражнений можно не только способствовать исправлению тазового предлежания плода на головное, но и регулировать тонус и спонтанную активность матки. У беременных с дифференцированным подбором физических упражнений отмечено исправление тазового предлежания плода на головное в 76,3 % случаев.
В отношении наружного профилактического поворота плода на головку при тазовом предлежании плода единая точка зрения отсутствует, хотя эффективность его достаточно высока – 67-70 %.
Наружный профилактический поворот, предложенный Б.А.Архангельским, требует соблюдения ряда условий: его должен выполнять врач высокой квалификации в стационарных условиях, где в случае необходимости (кровотечение, острая гипоксия плода) может быть произведено кесарево сечение. В последнее время наружный поворот на головку предлагается проводить после 36-37 нед беременности при достаточном количестве околоплодных вод под контролем УЗИ. Обязательным при этом является назначение р-миметиков для снижения тонуса матки. Кроме того, следует осуществлять мониторный контроль за сердечной деятельностью плода до поворота и в течение часа после его выполнения.
Однако, если учесть, что для проведения наружного профилактического поворота имеется достаточно много противопоказаний (угроза прерывания беременности, узкий таз, возраст первородящей более 30 лет, бесплодие или невынашивание беременности в анамнезе, аномалии развития гениталий, рубец на матке, многоплодие, малоили многоводие, заболевания сердечно-сосудистой системы и др.) и во время его проведения нередко наблюдаются такие осложнения, как преждевременная отслойка плаценты, вскрытие плодного пузыря, острая гипоксия плода, эмболия околоплодными водами, повреждения спинного мозга у плода и др., то становится ясным, почему вопрос о целесообразности проведения наружного поворота плода на головку остается предметом дискуссии и многие предпочитают вести роды в тазовом предлежании или производят плановое кесарево сечение.
Выбор способа родоразрешения при тазовом предлежании плода зависит от возраста женщины, срока беременности, состояния и массы плода, степени разогнутости его головки, "зрелости" шейки матки, размеров малого таза, сопутствующей экстрагенитальной патологии, осложнений данной беременности (длительная угроза невынашивания, гестоз, недонашивание и перенашивание) и др.
Тактика родоразрешения при тазовом предлежании должна быть определена до родов. Она может быть следующей: 1. спонтанное начало родов и родоразрешение через естественные родовые пути; 2. родовозбуждение в срок или до срока родов; 3. родоразрешение путем кесарева сечения в плановом порядке.
Очень важным при выборе метода родоразрешения является определение предполагаемой массы плода. Установлено, что самая низкая смертность при тазовом предлежании плода при его массе от 2500 до 3500 г. Плод более 3600 г при тазовом предлежании принято считать крупным. При массе плода 1500-2500 г часто неблагоприятен исход родов при влагалищном родоразрешении, потому что головка, являясь наиболее крупной частью плода, подвергается травмированию (внутричерепные кровоизлияния), особенно при ножном предлежании.
Наиболее объективным методом определения предполагаемой массы плода является ультразвуковое исследование.
Серьезным и опасным осложнением в процессе рождения головки является ее чрезмерное разгибание, вследствие чего нередко возникают кровоизлияния в мозжечок, субдуральные гематомы, травмы шейного отдела спинного мозга и разрывы мозжечкового намета. Наличие III степени разгибания головки (по данным УЗИ) является основанием для родоразрешения путем кесарева сечения. При 1 и II степени разгибания во время оказания ручного пособия при рождении плода требуется осторожность при выведении головки.
Для оценки состояния плода при тазовом предлежании показано изучение его сердечной деятельности, а также маточно-плацентарного и плодово-плацентарного кровотока (допплерометрия).
Огромное значение при тазовом предлежании плода имеет оценка размеров и формы малого таза. При тазовом предлежании даже небольшое уменьшение одного из размеров таза может привести к травматизму плода в процессе родов, поскольку при его рождении последующая головка не успевает приспособиться к тазу матери.
Объективную оценку размеров и формы костного таза можно получить при рентгенопельвиметрии.
При рентгенопельвиметрии производится измерение прямых и поперечных размеров малого таза во всех плоскостях, что позволяет избрать адекватный метод родоразрешения.
Большое значение при определении готовности женского организма к родам при тазовом предлежании плода имеет "зрелость" шейки матки для выбора метода родоразрешения как во время беременности, так и при преждевременном излитии околоплодных вод.
Для выбора способа родоразрешения все клинические данные и результаты, полученные при объективных методах исследования, целесообразно оценивать по балльной шкале прогноза родов при тазовом предлежании доношенного плода [Чернуха Е.А., Пучко Т.К., 1991] (табл. 7.1).
Оценка ведется по 13 параметрам от 0 до 2 баллов каждый. Если сумма баллов равняется 16 и более, то роды можно вести через естественные родовые пути. Кесарево сечение показано, если хотя бы один из внутренних размеров таза оценивается в 0 баллов, имеется чрезмерное разгибание головки плода, предполагаемая его масса 4000 г и более, при выраженном внутриутробном страдании плода, при "незрелой" шейке матки, переношенной беременности, а также при массе плода 3500-3999 г и размерах таза, оцененных в 1 балл, у первородящих.
В настоящее время в связи с опасностью травматизации плода при родоразрешающих операциях через естественные родовые пути большинство акушеров считают целесообразным расширение показаний к кесареву сечению при тазовом предлежании плода (операция проводится в 80-90 % случаев). Исход же для плода при кесаревом сечении значительно лучше, чем при родах через естественные родовые пути. При ведении родов через естественные родовые пути тактика может быть изменена в зависимости от конкретной акушерской ситуации.
Показаниями для проведения планового кесарева сечения при тазовых предлежаниях плода являются перенашивание беременности, неподготовленность родовых путей при доношенной беременности, аномалии развития половых органов, анатомически узкий таз, выраженная хроническая гипоксия плода, масса плода более 3600 г и менее 2000 г, разгибание головки III степени. Кроме указанных показаний, значительное место занимают сочетанные показания, а именно: сочетание тазового предлежания с возрастом первородящей более 30 лет, длительным бесплодием в анамнезе, неблагоприятным исходом предыдущих родов, рубцом на матке после кесарева сечения и др.
При хорошем состоянии беременной и плода, нормальных размерах таза и средних размерах плода, при согнутой его головке, при зрелой шейке матки роды следует вести через естественные родовые пути под мониторным контролем, В процессе родов могут появиться осложнения со стороны матери и(или) плода, и план ведения родов может быть изменен в сторону оперативного родоразрешения.
С началом родовой деятельности следует уточнить характер тазового предлежания, что облегчается после разрыва плодного пузыря и при значительном раскрытии маточного зева. При чисто ягодичном предлежании пальпируется объемистая мягковатой консистенции часть плода, можно при этом определить крестец, копчик, седалищные бугры, щель между ягодицами, заднепроходное отверстие, половые органы плода, паховый сгиб. По расположению крестца распознают позицию и вид плода: при переднем виде первой позиции он обращен влево и кпереди, при заднем виде второй позиции – вправо и кзади. При смешанном ягодичном предлежании рядом с ягодицами прощупывается стопа.
Можно ошибочно чисто ягодичное предлежание спутать с лицевым, приняв анус за рот, седалищные ости за молярные возвышения. Тщательное исследование должно предотвратить ошибку. Исследуемый патец ощущает сопротивление мышц ануса, в то время как более твердые челюсти ощущаются при прохождении в рот. Более того, палец, выведенный из ануса, иногда окрашен меконием. Рот и молярные возвышения имеют треугольную форму, в то время как седалищные бугры и анус располагаются по одной линии. Пальпацию половых органов и заднепроходное отверстие следует проводить очень бережно, чтобы не нанести травму.
При ножных предлежаниях пяточный бугор, короткие и ровные пальцы, отсутствие отведения большого пальца позволяют отличить ножку от ручки плода. Колено отличается от локтя наличием подвижной надколенной чашечки.
В первом периоде родов с целью профилактики раннего вскрытия плодного пузыря роженица должна соблюдать постельный режим. Роженицу укладывают на тот бок, куда обращена спинка плода, что способствует вставлению предлежащей части плода, усилению родовой деятельности, предупреждению выпадения петель пуповины.
Сразу после излития вод производят влагалищное исследование, чтобы уточнить диагноз и исключить выпадение петель пуповины.
При ведении родов в тазовом предлежании обязателен мониторный контроль за сердечной деятельностью плода и сократительной деятельностью матки.
Сердечная деятельность плода при тазовом предлежании в начале первого периода родов не отличается от сердечной деятельности плода при головном предлежании и имеет свои особенности в конце первого и втором периодах родов: отмечается более высокая базальная частота сердечных сокращений (БЧСС), появление акцелераций в ответ на схватку и ранних децелерации во время потуг. К начатьным признакам гипоксии плода в первом периоде родов относятся умеренная тахикардия (БЧСС 175-190 уд/мин) или брадикардия (БЧСС до 100 уд/мин), периодическая кратковременная аритмия или монотонность ритма; во втором периоде родов отмечается снижение БЧСС до 80 уд/мин, периодическая монотонность ритма в сочетании с аритмией. К выраженным признакам гипоксии в первом периоде родов относятся тахикардия до 200 уд/мин или брадикардия до 80 уд/мин, стойкая монотонность ритма или аритмия, длительные поздние урежения ЧСС. Во втором периоде родов – тахикардия свыше 200 уд/мин или брадикардия ниже 80 уд/мин, стойкая аритмия в сочетании с монотонностью или длительным поздним урежением ЧСС.
Для оценки динамики родового процесса (раскрытием маточного зева) необходимо ведение партограммы. При нормальном течении родов скорость раскрытия шейки матки в активную фазу родов при тазовом предлежании плода должна быть не менее 1,2 см/ч у первородящих и не менее 1,5 см/ч – у повторнородящих.
При установившейся регулярной родовой деятельности (открытие шейки матки на 3-4 см) показано введение обезболивающих (промедол и др.) и спазмолитических средств (но-шпа, баралгин и др.). Хорошие результаты получены при проведении эпидуральной анестезии, которая (кроме обезболивающего эффекта) способствует регуляции родовой деятельности, более быстрому раскрытию шейки матки; во втором периоде родов релак-сации мышц тазового дна. Необходимо проводить мероприятия по профилактике гипоксии плода: 2-4 мл 1 % раствора сигетина, 50-100 мг кокарбоксилазы, 10-20 мл 40 % раствора глюкозы, ингаляции увлажненного кислорода и др.
Важной задачей являются своевременная диагностика аномалий родовой деятельности и проведение соответствующего лечения. При выявлении нарушений сократительной деятельности матки при тазовых предлежаниях плода чаще, чем при головном, следует решать вопрос о родоразрешении путем кесарева сечения.
Наиболее частыми показаниями к экстренному проведению кесарева сечения у женщин с тазовым предлежанием являются слабость родовой деятельности, отсутствие схваток в течение 2-3 ч после излития околоплодных вод, гипоксия плода.
При выпадении петли пуповины при доношенном жизнеспособном плоде, неуспешности ее заправления и отсутствии условий для быстрого родоразрешения через естественные родовые пути следует произвести кесарево сечение.
Во втором периоде родов необходимо усилить наблюдение за плодом, сердцебиение плода следует выслушивать после каждой потуги. Предпочтительно проводить мониторный контроль с учетом особенностей сердечной деятельности плода у рожениц с тазовым предлежанием. В отличие от головного предлежания появление мекония во время изгнания плода не является признаком гипоксии, так как меконий выдавливается из кишечника механически.
Во втором периоде родов с профилактической целью рекомендуется внутривенное капельное введение утеротонических средств (окситоцин). К концу второго периода родов для предупреждения спазма шейки матки рекомендуется ввести 1,0 мл 0,1 % раствора сульфата атропина, или 2,0 мл 2,0 % раствора папаверина гидрохлорида, или другие спазмолитические средства.
С момента врезывания ягодиц роженицу укладывают так, чтобы ее таз находился на краю родильной кровати. Во время потуг роженице рекомендуют стопами упираться в подставки, а руками удерживаться за специальные приспособления или прижимать руками бедра к животу для усиления потуг Уменьшения угла наклонения таза.
До прорезывания ягодиц вмешиваться в течение родов не следует. При прорезывании тазового конца необходимо произвести средин но-латеральНУЮ элизиотомию.
При родах в тазовом предлежании различают 4 этапа: 1. рождение плода до пупка 2. рождения плода от пупка до нижнего угла лопаток 3. рождение плечевого пояса и ручек 4. рождение головки.
Когда в половой щели показывается пупочное кольцо, наступает момент, чрезвычайно опасный для плода. В это время головка вступает в малый таз и прижимает пуповину, что ведет к гипоксии плода.
Если родовой процесс протекает правильно, то рождение туловища и головки завершается быстро. Весь механизм изгнания плечевого пояса и головки должен закончиться в ближайшие 3-5 мин, иначе плод родится в состоянии асфиксии. Прижатие пуповины более 10 мин может закончиться гибелью плода. Плоду, помимо прижатия пуповины, грозит другая опасность – отслойка плаценты, ввиду резкого уменьшения объема матки в связи с рождением туловища плода. Поэтому после рождения плода до пупочного кольца необходима скорая и умелая акушерская помощь.
Роды ведут выжидательно, пока плод не родится до пупка. Преждевременное потягивание за ножку или паховый сгиб противопоказано, поскольку это ведет к нарушению членорасположения, запрокидыванию ручек и разгибанию головки плода. Следует обратить внимание на то, не натянута ли пуповина (характер ее пульсации), и при возможности ее ослабить или даже пересечь, а затем ускорить рождение плода.
В периоде изгнания при родах в тазовом предлежании необходимо оказание ручного пособия, которое отличается при чисто ягодичном и ножных предлежаниях. Ручное пособие направлено на сохранение членорасположения плода и следование естественному течению родов.
В нашей стране наибольшее распространение при чисто ягодичном и ножных предлежаниях получили пособия по методу Н.А.Цовьянова (1929) и метод Морисо-Левре-Лашапелль для выведения последующей головки плода.
Ручное пособие при чисто ягодичном предлежании по методу Цовьянова. Основная цель – удержание ножек в течение периода изгнания вытянутыми и прижатыми к туловищу плода, что способствует сохранению нормального членорасположения плода. Тем самым предупреждается возникновение таких неблагоприятных осложнений, как запрокидывание ручек и разгибание головки.
При чисто ягодичном предлежании ножки плода вытянуты вдоль туловища и прижимают скрещенные ручки к грудной клетке, а стопы, достигая уровня лица, поддерживают головку согнутой, если она не находится в разогнутом состоянии. Такое расположение ножек превращает тело плода в конус, постепенно расширяющийся кверху. На уровне плечевого пояса он достигает своего максимального объема (в среднем 42 см), который слагается из объема грудной клетки, обеих скрещенных на груди ручек плода и прижатых к ним ножек – все это превышает объем последующей головки (32-34 см), поэтому рождение ее происходит без затруднения.
Техника ручного пособия по Цовьянову при чисто ягодичном предлежании заключается в следующем. После прорезывания ягодиц их захватывают руками так, чтобы большие пальцы обеих рук располагались на прижатых к животу бедрах плода, а остальные четыре пальца обеих рук – на поверхности крестца. При таком захватывании ножек предупреждается преждевременное их выпадение и это способствует физиологическому течению механизма родов – движению рождающегося туловища кпереди (к животу матери) по проводной оси таза (рис. 7.3, а,б).
 Рис. 7.3. Ручное пособие по Цовьянову при чисто ягодичном предлежании. а – захватывание туловища; б – по мере рождения туловища руки передвигаются к половой щели
Рис. 7.3. Ручное пособие по Цовьянову при чисто ягодичном предлежании. а – захватывание туловища; б – по мере рождения туловища руки передвигаются к половой щели
По мере рождения туловища плода врач бережно прижимает ножки плода к животу большими пальцами, остальные пальцы рук перемещает вверх по спине, постепенно продвигая руки к половой щели, чем предупреждается выпадение ножек плода, а также запрокидывание ручек за головку. Следует удерживать туловище так, чтобы не образовался задний вид (спинка плода не повернулась кзади). При хорошей родовой деятельности плод быстро рождается до пупочного кольца, а вслед за этим и до нижних углов лопаток. При этом поперечный размер плечиков плода переходит в один из косых размеров, а к моменту рождения плечевого пояса – в прямой размер выхода таза. Ягодицы плода необходимо направлять несколько кзади, чтобы облегчить рождение передней ручки плода из-под лобковой дуги. Для рождения задней ручки плод приподнимают кпереди и из крестцовой впадины рождается задняя ручка. После этого в глубине зияющей половой щели появляются подбородок, рот, нос плода. Если в это время потуги сильны, для освобождения головки достаточно направить ягодицы плода на себя и кверху. При этом головка рождается без какого-либо дополнительного вме-шательства.
Если же рождение ручек и головки задерживается, то последние освобождают ручными приемами, а головку – приемом Морисо-Левре-Лашапелль и значительно реже – акушерскими щипцами (см. акушерские пособия и операции при тазовых предлежаниях).
Для удержания головки в согнутом состоянии необходимо, чтобы ассистент осторожно надавливал рукой на дно матки, чтобы оно все время находилось в соприкосновении с опускающейся головкой.
При заднем виде чистого ягодичного предлежания прорезывающееся туловище осторожно поворачивается вокруг продольной оси спинкой кпереди, вправо или влево, в зависимости от позиции. Если поворот затруднителен, роды ведут в заднем виде. При повороте плода из заднего вида в передний может произойти запрокидывание ручек плода, что обычно вызывает значительные трудности при их выведении.
При ножных предлежаниях осложнения родов и мертворожден ия встречаются чаше, чем при ягодичных. Возникновение осложнений связано с тем, что рождающиеся ножки не могут расширить родовые пути для беспрепятственного рождения объемистого плечевого пояса и головки. Поэтому при ножных предлежаниях нередко наблюдаются за-прокидывание ручек, разгибание головки и ее ущемление в судорожно сократившейся шейке матки. Эти осложнения можно предотвратить, если к моменту изгнания плечевого пояса шейка матки.
В настоящее время при ножных предлежаниях плода, особенно при выпадении ножки (или ножек), при неполном открытии маточного зева методом выбора родоразрешения считают кесарево сечение.
Ручное пособие при ножных предлежаниях по методу Цовьянова. До недавнего времени широко применялось предложенное Н.А.Цовьяновым ручное пособие при ножных предлежаниях плода, при котором ножки удерживались во влагалище до полного раскрытия маточного зева.
Уточнив путем влагалищного исследования ножное предлежание, стерильной пеленкой покрывают наружные половые органы и ладонью, приложенной к вульве, препятствуют преждевременному выпадению ножек из влагалиша (рис. 7.4). Плод во время потуги как бы садится на корточки и образует смешанное ягодичное предлежание, а затем, продвигаясь по родовому канату, оказывает сильное давление на нервное крестцовое сплетение, усиливая схватки и потуги.
Противодействие рождающимся ножкам следует оказывать до тех пор, пока не наступило полное раскрытие маточного зева, на что указывает сильное выпячивание промежности предлежащей частью плода, зияние заднепроходного отверстия, частые и энергичные потуги, стояние контракционного кольца на 5 поперечных пальцев выше лобка. Когда ягодицы спускаются до преддверия влагалища, ножки плода, несмотря на оказываемое им противодействие, начинают выступать из-под боковых сторон ладони акушера. Это соответствует полному раскрытию маточного зева. Как только установлено полное раскрытие маточного зева, противодействие ножкам больше не оказывают, и ножки, а вслед за ними ягодицы плода и его туловище рождаются без затруднений.
После рождения туловища до нижних углов лопаток ручное пособие оказывают, как при ягодичном предлежании.
 Рис. 7.4. Ручное пособие по Цовьянову при ножных предлежаниях.
Рис. 7.4. Ручное пособие по Цовьянову при ножных предлежаниях.
При ножных предлежаниях осложнения родов и мертворожден ия встречаются чаше, чем при ягодичных. Возникновение осложнений связано с тем, что рождающиеся ножки не могут расширить родовые пути для беспрепятственного рождения объемистого плечевого пояса и головки. Поэтому при ножных предлежаниях нередко наблюдаются запрокидывание ручек, разгибание головки и ее ущемление в судорожно сократившейся шейке матки. Эти осложнения можно предотвратить, если к моменту изгнания плечевого пояса шейка матки будет раскрыта полностью.
Непременным условием успешного ведения родов указанным методом является внутривенное введение утеротонических средств, систематическое (после каждой потуги) выслушивание сердечных тонов плода стетоскопом.?
а лучше ультразвуковым датчиком с цифровым обозначением или с помощью кардиотокографа, наблюдение за высотой стояния контракционного кольца, за выделениями из половых путей (возможна отслойка плаценты, разрыв шейки матки).
Ручное пособие по Цовьянову не всегда предупреждает выпадение ножек, запрокидывание ручек и затруднения при выведении ручек (плечевого пояса) и головки плода. В подобных ситуациях прибегают к классическому ручному пособию с целью рождения ручек и головки плода. Классическое ручное пособие оказывается при самопроизвольных родах, после рождения туловища до нижнего утла лопаток или при оказании пособия по Цовьянову, если рождение плечевого пояса и головки не совершается в течение 2-3 мин.
При потягивании плода за туловище и несвоевременном его отклонении кпереди может произойти резкое разгибание головки и повреждение позвоночных артерий, которые проходят в поперечных отростках шейных позвонков и кровоснабжают мозг и шейный отдел позвоночника. Важно отметить, что на уровне CIV спинного мозга у плода расположены клетки спинального дыхательного центра. Даже незначительные повреждения стенки позвоночной артерии могут вызвать ее спазм, нарушение вертебробазилярного кровотока и привести к молниеносной смерти плода в процесе родов или развитию параличей у новорожденного. Кроме того, грубые манипуляции во время оказания пособия при выведении головки могут привести к травме шейного отдела позвоночника и повреждению спинного мозга.
Метод Bracht. В Европе при родах в тазовом предлежании используется метод Bracht, при котором плод спонтанно рождается до пупка. Затем тело ребенка удерживают и, не сдавливая, отктоняют в сторону симфиза матери. Применяемая сила при этой процедуре должна быть умеренной. Удержание ребенка в этой позиции усиливает маточные сокращения и умеренного давления ассистента над лобком на головку плода часто достаточно, чтобы завершить роды спонтанно.
В некоторых случаях туловище плода после его выхождения из родовых путей поворачивается спинкой не кпереди, как это бывает при типичном механизме родов, а кзади. Образующийся при этом задний вид осложняет течение родов, так как последующая головка прорезывается в заднем виде прямым своим размером, а не малым косым, как при переднем виде. Возникающие трудности для прохождения головки через родовые пути часто являются причиной гибели плода от внутричерепной травмы, у матери возникают глубокие разрывы промежности.
Задний вид ягодичного предлежания часто самопроизвольно переходит в передний. Если этого не происходит, необходимо оказать соответствующую помощь. Как только обнаруживается, что крестец, подколенная ямка, пятки плода обращены кзади, родившуюся голень плода обхватывают через стерильную пеленку и потягивают книзу, одновременно вращая ее в сторону большого пальца стопы с тем, чтобы туловище плода до появления из половой щели нижних углов лопаток установилось в одном из косых раз-меров со спинкой, обращенной кпереди.
Если предотвратить образование заднего вида не удалось, что является серьезным осложнением операции, то предложенные для таких случаев методы извлечения головки очень редко дают благоприятные результаты. И в большинстве таких случаев дети рождаются мертвыми или умирают от тяжелой родовой травмы. Травму получает и роженица. Поэтому после не очень продолжительных и не очень энергичных попыток освободить головку сердцебиение плода обычно не прослушивается. В такой ситуации следует произвести перфорацию головки.
Тяжелым осложнением при родах в чисто ягодичном предлежании является вколачивание ягодиц, которое может быть вследствие слабости родовых сил, а при крупном плоде как признак клинического несоответствия между тазовым концом плода и тазом матери.
Иногда наблюдается запрокидывание ручек плода за головку различной степени выраженности. Запрокидыванию ручек способствуют несвоевременные попытки к извлечению плода (при недостаточном раскрытии маточного зева, слабости родовых сил, узком тазе и т.д.). Ручки теряют типичное расположение, отходят от грудки вверх к личику. Отходя кверху, ручки располагаются или впереди личика, по бокам головки, или запрокидываются на затылок (I, П, III степени).
Нередко при тазовых предлежаниях плода возникает необходимость досрочного родовозбуждения (иммуноконфликт, ОПГ-гестоз, хроническая гипоксия плода и др.), как при наличии плодного пузыря, так и при его отсутствии. Для родовозбуждения используют капельное внутривенное введение окситоцина, простагландина или их сочетание. При отсутствии готовности родовых путей к родам, особенно при преждевременном излитии околоплодных вод, недоношенной беременности производят кесарево сечение.
Во время кесарева сечения у женщин с тазовым предлежанием плода ребенка необходимо извлекать за ножку или паховые сгибы.
Для оказания новорожденному первой помощи в родильном зале необходимо присутствие неонатолога. При осмотре ребенка не только оценивается его состояние по шкале Апгар на 1-й и 5-й минутах жизни, определяется КОС пуповинной крови, но и обращается внимание на выявление признаков внутричерепной травмы, нарушения мозгового кровообращения. Довольно часто (до 20-22 %) у новорожденных, рожденных в тазовом предлежании, выявляется дисплазия тазобедренных суставов, требующая корригирующей терапии с первых дней жизни. Детей, рожденных в тазовом предлежании, следует относить к группе высокого риска.
Течение и ведение третьего периода родов не отличается от такового при головном предлежании.
Послеродовой период у большинства родильниц протекает нормально. Однако послеродовые заболевания наблюдаются чаще, чем при головных предлежаниях. Это связано с более частым повреждением мягких родовых путей, что обусловлено более частым применением пособий и хирургических вмешательств в связи с возникновением осложнений.
Прогноз для плода менее благоприятен, чем при головных предлежаниях в плане ближайших и отдаленных последствий.?
Глава 8. Многоплодная беременность
Многоплодной называется беременность двумя или большим количеством плодов. При беременности двумя плодами говорят о двойне, тремя – о тройне и т.д. Дети, родившиеся от многоплодной беременности, называются близнецами.Многоплодная беременность встречается в 0,7-1,5 % случаев, в настоящее время наблюдается тенденция к увеличению частоты ее наступления в связи с гиперстимуляцией овуляции у женщин, страдающих бесплодием, при экстракорпоральном оплодотворении. При этом происходит одновременное созревание нескольких фолликулов – 3-4 и более и соответственно при оплодотворении нескольких яйцеклеток может возникать многоплодная беременность. Тройни рождаются в 1 % случаев многоплодных родов.
Перинатальная смертность при многоплодной беременности в 3-4 раза выше, чем при одноплодной. Перинатальные потери находятся в прямой зависимости от массы тела детей, составляя в среднем 10 %. Перинатальная смертность среди монозиготных детей в 2,5 раза выше, чем среди дизиготных двоен, и особенно высока при моноамниотических двойнях – редком варианте монозиготной двойни, когда оба плода находятся в одной амниотической полости. В связи с этим многоплодную беременность и роды относят к состоянию, пограничному между нормой и патологией.
Этиология и патогенез.
В развитии многоплодной беременности определенное значение имеет наследственность. Многоплодная беременность чаще встречается в семьях, где мать или отец, или оба супруга произошли из двойни или большего числа плодов. При этом большее значение имеет генотип матери.
В литературе приведены многочисленные доказательства значимости наследственного фактора. Имеется описание случая, когда за 33 года замужества роженица родила 44 ребенка: 13 двоен, 6 троен. У другой семейной пары (женщина из четверни, а муж из двойни) наблюдалось рождение 3 двоен, 6 троен и 2 четверни.
В возникновении многоплодной беременности большую роль играет повышение уровня фолликулостимулирующего гормона, который способствует созреванию нескольких яйцеклеток. Двойни наиболее часто являются результатом оплодотворения двух отдельных яйцеклеток (рис. 8.1). Это двуяйцевые или дизитотные двойни. Среди всех видов двоен дизиготные наблюдаются в 70 %. Созревание двух и более яйцеклеток может происходить как в одном яичнике (ovulatio uniovariales), так и в двух (ovulatio biovariales). Дизиготные близнецы могут быть как одно-, так и разнополыми, и находиться в той же генетической лвисимости, что и родные братья и сестры.
Одна треть двоен развивается из единственно оплодотворенной яйцеклетки, которая впоследствии делится на две сходные структуры, каждая с возможностью развиваться в отдельную индивидуальность (однояйцевые, монозиготные двойни).
Однояйцевые близнецы всегда однополые, имеют одну группу крови, одинаковый цвет глаз, волос, кожный рельеф кончиков пальцев, форму и расположение зубов.
При большем числе плодов (тройня, четверня и т.д.) близнецы могут быть как монозиготными, так и дизиготными в различных сочетаниях.
Однозначной гипотезы, объясняющей формирование монозиготной двойни, нет. Монозиготные двойни формируются вследствие деления оплодотворенной яйцеклетки в различных ранних стадиях ее развития. 1. При разделении до формирования внутреннего слоя клеток (в стадии морулы) и преобразования наружного слоя клеток бластоциты в элементы хориона, что имеет место в первые 72 ч после оплодотворения, развиваются дваамниотических мешка и два хориона. В результате образуется диамниотическая, дихориальная монозиготная двойня. Могут наблюдаться две морфологически раздельные плаценты или одна плацента, состоящая из двух, слившихся воедино. 2. Если разделение происходит между 4-м и 8-м днем после оплодотворения, по окончании формирования внутреннего слоя клеток и закладки хориона из наружного слоя, но до закладки амниотических клеток, сформируются два эмбриона, каждый в отдельном амниотическом мешке. Два амниотических мешка будут окружены общей хориальной оболочкой, что приведет к развитию диамниотической, монохориальной монозиготной двойни. 3. Если к моменту разделения закладка амниона уже произошла, что имеет место к 8-му дню после оплодотворения, то разделение приведет к формированию двух эмбрионов в общем амниотическом мешке, т.е. моноамниотической, монохориальной монозиготной двойне. 4. При разделении яйцеклетки в более поздние сроки (после формирования эмбрионального диска) разделение будет неполным, что приведет к развитию сросшихся близнецов.
 Рис. 8.1. Зрелый фолликул с двумя яйцеклетками.
Рис. 8.1. Зрелый фолликул с двумя яйцеклетками.
При многоплодной беременности каждая оплодотворенная яйцеклетка, внедряясь в отпадающую оболочку, образует свои водную и ворсинчатую оболочки, из которых впоследствии развивается своя плацента. Различие возможно в зависимости от того, как далеко или близко друг от друга внедрились яйцеклетки в отпадающую оболочку (рис. 8.2). Если близко, то края обеих плацент соприкасаются, и это создает впечатление единого образования. В действительности такое слияние плацент кажущееся, поскольку каждая плацента имеет свою сосудистую сеть, каждый плодный?мешок имеет свою водную и ворсинчатую оболочки. Перегородка между двумя плодными мешками состоит из четырех оболочек: двух водных и двух ворсинчатых, а отпадающая оболочка общая (двухориальные близнецы). Если же оплодотворенные яйцеклетки внедрились на значительном расстоянии, то плаценты развиваются отдельными образованиями, а каждое яйцо имеет свою отдельную отпадающую оболочку. При двуяйцевой двойне близнецы могут быть как однополыми, так и разнополыми, группа крови как одинаковой, так и различной.
 Рис. 8.2. Схематическое изображение плодных оболочек и плаценты при двойне, а – две плаценты, два амниона, два хориона; б – одна плацента, два амниона, два хориона (варианты, представленные на а и б, могут быть как при одно-, так и при двуяйцевой двойне); в – одна плацента, два амниона, один хорион (однояйцевая двойня).
Рис. 8.2. Схематическое изображение плодных оболочек и плаценты при двойне, а – две плаценты, два амниона, два хориона; б – одна плацента, два амниона, два хориона (варианты, представленные на а и б, могут быть как при одно-, так и при двуяйцевой двойне); в – одна плацента, два амниона, один хорион (однояйцевая двойня).
Однояйцевая двойня возникает в тех случаях, когда при полном разделении яйца оба зачатка располагаются на расстоянии друг от друга. Каждый из развивающихся зародышей имеет отдельный амнион и, таким образом, они оказываются обособленными или биамниотическими двойнями. Если оба амниотических мешка имеют общий хорион, а перегородка для них состоит из двух амнионов, в этом случае двойни называют монохориальными, они имеют общую плаценту. Иногда зачатки располагаются так близко, что образуется общая для обоих зародышей амниотическая полость – развивается моноамниотическая двойня. Простым способом определить принадлежности родившихся близнецов к однояйцевой или двуяйцевой двойне является осмотр последа – при однояйцевой двойне перегородка между амниональными полостями состоит из двух оболочек – двух амнионов, а при двуяйцевой – из 4 оболочек: двух амнионов и двух хорионов (рис. 8.3).
В монохориальных плацентах часто можно обнаружить сосудистый анастомоз – либо артерии с артерией, либо артерии с веной. Наиболее неблагоприятное сосудистое соединение артерии с веной. Артериовенозное соединение осуществляется через капиллярную систему плаценты. Вследствие такого анастомоза кровь оттекает от артерии к вене от одного плода к Другому, т.е. в плацентарных сосудах происходит смещение крови обоих близнецов. В бихориальных плацентах артериовенозный анастомоз развивайся значительно реже. Последствия артериовенозного анастомоза могут быть весьма серьезными. Если в сосудистой системе плаценты кровяное Давление симметрично, оба близнеца развиваются в одинаковых условиях питания и развития. Однако при однояйцевых двойнях это равновесие Может быть нарушено вследствие асимметричного плацентарного кровообращения, и тогда один из близнецов получает больше крови, чем другой. Последний не получает достаточного питания и оказывается в худших условиях для своего развития. При резком нарушении равновесия в системе плацентарного кровообращения один из близнецов принимает на себя осуществление собственного кровообращения и кровообращения близнеца, Сердце последнего становится бездеятельным, а близнец превращается в "бессердечного" урода (acardiakus). В других же случаях при этих же условиях один из близнецов постепенно истощается, умирает и мумифицирует-, ся, превращается в бумажный плод (fetus papyraceus), который рождается после живого в виде придатка к нему.
 Рис. 8.3. Послед при двуяйцевой двойне: четыре оболочки – два амниона и два хориона, составляющие перегородку между амниотическими полостями.
Рис. 8.3. Послед при двуяйцевой двойне: четыре оболочки – два амниона и два хориона, составляющие перегородку между амниотическими полостями.
Смерть одного из плодов может быть причиной нарушения коагуляционных свойств крови, приводить к диссеминированному внутрисосудистому свертыванию, гипофибриногенемии. Кроме того, формирование артериовенозного анастомоза создает условия для развития хронической внутриутробной недостаточности питания и анемии одного из плодов (концентрация гемоглобина может быть 80 г/л и меньше). Если у близнеца с недостаточным: питанием отмечается пониженное АД и общее недоразвитие, то у плода с-' повышенным питанием – артериальная гипертония, гипертрофия сердца,гидрамнион, гиперволемия и полицитемия. Неонатальный период у такого плода может быть осложнен опасной перегрузкой сердца и сердечной недостаточностью. Полицитемия может осложнить течение неонатального периода тяжелой гипербилирубинемией и желтухой.
При многоплодной беременности пороки развития плода в 2 раза превышают их частоту у женщин с одноплодной беременностью и наиболее; характерны для монозиготных плодов.
Врожденные дефекты при многоплодной беременности могут быть классифицированы на: 1. встречающиеся только при многоплодной беременности (сросшиеся близнецы, последствия обратной артериальной перфузии у двоен); 2. чаще встречающиеся у близнецов (гидроцефалия, пороки сердца, единственная артерия пуповины и дефекты нервной системы, стойкие деформации стопы, асимметрия черепа, врожденные вывихи бедра).
 Рис. 8.4. Типы сросшихся близнецов.
а-в – краниопаги; г-ж – торакопаги; з, и – пигопаги.
Рис. 8.4. Типы сросшихся близнецов.
а-в – краниопаги; г-ж – торакопаги; з, и – пигопаги.
К наиболее частым типам срастания относятся торакопаги (сращение в области грудной клетки), омфалопаги (сращение в области пупка и хрящом мечевидного отростка), краниопаги (сращение гомологичными частями чеРепа), пигопаги и ишиопаги (соединение боковых и нижних отделов копчика и крестца), а также неполное расхождение: раздвоение только в одной части или области тела (рис. 8.4). Настороженность в отношении этой патологии повышается при идентификации моноамниотических близнецов. В 31 % случаев сросшиеся близнецы рождаются мертвыми и в 34 % умирают в 1-й день жизни. Выживание детей зависит от типа сращения и сочетанных аномалий.
При двойнях масса детей при рождении менее 2500 г наблюдается в 40-60 %. Задержка роста плодов после II триместра по сравнению с единичными плодами также регистрируется значительно чаще. Разница в массе тела между обоими близнецами при двойнях обычно невелика и составляет 200-300 г. В некоторых случаях вследствие различия в условиях питания и развития разница может достичь 1000 г и более (диссоциированный тип развития плодов).
Для объяснения причин диссоциированного развития плода издавна обращает на себя внимание выдвинутая гипотеза сверхзачатия и сверхоплодотворения, которая определенно не была доказана у женщин, но доказана у некоторых животных, в частности у лошадей. При сверхзачатии между оплодотворениями имеется значительный интервал времени, и разница в массе объясняется тем, что оплодотворение двух яйцеклеток происходит в разные овуляционные периоды. Описан случай сверхзачатия у женщины с раздвоением матки, при этом в каждой из маток развивалась беременность: в одной – 12-недельная, а в другой – 4-недельная. Возможность оплодотворения двух яйцеклеток в различные овуляционные периоды не может быть исключена, поскольку иногда при наступлении беременности происходит очередная овуляция. В первые недели беременности сперматозоид может проникнуть в полость матки, а оттуда в трубы и оплодотворить яйцеклетку, освободившуюся при последней овуляции. Оплодотворенная яйцеклетка может имплантироваться в отпадающую оболочку, поскольку в первые недели беременности полость матки еще не полностью выполнена плодным яйцом. Интересен также вопрос о возможности возникновения многоплодной беременности из яйцеклеток одного и того же овуляционного периода, но оплодотворение при двух половых сношениях. Такое супероплодотворение теоретически возможно, так как во время овуляции в некоторых случаях могут выделяться две зрелые яйцеклетки. В литературе описан случай, когда белая женщина после половых связей с белым и черным мужчиной в течение короткого периода родила двойню, при этом один ребенок был белый, а другой – мулат.
Клиническая картина и диагностика
Течение многоплодной беременности с разными группами крови по сравнению с одноплодной отличается рядом неблагоприятных особенностей, поскольку к организму беременной предъявляется больше требований в связи с развитием не одного, а двух плодов и более.Объем циркулирующей крови (ОЦК) при многоплодной беременности возрастает на 50-60 %, тогда как при одноплодной на 40-50 %. Чаше наблюдается анемия вследствие гемодилюции, повышенной потребности в железе и в фолиевой кислоте.
При многоплодной беременности женщины нередко жалуются на повышенную утомляемость, одышку, изжогу, запоры, расстройства мочеиспускания, которые особенно беспокоят пациентку в конце беременности.
Одним из частых осложнений являются самопроизвольный аборт, преж-девременные роды. Продолжительность беременности прямо зависит от числа плодов. Преждевременные роды при многоплодии отмечаются в 25- 50 % случаев в зависимости от числа плодов. Средняя продолжительность беременности для двоен составляет 260 дней (37 нед), а для троен – 247 дней (35 нед). При многоплодной беременности более часто наблюдаются и более тяжело протекают ранние токсикозы и гестозы. Матка при многоплодной беременности достигает больших размеров не только за счет большого количества плодов, но и за счет часто наблюдающегося многоводия. Острое многоводие (гидрамнион) наиболее часто развивается у одного из однояйцевых близнецов. Многоплодная беременность, особенно сочетающаяся с многоводием, может явиться причиной нарушения функции почек.
До внедрения УЗИ в клиническую практику диагностика многоплодной беременности была не всегда простой, нередко диагноз ее устанавливался в поздние сроки беременности и даже во время родов. Заподозрить многоплодную беременность можно не только при обследовании пациентки, но и на основании правильно собранного анамнеза, из которого можно установить, что беременная или ее муж, ее ближайшие родственники (сестры, братья, родители) являются одними из двоен. Указанием на возможное развитие многоплодной беременности может быть информация о том, что женщина подверглась стимуляции овуляции или экстракорпоральному оплодотворению. Указанием на возможность многоплодной беременности в I триместре беременности может быть несоответствие размеров матки сроку беременности – рост матки как бы опережает срок беременности, но этот признак весьма относителен, так как такая картина может наблюдаться и при других состояниях, например при пузырном заносе, миоме матки.
В поздние сроки беременности определенное значение для постановки диагноза многоплодной беременности имеют данные наружного акушерского исследования: окружность живота, высота стояния дна матки, которые оказываются большими, чем должны быть при данном сроке беременности. Иногда удается пальпировать большое количество мелких частей плода и две или более крупные баллотирующие части (головки и тазовые концы). Аускультативными признаками является обнаружение в разных отделах матки двух фокусов отчетливого выслушивания сердечных тонов плодов, особенно если между ними имеется так называемая зона молчания (рис. 8.5). О двойне свидетельствует и наличие различной частоты сердечных тонов плодов (различие не менее 10 ударов в минуту). Сердечная деятельность обоих плодов может регистрироваться одновременно при использовании специальных кардио мониторов.
Из других признаков многоплодной беременности заслуживает внимания наличие углубления в середине дна матки, которое образуется вследствие выпячивания углов матки крупными частями двух близнецов.
Биохимические тесты имеют определенное значение в постановке диагноза многоплодной беременности, при которой уровень хорионического гонадотропина и плацентарного лактогена выше, чем при одноплодной беременности. Повышен уровень а-фетопротеина.
Основой диагноза многоплодной беременности является ультразвуковое исследование (рис. 8.6). Точность диагностики составляет 99,3 %, начиная с самых ранних сроков беременности. Ультразвуковая диагностика многоплодной беременности в ранние сроки основана на визуализации в полости Матки нескольких плодных яиц или эмбрионов и возможна с 5-6-й недели беременности.
Помимо раннего выявления многоплодной беременности, эхография во II и Ш триместрах позволяет установить характер развития, положение, предлежание плодов, локализацию, структуру, число плацент и амниотических полостей, объем околоплодных вод, наличие врожденных пороков развития и антенатальной гибели плодов. Во второй половине беременности ультразвуковая диагностика двойни основывается на визуализации одновременно двух поперечных сечений головки или туловища плодов.
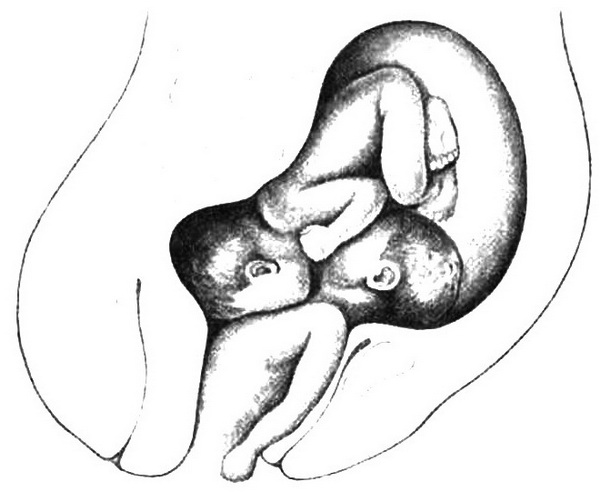 Рис. 8.5. Два фокуса выслушивания сердцебиений у плодов при двойне.
Рис. 8.5. Два фокуса выслушивания сердцебиений у плодов при двойне.
По данным ультразвуковой биометрии установлено 5 типов развития плодов близнецов: 1. физиологическое развитие обоих плодов; 2. гипотрофия при диссоциированном развитии обоих плодов; 3. диссоциированное (неравномерное) развитие плодов при различии более 10 % от массы тела большего плода; 4. врожденная патология развития плодов; 5. антенатальная гибель одного из плодов.
 Рис.8.6. Многоплодная беременность (эхограммы).
а, б – двойня; в – тройня.
Рис.8.6. Многоплодная беременность (эхограммы).
а, б – двойня; в – тройня.
Одним из важных моментов при ультразвуковом исследовании плодов при многоплодной беременности является определение их положения и предлежания перед родами. Определение положения плодов должно основываться на данных визуализации головок и ориентации продольных осей туловища. Положение плодов в матке бывает различным: оба плода в продольном положении и головном предлежании (рис. 8.7, а); оба плода в газовом предлежании; один в головном предлежании, один в тазовом (рис. 8.7, б), один в поперечном предлежании; оба в поперечном предлежании (рис. 8.7, в) и др. Чаще встречаются продольные положения ( 88 %). В 45 % оба плода предлежат головой. Далее следуют такие варианты – один плод в головном предлежани, другой в тазовом (6 %); один в продольном, другой в поперечном положении (5,5 %); оба плода в поперечном положении (0,5 %).
 Рис. 8.7. Положение плодов в матке при двойне.
а _ головное предлежание обоих плодов; б – головное предлежание одного плода и тазовое – второго; в – поперечное положение обоих плодов.
Рис. 8.7. Положение плодов в матке при двойне.
а _ головное предлежание обоих плодов; б – головное предлежание одного плода и тазовое – второго; в – поперечное положение обоих плодов.
В процессе ультразвукового исследования при многоплодной беременности пристальное внимание должно быть уделено поиску врожденных пороков развития плодов; тщательная визуализация должна проводиться как внутренних, так и наружных контуров плодов для исключения сросшихся близнецов.
К диагностическим критериям сросшихся близнецов следует отнести невозможность раздельной визуализации головки и туловища плодов и наличие их фиксированного положения на протяжении нескольких ультразвуковых исследований. Ультразвуковая диагностика сросшихся близнецов возможна уже с конца I триместра беременности.
Другой патологией развития, наблюдаемой только при многоплодной беременности, является фетофетальный трансфузионный синдром, обусловленный наличием анастомозов между плодовыми сосудами в монохориальной плаценте, ввиду чего один плод становится донором, у него наблюдаются анемия, задержка развития и маловодие, а второй – реципиентом. Нередко у близнеца-реципиента развиваются многоводие и водянка, которые обусловлены сердечной недостаточностью и могут проявляться при ультразвуковом исследовании наличием общего отека, асцита, перикардиального или плеврального выпота.
Ведущим критерием в антенатальной ультразвуковой диагностике синдрома акардии-ацефалии является обнаружение признаков недоразвития одного из плодов и отсутствие у него сердца. Часто у плода-реципиента обнаруживают признаки водянки. Различают несколько видов данного синдрома: acardius anceps (один из плодов резко недоразвит, но можно различить отдельные части тела), acardius acephalus (отсутствие головы, верхней части туловища с органами грудной клетки, верхних конечностей), acardius acornus (наличие рудиментарноподобной головки, отсутствие туловища) и acardius amorphus (плод представляет собой аморфную массу, в которой неразличимы части тела).
Ведение беременности
При многоплодии необходимо учитывать возможные осложнения, повышенную потребность в полноценном сбалансированном питании. Питание беременной должно быть достаточно калорийным. Учитывая высокую частоту анемии при многоплодной беременности, дополнительно необходимо назначать железо от 60 до 100 мг, фолиевую кислоту 1 мг в день.Серьезным осложнением многоплодной беременности является невынашивание. Само наличие многоплодия является фактором угрозы невынашивания и диктует необходимость осуществления лечебно-профилактических мероприятий с момента диагностики многоплодной беременности. В последние годы в практике в полости матки более 3-4 плодных яиц нашел применение метод редукции плодных яиц: производится аспирация одного или более плодных яиц из матки.
Профилактика преждевременных родов осуществляется прежде всего ограничением активного образа жизни и назначением постельного режима, при котором усиливается маточная перфузия, способствующая росту плода. После 20 нед рекомендуют в дневное время трижды по 1-2 ч находиться в постели. Расширяются показания к выдаче больничного листа. Хорошие результаты при угрозе преждевременных родов оказывает применение В-адреномиметических средств (токолитики). При назначении токолитиков следует тщательно следить за общим состоянием (отек легкого!), проводить исследование крови матери, определяя электролиты и толерантность к глюкозе.
Для прогнозирования исхода многоплодной беременности большое значение имеет определение состояния плодов (кардиомониторный контроль – использование нестрессового теста). При наличии отрицательного нестрессового теста прогноз для плода неблагоприятный. После 30-32 нед нестрессовый тест и определение биофизического профиля должны проводиться еженедельно. Если возможно, то целесообразно проводить исследование кровотока у каждого плода в отдельности.
Некоторые формы нарушения развития плода обнаруживаются при ис-следовании амниотической жидкости. Непременным условием является взятие пробы околоплодных вод из каждого плодного мешка, что делается под контролем УЗИ. Эти исследования проводятся также при подозрении на генетически обусловленные аномалии развития, гемолитическую болезнь плода и для определения зрелости легких плода по соотношению уровня лецитина-сфигмомиелина, который отражает выработку сурфактанта.
Пациентки с двойней требуют особого внимания на протяжении беременности. Следует особое внимание обращать на функцию сердечно-сосудистой системы, почек, выявление ранних симптомов гестоза. Очень важно определить в III триместре показатели свертывающей системы крови, число и агрегационные свойства эритроцитов, содержание глюкозы в крови. При Появлении симптомов гестоза или других осложнений беременности необходима госпитализация в акушерский стационар. При неосложненном течении беременности пациентка должна быть направлена в родильный дом за 2-3 нед до родов, а при наличии тройни – за 4 нед.
При обнаружении выраженного отставания в развитии одного из плодов, являющегося донором, при наличии сосудистого анастомоза можно произвести перевязку его пуповины (антенатально), что предотвращает гиперволемию, полицитемию второго плода, а также улучшает его состояние. Проведение этой манипуляции дает возможность пролонгировать беременность жизнеспособного плода. Перевязка сосудов пуповины производится под контролем УЗИ или при фетоскопии.
Даже при отсутствии осложнений со стороны плодов в 37 нед целесообразно индуцировать роды. В некоторых случаях в плановом порядке производится кесарево сечение при сроке в 37-38 нед. Показаниями к кесареву сечению являются: экстрагенитальные заболевания и тяжелое течение гестоза, при которых противопоказаны (опасны) самопроизвольные роды; чрезмерное перерастяжение матки (крупные плоды); неподготовленность родовых путей после 38 нед беременности; поперечное положение первого плода из двойни или обеих плодов; тазовое предлежание первого плода у первородящих; гипоксия плодов (плода).
Течение родов
Течение родов может быть нормальным, но часто сопровождается значительными осложнениями. Вследствие перерастяжения матки роды часто бывают продолжительными, поскольку затягивается период раскрытия шейки матки из-за слабости родовых сил. Нередко затяжным бывает й период изгнания первого плода. Иногда предлежащая часть второго плода стремится одновременно вставиться в таз, и нужна продолжительная родовая деятельность, чтобы в конце концов во входе в таз установилась одна головка.В процессе родов у каждой 3-й роженицы наблюдается несвоевременное излитие околоплодных вод (преждевременное или раннее). При этом из-за небольшого размера плода и отсутствия пояса прилегания возможно выпадение петель пуповины, мелких частей (ручки, ножки).
Второй период родов при многоплодной беременности ведет акушер-гинеколог с обязательным присутствием неонатолога. Должны быть подготовлены средства интенсивной терапии новорожденных. При недоношенной многоплодной беременности период изгнания ведется без защити промежности. В целях профилактики травмирования продвигающейся головки первого плода проводятся пудендальная анестезия и рассечение промежности. В случае тазового предлежания первого плода ручное пособие следует оказывать очень осторожно.
При ягодичном предлежании первого плода могут возникнуть серьезные проблемы, если плод больших размеров, и затрудняется рождение последующей головки. То же самое может быть при малых размерах плода, когда он рождается через не полностью раскрытую шейку.
Одним из серьезных осложнений периода изгнания является преждевременная отслойка плаценты как родившегося, так и неродившегося плода. Причиной этого является быстрое уменьшение объема матки и понижение внутриматочного давления после рождения первого плода. Подобное явление может быть причиной опасного для жизни женщины кровотечения и представляет угрозу жизни второго плода. Предотвратить отслойку плаценты при наличии второго плода в матке можно путем вскрытия плодного пузыря.
 Рис. 8.8. Коллизия плодов при двойне.
Рис. 8.8. Коллизия плодов при двойне.
При поперечном положении второго плода при хорошей родовой деятельности иногда возможен самоизворот – переход в продольное положение.
Очень редким, но тяжелым осложнением является сцепление плодов – коллизия, когда головка одного плода цепляется за таковую второго и во вход малого таза вступают одновременно крупные части обоих плодов (рис. 8.8).
При многоплодной беременности повышается мертворождаемость чаще за счет гибели одного из плодов, что определяется возможной незрелостью его, а также осложнениями в течение родов.
В последовом и раннем послеродовом периодах нередко возникает ги-потоническое кровотечение из-за перерастянутости матки.
В послеродовом периоде возможна субинволюция матки, часто развивается эндометрит.
Ведение родов
едение родов при многоплодной беременности имеет свои особенности. время родов нужно быть готовым к необходимости усилить родовую Деятельность, произвести адекватное обезболивание и осуществить тщательный контроль за сердечной деятельностью обоих плодов (кардиомониторное наблюдение), тщательное наблюдение за состоянием женщины. При выявАнни слабости родовых сил показано внутривенное введение окситоцина ВД в 500 мл 5 % раствора глюкозы капельно. Для обезболивания родов можно производить эпидуральную анестезию. Наилучшее положение роженицы – на боку (во избежание сдавливания нижней полой вены).При слабости родовой деятельности в периоде изгнания первого плода или гипоксии производят акушерские операции, направленные на извлечение его: акушерские щипцы при головном предлежании и извлечение плода за тазовый конец при тазовом предлежании.
После рождения первого плода тщательно перевязывают не только плодовый, но и материнский конец пуповины, так как при монохориальной двойне второй плод может погибнуть от кровотечения через неперевязанную пуповину первого плода.
После рождения первого плода путем наружного акушерского исследования определяют положение второго плода, далее следует произвести влагалищное исследование, выяснить акушерскую ситуацию. Тщательно ftслушивается сердцебиение второго плода. Если в течение ближайших 10-15 мин второй плод не родился, вскрывают его плодный пузырь, ftпуская медленно воды, и при продольном положении плода предоставляют роды естественному течению. При поперечном положении второго плода, при неправильном вставлении головки дают обший наркоз и производят комбинированный поворот плода на ножку с последующим его извлечением. Если что-то угрожает здоровью второго плода (крупный плод при тазовом предлежании или поперечном положении, спазм шейки матки) при его рождении через естественные родовые пути, производят кесарево сечение. Не исключена возможность производства акушерских операций для извле• чения второго плода при нахождении его в полости малого таза и слабости родовых сил. Применяются акушерские щипцы или производят извлечение , плода за тазовый конец.
Вопрос о кесаревом сечении может встать при многоплодной беременности и в процессе родов: стойкая слабость родовых сил, выпадение мелких j частей и петель пуповины при головном предлежании, симптомы острой; гипоксии одного из плодов и др.
При беременности тремя плодами и более предпочтительным является' родоразрешение путем кесарева сечения. Путем кесарева сечения проводится родоразрешение и при сращении близнецов. При значительном недонашивании беременности, когда сомнительна жизнеспособность плодов, или же осложнения со стороны матери делают кесарево сечение для нее опасным, роды должны вестись через естественные родовые пути.
Последовый период требует особого внимания. В конце второго периода родов внутривенно вводится метилэргометрин (1 мл), а в послеродовом периоде – окситоцин (5 ЕД) и 5 % раствор глюкозы – 400 мл в течение 2 ч. Необходимо следить за состоянием роженицы и количеством теряемой крови.
При отсутствии признаков отделения последа производят ручное его: удаление и массаж матки на кулаке, введение сокращающих матку средств.: Послеродовой период протекает так же, как и после рождения одним плодом, но частота осложнений у женщин с многоплодной беременностью выше: чаще наблюдаются позднее послеродовое кровотечение, субинволюция матки, эндометрит. Поэтому необходимо тщательно следить за сокращением послеродовой матки, своевременно назначать сокращающие средства.?
Глава 9. Невынашивание беременности
Невынашивание беременности – самопроизвольное прерывание беременности в сроки от зачатия до 37 нед, считая с первого дня последней менструации. Прерывание беременности в сроки от зачатия до 22 нед называют самопроизвольным аборгом (выкидышем), а в сроки 28-37 нед – преждевременными родами. Прерывание ее в сроки от 22 до 28 нед, согласно номенклатуре ВОЗ, относят к очень ранним преждевременным родам, и в большинстве развитых стран с этого срока гестации исчисляют перинатальную смертность. В нашей стране прерывание беременности при сроке 22-28 нед относят к преждевременным родам, если новорожденный прожил 7 дней после рождения. Если его гибель произошла ранее 7 дней после рождения, то это считается поздним выкидышем. При этом гибель ребенка к перинатальной смертности не относят. Беременным в указанные сроки гестации оказывают помощь, как правило, не в гинекологическом отделении, а в родильном доме, где имеется возможность выхаживания глубоко недоношенного новорожденного. Если ребенок прожил 7 дней после рождения и умер, то эту смерть относят к перинатальной; при этом следует проводить патологоанатом и ческое исследование.Самопроизвольный аборт (выкидыш)
Самопроизвольный аборт относят к основным видам акушерской патологии. Самопроизвольные выкидыши происходят в 15-20 % всех желанных беременностей. Полагают, что в статистику не входит большое число очень ранних и субклинически протекающих выкидышей.Многие исследователи считают, что самопроизвольные выкидыши в I триместре служат проявлением естественного отбора. Подтверждением этого является тот факт, что при исследовании абортного материала находят от 60 до 80% эмбрионов с хромосомными аномалиями.
Причины спорадического самопроизвольного аборта чрезвычайно разнообразны и не всегда четко обозначены. К ним относят такие социальные факторы, как вредные привычки, вредные производственные факторы, неустроенность семейной жизни, тяжелый физический труд, стрессовые ситуации и др., а также медицинские факторы: генетические поломки кариотипа родителей, эндокринные нарушения, пороки развития матки, инфекционнные заболевания, предшествующие аборты и др.
Для самопроизвольного прерывания беременности характерно появление сокращений матки, приводящих к отслойке плодного яйца и изгнанию его из полости матки.
Ведение пациенток при самопроизвольном выкидыше определяется стадией прерывания беременности. В зависимости от клинического течения?
различают угрожающий аборт, начавшийся аборт, аборт в ходу, неполный аборт, несостоявшийся аборт, инфицированный аборт и привычный аборт.
Угрожающий аборт
Угрожающий аборт – повышение сократительной активности матки. В этой стадии прерывания беременности плодное яйцо сохраняет связь со стенкой матки.
Клинически угрожающий аборт проявляется ощущением тяжести или несильными тянущими болями внизу живота и в области крестца. При позднем аборте могут отмечаться схваткообразные боли. Кровяные выделения отсутствуют. Шейка матки не укорочена, внутренний зев закрыт, тонус матки повышен. Величина матки соответствует сроку беременности.
Начавшийся аборт
При начавшемся аборте на фоне усилившихся сокращений матки происходит частичная отслойка плодного яйца от ее стенки. При этом усиливаются боли, нередко приобретающие схваткообразный характер, и появляются кровяные выделения из влагалища. Плодное яйцо отслаивается на небольшом участке, поэтому величина матки соответствует сроку беременности. Шейка матки сохранена, канат ее закрыт или слегка приоткрыт. При истмико-цервикачьной недостаточности канал шейки матки может быть несколько расширен, болевые ощущения менее выражены или отсутствуют. Возможно подтекание околоплодных вод.
Угрожающий и начавшийся аборт необходимо дифференцировать от следующих состояний. 1. Злокачественные или доброкачественные заболевания шейки матки и влагалища исключают при проведении осторожного осмотра в зеркалах, при необходимости выполняют кольпоскопию или биопсию. 2. Кровяные выделения при ановуляторном цикле нередко наблюдаются после задержки менструации. При этом отсутствуют симптомы беременности. Тест на р-ХГ отрицательный. При бимануальном исследовании матка нормальных размеров, не размягчена, шейка плотная кецианотичная. В анамнезе могут быть аналогичные нарушения менструального цикла. 3. При пузырном заносе могут наблюдаться характерные выделения в виде пузырьков. У 50 % пациенток величина матки больше, чем должна быть при предполагаемом сроке гестации. При УЗИ выявляют характерную картину, сердцебиение плода отсутствует. 4. При внематочной беременности пациентки могут жаловаться на кровяные выделения и боли в животе; при этом нередко возникают обморочные состояния (гиповолемия), чувство давления на прямую кишку или мочевой пузырь. Тест на р-ХГ положительный. При бимануальном исследовании отмечается болезненность при потягивании за шейку матки, размер матки меньше, чем должен быть при предполагаемом сроке беременности, может пальпироваться утолщенная труба, нередко отмечается выбухание сводов. Согласно результатам УЗИ, в матке отсутствует плодное яйцо, которое иногда определяется в трубе.
Для уточнения диагноза и контроля за течением беременности, кроме результатов обще клинических исследований, целесообразно использовать данные, полученные при измерении ректальной температуры (температура выше 37 °С без перепадов – благоприятный признак), определение уровня р-ХГ и ТБГ (трофобластический гликопротеин), УЗИ.
Лечение. Лечение угрожающего выкидыша должно быть комплексным: постельный режим, седативные средства, спазмолитики. Могут быть использованы немедикаментозные и физиотерапевтические методы лечения: иглоукалывание, электроаналгезия, противоболевая чрескожная стимуляция, эндоназальная гальванизация и др. При позднем угрожающем выкидыше (после 20 нед) используют В-миметики, индометацин.
При начавшемся аборте лечение в основном такое же, как и при угрожающем. Назначают этамзилат (дицинон), аскорутин. При гормональной дисфункции проводят соответствующую коррекцию. При гиперандрогении надпочечникового генеза используют кортикостсроиды под контролем значений 17-КС в суточной моче. В случае недостаточности желтого тела в I триместре назначают гестагены, у беременных с гипоэстрогенией возможно применение эстрогенов. При подтекании околоплодных вод беременность сохранять нецелесообразно.
Аборт в ходу, неполный и полный аборт
Аборт в ходу характеризуется тем, что плодное яйцо полностью отслаивается от стенки матки и опускается в ее нижние отделы, в том числе в шеечный канал.
Клинически отмечаются схваткообразные боли внизу живота и выраженное кровотечение. Плодное яйцо находится в канале шейки матки, нижний полюс его может выступать во влагалище. Аборт в ходу может завершиться неполным или полным абортом.
При неполном аборте после изгнания плодного яйца в полости матки находятся его остатки. В матке обычно задерживаются плодные оболочки, плацента или ее части.
Когда плодное яйцо изгоняется из полости матки, наблюдаются схваткообразные боли внизу живота и кровотечение разной интенсивности. Канал шейки матки свободно пропускает палец. Матка мягковатой консистенции. Величина ее меньше, чем должна быть при предполагаемом сроке беременности.
В связи с тем что неполный аборт нередко сопровождается обильным кровотечением, необходимо оказать беременной неотложную помощь. При поступлении в стационар производят анализ крови, определяют группу крови и резус-принадлежность, ВИЧ, выполняют реакцию Вассермана. Абортцангом удаляют остатки плодного яйца, производят вакуум-аспирацию Или кюретаж. Одновременно стабилизируют состояние больной, начав внутривенное вливание кровезаменителей. Целесообразно внутривенное введение окситоцина с изотоническим раствором хлорида натрия (30 ЕД окситоцина на 1000 мл раствора) со скоростью 200 мл/ч (в ранние сроки временности матка менее чувствительна к окситоцину).
В связи с тем что окситоцин может оказывать антидиуретическое Действие, после опорожнения матки необходимо прекратить его введение в больших дозах. После удаления остатков плодного яйца назначают антибактериальную терапию, при необходимости проводят лечение постгеморрагической анемии. Пациенткам с резус-отрицательной кровью необходимо ввести иммуноглобулин антирезус.
Полный аборт чаще наблюдается в поздние сроки беременности, когда плодное яйцо выходит из полости матки. Матка полностью сокращается кровотечение прекращается. При бимануальном исследовании матка хорошо контурируется, размер ее не соответствует сроку гестации, цервикальный канал может быть закрыт.
При полном аборте, произошедшем в сроки гестации до 14-16 нед, показано инструментальное контрольное выскабливание матки, так как велика вероятность того, что в ее полости остались части плодного яйца. В более поздние сроки при хорошо сократившейся матке выскабливание не производят, целесообразно назначить антибиотики, провести лечение анемии и ввести иммуноглобулин антирезус пациенткам с резус-отрицательной кровью.
Несостоявшийся выкидыш (неразвивающаяся беременность)
При неразвивающейся беременности происходит гибель эмбриона плода, но признаки угрозы прерывания беременности отсутствуют. Чаще этот тип прерывания беременности наблюдается при привычном (missed abortion) невынашивании и после вирусных инфекций. Клинически размер матки меньше, чем должен быть к данному сроку гестации, сердцебиение плода не определяется, уменьшается выраженность субъективных признаков беременности, иногда периодически могут появляться мажущие кровяные выделения из влагалища.
Погибшее плодное яйцо может находиться в матке в течение длительного времени, иногда больше месяца, подвергаясь некрозу и мацерации, на ранних стадиях иногда наблюдается его аутолиз. В некоторых случаях происходит мумификация и петрификация зародыша или плода. В связи с нарушением нейрогуморальной регуляции половой системы сокращения матки могут отсутствовать. Диагноз подтверждается при УЗИ.
При длительной задержке плодного яйца в полости матки (4 нед и более) возможны коагулопатические осложнения.
При ведении таких пациенток необходимо провести исследование системы гемостаза, определить группу крови и резус-принадлежность, а также иметь все необходимое для остановки коагулопатического кровотечения. При сроке беременности до 14 нед возможно одномоментное удаление плодного яйца (предпочтение должно быть отдано вакуум-аспирации). Для удаления погибшего плода во II триместре беременности могут быть использованы специфические методы: внутривенное введение больших доз окситоцина, интраамниальное введение простагландина F2u, интравагинальное введение суппозиториев простагландина Е2. Независимо от выбранного метода прерывания беременности для созревания шейки матки в цервикальный канал целесообразно ввести ламинарию на ночь перед опорожнением матки.
При длительном течении самопроизвольного (начавшегося, неполного) аборта возможно проникновение микрофлоры из влагалища в полость матки с последующим развитием хорионамнионита и эндометрита. Инфицированный (лихорадочный) аборт может стать причиной развития генерализованных септических заболеваний, В зависимости от степени распространения инфекции выделяют неосложненный инфицированный (инфекция локализуется в матке), осложненный инфицированный (инфекция не выходит за пределы малого таза) и септический (процесс принимает генерализованный характер) аборт. Клиническое течение инфицированного аборта определяется в основном степенью распространения инфекции.
Септический аборт
Диагноз септического аборта может быть установлен при наличии симптомов выкидыша и температуре тела выше 38 °С, когда другие причины лихорадки исключены. Септический аборт чаще всего развивается при криминальных вмешательствах, длительном подтекании околоплодных вод, наличии швов на шейке матки, препятствующих ее опорожнению, при наличии спирали в полости матки и пр. В зависимости от степени распространения инфекции симптомы могут быть различными: от болезненности матки с гнойным отделяемым из цервикального канала до тяжелейших проявлений перитонита.
Ведение пациенток определяется тяжестью распространения инфекции. Выделяют 3 стадии распространения инфекции: 1. в процесс вовлечены эндометрий и миометрии 2. помимо матки, в процесс вовлечены придатки 3. генерализованный перитонит и сепсис.
Прогноз зависит от степени выраженности лихорадки, гипотензии, олигурии, наличия инфекции за пределами матки и срока беременности (чем он больше, тем хуже прогноз).
При ведении пациенток необходимы мониторный контроль жизненно важных функций и диуреза. Производят анализ крови с определением числа тромбоцитов, уровня электролитов, белков крови, креатинина, гемостазиограммы. Гематокрит должен быть не менее 30-35 %,
Проводят интенсивное и комплексное лечение, применяют антибиотики широкого спектра действия (антибактериальная, дезинтоксикационная, десенсибилизирующая, иммунокорригирующая терапия),
В зависимости от состояния больной и степени тяжести инфекции производятоперативные вмешательства от кюретажа до экстирпации матки.
В настоящее время установлено, что септический аборт всегда является показанием к хирургическому лечению, так как прежде всего должен быть удален источник инфицирования.
При сроке беременности до 12 нед осторожно расширяют шейку матки (если она не раскрыта) и с помощью кюретки или вакуум-аспиратора Удаляют содержимое матки. Для того чтобы быть уверенным в полном опорожнении матки, операцию целесообразно производить под контролем либо УЗИ, либо гистероскопии. После инструментального удаления плодного яйца или его остатков необходимо промыть матку 1 % раствором Диоксидина под малым давлением. Если не удастся полностью опорожнить Матку или сохраняется клиническая картина сепсиса, то производят чревосечение и экстирпацию матки с маточными трубами.
Все оперативные вмешательства при септическом аборте осуществляет опытньгй врач (опасность перфорации стенки матки при аборте! Необходимость быстрого бережного удаления матки при чревосечении!) с одновременной интенсивной медикаментозной терапией.
При беременности свыше 12 нед. плод из матки удаляют путем введения утеротонических средств (окситоцин, простагландин F 2 a ) . В тяжелых случаях удаляют матку с плодом.
Наиболее тяжелым осложнением септического аборта является септический шок, основными симптомами которого являются олигурия, гипотензия, тахипноэ, нарушение сознания, цианоз кожи конечностей; почечная недостаточность и диссеминированная внутрисосудистая коагулопатия.
Привычный выкидыш
Привычный выкидыш – самопроизвольное прерывание беременности 2 раза подряд и более. В популяции он отмечается в 2 % беременностей. В структуре невынашивания привычный выкидыш составляет – 5- 20 %.Привычное невынашивание
Привычное невынашивание – осложнение беременности, в основе которого лежат нарушения функции репродуктивной системы. Наиболее частыми причинами привычного невынашивания являются эндокринные нарушения репродуктивной системы, стертые формы дисфункции надпочечников, поражение рецепторного аппарата эндометрия, хронический эндометрит с персистенцией условно-патогенных микроорганизмов и(или) вирусов; истмико-цервикальная недостаточность, пороки развития матки, внутриматочные синехии, волчаночный антикоагулянт (ВА) и другие аутоиммунные нарушения. Хромосомная патология для пациенток с привычным невынашиванием менее значима, чем при спорадических абортах, тем не менее при привычном невынашивании структурные аномалии кариотипа встречаются в 10 раз чаще, чем в популяции.При ведении пациенток с привычным невынашиванием необходимо исследование репродуктивной системы супружеской пары вне беременности. Производят гистеросальпингографию на 18-20-й день цикла или гистероскопию для исключения пороков развития матки и внутриматочных синехий; УЗИ матки и придатков для исключения истмико-цервикальной недостаточности, поликистозных яичников; гормональные, бактериологические и вирусологические исследования; гемостазиограмму; определение волчаночного антикоагулянта и других аутоантител; спермограмму супруга. После обследования обоих супругов проводят подготовку к беременности с учетом состояния репродуктивной системы и основного причинного фактора невынашивания беременности. При неполноценной лютеиновой фазе (НЛФ), обусловленной дисфункцией яичников, назначают циклическую гормональную терапию, при необходимости – стимуляцию овуляции клостильбегитом (по 50 мг в течение 5 дней, начиная с 5-го дня цикла). В случае НЛФ, вызванной нарушением рецепторного аппарата эндометрия, проводят иглоукалывание, электрофорез магния с 5-го дня цикла.
При наступлении беременности осуществляют контроль за уровнем XI и ТБГ, проводят УЗИ. Для профилактики осложнений рекомендуется выполнить иммуноцитотерапию лимфоцитами мужа (или донора, если супруги совместимы по HLA либо муж болел гепатитом). После введения лимфоий' тов мужа в организме женщины увеличивается секреция белков и гормонов плаценты, в результате чего повышаются блокирующие свойства сыворотки крови беременной, исчезает угроза прерывания беременности и раннего токсикоза.
После стимуляции овуляции нередко появляются симптомы угрозы прерывания беременности на 7-8-й неделе как следствие снижения уровня эстрогенов, чрезмерно повышенного после стимуляции овуляции. Для профилактики этого осложнения необходимо использовать гестагенные препараты (туринал, дюфастон по 5-15 мг), подбираемые индивидуально. Профилактическое назначение гестагенов показано до завершения процессов плацентации.
Пациенткам с гиперандрогенией во время беременности назначают дексаметазон. Дозу препарата подбирают индивидуально под контролем экскреции 17-КС. При высоком уровне дегидроэпиандростерона и нормальном уровне экскреции 17-КС – дексаметазон принимает только до 16 нед беременности. Если же экскреция 17-КС не нормализуется, то продолжительность приема дексаметазона увеличивается, иногда до 34-35 нед. Перед отменой дексаметазона дозу препарата постепенно снижают.
Сроки беременности 13, 20-24 и 28 нед являются критическими для пациенток с гиперандрогенией из-за начала продукции гормонов плодом. В эти сроки необходимо оценить уровень экскреции 17-КС и уточнить дозу дексаметазона. Для этих пациенток характерна функциональная истмикоцервикальная недостаточность (ИЦН), поэтому после 12 нед беременности необходим контроль за состоянием шейки матки.
При ИЦН, хроническом эндометрите с персистенцией микроорганизмов в эндометрии вне беременности проводят лечение антибиотиками с учетом чувствительности к ним микрофлоры. Принимая во внимание, что хронический эндометрит чаще всего обусловлен персистенцией микоплазмы, хламидий, анаэробов, назначают доксициклин с трихополом и нистатином с 1-го по 7-й день менструального цикла. После антибиотиков применяют эубиотики (лактобактерин, ацилакт и др.) в течение 10-14 дней.
У пациенток с ИЦН и хроническим эндометритом необходим микробиологический мониторинг в процессе беременности, особенно во II триместре и начале III. Хирургическую коррекцию ИЦН следует проводить в начале II триместра беременности при появлении клинических признаков ИЦН – размягчения и укорочения шейки матки. В отсутствие этих признаков наложение швов нецелесообразно, так как необходимое натяжение их может быть утрачено после размягчения шейки матки.
Впервые хирургическое лечение ИЦН при беременности было предложено в 1955 г. Широдкаром. Операция заключалась в наложении циркулярного шва на шейку матки в области внутреннего зева (рис. 9.1) после рассечения слизистой оболочки переднего свода влагалища и смещения вверх мочевого пузыря. После операции в области перешейка матки формировался плотный рубец.
В дальнейшем было предложено много модификаций этого метода. Наиболее удачная модификация – метод, разработанный Мак-Дональдом ЛУ57). Производятся сужение внутреннего зева шейки матки путем наложения кисетного шва без предварительного рассечения слизистой оболочки фис. 9.2). Концы нитей завязывают в области переднего свода. В качестве Ровного материала используют хромированный кетгут, но можно применять также лавсан и шелк. Швы снимают в 37-38 нед или при возникновении угрозы преждевременных родов.
Метод, предложенный В.Сценди (1961), заключается в следующем. Шейку матки обнажают в зеркалах. С помощью мягких кишечных зажимов фиксируют переднюю губу шейки матки и вокруг наружного зева иссекают слизистую оболочку на ширину 0,5 см. То же самое производят на задней губе шейки. После этого переднюю и заднюю губы шейки матки сшивают отдельными кетгутовыми или шелковыми швами.
Широкое применение нашла модификация Любимовой-Мамедалиевой (1978) – наложение двойного П-образного шва в области внутреннего зева (рис. 9.3). Этот шов удобен при пролабировании плодного пузыря: после взятия шейки матки на пулевные щипцы влажным тампоном плодный пузырь удерживают за областью внутреннего зева, шейку слегка подтягивают, накладывают П-образные швы, нити берут на зажим, затем осторожно убирают тупфер, одновременно подтягивая нити, которые завязывают в переднем своде.
После операции по показаниям применяют антибиотики с учетом чувствительности микрофлоры в течение 7-8 дней, а затем – эубиотики (лактобактерин, ацилакт) на протяжении 10 дней. Обработку влагалища и шейки матки, контроль за состоянием швов проводят ежедневно в течение 3-5 дней. Швы снимают в 37-38 нед или раньше, если преждевременно начинается родовая деятельность.
При привычном невынашивании лечебные мероприятия нередко начинают проводить до наступления очередной беременности.
В случае наличия внутриматочных си некий перед наступлением беременности проводят гистероскопию и разрушение синехий. В полость маткй вводят внутриматочный контрацептив, осуществляют лечение антибиотиками с трихополом и циклическую гормональную терапию (3 цикла). Затем спираль убирают и проводят еще 3 цикла гормональной терапии, после чего разрешают беременность.
При выявлении хронических персистирующих вирусных инфекциях, обусловленных вирусом простого герпеса, цитомегаловируса, вирусом Коксаки, энтеровирусом, которые не являются прямым причинным фактором привычного невынашивания, но существенно осложняют течение беременности, необходимо провести иммуномодулирующую и общеукрепляющую терапии.
В случае наступления беременности проводят контроль с целью установления возможной активации вирусной инфекции и для ее профилактики используют комплекс витаминов, а также иммуноглобулин (внутривенно капельно); осуществляют профилактику плацентарной недостаточности (см. Плацентарная недостаточность).
Для подготовки к беременности пациенток с волчаночным антикоагулянтом (ВА) проводят лечение для нормализации гемостазиограммы. С этой целью могут быть использованы антиагреганты (курантил, трентал, никошпан, теоникол) и антикоагулянты (гепарин, фраксипарин и др.). Беременность разрешают при нормальной гемостазиограмме. Преднизолон в дозе 5 мг назначают на 2-й день после овуляции во время того цикла, когда разрешена беременность. В первые недели беременности контроль гемостазиограммы и уровня ВА проводят каждые 7-10 дней для подбора дозы глюкокортикоидов и антиагрегантов. При необходимости возможно проведение гепаринотерапии (10.000 – 20.000 ЕД в сутки подкожно). Со II триместра может быть применен аспирин в низких дозах.
Независимо от причинных факторов привычного невынашивания в процессе беременности проводят профилактику плацентарной недостаточности и хронической гипоксии плода, которые, как правило, наблюдаются при данной патологии.
Преждевременные роды
Преждевременными родами считают роды, наступившие при сроке беременности от 28 до 37 нед, при этом масса плода составляет от 1000 до 2500 г.Эти границы срока гестации и массы плода были установлены в связи с тем, что чаще всего выживали дети, родившиеся после 28 нед беременности и имевшие массу тела более 1000 г. В настоящее время благодаря созданию новых технологий, позволяющих проводить интенсивную терапию родившихся с массой менее 1000 г, нижние границы массы плода и сроки гестации пересмотрены. По рекомендации ВОЗ, в том случае, если беременность прерывается при сроке 22 нед и более, масса плода составляет 500 г и более, а новорожденный выживает в течение 7 дней, роды считают преждевременными с экстремально низкой массой плода. Гибель ребенка, родившегося после 22 нед гестации (масса 500 г и более), через 7 дней после Рождения входит в показатель перинатальной смертности.
Принятие подобного положения на государственном уровне привело к тому, что дети, имевшие при рождении массу не менее 500 г, подвергаются интенсивной терапии, и число выживших новорожденных с экстремальной Малой массой увеличивается.
Масса новорожденных менее 2500 г может быть не только при преждеВременных родах. В связи с этим новорожденных с малой массой тела делят на 3 группы: 1. новорожденные, скорость внутриутробного роста которых была нормальной до момента рождения (масса тела соответствует гестационному сроку); 2. дети, рожденные в срок или переношенные, но имеющие массу тела, недостаточную для данного гестационного срока вследствие замедления внутриутробного развития; 3. недоношенные, у которых, кроме того, отмечалось замедление внутриутробного развития, т.е. их масса тела недостаточна в связи как с недоношенностью, так и с нарушением внутриутробного развития.
Факторами риска преждевременных родов являются как социально-де-мографические (неустроенность семейной жизни, низкий социальный уровень, молодой возраст), так и медицинские (ранее перенесенные аборты, преждевременные роды и самопроизвольные выкидыши, инфекции мочевых путей, воспалительные заболевания половых органов). Важную роль в возникновении преждевременных родов играет осложненное течение данной беременности, чаще всего это угроза ее прерывания. Особое место занимают инфекции, перенесенные во время беременности (ОРВИ и другие вирусные инфекции). Однако эти факторы не позволяют прогнозировать исход преждевременных родов для плода.
В связи с особенностями акушерской тактики и разным исходом преждевременных родов для плода целесообразно выделить 3 периода таких родов с учетом сроков гестации: 1. в 22-27 нед; 2. в 28-33 нед; 3. в 34-37 нед.
Преждевременные роды в 22-27 нед (масса плода от 500 до 1000 г) составляет 5 % их общего количества. Чаще всего они обусловлены истмико-цервикальной недостаточностью, инфицированием нижнего полюса плодного пузыря и его преждевременным разрывом. Легкие плода незрелые, и добиться ускорения их созревания с помощью лекарственных средств, назначаемых матери, не всегда удается. Исход родов для плода в этой группе наиболее неблагоприятный: чрезвычайно высоки перинатальные заболеваемость и смертность.
Преждевременные роды при сроке гестации 28-33 нед (масса плода 1000-1800 г) обусловлены более разнообразными причинами, чем ранние преждевременные роды. Несмотря на то что легкие плода еще незрелые, с помощью назначения глюкокортикоидов или других медикаментозных средств удается добиться ускорения их созревания. В связи с этим исход родов для плода при этом сроке гестации более благоприятный, чем в предыдущей группе.
Преждевременные роды при сроке гестации 34-37 нед (масса плода 1900-2500 г и более) обусловлены еще более разнообразными причинами, процент инфицирования гораздо меньше, чем в предыдущих группах.
Факторами риска перинатальной заболеваемости и смертности при преждевременных родах, помимо срока гестации и массы плода, являются особенности течения самих родов. При преждевременных родах нередко наблюдаются неправильное положение и предлежание плода, в том числе тазовое предлежание, отслойка нормально или низко расположенной плаценты, быстрые или стремительные роды, при которых в 5 раз увеличивается риск перинатальной гибели плода и новорожденного.
Клиническая картина и диагностика.
Различают угрожающие, начинающиеся и начавшиеся преждевременные роды.
Угрожающие преждевременные роды характеризуются болями в пояснице и в нижней части живота. Возбудимость и тонус матки повышены, что может быть подтверждено результатами гистерографии и тонусометрии. При влагалищном исследовании обнаруживают, что шейка матки сохранена, наружный зев ее закрыт. У повторнородящих он может пропускать кончик пальца. Нередко отмечаются подтекание околоплодных вод и повышенная двигательная активность плода.
При начинающихся преждевременных родах обычно выражены схваткообразные боли внизу живота или регулярные схватки, что подтверждается результатами гистерографии. При влагалищном исследовании отмечаются изменения шейки матки (укорочение или сглаженность). Часто наблюдается преждевременное излитие околоплодных вод. Для начавшихся преждевременных родов характерны регулярная родовая деятельность и динамика раскрытия шейки матки (более 2-4 см).
Течение преждевременных родов имеет ряд особенностей: 1. преждевременное излитие околоплодных вод (около 40 %); 2. аномалии родовой деятельности: слабость родовой деятельности, дискоординация, чрезмерно сильная родовая деятельность; 3. часто быстрые или стремительные роды в связи с развитием истмико-цервикчьной недостаточности, в то же время возможно увеличение продолжительности родов; 4. дородовое кровотечение в результате отслойки низко или нормально расположенной плаценты либо предлежания плаценты, кровотечение в последовом и раннем послеродовом периодах вследствие задержки частей плаценты; 5. инфекционные осложнения в родах (хориоамнионит) и в послеродовом периоде (эндомиометрит, флебит и т.д.); 6. гипоксия плода.
Диагностика угрожающих и начинающихся родов нередко представляет значительные трудности.
При поступлении беременной по поводу преждевременных родов необходимо: 1. выяснить возможную причину угрозы или наступления преждевременных родов; 2. установить срок беременности и предполагаемую массу плода, его положение, предлежание, характер сердцебиения плода, характер выделений из влагалища (околоплодные воды, кровотечение), состояние шейки матки и плодного пузыря, наличие или отсутствие признаков инфекции, наличие родовой деятельности и ее интенсивность; 3. определить стадию развития преждевременных родов (угрожающие, начинающиеся, на-чавшиеся), так как терапия должна быть строго дифференцированной. При Угрожающих или начинающихся родах может быть проведена терапия, направленная на сохранение беременности. При начавшихся родах такое лечение неэффективно.
Для диагностики угрожающих и начинающихся преждевременных родов Редко требуется проведение специальных исследований, с целью определения возбудимости и сократительной активности матки (гистерография ).
При влагалищном исследовании определяют состояние шейки матки: ее консистенцию, длину (сглаженность), проходимость канала, отношение шейки матки к оси таза, наличие деформации шейки матки, состояние плодного пузыря.
Для угрожающих преждевременных родов характерно наличие непостоянных болей в нижней части живота и пояснице. При начинающихся преждевременных родах обычно отмечаются выраженные схваткообразные боли внизу живота или регулярные схватки. Начавшиеся преждевременные роды характеризуются наличием регулярных схваток, иногда наблюдается подтекание околоплодных вод.
При угрожающих преждевременных родах шейка матки обычно сохранена, наружный зев закрыт либо пропускает кончик пальца. При начинающихся родах шейка матки укорочена либо сглажена, канал ее проходим для пальца. При начавшихся преждевременных родах наблюдаются сглаженность и открытие шейки матки. С целью более объективной оценки акушерской ситуации при преждевременных родах можно использовать индекс гоколиза по Баумгартену, который позволяет индивидуально подойти к назначению лечения, оценить показания и противопоказания к сохранению беременности (табл. 9.1).
Примечание. 0 баллов – сократительная деятельность матки отсутствует. Плодный пузырь цел, кровяных вьщелений нет. Шейка матки закрыта. 1 балл – нерегулярные схватки, плодный пузырь цел. Могут обнаруживаться следы крови Шейка матки закрыта. 2 балла – регулярные схватки. Подтекают околоплодные воды, но плодный пузырь определяется. Могут быть следы крови. Шейка мзтки открыта на 2 см. 3 балла – регулярные схватки. Подтекают околоплодные воды, но плодный пузырь определяется. Могут быть следы крови. Шейка штки открыта на 3 см. 4 балла – регулярные схватки. Плодный пузырь не определяется, могут быть следы крови. Шейка матки открыта на 4 см и более.
Чем меньше сумма баллов, тем более успешной может быть терапия, чем сумма больше, тем выше вероятность того, что роды вступили в активную фазу и терапия по сохранению беременности будет безуспешной. При длительной угрозе преждевременных родов и повышенном тонусе матки нередко нарушается маточно-плацентарное кровообращение, вследствие чего могут развиться плацентарная недостаточность и хроническая гипоксия плода.
Лечение.
Для понижения возбудимости матки и подавления ее сократительной деятельности предлагается следующее комплексное лечение. 1. Постельный режим. 2. Психотерапия, седативные средства: настойка пустырника (15,0:200,0) по 1 столовой ложке 3-4 раза в день, настойка валерианы (20,0:200,0) + настойка пустырника (20,0) по 1 столовой ложке 3 раза в день; могут быть использованы такие седативные препараты, как триоксазин по 0,3 г 2-3 раза в сутки, нозепам (тазепам) по 0,01 г 2-3 раза в день, сибазон по 0,015 г 1-2 раза в сутки. 3. Спазмолитическая терапия: 0,1 % раствор метацина – 1 мл внутримышечно, баралгин по 2 мл, но-шпа по 2 мл внутримышечно 2-4 раза в сутки, 2 % раствор папаверина гидрохлорида по 2 мл внутримышечно 2-3 раза в сутки. После хирургической коррекции истмико-цервикальной недостаточности целесообразно назначить более сильные спазмолитики (баралгин, метацин). В случае проявлений истмико-цервикальной недостаточности без хирургической коррекции или после ушивания наружного зева шейки матки по методу Сенди целесообразно использовать препараты с менее выраженными спазмолитическими свойствами, но являющиеся антиагрегантами, способствующими снижению уровня простагландинов (но-шпа, папаверина гидрохлорид). 4. Средства, снижающие активность матки: 25 % раствор магния сульфата по 10 мл внутривенно 2-4 раза в сутки; токолитики: партусистен, бриканил: антагонисты ионов кальция – финоптин (изоптин). 5. Немедикаментозные средства для снижения сократительной активности матки: электрорелаксация матки, иглоукалывание, электроаналгезия. 6. Физиотерапевтические методы: электрофорез магния синусоидальным модулированным током.
В настоящее время в борьбе с угрожающими преждевременными родами достигнуты определенные успехи благодаря использованию в акушерской практике препаратов, подавляющих сократительную активность матки: р-миметики или токолитики, группа веществ, специфически действующих на р-рецепторы и вызывающих релаксацию матки.
Препараты этого ряда являются производными эпинефрина – нейрогормона, освобождающегося при стимуляции симпатических нервных окончаний. Токолитики быстро блокируют сокращения матки, а после прекращения их введения сократительная активность матки может вновь восстановиться, в связи с чем (3-адреномиметики применяют длительно и вводят через равные промежутки времени в постепенно снижающихся дозах.
Применение партусистена (беротек), бриканила (тербутален), гинипрала Для подавления сократительной деятельности матки заключается в следующем: 0,5 мг партусистена или 0,5 мг бриканила разводят в 250-400 мл изотонического раствора натрия хлорида и вводят внутривенно капельно, начиная с 5-8 капель в минуту, постепенно увеличивая дозу до прекращения сократительной активности матки. Средняя скорость введения раствора составляет 15-20 капель в минуту в течение 4 -12 ч. В случае положительного эффекта за 15-20 мин до окончания введения препарата следует начать прием внутрь партусистена, бриканила в дозе 5 мг 4 – 6 раз в сутки или по 2,5 мг через 2-3 ч. В случае прекращения сократительной деятельности Матки через 2-3 дня дозу токолитиков постепенно снижают в течение 8-10 дней. Вместо таблетированного препарата можно использовать суппозитории в тех же дозах.
Через 5-10 мин после начала внутривенного введения р-адреномиметиков отмечаются значительное уменьшение интенсивности болей, снижение напряжения матки, а через 30-40 мин боли и сократительная деятельность матки прекращаются. Токолитики в таблетированном виде через 30 мин после приема дают эффект, который держится в течение 3-4 ч. Лечение токолитиками можно проводить длительное время (до 2 мес) до исчезновения клинических признаков угрозы прерывания беременности.
Токолитические препараты могут вызывать побочные действия и осложнения: сердцебиение, снижение АД (особенно диастолического), потливость, тремор, беспокойство (возбуждение), тошноту, рвоту, озноб, головную боль, метеоризм. Побочные действия и осложнения обычно связаны с передозировкой препарата и очень редко с его непереносимостью, поэтому следует уменьшить дозу или прекратить введение токолитиков. При лечении р-адреномиметиками необходим контроль за частотой сердечных сокращений, АД, уровнем глюкозы в крови. Для устранения побочных действий р-адреномиметиков их применяют в сочетании с финоптином (по 0,04 г 3-4 раза в день). Этот препарат, являясь антагонистом ионов кальция, не только снимает побочные действия р-адреномиметиков, но и сам подавляет сократительную активность матки. Уменьшить дозировку медикаментозных средств удается при сочетании лекарственной терапии с физиотерапией – электрофорез магния синусоидальным модулированным током.
В том случае, если угроза прерывания беременности проявляется повышенным тонусом матки, с успехом может быть использован индометацин – ингибитор синтеза простагландинов. Индометацин назначают в дозе 200 мг в сутки в таблетках или свечах: в 1-е сутки по 50 мг 4 раза в таблетках (в свечах по 100 мг 2 раза), на 2-3-й сутки по 50 мг через 8 ч, на 4 – 6-е сутки по 50 мг через 12 ч, на 7-8-е сутки по 50 мг на ночь. Общая доза не должна превышать 1000 мг. Длительность курса лечения 5-9 дней. Противопоказа-ниями к использованию индометацина являются заболевания желудочнокишечного тракта, бронхиальная астма. Торможение сократительной деятельности матки начинается через 2-3 ч после приема препарата и выражается в снижении тонуса, постепенном снижении амплитуды схваток. Полная нормализация состояния матки наступает через 3-4 дня от начала терапии.
В указанных дозах препарат не оказывает отрицательного влияния на состояние плода. Эффективность препарата зависит от срока беременности и выраженности изменений шейки матки. Если угроза прерывания проявляется в стадии, когда шейка матки укорочена или сглажена, то индометацин менее эффективен, чем р-адреномиметики. Если сократительная деятельность характеризуется высоким тонусом матки, а шейка матки сохранена, то индометацин по эффективности не уступает р-адреномиметикам. Побочные действия индометацина менее выражены, чем у р-адреномиметиков (головная боль, аллергическая сыпь, боли в области желудочно-ки-шечного тракта). Для закрепления эффекта целесообразно использовать индометацин в сочетании с электрофорезом магния.
Терапию, направленную на сохранение беременности, можно проводить, вводя внутривенно капельно 2 % раствор сульфата магния в дозе 200 мл в течение 1 ч 5-7 дней. Токолитическая терапия сульфатом магния не оказывает отрицательного влияния на плод, у матери снижается артериальное давление, увеличивается диурез, отмечается благоприятный седативный эффект. Однако эффективность сульфата магния ниже, чем р-адреномиметиков и индометацина.
Для лечения беременных, у которых отмечаются угрожающие преждевременные роды, необходимо шире использовать немедикаментозные и физиотерапевтические средства воздействия на мускулатуру матки. Электрорелаксация матки с помощью воздействия на ее нервно-мышечный аппарат переменного синусоидального тока с частотой в диапазоне от 50 до 500 Гц и силой тока до 10 мА по амплитудному значению является высокоэффективным средством подавления сократительной активности матки. Электроды располагают на передней брюшной стенке (прокладка 8x10 см) на 2 см ниже пупка и на пояснично-крестцовой области (прокладка 15x22 см). Прокладки смачивают водопроводной водой. Электрорелаксацию проводят с помощью аппарата "Амплипульс-4". Параметры воздействия: частота модуляций 100 Гц, глубина модуляций 100 %, длительность процедуры 30 мин. Курс лечения состоит из 1-3 процедур. Этот метод терапии высокоэффективен и безопасен для матери и плода.
При угрожающих преждевременных родах успешно применяют иглоукалывание как самостоятельный метод в сочетании с лекарственными средствами (иглоукалывание проводит врач, получивший специальную подготовку) .
Профилактика респираторного дистрес с синдрома. При угрозе преждевременных родов неотъемлемой частью терапии должна быть профилактика респираторного дистресс-синдрома (РДС) у новорожденных путем назначения беременной глкжокортикоидных препаратов. Многочисленные экспериментальные работы показали, что у недоношенных новорожденных РДС развивается из-за недостатка сурфактанта в незрелых легких. Сурфактант – гетерогенная смесь липидов и белков, синтезируемых в больших альвеолах, которая покрывает альвеолы, способствует их открытию при вдохе и препятствует коллапсу при выдохе.
Небольшое количество сурфактанта продуцируется с участием метилтрансферазы с 22-24-й недели внутриутробной жизни. После рождения продуцирование сурфактанта этим путем прекращается под влиянием гипоксии. Синтез сурфактанта с участием фосфохолинтрансферазы начинается с 35-й недели внутриутробной жизни; эта система более устойчива к ацидозу и гипоксии. Под влиянием глюкокортикоидов, введенных беременной или непосредственно плоду, наблюдается ускоренный синтез сурфактанта.
Беременным на курс лечения назначают 8-12 мг дексаметазона (по 4 мг 2 раза в день внутримышечно 2-3 дня или в таблетках по 2 мг 4 раза 1-й день, по 2 мг 3 раза на 2-й день, по 2 мг 2 раза на 3-Й день). Назначение Дексаметазона с целью ускорения созревания легких плода имеет смысл, если роды ожидаются в течение ближайших дней. Противопоказаниями к терапии являются язвенная болезнь желудка и двенадцатиперстной кишки, недостаточность кровообращения (II степени, эндокардит, нефрит, активная форма туберкулеза, тяжелые формы сахарного диабета, остеопороз, тяжелая Форма гестоза.
При проведении сочетанной терапии р-адреномиметиками и глюкокортикоидами в случае их непереносимости или передозировки у беременных Может развиться легочно-сердечная недостаточность с отеком легкого. Для профилактики этих тяжелых осложнений необходим жесткий контроль за состоянием беременной и всеми гемодинамическими показателями.
Кроме дексаметазона, для профилактики РДС могут быть использованы другие глкжокортикоиды (преднизолон в дозе 60 мг в сутки в течение 2 дней, дексазон в дозе 4 мг в 1 мл внутримышечно 2 раза в день в течение 2 дней).
При гипертензионном синдроме у беременной для стимуляции созревания сурфактанта можно применить 2,4 % раствор эуфиллина в 10 мл 20 % раствора глюкозы в дозе 10 мл в течение 3 дней. Хотя эффективность этого метода профилактики РДС невысока, но при сочетании гипертензии и угрозы преждевременных родов он является единственно возможным.
Лазольван (амбраксол) не уступает по эффективности глюкокортикоидным препаратам и практически не имеет противопоказаний. Побочные действия – слабость, тремор, головная боль. Препарат вводят внутривенно капельно в дозе 800-1000 мг в сутки в течение 5 дней.
Профилактика РДС имеет смысл при сроках гестации 28-35 нед. В более ранние сроки гестации для антенатального созревания легких требуется более длительное использование препаратов.
Профилактику РДС повторяют через 7 сут 2-3 раза. В тех случаях, когда нет возможности пролонгировать беременность, необходимо использовать сурфактант для лечения РДС у новорожденного.
Ведение преждевременных родов. При преждевременных родах широко используют метод медикаментозного обезболивания (см. Обезболивание родов). Большинство осложнений в родах как у матери, так и у плода обусловлено нарушением сократительной деятельности матки. Для выявления особенностей этой функции матки при преждевременных родах необходимы ведение партограммы и запись сократительной деятельности.
При нормальной продолжительности преждевременных родов имеется тенденция к увеличению скорости раскрытия шейки матки, которая в латентной фазе составляет 0,8 см/ч, в активной – 3-5 см/ч. В результате ускорения периода раскрытия шейки матки в динамике нормальных преждевременных родов происходит уменьшение длительности как латентной (6,25+0,312 ч), так и активной (2,16 + 0,15 ч) фазы по сравнению со своевре-менными родами. Отличительной чертой преждевременных родов является монотонность ритма схваток, заключающаяся в отсутствии увеличения количества схваток и удлинения их в активной фазе родов. Продолжительность нормальных преждевременных родов меньше, чем своевременных, вследствие увеличения скорости раскрытия шейки матки. Возможно, это связано с тем, что у таких женщин чаще наблюдается истмико-цервикальная недостаточность и при меньшей массе плода не требуется высокой маточной активности и интенсивности схваток для его рождения.
Если параметры сократительной деятельности матки при преждевременных родах соответствуют норме, то при ведении родов применяют выжидательную тактику. Регулярно проводят профилактику гипоксии плода, при этом нецелесообразно применять промедол из-за его неблагоприятного влияния на дыхательный центр плода. Может быть использована длительная перидуральная анестезия, В этом случае роды ведут совместно с анестезиологом.
С целью уменьшения родового травматизма в периоде изгнания оказывают пособие без защиты промежности. Акушерка или врач, принимающий ребенка, вводит пальцы во влагалище и, растягивая бульварное кольио, способствует рождению головки плода. Часто при преждевременных родах производят рассечение промежности для облегчения прорезывания головки плода.
Целесообразны проведение пудендальной анестезии (75 мл 0,25 % раствора новокаина с двух сторон) и введение лидазы (64 или 128 ЕД в 10 мл 0,25 % раствора новокаина).
Ребенка принимают на специальную подставку на уровне промежности матери. Не следует поднимать или опускать его ниже уровня матки, чтобы не создавать гиперили гиповолемию у новорожденного, что может оказать влияние на его сердечную деятельность. Принимать ребенка необходимо в теплые пеленки. Отделение его от матери целесообразно проводить в течение 1-й минуты после рождения, а затем, если необходимо, приступить к реанимационным мероприятиям (бережно, осторожно, лучше в кувезе).
Профилактику кровотечения в последовом и раннем послеродовом периодах проводят по обычной методике (внутривенное введение метилэргометрина или окситоцина).
Быстрые преждевременные роды
Клиническими проявлениями быстрых преждевременных родов являются частые болезненные продолжительные схватки. Сократительная деятельность матки при быстрых преждевременных или осложненных чрезмерно активной родовой деятельностью родах характеризуется рядом особенностей: скорость раскрытия шейки матки превышает 0,8-1 см/ч в латентную и 2,5-3 см/ч в активную фазу родов, частота схваток 5 за 10 мин и более, интенсивность схваток более 5 кПа, маточная активность 2100 АЕ (алексан-дрийские единицы) в латентную и 2430 АЕ в активную фазу родов.
С целью прогнозирования быстрых преждевременных родов необходимо при поступлении пациенток проводить запись токограмм в течение 10-20 мин для оценки интенсивности схваток, а также производить повторное влагалищное исследование через 1 ч для определения скорости раскрытия шейки матки.
Коррекцию нарушений деятельности матки при быстрых преждевременных родах проводят путем внутривенного капельного введения р-адреномиметиков (партусистен, бриканил, гинипрал). Для этого непосредственно перед употреблением 0,5 мг партусистена растворяют в 250-300 мл изотонического раствора натрия хлорида или 5 % раствора глюкозы. С целью предварительной оценки реакции матки на введение препарата в течение первых 10 мин партусистен следует вводить в дозе 0,8 мкг/мин (10 капель в минуту). При дискоординированной родовой деятельности эта доза является достаточной для ее нормализации. При чрезмерно активной родовой Деятельности и быстрых родах дозу партусистена нужно увеличить до 1,2- 3 мкг/мин, т.е. до 40 капель в минуту, для подавления чрезмерно высокой активности матки, при этом снижение ее сократительной деятельности наступает в среднем через 10 мин. Затем скорость введения препарата постепенно снижают до появления ка мониторе регулярных схваток с частотой 3-4 схватки за 10 мин. Токолиз продолжают не менее 2-3 ч под постоянным контролем гистерографии, так как после быстрой отмены препарата нередко вновь возникают дискоординированные сокращения или иперактивность матки. Токолиз нужно прекратить при открытии шейки матки на 8-9 см, т.е. за 30-40 мин до предполагаемых родов. В последовом и раннем послеродовом периодах необходимо проводить профилактику кровотечения путем введения метилэргометрина (1 мл) или окситоцина (5 ЕД на 300 мл изотонического раствора натрия хлорида), В процессе введения препарата необходимо постоянно следить за пульсом и уровнем артериального давления.
Наиболее эффективными средствами для нормализации сократительной деятельности матки в родах являются р-адреномиметики. Другие ингибиторы (индометацин, раствор магния сульфата) менее эффективны, и для реализации их действия требуется больше времени.
Использование токолитиков при ведении быстрых преждевременных родов способствует снижению скорости раскрытия шейки матки, более плавному течению родов и нормализации сократительной деятельности матки, что выражается в снижении частоты и интенсивности схваток, увеличении пауз между ними, наряду с отсутствием достоверного уменьшения длительности схваток.
Ведение преждевременных родов при слабости родовой деятельности
Средства, стимулирующие сокращения матки, следует вводить осторожно. Наиболее эффективным методом родостимуляции является сочетанное применение окситоцина (2,5 ЕД) и простагландина (2,5 мг в 500 мл 0,9 % раствора натрия хлорида). Их следует вводить, начиная с 5-8 капель в минуту. В дальнейшем дозу увеличивают каждые 10-20 мин на 4-5 капель до появления регулярных схваток с частотой 3-4 за 10 мин. После этого введение утеротонических средств прекращают и внутривенно вводят 0,9 % раствор натрия хлорида. Если регулярная родовая деятельность в дальнейшем продолжается, то утеротонические средства используют для профилактики кровотечения в последовом и раннем послеродовом периодах. Если же родовая деятельность вновь ослабевает, то продолжают введение этих средств.
При возникновении слабости родовой деятельности во втором периоде родов можно использовать эндоназальное введение окситоцина. Для этого из ампулы, содержащей 5 ЕД окситоцина, набирают раствор в пипетку и вводят по 1-2 капле в каждую половинку носа через 20 мин.
Применение метода Кристеллера, вакуум-экстрактора при недоношенном плоде противопоказано. Использование акушерских щипцов возможно при сроке гестации 34-37 нед.
При тазовом предлежании плода ручное пособие следует проводить очень осторожно, используя приемы классического пособия. Метод Цовьянова при чисто ягодичном предлежании глубоко недоношенных детей применять нецелесообразно в связи с их легкой ранимостью (опасность кровоизлияния в шейный отдел спинного мозга).
Вопрос о родоразрешении путем кесарева сечения при недоношенной беременности при сроке гестации до 32 нед решают индивидуально. В интересах плода в эти сроки может быть поставлен вопрос о выполнении кесарева сечения при осложненном течении родов в тазовом предлежании, при поперечном и косом положении плода, у женщин с отягощенным акушерским анамнезом (бесплодие, невынашивание). В случае необходи-мости оперативного родоразрешения при неразвернутом нижнем сегменте матки лучше использовать продольный разрез на матке, так как извлечение плода при поперечном разрезе может быть затруднено.
Ведение преждевременных родов при дородовом излитии околоплодных вод
Диагностика преждевременного разрыва плодных оболочек при недоношенной беременности нередко затруднена, так как возможны, с одной стороны, маловодие, с другой – обильные выделения из-за сопутствующего кольпита.
Наиболее эффективным и быстрым методом диагностики преждевременного разрыва плодных оболочек является амнитест – экспресс-метод определения плацентарного армикроглобулина в отделяемом из влагалища. В норме в отделяемом влагалища этого белка нет. Стерильный тампончик на 5-10 мин помещают во влагалище, а затем прикладывают к окошку индикаторной полоски. Через несколько минут читают результат. Если произошел разрыв плодного пузыря, то в содержимом влагалища появляется плацентарный сц-микроглобулин, а на индикаторной полоске в окошке появляется такая же полоса, как в контроле.
Возможность инфицирования при преждевременном разрыве плодных оболочек оказывает решающее влияние на ведение беременности. В настоящее время в такой ситуации придерживаются выжидательной тактики, контролируя возможное развитие инфекции.
Выжидательная тактика тем предпочтительнее, чем меньше срок гестации, так как при удлинении безводного промежутка отмечают более быстрое созревание сурфактанта легких плода и снижение частоты болезни гиалиновых мембран.
План ведения беременной при преждевременном разрыве плодных оболочек и недоношенной беременности должен быть следующим. 1. Госпитализация в палату, обрабатываемую по такому же графику, как помещение родильного блока. 2. Ежедневная смена белья. 3. Постельный режим, полноценное питание. 4. Контроль за состоянием здоровья матери и плода: измерение окружности живота и высоты дна матки, оценка количества и качества подтекающих вод, определение частоты пульса, температуры тела, частоты сердцебиений плода каждые 4 ч. Необходимо каждые 12 ч определять содержание лейкоцитов в крови, а при его увеличении анализируют лейкоцитарную формулу крови. Посев содержимого цервикального канала и мазки из влагалища контролируют каждые 5 дней. Для выявления начинающейся ин-фекции можно использовать более чувствительные тесты: оценку Т-клеточного звена иммунитета, появление С-реактивного белка, спонтанный тест с нитросинимтетразолием (НСТ) и др. 5. Решить вопрос о применении токолитической терапии и антибиотиков, профилактике дистресс-синдрома глюкокортикоидами.
Токолитические препараты могут быть назначены пациентке при преждевременном разрыве плодных оболочек в случае угрожающих и начинающихся преждевременных родах. Если родовая деятельность началась, то ее больше не подавляют.
Использование антибиотиков при преждевременном разрыве плодных оболочек показано в случае опасности развития инфекционных осложнений (длительное применение глюкокортикоидов, истмико-цервикальная недостаточность, наличие у беременных анемии, пиелонефрита и других хронических инфекций, проведение в связи с акушерской ситуацией нескольких влагалищных исследований даже в отсутствие признаков инфицирования). Всем остальным пациенткам при появлении малейших признаков инфекции необходимо назначить антибиотики и создать гормональный фон с последующим родовозбуждением.
Характеристика недоношенного ребенка
У ребенка, рожденного преждевременно, обнаруживаются признаки незрелости: много сыровидной смазки, недостаточное развитие подкожной жировой клетчатки, пушок на теле (в норме он отмечается только в области плечевого пояса), небольшая длина волос на голове, мягкие ушные и носовые хрящи, ногти не заходят за кончики пальцев, пупочное кольцо расположено ближе к лобку, у мальчиков яички не опущены в мошонку, у девочек клитор и малые половые губы не прикрыты большими, крик ребенка слабый (пискливый).Оценку степени зрелости проводят по специальной шкале. При этом срок внутриутробного развития новорожденного можно определить с точностью до 2 нед. При установлении степени зрелости следует учитывать срок беременности, при котором произошли роды.
Оценка состояния ребенка по шкале Апгар была предложена для доношенного новорожденного, но эта шкала с успехом может быть использована и при недоношенности. Повышенная частота угнетения жизненно важных параметров у недоношенного ребенка коррелирует с низкими оценками состояния при рождении. По данным многих исследователей, состояние примерно 50 % детей с массой тела до 1500 г оценивают по шкале Апгар в 0-3 балла, в то время как при массе 3000 г такую оценку получают только 5-7 % новорожденных. Большое прогностическое значение имеет оценка состояния ребенка по шкале Апгар через 5 мин после рождения. Если она остается низкой, то прогноз неблагоприятный.
Для оценки функции дыхания в момент рождения и в последующие дни у новорожденных применяют шкалу Сильвермана, в соответствии с которой дыхательная функция новорожденного характеризуется: 1. движением грудной клетки и втяжением передней брюшной стенки на вдохе; 2. втяжением межреберий; 3. втяжением грудины; 4. положением нижней челюсти и участием крыльев носа в акте дыхания; 5. характером дыхания (шумное, со стоном).
Каждый из этих симптомов оценивают от 0 до 2 баллов по мере нарастания его тяжести. Сумма баллов дает представление о функции дыхания у новорожденного: чем меньше эта сумма, тем менее выражены проявления легочной недостаточности (табл. 9.2). При выхаживании недоношенных детей необходимо поддерживать адекватное дыхание и нормальное функционирование легких. Особенно важно не нарушить механизм первого вдоха, поэтому все манипуляции по отсасыванию слизи из верхних дыхательных путей нужно проводить чрезвычайно осторожно.
Примечание. 0 баллов – нет нарушений функции дыхания; 1 балл – асинхронное движение грудной клетки с небольшим втяжением передней брюшной стенки на вдохе, втяжение межреберий и грудины, крылья носа участвуют в акте дыхания, нижняя челюсть западает, дыхание учащенное, шумное, иногда со стоном; 2 балла – асинхронное движение грудной клетки и передней брюшной стенки, значительное втяжение передней брюшной стенки на вдохе, зна-чительное втяжение межреберий и грудины, крылья носа раздуты, нижняя челюсть западает, дыхание шумное, со стоном, стридорозное.
Недоношенные новорожденные плохо переносят стрессовые ситуации, которые возникают в связи с началом внеутробной жизни. Их легкие недостаточно зрелы для осуществления газообмена, пищеварительный тракт не может усвоить 20-40 % жира, содержащегося в молоке. Их устойчивость к инфекции невелика, а вследствие увеличения скорости потери тепла нарушается терморегуляция. Повышенная хрупкость капилляров предрасполагает к кровоизлияниям, особенно в желудочки мозга и шейный отдел спинного мозга. Самыми распространенными заболеваниями, к которым предрасположены недоношенные новорожденные, являются болезнь гиалиновых мембран, внутричерепные кровоизлияния, инфекции, асфиксия.
Наиболее тяжелым осложнением постнатчьного периода жизни у новорожденного является болезнь гиалиновых мембран, или синдром расстройства дыхания. Чаще всего это заболевание наблюдается у детей с массой тела при рождении 1000-1500 г и меньше. У большинства новорожденных в легких имеется сурфактант, обеспечивающий эффективное дыхание.
Недоношенные дети легко подвергаются охлаждению, которое обусловливает развитие гипоксемии, метаболического ацидоза, быстрое истощение запасов гликогена и снижение уровня глюкозы в крови.
Поддержание оптимальной температуры окружающей среды является Одним из самых важных аспектов эффективного ухода за недоношенным Ребенком. Анатомические особенности недоношенных таковы, что предрасполагают к потере тепла и тепловой баланс у них менее устойчив, чем у Детей с большей массой тела.
У новорожденного при малой массе тела относительно велика его поверхность, которая обусловливает более обширный контакт с внешней среДой, увеличивая тепловые потери. Потери тепла на единицу массы у недоношенного ребенка с массой тела 1500 г в 5 раз больше, чем у взрослого. Другим анатомическим препятствием к сохранению тепла является слишком тонкий слой подкожной жировой клетчатки, вследствие чего тепло быстро передается от внутренних органов к поверхности кожи. С целью уменьшения потерь тепла недоношенного ребенка следует помещать в теплые пе-ленки, на столик, обогреваемый сверху источником тепла, либо в кувез, нагретый до 32-35 °С.
При рождении и вскоре после него недоношенный ребенок может дышать без затруднений, но в связи с тем, что сурфактант расходуется, а новая система синтезирует его еще в незначительном количестве, не устанавливается нормальная функциональная остаточная емкость легких. Альвеолы, которые раздуваются при вдохе, спадаются во время выдоха. Каждый последующий вдох требует от ребенка невероятных усилий.
По мере ослабления ребенка усиливается ателектаз, что влечет за собой развитие гипоксии, гиперкапнии и метаболического ацидоза. Гипоксия и ацидоз усиливают спазм сосудов, вследствие чего уменьшается приток крови к легким. Гипоксия и ацидоз приводят к повреждению капилляров и некрозу альвеол. В альвеолах и терминальных респираторных бронхиолах из разрушенных клеток образуются гиалиновые мембраны, которые, не вызывая ателектаза, значительно снижают упругость легких. Эти процессы в еще большей степени нарушают продуцирование сурфактанта. Недостаточное расправление легких и сохранение высокой резистентности сосудов легких вызывает увеличение артериального давления в малом круге кровообращения, вследствие чего сохраняется внутриутробный тип кровообращения (овальное окно, артериальный проток). Действие этих внелегочных шунтов приводит к оттоку крови от легких, состояние ребенка прогрессивно ухудшается. Современные методы интенсивной терапии с применением сурфактанта позволяют значительно снизить смертность при этом заболевании.
У детей, рожденных от матерей с экстрагенитальной патологией, гестозом и плацентарной недостаточностью, могут быть признаки задержки внутриутробного развития.?
Глава 10. Внематочная беременность
Внематочная, или эктопическая, беременность (graviditas extrauterine, S.ectopica) подразумевает развитие плодного яйца не в полости матки, а за ее пределами.В последние годы во всем мире отмечено увеличение частоты внематочной беременности (в разных странах от 1,4 до 13 % ) , которая является одной из причин материнской смертности.
По локализации плодного яйца выделяют трубную, яичниковую, брюшную, шеечную беременность, а также беременность в зачаточном роге матки (рис. 10.1). Наиболее часто (около 99,5%) наблюдается трубная беременность. Плодное яйцо может имплантироваться в ампулярном (43%) , истмическом (54%) и интерстициальном (3%) отделах маточной трубы. Яичниковая беременность наблюдается в 0,1–0,2% случаев, брюшная беременность на висцеральной и париетальной брюшине – в 0,3 %.
Яичниковая и брюшная беременность первично развивается редко. Чаще оплодотворенное яйцо из трубы сначала попадает в брюшную полость (трубный аборт), а затем имплантируется на яичнике или брюшине, покрывающей внутренние органы. В 0,5 % случаев беременность может развиваться в зачаточном роге матки при ее аномалии развития, в 0,01 % – в шейке матки.
Этиология.
Причиной внематочной беременности является либо замедленное продвижение яйцеклетки, либо ее ускоренное созревание. Этому способствуют следующие факторы:
1. воспалительные заболевания половых органов;
2. реконструктивно-пластические операции на маточных трубах;
3. экстракорпоральное оплодотворение;
4. опухоли и опухолевидные образования матки и ее придатков;
5. эндометриоз;
6. половой инфантилизм;
7. аномалии положения и развития половых органов;
8. нарушения миграции плодного яйца (migracio ovi externum);
9. повышенная протеолитическая активность трофобласта;
10. эндокринные заболевания.
Воспалительные заболевания половых органов приводят к нарушению проходимости маточных труб, повреждению их нервно-мышечного аппарата.
Воспалительные заболевания способствуют появлению анатомических изменений в виде спаек и перегибов, нарушению тканевых структур и перистальтической активности. Источником инфицирования, как правило, являются заболевания, передаваемые половым путем (хламидиоз, трихомоноз, гонорея, гарднереллез и др.). В последние годы многие авторы связывают повышенный риск наступления внематочной беременности с широким применением внутриматочных контрацептивов, способствующих распространению инфекции восходящим путем. Большое значение в возникновении воспалительных процессов имеет искусственный аборт, особенно произведенный до первых родов или повторно.
 Рис. 10.1. Локализация плодного яйца при внематочной беременности.
1 -нормальное развитие беременности в полости матки; 2 – в интерстициальной части трубы; 3 – в истмической части трубы; 4 – в ампулярной части трубы; 5 – на фимбриях трубы; 6 – на яичнике.
Рис. 10.1. Локализация плодного яйца при внематочной беременности.
1 -нормальное развитие беременности в полости матки; 2 – в интерстициальной части трубы; 3 – в истмической части трубы; 4 – в ампулярной части трубы; 5 – на фимбриях трубы; 6 – на яичнике.
Риск наступления внематочной беременности повышается также после различных операций на органах брюшной полости в связи с развитием спаечного процесса. Особого внимания заслуживают реконструктивно-пластические операции на маточных трубах и экстракорпоральное оплодотворение (ЭКО), производимые при бесплодии. После ЭКО отмечено увеличение частоты внематочной беременности – как изолированной, так и в сочетании с маточной беременностью.
При наличии опухолей и опухолевидных образований матки (миома) и придатков (опухоли яичников, кисты) изменяются анатомические соотношения в малом тазе, включая сдавление маточных труб и образование спаек.
Возникновение внематочной беременности при эндометриозе связано прежде всего с нарушением транспортной функции маточных труб на фоне измененных гормональных взаимосвязей в системе гипоталамус – гипофиз – яичники – матка и другие органы-мишени, к которым относятся и маточные трубы. Меньшее значение имеют анатомические повреждения труб.
Развитие эктопической беременности при инфантилизме обусловлено гипофункцией эндокринных желез, а также чрезмерной длиной и извитостью маточных труб, изменением их перистальтической активности.
В отдельных случаях внематочная беременность может возникнуть при отклонениях в развитии и положении матки и придатков.
Не исключена возможность наступления внематочной беременности в результате наружной миграции яйцеклетки. Это подтверждается выявлением во время операции желтого тела в яичнике на стороне, противоположно!! локализации эктопической беременности.
Повышение протеолитической активности трофобласта ускоряет процесс внедрения оплодотворенной яйцеклетки в слизистую оболочку маточной трубы или вне ее.
Эндокринные заболевания, при которых нарушается функция гипотадамо-гипофизарно-яичниковой системы (заболевания щитовидной железы, надпочечников и др.), также могут привести к нарушению перистальтики маточной трубы.
В развитии эктопической беременности любой локализации принято выделять два этапа – прогрессирование и прерывание беременности.
Клиническая картина и диагностика прогрессирующей трубной беременности
Клиническая картина прогрессирующей трубной беременности (рис. 10.2, см. с. 308), как правило, ничем не отличается от таковой при прогрессирующей маточной беременности, поэтому установить правильный диагноз достаточно сложно. Женщина считает себя беременной. У нее появляются сомнительные и вероятные признаки беременности, отмечаются изменения вкуса и аппетита, могут наблюдаться тошнота, слюнотечение или рвота, задержка менструации, нагрубание молочных желез. При сборе анамнеза удается выявить факторы риска возникновения трубной беременности: инфекционные заболевания, аппендицит, позднее становление менструальной функции и ее нарушения, бесплодие, осложненные роды и аборты, воспалительные заболевания внутренних половых органов, операции на органах малого таза, применение внутриматочной контрацепции.При общем объективном обследовании пациентки никаких признаков трубной беременности не выявляют.
Гинекологическое исследование позволяет обнаружить небольшой цианоз слизистой оболочки влагалища и шейки матки. При двуручном влагалищном исследовании могут быть выявлены размягчение перешейка матки и увеличение тела матки. В области придатков с одной стороны или кзади и сбоку от матки можно определить опухолевидное образование мягковатой консистенции овоидной формы, незначительно болезненное при пальпации. Своды влагалища свободные, глубокие, безболезненные. Смещения шейки матки также безболезненные.
С внедрением в клиническую практику трансвагинальной эхографии возможности диагностики внематочной беременности значительно расширились. В настоящее время трансвагинальное ультразвуковое исследование является первым и обязательным этапом в комплексе дополнительных диагностических мероприятий при подозрении на эктопическую беременность. Трансвагинальная эхография позволяет детально изучить акустическое отражение от матки, ее придатков, углублений малого таза, обеспечить визу-альный контроль кульдоцентеза и тем самым в большинстве наблюдений Установить правильный диагноз на самых ранних этапах обследования. При Ультразвуковом исследовании, которое проводят в случае возникновения подозрения на внематочную беременность, в первую очередь исключают маточную беременность (прогрессирующую или нарушенную).
Патогномоничными ультразвуковыми критериями прогрессирующей внематочной беременности являются увеличение матки в отсутствие органических изменений миометрия или маточной беременности; утолщение срединного М-эха (в результате воздействия трофобластического гормона на эндометрий); выявление в проекции придатков матки (изолированно от яичников) образования с негомогенной эхоструктурой.
Наиболее достоверным акустическим критерием внематочной беременности является обнаружение плодного яйца с живым эмбрионом вне полости матки, т.е. прогрессирующая эктопическая беременность. Однако диагностика прогрессирующей внематочной беременности возможна лишь в 5-8 % случаев, что связано с поздним обращением пациенток (как правило, при появлении признаков прерывания беременности) и сложностью диагностики эктопической имплантации трофобласта на ранних этапах ее развития.
В тех случаях, когда окончательный диагноз невозможно установить на основании результатов клинического и ультразвукового исследований, проводят определение хорионического гонадотропина (ХГ) в моче и крови пациентки.
Хорионический гонадотропин выделяется с мочой уже на 8-й день после оплодотворения. При эктопической беременности, даже при ее прогрессировании, продукция ХГ снижена по сравнению с таковой при маточной беременности.
Более чувствительны методы радиоиммунной диагностики ХГ (особенно В-единицы ХГ) в сыворотке крови, которые позволяют обнаружить его в количестве 1 мМЕ/мл (при иммунологических пробах – 1 МЕ/мл). Если при физиологической беременности малого срока концентрация ХГ в крови увеличивается каждые 2 дня в 2 раза, то при внематочной беременности – лишь незначительно за тот же период.
Диагноз внематочной беременности уточняют при лапароскопии. Лапароскопическая картина прогрессирующей трубной беременности характеризуется выявлением в одном из отделов маточной трубы утолщения округлой или овоидной формы с усиленным сосудистым рисунком.
Прерывание беременности может происходить по типу разрыва маточной трубы или трубного аборта.
Клиническая картина и диагностика прерывания беременности по типу трубного аборта
Как правило, после задержки менструаций (реже в дни менструаций) появляются боли внизу живота и темно-кровяные выделения из влагалища. Болевые ощущения и общее состояние пациентки при прерывании беременности по типу трубного аборта зависят от количества крови, поступающей в брюшную полость. При небольшом количестве крови общее состояние не изменяется, отмечаются ноющие боли внизу живота соответственно локализации трубной беременности слева или справа. Вследствие скопления крови в прямокишечно-маточном пространстве боли иррадиируют в прямую кишку.Поступление значительного количества крови (400-500 мл) в брюшную полость характеризуется резко выраженным болевым симптомом. Боли иррадиируют в прямую кишку, крестец, ногу. В положении лежа на спине боли могут иррадиировать в область ключицы (фре ни кус-симптом), лопатку.
Вo время приступа болей могут отмечаться головокружение, обморочное состояние, иногда рвота.
При общем объективном обследовании у больной наблюдаются бледность кожи и слизистых оболочек, иктеричность склер и желтушное окрашивание ладоней, обусловленное всасыванием продуктов распада крови, излившейся в брюшную полость, в течение длительного времени. При значительной кровопотере отмечаются бледность кожи и видимых слизистых оболочек, частый пульс слабого наполнения, пониженное артериальное давление, снижение уровня гемоглобина. При пальпации молочных желез выявляется большое количество железистой ткани, при надавливании на соски выделяется молозиво. Этот симптом имеет большое значение у первобеременных, так как он указывает на прерывание беременности. У повторнобеременных, особенно у рожавших, отделяемое из сосков диагностического значения не имеет.
Отмечаются вздутие живота и отставание брюшной стенки при дыхании, связанные с наличием крови в брюшной полости. Определяется притупление перкуторного звука в отлогих местах. Живот при пальпации может быть напряжен, отмечается болезненность в нижних отделах, иногда положительный симптом раздражения брюшины.
Гинекологическое исследование позволяет обнаружить цианоз слизистой оболочки влагалища и шейки матки, мажущие темно-коричневые выделения из цервикального канала. Наружный зев шейки матки закрыт. Смещения за шейку матки при двуручном влагалищном исследовании болезненные. Матка увеличена, перешеек размягчен. В области придатков (обычно с одной стороны) пальпируется опухолевидное образование овоидной формы без четких границ и контуров, болезненное, ограниченно подвижное. При наличии крови в брюшной полости задний и соответствующий боковой своды уплощены или даже выпячены, болезненны.
Из дополнительных методов важную информацию могут дать ультразвуковое исследование, пункция заднего свода влагалища, определение концентрации ХГ, лапароскопия.
При подозрении на нарушение внематочной беременности особое внимание при ультразвуковом исследовании уделяют изучению акустического отражения от пузырио-маточного и прямокишечно-маточного пространств для выявления свободной жидкости в брюшной полости, что может свидетельствовать о внутрибрюшном кровотечении.
Пункция заднего свода влагалища – лишь вспомогательный диагностический прием, и результаты ее необходимо оценивать, сопоставляя с другими данными обследования больной. Иногда при трубной беременности не Удается получить кровь в связи с наличием небольшой перитубарной гематомы или организацией сгустков крови. Кроме того, кровоизлияние в брюшную полость может произойти не только при нарушении внематочной беременности, но и при апоплексии яичника. В сомнительных случаях можно провести микроскопическое исследование пунктата для определения плодного яйца.
Иммунологическое определение ХГ при подозрении на внематочную беременность имеет диагностическое значение только при комплексном обследовании больной, позволяя дифференцировать маточную беременность от внематочной. После прерывания беременности хорион отмирает, Продукция ХГ прекращается и, следовательно, иммунологический тест на беременность может быть отрицательным. При исследовании крови можно не выявить каких-либо специфических изменений. При повторных кровоизлияниях в брюшную полость и всасывании крови возникают гипохромная анемия, небольшой сдвиг формулы крови влево, повышение СОЭ.
 Рис. 10.2. Прогрессирующая трубная беременность (материал С.В.Штырова). 1 – матка; 2 – маточная труба с плодным яйцом; 3 – яичник.
Рис. 10.2. Прогрессирующая трубная беременность (материал С.В.Штырова). 1 – матка; 2 – маточная труба с плодным яйцом; 3 – яичник.
 Рис. 10.3. Трубный аборт (материал С.В.Штырова).
1 – матка; 2 – маточная труба с плодным яйцом; 3 – кровь в позадиматочном пространстве; 4 – субсерозный фиброзный узелок матки
Рис. 10.3. Трубный аборт (материал С.В.Штырова).
1 – матка; 2 – маточная труба с плодным яйцом; 3 – кровь в позадиматочном пространстве; 4 – субсерозный фиброзный узелок матки
В том случае, если при пункции брюшной полости характерная кровь (темная, с ворсинами хориона, которые плавают при помещении крови из заднего свода в стакан с водой) не получена, то производят выскабливание слизистой оболочки матки. Результаты гистологического исследования соскоба свидетельствуют о наличии децидуальной реакции без ворсин хориона. Получение подобных результатов, как правило, указывает на внематочную беременность, хотя отсутствие ворсин в выделенной ткани не дает основания для окончательного установления такого диагноза. Децидуальное превращение слизистой оболочки наблюдается не только при беременности, но и при персистирующем желтом теле и текалютеиновых кистах яичника. Ворсины хориона могут быть обнаружены в случае редко наблюдающегося сочетания маточной и внематочной беременности.
Лапароскопия в 100 % случаев позволяет диагностировать внематочную беременность на основании характерных изменений трубы (рис. 10.3).
Клиническая картина и диагностика разрыва маточной трубы
У больной внезапно возникают сильные боли в нижних отделах живота, иррадиирутощие в задний проход и ногу, потеря сознания, иногда шок. Больная вялая, адинамичная, с трудом отвечает на вопросы. При попытке встать или приподняться у нее может повторно произойти потеря сознания.При общем объективном обследовании больной выявляют все признаки острого внутрибрюшного кровотечения: выраженная бледность кожи и слизистых оболочек, пульс частый, слабого наполнения и напряжения, артериальное давление низкое, уровень гемоглобина снижен. Живот резко вздут, при дыхании движения его ограничены. Перкуссия и пальпация живота резко болезненны, в отлогих местах отмечается притупление перкуторного звука, обусловленное наличием крови в брюшной полости. Брюшная стенка напряжена, болезненна, выявляются положительные симптомы раздражения брюшины (клиническая картина острого живота).
При гинекологическом исследовании отмечается цианоз слизистой оболочки влагалища и шейки матки, наружный зев закрыт, кровяные выделения часто отсутствуют. При двуручном влагалищном исследовании отмечаются резкая болезненность при смещении шейки матки, болезненность заднего и боковых сводов влагалища, нависание которых выявляют при пальпации. Из-за сильных болей контурировать матку не всегда удается. Обычно матка несколько увеличена, размягчена и болезненна. Определяется симптом "плавающей матки", заключающийся в ее чрезмерной подвижности, обусловленной большим количеством крови в брюшной полости. Придатки с одной стороны увеличены, без четких контуров, резко болезненны. Клиническая картина при разрыве маточной трубы обычно настолько типичная, что диагностика не вызывает затруднений.
Дополнительные методы исследования, как правило, не используют, так как установить диагноз разрыва трубы нетрудно на основании характерного анамнеза, выраженной клинической картины острого живота и внутрибрюшного кровотечения.
 Рис. 10.4. Плодное яйцо в рудиментарном роге матки.
Рис. 10.4. Плодное яйцо в рудиментарном роге матки.
Клиническая картина и диагностика редких форм внематочной беременности
Признаки прерывания редких форм внематочной беременности схожи с описанной клинической картиной трубной беременности, что затрудняет диагностику.Прерывание яичниковой беременности сопровождается теми же симптомами, что и прерывание трубной беременности. Яичниковая беременность чаще всего прерывается на 6-8-й неделе по типу разрыва плодовместилища с кровотечением в брюшную полость. В клинической картине преобладают симптомы внутреннего кровотечения, перитонита и геморрагического шока. Диагноз обычно устанавливают во время операции.
Беременность в рудиментарном роге матки встречается редко (рис. 10.4). При ее прогрессирующем течении какие-либо симптомы, кроме характерных для беременности, отсутствуют, однако при пальпации матки у одного из углов определяется опухолевидное образование мягковатой консистенции. При прерывании беременности клиническая картина характеризуется обильным внутренним кровотечением и шоком. Большую помощь в установлении правильного диагноза оказывают УЗИ и лапароскопия.
Брюшная беременность клинически протекает так же, как трубная, чаще всего заканчивается разрывом капсулы плодовместилища в ранни сроки с обильным внутренним кровотечением и шоком. До прерывания беременности иногда трудно установить диагноз. При этом важную р А также играет УЗИ. В литературе описаны случаи доношенной брюшной беременности и извлечения живого ребенка при чревосечении.
Шеечная беременность, как правило, проявляется безболезненным крововотечением, возникшим в первой половине беременности. Иногда беспокоят боли в пояснице (не схваткообразные), затрудненное мочеиспускание.
Наиболее характерными признаками шеечной беременности являются оовотечение, значительное увеличение объема шейки матки ("бочкообразной вид"), растяжение и эксцентричное расположение наружного зева вследствие утолщения той части шейки матки, где прикреплено плодное яйцоИногда шейка матки имеет форму яйца, на нижнем полюсе которого расположен наружный зев с тонкими краями. При влагалищном исследовании шейка матки значительно увеличена, иногда по величине больше тела матки, наружный зев приоткрыт. Окончательный диагноз устанавливают с помощью УЗИ, при котором плодное яйцо обнаруживают не в полости, а в шейке матки.
Дифференциальная диагностика эктопической беременности
Прогрессирующую трубную беременность чаще всего дифференцируют от маточной беременности в ранние сроки, хронического воспаления придатков матки (гидросальпинкс), кистозного изменения яичника (ретенционная киста).Отличить прогрессирующую трубную беременность от маточной в ранние сроки на основании анамнеза и результатов объективного (общего и специального) исследования практически невозможно. Заподозрив прогрессирующую трубную беременность на основании отставания увеличения матки в соответствии с предполагаемым сроком беременности и пальпации рядом с маткой колбасовидной пульсирующей "опухоли", следует произвести анализ мочи или, лучше, крови на ХГ, при котором выявляется несоответствие количества этого гормона таковому при данном сроке маточной беременности.
При УЗИ обнаруживают отсутствие в полости матки элементов плодного яйца, которые могут визуализироваться в области придатков матки. Дополнить результаты указанного обследования позволяет динамическое наблюдение, при котором отмечаются увеличение опухолевидного образования в области придатков и отсутствие прогрессирующего увеличения матки. Если данных, подтверждающих матичную беременность, больше, рекомендуется одновременно проводить лечение, направленное на сохранение беременности. В случае неясных результатов указанного исследования производят лапароскопию.
С целью дифференциальной диагностики прогрессирующей трубной беременности и гидросальпинкса или кисты яичника проводят исследования мочи или крови на ХГ (результат будет отрицательным), ультразвуковое сканирование. В неясных случаях показана лапароскопия. Дифференциальную диагностику трубного аборта в отсутствие значительного внутреннего кровотечения проводят с прерыванием маточной беременности в ранние сроки, обострением хронического сальпингоофорита Анефункциональным маточным кровотечением репродуктивного периода, Рекручиванием ножки опухоли яичника, апоплексией яичника, острым аппендицитом.
Чаще всего трубный аборт приходится дифференцировать от прерывания Шчной беременности при небольшом сроке (табл. 10.1).
Трубный аборт 1. Нарушение трубной беременности чаще происходит в ранние сроки (между 4-й и 6-й неделями) 2. Боли локализуются преимуществен-но в одной паховой области. Внача-ле боли тянущие, затем схваткооб-разные. Приступы болей имеют бур-ный характер (внезапное начало, шок, коллапс, обморочное состоя-ние, явления раздражения брюшины) 3. Наружное кровотечение незначительное, часто в виде коричневой мазни, иногда выделяются пленки. Обычно начинается лишь после появления болей 4. Нередко наблюдается отхождение децидуальной оболочки либо целиком, либо в виде мелких обрывков; при рассмотрении ткани в стакане с водой обнаружить ворсинки не удается 5. Степень малокровия не соответствует количеству крови, изливающейся наружу 6. Увеличенная матка имеет грушевидную форму, размер ее не вполне соответствует сроку беременности; зев закрыт
Маточный аборт 1. Самопроизвольное нарушение маточной беременности чаще происходит между 8-й и 12-й неделями 2. Боли схваткообразные, локализуются главным образом внизу живота, посередине и в крестце. Медленное, постепенное нарастание регулярных болей, по характеру напоминающих схватки 3. Наружное кровотечение более обильное, выделения нередко ярко-красного цвета, часто со сгустками; возникает до появления болей 4. Наблюдается отхождение плацентарной ткани, характеризующейся наличием ворсинок, хорошо видимых глазом, когда отошедшую ткань рассмат-ривают на свет в стеклянной посуде 5. Степень малокровия соответствует количеству крови, изливающейся наружу 6. Матка увеличена соответственно сроку беременности, имеет шарообразную форму (при шеечном выкидыше шейка матки принимает бочкообразную форму, а тело матки помещается на нем в виде небольшой "шапки"); зев приоткрыт.
Положительный анализ крови на ХГ (особенно его количественное определение) в случае его высокого содержания позволяет думать о маточной беременности. В случае заинтересованности женщины в сохранении беременности проводят соответствующее лечение в условиях стационара. Подтвердить правильность диагноза маточной беременности возможно с помощью УЗИ.
Прекращение кровяных выделений из влагалища и болей, дальнейший рост матки, увеличение содержания ХГ в моче и крови позволяют уточнить диагноз маточной беременности в течение 1 нед. Если больная не заинтересована в сохранении беременности, то показано выскабливание слизистой оболочки полости матки. При этом следует исключить наличие противопоказаний к этой операции, которыми могут служить признаки подострого или острого воспаления внутренних половых органов.
При трубной беременности после диагностического выскабливания кро-вяные выделения из половых путей не прекращаются, а боли могут усилиться. Обязательно проводят гистологическое исследование соскоба эндометпИЯ, даже если при макроскопическом исследовании он производит впечатление хориальной ткани. При пастозности в области придатков матки, нависании сводов влагалища, болезненности при смещении шейки матки производят пункцию брюшной полости через задний свод влагалища. Пункция может оказаться положительной даже при небольшом количестве крови Б брюшной полости. В случае применения правильной техники и адекватной анестезии эта манипуляция безопасна и имеет достаточно высокую диагностическую ценность. Отрицательный результат пункции не позволяет с уверенностью отвергнуть внематочную беременность. Если после проведенного обследования нет твердой уверенности в диагнозе, то показана лапароскопия.
Отрицательный результат исследования мочи и крови на ХГ или низкое его содержание могут свидетельствовать либо о внематочной беременности, либо о воспалении придатков матки и(или) дисфункциональном маточном кровотечении в репродуктивном периоде. Диагноз воспаления придатков матки подтверждают повышение температуры тела, увеличение СОЭ, лейкоцитоз, сдвиг формулы крови влево. При гинекологическом обследовании выявляют гнойные выделения из половых путей. При пункции брюшной полости через задний свод может быть получен гной. В неясных случаях прибегают к лапароскопии.
Апоплексия яичника, как и трубный аборт, может сопровождаться внутрибрюшным кровотечением. До операции апоплексию яичника распознать трудно. В диагностике помогает тщательное изучение анамнеза и результатов объективного исследования; у больной с апоплексией яичника, как правило, не бывает задержки менструации, а заболевание возникает в дни, близкие к овуляции, или перед очередной менструацией, больная не считает себя беременной (нет признаков беременности).
При нависании сводов влагалища показана пункция брюшной полости через задний свод, а получение крови уточняет диагноз. Если нет признаков массивного кровотечения, то в дальнейшем проводят другие дополнительные исследования. Анализ мочи на ХГ отрицательный. В неясных случаях показана лапароскопия.
Дифференцировать трубный аборт от перекрута ножки кисты или опухоли яичника можно на основании анамнеза, в котором имеются указания на наличие опухоли или кисты яичника и отсутствуют сведения о задержке менструации и других признаках беременности. При гинекологическом исследовании опухоль или киста яичника с перекрутом ножки контурируется более четко, чем труба с плодным яйцом. Из дополнительных методов применяют анализ мочи на ХГ, УЗИ, а при затруднении в установлении Диагноза – лапароскопию.
При приступообразных болях в правой подвздошной области с рвотой симптомами раздражения брюшины, которые бывают при правостороннем бубном выкидыше, можно заподозрить острый аппендицит. При остром аппендиците отсутствуют признаки беременности, нет кровяных выделений, имеются напряжение мышц брюшной стенки, симптомы раздражения брюшины, лейкоцитоз, при пункции брюшной полости крови нет. Диагноз Может быть уточнен при лапароскопии.
Разрыв трубы следует дифференцировать от таких заболеваний, как Апоплексия яичника, перитонит, травма печени и селезенки.
Апоплексия яичника, как и разрыв трубы, может сопровождаться значительным кровотечением в брюшную полость и вызывать симптомы, сходные с симптомами разрыва маточной трубы. В таких случаях до операции бывает трудно уточнить диагноз. Отсутствие признаков беременности позволяет заподозрить апоплексию яичника, но то и другое состояния являются показанием к срочному оперативному вмешательству. При операции уточняют источник кровотечения.
Шеечную беременность необходимо дифференцировать от аборта в ходу, так как тактика лечения при данных видах патологии совершенно разная. Общим симптомом является кровотечение. Однако при аборте в ходу шейка матки кольцевидно симметричная, раскрыта, плодное яйцо при этом можно обойти вокруг зондом, так как оно располагается в цервикальном канале свободно, не связано со стенкой шейки матки. При шеечной беременности этого сделать не удается, а при попытке войти в шеечный канал может усилиться кровотечение. Наружный зев располагается эксцентрично. В установлении диагноза может помочь УЗИ, однако при этом также воз-можны ошибки. Необходимо обратить внимание на внутренний зев шейки матки, который, как правило, закрыт при шеечной беременности и расширен при аборте в ходу.
Дифференциальная диагностика шеечной беременности и рождающегося миоматозного узла основывается на данных анамнеза (наличие миомы в анамнезе, меноррагии) и отсутствии признаков беременности. Больная с миомой матки обычно жалуется на схваткообразные боли в нижних отделах живота, чего не бывает при шеечной беременности.
Лечение при внематочной беременности и восстановление репродуктивной функции
Лечение при внематочной беременности должно быть комплексным. Оно складывается из следующих этапов: 1. операция – остановка кровотечения 2. восстановление кровопотери и борьба с шоком 3. реабилитация репродуктивной функции.В настоящее время оперативное вмешательство является общепринятым методом лечения при внематочной беременности. Если установлен диагноз внематочной беременности, в том числе и прогрессирующей, следует произвести немедленную операцию.
При разрыве маточной трубы или трубном аборте показано экстренное оперативное вмешательство: чревосечение или лапароскопия с последующим удалением маточной трубы. При геморрагическом шоке необходима лапаротомия.
При тяжелом состоянии больной необходимо немедленно начать гемотрансфузию одновременно с другими реанимационными мероприятиями. В короткий период подготовки к операции срочно определяют резус-принадлежность и группу крови больной и после остановки кровотечения приступают к гемотрансфузии.
Способ обезболивания имеет важное значение для успешного проведения операции и реанимационных мероприятий. В настоящее время предпочтение следует отдать современному многокомпонентному эндртрахеальному наркозу с применением миорелаксантов.
При операции по поводу внематочной беременности могут быть произведены как чревосечение, так и лапароскопия. При чревосечении разрез п6редней брюшной стенки обычно выбирает хирург. Следует отметить, что нижнесрединный продольный разрез выполняется проще и быстрее, он обеспечивает лучший обзор органов брюшной полости. Кроме того, если при операции возникают технические затруднения (спайки, сращения и пр ), этот разрез легко можно продлить выше пупка. Однако можно произ-вести и поперечный надлобковый разрез. При тяжелом состоянии больной, повторных чревосечениях, сомнениях в диагнозе, ожирении передней брюшной стенки, безусловно, следует предпочесть нижнесрединный продольный разрез.
После вскрытия париетальной брюшины из брюшной полости начинает изливаться кровь. Для того чтобы она не изливалась через края раны, брюшину берут на зажимы и ассистент поднимает ее кверху. Кровь частично вычерпывают стерильным металлическим стаканчиком или специальной ложкой, но не всю, а лишь ту, которая может излиться через края раны. Кровь сразу же передают помощникам, которые приступают к реинфузии. Не теряя времени на полное удаление крови, следует ввести руку в брюшную полость, захватить и вывести в рану матку и придатки пораженной стороны. Нужно тщательно осмотреть выведенные придатки, так как при беглом осмотре можно сделать ошибочное заключение об отсутствии изменений, что может наблюдаться при очень малых сроках беременности или изгнании плодного яйца в брюшную полость. Убедившись, что действительно имеется трубная беременность, нужно остановить кровотечение.
Чаще всего производят удаление маточной трубы, особенно если имеется разрыв ее стенки. На маточный конец трубы и мезосальпинкс параллельно трубе накладывают зажимы Кохера, после чего кровотечение останавливается. При этом нужно следить за тем, чтобы в зажим не попали собственная связка яичника и круглая маточная связка. Мезосальпинкс пересекают параллельно маточной трубе до угла матки. Затем трубу отсекают от матки, для чего прошивают угол матки иглой и над ней под предварительно наложенным зажимом клиновидно неглубоко иссекают угол матки. После отсечения от матки трубы шов затягивают. Этот шов одновременно служит держалкой. При необходимости дополнительно накладывают восьмиобразный шов. Затем накладывают лигатуру на культю мезосальпинкса. Иссечение интерстициального отдела трубы рекомендуется как профилактика повторной имплантации плодного яйца в этом участке. После удаления трубы производят перитонизацию, для которой используют брюшину, покрывающую круглую связку матки с соответствующей стороны. Для этого, отступя от матки 3-4 см, брюшину круглой связки захватывают зажимом и непрерывным швом подшивают к заднему листку широкой связки в области культи мезосальпинкса, а затем к углу матки, полностью прикрывая культю трубы. Прилокализации плодного яйца в интерстициальном отделе трубы необходимо произвести иссечение этого отдела. В этом случае разрез большой, что зависит от величины плодного яйца; он должен быть тщательно ушит двумя этажами швов и хорошо перитонизирован за счет круглой связки матки. Описанную технику удаления трубы применяют как при разрыве трубы, к и при трубном аборте и прогрессирующей трубной беременности. После окончания перитонизации собирают оставшуюся в брюшной полости кровь, для чего больную нужно перевести из положения Тренделенбурга, чтобы обеспечить стекание крови, скопившейся под диафрагмой, в малый таз После забора крови брюшную полость осушают с помощью марлевых тампонов. При наличии в брюшной полости большого количества крови ц тяжелом состоянии больной необходима инфузия этой крови (реинфузии по жизненным показаниям.
Преимущество реинфузии крови заключается в том, что ее можно переливать сразу после вскрытия брюшной полости без определения группы крови, резус-принадлежности и индивидуальной совместимости. На переливание собственной крови организм не дает никаких реакций, можно переливать большие количества ее, что не всегда безопасно при использовании донорской крови, не говоря уже о том, что не всегда под рукой оказывается нужное количество ее.
Реинфузия крови очень быстро дает положительный результат: гемодинамические показатели восстанавливаются, состояние больной улучшается Однако объем реинфузии не может полностью соответствовать объему кровопотери ввиду частичного свертывания крови, поэтому почти во всех случаях приходится дополнительно переливать некоторое количество компонентов донорской крови.
Реинфузию не производят, если после прерывания внематочной беременности прошло много времени и кровь гемолизирована, а также при небольших кровопотерях. Противопоказаниями к реинфузии являются наличие свежих очагов инфекции в брюшной полости и возможное инфицирование крови.
Техника реинфузии чрезвычайно проста. В набор инструментов для операции должен входить стерильный металлический стаканчик обтекаемой формы с рукояткой или специальная ложка, которую используют, чтобы не травмировать органы брюшной полости при сборе крови. На столе у операционной сестры должен стоять стерильный градуированный сосуд, накрытый стерильной марлей (8 слоев). В сосуд можно добавить небольшое количество натрия цитрата. После вскрытия париетальной брюшины кровь вычерпывают стерильным стаканчиком и переливают через марлю в сосуд для определения ее количества, а затем во флакон, соединенный с системой для переливания, и вводят больной. Имеются специальные аппараты (сепараторы), с помощью которых получают градиенты крови: эритроциты, плазму. Эритроциты вводят внутривенно пациентке.
Необходимо тщательно следить за гемодинамикой и продолжать инфузионную терапию, если больная до операции находилась в состоянии шока. В послеоперационном периоде у этих больных нередко в течение 3-4 дней сохраняются выраженная гиповолемия и анемия, поэтому приходится прибегать к повторным гемотрансфузиям. При этом донорскую цельную кровь используют редко, так как лучше вводить свежезамороженную плазму и эритроцитнуто массу. Обычно вводятся и кровезаменители: реополиглюкин, раствор Рингера – Локка, 5 % раствор глюкозы и др.
Важно проведение антибактериальной терапии, чтобы предотвратить развитие инфекционного процесса, поскольку организм больной ослаблен вследствие кровопотери и анемии. Необходимо вводить обезболивающие средства. Для профилактики тромбоэмболических осложнений показано активное ведение больных – раннее вставание (если нет противопоказаний). Через 10-12 ч после окончания операции больным разрешается поверНуться на бок, на 2-е сутки – ходить. Такое активное ведение послеопепаиионного периода является надежной профилактикой тромбоэмболических осложнений.
Рекомендуются лечебная физкультура и дыхательная гимнастика, для которой можно использовать резиновые надувные игрушки.
В последние годы при хирургическом лечении внематочной беременности широко используют лапароскопию. Необходимым условием для проведения лапароскопических операций является стабильная гемодинамика пациентки. Улучшение ранней диагностики эктопической беременности позволяет во многих случаях произвести органосохраняющие операции (не удалять маточную трубу) и тем самым повысить частоту восстановления репродуктивной функции.
Удаление маточной трубы во время лапароскопии производят у пациенток, не заинтересованных в сохранении детородной функции, или при невозможности выполнения пластической операции. Маточную трубу захватывают зубчатым диссектором, приподнимают, прошивают, аспирируют кровь и сгустки. Атравмэтический зажим, соединенный с источником монополярной коагуляции, накладывают на мезосальпинкс и коагулируют его. Вместо коагуляции на мезосальпинкс и трубу за плодовместилищем можно наложить несколько кетгутовых (или синтетических) нераспускающихся петель. Ножницами или игольчатым диссектором в режиме "резание" пересекают мезосальпинкс выше области коагуляции или затянутой петли. При коагуляции этапы повторяют до полного отсечения маточной трубы. Кровоточащие участки коагулируют. Удаленную маточную трубу извлекают через троакар диаметром 11 мм. При больших размерах ее предварительно рассекают. Операцию заканчивают промыванием брюшной полости и аспирацией крови, жидкости и мелких кусочков ткани.
С целью сохранения органа можно произвести сальпинготомию или резекцию трубы. При сальпинготомии маточную трубу захватывают атравматическим зажимом. Точечным коагулятором продольно коагулируют место предполагаемого разреза трубы над плодным яйцом. Маточную трубу вскрывают монополярным электродом или ножницами на протяжении 2-3 см. Плодное яйцо удаляют вакуум-аспиратором или при помощи щипцов. Плодовместилище промывают изотоническим раствором натрия хлорида, кровоточащие участки коагулируют. Дефект трубы оставляют открытым. Заживление трубы происходит вторичным натяжением. В послеоперационном периоде необходим контроль за содержанием ХГ, так как в стенке трубы могут оставаться элементы хориона. Исследование осуществляют 2 раза в неделю до снижения уровня ХГ ниже 10 мМЕ/мл.
При невозможности произвести сальпинготомию и наличии одной трубы выполняют резекцию измененного участка трубы с помощью только коагулятора или в сочетании с ножницами. В дальнейшем проходимость маточной трубы восстанавливают посредством микрохирургической пластикиЛ Естественно, резекция трубы, сальпинготомия и проведение пластической операции возможны и при лапаротомии. Преимуществом лапароскопии является значительное уменьшение операционной травмы (нет разреза передней брюшной стенки, отсутствуют травматические контакты с кишечником и брюшиной), значительно меньше выражен в последующем спаечный процесс, хороший косметический эффект. При лапароскопии затрачивается меньше времени на операцию, снижается продолжительность койко-дня, быстрее восстанавливается работоспособность. Через 2-3 дня после операции пациентка может быть выписана из стационара.
Маточная беременность после операций на маточных трубах отмечается в 55 – 70 % случаев, после повторной внематочной беременности – в 10-30 %. Частота бесплодия и повторной эктопической беременности увеличивается при измененной второй маточной трубе.
Исследования последних лет доказали возможность консервативного лечения при прогрессирующей внематочной беременности цитостатическим препаратом метотрексатом, простагландинами, антигестагенным препаратом RU-486 и др. Наиболее широкое применение получил метотрексат, который используют при трофобластической болезни. Его можно вводить интраамниально (под контролем трансвагинальной эхографии или при лапароскопии) либо внутрь, либо внутримышечно. Лечение метотрексатом вызывает резорбцию плодного яйца, не затрагивая неповрежденную стенку маточной трубы, проходимость которой сохраняется. Критерием эффективности лечения является изменение уровня р-ХГ в крови, который определяют через день в свободные от инъекций метотрексата дни до снижения его до 10 мМЕ/мл. Терапию считают успешной при снижении уровня ХГ в двух последовательных анализах на 20 % и более.
При локализации плодного яйца в яичнике обычно обнаруживают увеличение яичника и кровоизлияние в нем с разрывом поверхностных тканей. Желательно резецировать яичник в пределах здоровых тканей с наложением отдельных кетгутовых швов для гемостаза. Перитонизацию не производят. При поражении всей ткани яичника приходится удалять его полностью вместе с маточной трубой. При удовлетворительном состоянии больной можно выполнить операцию путем лапароскопии.
Беременность в рудиментарном роге матки обнаруживают в виде образования, связанного с телом матки тонкой ножкой на уровне внутреннего зева. Операция заключается в удалении рудиментарного рога вместе с маточной трубой на этой же стороне. Круглую связку матки, отсеченную от рудиментарного рога, пришивают к дну основного тела матки.
При межсвязочном расположении плодовместшшща приходится удалять его вместе с маточной трубой, при этом анатомические соотношения резко нарушены. После удаления плодного яйца из ложа в клетчатке параметрия может возникнуть сильное паренхиматозное кровотечение, которое иногда трудно остановить. Следует помнить об анатомической близости мочеточника и возможности его повреждения. После удаления трубы и плодовместилища сшивают листки широкой связки матки.
При брюшной беременности выполнение оперативного вмешательства сопряжено со значительными трудностями. Техника операции обычно зависит от места прикрепления плаценты. Вмешательство состоит в удалении плодовместилища и проведении гемостаза, которое нередко затруднено, особенно если плацента прикреплена к кишке или ее брыжейке. Эта операция чрезвычайно сложна при поздних сроках беременности. Хирург должен быть готов к вмешательству на соседних органах. В брюшной полости образуются плотные сращения между органами, развивается обширная сосудистая сеть. Операция нередко сопровождается массивным кровотечени-ем. Однако нужно стремиться к полному удалению плодного мешка. Если это не удается, то проводят тампонаду сальником, либо марлевыми салфетками с выведением их из раны (тампонада по Микуличу).
Особенности реабилитации после органосохраняющих операций на маточных трубах заключаются во вливании в трубу, начиная со 2-го дня, лекарственных растворов (антибиотики, гидрокортизон) через выведенный на брюшную стенку протектор, который рекомендуется оставлять в трубе на 2 нед.
Лечение при шеечной беременности заключается в экстирпации матки. Попытка удаления плодного яйца инструментальными методами вызывает обильное кровотечение и приводит к летальному исходу. Установление диагноза шеечной беременности при наличии кровотечения является абсолютным показанием к экстирпации матки. При прогрессирующей шеечной беременности без кровотечения в последние годы с успехом применяют лечение метотрексатом. В плодное яйцо вводят 50 мл препарата, затем, так же как и при прогрессирующей трубной беременности, метотрексат вводят внутримышечно в дозе 1 мг/кг через день (4 инъекции) под контролем уровня р-ХГ в крови. Эффективным лечение считают в случае уменьшения содержания р-ХГ на 20 % при повторных анализах.
Своевременная диагностика и правильно выбранное лечение улучшают прогноз при эктопической беременности в отношении как здоровья больных, так и их репродуктивной функции.
Раннее начато реабилитационных мероприятий и дифференцированный подход к лечению позволяют восстановить репродуктивную функцию у 70 % больных, перенесших внематочную беременность. Рекомендуется контрацепция механическими средствами до восстановления хорошей проходимости труб.
Реабилитация после операции и профилактика повторной эктопической беременности должны включать в себя комплекс лечебно-диагностических мероприятий. При этом важны раннее начало (до выписки больной из стационара) и дифференцированный подход к лечению. Со 2-го дня после операции начинают проводить неспецифическую терапию: общеукрепляющую, гемостимулирующую, десенсибилизирующую. С 5-го дня применяют УВЧ-терапию (5 сеансов), а затем электрофорез цинка сульфата. Возможно применение низкой нтенсивного лазерного облучения.
Глава 11. Переношенная беременность
Переношенной считают беременность, продолжительность которой превышает 42 нед (294 дня) и заканчивается рождением ребенка с признаками перезрелости. Роды при переношенной беременности называют запоздалыми. Помимо истинного перенашивания, возможна пролонгированная, физиологически удлиненная беременность, при которой ребенок рождается без признаков перенашивания, при этом отсутствуют выраженные инволютивные процессы в плаценте. Ввиду индивидуальных особенностей скорости созревания плода признаки переношенности у ребенка и в плаценте могут появиться и до 42 нед беременности.Истинное перенашивание беременности отмечается в 2-42 % случаев; такие широкие колебания объясняются отсутствием единого мнения о начале перенашивания и сложностью определения истинной продолжительности беременности.
Переношенная беременность – тяжелое осложнение и для плода, и для матери. Вследствие морфологических изменений в плаценте развивается плацентарная недостаточность, приводящая к гипоксии плода.
В связи с большей зрелостью центральной нервной системы у переношенных плодов повышена чувствительность их к гипоксии и родовым травмам. Этому способствуют также большие размеры головки и отсутствие способности ее к конфигурации (плотные кости черепа, узкие швы и роднички). Частыми осложнениями у ребенка являются синдром дыхательных расстройств и пневмопатии (внутриутробная аспирация околоплодными водами, разрушение сурфактанта в легких переношенного плода).
Нарушение проницаемости и защитной функции плаценты нередко сопровождается внутриутробным инфицированием.
При перенашивании значительно увеличивается перинатальная смертность (в 1,5-2 раза), в большей мере за счет интранатальной гибели плода. Перенашивание способствует нарушению функции ЦНС у ребенка в отдаленном периоде жизни: отставание в физическом и нервно-психическом развитии детей.
В процессе родов у матери нередко наблюдаются аномалии родовой деятельности, кровотечение в третьем периоде родов и в раннем послеродовом периоде. При перенашивании возрастает частота оперативных вмешательств.
Этиология и патогенез.
Причины перенашивания беременности изучены недостаточно. Известно, что перенашиванию способствуют нейроэндокринные заболевания, ожирение. Перенашивание может повторяться при каждой последующей беременности. У первородящих старше 30 лет перенашивание наблюдается чаше. Полагают, что перенашиванию могут способствовать нарушения любого из механизмов, которые играют ведушУ роль в подготовке и развитии родовой деятельности, вследствие функциональных сдвигов в деятельности ЦНС, а также вегетативных и эндокринных механизмов.
Факторами, приводящими к перенашиванию беременности, являются недостаточная перестройка в ЦНС (отсутствие своевременного формирования родовой доминанты) и нарушение вегетативного равновесия (преобладание тонуса парасимпатической нервной системы).
При перенашивании беременности нередко отмечаются изменения соотношений гонадотропных гормонов, прогестерона, снижение уровня эстрогенов, особенно активного эстриола, калия, кальция, ацетилхолина. При переношенной беременности выявляется наиболее низкий суммарный уровень эстрогенов, в основном за счет эстриола, в 2 раза снижена экскреция катехоламинов. Соотношение норадреналина и адреналина в крови возрастает до 0,73 (в норме 0,47), что отражает нарушения деятельности симпатико-адреналовой системы. Определенное значение имеют изменения в матке, снижающие ее возбудимость и сократительную активность: недостаточное количество рецепторов к окситотическим веществам, нарушение синтеза сократительных белков в миометрии. Нередко это связано с перенесенными абортами и воспалительными заболеваниями.
В перенашивании играет роль наличие у беременной аутоиммунной патологии, эндокринно-обменных нарушений, эмоциональной напряженности. Важное значение имеют запоздалое или диссоциированное созревание плаценты, хроническая плацентарная недостаточность, а также сохранение плацентарной иммунологической толерантности, препятствующей иммунологическому отторжению плода в срок родов. При выраженном перенашивании в крови беременных отсутствуют киллеры против клеток плода, сохраняется высокая продукция клеток-супрессоров. Одной из причин изменения иммунного статуса может быть генетически обусловленная несовместимость матери и плода (родственный брак), что способствует длительной задержке плода в матке.
Причинами перенашивания беременности плода могут быть пороки развития ЦНС плода (анэнцефалия, гидроцефалия, микроцефалия, нарушение развития гипофизарно-надпочечниковой системы, поликистоз почек, болезнь Дауна). Пороки развития плода сопровождаются снижением синтеза кортикостероидных гормонов, от которых зависят каскадный выброс простагландинов и развитие родовой деятельности. Подтверждением роли плода в генезе перенашивания беременности является увеличение частоты пороков развития плода, которые наблюдаются в 10-15 раз чаще, чем при доношенной беременности.
Патогенез перенашивания в большой мере определяется изменениями в плаценте, которые в последующем отражаются на состоянии плода. Макроскопически наблюдается увеличение массы плаценты при уменьшении ее толщины. Поверхность плаценты суховатая, границы между дольками стертые, нечеткие. Может отмечаться прокрашивание тканей плаценты, оболочек, пуповины мекониальными зелеными водами. На поверхности плаценты видны белые инфаркты, кальцификаты, участки жирового перерождения. Соотношение массы плаценты и массы плода при переношенной беремен-ности составляет 1,67 (при доношенной беременности 1,62).
При микроскопическом исследовании плаценты выявляются характерные для инволютивных процессов особенности: распространенные склеротические изменения стромы ворсин и стенок сосудов; дистрофические изменения концевых и стволовых ворсин; повышенное отложение фибриноидного слоя; обеднение концевых ворсин капиллярами; морфологические признаки нарушения кровотока и ишемии.
Результаты морфологических и гистохимических исследований плаценты при перенашивании свидетельствуют о снижении активности окислительно-восстановительных процессов, уменьшении содержания гликогена функционально активных липидов, РНК, нейтральных мукополисахаридов.
При дистрофических процессах увеличивается трансплацентарный переход белков "зоны беременности" через поврежденные клеточные мембраны и микроканалы плаценты, повышается уровень этих белков в сыворотке крови и снижается в тканях плаценты; отмечается снижение уровня термостабильной плацентарной щелочной фосфатазы, которая регулирует энергетический обмен, что также обусловливает функциональную недостаточность плаценты; снижается уровень трофобластического р-глобулина и связанного с беременностью р2-глобулина, вследствие чего уменьшаются продукция эстрогенов и насыщение ими организма.
Характерными особенностями переношенной беременности являются уменьшение количества и изменения свойств околоплодных вод. При перенашивании беременности на одну неделю количество околоплодных вод уменьшается в среднем на 100-200 мл, составляя 600-700 мл (в норме 800-900 мл). В 42 нед беременности количество околоплодных вод в 2 раза меньше, чем в норме (350-400), а при перенашивании на 3 нед и более наблюдается резко выраженное маловодие (200 – 300 мл). Далеко зашедшее перенашивание (44 нед и более) характеризуется практически полным отсутствием околоплодных вод (их количество может составлять 40-60 мл).
При перенашивании изменяются прозрачность и состав околоплодных вод. При легких степенях перенашивания беременности воды становятся опалесцирующими, беловатыми вследствие растворения в них сыровидной смазки и поверхностных слоев кожи плода. При гипоксии плода и наличии мекония в околоплодных водах последние имеют зеленую или даже желтую окраску (присутствие мекония из верхних отделов кишечника плода).
Изменен фосфолипидный состав околоплодных вод. Соотношение содержания лецитина и сфигмомиелина, определяющего образование сурфактанта в легких плода, нарушено и составляет 1:1,8; 3:1,2 и более. При соотношении 1:4 у переношенного плода разрушается сурфактантная система легких, что вызывает синдром дыхательных расстройств и образование гиалиновых мембран в легких у новорожденного.
С уменьшением количества и изменением физико-химических свойств околоплодных вод понижается их бактерицидность, увеличивается количество бактерий, вследствие чего повышается риск развития внутриутробной пневмонии у плода.
Изменения в плаценте, количества и качества околоплодных вод, уменьшение количества вартонова студня в пуповине (тощая пуповина) отражаются на состоянии плода и новорожденного. При сдавлении тошей пуповины в процессе родов легко нарушается п у повинный кровоток. Нарушения кровотока, микроциркуляции в плаценте, повышенная вязкость крови, микротромбозы, гиперкоагуляция в системе плацента – плод приводят к централизации кровообращения у плода, когда для сохранения жизни происходит перераспределение кровотока. При этом в жизненно важных органах (мозг, сердце, печень) кровоток сохраняется в ущерб кровоснабжению ко и› мышц, кишечника, почек и др. Вследствие уменьшения почечного кровотока плода экскреция мочи снижается в 2 раза по сравнению с нормой.
При нахождении плода в матке 42 нед и более его кожные покровы начинают терять первородную смазку. С утратой этого защитного слоя кожа непосредственно контактирует с околоплодными водами и сморщивается. Рост волос и ногтевых пластинок продолжается; по мере перенашивания беременности происходит потеря подкожной жировой клетчатки. При попадании мекония в амниотическую жидкость кожа плода приобретает зеленоватую или желтоватую окраску.
При перенашивании беременности плод нередко крупный, размеры головки приближаются к верхней границе нормы или превышают ее. Однако масса переношенного новорожденного может быть и небольшой вследствие развивающейся внутриутробной задержки роста плода. Длина плода при перенашивании превышает нормальные показатели и составляет 54-56 см и более.
Следствием внутриутробной кислородной недостаточности являются снижение сократительной функции миокарда, нарушение ряда обменных процессов у плода и в дальнейшем – асинхронное развитие ребенка.
Вследствие гипоксии при перенашивании развивается метаболический ацидоз, происходят накопление кислых продуктов обмена в крови плода и нарушение ферментативных процессов, развивается тканевая гипоксия. Клетки печени плода теряют способность утилизировать кислород. Хроническая кислородная недостаточность сопровождается повышенной проницаемостью стенок сосудов у плода, что способствует развитию отека мозга, расстройству мозгового кровообращения.
При перенашивании возрастает частота гестоза, внутриутробного инфицирования плода, что может привести даже к его внутриутробной гибели. Нередким и особенно опасным осложнением при перенашивании является преждевременная отслойка нормально расположенной плаценты как следствие дегенеративных изменений быстро стареющей плаценты.
По мере увеличения срока беременности нарастают изменения в плаценте и у плода, но полного параллелизма между ними нет.
Клиническая картина и диагностика
Диагноз переношенной беременности устанавливают с учетом совокупности результатов обследования. Большое значение имеют тщательное ознакомление с анамнезом (срок последней менструации, предполагаемое время овуляции, первое шевеление плода), систематическое наблюдение за беременной в женской консультации, проведение дополнительных исследований (амниоскопия, кардиотокография, ультразвуковое сканирование плода и Плаценты, допплерометрическая оценка кровотока в сосудах системы мать – плацента – плод).Объективные признаки, свидетельствующие о перенашивании беременности, наблюдаются как у матери, так и у плода. У матери выявляют следующие признаки перенашивания: 1. уменьшение окружности живота после 40-й недели беременности (косвенное свидетельство уменьшения количества околоплодных вод); 2. увеличение высоты дна матки из-за более крупных размеров плода и гипертонуса нижнего сегмента, высокого расположения предлежащей части плода; 3. снижение эстрогенной насыщенности организма: уменьшение содержания в крови эстрадиола, плацентарного лактогена, кортикостероидов, трофобластического В-глобулина.
Характерные признаки перенашивания беременности, наблюдаемые у плода, определяются его хронической гипоксией. Отмечаются усиление или ослабление двигательной активности плода; изменение частоты и ритма сердечных сокращений – монотонный ритм сердца при кардиотокографии, снижение параметров биофизического профиля плода.
К характерным ультразвуковым признакам переношенной беременности относятся уменьшение толщины плаценты и наличие в ней структурных изменений (петрификаты, кисты), маловодие, отсутствие прироста биометрических параметров плода при динамическом исследовании, утолщение костей черепа, снижение двигательной активности, отсутствие дыхательных движений плода. При этом основное внимание уделяют структуре плаценты и степени выраженности маловодия. После 40 нед беременности УЗИ рекомендуется проводить 2 раза в неделю для своевременного выявления уменьшения объема околоплодных вод и появления петрификатов в пла-центе. К 42 нед беременности, как правило, наблюдается выраженное уменьшение количества амниотической жидкости, при этом наибольший вертикальный размер кармана свободного от эхоструктур плода участка околоплодных вод составляет менее 2 см. В ряде наблюдений изменяется эхографическая характеристика околоплодных вод: визуализируется мелкодисперсная эхопозитивная взвесь, что обусловлено примесью сыровидной смазки, пушковых волос и эпидермиса, а также, возможно, мекония.
При допплерометрическом исследовании регистрируется разной степени выраженности снижение маточно-плацентарного и плодово-плацентарного кровотока, свидетельствующее о гипоксии плода.
При амниоскопии отмечаются уменьшение прозрачности и изменение цвета околоплодных вод: беловатая окраска или зеленый цвет как следствие наличия мекония в околоплодных водах, при исследовании которых выявляются нарушения их биохимического состава (повышение концентрации общего белка и глюкозы, уровня креатинина, лактата, щелочной фосфатазы, изменение соотношения лецитин/сфигмомиелин).
Важно дифференцировать переношенную и пролонгированную беременность, при этом следует учитывать клинические данные и результаты специальных исследований: электрокардиографии, УЗИ, амниоскопии, амниоцентеза и др.
При пролонгированной беременности нередко отмечаются крупные размеры плода, отсутствуют изменения сердечной деятельности плода на КТГ; при УЗИ не выявляют выраженных признаков старения плаценты и маловодия, контуры головки обычные; при амниоскопии обнаруживают достаточное количество вод, которые не опалесцируют; при амниоцентезе околоплодные воды обычной окраски, в них достаточное количество хлопьев, не отмечается снижения концентрации суммарных эстрогенов, содержания общего белка и др.
У ребенка, рожденного при пролонгированной беременности, нет признаков переношен ности.
Ведение беременности
Ведение беременности при перенашивании имеет особенности. При сроке беременности 41 нед, отсутствии признаков родовой деятельности, недостаточной готовности организма беременной к родам (незрелая или недостаточно зрелая шейка матки, гипотонус и снижение возбудимости матки) показана госпитализация в родильный дом в связи с необходимостью детального обследования, постоянного наблюдения за состоянием матери и плода, подготовки к родоразрешению.В стационаре решают вопрос о сроке и методе родоразрешения (через естественные родовые пути или путем кесарева сечения). Для этого необходимо: 1. установить наличие и степень перенашивания беременности (срок беременности, предполагаемый срок родов, число дней или недель перенашивания); 2. оценить состояние плода по результатам объективного и дополнительных исследований (КТГ, УЗИ, допплерометрическая оценка кровотока) ; 3. определить состояние плаценты: соответствие ультразвуковых признаков зрелости плаценты гестационному сроку, наличие патологических структурных изменений в плаценте, степень маловодия; 4. установить степень готовности шейки матки к родам (зрелая, недостаточно зрелая, незрелая); 5. определить размеры плода и размеры таза матери.
При перенашивании беременности в сочетании с другими неблагоприятными факторами, такими как возраст первородящей более 30 лет, крупный или гипотрофичный плод, отсутствие готовности шейки матки к родам, хроническая гипоксия плода, тазовое предлежание, отягощенный акушерско-гинекологический анамнез (бесплодие, индуцированная беременность, мертворождение, наличие в семье травмированного во время родов ребенка), показано плановое кесарево сечение.
При благоприятной акушерской ситуации (соразмерность головки плода и таза матери, головное предлежание), удовлетворительном состоянии плода и отсутствии других отягощающих факторов необходимо подготовить шейку матки к родам. С этой целью используют эстрогены по 30 000 – 60 000 ЕД, Раствор глюкозы с витаминами (5,0 мл 5 % раствора аскорбиновой кислоты, I мл 1 % раствора витамина В6, 150 мг ко карбоксил азы) или (что более эффективно) препараты простагландина Е2 (препидил-гель, содержащий и›6 мг динопростона). С помощью специального шприца препидил-гель вводят в шейку матки на всю длину вплоть до внутреннего зева, но не выше (попадание геля в полость матки может вызвать ее чрезмерную активность и несвоевременное излитие околоплодных вод). Через 6-12 ч, как правило достигается полное созревание шейки матки. При недостаточном эффекте можно повторить введение геля.
В период подготовки организма беременной и плода к родам назначают также галаскорбин по 1 г 3 раза в день, фолиевую кислоту по 0,002 г 2 раза, линетол по 30 мг 1 раз, витамин Е 1,2 мл 1 % раствора натрия аденозинтрифосфата (АТФ) внутримышечно. Необходимо обеспечить полноценный сон в течение не менее 8-10 ч (седуксен, реланиум, сибазон).
Течение и ведение родов
При пролонгированной беременности или небольшом перенашивании роды нередко протекают нормально, но требуют особого внимания (кардиомониторный контроль за состоянием плода и сократительной активностью матки, функциональная оценка таза). Запоздалые роды часто сопровождаются осложнениями: длительный патологический прелиминарный период, дородовое или раннее излитие околоплодных вод, слабость или дискоординация родовой деятельности, затяжное течение родов, повышенная частота кровотечений в последовом и раннем послеродовом периодах, а также патология отделения и выделения последа.В процессе родов важна оценка акушерской ситуации для решения вопроса о возможности ведения родов через естественные родовые пути: характер родовой деятельности, соразмерность плода и таза матери, предлежание плода, механизм родов. Следует также учитывать анамнез, наличие сопутствующей экстра ген итальной или нейроэндокринной патологии, осложнений настоящей беременности (маловодие, обвитие пуповины вокруг щей и туловища плода).
Для родовозбуждения используют амниотомию, а в отсутствие эффекта через 2-3 ч внутривенно капельно вводят окситоцин или простагландин F2a и Е2 или их сочетание. При выявлении слабости родовой деятельности применяют соответствующие меры по борьбе с этим осложнением. В случае отсутствия эффекта от стимуляции в течение 3 ч следует ставить вопрос о родоразрешении путем кесарева сечения.
При ведении запоздалых родов необходимо систематически проводить мероприятия по профилактике гипоксии плода. Если решено применить выжидательную тактику, то во время родов, в периодах раскрытия и изгнания плода, осуществляют постоянное кардиомониторное наблюдение за состоянием плода и сократительной деятельностью матки.
В родах необходимо оценить функциональную полноценность плодного пузыря, так как из-за маловодия может иметь место плоский плодный пузырь. Плоский плодный пузырь вскрывают. В связи с большими размерами и плохой конфигурацией головки переношенного плода особое внимание уделяют функциональной оценке таза в процессе родов.
При выявлении мекония в околоплодных водах особую опасность представляет аспирация околоплодными водами, поэтому в родах проводят медикаментозную защиту плода (2 мл 1 % раствора седуксена) или решают вопрос об оперативном родоразрешении.
С целью профилактики родового травматизма матери и плода целесообразно применять эпидуральную и(или) пудендальную анестезию, рассечение промежности.
Особого внимания заслуживает ведение последового и раннего послеродового периодов в тех случаях, когда может начаться кровотечение. Для профилактики кровотечения при запоздалых родах необходимо внутривенно одномоментно вводить 1 мл метилэргометрина либо сочетание метилэргометрина (0,5 мл) и окситоцина (0,5 мл) в одном шприце с последующим внутривенным капельным введением окситоцина на протяжении раннего послеродового периода (1 – 3 ч).
Показаниями к пересмотру тактики ведения родов и переходу от консервативной терапии к кесареву сечению являются: 1. выявление диспропорции плода и таза матери, неправильное вставление головки; 2. ухудшение состояния плода в процессе родов (усугубление гипоксии); 3. аномалии родовой деятельности, начавшаяся преждевременная отслойка плаценты и другие осложнения.
После рождения ребенка диагноз перенашивания беременности верифицируют на основании выявления признаков перезрелости у новорожденного и соответствующих патоморфологических изменений в плаценте. Классический синдром Беллентайна – Рунге включает следующие признаки перенашивания: 1. отсутствие пушковых волос; 2. отсутствие казеозной смазки; 3. повышенная плотность костей черепа (затруднение конфигурации головки в родах); 4. узость швов и родничков; 5. удлинение ногтей; 6. зеленоватый оттенок кожи; 7. сухая "пергаментная" мацерированная кожа; 8. "банные" ладони и стопы; 9. снижение тургора кожи; 10. слабая выраженность слоя подкожной жировой клетчатки.
При осмотре последа и оболочек видны характерные для перенашивания изменения: жировое перерождение, кальцификаты, желто-зеленое прокрашивание оболочек. Послед необходимо направить на патогистологическое исследование.
При запоздалых родах необходима полная готовность к оказанию неотложной помощи новорожденному, который может родиться в асфиксии.
Глава 12. Экстрагенитальные и сопутствующие гинекологические заболевания при беременности
Экстрагенитальные и сопутствующие гинекологические заболевания могут влиять на течение беременности, родов, перинатальную заболеваемость, В свою очередь беременность и роды нередко отягощают течение основного заболевания, В связи с этим в данном разделе приведены сведения о течении беременности и родов при различных заболеваниях. Некоторые из них являются противопоказанием к сохранению беременности. В настоящее время благодаря внедрению в медицину новых технологий, совершенствованию лекарственных препаратов показания к сохранению беременности при экстрагенитальной патологии расширились. Однако врачебный контроль за беременной с тем или иным заболеванием должен проводиться особенно тщательно.Заболевания сердечно-сосудистой системы
Гипертоническая болезнь
Гипертоническая болезнь наблюдается у 4 – 5 % беременных. Данная патология и ее осложнения, возникающие во время беременности, занимают важное место в структуре материнской и перинатальной заболеваемости и смертности. У большинства беременных гипертоническая болезнь развивается до беременности, но может впервые проявиться во время нее. О наличии артериальной гипертензии свидетельствует артериальное давление, превышающее 140/90 мм рт.ст. Течение гипертонической болезни у беременных может быть различным. В I триместре у Уз больных артериальное давление снижается и создается впечатление относительного благополучия. В дальнейшем у большинства беременных оно стойко повышается и на этом фоне могут развиваться такие осложнения, как гестоз (в 78 %), плацентарная недостаточность, внутриутробная задержка развития плода, хроническая гипоксия, преждевременная отслойка нормально расположенной плаценты, гипертензивная энцефалопатия, нарушение мозгового кровообращения, массивные коагулопатические кровотечения в послеродовом периоде. Все это обусловило выделение больных с гипертонической болезнью в группу повышенного риска материнской и перинатальной заболеваемости и смертности.
Для решения вопроса о возможности продолжения беременности › женщин с гипертонической болезнью М.М.Шехтман выделил три степени риска. Гипертоническая болезнь I стадии относится к I степени риска, II стадия – ко II степени, III стадии и злокачественная артериальная гипертензия – к III степени. При I степени риска беременность, как правило, заканчивается благоприятно, при II степени на фоне адекватного лечения можно довести беременность до благополучного конца. При Ш степени риска беременность противопоказана.
При I степени риска беременные нуждаются в осмотре терапевтом и акушером 2 раза в месяц. В случае присоединения гестоза показано стационарное лечение. В случае установления II или III степени риска при беременности до 12 нед необходимо провести стационарное обследование женшины для уточнения стадии заболевания и решения вопроса о продолжении беременности.
Лечение. Во время беременности проводят лечение гипертонической болезни. Основным методом лечения является применение антигипертензивных средств. Использование ряда из них ограничено из-за неблагоприятного влияния на плод, поэтому разработанные в настоящее время эффективные схемы антигипертензивного лечения не всегда можно применять у беременных. Особое значение у беременных приобретает немедикаментозная терапия (седативная физиотерапия, фитотерапия, корректировка питания, ограничение приема поваренной соли – менее 6 г в сутки).
Из медикаментозных средств у беременных используют диуретики, спазмолитики, антагонисты ионов кальция, стимуляторы адренергических рецепторов, вазодилататоры, ганглиоблокаторы. Из диуретиков предпочтение следует отдавать калийсберегаюшим препаратам: триамтерену (по 25-50 мг/сут), спиронолактону (по 25-50 мг/сут) или тиазидовому диуретику индапамиду (по 2,5 мг/сут), который обладает натрийуретическим эффектом и способствует периферической вазодилатации, не уменьшая сердечного выброса и числа сердечных сокращений. Диуретики применяют курсами по 1-3 дня через 7-10 сут.
Согласно современным представлениям, спазмолитики (дибазол, папаверин, но-шпа, эуфиллин) дают слабый гипотензивный эффект по сравнению с остальными вновь предложенными препаратами. Однако в связи с отсутствием отрицательного влияния спазмолитических средств на плод они незаменимы у беременных. При этом спазмолитики лучше действуют при парентеральном введении, особенно при купировании гипертонических кризов.
В настоящее время в качестве препаратов первой ступени все шире используют антагонисты ионов кальция дигидропиридинового ряда. Из этой группы лекарственных средств во время беременности целесообразно применять препараты второго поколения (норвакс, ломир, форидон), которые оказывают высокоспецифичное действие, характеризуются длительным периодом полувыведения и очень небольшим числом побочных эффектов. Антагонист ионов кальция первого поколения нифедипин противопоказан при беременности.
Стимуляторы адренергических рецепторов (клофелин по 0,250 – 0,500 мг/сут, метилдопа до 1500 мг/сут) широко применяют во время беременности благодаря их эффективности и отсутствию отрицательного влияния на плод.
Из вазодилататоров во время беременности чаще всего используют гидралазин (апрессин) по 100-200 мг/сут при гипертоническом кризе или при диастолическом давлении выше 100-110 мм рт.ст.
Ганглиоблокаторы (пентамин, бензогексоний) дают побочные эффекты, влияют на функцию кишечника у плода и могут стать причиной кишечной непроходимости у новорожденного. Эти препараты применяются только во время родов для достижения быстрого кратковременного снижения артериального давления.
Лечение гипертонической болезни у беременных осуществляют по тем же принципам, что и у небеременных. При гипертонической болезни I стадии чаще проводят монотерапию, при II стадии назначают комбинации двух или трех гипотензивных препаратов с различным механизмом действия. Одновременно проводят мероприятия, направленные на нормализацию микроциркуляции и профилактику плацентарной недостаточности. При развитии на фоне гипертонической болезни гестоза или плацентарной недостаточности назначают весь лечебный комплекс, применяемый при этих осложнениях беременности.
Родоразрешение у женщин с гипертонической болезнью чаще всего осуществляют через естественные родовые пути на фоне обезболивания и гипотензивной терапии.Кесарево сечение производят по акушерским показаниям или при состояниях, угрожающих здоровью и жизни матери (отслойка сетчатки, расстройство мозгового кровообращения и т.д.).
Артериальная гипотензия
Артериальная гипотензия характеризуется снижением артериального давления ниже 100/60 мм рт.ст. вследствие нарушения сосудистого тонуса; она наблюдается у 12 % беременных. Артериальная гипотензия может возникать во время беременности (обычно в первые месяцы) или предшествовать ей.
Причина артериальной гипотензии беременных точно не установлена. Ее возникновение объясняют относительной недостаточностью функции коры надпочечников и симпатико-адреналовой системы, угнетением функции яичников, изменением соотношения вазоактивных простагландинов во время беременности. В зависимости от течения выделяют три стадии артериальной гипотензии: компенсированную, субкомпенсированную, декомпенсированную. Компенсированная стадия заболевания проявляется только снижением артериального давления. При субкомпенсированной стадии болезни возникает разнообразная субъективная и объективная симптоматика. Декомпенсированная стадия характеризуется гипотоническими кризами.
Клиническая картина.
При артериальной гипотензии беременные предъявляют жалобы на головную боль, головокружение, слабость, сердцебиение, боли и другие неприятные ощущения в области сердца, потливость, ослабление памяти, снижение трудоспособности. Нередко у беременной появляются раздражительность, эмоциональная неустойчивость, склонность к пониженному настроению.
Женщины с артериальной гипотензией чаще астенического телосложения с бледной кожей. Почти у половины из них наблюдается варикозное расширение вен. Руки и ноги на ощупь холодные, пульс лабильный, слабого наполнения и напряжения, нередко отмечаются брадикардия, увеличение левого желудочка сердца, систолический шум на верхушке. Однако у большинства больных при перкуссии и аускультации сердца патологии не выявляют. Специфические изменения на ЭКГ отсутствуют. Минутный объем крови увеличен, а периферическое сопротивление кровотоку уменьшено неадекватно, вследствие чего артериальное давление снижается.
Гипотонические кризы протекают как коллаптоидные состояния, длящиеся несколько минут. Во время криза артериальное давление снижается до 80/50 мм рт.ст. и ниже. Отмечаются усиление головной боли и головокружения, резкая слабость, чувство закладывания в ушах, может возникнуть рвота, кожа и слизистые оболочки бледнеют, выступает холодный пот.
При артериальной гипотензии течение беременности осложняется гестозом. При гестозе у больных с артериальной гипотензией артериальное давление может не превышать нормальных цифр (120/80 мм рт.ст.), однако оно будет на 30 мм рт.ст. выше исходного, что принято считать патологией. Чаше, чем у здоровых женщин, у беременных с артериальной гипотензией возникает токсикоз в ранние сроки.
При артериальной гипотензии в 3-5 раз чаще, чем у здоровых беременных, наблюдаются угроза прерывания беременности и преждевременные роды.
Только у 25 % больных с артериальной гипотензией отмечается физиологическое течение родов. Осложнения родов обусловлены нарушением сократительной деятельности матки. При сочетании артериальной гипотензии со слабостью родовой деятельности часто развивается гипоксия плода.
Опасным осложнением при данной патологии является кровотечение в последовом и раннем послеродовом периодах. Оно может быть обусловлено как нарушением сократительной деятельности матки, так и снижением свертывающей способности крови (уменьшение содержания фибриногена плазмы, количества тромбоцитов и их адгезивной способности, повышение фибринолитической активности крови). При кровотечении у больных с артериальной гипотензией геморрагический шок развивается раньше и про-текает тяжелее, чем при нормотонии.
Артериальная гипотензия, даже декомпенсированная (это бывает редко, обычно в конце беременности), не является показанием к прерыванию беременности.
Лечение.
При лечении артериальной гипотензии важное значение придают соблюдению режима труда и отдыха. Необходимо освобождение от работ в ночную смену, а также связанных с физическим и эмоциональным перенапряжением. Целесообразна лечебная физкультура. Питание должно быть полноценным, разнообразным с содержанием в пище витаминов и белковых продуктов до 1,5 г на I кг массы тела. Основным в лечении артериальной гипотензии является использование общеукрепляющих и тонизирующих препаратов, которые целесообразно применять с учетом гемоДинамического варианта болезни. При сниженном тонусе периферических сосудов и малоизмененном сердечном выбросе (эукинетический вариант) беременным назначают седативные средства (валериана), 40 % раствор глюкозы по 20-40 мл, комплекс витаминов, а также средства, оказывающие возбуждающее действие на ЦНС: настойки женьшеня, китайского лимонника, элеутерококка по 20 капель 2-3 раза в день за 20 мин до еды, апилак по 1 таблетке (0,001 г) 3 раза в сутки под язык. Указанное лечение проводят, как правило, амбулаторно тремя курсами по 10-15 дней.
При снижении артериального давления вследствие уменьшения сердечного выброса (гипокинетический вариант кровообращения) патогенетически обосновано назначение средств, способствующих увеличению объема крови. К их числу относится изадрин, избирательно стимулирующий (3-адренорецепторы миокарда. Изадрин применяют в таблетках, содержащих ,005 г препарата, сублингвально 3 раза в день в течение 10-14 дней, назначают также препараты, улучшающие метаболические процессы в миокарде (рибоксин, панангин, аскорбиновая кислота, витамины Вь В2, В6). Учитывая благоприятное действие оксигенотерапии, беременным назначают сеансы гипербарической оксигенации.
При гипотонических кризах, вызванных значительным снижением артериального давления, иногда достаточно ввести подкожно 0,5 мл 5 % раствора эфедрина гидрохлорида, а затем 1 мл 10 % раствора кофеина или 1 мл кордиамина.
У беременных с артериальной гипотензией период подготовки к родам носит затяжной характер; для его укорочения следует применять кальция хлорид, глюкозу, эстрогены, витамины, по показаниям медикаментозный сон. отдых, а не стремиться к немедленному назначению средств, возбуждающих родовую деятельность. Замедленное развитие родовой деятельности у рожениц с артериальной гипотензией может быть ошибочно принято за первичную слабость родовой деятельности. Родостимуляция в таких случаях влечет за собой дискоординацию родовых сил. Роженицы с артериальной гипотензией плохо переносят кровопотерю, у них может возникнуть геморрагический шок даже при сравнительно небольшом кровотечении, поэтому рекомендуется проводить профилактику кровотечения в последовом и раннем послеродовом периодах.
Заболевания вен
Варикозная болезнь нижних конечностей
Варикозная болезнь развивается при стойком необратимом расширении и удлинении вен вследствие грубых патологических изменений их стенок и клапанного аппарата.
Этиология и патогенез.
Среди женщин, страдающих варикозной болезнью, примерно 70-90 % связывают появление заболевания с беременностью. Данная патология встречается в среднем у 20 – 40 % беременных. Появление расширенных вен у беременных объясняют недостаточным содержанием в организме эстрогенов и увеличением при беременности уровня прогестерона и релаксина, оказывающих расслабляющее действие на мышечную стенку вен. Кроме того, прогестерон угнетает выработку гормонов задней доли гипофиза, тонизирующих гладкие мышечные волокна. Следствием этого является снижение тонуса мускулатуры стенки сосудов матки, мочевого пузыря, кишечника и других органов. Определенную роль в развитии заболевания играет нарушенный гормональный фон до беременности.
Немаловажными факторами, способствующими развитию варикозной болезни при беременности, являются также увеличение массы циркулирующей крови, повышение венозного давления, замедление кровотока в нижних конечностях.
Некоторые авторы придают существенное значение в возникновении варикозной болезни у беременных иммунологическим механизмам, играющим важную роль в развитии не только функциональных, но и структурных нарушений в сосудах.
Развитию первичного расширения вен при беременности может способствовать низкая локализация или предлежание плаценты.
Снижение тонуса венозной стенки приводит к возникновению дилатации сосудов и клапанной недостаточности подкожных и глубоких вен нижних конечностей с развитием коллатералей в области наружных половых органов.
Клиническая картина
Клинические проявления зависят от локализации поражения, формы и стадии заболевания. Могут быть поражены подкожные вены нижних конечностей, а также наружных половых органов, влагалища, прямой кишки, органов малого таза, кожи живота, молочных желез, ягодиц. Различают две формы варикозной болезни: неосложненную и осложненную (кровотечением, тромбофлебитом подкожных вен, острым тромбозом глубоких вен, аллергическим дерматитом, экземой, лекарственной аллергией, рожистым воспалением, варикозной язвой). Обычно беременные жалуются на боли, быструю утомляемость при ходьбе, тяжесть в ногах и отеки. Возникшее в начале беременности расширение подкожных вен имеет тенденцию к постоянному прогрессированию. Подкожные вены нижних конечностей четко контурируются, стенки их напряжены. Расширение вен в области половых губ, влагалища и паха возникает у 3,7 % женщин. В этом случае заболевание сопровождается болями и ощущением распирания в области половых органов, а также расширением вен влагалища.
Диагностика.
Обычно несложна и основывается на данных анамнеза и клинической картине. Результаты флебографии и других исследований (гемодинамические функциональные пробы, комплексное ультразвуковое исследование, включающее ангиосканирование и допплерографию) позволяют уточнить характер заболевания.
Лечение.
Различают три основных метода лечения варикозной болезни нижних конечностей: консервативное, инъекционно-склерозирующее и хирургическое. Сторонники консервативного метода лечения считают, что с прекращением беременности расширение подкожных вен уменьшается или исчезает. В связи с этим беременным рекомендуют периодически принимать горизонтальное положение с приподнятыми нижними конечностями и поддерживать эластическую компрессию (эластичные бинты, чулки или колготки). Эластическая компрессия способствует сдавлению подкожных вен, уменьшению застойных явлений и увеличению (в 3-5 раз) скорости кровотока. Помимо эластической компрессии, беременным рекомендуют лечебную физкультуру и самомассаж в сочетании с правильным режимом труда и отдыха, диету, направленную на профилактику запоров. Для повышения тонуса сосудов назначают эскузан (по 12-15 капель 3 раза в день), гливенол (по 0,4 г 2 раза в день), венорутон (по 0,3 г 2 раза в день), троксевазин (по 0,3 г 2-3 раза в день), детралекс (по 1-2 таблетки в день), гинкор форте (по 1 капсуле 2 раза в день). Перечисленные препараты оказывают ангиопротективное действие, нормализуют проницаемость капилляров, уменьшают агрегацию тромбоцитов, что приводит к уменьшению отечного и болевого синдромов, регрессии трофических нарушений, уменьшению или исчезновению парестезии и судорог, В I триместре беременности следует соблюдать осторожность при приеме гливенола и венорутона, а в период лактации не рекомендуют принимать детралекс. Кроме того, при беременности показано периодическое применение витаминов, особенно С РР, а также глюконата кальция.
Инъекционно-склерозируюшую терапию при беременности, как правило, не применяют.
При выраженном расширении вен, сопровождающемся недостаточностью клапанов подкожных или коммуникантных вен, следует ставить вопрос о хирургическом лечении.
Ведение беременности и родов.
Варикозная болезнь нижних конечностей не является противопоказанием к пролонгированию беременности. Следует лишь проводить профилактические мероприятия по предупреждению тромботических и тромбоэмболических осложнений.
Роды у беременных с варикозной болезнью нередко осложняются дородовым излитием околоплодных вод, слабостью родовой деятельности, преждевременной отслойкой плаценты, кровотечением в последовом и раннем послеродовом периодах.
Выбор метода родоразрешения зависит от акушерской ситуации. По возможности предпочтение следует отдавать ведению родов через естественные родовые пути. Обязательным мероприятием является эластическое бинтование обеих ног для предупреждения рефлюкса крови в них во время потуг. Вопрос о необходимости дезагрегантной и антикоагулянтной терапии в конце беременности решают в зависимости от состояния системы гемостаза. При патологической гиперкоагуляции и наличии признаков внутрисосудистого свертывания крови следует начать антикоагулянтную (гепарин) и дезагрегантную (декстраны, ацетилсалициловая кислота, трентал, курантил) терапию. С лечебно-профилактической целью 5000 ЕД гепарина могут быть введены в первом периоде родов за 2-4 ч до ожидаемого рождения плода или за 2 ч до выполнения кесарева сечения. Наряду с обычным гепарином получили распространение низкомолекулярные гепарины (фраксипарин, фрагмин, тропарин, кливарин, клексан и др.), которые ингибируют свертывание крови на более ранних стадиях. Дезагрегантную терапию (ацетилсалициловая кислота по 0,125 г в день, трентал по 100-200 мг 3 раза в день, реополиглюкин по 400 мл внутривенно капельно), начатую до родов, продолжают и в послеродовом периоде.
В послеродовом периоде родильницам рекомендуют раннее вставание, лечебную физкультуру, обязательную эластическую компрессию обеих ног. В случаях оперативного родоразрешения и при наличии выраженной гиперкоагуляции дезагрегантная терапия и гепаринотерапия должны быть продолжены в послеродовом периоде (5000 ЕД гепарина через 6 ч после родов, в дальнейшем – каждые 8 ч в течение 5-7 дней). Дозы гепарина 15 000 – 20 000 ЕД в сутки считают мини-дозами, поэтому ежедневный контроль за системой гемостаза не требуется. На 3-4-й день после родов рекомендуется произвести повторно гемостазиограмму, ангиосканирование и допплерографию, чтобы своевременно выявить снижение венозного кровотока в нижних конечностях. При выраженной варикозной болезни родильницу должен осмотреть хирург для решения вопроса о дальнейшем лечении.
Тромбозы вен, тромбофлебиты, тромбоэмболии
Тромбозы вен.
В последние годы наметилась тенденция к увеличению частоты возникновения тромбозов и тромбоэмболии во время беременности, в родах и в послеродовом периоде. Отмечено, что тромбоз глубоких вен и тромбоэмболия легочной артерии во время беременности наблюдаются в 5-6 раз чаще, чем у небеременных женщин, а после родов – в 3-6 раз чаше, чем до родов. Частота тромбоэмболических осложнений в акушерстве варьирует от 0,6 до 5,0 на 1000 беременных.
Осложняя течение беременности, родов и послеродового периода, тромботические и тромбоэмболические осложнения создают реальную угрозу для здоровья матери и плода, ведут к увеличению материнской летальности и перинатальной смертности.
Этиология и патогенез.
Причины возникновения тромбоза были определены еще Р.Вирховым (1856): 1. нарушение скорости кровотока (стаз); 2. повреждение стенки сосудов (эндотелия); 3. изменение состава крови, т.е. повышение ее свертываемости.
Затруднение венозного оттока из нижних конечностей при беременности обусловлено в основном тремя причинами: 1. давлением увеличенной матки на подвздошные сосуды; 2. увеличением оттока крови от плацентарного отдела матки, что приводит к перегрузке внутренней и общей подвздошных вен и нарушению оттока крови из нижних конечностей; 3. снижением тонуса венозной стенки и физиологическим расширением вен, что обусловливает развитие относительной клапанной недостаточности и рефлюкс крови в дистальные отделы конечности.
В возникновении тромбозов большое значение имеет операционная и родовая травмы, так как при этом из тканей в кровоток поступает тканевый тромбопластин, запускающий внешний механизм внутрисосудистого свертывания крови.
Внутрисосудистую активацию системы гемостаза может вызвать токсическое повреждение эндотелия сосуда инфекционными агентами и/или аллергенами через реакцию антиген – антитело, вследствие чего снижаются антитромботические свойства внутренней оболочки (интимы) сосудов. Особенно выражены изменения в системе свертывания крови у беременных, у которых до беременности имелись врожденные или приобретенные нарушения в системе гемостаза.
Тромбофлебит поверхностных вен.
Клиническая картина.
Заболевание характеризуется наличием гиперемии кожи, уплотнением и болезненностью по ходу вены, локальной гипертермией. Общее состояние пациенток удовлетворительное, температура тела чаще субфебрильная, у многих больных наблюдается ступенеобразное нарастание пульса (симптом Малера), в крови – незначительные изменения или умеренный лейкоцитоз со сдвигом лейкоцитарной формулы влево, СОЭ несколько повышена.
Диагностика тромбофлебита поверхностных вен обычно несложна, трудности могут возникнуть при восходящей форме заболевания, когда истинная протяженность тромбоза не соответствует определяемому клинически. Определить проксимальный уровень тромбоза и исключить бессимптомно протекающий тромбоз глубоких вен можно на основании результатов Комплексного ультразвукового исследования сосудов нижних конечностей, включающего ангиосканирование и допплерографию.
Лечение.
Выбор тактики лечения зависит от локализации тромбоза.
При развитии тромботического процесса на голени и нижней трети бедра Применяют консервативную терапию. В случае восходящего тромбофлебита большой подкожной вены из-за опасности тромбоэмболии следует производить перевязку большой подкожной вены бедра в области сафенофеморального соустья (операция Троянова – Тренделенбурга).
Консервативная терапия включает местное и общее воздействие на патологический процесс.
В качестве местной терапии используют холод в течение первых 2-3 дней, мазевые аппликации (гепариновая, троксевазиновая или бутадиеновая мазь), эластическую компрессию нижних конечностей и их возвышенное положение во время сна.
Общая терапия включает назначение следующих препаратов: противо-воспалительных и дезагрегантных (бутадион по 0,15 г 3 раза в сутки, реопирин по 5 мл внутримышечно или по 1 таблетке 3 раза в сутки, теоникол по 0,15 г 3 раза в сутки, ацетилсалициловая кислота по 0,125 г в сутки); десенсибилизирующих (димедрол по 0,05 г, пипольфен по 0,025 г, супрастин по 0,025 г или тавегил по 0,001 г 2 раза в сутки); улучшающих микроциркуляцию и оказывающих флебодинамическое действие (троксевазин по 5 мл 10 % раствора внутримышечно или по 0,3 г 3 раза в сутки внутрь, эскузан по 12-15 капель 3 раза в сутки). Применение антибиотиков при тромбофлебите нецелесообразно, так как данное заболевание является разновидностью асептического воспаления. Кроме того, большинство антибактериальных препаратов вызывает изменение системы гемостаза, приводя к гиперкоагуляции. Гепаринотерапию назначают в случае выявления с помощью гемостазиограммы патологической гиперкоагуляции, а также при тяжелых тромбоэмболических осложнениях в анамнезе. Наряду с обычным гепарином могут быть применены и его низкомолекулярные аналоги (тропарин, фрагмин, фраксипарин, кливарин, клексан и др.). Применение низкомолекулярных гепаринов позволяет уменьшить кратность инъекций до 1-2 раз в сутки.
Ведение родов.
Проведенное при беременности эффективное лечение тромбофлебита поверхностных вен дает возможность вести роды, ориентируясь в основном на акушерскую ситуацию. Для того чтобы избежать прогрессирования тромботического процесса, важно провести роды бережно, с тщательным обезболиванием. Всем роженицам следует проводить эластическое бинтование обеих ног для уменьшения венозного застоя и предупреждения рефлюкса крови во время потуг. Во втором – третьем периодах родов в качестве дезагрегантной терапии целесообразно использовать внутривенное капельное введение 400 мл реополиглюкина. Профилактику и лечение гипоксии плода следует осуществлять общепринятыми методами, исключая из комплекса применяемых лекарственных средств аскорбиновую кислоту в связи с ее свойствами повышать свертываемость крови.
Ведение послеродового периода.
В послеродовом периоде должна быть продолжена эластическая компрессия обеих нижних конечностей. Рекомендуются раннее вставание и лечебная физкультура. У всех родильниц необходимо ежедневно осматривать обе ноги, пальпировать подкожные вены, проверять наличие симптомов Хоманса и Мозеса. На 3-4-й день после родов целесообразно провести комплексное УЗИ сосудов нижних конечностей, включающее ангиосканирование и допплерографию.
В тех случаях, когда с момента возникновения заболевания до родов прошло менее 4 нед, в послеродовом периоде должна быть продолжена дезагрегантная терапия: трентал по 0,1 г 3 раза в сутки, курантил по 0,025 Г 3 раза в сутки, ацетилсалициловая кислота по 0,125 г в сутки. Родильницам, у которых высок риск развития рецидива заболевания, а также перенесшим оперативное родоразрешение, через 6 ч после родов следует назначить гепаринотерапию. Дозу гепарина подбирают индивидуально с учетом показателей гемостазиограммы.
При выписке из стационара всем пациенткам рекомендуют эластическую компрессию нижних конечностей, ограничение статических нагрузок, а также наблюдение у хирурга поликлиники.
Тромбоз глубоких вен.
Клиническая картина.
Ранними клиническими проявлениями глубокого венозного тромбоза являются боли, возникающие в икроножных мышцах, в подколенной ямке либо на бедре и в паху по ходу сосудистого пучка. Обращают на себя внимание вегетативные симптомы: частый пульс, несоответствие частоты пульса и температурной кривой, озноб. Пораженная конечность увеличивается в объеме, изменяется окраска кожи, отмечается локальное повышение ее температуры.
Уточнение диагноза необходимо проводить совместно с хирургом.
Лечение.
Всем больным назначают комплексную антитромботическую терапию (антикоагулянты, дезагреганты, вазопротекторы, неспецифические противовоспалительные средства) с обязательной эластической компрессией обеих нижних конечностей и применением холода в течение первых 3 дней. В состав комплексной терапии должен входить гепарин, который применяют по приведенной выше схеме. Антикоагулянты непрямого действия беременным назначать не следует из-за их тератогенного действия. Кроме того, проникая трансплацентарно, эти препараты могут вызвать геморрагии в самой плаценте или геморрагический синдром у плода, приводя к его внутриутробной гибели или аборту.
Описанным лечением можно ограничиться, если нет прямой угрозы тромбоэмболии легочной артерии (ТЭЛА). Обнаружение при ангиографическом исследовании флотирующего тромба магистральной вены свидетельствует о наличии потенциального источника ТЭЛА и является сигналом для немедленного проведения консультации хирурга с целью хирургической профилактики этого грозного осложнения. При этом решают вопрос об установлении кава-фильтра или пликации нижней полой вены.
Тактика врача зависит от срока беременности и наличия акушерской патологии. В I триместре в случае предпринятого ангиографического исследования беременность должна быть прервана ввиду перенесенного облучения плода и необходимости длительной гепаринотерапии. Искусственный аборт производят после имплантации кава-фильтра в случаях эмболоопасного тромбоза на фоне лечения гепарином, дозу которого к этому моменту снижают. После аборта назначают непрямые антикоагулянты (фенилин), а гепарин постепенно отменяют.
Беременность может быть пролонгирована у больных с глубоким венозным тромбозом, развившимся в I триместре, в тех случаях, когда диагноз был подтвержден при УЗИ и ангиография не потребовалась.
Во II триместре вопрос о прерывании беременности решить значительно сложнее, поэтому подходить к нему следует осторожно. Не следует сохранять беременность, протекающую с угрозой прерывания, а также при прогрессирующей гипоксии плода. В остальных случаях беременность может быть пролонгирована.
Беременность у пациенток с тромбозом глубоких вен, развившимся в III триместре, прерывать не следует, за исключением тех случаев, когда имеется сопутствующая акушерская патология, при которой требуется экстренное родоразрешение (отслойка плаценты, тяжелые формы гестоза и т.п.).
Ведение родов.
При родоразрешении больных, перенесших тромбоз глубоких вен нужно учитывать, с одной стороны, степень активности тромботического процесса и характер тромбоза, с другой – акушерскую ситуацию. В каждом случае вопрос должен быть решен индивидуально. Если тромбоз не был эмболоопасным (окклюзивный), то родоразрешение может быть произведено как через естественные родовые пути, так и путем кесарева сечения, в зависимости от акушерской ситуации. Поскольку операция вызывает гораздо более выраженные изменения в системе гемостаза, предпочтение следует отдавать ведению родов через естественные родовые пути, проводя дезагрегантную терапию. Введение гепарина следует прекратить за 6 ч до ожидаемых родов и возобновить через 6 ч после них. При наличии у пациентки эмболоопасного (флотирующего) тромбоза родоразрешение через естественные родовые пути возможно лишь после имплантации кавафильтра. Если кава-фильтр не установлен, то родоразрешение должно быть оперативным – кесарево сечение в сочетании с пликацией нижней полой вены механическим швом на фоне комплексной антитромботической терапии.
В послеродовом периоде всем родильницам должны быть продолжены дезагрегантная терапия и эластическая компрессия нижних конечностей, рекомендована ранняя активизация и лечебная физкультура. Пациенткам, получавшим до родов гепарин, а также перенесшим операцию, в послеродовом периоде антикоагулянтная терапия должна быть продолжена.
При выписке из стационара следует рекомендовать эластическую компрессию нижних конечностей в течение 1,5-2 лет, ограничение физических и длительных статических нагрузок, наблюдение у хирурга поликлиники.
Тромбоэмболия легочных артерий.
Клиническая картина этого осложнения во многом определяется объемом эмболической окклюзии. В случае массивной тромбоэмболии (легочный ствол и/или главные легочные артерии) возникает синдром острой сердечно-легочной недостаточности с болями в груди и внезапной потерей сознания. При осмотре больных обычно выявляют цианоз кожи лица, набухание и пульсацию яремных вен, учащенное и поверхностное дыхание, артериальную гипотензию, тахикардию. Наряду с этим эмболия сегментарных и даже легочных артерий обычно проявляется легочно-плевральным синдромом. В таких случаях отмечают неспецифические симптомы: боли в груди, усиливающиеся при дыхании, гипертермию, кашель.
Диагностика.
При обследовании пациенток с подозрением на ТЭЛА в первую очередь должны быть произведены электрокардиография и обзорная рентгенография органов грудной клетки.
На рентгенограмме грудной клетки при массивной ТЗЛА отмечают расширение правых отделов сердца и верхней полой вены, возможны обеднение легочного рисунка и высокое стояние куполов диафрагмы. При тромбоэмболии периферических легочных артерий рентгенологически определяют симптомы инфарктной пневмонии, которая развивается, как правило, через 2-3 сут после эпизода эмболии.
Если диагноз ТЭЛА после такого обследования не исключен, то дальнейшее обследование следует проводить в ангиохирургическом отделении.
Лечение.
Его проводят сосудистые хирурги. У беременных и родильниц могут быть применены все общепризнанные методы лечения: эмболэктомия из легочных артерий, тромболитическая и комплексная антитромботическая терапия.
Акушерская тактика у беременных с ТЭЛА зависит от тяжести их состояния и срока беременности. При возникновении ТЭЛА в I триместре после лечения беременность следует прервать в связи с тяжелым состоянием больной, облучением плода и необходимостью продолжительной антикоагулянтной терапии. В случае возникновения ТЭЛА во 11 – 111 триместре вопрос о сохранении беременности нужно решать индивидуально в зависимости от состояния беременной и жизнеспособности плода. При успешном лечении ТЭЛА и удовлетворительном состоянии больных беременность можно сохранить. В случае тяжелого состояния беременной, а также при прогрессирующем ухудшении функционального состояния плода беременность следует прервать.
Ведение родов и послеродового периода.
При родоразрешении следует учитывать следующие моменты: тяжесть состояния беременной, был ли установлен кава-фильтр с целью профилактики рецидива ТЭЛА, а также наличие акушерской и экстрагенитальной патологии. При тяжелом состоянии пациентки родоразрешение должно быть произведено путем кесарева сечения. Показанием к кесареву сечению является также отсутствие у больной кава-фильтра. В таком случае вслед за кесаревым сечением сосудистый хирург выполняет пликацию нижней полой вены механическим швом. Кроме того, показанием к оперативному родоразрешению является сочетание экстрагенитальной и акушерской патологии. При удовлетворительном состоянии больных, когда с момента возникновения ТЭЛА до родов прошло более 1 мес и гемодинамические показатели стабилизировались, при наличии установленного кава-фильтра роды могут быть проведены через естественные родовые пути. При этом следует широко применять анальге-тики и спазмолитики, продолжать дезагрегантную терапию и эластическую компрессию обеих нижних конечностей, а для облегчения потуг целесообразно произвести перинеотомию.
В послеродовом периоде должна быть продолжена гепаринотерапия с постепенным переходом на антикоагулянты непрямого действия, которые длительно (до 6 мес) принимают и после выписки из стационара под контролем хирурга и кардиолога поликлиники. В дальнейшем регулярно проводят курсы реабилитационной терапии и осуществляют индивидуальный подбор контрацептивов, учитывая, что гормональная контрацепция противопоказана. В будущем, прежде чем планировать беременность, необ-ходимо провести тщательное обследование, включая исследование системы гемостаза.
Пороки сердца
Прогноз беременности и родов у женщин с приобретенными или врожденными пороками сердца определяется следующими факторами: 1. формой порока; 2. степенью сердечной недостаточности и активностью ревматического процесса, послужившего причиной возникновения порока сердца.
У беременных после операции на сердце прогноз зависит от эффективности хирургического лечения и степени сердечной недостаточности. Материнская летальность при пороках сердца составляет 1 – 1,5 %, перинатальная смертность – 25-30 %.
Приобретенные ревматические пороки сердца
Приобретенные пороки сердца встречаются у 7-8 % беременных. Для прогнозирования исходов беременности и родов при приобретенных пороках имеют значение следующие факторы: 1. активность ревматического процесса; 2. форма и стадия развития порока; 3. компенсация или декомпенсация кровообращения; 4. степень легочной гипертензии; 5. нарушение сердечного ритма; 6. присоединение акушерской патологии.
Все эти факторы определяют выбор акушерской тактики во время беременности, родов и в послеродовом периоде.
Во время беременности необходимо уточнить степень активности ревматического процесса, так как она определяет акушерскую тактику, служит критерием при решении вопроса о том, сохранить или прерывать беременность.
Определить активность ревматического процесса у беременных очень сложно, поскольку он чаще имеет затяжное или латентное течение и не дает выраженных клинических проявлений. Большинство исследователей считают, что беременность подавляет ревматическую активность.
Во время беременности и в послеродовом периоде ревматический процесс при обострении протекает волнообразно. Критические периоды обострения ревматизма соответствуют ранним срокам беременности – до 14 нед, 20-32 нед и послеродовому периоду. В связи с преобладанием стертых форм ревматизма определение его активности во время беременности на основании результатов клинических, гематологических и иммунологических исследований затруднено. Определенную диагностическую ценность представляют цитологический и иммунофлюоресцентный методы, применяемые в последнее время.
Течение беременности на фоне активного ревматического процесса весьма неблагоприятно, поэтому рекомендуется ее прерывание (искусственный аборт) в ранние сроки с последующим проведением антиревматической терапии. В поздние сроки беременности предпринимают досрочное родоразрешение. В этом случае наиболее щадящим методом родоразрешения является кесарево сечение с проведением противорецидивной терапии. Женщин, перенесших последнее обострение ревматизма в ближайшие 2 года до наступления беременности, следует относить к группе высокого риска обострения процесса.
Стеноз левого предсердно-желудочкового отверстия (митральный стеноз).
Примерно у 85 % беременных с митральным стенозом отмечаются признаки сердечной недостаточности. Наиболее часто они появляются или начинают нарастать с 12-20-й недели беременности. Восстановление гемодинамики у родильниц начинается лишь через 2 нед после родов.
Тактика ведения беременности при митральном стенозе зависит от степени сужения предсердно-жслудочкового отверстия. При митральном стенозе I степени беременность может быть сохранена в отсутствие обострения ревматического процесса, сердечной недостаточности и нарушения сердечного ритма. При выраженном митральном стенозе (II и III степени), когда диаметр предсердно-желудочкового отверстия 1,5 см или меньше, беременность противопоказана. В анамнезе у таких пациенток, как правило, имеются указания на острый отек легких, кровохарканье, частые пневмонии. При сужении II и III степени наблюдаются сердечная недостаточность, тахикардия, тахипноз, застойные хрипы в легких, увеличение печени, имеется опасность развития отека легких. При этом ни один способ родоразрешения (наложение акушерских щипцов, кесарево сечение) не помогает его купировать. У пациенток с митральным стенозом II-III степени беременность следует прервать в ранние сроки и рекомендовать в последующем митральную комиссуротомию. Если больная категорически настаивает на сохранении беременности, то ее пролонгирование допустимо только на фоне стационарного лечения и при обеспечении возможности выполнения операции на сердце во время беременности.
Недостаточность левого предсердно-желудочкового клапана (митральная недостаточность).
Беременность и роды при этой патологии протекают без существенных осложнений. При чрезмерно выраженной митральной недостаточности со значительной регургитацией крови и резким увеличением левого желудочка беременность протекает тяжело и может осложниться развитием острой левожелудочковой недостаточности. У таких женщин в ранние сроки беременности появляются или нарастают признаки сердечной недостаточности, к которым, как правило, присоединяется гестоз. Сохранение беременности в этих условиях нецелесообразно. После прерывания беременности больной рекомендуется консультация кардиохирурга.
Комбинированный митральный порок сердца является противопоказанием к беременности у больных с признаками декомпенсации сердечной деятельности.
Стеноз устья аорты (аортальный стеноз).
Среди приобретенных пороков сердца у беременных это заболевание заслуживает особого внимания. Беременность и роды можно допустить лишь в отсутствие выраженных признаков гипертрофии левого желудочка и симптомов недостаточности кровообращения, поскольку компенсация порока происходит за счет концентрической гипертрофии мышцы левого желудочка и утолщения его стенки. В случае тяжелого течения аортального стеноза, когда необходима хирургическая коррекция порока – замена пораженного клапана протезом, вопрос о возможности вынашивания беременности решают после операции.
Недостаточность клапана аорты (аортальная недостаточность).
По сравнению с аортальным стенозом аортальная недостаточность является менее тяжелым пороком, так как при ней длительное время сохраняется компенсация кровообращения. Однако в связи с изменениями гемодинамики вследствие беременности и частым присоединением гестоза течение аортальной недостаточности может быть более тяжелым.
У больных с аортальными пороками сердца беременность и роды через стественные родовые пути допустимы только в стадии компенсации кровообращения. При симптомах сердечной недостаточности беременность недопустима.
Тактика ведения беременных с приобретенными ревматическими пороками сердца.
Л.В.Ванина (1961) предложила различать четыре степени риска неблагоприятного исхода беременности у больных с пороками сердца. Эта классификация разработана с учетом функциональной способности сердца степени активности ревматического процесса и наличия тех или иных осложнений (легочная гипертензия, мерцательная аритмия и др.).
Классификация степени риска неблагоприятного исхода беременности у больных с пороками сердца 1. степень I – беременность при пороке сердца без выраженных признаков сердечной недостаточности и обострения ревматического процесса; 2. степень II – беременность при пороке сердца с начальными симптомами сердечной недостаточности (одышка, тахикардия), наличии признаков активной фазы ревматизма (степень А1 по А.И.Нестерову); 3. степень III – беременность при декомпенсированном пороке сердца с признаками преобладания правожелудочковой недостаточности, наличии активной фазы ревматизма (А2), мерцательной аритмии, легочной гипертензии; 4. степень IV- беременность при деком пен си рован ном пороке сердца с признаками левожелудочковой недостаточности и мерцательной аритмии с тромбозмболическими проявлениями легочной гипертензии.
На основании этой схемы сохранение беременности можно считать допустимым при I и II степени риска при условии, что больная будет находиться под наблюдением в акушерском (лучше специализированном кардиоакушерском) учреждении в течение всей беременности (амбулаторно в консультативно-диагностическом центре и стационаре с трехкратной госпитализацией). Первую госпитализацию проводят в срок 8-12 нед в терапевтическое отделение для решения вопроса о сохранении или прерывании беременности. Второй раз беременную госпитализируют в срок 28-32 нед в отделение патологии беременных для проведения лечебно-профилактических мероприятий (кардиотоническая, антиревматическая, десенсибилизирующая, умеренно дегидратационная, общеукрепляющая терапия). Третий раз госпитализируют за 2-3 нед до родов в отделение патологии беременных для подготовки к родоразрешению.
При III и IV степени риска беременность противопоказана. В случае отказа от прерывания беременности в течение всей беременности проводят кардиальную терапию, и иногда к моменту родоразрешения удается добиться положительных результатов.
В настоящее время интенсивное наблюдение в условиях специализированного стационара и длительное лечение больных с пороками сердца позволяют у большинства из них сохранить беременность и с успехом провести роды.
Врожденные порока сердца
Существует 50 различных форм врожденных аномалий развития сердечнососудистой системы, из них около 15-20 форм – это пороки, с которыми больные доживают до репродуктивного возраста. В недалеком прошлом при любой форме врожденного порока сердца беременность считали недопустимой. В настоящее время в связи с накопившимся опытом ведения таких больных можно полагать, что беременность допустима при оперированном открытом артериальном протоке; изолированном стенозе легочной артерии с небольшим сужением, протекающем без значительной нагрузки на правые отделы сердца; коарктации аорты I степени (при стабилизации АД в пределах 160/90 мм рт.ст.); низко расположенном дефекте (в мышечном отделе) межжелудочковой перегородки, болезни Толочинова – Роже и небольшом изолированном дефекте межпредсердной перегородки.
Беременность недопустима при пороках с преходящим цианозом, например у больных с высоко расположенным дефектом межжелудочковой перегородки. Беременность и роды представляют большой риск при значительном стенозе легочной артерии, большом дефекте межсердечной перегородки, коарктации аорты II-III степени (АД выше 160/100 мм рт.ст.), с пороками "синего" типа (комплекс и синдром Эйзенменгера, тетрада фалло). У этих больных беременность нередко наступает на фоне аменореи, обусловленной тяжелым течением заболевания, поэтому ее поздно диагностируют. В результате этого создается ситуация, при которой и продолжение беременности, и прерывание ее любым способом сопряжены с высоким риском для жизни больной.
Беременность и оперированное сердце
В настоящее время постоянноувеличивается число беременных, перенесших хирургическую коррекцию приобретенных или врожденных пороков сердца. В большинстве случаев хирургическое лечение возвращает женщине не только жизнь и трудоспособность, но и возможность стать матерью. Однако у больных этой группы существуют показания и противопоказания к беременности и самопроизвольным родам.
Больным, перенесшим митральную комиссуротомию, беременность можно разрешить лишь при хороших результатах операции не ранее чем через 6-12 мес после нее.
Противопоказаниями к беременности являются бактериальный эндокардит, обострение ревматического процесса, неадекватное расширение предсердно-желудочкового отверстия, травматическая недостаточность митрального клапана. После неадекватной митральной комиссуротомии или при развившемся рестенозе необходимо либо прерывать беременность, либо выполнить повторную операцию на сердце во время беременности.
Увеличилось также число беременных, перенесших операцию замены неполноценных сердечных клапанов искусственными протезами или биологическими трансплантатами. Эта операция обеспечивает коррекцию внутрисердечной гемодинамики, приводит к быстрому устранению симптомов недостаточности кровообращения и практически полному выздоровлению. Хорошие отдаленные результаты после протезирования митрального и аортального клапанов получают в 75-80 % случаев. Однако эти операции не лишены серьезных недостатков. Одним из наиболее частых осложнений двляется тромбоз клапана, вызывающий нарушение его функций, в связи с м в ряде случаев необходима замена клапана. Помимо этого, возможны тромбоэмболические осложнения, бактериальный эндокардит и др.
Опасность возникновения этих осложнений, особенно тромбоэмболических, значительно возрастает у беременных в связи с физиологической Иперволемией и гиперкоагуляцией. Вопрос о допустимости беременности после протезирования клапанов сердца остается дискутабельным. В случае хороших результатов операции кардиохирурги разрешают вынашивание беременности, акушеры же скорее склонны к ее запрету. Более благоприятные течение и исход беременности отмечаются у больных после замены одного клапана протезом современной конструкции с антитромбогенным покрытием или биологическим трансплантатом с хорошим результатом операции (нормализация сердечного ритма, выраженный гемодинамический эффект) Однако и этим больным беременность лучше разрешать через год после хирургической коррекции порока, когда организм адаптируется к новым условиям гемодинамики и восстановится трудоспособность. После многоклапанного протезирования беременность следует считать недопустимой не только при удовлетворительных, но и при хороших результатах операции.
Все беременные с искусственными клапанами сердца при первом же обращении к акушеру-гинекологу должны быть госпитализированы, лучше в специализированное кардиоакушерское учреждение. Первая госпитализация рекомендуется в ранние сроки беременности (до 12 нед) для оценки состояния беременной, выбора антикоагулянтов и установления их дозы. После этого больная может быть выписана под наблюдение врача женской консультации и поликлинического отделения кардиохирургического учреж-дения.
Повторную госпитализацию осуществляют на 26-28-й неделе беременности, когда особенно резко повышается нагрузка на сердце в связи с развитием физиологической гиперволемии, увеличением минутного объема сердца и объема циркулирующей крови. В эти сроки беременности возникает большая опасность развития сердечной недостаточности, тромбоза искусственного клапана и артериальных тромбоэмболии, в связи с чем необходимо пересмотреть антитромбогенную профилактику. Третья госпитализация рекомендуется на 36-37-й неделе беременности для подготовки к родам и заблаговременного решения вопроса о способе родоразрешения. Больным с клапанными протезами во время беременности проводят комплексную медикаментозную терапию с применением антиревматических, десенсибилизирующих средств, сердечных гликозидов и антикоагулянтов. Применение антикоагулянтов – один из основных методов лечения беременных с клапанными протезами; используют антикоагулянты непрямого (фенилин) и прямого (гепарин) действия при строгом контроле за состоянием свертывающей и противосвертывающей систем крови.
К специфическим осложнениям, возникающим у беременных с оперированным сердцем, относят системные артериальные тромбоэмболии (чаще всего сосудов головного мозга, в системе почечных артерий) и тромбозы протеза клапанов.
Родоразрешение беременных с пороками сердца
У больных с заболеваниями сердца роды должна вести бригада врачей, включающая акушера-гинеколога, терапевта, кардиолога, анестезиолога, реаниматолога, неонатолога и в ряде случаев кардиохирурга, в специализированном родильном доме.
В отсутствие сердечной недостаточности и при ее минимальных проявлениях родоразрешение проводят через естественные родовые пути с применением спазмолитических и обезболивающих средств. Кардиотоническую терапию и выключение потуг во втором периоде родов путем наложения акушерских щипцов применяют в связи с ухудшением гемодинамических показателей. Кесарево сечение производят по акушерским показаниям.
Особого внимания заслуживает родоразрешение беременных с пороками сердца и сердечной недостаточностью, поскольку оно сопряжено с большим риском для матери и плода. Выбор срока и метода родоразрешения строго индивидуален. До 36 нед досрочное родоразрешение осуществляют по следующим показаниям: отсутствие положительного эффекта от комплексной терапии в течение 12-14 дней, нарастание или наличие стойкой легочной гипертензии, отсутствие стабилизации гемодинамических показателей после отека легких или тромбоэмболии в течение 2 нед, активный ревматизм.
Роды в срок, иногда спонтанные, чаще после родовозбуждения в 37-38 нед проводят в тех случаях, когда в процессе предродовой подготовки удается значительно улучшить гемодинамические показатели, приблизив их к таковым при I степени сердечной недостаточности.
Родоразрешение через естественные родовые пути осуществляют при относительно стабильных показателях гемодинамики и благоприятной акушерской ситуации. Подготовку к родам проводят в течение 3-7 дней с использованием витаминно-энергетического комплекса, с последующей амниотомией. Одновременно пунктируют подключичную вену для проведения длительной инфузионной терапии и контроля центрального венозного давления. В зависимости от тяжести сердечно-сосудистой патологии роды могут быть проведены на фоне мониторного наблюдения за функцией сердечнососудистой системы, кардиальной терапии и поэтапного адекватного обез-боливания в обычных условиях и в условиях гипербарической оксигенации (ГБО).
В условиях ГБО должны проводить родоразрешение рожениц с приобретенными пороками сердца и недостаточностью кровообращения ПВ и III стадии, сопровождающейся циркуляторной гипоксией; с врожденными пороками сердца "синего" типа со смешанной (циркуляторной и гипоксической) формой гипоксии. Эти больные не в состоянии перенести родоразрешение ни абдоминальным путем, ни через естественные родовые пути.
Показания к родоразрешению в условиях ГБО: 1. снижение артериального Ро2 до 70 мм рт.ст. и ниже; 2. снижение венозного Ро2 ниже 40 мм рт.ст.; 3. увеличение артериально-венозной разницы по кислороду до 9 об.% и более; 4. появление вено-венозного градиента; 5. увеличение минутного объема дыхания более чем на 180 % от должного; 6. уменьшение жизненной емкости легких и коэффициента использования кислорода более чем на 50 % от величин, характерных для здоровых беременных.
При родоразрешении беременных с пороками сердца и сердечной недостаточностью используют давление 2-3 атм, обеспечивающее содержание кислорода в артериальной крови на 5-6 об.%.
Особенностью ведения родов у больных с сердечно-сосудистыми заболеваниями является раннее (с началом родовой деятельности) обезболивание, что способствует снижению частоты осложнений и не влияет на про. должительность родов. В начале первого периода родов, когда преобладают эмоциональные реакции роженицы, показано применение транквилизаторов, антигистаминных препаратов и спазмолитиков.
В активной фазе родов (раскрытие маточного зева от 3 до 9 см) больной рекомендуется предоставить медикаментозный сон: предион, натрия оксибутират в сочетании с наркотическими анальгетиками (промедол и др.) и нейролептиком дроперидолом. В конце первого периода родов можно проводить аутоаналгезию закисью азота с кислородом в соотношении 2:1 или метоксифлюраном (пентраном).
При выраженной сердечной недостаточности в конце первого периода родов необходимо проводить искусственную вентиляцию легких с предварительной кураризацией релаксантами деполяризующего действия, интубацией и последующей ингаляцией воздушно-кислородной смесью (в соотношении 1:1) в режиме умеренной гипервентиляции с перемежающимся давлением на выдохе и вдохе.
Особое место в ведении и обезболивании родов при заболеваниях сердца занимает эпидуральная анестезия, которая позволяет снизить частоту осложнений в родах.
Наибольшую опасность для рожениц с заболеваниями сердца представляют второй и начало третьего периода родов в связи с чрезмерной нагрузкой на сердце в период изгнания и повышением артериального давления. Сразу после рождения плода у роженицы резко снижается давление, сосуды органов брюшной полости переполняются кровью, что может привести к гиповолемии и снижению артериального давления. В связи с этим во втором периоде родов для выключения потуг рекомендуется применять операцию наложения акушерских щипцов. При выполнении этой операции из анестетиков используют закись азота, фторотан, метоксифлюран. Можно применять и внутривенную анестезию препаратами барбитуровой кислоты (пропамидил, калипсол).
Третий период родов у рожениц с заболеваниями сердца необходимо вести наименее травматично, избегать применения метода выжимания последа по Креде – Лазаревичу без хорошего обезболивания, так как при этом рефлекторно может возникнуть нарушение ритма сердца.
В конце второго и в третьем периоде родов рекомендуется проводить профилактику кровотечения (1 мл метилэргометрина в 10-20 мл 40 % раствора глюкозы медленно или 3-5 ЕД окситоцина в 500 мл 5 % раствора глюкозы внутривенно капельно).
Кардиальная терапия, применяемая в родах, включает сердечные гликозиды (строфантин, дигоксин, коргликон), которые вводят внутривенно медленно в начале и во втором периоде родов.
С целью повышения окислительно-восстановительных процессов в миокарде и устойчивости организма к нагрузке в родах показаны витамины (В|» Вл, аскорбиновая кислота), кокарбоксилаза, рибоксин.
А При заболеваниях сердца кесарево сечение не является оптимальным методом родоразрешения, поскольку при этой операции создается значительная гемодинамическая нагрузка на сердце по сравнению с таковой при родоразрешении через естественные родовые пути, которая сохраняется в первые 4 дня послеоперационного периода.
Показаниями к кесареву сечению в плановом порядке с тщательной предоперационной подготовкой являются: 1. комбинированная недостаточность аортального и митрального клапанов; 2. митральный стеноз II-III стадии; 3. клапанные протезы в отсутствие эффекта от лечения сердечной недостаточ ности; 4. артериальные тромбоэмболии, перенесенные во время беременности; 5. бактериальный эндокардит; 6. паравальвулярная фистула; 7. многоклапанные протезы сердца; 8. неудовлетворительный эффект хирургической коррекции пороков сердца или возникающие после нее осложнения; 9. рестеноз, реканализация, травматическая недостаточность после митральной комиссуротомии; 10. отек легких, перенесенный во время беременности; 11. коарктация аорты, в том числе после хирургической коррекции.
Операцию кесарева сечения у больных с сердечно-сосудистыми заболеваниями выполняют под эндотрахеальным наркозом или эпидуральной анестезией.
Кесарево сечение противопоказано больным с тяжелой декомпенсацией при кардиомегалии, циррозах печени, тяжелых расстройствах сердечного ритма, сложных врожденных пороках "синего" типа, легочной гипертензии крайней степени. Роды у таких больных проводят в условиях ГБО. Прогноз часто неблагоприятный.
При сердечной патологии в родах может развиться легочная гипертензия, которая ухудшает прогноз. У больных с легочной гипертензией во время родов и в послеродовом периоде нередко развиваются такие осложнения, как тромбоз сосудов малого круга кровообращения с последующим инфарктом легкого и инфарктной пневмонией, тромбоэмболии в систему легочной артерии, отек легких. Эти осложнения являются основной причиной летальных исходов при сердечной патологии. Беременность у больных с легочной гипертензией недопустима.
Заболевания органов дыхания
Бронхиты
Острый бронхит.
Заболевание чаще возникает весной и осенью. У беременных преобладают первичные бронхиты, развивающиеся вследствие инфекционного, вирусного поражения бронхов при охлаждении тела. Гораздо реже встречаются вторичные бронхиты – осложнения туберкулеза и других инфекционных заболеваний. Бронхит может быть также аллергическим. В этом случае он нередко сопровождается астматическим компонентом. Причиной оронхита могут быть производственные вредности: химические, физические, спылевые раздражители дыхательных путей. Острый бронхит часто сочетается ларингитом, трахеитом, острой респираторно-вирусной инфекцией.
Беременность не предрасполагает к заболеванию бронхитом, но свойственное периоду беременности набухание слизистой оболочки бронхов затрудняет отхаркивание.
Клиническая картина острого бронхита у беременных не отличается от проявлений заболевания у небеременных.
На течение беременности острый бронхит существенного влияния не оказывает, но возможно внутриутробное инфицирование плода.
Лечение.
При остром бронхите лечение заключается в назначении частого теплого питья: горячий чай с медом и лимоном, молоко с содой или боржомом, липовый чай. Такое питье смягчает ощущение першения в горле и за грудиной, облегчает отхаркивание. Применяют микстуру из термопсиса. Более эффективна микстура из корня ипекакуаны, но она оказывает раздражающее действие на слизистую оболочку желудка и вызывает тошноту, что нежелательно при наличии токсикоза беременных. Показаны ингаляции щелочных растворов. Для подавления мучительного кашля рекомендуется слизистый отвар алтейного корня. Для снятия бронхоспазма может быть использован эуфиллин (0,15 г 3 раза в день). В большинстве случаев удается ликвидировать острый бронхит у беременных без антибактериальных препаратов. В случае необходимости следует применять пенициллин или ампициллин (по 0,05 г 4 раза в день). Такие антибиотики, как стрептомицин, левомицетин и производные тетрациклина, противопоказаны на всем протяжении беременности и после родов. Сульфаниламидные препараты беременным назначать нежелательно, так как они могут вызывать кристаллурию с закупоркой мочевых путей.
Хронический бронхит.
Клиническая картина хронического бронхита у беременных аналогична таковой у небеременных.
Неосложненный хронический бронхит не является противопоказанием к беременности и родам. Беременным с хроническим бронхитом рекомендуется прекратить курение. Больные нуждаются в обследовании, в случае выявления заболеваний околоносовых пазух и зубов проводят необходимое лечение, поскольку эти заболевания могут быть причиной хронического бронхита. Медикаментозные средства и физические методы воздействия такие же, как при лечении острого бронхита. Роды у больных бронхитом протекают без осложнений.
Пневмонии
Острая пневмония.
У беременных пневмония нередко протекает более тяжело в связи с уменьшением дыхательной поверхности легких, высоким стоянием диафрагмы, ограничивающим экскурсию легких, дополнительной нагрузкой на сердечно-сосудистую систему.
Клиническая картина острой пневмонии не отличается от таковой у небеременных.
При развитии пневмонии незадолго до родов следует по возможности отсрочить развитие родовой деятельности с помощью р-миметиков и других средств, так как родовой акт опасен в связи с воздействием токсико-инфекционных факторов на нервную и сердечно-сосудистую системы.
Лечение.
Применение антибиотиков дает возможность не только успешно лечить больных, но и предотвращать внутриутробную гибель плода. При выборе антибиотика руководствуются чувствительностью микрофлоры, выделяемой с мокротой, к антибиотикам с учетом срока беременности и влияния препарата на плод. Могут быть использованы те же антибиотики и в таких же дозах, что и при лечении острого бронхита. Не следует забывать о противогрибковых препаратах (нистатин или леворин по 1.000.000-1.500.000 ЕД в сутки). Назначают муколитические средства. При тенденции к артериальной гипотензии применяют сульфокамфокаин, кордиамин внутримышечно. Очень полезна кислородотерапия.
Как правило, пневмония не является противопоказанием к сохранению беременности. Однако следует иметь в виду, что несвоевременное и беспорядочное назначение антибиотиков приводит к образованию вирулентных форм микроорганизмов, нечувствительных к антибиотикам, к дисбактериозу, снижению защитных сил организма, а в результате – к учащению случаев перехода острой пневмонии в хроническую. Пневмонию, не разрешающуюся в течение 6 нед, считают хронической.
Хроническая пневмония.
При хронической пневмонии I стадии (классификация 1964 г.) беременность допустима. При II стадии заболевания беременность можно сохранить, но больные должны длительно лечиться в стационаре. В III стадии хронической пневмонии отчетливо выражены дыхательная и легочно-сердечная недостаточность. Функции внешнего дыхания нарушены, снижено поглощение кислорода. Развивается миокардитический кардиосклероз – легочное сердце. При таком тяжелом состоянии беременность абсолютно противопоказана. Беременные должны быть госпитализированы; с помощью лечебных процедур достигают максимально возможного улучшения состояния, после чего беременность должна быть прервана.
Лечение.
В периоды обострений хронической пневмонии назначают антибиотики. Этим больным антибиотики показаны и при простудных заболеваниях (во избежание обострения пневмонии). Целесообразна кислородотерапия – ингаляции, кислородная "пенка", кислородная палатка и пр. Весьма эффективно применение эуфиллина, так как при этом снижается давление в малом круге кровообращения, т.е. эуфиллин действует на основной патогенетический механизм легочного сердца. Кроме того, эуфиллин снимает бронхоспазм. При недостаточности кровообращения назначают сердечные гликозиды и мочегонные средства. Не следует ограничивать прием муколитических средств (термопсис, терпингидрат, натрия бензоат). Препараты, угнетающие дыхательный центр у женщины и плода, противопоказаны.
Роды у больных хронической пневмонией I и II стадии не имеют особенностей, женщина может рожать через естественные родовые пути, но во время родов необходима терапия: постоянная ингаляция кислорода, при II стадии заболевания введение 10 мл 2,4 % раствора эуфиллина. У больных хронической пневмонией III стадии потуги выключают с помощью акушерских щипцов или производят кесарево сечение. Это обусловлено тем, что характерное для легочного сердца увеличение объема циркулирующей крови Может вызвать острую правожелудочковую недостаточность сердца, ослаблeнного процессом миокардиосклероза и работающего в условиях гипоксии вледствие притока крови из матки. При хронической пневмонии III стадии.
Каким бы методом ни осуществлялось родоразрешение, терапия должна ключать, помимо ингаляции кислорода и введения эуфиллина, внутривенное введение сердечных гликозидов.
Бронхиальная астма
В подавляющем большинстве случаев бронхиальная астма – аллергическое заболевание. Чаще она развивается до беременности, но может впервые возникнуть во время беременности. Приступы удушья у одних женщин развиваются в начале беременности, у других – во второй половине. Возникновение астмы у беременных связывают с изменениями, происходящими в организме женщины, в частности с изменением синтеза простагландинов, вызывающих бронхоспазм. Астма, возникшая во время беременности, может исчезнуть после родов, но может остаться как хроническое заболевание. С учетом того, что при беременности увеличивается содержание кортизола, преднизолона и гистаминазы в плазме, у большинства больных бронхиальной астмой можно было бы ожидать некоторого улучшения. Однако клинические наблюдения не подтверждают это предположение. Только у 20 % больных сохраняется ремиссия, а у 10 % наступает улучшение во время беременности. У подавляющего большинства (70 %) беременных за-болевание протекает тяжелее, причем преобладают среднетяжелые и тяжелые формы обострения с ежедневными неоднократными приступами удушья, периодически возникающими астматическими состояниями, нестойким эффектом от лечения.
Течение астмы обычно ухудшается в ( триместре беременности. В настоящее время отсутствуют критерии, которые позволили бы прогнозировать состояние больной бронхиальной астмой во время беременности, и это очень затрудняет решение вопроса о допустимости ее сохранения.
Приступы бронхиальной астмы во время родов возникают редко, особенно при профилактическом назначении в этот период бронхолитических средств или глюкокортикоидных препаратов.
У больных бронхиальной астмой чаще, чем у здоровых женщин, наблюдаются токсикоз и гестоз. У них могут родиться недоношенные и маловесные дети; астма, хотя и довольно редко, бывает причиной антенатальной смерти плода.
Бронхиальная астма не является противопоказанием к беременности. Только при повторяющихся астматических состояниях и явлениях легочносердечной недостаточности может встать вопрос о досрочном родоразрешении. У больных бронхиальной астмой роды могут быть самопроизвольными, так как приступы удушья в родах нетрудно предотвратить.
Лечение бронхиальной астмы заключается прежде всего в предотвращении и купировании приступов удушья. В легких случаях бывает достаточно применения бронхолитических препаратов в виде ингаляций и таблеток; адреномиметика изадрина, вводимого с помощью ингалятора и в таблетках по 0,005 г под язык, или алупента (астмопент) – по 0,02 г под язык или 1-2 вдоха из ингалятора, микстуры, состоящей из эуфиллиня (3 г), алтейного сиропа (40 мл) и 12 % этилового спирта (360 мл), по 1 столовой ложке на прием, теофедрина или антастмана, солутана в каплях, но эти препараты содержат фенобарбитал и красавку, противопоказанные беременным, поэтому систематически с целью профилактики приступов их применять не следует. При легком приступе удушья одновременно назначают горячее питье, горчичники или банки.
При более тяжелых приступах удушья лечение больных с астматическим состоянием обязательно проводят в стационаре: внутривенно вводят ДО мл 2 4 % раствора эуфиллина в 40 % растворе глюкозы или медленно капельно Ю-15 мл эуфиллина с 1 мл эфедрина в 200-300 мл 5 % раствора глюкозы. При сердечной недостаточности добавляют коргликон. Одновременно больной дают кислород. Если приступу способствовала инфекция, назначают антибиотики, переносимые больной и не оказывающие отрицательного влияния на плод.
В случае недостаточного эффекта в мышцу или вену вводят 30 мг преднизолона каждые 3 ч до купирования астматического состояния, постепенно увеличивая интервалы между инъекциями. При метаболическом ацидозе вливают 200 мл 4 % раствора натрия гидрокарбоната. Подкожно вводят 2-4 мл кордиамина для стимуляции дыхательного центра. Через носовой катетер постоянно вводят кислород, периодически в смеси с закисью азота. Если в течение 1 – 1,5 ч состояние не улучшается, сохраняется аускультативная картина "немого легкого", то при помощи анестезиолога приступают к искусственной вентиляции легких с активным разжижением и отсасыванием мокроты.
Важное значение имеет исключение из диеты продуктов с высокими аллергенными свойствами (цитрусовые, яйца, орехи) и неспецифических пищевых раздражителей (перец, горчица, острые и соленые блюда). В ряде случаев нужно сменить работу, если имеются производственные вредности, играющие роль аллергенов (химикаты, антибиотики и др.).
Заболевания почек и мочевыводящих путей
Среди экстрагенитальных заболеваний беременных патология почек (пиелонефрит, гломерулонефрит, мочекаменная болезнь) занимает ведущее место. Заболевания почек оказывают неблагоприятное влияние на течение беременности, родов, послеродового периода и состояние плода.Беременность ухудшает течение пиелонефрита и гломерулонефрита. Факторами, способствующими обострению заболеваний почек, являются гормональные, гуморальные и анатомические изменения в организме беременных.
В результате изменения гормонального и гуморального фона (повышение уровня прогестерона, простациклина) у беременных развиваются гипотония, гипои дискинезия чашечно-лоханочной системы и мочеточников. Наблюдаемое одновременно ослабление связочного аппарата почек приводит к увеличению их подвижности, что способствует возникновению нефроптоза и нарушению пассажа мочи.
Немаловажное значение в возникновении нарушений уродинамики верхних мочевых путей имеют изменения анатомо-то по графических взаимоотношений за счет беременной матки. В результате сдавления мочеточников маткой возникают эктазии верхних мочевых путей, больше справа.
Снижение тонуса верхних мочевых путей и застой мочи в почечных лоханках способствуют повышению давления в них, что ведет к возникнонию пузырно-мочеточникового рефлкжса и инфицированию почек. Эти нарушения создают условия для обострения латентно протекающих хронических воспалительных процессов в мочевыделительной системе.
С целью диагностики заболеваний почек в ранние сроки гестации Проводят специальное обследование. Важное значение имеют исследование средней порции утренней мочи, подсчет количества форменных элементов в осадке мочи, использование методов Нечипоренко, Зимницкого. У всех беременных с патологией почек целесообразно проводить посевы мочи для выявления микрофлоры и определения чувствительности ее к антибиотикам При этом предварительно определяют степень бактериурии. Об инфицировании мочевых путей свидетельствует обнаружение более 100.000 бактерий в 1 мл. Для оценки состояния клубочковой фильтрации и канальцевой реабсорбции используют пробу Реберга, определяют почечный кровоток.
Пиелонефрит беременных
Пиелонефрит – неспецифический инфекционно-воспалительный процесс, сопровождающийся поражением интерстициальной ткани почек, канальцевого аппарата и стенок чашечно-лоханочной системы. У беременных процесс чаще развивается в правой почке.
Пиелонефрит развивается у 6-7 % беременных, чаще во второй половине беременности, Беременные с пиелонефритом составляют группу высокого риска возникновения осложнений беременности (невынашивание, гестоз, гипотрофия плода, азотемия и др.). Степень риска развития осложнений зависит от длительности пиелонефрита, степени поражения почек, общего состояния организма. Выделяют три степени риска [Шехтман М.М., 1980]: 1. степень I – неосложненное течение пиелонефрита, возникшего во время беременности; 2. степень И – хронический пиелонефрит, развившийся до наступления беременности; 3. степень III – пиелонефрит, протекающий с артериальной гипертензией или азотемией, пиелонефрит единственной почки.
Наиболее тяжелые осложнения возникают при III степени риска, поэтому беременность при ней противопоказана.
Пиелонефрит вызываетсяусловно-патогенными микроорганизмами, в первую очередь кишечной группы, микроорганизмами рода Proteus, а также энтеробактериями: Klebsiella, Enterobacter, Citrobacter, стрептококками групп D и В, стафилококками и микрококками. У беременных воспалительные процессы в почках вызываются также грибами рода Candida.
Пиелонефриту может предшествовать бессимптомная бактериурия, которая выявляется у 2-10 % беременных. В отсутствие лечения у 40 % из них в дальнейшем развивается пиелонефрит.
У беременных пиелонефрит может протекать как в острой, так и хронической форме. Независимо от формы течения пиелонефрита клиническая картина у беременных такая же, как у небеременных.
Лечение острого пиелонефрита начинают с восстановления нарушенного пассажа мочи под контролем УЗИ, которое позволяет оценить степень расширения почечных лоханок. На начальных этапах развития заболевания рекомендуется проводить так называемую позиционную терапиюбольную укладывают на кровать с приподнятым ножным концом в полоЖ ~ ние на "здоровом" боку с приведенными к животу ногами, что способствует отклонению беременной матки и уменьшению давления на мочеточник.
Если это мероприятие в течение суток не дает положительного эффекта, а При повторном УЗИ выявляется значительное расширение лоханки, целесообразно провести катетеризацию почечных лоханок после хромоцистоскопии и определения стороны поражения. Следующим этапом лечения является чрескожная пункционная нефропиелостомия. В случае ее неэффективности производят щадящие операции – декапсуляцию почки, нефростомию.
При гнойном пиелонефрите и наличии показаний производят операцию на почках и только потом решают вопрос о сохранении или прерывании беременности. Прерывание беременности, как правило, не улучшает течения гнойного процесса в почках.
Антибактериальные препараты назначают в зависимости от вида возбудителя и его чувствительности к антибиотикам. При этом предпочтение следует отдавать препаратам, не оказывающим выраженного отрицательного влияния на состояние плода; полусинтетические пенициллины (ампициллин, оксациллин, натриевая или калиевая соль пенициллина), цефалосиорины (цепорин). Для усиления антибактериальной терапии антибиотики назначают в комбинации с нитрофуранами (фурагин) и химиопрепаратами (5-НОК). Одновременно проводят инфузионную дезинтоксикационную терапию (гемодез, лактосол и т.д.).
Для улучшения эвакуации из почечной ткани воспалительного детрита и усиления действия антибактериальных препаратов назначают растительные мочегонные препараты и спазмолитики (платифилин, но-шпа). В комплексное лечение пиелонефрита обязательно включают десенсибилизирующие (супрастин, тавегил, дипразин) и седативные препараты, витамины.
Роды у больных с острым пиелонефритом проводят во втором акушерском отделении родильного дома многопрофильной больницы с использованием спазмолитических средств и анальгетиков. Оперативные вмешательства при остром пиелонефрите выполняют только по строгим акушерским показаниям.
Лечение хронического пиелонефрита зависит о т активности процесса. Лечение обострения мало чем отличается от терапии при остром пиелонефрите. После устранения активного процесса беременная должна находиться на диспансерном учете и систематически получать противоречили вную терапию. Во время беременности она включает в основном соответствующую диету с ограничением потребления острой пищи и использованием кислого питья (клюквенный морс), витаминотерапию, анти-бактериальные и диуретические фитосборы (плоды можжевельника, хвощ полевой, корень солодки, толокнянка, листья березы, трава василька синего, пол-пала и т.д.).
После гестационного пиелонефрита функция почек, как правило, восстанавливается, однако у 20 % женщин она остается сниженной. В послеРодовом периоде необходимо наблюдение нефролога.
Дети, рожденные от матерей, больных пиелонефритом, составляют группу риска развития гнойно-септических заболеваний.
Гломерулонефрит
Гломерулонефрит – инфекционно-аллергическое заболевание, сопровождающееся поражением клубочкового аппарата почек. Частота его составляет 0,1 – 0,2%. Острый гломерулонефрит во время беременности нередко протекает под видом тяжелых форм гестоза.
Клиническая картина.
У беременных чаще выявляют хронический гломерулонефрит, который протекает в нескольких формах: нефротической гипертонической, смешанной (отечно-гипертонической), латентной. Как правило, встречается латентная форма, при которой течение беременности родов и послеродового периода наиболее благоприятно. Максимальная степень риска отмечается у беременных со смешанной формой, острым гломерулонефритом и любой формой заболевания, сопровождающейся азотемией и почечной недостаточностью.
Лечение.
Общепринятая терапия гломерулонефрита с использованием цитостатических средств и иммунодепрессантов у беременных не может быть применена в связи с эмбриотоксическим действием препаратов. Проводят комплексную симптоматическую терапию, которая включает соответствующую диету, мочегонные, гипотензивные, десенсибилизирующие препараты, антикоагулянты, антиагреганты, мембранстабил и заторы, антиоксиданты, инфузии белковых препаратов, кортикостероиды по показаниям. Следует осуществлять профилактику и лечение внутриутробной задержки роста плода.
При назначении диеты необходимо учитывать форму гломерулонефрита. В случае нефротической формы количество белка составляет 2 г на 1 кг массы тела беременной, поваренной соли – до 5 г, жидкости – 800 мл в сутки. При смешанной и гипертонической формах прием поваренной соли ограничивают до 5 г, жидкости – до 1000 мл, белка до 1 г/кг в сутки. При латентной форме гломерулонефрита ограничений в диете не устанавливают. Дефицит белка возмещают парентеральным введением свежезамороженной плазмы, альбумина и других белковых препаратов.
При отеках с осторожностью используют мочегонные препараты: гипотиазид по 0,25-0,75 г/сут в течение 3-5 дней или через день, фуросемид по 0,04-0,08 г внутривенно. Вместе с мочегонными препаратами применяют калия хлорид по 1 г 3-4 раза в сутки.
В комплексном лечении гломерулонефрита используют гипотензивные препараты: вазодилататоры, симпатолитики, спазмолитики. Для устранения внутриклубочковой внутрисосудистой коагуляции и нормализации микроциркуляции используют гепарин (15 000-20 000 ЕД/сут) и дезагреганты (трентал по 0,2-0,3 г/сут, курантил по 4-6 мг/сут), ацетилсалициловую кислоту (0,25-0,5 г/сут). Из мембранстабилизаторов и антиоксидантов применяют липостабил (по 2 капсулы 3 раза в день), эссенциале-форте (по 2 капсулы 3 раза в день), витамин Е (по 100-150 мг/сут). В комплексное лечение гломерулонефрита входят фитосборы, оказывающие седативное и мочегонное действия, а также физиотерапевтические методы: ультразвук на область почек, гальванизация "воротниковой" зоны.
Сохранение беременности противопоказано при гипертонической и смешанной формах гломерулонефрита с типичным течением заболевания, а также при любой его форме, сопровождающейся азотемией и почечной недостаточностью. Для уточнения формы гломерулонефрита и выработки тактики ведения беременности необходимо проводить лечение в стационаре нефрологического отделения многопрофильной больницы в сроки до 12 неДГоспитализация в стационар показана при обострении гломерулонефрита и присоединении гестоза, а также при нарушении состояния плода. При всех формах гломерулонефрита за 3 нед до родов беременные должны поступать в стационар отделения патологии беременных для выработки тактики ведения родов.
Роды у больных гломерулонефритом не имеют особенностей. При тяжелом течении заболевания целесообразно произвести преждевременное родоразрешение во избежание внутриутробной гибели плода и прогрессирования заболевания.
Мочекаменная болезнь
Мочекаменная болезнь развивается у 0,1-0,35 % беременных. В настоящее время считают, что образование камней в почках у женщин в большей степени связано с мочевой инфекцией, пиелонефритом, в меньшей – с нарушениями обмена. При беременности часто наблюдается сочетание пиелонефрита и нефролитиаза.
Клиническая картина.
Наиболее частым симптомом мочекаменной болезни является почечная колика. Боли носят интенсивный характер, локализуются в пояснице, иррадиируют по ходу мочеточника в паховую область, бедро, половые губы. Нередко боли сопровождаются тошнотой, рвотой, метеоризмом, задержкой стула и газов, дизурическими явлениями, положительным симптомом Пастернацкого. После приступа колики в моче выявляется микроили макрогематурия. При беременности нередко наблюдается инфицирование камней и нефролитиаз осложняется пиелонефритом, что сопровождается лихорадкой, ознобом, пиурией и признаками воспалительных изменений в крови.
Диагностика.
Диагноз мочекаменной болезни во время беременности устанавливают на основании данных анамнеза, клинической картины во время приступа болей, результатов анализа мочи и УЗИ почек. Широко используют хромоцистоскопию, которая позволяет выявить наличие полной или частичной окклюзии мочевыводящих путей, а также оценить секреторную функцию почек. После хромоцистоскопии производят катетеризацию мочеточника и определяют уровень расположения камней. При про-хождении катетера выше камня приступ почечной колики обычно купируется.
Лечение.
Во время беременности, как правило, проводят консервативное лечение. При приступе почечной колики широко применяют спазмолитические и анальгетические средства, а также паранефральную блокаду.
При сочетании мочекаменной болезни с пиелонефритом назначают антибактериальную терапию с обязательным восстановлением пассажа мочи. При беременности хирургическое лечение мочекаменной болезни проводят в случае длительно некупирующегося приступа почечной колики, обтурационной анурии, а также острого пиелонефрита, когда путем катетеризации лоханки не удается восстановить отток мочи. Производят щадящие операции: пиелои уретеролитотомию, нефропиелостомию в любые Роки беременности. При восстановлении функции почки беременность сохраняют. В тех случаях, когда эффект от комбинированного лечения отсутствует и развивается почечная недостаточность, показано прерывание беременности.
Анемия и беременность
Во время беременности увеличиваются объем циркулирующей крови и его составляющие – объем плазмы и объем эритроцитов, причем объем плазмы возрастает больше, чем объем эритроцитов. Происходит разведение эритроцитов в большом количестве жидкости, относительное уменьшение их числа при абсолютном увеличении объема плазмы. Это состояние называется гидремией и не является анемией, хотя наблюдается закономерное снижение показателей красной крови.Однако у беременных часто развивается истинная анемия. В России ее диагностируют у 40 % беременных. Это заболевание широко распространено среди беременных во всем мире, в разных странах частота его колеблется от 21 до 89%. В подавляющем большинстве случаев (в 9 0%) развивается железодефицитная анемия.
Анемия, диагностируемая в ранние сроки беременности, обычно возникает до ее наступления. Анемия, связанная с беременностью, развивается во второй ее половине.
Клиническая картина и диагностика.
Часто больные с анемией не предъявляют никаких жалоб. Однако могут наблюдаться слабость, одышка, головокружение, обмороки. Нередко появляются трофические изменения, связанные с дефицитом в организме ферментов, содержащих железо: выпадение волос, ломкость ногтей, трещины в углах рта.
В крови при анемии выявляют уменьшение содержания гемоглобина (115 г/л и менее), количества эритроцитов (менее 3,7-Ш /л, цветной показатель 0,85 и ниже), уровня железа сыворотки крови (менее 10 ммоль/л). Диагноз истинной анемии (а не гидремии беременных) подтверждается при обнаружении в мазке крови измененных эритроцитов – пойкилоцитов и анизоцитов. Различают анемию легкой, средней и тяжелой степени. При анемии легкой степени содержание гемоглобина в крови составляет 90-115 г/л, при средней степени тяжести – 80-90 г/л и при тяжелой анемии – менее 80 г/л.
Лечение.
В лечении анемии у беременных важное значение имеет диета. Женщине следует потреблять не менее 120 г белка в день. Из мяса всасывается 6 % железа, а из растительной пиши – только 0,2 %. Анемию лечат препаратами железа, которые принимают внутрь в таблетках или капсулах. Внутривенное или внутримышечное введение препаратов железа не имеет преимуществ, но может привести к тяжелым осложнениям.
Феррокаль и ферроплекс следует принимать в больших дозах – по 2 таблетки 3-4 раза в день. Конферон содержит в 4 раза больше железа, поэтому его назначают в меньших дозах – 1 капсула 3 раза в день. Тардиферон – препарат пролонгированного действия, его рекомендуется принимать по 1 таблетке 2 раза в день.
Лечение анемии длительное и не предполагает быстрого достижения эффекта. Содержание гемоглобина в большинстве случаев увеличивается к концу 3-й недели лечения, нормализация этого показателя происходит еще позже – через 9-10 нед, но самочувствие больной улучшается быстро.
Очень важно, добившись выздоровления беременной, не прекращать лечения втечение 3 мес, так как предстоят роды с неизбежной кровопотерей, длительный период кормления ребенка грудью, что может вызвать рецидив анемии. Если во время беременности излечения анемии добиться не удалось, то после родов необходимо ежегодно в течение 1 мес принимать железосодержащие препараты.
Лечение железодефицитной анемии проводят преимущественно амбулаторно, только в тяжелых случаях требуется госпитализация.
У беременных, помимо железодефицитной анемии, могут наблюдаться и анемии другой природы: мегалобластная (витамин Влили фолиеводефицитная), гипои апластическая (вследствие угнетения костномозгового кроветворения), гемолитическая (врожденная или приобретенная аутоиммунная) .
Для их выявления необходимо обследование в специализированных лечебных учреждениях. После получения результатов назначают адекватную терапию.
Заболевания нервной системы и органа зрения
Эпилепсия.
Это заболевание нередко впервые проявляется во время беременности, течение которой при эпилепсии часто осложняется развитием токсикоза и гестоза. Эпилепсия ухудшает течение заболевания, в связи с чем лечение необходимо проводить в стационаре. При правильном, индивидуально подобранном и регулярном лечении эпилепсии во время беременности и родов можно добиться удовлетворительной компенсации заболевания. В отсутствие правильного лечения беременных припадки эпилепсии учащаются и может развиться эпилептический статус, который необходимо дифференцировать от эклампсии (см. Гестозы беременных).
Эпилептические припадки следует отличать от симптоматических, обусловленных другими нервными заболеваниями (энцефалит, сотрясение мозга, опухоли мозга и др.), а также от припадков эклампсии. Важным моментом в установлении диагноза является наличие припадков эпилепсии в анамнезе. Роды у больных эпилепсией нередко наступают преждевременно и протекают быстро. В связи с заболеванием может возникнуть потребность в ускорении второго периода родов путем наложения акушерских щипцов или перинеотомии.
Тактика ведения.
В случае сохранения беременности у больной эпилепсией необходимы тщательное наблюдение за беременной, назначение лекарственных средств, снижающих возбудимость ЦНС, исключение из пищи возбуждающих блюд, обеспечение удлиненного ночного сна. Лечение следует проводить по тем же правилам, что и у небеременных больных. Если пациентка уже принимала препараты, предупреждающие припадки, то во время беременности она должна продолжать их прием, В случае необходи-мости начать лечение во время беременности назначают либо фенобарбитал по 30-60 мг 3 раза в день в сочетании с фолиевой кислотой, либо дифенин, оензонал по 0,05-0,1 г, кальция глюконат, глутаминовую кислоту, фолие"Ую кислоту и кофеин в небольших дозах. Такой комплекс принимают по '-3 раза в день в течение всей беременности. Во время родов нужно Продолжать противосудорожную терапию. При возникновении эпилептического статуса во время родов, неэффективности интенсивной противосудорожной терапии и в отсутствие условий для быстрого родоразрешения через естественные родовые пути производят кесарево сечение. Оперировать таких больных следует под интубационным наркозом.
Миастения.
Сочетание беременности и миастении встречается редко.
Клиническая картина.
Заболевание характеризуется слабостью и патологической утомляемостью мышц, иннервируемых черепными нервами При этом возникает ряд расстройств – преимущественно глазодвигательных и мимических, глотания, жевания, иногда дыхания. После небольшого обострения в начале беременности симптомы миастении становятся менее выраженными и могут полностью исчезать к концу беременности. Роды наступают своевременно и характеризуются быстрым течением. В послеродовом периоде возможны тяжелые миастенические кризы.
Тактика ведения.
Беременность при миастении может быть сохранена, но требуется строгий контроль акушера, терапевта и невропатолога. Необходима готовность к оперативному родоразрешению и применению аппаратного искусственного дыхания. Больным в состоянии миастенического криза перед родами или в первом их периоде целесообразно производить кесарево сечение под эндотрахеальным наркозом. Наиболее благоприятно протекает беременность у больных миастенией после тимэктомии. При прогрессирующем ухудшении общего состояния беременность необходимо прервать. Женщинам, обращающимся за советом до беременности, рекомендуют воздержаться от нее.
Миопатия (первичная мышечная атрофия). фы
Это хроническое, постоянно прогрессирующее наследственное заболевание нервно-мышечного аппарата. Характеризуется постепенной атрофией мышц. Деятельность гладких мышц не нарушается. При всех формах миопатии беременность противопоказана.
Рассеянный склероз.
У беременных это заболевание возникает редко. Вследствие полиморфизма клинических симптомов и течения заболевания диагностика значительно затруднена. Первые симптомы могут появиться во время беременности или после родов. Беременность оказывает отрицательное влияние на течение заболевания. Аналогично и воздействие искусственного прерывания беременности. При рассеянном склерозе беременность проти во по казана.
Тактика ведения.
Наблюдение за беременной проводят совместно с невропатологом, В зависимости от клинического течения рассеянного склероза показан преднизолон, начиная с дозы 20-30 мг в сутки, которую в дальнейшем снижают до 5-10 мг. Необходим постоянный прием витаминов группы В и аскорбиновой кислоты. При ухудшении состояния и перед родами обязательна госпитализация.
Заболевания органа зрения
Беременность может значительно ухудшать течение глазных болезней, связанных с поражением роговицы, хрусталика, сетчатки, сосудистого тракта и зрительного нерва.
Болезни зрительного нерва и сетчатки. Это наиболее тяжелые заболевания глаз у беременных. В большинстве случаев эта патология служит одним из клинических проявлений гестоза и нефрита. При возникновении неврита зрительного нерва беременность должна быть прервана при любом сроке.
Прерывать беременность необходимо также при обнаружении ретинита или нейроретинита, установлении отслойки сетчатки любой этиологии.
Миопия.
Нормально протекающая беременность в большинстве случаев не влияет на миопический процесс. Прогрессирование миопии может быть обусловлено развитием раннего токсикоза и гестоза беременных. В течение беременности могут возникать такие осложнения, как кровоизлияния в сетчатку и ее отслойка, в связи с чем требуется срочное лечение у окулиста. С целью профилактики возможных осложнений необходимы динамическое наблюдение окулиста, витаминотерапия, назначение препаратов кальция и рутина, предупреждение и лечение гестоза. Показано бережное родоразрешение – сокращение периода потуг (наложение акушерских щипцов). При высокой степени миопии, а также ее осложнениях производят кесарево сечение. Показаниями к прерыванию беременности являются злокачественное течение миопии, неблагоприятное влияние предыдущих беременностей на миопический процесс, тяжелые миопические изменения в обоих глазах.
Заболевания органов пищеварения
Острая кишечная непроходимость.
Это понятие объединяет ряд заболеваний, общим для которых является нарушение проходимости просвета кишки. Различают динамическую и механическую острую кишечную непроходимость. Динамическая непроходимость может быть паралитической и спастической. Механическая кишечная непроходимость бывает обтурационной и стран гуляционной.
У беременных встречаются все варианты кишечной непроходимости. Частота этого заболевания во время беременности невелика – 1:40 000-1:50 000 родов.
Этиология. У беременных, как и у небеременных, наиболее часто отмечается странгуляционная острая кишечная непроходимость, а именно – заворот тонкой кишки. Обычно она возникает вследствие усиленной перистальтики и развития спаечного процесса в брюшной полости.
Этиологические факторы, способствующие развитию кишечной непроходимости, у беременных те же, что и у небеременных: спайки послеоперационные и воспалительного характера (поэтому особое внимание нужно уделять больным с операциями в анамнезе), длинная брыжейка, врожденные патологические карманы, внутренние грыжи, аномалии развития органов желудочно-кишечного тракта и брюшной стенки, новообразования. В 6-15% случаев беременная матка с растущим в ней плодным яйцом способствует развитию непроходимости кишечника.
Наиболее часто кишечная непроходимость развивается во второй половине беременности и во время родов, в последнем случае кишечная непроходимость протекает особенно тяжело.
Кишечная непроходимость у беременных характеризуется тяжелым течением, затруднениями при установлении диагноза и неблагоприятным прогнозом у матери и плода. Летальность среди больных с кишечной непроходимостью составляет 3-18 %, у беременных она увеличивается. Прогноз в огношении жизни ребенка еще хуже: мертворождаемость достигает 60 – 75 %.
Беременные поздно поступают в стационар, что обусловливает высокую смертность. Запаздывание хирургической помощи обусловлено тем, что симптомы кишечной непроходимости расценивают как признаки прерывания беременности. Диагностика во время беременности, особенно в конце ее, сложна. Обследование больных затруднено из-за того, что матка заполняет почти всю брюшную полость.
Клиническая картина кишечной непроходимости при беременности больших сроков не всегда характеризуется обычными симптомами Боли могут быть умеренными, непостоянными, локализоваться в эпигастральной области или по всему животу. Нередко наблюдаются рвота, задержка газов, явления интоксикации. Выраженное вздутие живота может отсутствовать.
Заворот слепой кишки у беременных характеризуется своеобразным течением с множеством нетипичных симптомов. Заворот в большинстве случаев происходит там, где анатомически имеется перегиб мобильной слепой кишки на границе с ее фиксированной частью. Это может стимулировать острое расширение желудка. Боли схваткообразные рецидивирующие; ранними симптомами являются рвота, запор или понос. Отмечается метеоризм, часто отсутствует напряжение мышц брюшной стенки.
Дифференциальная диагностика. При большом сроке беременности боли в животе, особенно схваткообразные, расцениваются как начало родовой деятельности. Кишечную непроходимость у беременной дифференцируют от перекрута ножки кисты яичника, перитонита, разрыва матки и пареза кишечника, выкидыша, преждевременных родов, острого аппендицита, разрыва паренхиматозных органов с внутрибрюшным кровотечением.
Акушерская тактика при кишечной непроходимости заключается в стремлении сохранить беременность, если заболевание развилось в первой ее половине. Во второй половине беременности вопрос о ее сохранении решается индивидуально. Если кишечная непроходимость сопровождается родовой деятельностью, то следует произвести родоразрешение через естественные родовые пути, а потом выполнить операцию на кишечнике. В отсутствие условий для быстрого родоразрешения производят лапаротомию и кесарево сечение, а затем хирургическое лечение кишечной непроходимости.
При нежизнеспособном плоде производить кесарево сечение во время операции по поводу кишечной непроходимости нецелесообразно. При перитоните предпринимают абдоминальное родоразрешение с обязательной над влагалищной ампутацией матки.
Лечение кишечной непроходимости проводят вместе с хирургами и начинают с консервативных мер: сифонная клизма, внутривенное введение глюкозо-новокаиновой смеси, изотонического раствора натрия хлорида (до 2-3 л). Таким образом удается ликвидировать динамическую кишечную непроходимость. Сифонную клизму применяют не только с лечебной, но и с диагностической целью: чем больше жидкости входит одномоментно в кишку, тем выше расположена обструкция. При спаечной кишечной непроходимости консервативные мероприятия не должны продолжаться более 2'/2 ч; при толстокишечной непроходимости их можно продолжать до 3'/2 ч. Позже указанных сроков наступает некроз кишки, происходят глубокие волемические и электролитные сдвиги, что чревато серьезными осложнениями.
Большое значение имеет хорошая подготовка к операции. При удовлетворительном состоянии больной нужно торопиться с операцией, а при тяжелом шоковом состоянии необходимо прежде всего вывести больную из этою состояния и одновременно готовиться к операции Вводят 200-400 мл 0 25 % раствора новокаина. Водно-электролитные нарушения компенсируют с помощью пол и электролитных растворов. Компенсируют белковый дефицит, вызывающий нарушения деятельности ЦНС; восстанавливают объем циркулирующей крови путем переливания свежезамороженной плазмы или сыворотки крови. Нормализуют кислотно-основное (КОС) состояние посредством введения 4% раствора натрия гидрокарбоната (100-300 мл). Вводят карднотонические средства – коргликон, аскорбиновую кислоту.
Указанные мероприятия могут привести к разрешению кишечной непроходимости. В противном случае выполняют операцию с целью устранения препятствия, опорожнения кишечника и его дренирования в послеоперационном периоде.
После операции осуществляют ряд мероприятий: постоянную аспирацию кишечного содержимого; возмещение дефицита белков, электролитов, крови, витаминов и жидкости; нормализацию КОС; назначают антигистаминные и карднотонические средства, глюкозу с инсулином, панангин, антибиотики широкого спектра действия; осуществляют профилактику агрегации форменные элементов крови (реополиглюкин, гепарин).
Панкреатит.
Клиническая картина. У 75% беременных острый панкреатит клинически проявляется острыми мучительными болями в верхней части живота (подложечная область, левое или правое подреберье). Часто отмечаются опоясывающие боли. Появляются тошнота, рвота, развивается коллапс. В самом начале заболевания живот может оставаться мягким, отсутствуют симптомы раздражения брюшины; в дальнейшем на первый план выступают явления пареза кишечника и кишечной непроходимости.
Однако у беременных чаще, чем вне беременности, наблюдаются безболевые формы острого панкреатита. В этих случаях заболевание проявляется шоком и симптомами поражения ЦНС При подобном течении острого панкреатита прогноз в отношении жизни беременной крайне неблагоприятен, смертность в таких случаях составляет 83 %; во время шока могут произойти преждевременные роды.
При осмотре иногда выявляют иктеричность склер. На коже могут появляться самопроизвольные "синячки" или подкожные кровоизлияния, Участки цианоза на коже боковых поверхностей живота (симптом Грея Тернера) или вокруг пупка (симптом Каллена). У половины больных наблюдается лихорадка. В большинстве случаев острого панкреатита уровень амилазы в крови повышается через 8 ч после приступа и достигает пика через 24 – 36 ч. Значительно увеличивается содержание амилазы (диастазы) в моче, обычно через 24-48 ч после начала заболевания, и остается повышенным в течением 10 дней. Уровень липазы повышается несколько позже и остается таким дольше, чем уровень амилазы.
Важное диагностическое значение имеет снижение содержания кальция крови. У большинства женщин, у которых во время беременности развивается острый панкреатит, отмечается лейкоцитоз и приблизительно у 1д анемия.
Острый панкреатит сопровождается изменением уровня глюкозы в крови, часто гипои гиперкалиемией. Гипогликемия может быть объяснена голоданием или повышенным уровнем инсулина. Гипергликемия свидетельствует о тяжелом течении заболевания, обычно заканчивающегося летально У 15-25 % женщин после приступа острого панкреатита развивается сахарный диабет.
При УЗИ поджелудочной железы острый панкреатит выявляют в 100 % случаев, хотя при сроке беременности 18-20 нед и более матка может помешать визуализации поджелудочной железы.
Лечение острого панкреатита проводят совместно с хирургом. Оно заключается в лечении шока. Для подавления функции поджелудочной железы производят отсасывание желудочного содержимого с помощью назогастрального зонда, исключают прием препаратов и пищевых продуктов внутрь (режим голода и жажды), вводят холинолитики: атропина сульфат (по I мл 0,1 % раствора подкожно), платифиллина гидротартрат (по 1 мл 0,2 % раствора подкожно), а также ферментные ингибиторы – гордокс, контрикал, трасилол (сначала 25 000-50 000 ЕД внутривенно, затем 25 000- 75 000 ЕД в 5 % растворе глюкозы капельно; в следующие дни вводят по 50 000-25 000 ЕД в сутки, уменьшая дозу по мере улучшения клинической картины и результатов лабораторных исследований).
Для купирования болей и спастических явлений вводят спазмолитические препараты и болеутоляющие средства: но-шпу (по 2-4 мл 2 % раствора внутримышечно), папаверина гидрохлорид (по 1-2 мл 1-2 % раствора внутримышечно), анальгин (по 1-2 мл 50 % раствора внутримышечно), баралгин (по 5 мл внутривенно или внутримышечно), новокаин (по 2-5 мл 0,25 % раствора внутривенно). Больным с панкреонекрозом для предотвращения нагноения назначают антибиотики. С целью снижения секреторной функции поджелудочной железы и устранения ее отека показано введение мочегонных средств (1 – 2 мл 1 % раствора лазикса внутривенно).
Кроме того, при лечении острого панкреатита необходимо поддерживать электролитный баланс. С этой целью вводят большое количество жидкости (3 – 6 л) с электролитами. В случае обнаружения гипергликемии назначают инсулин.
В отсутствие эффекта от проводимой адекватной консервативной терапии производят операцию в хирургическом отделении.
Акушерская тактика. Убедительные доказательства того, что прерывание беременности в I триместре или вызывание преждевременных родов во второй ее половине улучшают прогноз для матери, отсутствуют. При развитии острого панкреатита во время беременности необходимо как можно раньше начать адекватную терапию; в отсутствие эффекта от лечения вопрос о прерывании беременности и последующем хирургическом лечении решают строго индивидуально. Выбор метода родоразрешения у беременных с острым панкреатитом представляет большую сложность. Операция кесарева сечения нежелательна, так как ее приходится выполнять при инфицировании брюшной полости, поэтому методом выбора может быть экстраперитонеальное кесарево сечение.
Хронический панкреатит.
Заболевание развивается после перенесенного острого панкреатита либо как первично-хронический процесс. Обострение хронического панкреатита во время беременности возникает так же редко, как острый панкреатит.
Клиническая картина обострения хронического панкреатита во время беременности во многом сходна с таковой при его обострении вне беременности.
Дополнительные исследования такие же, как при остром панкреатите.
Лечение. Складывается из тех же принципов, что и при остром панкреатите. Диетотерапия является основным и наиболее важным звеном комплексной терапии при хронической форме заболевания. В период ремиссии следует принимать пищу 4-5 раз в день. Пища должна содержать избыточное количество углеводов, водорастворимых витаминов, веществ, оказывающих липотропное действие, ограниченное количество жиров при нормальном или повышенном количестве белков. Запрещается употребление холодных напитков, тортов, пирожных, крепких мясных или рыбных бульонов.
При обострении хронического панкреатита в первые 1-3 дня назначают режим голода и жажды. В последующем рекомендуется диета со значительным ограничением калорийности, с исключением из пищевого рациона жира, поваренной соли, азотсодержащих экстрактивных веществ. В дальнейшем назначают преимущественно углеводистую и белковую пищу. Из лекарственных средств показаны спазмолитические и болеутоляющие, антиферментные препараты.
В период ремиссии хронического панкреатита назначают панкреатин (по 1 г 3 раза в день после еды) или препараты, содержащие ферменты желудка, поджелудочной железы и тонкой кишки: холензим, панзинорм, фестал (по 1-2 таблетки 3 раза в день после еды).
Акушерская тактика. При стойкой ремиссии заболевания, в отсутствие выраженных нарушений функции поджелудочной железы и осложнений, таких как сахарный диабет, беременность при хроническом панкреатите может быть разрешена. С первых недель беременности женщины с хроническим панкреатитом должны находиться под наблюдением акушера-гинеколога и терапевта, с тем чтобы при появлении первых признаков обострения заболевания была начата соответствующая терапия. Беременность у таких больных в 28 % случаев осложняется ранним токсикозом (тошнота, рвота), причем нередко рвота продолжается до 16-17 нед беременности. Хронический панкреатит существенно не влияет на течение второй половины беременности и на ее исход. При обострении заболевания тактика ведения беременности и родов такая же, как при остром панкреатите.
Острый аппендицит. Во время беременности нередко развивается острый аппендицит в тяжелой деструктивной форме. Этому способствует смещение вверх и кнаружи слепой кишки вместе с червеобразным отростком по мере роста матки, что в свою очередь приводит к перегибу и растяжению его, Разрывам старых сращений, нарушению опорожнения, а также ухудшению кровоснабжения червеобразного отростка. Немаловажную роль играет имеющаяся при беременности склонность к запорам, в результате которых происходит застой содержимого кишечника и повышение вирулентности Кишечной микрофлоры. Наконец, определенное значение принадлежит и гормональным сдвигам, приводящим к функциональной перестройке лимФоидной ткани.
Примерно 1/4 заболеваний аппендицитом приходится на первую половину беременности и 1/4 – вторую. Деструктивный аппендицит способствует прерыванию беременности, а иногда гибели плода.
Клиническая картина и диагностика острого аппендицита в первую половину беременности (до 20 нед) мало чем отличается от таковой у небеременных.
В первую половину беременности острый аппендицит необходимо дифференцировать от раннего токсикоза, почечной колики, пиелонефрита, холецистита, панкреатита, острого гастрита, внематочной беременности, пневмонии и пере крута ножки кисты яичника. Для этого определяют симптом Пастернацкого (отрицательный при аппендиците), мочу (не должна содержать патологических элементов), кал, выслушивают легкие (в сомнительных случаях производят рентгеноскопию), обязательно обследуют беременную бимануально, производят хромоцистоскопию (при почечной колике индигокармин не выделяется из обтурированного мочеточника). Производят УЗИ для исключения перекрута ножки яичникового образования, внематочной беременности.
В первой половине беременности некоторое повышение температуры тела, рвота могут быть следствием раннего токсикоза. В более поздние сроки клиническая картина острого аппендицита выражена нечетко в отличие от таковой при беременности. Боли, появляющиеся внезапно, иногда не столь значительны, как вне беременности. Возможны тошнота, рвота, повышение температуры тела до 38 °С или отсутствие гипертермии. Пульс учащается до 100 в минуту и более. При пальпации защитное напряжение мышц живота выражено слабо из-за перерастянутости брюшной стенки и расположения червеобразного отростка за маткой. Симптомы Ровзинга и Ситковского сохраняют свое значение, но не всегда положительное. Часто отчетливо определяется симптом Бартомье – Михельсона: усиление боли при пальпации в положении больной на правом боку (когда червеобразный отросток придавлен маткой), а не на левом, как у небеременных. Симптом раздражения брюшины (Щеткина – Блюмберга) возникает рано. При исследовании крови выявляется лейкоцитоз.
Во второй половине беременности, когда червеобразный отросток расположен высоко, аппендицит особенно трудно дифференцировать от правостороннего пиелонефрита. У этих заболеваний различно начало: аппендицит всегда начинается с болей, а затем повышается температура тела и появляется рвота; пиелонефрит начинается с озноба, рвоты, лихорадки, и лишь после этого появляются боли. Максимальная болезненность при пиелонефрите беременных выявляется при пальпации ближе к поясничной области. Помочь в правильной ориентации может пальпация в положении больной на левом боку; в этом случае, благодаря некоторому смешению матки влево, удается более детально прощупать область червеобразного отростка и правой почки. Анализ мочи помогает уточнить диагноз острого пиелонефрита. Тем не менее если остаются сомнения, больную лучше подвергнуть операции, чем проводить консервативное лечение с риском развития аппендикулярного перитонита.
Лечение. У беременных хирургическая тактика более активна, чем У небеременных. Больную лучше оперировать даже тогда, когда имеются сомнения в диагнозе. При консервативном лечении есть риск развития аппендикулярного перитонита. Острый аппендицит вне зависимости от срока беременности является показанием к операции. Операция показана даже при картине стихающего приступа острого аппендицита, так как при беременности на фоне измененного иммунологического статуса вероятность развития деструктивного процесса значительно возрастает. В первой половине беременности техника операции не отличается от таковой вне беременности. Рана зашивается наглухо.
По желанию женщины аборт производят через 2-3 нед после операции.
Во II половине беременности следует производить рассечение передней брюшной стенки выше, чем разрез Мак-Бернея – Волковича – Дьяконова. В последние недели беременности разрез производят несколько выше подвздошной кости вследствие значительного смещения слепой кишки и червеобразного отростка кверху. Максимально удобен расширенный разрез Мак-Бернея – Волковича – Дьяконова с надсечением края влагалища правой прямой мышцы. Методом выбора является нижнесрединная лапаротомия.
В послеоперационном периоде, помимо обычной терапии, необходимо назначить лечение, направленное на профилактику преждевременного прерывания беременности. Категорически противопоказано введение прозерина, гипертонического раствора натрия хлорида как веществ, способствующих сокращению матки. По этой же причине не следует применять гипертонические клизмы.
Если операция и послеоперационный период прошли без осложнений и признаков прерывания беременности нет, то женщине разрешают вставать на 4-5-й день.
В случае возникновения разлитого перитонита на фоне острого аппендицита летальность очень высокая и составляет, по данным различных авторов, 23-55 % для матери и 40-92 % для плода, причем наибольшая летальность наблюдается в поздние сроки беременности.
Неблагополучные результаты лечения разлитого гнойного перитонита у беременных породили у старых авторов крайний радикализм в хирургической тактике. При этом считалось необходимым выполнить следующий объем оперативного вмешательства: сразу же после вскрытия брюшной полости произвести кесарево сечение, затем надвлагалищную ампутацию матки, затем аппендэктомию, туалет и дренирование брюшной полости. В настоящее время, благодаря наличию мощных антибактериальных средств, в большинстве случаев удается не прибегать в подобных обстоятельствах к кесареву сечению, а тем более – к последующей ампутации матки. Необходимо подчеркнуть, что вопрос об объеме и характере вмешательства при деструктивном аппендиците при больших сроках беременности следует решать совместно с хирургом.
Принцип современной хирургической тактики можно кратко сформулировать следующим образом: максимальная активность в отношении перитонита, максимальный консерватизм в отношении беременности.
В случае разлитого перитонита при доношенной или почти доношенной беременности (36-40 нед) операцию начинают с кесарева сечения, затем после ушивания матки производят аппендэктомию и все дальнейшие манипуляции, связанные с лечением перитонита.
Настоятельная необходимость в ампутации матки возникает лишь при Флегмонозном или гангренозном ее поражении, что изредка наблюдается в Условиях разлитого гнойного перитонита.
Острый аппендицит в родах. Существуют разноречивые мнения о том когда в подобных случаях нужно производить аппендэктомию: до или после родоразрешения, предоставить ли роды естественному течению или же произвести одномоментно кесарево сечение и аппендэктомию. По этому поводу необходимо заметить, что хирургическая тактика при аппендиците в родах зависит как от течения родов, так и от клинической формы острого аппендицита. Так, если роды протекают нормально при клинической картине катарального или флегмонозного аппендицита, то нужно способствовать быстрейшему естественному родоразрешению и затем произвести аппендэктомию. Если на фоне нормального течения родов имеется клиническая картина гангренозного или перфоративного аппендицита, то нужно произвести одномоментно кесарево сечение и аппендэктомию.
Независимо от сроков родоразрешения больную для аппендэктомии и последующего послеоперационного ведения необходимо перевести в хирургическое отделение, где она должна находиться под наблюдением как хирурга, так и гинеколога.
Наследственная и врожденная тромбофилия. Тромбоцитопатии
Наследственная и врожденная тромбофилия
К клиническим проявлениям, свидетельствующим о наследственном или врожденном характере тромбозов и тромбоэмболии, относятся: 1. тромбозы в молодом и юношеском возрасте; 2. рецидивирующий венозный тромбоз, первый эпизод которого произошел в молодом возрасте (до 30 лет); 3. наличие в семейном анамнезе случаев тромбоза нижних конечностей, брыжейки и легочной артерии; 4. тромботические осложнения после травм и операций; 5. тромбозы и рецидивирующий тромбофлебит в ранние сроки беременности; 6. тромботические проявления в ответ на любые заболевания, особенно в молодом возрасте; 7. рецидивирующие венозные тромбозы при лечении антикоагулянтами; 8. тромботические осложнения при терапии эстроген-гестагенными препаратами.
Гемостазиологическое обследование больных с высоким риском развития тромботических осложнений основано на определении активности и концентрации антитромбина III, протеинов С и S, резистентности к протеину С, гемостазиологической оценке реакции системы гемостаза на применение антикоагулянтов, оценке деятельности фибринолитической системы (включая определение активности и концентрацию плазминогена, его активаторов и ингибиторов, проведение пробы на выявление дефекта внешнего пути активации фибринолиза), выявлении признаков дисфибриногенемии.
Антитромбин Ш является мощным естественным ингибитором свертывания крови, на долю которого приходится 75 % антикоагулянтной активности. Действие антитромбина III заключается в нейтрализации тромбина, активированных факторов XII, XI, X, IX, калликреина и в меньшей степени плазмина, трипсина, Сгкомпонента комплемента.
С начала III триместра беременности биологическая активность антитромбина III снижается до 70-80 %. Выраженное потребление антитромбина Ш и снижение его биологической активности у беременных происходит при заболеваниях, при которых развивается ДВС-синдром в острой и подострой формах, – эмболии околоплодными водами, преждевременной отслойкой нормально расположенной плаценты, септическом шоке, тяжелых формах гестозов, длительной задержке мертвого плода в матке.
Мигрирующий тромбоз и тромбофлебит, возникающие во время беременности, после родов или кесарева сечения, довольно часто служат проявлением стертых форм заболевания с уровнем антитромбина 1 1 1 60-70 %.
Снижение активности антитромбина III ниже 40 % клинически проявляется многократными венозными тромбозами в возрасте 20-30 лет, а в особо тяжелых случаях – при гомозиготном типе наследования болезни, когда уровень антитромбина III составляет 2-3 %, тромбоэмболии приводят к гибели в периоде новорожденное™ или в раннем детском возрасте. Диагностика наследственного или врожденного дефицита антитромбина III основывается на определении его содержания и активности.
Приобретенная недостаточность антитромбина III описана при всех заболеваниях, протекающих с ДВС-синдромом (гиперпотребление), тяжелых заболеваниях печени (нарушение синтеза), заболеваниях почек с выраженной протеинурией (потеря антитромбина III одновременно с белком), после хирургических вмешательств, гемодиализа, на фоне пролонгированной гепаринотерапии при тромбозах и тромбоэмболиях, при длительном применении эстроген-гестагенных препаратов.
Протеин С относится к витаминзависимым протеинам плазмы. Активную форму, способную давать антикоагулянтный и стимулирующий фибринолиз эффекты, протеин С приобретает при связывании тромбина специальными рецепторами к нему, находящимися на мембране клеток эндотелия. При этом происходят не только активация протеина С, но и потеря способности тромбина активировать тромбоциты и превращать фибриноген в фибрин.
Активный протеин С как естественный антикоагулянт инактивирует активированные факторы VIII и V, а также, ингибируя активность ингибитора активатора плазминогена, усиливает общую фибринолитическую активность.
Наследственный или врожденный дефицит протеина С (заболевание с аутосомно-доминантным типом наследования) клинически проявляется рецидивирующими венозными тромбозами и тромбоэмболиями, некрозом кожи в случае применения средних и больших доз непрямых антикоагулянтов и злокачественной пурпурой новорожденных.
Фибринолитическая система состоит из трех компонентов: 1. плазминогена, который является основным субстратом фибринолитической системы и может быть активирован в плазмин; 2. активаторов плазминогена различного происхождения; 3. ингибиторов активации плазминогена и ингибиторов, нейтрализующих плазмин.
Наследственный или врожденный дефект фибринолитической системы (гипофибринолиз) может стать причиной рецидивирующего венозного тромбоза и тромбоэмболии.
Тяжелые тромбоэмболические состояния могут наблюдаться при дисфибриногенемии – врожденных или наследственных аномалиях структуры фибриногена. При этом нарушается чувствительность фибринового сгустка (аномального) к воздействию тканевого активатора плазминогена. Данная форма болезни наследуется по аутосомно-доминантному типу. При наследственной или врожденной дисфибриногенемии нарушается не только фибринолиз, что обусловливает тромботические осложнения, но и свертывание крови ввиду отсутствия чувствительности фибриногена к тромбину, что клинически может проявиться кровоточивостью (чаше наблюдаются ювенильные кровотечения).
В клинической практике весьма часто встречаются аномалии фибриногена как следствие множества острых и хронических заболеваний. Так, низкая концентрация фибриногена может быть следствием его ускоренного катаболизма при ДВС-синдроме (коагулопатии потребления), нарушенного синтеза при тяжелой патологии печени. Повышение концентрации фибриногена обнаруживается при увеличении СОЭ, хронических формах ДВС-синдрома, когда синтез фибриногена превалирует над его расхо-дованием. Приобретенная дисфункция молекулы фибриногена возникает как следствие его частичной протеолитической деградации.
Классическими гемостазиологическими признаками дисфибриногенемии являются увеличение тромбинового и рептилазного времени при нормальном содержании продуктов деградации фибрина и фибриногена.
Важнейшим принципом профилактики рецидивов тромбозов у больных с на-следственной или врожденной тромбофилисй в родах, в послеродовом и послеопе-рационном периодах является заместительное введение дефицитного фактора (обу-словившего громбофилию), свежезамороженной плазмы, содержащей ингибиторы свертывания крови (антитромбин III, протеин С) и компоненты фибринолиза (плазминоген). Больным с наследственной или врожденной тромбофилией противопоказано применение эстроген-гестагенных препаратов, ингибиторов фибринолиза (аминокапроновая кислота, гордокс, трасилол, контрикал, кальция хлорид, викасол, дицинон) и прочих препаратов, повышающих свертывание крови. Следует отметить, что ятрогенный тромбоз в случае применения названных препаратов является основанием для прицельного исследования всех звеньев системы гемостаза.
При тромбофилии всех видов, обусловленных дефицитом одного или нескольких ингибиторов свертывания крови (антитромбина III, протеина С, протеиназ), основным методом патогенетической терапии является замещение недостающих компонентов. С этой целью используют свежезамороженную донорскую плазму, поскольку в процессе замораживания значительно повышается активность антитромбина III. После размораживания плазму вводят внутривенно струйно. Если до назначения плазмы беременной или родильнице не проводили антикоагулянтную терапию, то вместе с плазмой необходимо ввести 5000 ЕД гепарина. Если дефицит антитромбина III выявлен на фоне применения гепарина (т.е. отмечалась гепарин»резистентность), то свежезамороженную плазму вводят через 3 ч после подкожного введения гепарина. Контроль дозы проводят на основании тестов, характеризующих кинетику свертывания крови (активированное частичное тромбопластиновое время, "r+к" тромбоэластограммы), контроль эффективности проводимой заместительной и антикоагулянтной терапии – по увеличению активности и содержания антитромбина Ш, протеина С и S.
В случае необходимости длительной антикоагулянтной терапии назначают непрямые антикоагулянты (пелентан) сначала в течение 48-72 ч на фоне применения гепарина, после чего его отменяют. Недооценка особенностей применения непрямых антикоагулянтов может привести к тромботическим осложнениям в случае отмены гепарина сразу после назначения лелентана в связи с замедленным действием пос-леднего, а при глубоком дефиците протеина С может наступить некроз кожи.
При гипоплазмшюгенемии применение свежезамороженной плазмы способст-вует восстановлению фибринолитического потенциала крови.
При гипои дисплазминогенемии тромболитическая терапия может привести к усилению депрессии фибринолиза, поэтому ее целесообразно проводить в сочета-нии с введением свежезамороженной плазмы.
Тромбоцитопатии
Идиопатическая тромбоцитопеническая пурпура
Идиопатическая тромбоцитопеническая пурпура (ИТП) – заболевание неизвестной этиологии, при котором развивается аутоиммунная тромбоцитопения. Клинически болезнь характеризуется легко возникающими кровоподтеками и пурпурой.
Верификация диагноза основана на отсутствии признаков болезни в раннем детстве, лабораторных и морфологических признаков наследственных и врожденных форм тромбоцитопении, признаков болезни у кровных родственников, положительном эффекте от применения глюкокортикоидных препаратов, обнаружении антитромбоцитарных антител, исключении таких причин тромбоцитопенической пурпуры, как острый лейкоз, аплазия костного мозга, дефицит витамина В и фолиевой кислоты, болезни Маркиафавы – Микели.
В случае частых обострений ИТП беременность представляет опасность как для матери, так и для плода. При обострении ИТП в случае наступившей беременности прерывание ее в I и во II триместрах представляет не меньшую опасность, чем ее продолжение.
В большинстве случаев беременность протекает благополучно и не приводит к обострению болезни, поэтому нет необходимости применять глюкокортикоиды. Лишь в родах показано назначение преднизолона в средней дозе 15-30 мг. После родов дозы преднизолона снижают под контролем количества тромбоцитов. Грудное вскармливание не показано ввиду угрозы перехода антител через молоко матери ребенку. В случаях обострения ИТП при беременности показана терапия глюкокорти ко идами. В редких тяжелых случаях ИТП, когда у беременных имеется выраженная кровоточивость и отсутствует эффект от применения глюкокортикоидов, может встать вопрос об одновременном проведении двух операций – кесарева сечения и спленэктомии по жизненным показаниям.
Наследственные тромбоцитопатии
Одним из видов наследственной тромбоцитопатии является тромбастения Ланцманна, но имеются и другие синдромы, сопровождающиеся изменением тромбоцитарного звена.
Тромбастения Гланцманна.
Заболевание характеризуется нормальным колсгичеством тромбоцитов и отсутствием или неполной ретракцией кровяного Устка.
Клинически геморрагический диатез при тромбоцитопатии проявляется носовыми кровотечениями, кровоточивостью десен, петехиями, подкожными кровоизлияниями, менои метроррагиями. При беременности геморрагические симптомы могут сохраняться, роды сопряжены с большим риском для матери. Эффективная профилактика кровотечения – переливание тромбоиитной массы во втором и третьем периодах родов, а также при выполнении кесарева сечения.
Дородовой диагноз возможен, если исследовать функцию тромбоцитов плода (кордоцентез). Заболевание наследуется по аутосомно-рецессивному типу.
Синдром Бернара – Сулье. Заболевание характеризуется кровоточивостью, обусловленной гигантскими дегенеративными формами тромбоцитов при их нормальном количестве, увеличением времени кровотечения. Заболевание наследуется по аутосомно-рецессивному типу. Беременность и роды опасны, если нет ремиссии.
Профилактика кровотечений заключается во введении тромбоцитной массы.
Болезни, связанные с недостаточностью пула накопления
Эти болезни стали распознаваться недавно, и еще не все они идентифицированы. В основедисфункции тромбоцитов при этих болезнях лежит неспособность тромбоцитов накапливать АТФ, серотонин, адреналин, фактор IV и другие вещества и выделять их при осуществлении гемостаза.
Наиболее эффективным средством профилактики кровотечения в родах и при выполнении кесарева сечения является заместительная терапия тромбоцитной массой.
Сахарный диабет
В последние годы проблема сахарного диабета (СД) у беременных и их потомства приобрела важное медико-социальное значение. Осложненное течение беременности и родов при СД, крайне неблагоприятное влияние этого заболевания на внутриутробное развитие плода приводят к инвалидизации беременных, а также к повышению частоты пороков развития, высокой перинатальной заболеваемости и смертности. Несмотря на улучшение диагностики и терапии СД, перинатальная смертность при данной патологии, даже в специализированных отделениях, остается крайне высокой.В классификации СД, предложенной ВОЗ (1985), выделены инсулинозависимый сахарный диабет (ИЗСД; тип I), инсулинонезависимый сахарный диабет (ИНСД; тип II), гестационный сахарный диабет (ГСД) и Другие формы. Дополнительно к этому R.Mazze предложил выделять две формы СД, наблюдающегося во время беременности: прегестационный (СД I и И типа, имеющийся у женщины до зачатия) и гестационный (СД, развивающийся во время беременности) сахарный диабет.
ГСД представляет собой нарушение толерантности к глюкозе, возникающее во время беременности и обычно проходящее после родов. Эта форма СД наблюдается в среднем у 2 % беременных и чаще развивается в середине II триместра беременности. У подавляющего большинства таких женщин имеется избыток массы тела (более 90 кг) и отягощенный по сахарному диабету анамнез (1-я степень родства). Катамнестические наблюдения заданной категорией больных показали, что более чем у 50 % из них в течение ближайших 15 лет развивается ИНСД или ИЗСД
С учетом особенностей течения беременности и ролов при СД для профилактики осложнений как у матери, так и плода особое внимание необходимо уделять раннему выявлению беременных с нарушениями углеводного обмена. Выявление беременных с повышенным риском развития СД осуществляется поэтапно в условиях женской консультации. На первом этапе повышенную вероятность развития заболевания определяют на основании следующих фактов: 1. данных анамнеза беременной: указания на отягощенной по СД или другим обменным и гормональным нарушениям семейный анамнез или наличие этих нарушений у самой беременной, возраст более 30 лет, появление при предыдущие беременностях "диабетических" жалоб, глюкозурии, гестационного диабета, таких акушерских осложнений, как невынашивание, многоводие, гестоз, инфекция мочевыводяших путей, рождение крупных детей (масса 4.5 кг и более), гибель детей, причина которой не установлена; 2. выявления этих осложнений при настоящей беременности; 3.. результатов лабораторных анализов – выявление глюкозурии, особенно до 20 нед беременности.
При наличии одного или нескольких факторов риска беременную обследуют на втором этапе – определяют уровень глюкозы в крови натощак и суточной моче. В случае выявления у беременной при повторных анализах уровня гликемии натощак выше 4,4 ммоль/л и глюкозурии показано проведение орального теста на толерантность к глюкозе (ТТГ) с 75 г глюкозы – третий этап обследования. Если в течение 2 ч после приема глюкозы уровень ее в плазме венозной крови или цельной капиллярной крови 11 ммоль/л и выше, то устанавливают диагноз ГСД. При нарушении толерантности к глюкозе (НТГ) во время беременности уровень гликемии в течение 2 ч после приема глюкозы составляет 8,0-10.9 ммоль/л.
Необходимо помнить, что нельзя устанавливать или отвергать диагноз ГСД на основании результатов однократного определения уровня глюкозы и ТТГ. Для этого нужно располагать одинаковыми результатами минимум лвух исследований. Лучше проводить ТТГ при сроке беременности 24-28 нед, предпочтительнее в 26 нед. При наличии факторов риска развития ГСД этот тест можно выполнить и раньше – между 18-й и 22-й неделями беременности.
Проведение полного ТТГ у всех беременных требует больших затрат времени и средств, поэтому у беременных с повышенным риском развития ГСД вначале можно проводить скрининг-тест, который состоит в определении гликемии через 1 ч после приема 50 г глюкозы. Если в этом случае Уровень гликемии в плазме венозной крови превышает 7,8 ммоль/л, то проводят полный ТТГ.
Течение и ведение беременности у больных СД. Первая половина беременности у большинства больных СД протекает без осложнений. Исключение составляют пациентки, у которых существует угроза самопроизвольного аборта, частота которого у больных СД несколько выше (15 %) , чем у здоровых беременных (10 %) , а также больные с сосудистыми осложнениями СД, про фесе ирование которых, начиная с ранних сроков беременности, может осложнять ее течение и даже привести к необходимости прерывания.
Во второй половине беременности значительно чаще отмечаются такие акушерские осложнения, как гестоз (50-80 % ) , многоводие (20-50 % ) , инфекция мочевыводящих путей (12,5-21,7 %) , угроза преждевременных родов (8- 12 %),гипоксия плода (8-12 %).
Что касается течения СД, то, как правило, в первые недели беременности может отмечаться улучшение толерантности к углеводам (эстрогены и хорионический гонадотропин стимулируют выделение инсулина поджелудочной железой, улучшается периферическое усвоение глюкозы и др.), что сопровождается снижением уровня гликемии и глюкозурии, появлением у беременных гипогликемических состояний, в связи с чем требуется снизить дозу инсулина.
Во второй половине беременности вследствие повышенной деятельности конгринсулярных гормонов (глюкагон, кортизол, плацентарный лактоген, пролактин) ухудшается толерантность к углеводам, усиливаются "диабетические" жалобы, повышается уровень гликемии и глюкозурии, возможно развитие кетоацидоза. К этому времени дозу вводимого инсулина необходимо значительно увеличить.
К концу беременности в связи со снижением уровня контринсулярных гормонов вновь улучшается толерантность к углеводам, снижается уровень гликемии и глюкозурии, поэтому дозу вводимого инсулина следует уменьшить.
Во время беременности больные СД должны находиться под амбулаторным и стационарным наблюдением. Беременные, у которых повышен риск развития СД при нормальной толерантности к углеводам и неосложненном акушерском анамнезе, могут находиться под строгим диспансерным наблюдением врача женской консультации и эндокринолога (терапевта). При увеличении степени риска развития СД беременная должна быть своевременно госпитализирована.
Беременных с вновь выявленным ГСД необходимо немедленно госпитализировать в эндокринологическое или специализированное по СД акушерское отделение для дополнительного обследования, подбора необходимой дозы инсулина, проведения курса профилактического лечения. В дальнейшем все беременные с ГСД подлежат тщательному наблюдению и лечению согласно рекомендациям по ведению беременности и родов у больных СД. Если больные ГСД, и особенно их плоды, в начале беременности не получали лечения, то это могло отразиться на течении и исходе беременности.
Оптимальным вариантом для беременных с СД является диспансерное наблюдение на базе специализированных по СД акушерских отделении, которые полностью обеспечивают как акушерские, так и эндокринологический аспекты амбулаторного и стационарного контроля. Стационарное лечение беременных, больных СД, в отсутствие у них акушерских осложнений и при сроке беременности до 20 нед целесообразно проводить в спеанализированных по СД акушерских или эндокринологических отделениях; со второй половины беременности таких больных необходимо госпитализировать в специализированные акушерские отделения, функционирующие на базе многопрофильной больницы.
Беременных с СД при первом посещении женской консультации после установления факта беременности и возможно более точного определения ее сроков следует предупредить об осложненном течении беременности и родов, прогнозе для плода (возможна наследственная отягощенность) и предложить им прервать беременность. При настойчивом решении сохранить беременность больная СД должна быть направлена в стационар. Целесообразно провести три госпитализации беременных с СД в стационар.
В отсутствие акушерских осложнений и при сроке беременности до 20 нед лечение целесообразно проводить в эндокринологических отделениях (компенсация СД), а со второй половины беременности больных госпитализируют в квалифицированное акушерское отделение. При первой госпитализации: 1. тщательное клиническое обследование, выявление сопутствующих заболеваний, установление акушерского и эндокринологического диагноза, определение степени риска и решение вопроса о целесообразности сохранения беременности; 2. выбор оптимальной дозы инсулина; 3. проведение курса профилактического лечения (оксигенотерапия, витамины, липотропные средства, дезагреганты). Вторую госпитализацию проводят при сроке беременности 21-24 нед в связи с возможным ухудшением течения СД и появлением осложнений беременности; третью – после 32 нед для тщательного наблюдения за плодом, лечения акушерских и диабетических осложнений, выбора срока и метода родоразрешения.
Основной принцип ведения беременности при СД – строгая, стабильная компенсация СД за счет восстановления обменных процессов, что в первую очередь предусматривает нормализацию углеводного обмена, которую по необходимости проводят совместно с эндокринологом путем индивидуального подбора дозы инсулина или соответствующей диеты. У беременных с СД уровень глюкозы в крови натощак должен быть в пределах 3,3-4,4 ммоль/л, а через 2 ч после еды – не более 6,7 ммоль/л.
За беременными с СД нужно осуществлять тщательный контроль (самоконтроль за течением заболевания, динамическое определение гликемии и гликированного гемоглобина, выполнение анализов мочи).
Для беременных с СД требуется диета из расчета 30-35 ккал идеальной массы тела, дополнительно 200-400 ккал (с учетом беременности). Суточная энергетическая ценность пищи в среднем составляет 1600-2000 ккал, причем 55 % ее покрывается за счет углеводов, 30 % – жиров, 15 % – белков. В пище должно содержаться достаточное количество витаминов (группы В, С, А, Е, D) и минеральных веществ. У беременных с СД и ожирением суточная энергетическая ценность пищи не должна превышать 1600 ккал (ограничение потребления жира, увеличение продуктов, содержащих пищевые волокна).
У беременных, больных СД, необходимо проводить тщательную профилактику и своевременное лечение акушерских осложнений. Следует погнить, что повышенная склонность беременных с СД к развитию тяжелых Форм гестоза и других осложнений беременности обусловливает необходимость строжайшего наблюдения за динамикой массы тела, артериального давления, анализами мочи и крови, а также педантичного соблюдения режима самой беременной.
В связи с повышенным риском развития различных аномалий у плодов матерей, больных СД, в практику акушерской диабетологии внедрена система мониторинга (УЗИи КТГ-контроль) за функциональным состоянием потомства больных СД матерей (начиная с 12 нед беременности до родоразрешения).
Течение и ведение родов у больных СД. Течение родов при СД часто осложняется несвоевременным излитием околоплодных вод (20- 30 % случаев), слабостью родовой деятельности (10-15 %) , в связи с наличием крупного плода, гипоксией плода, развитием клинически узкого таза затрудненным рождением плечевого пояса (6-8 % случаев).
В послеродовом периоде наиболее частыми осложнениями являются гипогалактия, а также инфекционные осложнения (эндометрит и др.).
В родах у беременных с СД могут наблюдаться как высокая гипергликемия и кетоацидотическое состояние (усиленная мышечная работа), так и гипогликемия.
В первые дни послеродового периода, особенно после абдоминального родоразрешения, уровень глюкозы в крови снижается, в дальнейшем же, к 4-5-му дню, он вновь повышается до обычного для каждой больной.
Срок родоразрешения у беременных с СД определяют индивидуально с учетом тяжести течения СД, степени компенсации заболевания, функционального состояния плода, наличия акушерских осложнений. Поскольку при СД отмечается запоздалое созревание функциональных систем плода, то оптимальными для больных СД беременных являются своевременные роды. Однако увеличение частоты различных осложнений к концу беременности (фетоплацентарная недостаточность, нарушение функционального со-стояния плода, гестоз и др.) нередко обусловливает необходимость родоразрешения этих беременных в 37-38 нед. Этот срок гестации в настоящее время следует рассматривать как приемлемый для родоразрешения беременных, больных СД.
При планировании родоразрешения беременных, больных СД, необходимо обязательно оценивать степень зрелости плода. При его недостаточной зрелости следует проводить терапию, направленную на ускорение созревания жизненно важных систем плода.
Оптимальными для матерей, больных СД, и их плодов являются роды через естественные родовые пути. Их необходимо проводить под постоянным КТГ-контролем и контролем уровня глюкозы в крови каждые 2 ч; в родах следует осуществлять тщательное обезболивание, лечение фетоплацентарной недостаточности, адекватную инсулинотерапию.
С учетом приведенных характерных для СД особенностей родового акта следует отметить следующие моменты. 1. Необходимость тщательной подготовки родовых путей по одной из существующих схем. 2. При подготовленных родовых путях родовозбуждение целесообразно начинать с амниотомии с последующим созданием гормонального фона. При развитии эффективной родовой деятельности роды ведут через естественные родовые пути с широким применением спазмолитических средств. 3. Для предупреждения вторичной слабости родовой деятельности при раскрытии шейки матки на 7-8 см необходимо начать внутривенное введение окситоцина и продолжить его по показаниям до рождения ребенка. 4. В родах необходимо тщательно следить за состоянием матери и плода, регулярно проводить профилактику гипоксии плода, контроль гемодинамических показателей матери и лечение сочетанного гестоза. 5. С целью профилактики декомпенсации СД в родах у роженицы необходимо регулярно (через 1-2 ч) определять уровень глюкозы в крови. Для предупреждения энергетического дефицита и декомпенсации заболевания с началом регулярной родовой деятельности у всех рожениц с СД I типа, некоторых рожениц с ГСД и СД П типа показано внутривенное капельное введение 10 % раствора глюкозы с инсулином. Регулярное по-ступление определенного количества глюкозы с инсулином позволяет достигнуть оптимального уровня глюкозы крови в родах – 6-7 ммоль/л. При значительном повышении уровня гликемии в родах коррекция СД может быть проведена путем введения (внутривенного или подкожного) инсулина. В связи с тем что у рожениц, больных СД, к концу родов часто развиваются такие тяжелые осложнения, как слабость потуг, гипоксия плода, затрудненное выведение его плечевого пояса, ведению второго периода родов должно быть уделено особое внимание. Для того чтобы предотвратить слабость потуг и обеспечить активную родовую деятельность к моменту рождения массивного плечевого пояса плода, необходимо продолжить начатую в конце первого периода родов активацию родовых сил окситоцином до рождения ребенка. В отсутствие гипоксии плода не следует форсировать рождение головки плода, целесообразнее выводить ее в конце паузы между потугами. В этом случае плечевой пояс опускается, и поворот плечиков совпадает с потугой, что обеспечит их рождение. В случае выявления гипоксии плода или вторичной слабости родовой деятельности показано оперативное родоразрешение – наложение акушерских щипцов, которое следует считать более бережным методом родоразрешения, чем длительное рождение головки в условиях нарастающей гипоксии плода. Для того чтобы предотвратить тяжелую травму и гибель плода при затрудненном выведении плечевого пояса, необходимо, не теряя времени, произвести эпизиотомию и срочно приступить к повороту плечиков и освобождению ручки плода (лучше задней) с помощью мануальных приемов. 6. При неподготовленных родовых путях в отсутствие эффекта от родовозбуждения или появлении симптомов нарастающей гипоксии плода роды необходимо закончить операцией кесарева сечения.
Плановое кесарево сечение у беременных, больных СД, проводят по следующим показаниям, помимо общепринятых в акушерстве: выраженные или прогрессирующие осложнения СД и беременности, тазовое предлежание плода, наличие крупного плода, прогрессирующая гипоксия плода. Следует помнить, что у больных СД матерей незрелые дети, извлеченные путем операции кесарева сечения, хуже адаптируются к условиям окружающей среды, чем дети такой же зрелости, но рожденные через естественные Родовые пути.
Влияние СД матери на развитие плода и новорожденного. Существует ряд особенностей, отличающих детей, рожденных больными СД Женщинами, от потомства здоровых матерей: характерный внешний вид, большая масса, значительная частота пороков развития, функциональная незрелость органов и систем, отклонение от нормального течения периода новорожденности, высокая перинатальная смертность. Весь этот комплекс известный под названием "диабетическая фетопатия", свидетельствует о значительных нарушениях внутриутробного развития этих детей.
Внешне новорожденные матерей, страдающих СД, напоминают больных синдромом Иценко – Кушинга: они часто рождаются нианотичными, отечными с чрезмерно развитой подкожной жировой клетчаткой, круглым лунообразным лицом, с большим количеством петехий и кровоизлияний на коже лица и конечностей, выраженным гипертрихозом, диспропорцией между головкой и туловищем – окружность головки значительно меньше окружности плечевого пояса.
Период новорожденности у потомства больных СД матерей характеризуется замедлением и неполноценностью процессов адаптации к условиям внеутробного сосуществования. Такие осложнения, как асфиксия, гипогликемия, синдром дыхательных расстройств, полицитемия, гипокалиемия, гипомагниемия, кардиомиопатия, заметно ухудшают течение периода новорожденности у потомства больных СД матерей.
В структуре перинатальной смертности значительный удельный вес занимает антенатальная гибель детей, частота которой увеличивается по мере прогрессирования беременности, и неонатальная смертность, которая заметно выше среди незрелых детей, родившихся ранее 35 нед беременности. Основной причиной смерти этих детей является синдром дыхательных расстройств, обусловленных ателектазом легких и болезнью гиалиновых мембран.
Ведение новорожденных при СД у матери. В связи с возможностью постнатальной гипогликемии особенностью ведения новорожденных при СД у матери является введение 10 % раствора глюкозы в вену пуповины сразу после рождения. Дальнейшее введение глюкозы этим новорожденным проводят из расчета суточной потребности в жидкости в зависимости от уровня гликемии, который проверяют через 2, 3 и 6 ч после родов, а затем по показаниям.
Потомство больных СД матерей нуждается в специализированном наблюдении педиатра и эндокринолога.
Оптимизация ведения беременных с СД и их потомства позволила в последние годы исключить материнскую смертность при этой патологии, а перинатальную смертность снизить до 2-4 %.
Планирование семьи у больных СД женщин. Важную роль в системе охраны здоровья матерей, больных СД, и их детей играют женские консультации, специализированные центры по СД, в задачи которых входят планирование семьи у больных СД женщин, диспансерное наблюдение за ними, ведение беременности у этого контингента больных. Предполагается также составление регистра больных СД женщин на участке, знакомство с особенностями заболевания у каждой больной. Больные СД должны иметь небольшую семью с учетом неблагоприятного влияния СД и беременности на здоровье женщин и их детей.
Противопоказания к беременности при СД следующие: 1. наличие прогрессирующих сосудистых осложнений СД (ретинопатия, нефропатия). Абсолютными противопоказаниями к беременности У больных СД женщин являются пролиферативная ретинопатия, также нефропатия, при которой клиренс креатинина менее 50 мл/мин, суточная протеинурия Зги более, креатинин крови более 130 ммоль/л, среднее артериальное давление более 107 мм рт.ст. У этих женщин течение беременности, как правило, осложненное, а прогноз для плода сомнителен: нередко возникает необходимость прерывания беременности по витальным показаниям при заведомо нежизнеспособном плоде; 2. наличие инсулинорезистентных и лабильных форм СД; 3. наличие СД у обоих супругов, в связи с чем значительно увеличивается вероятность раннего заболевания детей; 4. сочетание СД и резус-сенсибилизации матери, при котором значительно ухудшается прогноз для плода; 5. сочетание СД и активного туберкулеза легких, при котором беременность нередко приводит к тяжелому обострению процесса; 6. наличие в анамнезе у больных с хорошо компенсированным во время беременности СД повторных случаев гибели или рождения детей с пороками развития. Таким супружеским парам следует обратиться в меди ко-генетическую консультацию и только после этого решать вопрос о деторождении.
Вопрос о возможности беременности, ее сохранении или необходимости прерывания решается консультативно (нередко в стационаре) при участии акушера-гинеколога, терапевта, эндокринолога. Лучше решить этот вопрос до беременности.
Планирование беременности у больных СД. Планирование беременности у больных СД – единственный реальный путь снижения риска развития осложнений у матери и плода. В этой работе участвуют врачи многих специальностей (офтальмологи, генетики, терапевты, акушеры-гинекологи, нефрологи и др.). До беременности необходимо добиться стабильной нормализации обменных процессов, чтобы в период раннего эмбриогенеза предохранить плод от повреждающего влияния нарушений обмена у матери. Это предполагает нормализацию уровня гликемии в пределах 3,3 – 7,8 ммоль/л и гликозилированного гемоглобина до 6 % за 3-4 мес до планируемой беременности. Больных СД II типа, получающих сахароснижающие препараты и диетотерапию, целесообразно перевести на инсулинотерапию заблаговременно, т.е. при планировании беременности.
Методы контрацепции у больных СД женщин. В последние годы больные СД используют все методы контрацепции. В связи с влиянием противозачаточных гормональных препаратов на углеводный обмен У больных СД иногда может потребоваться увеличение дозы вводимого инсулина. При сосудистых осложнениях СД противозачаточные таблетированные препараты применять не следует. Больные с ГСД, который прекращается после родов, должны использовать только прогестины (фемоден и др.).
Заболевания, передаваемые половым путем
последние годы отмечается увеличение частоты возникновения заболеваний, передаваемых половым путем, в том числе и во время беременности.Так, хламидийную инфекцию обнаруживают у 12 % женщин, гонорею – у 2-3 %, сифилис – у 1-2 %, генитальный герпес – у 1 %, ВИЧ – у 0,4 %.
Сифилис.
Клиническая картина. В зависимости от клинического течения различают первичный, вторичный и третичный сифилис.
Первичный сифилис возникает после инкубационного периода продолжительностью 10-90 дней (обычно в течение 6 нед). Для беременных наиболее характерны шеечный шанкр (внедрение возбудителя в размягченную шейку матки) и твердый шанкр, который обычно самостоятельно регрессирует через 2-6 нед. Наличие твердого шанкра часто сопровождается безболезненным увеличением паховых лимфатических узлов.
Спустя примерно 8 нед после заживления твердого шанкра развивается вторичный сифилис в виде различной кожной сыпи, а также алопеции. Следует отметить, что проявления вторичного сифилиса остаются незамеченными у 25 % беременных. Третичный сифилис развивается с 3-го по 6-й год от начала заболевания, а иногда даже через 10 лет после заражения.
Установлено, что бледная трепонема проходит через плацентарный барьер и может вызвать инфицирование плода. Максимальная частота врожденного сифилиса плода отмечается при первичном сифилисе у матери и поздней латентной инфекции.
Под влиянием сифилитической инфекции плацента становится большой, отечной, ворсины утрачивают ветвистость, уменьшается число кровеносных сосудов в ворсинах, местами вплоть до их полного исчезновения, отмечаются некротические изменения в пупочном канатике, где обнаруживают бледные трепонемы спирохеты. При сифилисе поражаются внутренние органы плода, включая интерстициальные изменения в легких, печени, селезенке и поджелудочной железе.
Диагностика. В диагностике сифилиса важное место занимают серологические исследования: реакция связывания комплемента (РСК) с липидными антигенами – реакция Вассермана (RW), комплекс серологических реакций (КСР), реакция иммунобилизации бледных трепонем (РИБТ), реакция иммунофлюоресценции (РИФ). Серологические исследования проводят при первом обращении беременной в женскую консультацию. В арсенале серодиагностики, кроме того, имеются еще два специфических серологических теста – реакция пассивной гемагглютинации (РПГА) и иммуноферментный анализ (ИФА), РПГА может быть использован как поисковый тест и обе реакции – как специфические тесты для подтверждения диагноза. RW становится положительной лишь через 2-4 нед после возникновения первичной сифиломы.
С целью подтверждения диагноза врожденного сифилиса плода показано проведение кордоцентеза. При УЗИ плода обнаруживают асцит, гепатоспленомегалию, обструкцию желудочно-кишечного тракта и плацентомегалию. При допплерометрии выявляют нарушения маточно-плацентарно-плодового кровотока, при кардиотокографии – признаки хронической гипоксии плода.
Для профилактики врожденного сифилиса рекомендуется трехкратное серологическое обследование беременных: в первой половине беременности (при посещении акушера-гинеколога для постановки на учет по беременности) и во второй ее половине (в 24-28 нед, но не позднее оформления дородового отпуска по беременности).
Женщины, у которых после полноценного лечения наступила стойкая негативация КСР (отрицательные результаты по меньшей мере в течение года до наступления беременности), профилактическому лечению во время беременности не подлежат. Исключение могут составить лишь женщины с сохраняющейся выраженной позитивностью РИТ и/или РИФ без тенденции к их снижению. Женщины, получившие превентивную противосифилитическую терапию, также не подлежат дальнейшему лечению во время беременности.
Лечение. Специфическое лечение беременных проводят в соответствии со стадией заболевания препаратами пенициллинового ряда (новокаиновая соль пенициллина, экстенциллин, ретарпен, тардоциллин).
Профилактическое лечение беременных проводят по одной из следующих методик. 1. Водорастворимый пенициллин вводят по 400.000 ЕД 8 раз в сутки в течение 14 дней. 2. Новокаиновую соль бензилпенициллина вводят по 600.000 ЕД 4 раза в сутки в течение 14 дней. 3. Бициллин-1, бициллин-3 и бициллин-5 вводят в дозе 1.200.000, 1.800.000 и 1.500.000 ЕД соответственно 2 раза в неделю, на курс 7 инъекций.
Если специфическое лечение проведено в первые месяцы беременности, то профилактическое лечение должно быть начато не позднее 24- 28 нед. Если специфическое лечение проводят в более поздние сроки беременности, то профилактическое лечение следует за ним без перерыва.
Трихомоноз.
Трихомоноз выявляют у 3,6-9,1 % беременных. Клиническая картина. Заболевание нередко сопровождается обильными жидкими выделениями из половых путей, зудом в области наружных половых органов различной интенсивности, дизурическими явлениями. Во время беременности заболевание протекает по типу многоочагового поражения мочеполовых органов. В воспалительный процесс вовлекаются влагалище, большие железы преддверия влагалища, шейка матки, мочеиспускательный канал. Характерно развитие эрозивных и язвенных вульвитов и вагинитов.
Диагностика. Для установления диагноза необходимо исследование влагалищного содержимого; при микроскопии выятяют трихомонады.
Лечение. В первой половине беременности применяют местные виды терапии (обработка влагалища октиносептом), со второй половины, т.е. не ранее чем в 20 нед, – флагил (метронидазол, трихопол, клион) внутрь в курсовой дозе 5 г (по 0,25 г 2 раза в день после еды) в течение 10 дней.
Хламидиоз.
Заболевание диагностируют у 3-12 % беременных. При хламидийной инфекции могут развиться уретрит, сЛизисто-гнойный цервиЦ"т, острый сальпингит. У таких беременных происходят преждевременные Роды, отмечаются дородовое излитие околоплодных вод, их инфицированность, а у 10-30 % детей через 1-3 мес развивается хламидийная пневмония.
Диагностика. Диагноз устанавливают на основании результатов применения прямого иммунофлюоресцектного метода и при обнаружении хлаНдий в соскобе слизистой оболочки уретры и цервикального канала.
Лечение. См. Урогенитальный хламидиоз.
Туберкулез
Частота возникновения туберкулеза у беременных зависит от его распространенности в популяции и регионе. В последние годы отмечается заметный рост общей заболеваемости туберкулезом на территории Российской Федерации, что обусловливает увеличение частоты развития этой патологии у беременных.Наиболее частой формой туберкулеза является туберкулез легких. Заболевание выявляют приблизительно у 0,3 % беременных. Беременность оказывает неблагоприятное влияние на течение активного туберкулеза легких вызывая обострение процесса, что наиболее часто наблюдается при гематогенном, диссеминированном, инфильтративном, фиброзно-кавернозном туберкулезе. У большинства больных, у которых туберкулезный процесс находится в фазе уплотнения, обострения во время беременности не отмечаются. У 50 % больных женщин туберкулез протекает бессимптомно, у остальных основными проявлениями заболевания бывают субфебрилитет, кашель, потливость и небольшое увеличение массы тела.
У беременных, больных туберкулезом, часто происходят преждевременные роды, причинами чего являются специфическая инфекция, интоксикация и хроническая гипоксия. У них чаще, чем у здоровых беременных, наблюдаются ранний токсикоз и гестоз, отмечается меньшая продолжительность родов по сравнению с таковой у здоровых женщин. Осложненное течение родов отмечается у женщин с деструктивным процессом.
Другие формы туберкулеза – туберкулез почек, костей, туберкулезный менингит – у беременных наблюдаются крайне редко. В связи с успешным лечением туберкулеза почек антибактериальными препаратами возможно сохранение беременности. При проведении соответствующей специфической терапии ухудшения течения заболевания не наблюдается. Беременность и роды в этих условиях протекают нормально, дети рождаются здоровыми. При почечной недостаточности беременность необходимо прервать. После нефрэктомии по поводу туберкулеза почки при наличии здоровой, нормально функционирующей второй почки беременность не противопоказана. Туберкулез половых органов сопровождается бесплодием.
Диагностика. Для выявления туберкулеза во время беременности обязательно проводят обследование женщин из групп риска. К ним относятся беременные, у которых отмечался туберкулез в семье или анамнезе, с такими клиническими проявлениями, как слабость, потливость, субфебрилитет, кашель. Этим женщинам проводят реакцию Манту с оценкой кожной реакции через 48 и 72 ч. Положительный результат не означает наличия активного патологического процесса, а свидетельствует о необходимости дальнейшего обследования (посевы мокроты на микобактерии туберкулеза и рентгенография грудной клетки). Рентгенологическое исследование у беременных проводят с тщательным экранированием области живота (плод при этом подвергается минимальному облучению). Диагноз устанавливают на основании обнаружения микобактерии туберкулеза в мокроте. Все лина, контактирующие с женщиной, выделяющей микобактерии туберкулеза, под-лежат обязательному обследованию в противотуберкулезных диспансерах.
Лечение. При лечении предпочтение отдают изониазиду, этамбутолУВ случае очень тяжелых форм или при наличии резистентности к указанным препаратам допустимо применение рифампицина, однако в 1 триместре
беременности лечение этим препаратом нежелательно. Стрептомицин оказывает повреждающее действие на VIII пару черепных нервов плода. Лечение проводят под строгим контролем фтизиатра.
Акушерская тактика. Прерывание берменности в первые 12 нед производят по следующим показаниям: 1. распространенный деструктивный процесс в легких, плохо поддающийся лечению; 2. обострение процесса во время предыдущей берменности; 3. наступление беременности в первые 2 года после перенесенного милиарного туберкулеза или менингита; 4. наличие сопутствующих заболеваний почек, сахарного диабета и сердечно-легочной недостаточности.
В поздние сроки беременность прерывают в случае существования угрозы жизни.
Методы родоразрешения выбирают по акушерским показаниям, роды проводят в специализированных отделениях. При консервативном ведении родов необходимы кислородотерапия и тщательное обезболивание. Если женщина в конце беременности до родов получала противотуберкулезную терапию, то необходимо гистологическое исследование плаценты.
Грудное вскармливание разрешают женщинам, не выделяющим микобактерии туберкулеза, в противном случае новорожденных изолируют и вскармливают искусственно.
Инфицирование плода возможно при аспирации околоплодных вод или содержимого родовых путей во время родов. Заражение детей происходит крайне редко, и новорожденные, как правило, практически здоровы. Им необходимо сделать прививку вакциной БЦЖ в первые 6 дней жизни.
Патология половой системы
На течение беременности и родов влияют следующие патологические изменения половой системы: опухоли матки (миома или фиброма), новообразования яичников, врожденные аномалии развития половых органов, инфантилизм.Миома матки
Миома матки (фибромиома) довольно часто (в 0,5-2,5 % случаев) выявляется во время беременности. Опухоль состоит из мышечных и фиброзных клеток в различных сочетаниях, имеет доброкачественный характер. У беРеменных миома наблюдается чаще в виде узлов различной величины, Расположенных субсерозно и интерстициально. Субмукозное (подслизистое) Расположение узлов встречается реже, так как при этом наблюдаются либо бесплодие, либо аборты в ранние сроки гестации.
Течение беременности может быть осложненным, сопровождаться прерыванием ее в ранние сроки гестации, развитием плацентарной недостаточности, следствием которой является гипотрофия или гипоксия плода.?
При низком расположении миоматозного узла значительного размера нередко выявляется тазовое преддежание или косое положение плода Узел миомы может препятствовать рождению головки плода (рис. 12.1) Во время беременности может наблюдаться нарушение питания а узле, что определяется недостаточным кровоснабжением и чаще асептическим некрозом ткани узла. В редких случаях возможен септический некроз миоматозного узла.
Клиническая картина и диагностика. Миома матки в течение беременности может не проявляться клинически. При наличии узлов диагноз устанавливают при пальпации матки (узлы определяются как плотные образования). Уточнить наличие миомы матки любой локализации позволяет УЗИ.
При расположении плаценты $ проекции миоматозного узла нередко наблюдаются симптомы плацентарной недостаточности (см. Плацентарная недостаточность).
Ведение беременности. Абсолютных противопоказаний к сохранению беременности при миоме матки нет. Однако следует учитывать факторы, обусловливающие высокий риск развития осложнения исхода беременности: исходная величина матки, соответствующая 10-13 нед беременности; подслизистая и шеечная локализация узлов; длительность заболевания более 5 лет; нарушение питания в одном из узлов; консервативная миомэктомия со вскрытием полости матки и осложненным послеоперационным периодом.
На протяжении беременности следует тщательно следить за состоянием плода, своевременно проводя терапию, направленную на лечение плацентарной недостаточности. При появлении симптомов нарушения кровотока в миоматозном узле показаны препараты, улучшающие кровоток: 1. спазмолитики (но-шпа, баралгин, папаверин); 2. инфузионная терапия с включением таких компонентов, как трентал, реополиглюкин. Если нарушение кровотока в узле происходит во II-III триместре беременности, то целесообразно назначать инфузионные среды в сочетании с (бета-адреномиметиками (партусистен, алупент, бриканил, гинипрал).
 Рис. 12.1. Низкое расположение миома тозного узла.
Рис. 12.1. Низкое расположение миома тозного узла.
Отсутствие эффекта от лечения является показанием к чревосечению и вылущиванию миоматозного узла. Операция с целью удаления миоматозного узла путем вылущивания его или отсечения от основания также необходима, если во время беременности обнаруживают миоматозный узел на тонком основании, вызывающий болевые ощущения. В послеоперационном периоде продолжают терапию, направленную на снижение сократительной деятельности матки, т.е. на предупреждение прерывания беременности. Беременные с миоматозными узлами, подвергшиеся миомэктомии, должны быть госпитализированы за 2-3 нед до родов, остальные – за 1 нед. Во время беременности в силу ряда причин (низкое расположение узлов, препятствующих рождению ребенка, выраженная гипотрофия плода, гипоксия) нередко встает вопрос о плановом кесаревом сечении. Кесарево сечение необходимо производить в тех случаях, когда, помимо миомы матки, отмечаются другие осложняющие факторы: гипоксия плода, возраст первородящей более 30 лет, неправильное положение плода, перенашивание беременности, гестоз и др.
Ведение родов.
Роженицы с миомой матки представляют собой группу высокого риска развития осложнений исхода родов для матери и плода. Во время родов могут наблюдаться слабость родовой деятельности, гипотоническое кровотечение в третьем периоде и сразу после родов. Плод в процессе родов нередко страдает от гипоксии вследствие неполноценности маточного кровотока. В связи с этим как в конце беременности, так и в начале родов нередко встает вопрос об абдоминальном родоразрешении.
После извлечения ребенка во время кесарева сечения проводят тщательное исследование матки с внутренней и внешней сторон и решают вопрос о дальнейшем ведении больной. Тактика заключается в следующем: интерстициальные узлы малого размера могут быть оставлены, при умеренных размерах узлов и интерстициально-субсерозном их расположении, особенно при субсерозной локализации, узлы вылущивают (ложе зашивают или коагулируют), наличие больших узлов на широком основании являются показанием к надвлагалищной ампутации матки. Кроме того, имеют значение наличие живых детей у роженицы и ее возраст.
В случае родов через естественные родовые пути необходим постоянный мониторный контроль за сердцебиением плода и сократительной деятельностью матки. Введение окситоцина для ее усиления не рекомендуется. При слабости родовой деятельности и гипоксии плода показано кесарево сечение.
В третьем периоде родов производят ручное отделение плаценты и выделение последа, ручное обследование матки, чтобы исключить наличие субмукозных узлов. Роженице вводят сокращающие матку средства.
В раннем послеоперационном периоде также могут отмечаться симптомы нарушения питания узлов. При этом проводят спазмолитическую и инфузионную терапию. Отсутствие эффекта от терапии служит показанием к оперативному вмешательству лапароскопическим и лапаротомическим доступом.
Новообразования яичников
Новообразования яичников выявляют у 0,1 – 1,5 % беременных. Структура их различна: кисты, истинные опухоли яичника, рак яичника. Начало формирования новообразований яичников определить чрезвычайно сложно, так как клинические проявления чаще всего не выражены, если отсутствует болезненность при их смещении или перекрутке ножки.
) Клиническая картина и диагностика. В связи с невыраженностью клинической картины новообразования яичников в I триместре беременности выявляют при двуручном влагалищно-абдоминальном исследовании; при больших сроках беременности их можно обнаружить при пальпации живота или влагалищном исследовании (рис. 12.2). Образование Различной величины и консистенции определяют сбоку от матки, при расположении образования за маткой обнаружить его сложно. ЦеиА ным дополнительным методом гтри выявления новообразования яичников является УЗИ.
При перекрутке ножки образования или разрыве капсулы появляются симптомы острого живота: боли, тошнота, рвота, тахикардия, обложенность языка, болезненность при пальпации, симптомы раздражения брюшины.
Ведение беременности и родов. В отсутствие данных, свидетельствующих о злокачественности новообразования яичников, и клинических симптомов острого живота удалять образование не следует. В этом случае необходимо проводить наблюдение за беременной.
Если выявляются болевые ощущения из-за подвижности образования, то следует провести оперативное вмешательство и удалить измененные придатки матки. При этом стараются как можно бережнее относиться к матке. В I триместре можно использовать как лапаротомический, так и лапароскопический доступ.
При появлении клинических симптомов острого живота производят оперативноевмешательство и удаляют образование с его последующим гистологическим исследованием. В послеоперационном периоде проводят терапию, направленную на сохранение беременности.
Обнаружение рака яичника является показанием к операции независимо от срока беременности. На первом этапе можно удалить измененные яичники и сальник. После достижения жизнеспособности плода осуществляют кесарево сечение и экстирпацию матки. В последующем проводят химиотерапию.
Ведение родов зависит от того, препятствует ли опухоль рождению ребенка. Если препятствует, то производят кесарево сечение и удаляют измененные придатки матки. Вторые придатки следует обязательно тщательно осмотреть.
Обычно новообразования яичников не создают препятствия для прохождения плода по родовым путям и роды заканчиваются благополучно. В послеродовом периоде в зависимости от характера образования решают вопрос о его удалении.
Врожденные аномалии половых органов
 Рис. 12.2. Беременность и киста яичника. 1 – киста; 2 – беременная матка.
Рис. 12.2. Беременность и киста яичника. 1 – киста; 2 – беременная матка.
Врожденные аномалии половых органов представляют собой многочисленные варианты пороков развития. При некоторых из них беременность не возможна (например, отсутствие матки).
Беременность может наступить у женщин со следующими аномалиями развития половой системы: перегородка влагалища (vagina septa), седловидная (uterus introrsum arcuatus), двурогая (uterus bicornis) и однорогая (uterus unicornis) матка, двурогая матка с одним замкнутым рудиментарным рогом (uterus bicornis cum cornu rudimentario), двойная матка и двойное влагалище (uterus et vagina duplex).
Перегородку влагалища и двойную матку обычно нетрудно выявить при двуручном влагалищно-абдоминальном исследовании. Диагноз можно уточнить с помощью УЗИ.
Перегородки и рубцовое изменение влагалища могут быть не только врожденными, но и приобретенными (после заболевания дифтерией, химического ожога). Распознавание рубцовых изменений влагалища не вызывает затруднений. При значительном сужении влагалища роды через естественные пути невозможны, в таких случаях производят кесарево сечение.
Течение беременности и родов. При двойной матке беременность чаще развивается в одной из них, но при этом в другой наблюдается децидуальное изменение слизистой оболочки матки. Развитие беременности возможно в каждой матке или в двух ее половинах. Беременность в добавочном роге по существу представляет собой вариант внематочной беременности, которая обычно прерывается через 1-2,5 мес, что сопровождается сильным кровотечением. При такой ситуации показано экстренное оперативное вмешательство – либо иссечение рога матки, либо удаление его одновременно с телом матки.
При наличии пороков развития может отмечаться угроза прерывания беременности. К концу беременности нередко выявляют тазовое предлежание, косое или поперечное положение плода. В родах наблюдается слабость или дискоординация родовой деятельности. Если по каким-то показаниям при патологии матки выполняют кесарево сечение, то целесообразно произвести выскабливание второй матки с целью удаления децидуальной оболочки.
Перегородка влагалища может препятствовать рождению предлежащей части в период изгнания. При ножном предлежании плод "садится верхом" на растянутую перегородку. При любом варианте предлежания натянутую на предлежащей части перегородку следует рассечь. Кровотечения из рассеченных отрезков перегородки не бывает.
Инфантилизм
Диагноз инфантилизма у беременной основывается прежде всего на данных анамнеза: неблагоприятные условия развития в детстве, позднее наступление менструаций. При двуручном исследовании вне беременности обнаруживают, что влагалище узкое, матка меньших размеров, чем в норме. Первая беременность наступает не сразу после начала половой жизни. Нередко отмечаются самопроизвольные аборты или преждевременные роды.
Лечение во время беременности направлено прежде всего на устранение неблагоприятных факторов, способствующих преждевременному озникновению схваток (прекращение половой жизни, предотвращение чрезмерных эмоций, значительного физического напряжения). В процессе Родов необходимы тщательное наблюдение и своевременное устранение Дана омалий родовой деятельности, гипоксии плода, патологии третьего периода родов.
Рак шейки матки
Сочетание рака шейки матки и беремен ности встречается с частотой 1 на 1000 – 2500 беременностей. Частота наступления беременности у больных раком шейки матки составляет 3,1 %.
Отмечаются большие различия в возрасте беременных, страдающих раком шейки матки, и небеременных больных. Средний возраст больных раком шейки матки составляет 48 лет, а беременных, страдающих раком шейки матки, – 28.
Клиническая картина. Признаки опухолевого поражения шейки матки у женщин при беременности и вне ее практически одинаковы. Если в начале заболевания какие-либо выраженные клинические признаки отсутствуют, то при прогрессировании процесса появляются жидкие водянистые или кровянистые выделения из половых путей и контактные кровотечения.
Диагностика. Каждый акушер должен помнить о возможности сочетания бе-ременности и злокачественной опухоли шейки матки. Для своевременного распознавания рака шейки матки при первичном осмотре беременных в женской консультации наряду со специальным акушерским обследованием необходимо проводить осмотр шейки матки в зеркалах с одновременным взятием мазков с поверхности влагалищной части шейки матки и из цервикального канала. Цитологическое исследование мазков играет ведущую роль в распознавании рака шейки матки. В случае необходимости у беременной следует провести специальное исследование с осмотром шейки матки с помощью увеличивающего изображение прибора – кольпоскопа и биопсию подозрительного участка шейки матки. Биопсию следует производить в стационарных условиях из-за опасности возникновения кровотечения.
Клинически выраженная раковая опухоль может иметь вид язвы пли папиллярных разрастаний, напоминающих цветную капусту (рис. 12.3).
Применение клинического, цитологического, кольпоскопического и патогистологического методов исследования показано при любом сроке беременности. Проведения рентгенологического и радионуклидного исследований при беременности следует избегать.
Дифференциальная диагностика. Рак шейки матки следует диф-ференцировать от доброкачественных заболеваний шейки матки, выкидыша, предлежания плаценты. Решающее значение в распознавании опухоли имеет биопсия шейки матки, произведенная под контролем кольпоскопа.
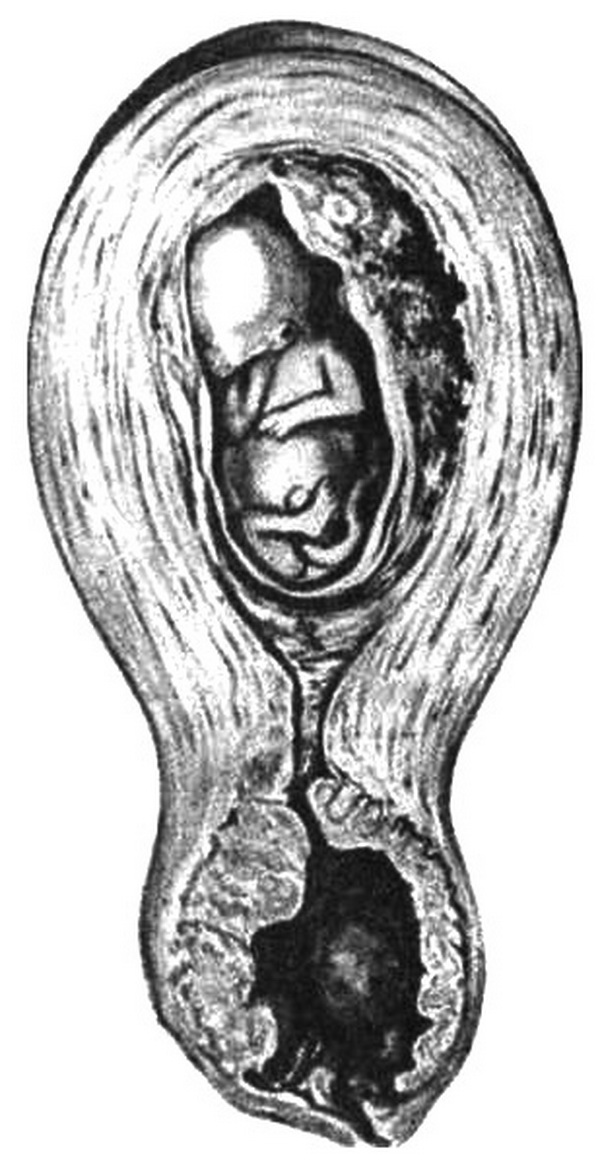 Рис. 12.3. Беременность и рак шейки матки.
Рис. 12.3. Беременность и рак шейки матки.
Лечение. При сочетании рака шейки матки и беременности лечебные мероприятия следует планировать с учетом срока беременности, стадии опухолевого процесса и биологических свойств опухоли, при этом интересы матери должны быть поставлены на первое место. При определении тактики ведения беременных, больных раком шейки матки, необходима консультация онколога.
В случае внутриэпителиальной карциномы (0 стадии) шейки матки допустимо донашивание беременности с удалением шейки через 1,5-2 мес после родов. При выявлении инвазивного рака в I и II триместрах беременности показана расширенная экстирпация матки. При далеко зашедшем опухолевом процессе необходимо проведение лучевой терапии после удаления плодового яйца влагалищным или брюшностеночным путем. При инвазивном раке и наличии жизнеспособного плода на первом этапе следует выполнить кесарево сечение, а в последующем – расширенную экстирпацию матки. При невозможности полного удаления матки допустима ее надвлагалищная ампутация с последующей лучевой терапией, возможно применение противоопухолевых лекарственных средств.
Прогноз при сочетании рака шейки матки и беременности менее благоприятен, чем у небеременных женщин.
Глава 13. Влияние вредных факторов на организм матери и плода
Система мать-плод во время беременности подвергается непрерывному воздействию разнообразных факторов окружающей среды. Под влиянием этих факторов изменяется течение физиологических взаимоотношений между материнским организмом и плодом, в результате чего в ряде случаев возникают различные формы патологии.Среди многочисленных факторов внешней среды, которые способны вызывать различные формы патологических реакций в организме матери и плода, наибольшее практическое значение имеют разнообразные химические агенты, ионизирующая радиация и лекарственные препараты. Большое влияние на организм матери и плода оказывают также курение и алкоголь.
Промышленные химические агенты.
В настоящее время в промышленном производстве занято более 50 % женщин. Относительно высок процент женщин, работающих на таких современных предприятиях, как заводы по производству синтетического каучука, синтетических волокон, пластмасс, в химико-фармацевтической промышленности и др. Существующее трудовое законодательство предусматривает ограничение использования женского труда на особо вредных предприятиях, а беременных работниц временно переводят в другие, менее вредные цеха. Однако эти мероприятия полностью не исключают возможности отрицательного влияния на организм матери и плода токсичных химических агентов промышленного производства.Изучение отрицательного ачияния агентов химического производства на организм матери и плода осуществляют как в клинических условиях, так и в эксперименте, хотя далеко не всегда результаты эксперимента можно безоговорочно экстраполировать на человека, и наоборот. Все это делает проблему химической токсикологии в акушерстве весьма сложной и противоречивой.
Разнообразные химические агенты могут оказывать повреждающее действие на организм плода как косвенно, вызывая изменения в организме матери, так и непосредственно, проникая через плаценту. Среди нескольких сотен таких химических соединений выявлены вещества, обладающие выраженной эмбриотоксичностью: свинец, ртуть, фосфор, бензол, оксиды углерода, никотин и многие другие.
Производство синтетического каучука связано с воздействием на организм этилового спирта, ацетилена, бутана, этилена, бензола, стирола, хлоропрена и ДРУ™* токсичных продуктов синтеза. При изготовлении вискозного волокна на организм женщин-работниц отрицательное влияние оказывают сероводород, сероуглерод, серчистый газ и аэрозоль серной кислоты. Женский организм подвергается разнообразному химическому воздействию на заводах по производству пластических масс (хлорвинил, метилметакрилат, фенол, формальдегид и др.). На заводах химико-фармацевтический промышленности работницы контактируют с такими вредными химическими соединениями, как бензол и его производные, бензин, фенолы, пириДИ и его основания, дихлорэтан, четыреххлористый углерод, метанол, формамид, ацетон, нитросоединения, оксиды углерода, цианистые соединения и лр При производстве антибиотиков воздействие на организм оказывают как высокодисперсная пыль самих готовых форм препаратов, так и разнообразные химические соединения, необходимые для химической очистки препаратов (бутилацетат, бутиловый, метиловый и изопропиловый спирты).
Согласно результатам клинических наблюдений и экспериментов, бензин активно проникает в ткани матки и снижает сократительную активность миометрия. Бензин быстро переходит через плаценту и может быть обнаружен в органах и тканях плода, особенно в его мозговой ткани. Описано тератогенное действие бензина. У работниц, отравившихся парами бензина и бензола, отмечено повышение частоты самопроизвольных абортов. Фенол и его производные обладают способностью тормозить процессы имплантации, приводят к возникновению аномалий развития у плода. Хлоропрен, широко используемый при производстве синтетического каучука, при длительном воздействии на организм беременной может обусловить разнообразные аномалии у новорожденных. Кроме того, этот химический агент способствует увеличению частоты самопроизвольных абортов, преждевременных родов и мертворождения. Стирол оказывает неблагоприятное влияние на развитие плода и новорожденного, У многих детей, матери которых заняты на производстве по переработке полистирола, отмечены гипотрофия, а также повышенная склонность к аллергическим заболеваниям. Формальдегид обладает способностью нарушать процессы внутриутробного развития плода, приводя к разнообразным порокам. Установлено также тератогенное действие монометилформамида.
Сероуглерод активно проникает через плаценту, его обнаруживают как в эмбриональных тканях, так и в молоке кормящих женщин. Длительный производ-ственный контакт с этим химическим соединением может привести к внутриутробной гибели плода вследствие интоксикации. Результаты многочисленных клинических наблюдений и экспериментальных исследований свидетельствуют об эмбриотоксичности марганца, кадмия, ртути, свинца, мышьяка, фтора, сурьмы и некоторых других металлов.
Наряду с химическими веществами на организм матери и плода в производственных условиях отрицательное влияние оказывают такие факторы, как повышенная температура в производственных помещениях, шум, пыль, лучистое тепло и повышенная физическая нагрузка. В связи с этим при анализе течения и исходов беременности для матери и плода иногда очень трудно выделить преимущественное влияние какого-либо одного фактора.
Нарушение развития плода в основном зависит от срока беременности с момента воздействия повреждающего агента и его концентрации в организме.
Радиация.
Среди многочисленных неблагоприятных факторов внешней среды, оказывающих отрицательное влияние на организм матери и плода, особого внимания заслуживает ионизирующая радиация. Сложность этой Проблемы обусловлена в значительной степени тем обстоятельством, что радиоактивные вещества даже при их однократном поступлении в организм матери могут надолго задерживаться в нем, переходить через плацентарный барьер и быть источником облучения плода в течение всего периода внутриутробного развития.Воздействие радиации на женский организм происходит по общим законам лучевых повреждений. В первую очередь поражаются три важнейшие системы – гормональная, иммунная и репродуктивная. При беременности изменяются ответные реакции организма на действие ионизирующего фактора. Это обусловлено гормональной перестройкой, снижением иммунного статуса и наличием развивающегося плодного яйца, элементы которого (плацента, плодные оболочки, амниотическая жидкость, плод) с различной интенсивностью и специфичностью накапливают отдельные радионуклиды.
Степень опасности для плода определяется временем попадания радионуклида в организм матери (до или во время беременности), длительностью воздействия, способностью радиоизотопа проникать через плацентарный барьер, накапливаться в организме плода и его элиминацией. Большое значение имеют вид радиоизотопа, энергия излучения, распределение его в органах и тканях и многие другие факторы.
В случае поступления радионуклидов в организм женщины до или во время беременности они избирательно накапливаются в органах и тканях, являясь постоянным источником воздействия на эмбрион и плод. Роль материнского организма в реализации негативного воздействия на плод возрастает, если в ее организм поступил радионуклид, избирательно накапливающийся в органах, обеспечивающих сохранение и развитие беременности (эндокринные железы, в основном щитовидная, и др.).
Результаты воздействия инкорпорированных источников радиации на эмбрион и плод в значительной степени определяются стадией внутриутробного развития. Если такое воздействие имело место до имплантации зародыша (период предымплантационного развития), то в 60 – 70 % случаев эмбрион погибает. Облучение в период основного органогенеза и плацентации часто сопровождается индукцией различных аномалий развития (тератогенное действие), а также внутриутробной гибелью зародыша (эмбриотоксический эффект). Наиболее характерным последствием воздействия ионизирующей радиации считается тератогенный эффект, т.е. врожденные уродства. Среди них основное значение имеют аномалии развития центральной нервной системы, что в дальнейшем почти всегда приводит к умственной отсталости.
Облучение в плодовом периоде (до 28 нед) в ряде случаев может сопровождаться тератогенным действием, задержкой физического развития, плацентарной недостаточностью, увеличением риска развития опухолевых заболеваний.
В настоящее время большее значение имеют следующие радиоактивные элементы: Р, Cs, трионий и его соединения, трансурановые элементы (Pu, Ат). Радиоактивный распад этих элементов сопровождается высвобождением энергии в виде а-, Ви у-лучей, обладающих различной проникающей способностью. Альфа-излучение практически неспособно проникать в живые ткани через кожные покровы, но оно очень опасно при попадании источника этого излучения внутрь организма. Бетаизлучение имеет значительно большую проникающую способность: оно проникает в ткани организма на глубину 1-2 см. Наибольшей проникающей способностью обладают у-лучи.
Лучевые поражения плода возможны, если тот или иной изотоп проникнет через плаценту. Необходимо подчеркнуть, что трансплацентарный путь является основным в проникновении радиоизотопов из организма матери в организм плода. Существует несколько механизмов трансплацентарного перехода радионуклидов: 1. гематогенный путь – свободный переход изотопов из крови матери в кровь плода через плацентарную мембрану; такой путь характерен для I, Р, Sr и некоторых других элементов; 2. накопление радионуклидов в тканях плаценты с последующим воздействием на плод (трансурановые элементы); 3. параплацентарный переход через плодные оболочки и околоплодные воды (радиоактивный плутоний); при этом возможна избирательная задержка радиоактивных изотопов в плодных оболочках, что создает дополнительную опасность в связи с лучевым воздействием на плод.
Определенная избирательность поражения плода радионуклидами характерна для многих изотопов. Так, при поступлении в ранние сроки беременности наиболее часто возникают генетические нарушения, в более поздние – обще соматические. Такое потомство характеризуется задержкой общего физического развития, увеличением частоты эндокринно-зависимыч новообразований (щитовидной железы, гипофиза, молочных желез, яичников), вплоть до внутриутробной гибели плода.
При поступлении в организм плода 90Sr отмечаются нарушения процессов плацентации и органогенеза, что может привести к внутриутробной гибели плода. Из аномалий развития наблюдаются нанизм, отеки универсального характера и др. Из локальных аномалий чаще всего отмечаются дефекты развития скелета и сердца. В постнатальном периоде такое потомство характеризуется пониженной жизнеспособностью, снижением фертильности (способности к размножению) и дефицитом иммунитета; возрастает частота опухолей и лейкозов.
При поступлении в организм беременной трансурановых соединений (плуто-ний, америций, нептуний), которые являются а-излучателями и интенсивно задерживаются плацентой, они проникают к плоду в ограниченных количествах и вследствие этого не могут оказывать прямого повреждающего действия. Однако, накапливаясь в тканях плаценты, эти изотопы нередко приводят к возникновению плацентарной недостаточности, сопровождающейся вторичными нарушениями развития плода.
Таким образом, на основании экспериментальных данных и результатов клинических наблюдений можно считать, что ионизирующая радиация (внешняя и инкорпорированная) представляет собой очень большую опасность для эмбриона, плода и последующего развития потомства.
Пестициды.
В условиях бурного развития химической индустрии создается качественно новая среда, окружающая человека и животных. Изменения этой среды обусловлены влиянием пестицидов, гербицидов и некоторых других аналогичных химических агентов. Эти химические вещества циркулируют в воздухе, воде, почве, их находят практически во всех продуктах питания.В большинстве стран мира, в том числе в нашей стране, существует система государственного контроля, позволяющая сводить к минимуму попадание пестицидов во внешнюю среду и продукты питания. Тем не менее возможность попадания пестицидов в организм беременных, особенно работающих в сельском хозяйстве, не исключена.
Пестициды, проникающие в организм женщины, могут вызывать как наследственные, так и не наследстве иные изменения. Химический мутагенез обычно проявляется не сразу, а во втором и даже в третьем поколении. В то же время ненаследственные изменения, которые обусловлены воздействием пестицидов во время беременности, чаще всего можно обнаружить УЖе вскоре после рождения ребенка. Химические агенты представляют особенно большую опасность во время беременности и лактации, когда они активно переходят через плаценту и альвеолы молочных желез и оказывают токсическое воздействие на организм плода и новорожденного.
Среди многочисленных пестицидов наибольшей эмбриотоксичностью обладают хлорорганические соединения. Они переходят через плацентарный барьер и обнаруживаются в тканях плаценты, крови пуповины, околоплодных водах, сыровидной смазке, а также в печени мертворожденных детей.
Большого внимания заслуживает и другая группа пестицидов – ртутьорганические соединения, которые обладают эмбриотоксичностью.
Никотин и алкоголь. Курение и употребление алкоголя являются самыми распространенными вредными привычками во всех странах мира.
Никотин.
При курении организм подвергается воздействию более 600 различных химических соединений, содержащихся в табаке. К ним относятся органические и неорганические кислоты, белки, аминосоединения, этиловый спирт, различные ароматические вещества, сложные эфиры, альдегиды, смолы, фенолы и многие другие. Решающая роль в токсическом воздействии на организм человека играет никотин. При курении одной пачки сигарет человек поглощает от ] до 2 мг никотина на 1 кг массы тела, при этом в его организме задерживается от 70 до 90 % вдыхаемого никотина. Высокое содержание никотина обнаружено в бронхах, слизистой оболочке носа, слюнных железах, печени, почках, центральной нервной системе. Наиболее выраженное токсическое воздействие никотин оказывает на нервную и сердечно-сосудистую системы. У женщин никотин может вызывать нарушения менструального цикла, а также более раннее наступление климакса.Опасность воздействия никотина на организм женщины значительно возрастает при наступлении беременности, поскольку в этот период повышается чувствительность женского организма к действию табачного дыма. В начале беременности воздействие никотина может привести к нарушениям имплантации плодного яйца и самопроизвольному аборту в ранние сроки. Опасность самопроизвольного аборта и преждевременных родов обусловлена также повышением сократительной способности матки вследствие прямого влияния никотина на миометрий.
Никотин обладает способностью вызывать сокращение сосудов матки и плаценты с развитием плацентарной недостаточности, а это в свою очередь приводит к возникновению хронической гипоксии плода. Гипоксия плода и асфиксия новорожденного связаны не только с сосудистыми изменениями в маточно-плацентарном круге кровообращения, но и с повышением в крови плода уровня карбоксигемоглобина, который в 2 раза превышает его концентрацию в крови матери. Наряду с этим в тканях плодов интенсивно курящих женщин (до 20 сигарет в день) обнаружено повышенное содержание окиси углерода, что способствует развитию тканевой гипоксии.
Никотин не только интенсивно проникает через плаценту, но и накапливается в ней. Он попадает в ткани плода как трансплацентарным, так и параплацентарным путем – через гладкий хорион и амнион. Плод, аспирируя амниотическую жидкость, содержащую никотин, получает при этом дополнительную интоксикацию. Поступивший в кровь плода никотин в повышенных концентрациях накапливается в миндалинах, трахее, мозговой ткани, почках, сердце, желудке и некоторых других внутренних органах. Из организма плода никотин выводится более медленно, чем из организма матери.
Никотин не оказывает тератогенного действия, но следствием плацентарной недостаточности и связанной с ней блокады транспорта аминокислот является синдром задержки развития плода. При доношенной беременности такой дефицит массы тела плода может составлять 300 г и более. Дефицит массы тела сохраняется в течение первого года жизни ребенка. Интенсивное курение женщин обусловливает повышенную перинатальную смертность.
Алкоголь. При систематическом употреблении алкогольных напитков во время беременности может возникнуть алкогольный синдром плода (АСП), характеризующийся множественными аномалиями развития, а также нарушениями физического и психического развития ребенка. АСП проявляется следующими характерными симптомами: 1. нарушениями структуры и функции ЦНС; 2. замедлением роста; 3. характерными аномалиями лицевого черепа, внутренних органов, конечностей и других систем организма.
Повреждения ЦНС выражаются в развитии микроцефалии, нарушениях интеллекта и координации движений, состоянии возбуждения. Эти явления, возникающие в период новорожденности, сохраняются на многие годы. Деменция имеет прогрессирующий характер.
Задержка роста возникает еще в период антенатального развития и становится особенно заметной после рождения ребенка. Характерны аномалии развития лицевого черепа: микрофтальмия, удлинение лица, низкий лоб, выраженное недоразвитие подбородка, маленький седловидный нос, дисплазия ушных раковин, большой широко открытый рот, птоз, косоглазие, уменьшение длины глазных щелей, уплощение затылка. Сочетание этих симптомов делает внешний вид таких детей весьма характерным и облегчает диагностику АСП. Из других аномалий развития сравнительно часто встре-чаются врожденные пороки сердца, множественные гемангиомы, неправильное развитие верхних и нижних конечностей. Перинатальная смертность при данном синдроме высокая, поэтому систематическое употребление алкоголя во время беременности является фактором высокого риска развития перинатальной патологии.
Патогенез АСП изучен недостаточно. Установлено, что алкоголь (этанол) сравнительно быстро проникает через плаценту и гематоэнцефалический барьер плода и в повышенных количествах накапливается в тканях, богатых липидами (ЦНС). Присутствие этанола обнаружено также в амниотической жидкости, в связи с чем возникло предположение о возможном параплацентарном пути проникновения этого вещества.
Большое значение в патогенезе АСП, по-видимому, имеют патологические изменения в плаценте (дистрофические изменения ворсин хориона, нарушения процессов микроциркуляции). Одним из возможных факторов тератогенного действия этанола является нередко встречающееся при АСП недоразвитие одной из артерий пуповины.
Известную роль в патогенезе АСП играют морфофункциональные нарушения в печени плода. Характерно, что в печени плода отсутствует алкогольдегидрогеназа, которая разрушает этанол у взрослого человека.
Развитие АСП может быть обусловлено прямым воздействием на эмбрион и плод не только этилового спирта, но и его важнейшего метаболита – ацетальдегида. Это соединение особенно активно переходит к плоду в I триместре беременности, когда происходят активные процессы дифференциРовки важнейших органов и тканей (критический период развития).
Таким образом, выраженное тератогенное и эмбриотоксическое действис этилового алкоголя на плод является основанием для полного запрещения употребления всех спиртных напитков во время беременности.
При возникновении беременности у женщин, страдающих хроническим алкоголизмом, целесообразно ставить вопрос об искусственном прерывании беременности.
Лекарственные вещества.
Среди различных факторов окружающей среды, способных вызывать различные отклонения в развитии плода, лекарственным веществам принадлежит особое место. Это в первую очередь связано с частым приемом различных медикаментов во время беременности (80 % беременных принимают те или иные препараты), а также со свойством ряда фармакологических агентов как биологически активных веществ вызывать различные изменения у плода и новорожденного.При проведении медикаментозной терапии во время беременности необходимо учитывать следующие важнейшие моменты: 1. особенности фармакокинетики и метаболизма лекарственных препаратов в организме матери; 2. скорость и степень перехода лекарственного препарата через плаценту; 3. стадию внутриутробного развития эмбриона и плода во время фармакотерапии; 4. наличие эмбриотоксичности или тератогенности у того или иного препарата; 5. особенности метаболизма и элиминации фармакологического агента из организма плода.
Во время беременности в организме женщины возникают многообразные физиологические изменения практически во всех органах и системах. Среди этих изменений, имеющих адаптационный характер, наибольшее значение для метаболизма лекарственных препаратов имеют изменения гемодинамики, продукции гормонов, особенно усиленный процесс синтеза половых гормонов плацентой, снижение дезинтоксикационной функции печени и выделительной функции почек, а также значительное усиление процессов метаболизма. В результате этого чувствительность организма беременной к лекарственным препаратам несколько повышается. Например, опасность возникновения лекарственной аллергии ко многим фармакологическим средствам во время беременности выше, чем вне беременности. Особенно значительно возрастает аллергизация организма беременных при назначении одновременно большого количества лекарственных препаратов, что нередко имеет место при лечении гестозов и различных экстрагенитальных заболеваний.
В ряде случаев в процессе беременности изменяется концентрация лекарственных препаратов в крови. Так, у беременных по сравнению с небеременными значительно более низкой оказывается концентрация антибиотиков, сульфаниламидов, дигоксина и ряда других препаратов в крови, что отрицательно сказывается на эффективности проводимой терапии.
Для трансплацентарного перехода лекарственных веществ большое значение имеют следующие моменты: 1. молекулярная масса препарата; 2. способность препарата к ионизации; 3. липидная растворимость; 4. связь препарата с белками плазмы крови; 5. метод введения препарата (внутривенно, внутримышечно, внутрь); 6. стадия беременности во время медикаментозного лечения.
Молекулярная масса лекарственного препарата имеет очень большое значение при переходе его через плаценту. Фармакологические агенты, имеющие молекулярную массу до 600, сравнительно легко переходят от матери к плоду; при массе от 600 до 1000 переход лекарственных средств через плаценту ограничен, а при молекулярной массе свыше 1000 он почти не происходит. Большинство лекарственных препаратов имеет молекулярную массу менее 600, поэтому они сравнительно свободно минуют плацен-тарный барьер. Из-за высокой молекулярной массы через плаценту не переходят гепарин и инсулин.
Более активно проникают через плаценту низкодиссоциированные лекарственные вещества, а также препараты, хорошо растворимые в липидах. Поэтому наркотические вещества (эфир, закись азота и др.), имеющие высокую липидную растворимость, очень быстро проникают к плоду и накапливаются в его организме в повышенных количествах. Это обстоятельство должны учитывать анестезиологи при проведении наркоза у беременных и рожениц.
Существенную роль в трансплацентарном переходе лекарственных препаратов играет их способность связываться с белками плазмы крови. Чем сильнее эта связь, тем медленнее препарат переходит через плаценту. Например, через плаценту проникает всего 10 % полусинтетического антибиотика оксациллина, который связывается с белками крови на 80-90 %, и в то же время 50 % канамицина, связывающегося с белками крови на 40-50 %. Эти особенности необходимо учитывать при лечении внутриутробной инфекции плода.
Переход лекарственных веществ через плаценту совершается более активно при быстром увеличении их концентрации в крови матери (внутривенное введение), чем при внутримышечном введении или приеме внутрь. В связи с этим при необходимости получения быстрого терапевтического эффекта, например при лечении хориоамнионита, предпочтителен внутривенный путь введения лекарственных препаратов.
Стадия внутриутробного развития имеет очень большое значение в конечном эффекте воздействия препарата на плод. Эмбриотоксическое и тератогенное влияние препарата обычно проявляется на ранних стадиях развития зародыша (первые 6-8 нед беременности). В более поздние сроки беременности некоторые лекарственные препараты могут оказывать отрицательное действие, обусловленное в основном функциональной и морфологической незрелостью органов и систем плода.
Необходимо подчеркнуть, что большинство лекарственных средств, которые в настоящее время сравнительно широко используют при беременности по соответствующим показаниям, безвредны для эмбриона и плода. Более того, некоторые лекарственные вещества обладают способностью оказывать положительное влияние на состояние плода. Например, при анемии беременных, особенно протекающей в тяжелой форме, почти всегда страдает и плод, у которого также возникают признаки малокровия. В этих Условиях проведение антианемической терапии оказывает положительное влияние и на показатели красной крови родившегося ребенка.
Некоторые препараты противопоказаны (абсолютные тератогены) во время беременности или могут быть использованы с соблюдением осторожности из-за их эмбриотропных свойств. Обычно такие лекарственные вещества применяют при наличии строгих показаний в небольших дозах и в Течение ограниченного времени.
К абсолютным тератогенам относят антиметаболиты (аминоптерин, 6-меркаптопурин и др.), алкилирующие соединения (допан, циклофосфан, тиофосфамид и др.) и противоопухолевые антибиотики (актиномицин, сарколизин и др.)Введение этих препаратов в ранние сроки беременности очень часто дает выраженный тератогенный эффект, поэтому они абсолютно противопоказаны беременным.
Антибиотики.
Из антибиотиков опасность для эмбриона и плода представляют прежде всего тетрациклин и его производные. В ранние сроки беременности назначение этих препаратов опасно из-за возможности возникновения у эмбрионов аномалий развития, что было обнаружено в условиях эксперимента. В более поздние сроки беременности введение антибиотиков группы тетрациклина сопровождается замедлением роста плода (тетрациклин откладывается в костях скелета и несколько замедляет их рост) и поражением у него зачатков временных зубов, вследствие чего в дальнейшем у таких детей наблюдается множественный кариес зубов. Кроме того, необ-ходимо учитывать и возможность гепатотоксического действия этого антибиотика.Применение во время беременности левомицетина опасно из-за его возможного отрицательного действия на органы кроветворения плода (гипопластическая анемия). При введении беременным высоких доз стрептомицина у плода может возникнуть необратимая дистрофия слуховых нервов с развитием врожденной глухоты.
Сульфаниламидные препараты.
Известную осторожность следует соблюдать при назначении сульфаниламидов пролонгированного действия, которые, связываясь с альбуминами крови, приводят к повышению концентрации билирубина в крови плода и развитию ядерной желтухи. Антидиабетические сульфаниламидные препараты противопоказаны во время беременности из-за их возможного тератогенного действия.Гормональные препараты.
Препараты тестостерона и его производные (прегнин, норстероиды) во время беременности, особенно в сроки 10-12 нед, применять не следует из-за опасности возникновения у плодов женского пола явлений ложного мужского гермафродитизма. Из эстрогенных препаратов при беременности противопоказан диэтилстильбэстрол, который может приводить к развитию аденоза и светлоклеточной аденокарциномы влагалища и шейки матки у девушек, матери которых во время беременности подвергались воздействию этого гормонального препарата.При длительном введении препаратов глкжокортикоидн ых гормонов беременным, у которых наблюдаются дисфункция коры надпочечников и повышенная продукция андрогенов, у новорожденных отмечено угнетение функции коры надпочечников, имеющее обратимый характер. В то же время кратковременное назначение даже высоких доз этих препаратов не приводит к отрицательным последствиям для плода. Другие гормональные препараты не дают эмбриоили фетопатического эффекта.
Тиреостатические препараты группы тиоурацила (метилтиоурацил и др.) при длительном введении в организм беременной могут привести к возникновению аномалий развития и врожденного коллоидного зоба у плода. В связи с этим данные препараты можно назначать беременным только короткими курсами и в сравнительно небольших дозах.
Антикоагулянты.
В противоположность антикоагулянтам прямого действия (гепарин) антикоагулянты непрямого действия (дикумарин, пелентан и др.) быстро проникают через плаценту и могут вызвать у плода выраженную гипокоагуляпию крови с последующим возникновением кровоизлияний в мягкие мозговые оболочки и внутренние органы. Особенно опасно назначение этих препаратов беременным незадолго до родов, когда вероятность кровоизлияний в ЦНС плода прогрессивно увеличивается. В связи с этим во время беременности, например больным с протезированными клапанами сердца, данные препараты следует назначать с большой осторожностью.Применение препаратов кумаринового ряда в I триместре беременности способствует развитию двусторонней атрофии зрительного нерва, умственной отсталости, а длительное использование гепарина во II и III триместрах беременности может привести к остеопорозу и тромбоцитопении У матери.
Нестероидные противовоспалительные средства.
Среди многочисленных препаратов этой группы, применяемых в акушерской практике, наибольшего внимания заслуживают салицилаты и индометацин. В опытах на животных установлено тератогенное действие ацетилсалициловой кислоты (аномалии скелета, расщепление твердого неба и пр.). В клинике аналогичный эффект не получен. Однако при назначении салицилатов беременным существует опасность возникновения у плода и новорожденного различных геморрагии и даже ядерной желтухи. В связи с этим ацетилсалициловую кислоту не рекомендуют назначать в I триместре беременности; в дальнейшем эти препараты могут быть применены при лечении беременных женщин, но в относительно невысоких дозах и кратковременными курсами.Индометацин нередко назначают при невынашивании беременности как средство, ингибирующее фермент простагландинсинтетазу. Установлено, что простагландин Е| в обычных условиях развития плода расширяет артериальный проток и предотвращает его закрытие, но он же обладает способностью вызывать преждевременное закрытие этого протока, что сопровождается недостаточной оксигенацией крови плода и развитием у него стойкой легочной гипертензии. В связи с этим многие акушеры считают нежелательным применение индометацина для сохранения беременности.
Противосудорожные препараты используют у беременных, у которых наблюдаются припадки эпилепсии. Некоторые препараты этой группы опасны для плода. Так, прием во время беременности карбамазепина может вызвать нарушения развития плода (уменьшение размеров головки, увеличение массы тела). Фенитоин обладает тератогенными свойствами (аномалии скелета). Токсичны для плода также триметин и этосуксимид. Кроме нарушений развития плода, при приеме беременной некоторых противосудорожных средств у новорожденных возможно развитие тяжелых геморрагии, обусловленных дефицитом витамина К. В связи с этим новорожденным, матери которых во время беременности получали противосудорожные препараты, необходимо сразу же после рождения вводить викасол.
Антидепрессанты (имизин, амитриптилин и др.) не следует назначать в ранние сроки беременности из-за их слабого тератогенного действия.
Транквилизаторы.
Мышечные релаксанты имеют большое значение при проведении интубационного наркоза во время кесарева сечения, поэтому вопрос об их воздействии на плод весьма важен. Установлено, что деполяризующие миорелаксанты (дитилин, листенон, миорелаксин и др.) плохо растворяются в жирах и имеют высокую степень ионизации, вследствие чего они практически не проникают через плаценту и безопасны в отношении развития паралитического апноэ у новорожденных, извлеченных во время кесарева сечения, произведенного под интубационным наркозом. Неде поляризующие миорелаксанты (тубокурарин, диплацин и др.) сравнительно легко проникают через плаценту и могут оказать миопарализующее воздействие на плод, поэтому в акушерской практике их не используют.Гипотензивные препараты группы раувольфии применяют при лечении гипертензивных состояний во время беременности. Однако следует учитывать, что их длительное введение матери может привести к депрессии новорожденных, повышенной сонливости, брадикардии, гипотермии и "резерпиновому" риниту вследствие отека слизистых оболочек полости носа. Эти симптомы являются преходящими и обычно исчезают в течение первой недели жизниребенка. Для предупреждения этих побочных реакций необходимо прекратить прием беременными этих препаратов приблизительно за 2 нед до ожидаемого срока родов.
Хлоридин.
В эксперименте это лекарственное средство проявляло выраженную тератогенную активность. Отдельные клинические наблюдения также свидетельствуют о возможности тератогенного эффекта, поэтому хлоридин в ранние сроки беременности при врожденном токсоплазмозе не применяют. В связи с аналогичной ситуацией хинин также противопоказан в ранние сроки беременности.Антипротозоиные средства
. Из лекарственных средств данной группы наибольшее значение в акушерской практике имеют препараты, назначаемые для лечения мочеполового трихомоноза (трихопол и др.); они быстро проникают через плаценту и в большом количестве концентрируются в крови плода. Тератогенный эффект препаратов данной группы окончательно не доказан, однако во всех инструкциях по использованию трихопола и других аналогичных средств отмечается нежелательность их применения при мочеполовом трихомонозе в ранние сроки беременности.Противогрибковые препараты (леворин, гризеофульвин) во время беременности противопоказаны, так как они обладают слабовыраженными тератогенными свойствами (что было установлено в основном в эксперименте), поэтому их использование в ранние сроки беременности нежелательно. Нистатин можно использовать во все сроки беременности.
Употребление кокаина во время беременности может привести к развитию врожденных пороков ЦНС, мочеполовой системы, самопроизвольному выкидышу, отслойке плаценты. Прием марихуаны приводит к неврологическим расстройствам у новорожденных.
Противоопухолевые препараты.
Противоопухолевые препараты (метотрексат, циклофосфамид, 6-меркаптопурин и др.) во время беременности способствуют развитию аномалий плода: гипоплазии нижней челюсти, расщепления верхнего неба, дизостоза черепа, недоразвития ушей, косолапости, внутриутробной задержки роста, болезни Дауна.В ранние сроки беременности необходимо избегать иммунизации живыми вирусными вакцинами против гепатитов А и В, полиомиелита, бешенства, брюшного тифа, ветряной оспы, гриппа, чумы и других заболеваний.
Использование оксидантов (витамин К, сульфаниламидные препараты, хлорамфеникол и др.) приводит к гемолизу у плода в случае генетически обусловленной недостаточности глюкозо-6-фосфатдегидрогеназы.
Таким образом, большинство лекарственных препаратов, назначаемых беременным, роженицам и родильницам, безопасны для плода и новорожденного. Однако некоторые препараты противопоказаны беременным и кормящим матерям. В отношении ряда лекарственных средств следует соблюдать известную осторожность. В связи с этим проведение научно обоснованной рациональной медикаментозной терапии во время беременности является мерой профилактики различных осложнений как у матери, так и у плода и новорожденного.
Глава 14. Токсикозы и гестозы беременных
К токсикозам и гестозам беременных относятся патологические состояния которые проявляются только во время беременности и, как правило, исчезают после ее окончания или в раннем послеродовом периоде.Осложнения, связанные с беременностью, могут проявляться в ранние сроки беременности, чаще в первые 3 мес, тогда их называют токсикозами. Если же клинические симптомы наиболее выражены во II и III триместрах, то чаше всего речь идет о гестозе.
Для большинства форм токсикозов характерны диспепсические расстройства и нарушения всех видов обмена, для гестозов – сосудистой системы и кровотока. К токсикозам относятся рвота беременных (легкая форма, умеренная, чрезмерная) и слюнотечение (птиализм), к гестозам – водянка беременных, нефропатия, преэклампсия, эклампсия. Помимо перечисленных, реже встречаются такие формы токсикоза, как дермопатия (дерматоз), тетания, бронхиальная астма, гепатопатия (желтуха беременных), остеомаляция беременных и др.
Токсикозы
Несмотря на многочисленные исследования, этиология токсикозов до настоящего времени не уточнена. Большинство исследователей отмечают полиэтиологичность этого осложнения беременности.Рвота беременных
Среди токсикозов особое внимание уделяли изучению этиологии рвоты беременных, в связи с чем появились различные теории. Рвоту беременных связывали с отравлением организма токсичными продуктами обмена веществ. Полагали также, что она может быть результатом сенсибилизации материнского организма антигенами плода при гистонесовместимости. Возникновение рвоты объясняли также психогенными факторами (отрицательные эмоции, страх перед родами) или проявлением истерических реакций. Наиболее признанной является нервно-рефлекторная теория, согласно ко-торой важную роль в развитии заболевания играют нарушения взаимоотношения деятельности ЦНС и внутренних органов. При этом существенное значение имеет преобладание возбуждения в подкорковых структурах ЦНС (ретикулярной формации, центрах регуляции продолговатого мозга). В указанных областях располагаются рвотный центр и хеморецепторная триггер' ная зона, регулирующие рвотный акт. Рядом с ними находятся дыхательный, вазомоторный, слюноотделительный центры, ядра обонятельной системы мозга. Тесное расположение указанных центров обусловливает предшествутощие рвотному акту ощущения тошноты и ряд сопутствующих вегетативных расстройств: усиление саливации, углубление дыхания, тахикардия, бледность кожного покрова вследствие спазма периферических сосудов.
Преобладание возбуждения в подкорковых структурах мозга с возникновением ответной вегетативной реакции связывают с патологическими процессами в половых органах (перенесенные воспалительные заболевания, интоксикации), нарушающими рецепторный аппарат матки, возможно также его повреждение плодным яйцом. Указанное наблюдается, скорее всего, при нарушении физиологических взаимосвязей материнского организма и трофобласта в ранние сроки гестации.
Вегетативные расстройства в начале беременности одновременно могут быть обусловлены гормональными нарушениями, в частности увеличением уровня хориального гонадотропина (ХГ) в организме. Доказательством этого является тот факт, что при многоплодии и пузырном заносе, когда выделяется большое количество ХГ, рвота беременных наблюдается особенно часто.
К факторам, предрасполагающим к развитию токсикозов, относятся хронические заболевания желудочно-кишечного тракта, печени, астенический синдром.
В патогенезе рвоты беременных определяющим звеном является нарушение нейроэндокринной регуляции всех видов обмена вследствие частичного (или полного) голодания и обезвоживания. При прогрессировании заболевания постепенно нарушаются водно-солевой (гипокалиемия), углеводный, жировой и белковый обмен в организме матери на фоне нарастающего обезвоживания, истощения и уменьшения массы тела. Вследствие голодания первоначально расходуются запасы гликогена в печени и других тканях. Затем происходит уменьшение эндогенных ресурсов углеводов, активизируются катаболические реакции, в частности повышаются жировой и белковый обмен. На фоне угнетения активности ферментных систем тканевого дыхания энергетические потребности организма матери удовлетворяются за счет анаэробного распада глюкозы и аминокислот. В этих условиях р-окисление жирных кислот невозможно, в результате чего в организме накапливаются недоокисленные метаболиты жирового обмена – кетоновые тела (ацетон, ацетоуксусная и р-оксимасляная кислоты), которые выделяются с мочой. Помимо этого, кетоз поддерживается за счет усиленного анаэробного распада кетогенных аминокислот. На этом фоне развивается кетонурия, выраженность которой соответствует тяжести метаболических нарушений в организме беременной, у которой наблюдается рвота, понижается оксигенация артериальной крови, происходит сдвиг КОС в сторону ацидоза.
Изменения в органах беременной первоначально имеют функциональный характер, а затем, по мере нарастания обезвоживания, катаболических Реакций, интоксикации недоокисленными продуктами, переходят в дистрофические процессы в печени, почках и других органах. Первоначально нарушаются белковообразовательная, антитоксическая, пигментная и другие Функции печени, выделительная функция почек, в последующем дистрофические изменения наблюдаются в ЦНС, легких, сердце.
Клиническая картина. Рвота беременных часто (в 50-60 % слуев) наблюдается как физиологический признак беременности, а в 8-10 % Проявляется как осложнение беременности – токсикоз. При нормальной беременности тошнота и рвота могут быть не более 2-3 раз в сутки по утрам, чаще натощак, но это не нарушает общего состояния женщины поэтому лечения не требуется. Как правило, по окончании процесса плацентации к 12 -13 нед тошнота и рвота прекращаются.
К токсикозам относят рвоту, которая наблюдается несколько раз в день независимо от приема пищи, сопровождается снижением аппетита, изменением вкусовых и обонятельных ощущений, чувством слабости, иногда уменьшением массы тела. Различают рвоту беременных легкой, средней степени и чрезмерную. Степень тяжести рвоты определяется сочетанием рвоты с нарушениями, происходящими в организме (обменные процессы функции важнейших органов и систем).
Легкая рвота мало чем отличается от таковой при неосложненной беременности, но наблюдается до 4-5 раз в день, сопровождается почти постоянным ощущением тошноты. Несмотря на рвоту, часть пищи удерживается и значительного похудания беременных не наблюдается. Уменьшение массы тела составляет 1-3 кг (до 5 % от исходной массы). Общее состояние остается удовлетворительн ым, но могут отмечаться апатия и снижение работоспособности. Гемодинамические показатели (пульс, артериальное давление) у большинства беременных остаются в пределах нормы. Иногда регистрируется умеренная тахикардия (80 – 90 уд/мин). Изменения в морфологическом составе крови отсутствуют. Диурез не изменяется. Ацетонурия отсутствует. Легкая рвота быстро поддается лечению или проходит самостоятельно, поэтому специального лечения не требуется, но у 10-15 % беременных она усиливается и может переходить в следующую стадию.
Умеренная рвота (средней тяжести) выражается в учащении рвоты до 10 раз в сутки и более, ухудшении общего состояния и метаболизма с развитием кетоапидоза. Рвота нередко сопровождается слюнотечением, вследствие чего происходит дополнительная существенная потеря жидкости и питательных веществ. В результате этого происходят обезвоживание и уменьшение массы тела до 3-5 кг (6 % от исходной массы) вплоть до истощения. Общее состояние беременных ухудшается, возникают значительная слабость и апатия. Кожа бледная, сухая, язык обложен беловатым налетом, суховат. Температура тела субфебрильная (не выше 37,5 °С), характерны тахикардия (до 100 уд/мин) и гипотензия. При исследовании крови может быть выявлена легкая анемия, при анализе КОС – метаболический ацидоз. Диурез снижен, в моче может быть ацетон. Нередко наблюдается запор. Прогноз, как правило, благоприятный, но при подобном состоянии беременной требуется лечение.
Чрезмерная рвота встречается редко. Для чрезмерной рвоты характерно нарушение функций жизненно важных органов и систем, вплоть до развития в них дистрофических изменений вследствие выраженной интоксикации и обезвоживания. Рвота наблюдается до 20 раз в сутки, сопровождается обильным слюнотечением и постоянной тошнотой. Пища и жидкость не удерживаются. Общее состояние при этом тяжелое. Отмечаются адинамия, упадок сил, головная боль, головокружение, масса тела быстро уменьшается (Ц_ 2-3 кг в неделю, свыше 10% от исходной массы тела). Слой подкожно жировой клетчатки исчезает, кожа становится сухой и дряблой, язык и губь сухие, изо рта отмечается запах ацетона, температура тела субфебрильная, но может повышаться до 38 °С, возникают выраженная тахикардия, гипотензия. Резко снижается диурез.
В крови повышается уровень остаточного азота, мочевины, билирубина, гематокрита, отмечается лейкоцитоз, одновременно уменьшается содержание альбуминов, холестерина, калия, хлоридов. В моче определяются протеин и цилиндрурия, уробилин, желчные пигменты, эритроциты и лейкоциты, реакция на ацетон резко положительная.
Прогноз чрезмерной рвоты не всегда благоприятный. Признаками угрожающего состояния, определяющими показания к экстренному прерыванию беременности, являются нарастание слабости, адинамия, эйфория или бред, тахикардия до 110-120 уд/мин, гипотензия – до 90-80 мм рт. ст., желтушность кожи и склер, боли в правом подреберье, снижение диуреза до 300-400 мл в сутки, гипербилирубинемия в пределах 100 мкмоль/л, повышение уровня остаточного азота, мочевины, протеинурия, цилиндрурия.
Диагностика. Установить диагноз рвоты беременных несложно. Для выяснения степени тяжести рвоты беременных, помимо проведения клинического обследования больной, общего анализа крови и мочи, необходимо определение в динамике следующих показателей: в крови – содержания билирубина, остаточного азота и мочевины, гематокрита, электролитов (калий, натрий, хлориды), общего белка и белковых фракций, трансаминаз, показателей КОС, глюкозы, протромбина, в моче – уровня ацетона, уробилина, желчных пигментов, белка. При значительной дегидратации и сгущении крови могут отмечаться ложнонормальные показатели содержания гемоглобина, эритроцитов, белка. При этом степень обезвоживания опре-деляют по уровню гематокрита. Значение его выше 40 % свидетельствует о выраженном обезвоживании.
Лечение, Лечение больных, у которых наблюдается легкая форма рвоты, можно проводить амбулаторно, при рвоте средней тяжести и тяжелой – в стационаре. Большое значение необходимо придавать диете. В связи со снижением аппетита рекомендуют разнообразную пищу по желанию. Она должна быть легкоусвояемой, содержать большое количество витаминов. Ее следует принимать в охлажденном виде, небольшими порциями каждые 2-3 ч в положении лежа. Показана минеральная щелочная вода в небольших объемах 5-6 раз в день.
Медикаментозное лечение при рвоте беременных должно быть комплексным: 1. препараты, регулирующие функцию ЦНС и блокирующие рвотный рефлекс; 2. инфузионные средства для регидратации, дезинтоксикации и парентерального питания; 3. препараты, предназначенные для нормализации метаболизма.
Для нормализации функции ЦНС немаловажное значение имеют правильно организованный лечебно-охранительный режим, устранение отрицательных эмоций. При госпитализации больную необходимо поместить в отдельную палату, чтобы исключить рефлекторную рвоту.
В начале лечения, учитывая небольшой срок гестации, для исключения отрицательного влияния на плодное яйцо целесообразно назначать немедикаментозные средства. Для нормализации функционального состояния коры головного мозга и устранения вегетативной дисфункции показаны центральная электроаналгезия, иглоукалывания, психои гипнотерапия. Этих неме-дикаментозных методов лечения может быть достаточно при лечении больных с легкой формой рвоты беременных, а при средней и тяжелой степени – позволяют ограничить объем лекарственной терапии.
В отсутствие эффекта используют средства, непосредственно блокирующие рвотный рефлекс: препараты, воздействующие на различные нейромедиаторные системы продолговатого мозга: м-холинолитики (атропин), антигистаминные препараты (пипольфен, дипразин, тавегил), блокаторы дофаминовых рецепторов (нейролептики – галоперидол, дроперидол, производное фенотиазина – торекан), а также прямые антагонисты дофамина (реглан, церукал). Наиболее эффективны в клиническом отношении следующие комбинации: 1. дроперидол (1 мл внутримышечно), атропин (0,5 мл 0,1 % раствора внутримышечно), тавегил (1 мл внутримышечно); 2. церукал реглан (2 мл внутримышечно), атропин (0,5 мл 0,1 % раствора внутримы-шечно). При гипотензии, возникающей как следствие применения этих препаратов и самого заболевания, целесообразно введение 0,1 % раствора мезатона.
Инфузионная терапия при рвоте включает использование кристаллоидов, коллоидов и средств для парентерального питания. Кристаллоиды предназначены для регидратации. Из кристаллоидов используют комплексные солевые растворы Рингера-Локка, трисоль, хлосоль. Объем вводимых кристаллоидов должен составлять до 50 % от общего объема инфузии. Из коллоидов для дезинтоксикации целесообразно использовать гемодез и реополиглюкин. Объем коллоидных растворов должен составлять 10-15% от объема инфузии. Для парентерального питания применяют растворы глюкозы и аминокислот (альвезин, гидролизин). С целью лучшего усвоения глюкозы целесообразно вводить инсулин в небольших дозах. Объем вводимых препаратов для парентерального питания должен составлять не менее 35-40 % от общего объема инфузии.
Общий объем инфузионной терапии составляет 1-3 л в зависимости от тяжести токсикоза и массы тела пациентки. Критериями достаточности инфузионной терапии являются уменьшение обезвоживания и увеличение тургора кожи, нормализация величины гематокрита, увеличение диуреза.
На фоне инфузионной терапии назначают препараты, нормализующие метаболизм, С этой целью используют кофакторы биоэнергетического обмена: кокарбоксилазу (0,1 г), рибофлавин-мононуклеотид (1 мл 1 % раствора внутримышечно); витамин С (до 5 мл 5 % раствора). Для стимуляции анаболических реакций в тканях назначают спленин (2 мл внутримышечно), перидоксальфосфат (по 2 мл внутримышечно), рибоксин (0,2 г 3 раза в день), фолиевую кислоту (по 0,001 г 3 раза в день).
Комплексную терапию продолжают до стойкого прекращения рвоты, нормализации общего состояния, постепенного увеличения массы тела. Лечение рвоты беременных легкой и средней степени почти всегда бывает эффективным. Чрезмерная рвота беременных в отсутствие эффекта от комплексной терапии в течение 3 сут является показанием к прерыванию беременности.
Слюнотечение
Слюнотечение (ptyalism) заключается в повышенной саливации и потере значительного количества жидкости – до 1 л в сутки. Оно может быть самостоятельным проявлением токсикоза или сопровождать рвоту беремен-в ных. В развитии слюнотечения имеют значение не только изменения ЦНС, но и местные нарушения в слюнных железах и протоках под влиянием гормональной перестройки. Известно, что эстрогены оказывают активирующее воздействие на эпителиальный покров полости рта, вызывая секрецию слюны. При выраженном слюнотечении понижается аппетит, ухудшается самочувствие, возникает мацерация кожи и слизистой оболочки губ, больная худеет, нарушается сон; вследствие значительной потери жидкости появляются признаки обезвоживания.
Лечение. При слюнотечении проводят в основном то же лечение, что и при рвоте (режим, психотерапия, физиотерапевтические процедуры, инфузии и др.). Рекомендуется лечение в стационаре, где создаются условия для соблюдения лечебно-охранительного режима, назначают средства, регулирующие функцию нервной системы, метаболизма, при обезвоживании – инфузионные препараты. Одновременно рекомендуется полоскание рта настоем шалфея, ромашки, ментола. При сильном слюнотечении можно применять атропин по 0,0005 г 2 раза в день. Для предупреждения мацерации кожу лица смазывают вазелином. Слюнотечение обычно поддается лечению, и после выздоровления беременность развивается нормально.
Гестозы .
Гестозы представляют собой осложнение физиологически протекающей беременности, характеризующееся глубоким расстройством функций жизненно важных органов и систем. Основу гестозов составляют генерализованный спазм сосудов, гиповолемия, изменения реологических и коагуляционных свойств крови, нарушения микроциркуляции и водно-солевого обмена. Эти изменения вызывают гипоперфузию тканей и развитие в них дистрофии вплоть до некроза.Гестоз стабильно занимает 2-3-е место в структуре причин материнской смертности, являясь основной причиной перинатальной смертности и заболеваемости. Гестоз встречается в 13-16% от общего количества родов.
Единая терминология заболевания отсутствует. В течение многих лет в нашей стране был принят термин "поздний токсикоз беременных", подчеркивающий проявление симптомов заболевания в поздние сроки гестации (во второй половине). За рубежом был распространен термин "токсемия беременных". В 1972 г. Комитетом по терминологии при Американском обществе акушеров-гинекологов вместо этого термина введено обозначение заболевания как "преэклампсия" и "эклампсия". Преэклампсия включает в себя все клинические проявления гестоза, предшествующие эклампсии. За Рубежом используют и другие термины: "ОПГ-гестоз" EPH-gestosis (edema – отек, proteinuria – протеинурия, hypertension – гипертензия), "гипертензия, индуцированная беременностью", "гипертензия беременных". В 1985 г. в нашей стране был принят термин "ОПГ-гестоз", а с 1996 г. на пленуме межведомственного научного совета по акушерству и гинекологии РАМН, российской ассоциации акушеров-гинекологов было решено использовать рмин "гестоз".
Существующие термины не являются оптимальными. Термин "ОПГКестоз" предполагает наличие триады симптомов, которая встречается далене всегда. Термин "гипертензия, индуцированная беременностью", подчеркивает наличие только одного симптома заболевания – гипертензии. Исользуя термин "преэклампсия" как собирательное понятие, включающее нефропатию и собственно преэкламггсию, врач может не обратить должного внимания на кратковременный период, который непосредственно предшествует эклампсии.
Классификация. Чаще всего гестоз подразделяют на водянку беременных (hydrops gravidarum), нефропатию беременных (nephropatia gravidarum), преэклампсию (preeclampsia), эклампсию (eclampsia).
Некоторые авторы выделяют прегестоз, или претоксикоз, который представляет собой изменения метаболизма, сосудистой системы, гемостатических и реологических свойств крови, выявляющиеся в I-II триместрах беременности до клинических проявлений гестоза. Их обнаруживают при лабораторных исследованиях или после проб с физической нагрузкой.
Выделяют "чистые" и "сочетанные" гестозы. К "чистым" относят гестозы, которые возникают у беременных среди полного здоровья в отсутствие экстрагенитальной патологии. Такое подразделение в определенной мере условно, так как нередко экстрагенитальные заболевания протекают скрыто (например, латентное течение пиелонефрита, вегетососудистая дистония, гормональные нарушения). "Чистые" гестозы в настоящее время встречаются у 20-30 % беременных. Чаще наблюдаются сочетанные гестозы, которые возникают у беременных на фоне предшествовавшего заболевания. Наиболее неблагоприятно протекает гестоз у беременных с гипертонической болезнью, заболеваниями почек, печени, эндокринопатиями, нарушениями жирового обмена.
Этиология и патогенез.
До настоящего времени, несмотря на многочисленные исследования, этиология гестозов не установлена. Цвайфель еще в 1916 г. назвал эклампсию болезнью теорий. Исторически одной из первых была так называемая инфекционная теория, не подтвержденная в дальнейшем, так как не удалось найти возбудителя заболевания. В 20-40-е годы XX века возникновение токсикоза связывали с интоксикацией организма беременной веществами (интоксикационная теория), поступающими из плодного яйца. Эта точка зрения господствовала очень долго, несмотря на то что никаких токсичных веществ, первично вызывающих токсикоз, не было выявлено.
Кортико-висцеральная теория рассматривает гестоз как своеобразный невроз беременных с нарушением физиологических взаимоотношений между корой головного мозга и подкорковыми образованиями, с рефлекторными изменениями в сосудистой системе и нарушением кровообращения.
Подтверждением этой теории является факт относительно частого возникновения гестоза у беременных на фоне нервно-психических стрессов, нервных переживаний в условиях военного времени, недосыпаний, ведущих к истощению ЦНС. Методом электроэнцефалографии у беременных в ранних стадиях заболевания выявляются изменения функционального характера в подкорковых структурах.
Важное значение для развития гестозов имеет нарушение гормональной регуляции функций жизненно важных органов и систем. В связи с этим возникла эндокринная теория. По мнению сторонников эндокринной теории, в частности H.Selie. гестоз относится к реакциям типа общего адаптационного синдрома. Обоснованность теории подтверждается существенными изменениями при гестозах регуляции сердечно-сосудистой системы, органного кровотока, метаболизма за счет изменения функции гипоталамогипофизарно-надпочечниковой, ренин-ангиотензиновой и кинин-калликреиновой, простагландиновой систем, гормональной функции плаценты.
В последнее время большое значение в развитии гестоза придают им-мунологической несовместимости тканей матери и плода (иммунологическая теория). Роль иммунологических факторов до настоящего времени окончательно не установлена. Иммунологическая теория гестозов получила свое развитие в связи с разработкой проблемы тканевой совместимости. Ткань хрофобласта, являясь фетальной по своей сути, представляет собой слабый антиген. Считается, что мембраны трофобласта не содержат главного антигена гистосовместимости – HLA (Human Leucocyte Antigens). Тем не менее у беременных формируются антитела против HLA-антигенов. Беременные с гестозом чаще бывают гомозиготными по HLA-B. Женщины с указанным генотипом склонны к гипертонической болезни. Разные авторы придают значение в развитии гестозов различным изоантигенам гистосовместимости: HLA-B7, HLA-B17, HLA-B27 и т.д. Предполагается, что для развития гестоза необходимо сочетание HLA-гомозиготности и дефекта в рецессивном гене. Возможно, что в этих условиях менее устойчивы механизмы, обеспечивающие толерантность материнского организма к антигенам плода и больше вероятность развития иммунного конфликта мать-плод. Этот механизм может заключаться в избирательном угнетении Т-клеток матери веществами, вырабатываемыми плацентой. При этом блокируется первоначальное звено реакций трансплацентарного иммунитета – процесс распознавания Т-клетками антигенных различий между тканями матери и плаценты. В этих условиях возможна сенсибилизация материнского организма плацентарными белками. С учетом сходной антигенной структуры плаценты с тканями почек и печени вырабатываемые антиплацентарные антитела могут быть одновременно антиорганными по отношению к органам, поражающимся при гестозах. По мнению приверженцев иммунологической теории заболевания, результатом аутосенсибилизации и образования иммунных комплексов является, с одной стороны, морфологическая деструкция органов за счет васкулитов, микротромбозов; с другой стороны, иммунологические реакции, представляющие собой стрессорные раздражители, вовлекают в процесс гипофиз, надпочечники, нервную систему, усугубляя нарушения гормональной регуляции. Однако не всем ученым удалось выявить у женщин с гестозом циркулирующие иммунные комплексы.
Выдвигается также генетическая теория гестозов. Замечено, что среди дочерей женщин с преэклампсией число заболеваний гестозами в 8 раз выше, чем в нормальной популяции. Создана генетическая карта исключения, на основании которой предположен аутосомно-рецессивный путь наследования заболевания. При этом не отвергается существование "генов преэклампсии". Исследования указывают на то, что гены плода тоже могут играть роль в развитии гестозов.
Иммунологические и генетические особенности, свойственные беременным с гестозом, могут проявиться в нарушениях плацентации, о чем свидетельствуют положения плацентарной теории. Плаценте принадлежит существенная роль в развитии гестозов, поскольку только после рождения плаценты устраняются симптомы заболевания. В качестве пускового механизма гестозов сторонники плацентарной теории придают важное значение гуморальным факторам плацентарного происхождения. Как известно, во Ремя нормальной беременности извитые материнские артерии, которые питают плацентарное ложе, подвергаются выраженной перестройке для улучшения адекватной доставки кислорода к растущей матке. Внедряющийся в сосуды матки трофобласт в первой половине беременности способствует преобразованию мышечных артерий с узким просветом в расширенные тонкостенные сосуды путем нарушения целостности их эндотелия и разрушения подлежащей мышечно-эластичной мембраны. У пациенток, у которых в последующем развивается гестоз, возможно, в результате иммунологических и генетических особенностей в ранних стадиях гестации происходит торможение миграции трофобласта в сосуды матки. При этом извитые маточные артерии сохраняют морфологическую структуру небеременных; в них не происходит трансформации мышечного слоя. Указанные морфологические особенности спиральных сосудов матки по мере прогрессирования беременности предрасполагают их к спазму, снижению межворсинчатого кровотока и гипоксии. Гипоксия, развивающаяся в тканях маточно-плацентарного комплекса, вызывает поражение эндотелия сосудов с нарушением его вазоактивных свойств и выделением ряда медиаторов, играющих ключевую роль в регуляции сосудистого тонуса и микроциркуляции.
В настоящее время большинство исследователей пришли к выводу, что не существует единого механизма развития гестозов, а наблюдается сочетанное воздействие этиологических факторов: нейрогенных, гормональных, иммунологических, генетических, плацентарных.
В конечном итоге выявленные изменения в ЦНС, плаценте, гормональной регуляции, иммунном статусе обусловливают нарушения микрогемодинамики, которые приводят к развитию дисфункции большинства органов.
В большей мере, чем этиология, определен патогенез гестозов (схема 14.1), в основе которого лежит генерализованный спазм сосудов, обусловливающий ишемические и гипоксические изменения в тканях с нарушением их функции. Отражением спазма сосудов является гипертензия.
Спазм сосудов при гестозах обусловлен многими факторами. С 80-х годов одним из звеньев регуляции сосудистого тонуса наряду с нейрогенными и гормональными считается эндотелий, обладающий потенциальными вазоактивными свойствами. Вследствие особого расположения эндотелий является своеобразной мишенью для эритроцитов, тромбоцитов, лейкоцитов, иммунных комплексов, вирусов, бактерий, которые могут нарушать его структуру и функцию. В эндотелии синтезируется ряд медиаторов, играющих важную роль в регуляции гемостаза и сосудистого тонуса.
Изменения эндотелия для гестозов специфичны. Они заключаются в набухании цитоплазмы с отложением фибрина вокруг базальной мембраны и внутри набухшей эндотелиальной цитоплазмы. Развивается своеобразный эндотелиоз, который первоначально носит локальный характер и наблюдается в сосудах плаценты. Повреждение эндотелия при гестозах подтверждается увеличением содержания в плазме крови фибронектина – гликопротеида преимущественно субэндотелиального происхождения. Указанные изменения в эндотелии приводят к выделению эндотелина. Он является мощным вазоконстриктором. Его субпороговый уровень способен потенцировать эффект других вазоконстрикторов (норадреналин, серотонин). Наиболее чувствительны к вазоконстрикторному действию эндотелина почечные артерии.
Повреждение эндотелия приводит к уменьшению в нем синтеза вазодилататоров, клеточных дезагрегантов (простациклина, эндотелиального релаксирующего фактора – NO) и потере тромборезистентных свойств сосудов. При поражении эндотелия на ранних стадиях заболевания обнажается мышечно-эластичная мембрана сосудов, которая повышает их чувствительность к вазоактивньш веществам. В конечном итоге создаются условия ддя генерализованного спазма.
Важной причиной спазма сосудов при гестозах является дисбаланс между вазоконстрикторами и вазодилататорами. Для гестозов характерна активация вазоконстрикторов: вазопрессина, метаболитов ренин-ангиотензин-альдостероновой системы, катехоламинов, серотонина, тромбоксанов Одновременно отмечается снижение активности вазодилататоров: продуктов калликреин-кининовой системы, простациклина, эндотелиального релаксцрующего фактора. Особое значение в развитии вазоспазма при гестозах имеют изменение синтеза альдостерона, ангиотензина II, дисбаланс простагландинов. Альдостерон после образования в надпочечниках быстро диффундирует из сосудистого русла в клетки и экстрацеллюлярную жидкость, что является причиной задержки натрия и воды в межклеточном пространстве, в клетках и сосудах. Задержка натрия в сосудистой стенке приводит к набуханию ее слоев и дополнительно к сужению просвета сосудов. Мышечный слой артериол становится более чувствительным к действию различных прессорных веществ, в том числе ангиотензина II. Чувствительность сосудов к ангиотензину II увеличивается по мере прогрессирования заболевания.
В механизмах развития вазоспазма при гестозах важное значение имеют гормоноподобные вещества с широким спектром биологического действия – простагландины. Из них в первую очередь заслуживают внимания тромбоксаны (А2) и простациклины, являющиеся метаболитами арахидоновой кислоты, Тромбоксаны синтезируются преимущественно в мембранах микросом тромбоцитов, а простациклины – в эндотелии сосудов. Простациклины и тромбоксаны оказывают антагонистическое действие на тонус сосудистой стенки и на гемостаз, в частности на агрегационную активность тромбоцитов. Тромбоксан приводит к повышению агрегации тромбоцитов, образованию клеточных агрегатов с выделением из них биологически активных веществ (серотонин, Са и др.), повышающих сосудистый тонус. Простациклин обладает выраженной антиагрегационной активностью и является мощным вазодилататором, вызывая гипотензию за счет преимущественного снижения диастолического давления. При гестозах недостаточное содержание простациклина и избыточное – тромбоксана способствует возникновению генерализованного вазоспазма и гиперкоагуляции с развитием синдрома диссеминированного внутрисосудистого свертывания (ДВС).
Не преуменьшая роли генерализованного спазма артериол в возникновении гипоксии тканей при гестозах, следует обратить внимание на важное значение нарушений реологических (текучих) свойств крови в формировании микроциркуляторных нарушений. Они играют особую роль в перфузии органов. Изменения текучести крови при гестозах определяются повышением вязкостных характеристик крови, агрегационных свойств эритроцитов и тромбоцитов с образованием клеточных агрегатов, появление которых в кровотоке на фоне вазоспазма способствует формированию локализованных областей стаза, депонированию клеточных элементов крови. В результате этого снижаются кислородная емкость крови и объемный кровоток в органах.
Текучесть крови по сосудам при гестозах определяется также коагуляционными свойствами крови, изменения которых свидетельствуют о гиперкоагуляции и развитии хронической формы ДВС-синдрома. Причины гиперкоагуляции и развития ДВС-синдрома при гестозах могут быть следующими: повреждение эндотелия и снижение его антитромботического потенциала, уменьшение антикоагулянтного потенциала крови, циркуляторные нарушения за счет вазоспазма, гипоксия и гипоксемия. Основу хронического течения ДВС-синдрома при гестозах составляет генерализованное внутрисосудистое свертывание крови с нарушением микроциркуляции в органах.
Обязательными компонентами ДВС-синдрома при гестозах являются агрегация тромбоцитов и вовлечение их в тромбообразование, включающее в себя первоначально взаимодействие клеток с сосудистой стенкой за счет обнажения субэндотелиального слоя при повреждении эндотелия. Образование в дальнейшем фибриногена приводит к формированию клеточнофибриновых микросгустков и отложению в микрососудах прочных нитей фибрина, которые одновременно повреждают строму эритроцитов и затрудняют их прохождение по капиллярам. В результате этого происходит разрушение эритроцитов с развитием микроангиопатической гемолитической анемии.
Наряду с вазоспазмом, нарушением реологических и коагуляционных свойств крови в развитии гипоперфузии органов важную роль играют изменение макрогемодинамики, снижение объемных показателей центральной гемодинамики: ударного объема, минутного объема сердца, объема циркулирующей крови (ОЦК). У пациенток с гестозом не наблюдается выявляемого при физиологическом течении беременности увеличения (в среднем на 1500 мл) ОЦК, необходимого для адекватного формирования плацентарного кровотока. Низкие значения ОЦК при гестозах обусловлены как генерализованной вазоконстрикцией и снижением сосудистого русла, так и повышенной проницаемостью сосудистой стенки и выходом жидкой части крови в ткани. Увеличение проницаемости сосудов зависит от дистрофических изменений эндотелия, повышения гиалуронидазной активности сыворотки крови, липолитических и протеолитических ферментов, высвобождения брадикинина и серотонина из связанного состояния, уменьшения в сосудистой стенке содержания кальция. Одновременно с этим причинами увеличения количества интерстициальной жидкости при гестозах является дисбаланс коллоидно-осмотического давления плазмы и тканей, окружающих сосуды, что обусловливается гипопротеинемией, с одной стороны, а с другой – задержкой натрия в тканях и повышением их гидрофильности. В результате у беременных с гестозом формируется характерное парадоксальное сочетание – гиповолемия на фоне задержки большого количества жидкости (до 15,8 – 16,6 л) в интерстиции, что приводит к снижению адекватности микроциркуляции.
Развивающийся спазм сосудов, нарушение реологических и коагуляционных свойств крови, повышение общего периферического сосудистого сопротивления, гиповолемия формируют гипокинетический тип кровообращения, свойственный большинству беременных с гестозами.
В тканях жизненно важных органов при гестозах по мере прогрессирования заболевания происходят существенные нарушения, развитие некрозов. Они обусловлены гипоксическими изменениями как финалом гипоперФУзии и связаны с иммунологическими, гормональными и, возможно, генетическими дисфункциями. Перечисленные изменения в ранних стадиях заболевания способствуют активации в клетках свободно-радикального перекисного окисления липидов (СПОЛ) и фосфолипаз со снижением содержания полиненасышснпых жирных кислот (ПНЖК) и нарушениями в "арахидоновом каскаде", что является одним из дополнительных факторов дисбаланса тромбоксана и простациклина и нарушения микроциркуляции Одновременно образование токсичных радикалов приводит к дисбалансу барьерной и матричной функции клеточных мембран.
Нарушение матричной функции мембран заключается в изменении или извращении механизма действия различных мембранных белков (транспортных, ферментных, рецепторов гормонов, антител и белков, связанных с иммунитетом), что приводит к изменению функции клеточных структур.
Нарушение барьерной функции липидного бислоя мембран сопряжено с изменением функционирования каналов для ионов^+в первую очередь Са , а также Na , Ка , Mg . Массивный переход Са в клетку приводит к необратимым изменениям в ней, к энергетическому голоду и гибели, с одной стороны, а с другой – дополнительно к мышечной контрактуре и вазоспазму. Возможно, эклампсия, представляющая собой контрактуру поперечнополосатой мускулатуры, обусловлена нарушением проницаемости мембран и массивным перемещением Са в клетку. Подтверждением этому может быть тот факт, что в эксперименте Mg, являющийся антагонистом Са, предотвращает развитие этого процесса. Как известно, Mg оказывает п рот и вое уд о рож ное действие у беременных с эклампсией.
Указанный комплекс гемодинамических и метаболических изменений является фоном, на котором развиваются дистрофические процессы в жизненно важных органах, обусловливающих их дисфункцию.
Гестоз почти всегда сопровождается тяжелым нарушением функции почек – от протеинурии до острой почечной недостаточности. Патоморфологические изменения, связанные с гестозом, в наибольшей степени распространяются на канальцевый аппарат (картина гломерулярно-капиллярного эндотелиоза) – выраженная дистрофия извитых канальцев, в части случаев с десквамацией и распадом клеток почечного эпителия. Эту картину дополняют очаговые и мелкоточечные кровоизлияния от единичных до множественных под капсулу почек, в паренхиму – преимущественно в интермелиарную зону, редко в мозговой слой, а также в слизистую оболочку чашечек и лоханок.
При гестозах в связи с тяжелыми патоморфологическими изменениями в печени нарушается ее функция . Эти изменения возникают в результате хронического расстройства кровообращения: паренхиматозная и жировая дистрофия гепатоцитов, некрозы печени и кровоизлияния. Некрозы могут быть от очаговых, мелких до обширных. Кровоизлияния чаще множественные, различной величины, сочетаются с субкапсулярными кровоизлияниями, перенапряжением фиброзной оболочки печени (глиссоновой капсулы) вплоть до ее разрыва.
Функциональные и структурные изменения большого мозга при гестоэе варьируют в широких пределах. Они обусловлены, как и в других органах, нарушением микроциркуляции, появлением тромбозов в сосудах с развитием дистрофических изменений нервных клеток, периваскулярных некрозов. Одновременно развиваются мелкоточечные или мелкоочаговые кровоизлияния. Характерен (особенно при тяжелой нефропатии) отек головного мозга с повышением внутричерепного давления. Комплекс ишемических изменений в конечном итоге меожет обусловливать приступ эклампсии.
При гестозах у беременных обнаружены выраженные изменения в плаценте, которые являются причиной развития хронической гипоксии и синдрома задержки роста плода (ВЗРП). Наблюдаются выраженные изменения эндотелия сосудов в виде облитерирующего эндартериита, отек стромы ворсин, тромбоз сосудов и межворсинчатого пространства,некроз отдельных ворсин, очаги кровоизлияния, жирового перерождения плацентарной ткани. Указанные изменения приводят к снижению маточно-плацентарного кровотока, инфузионной и трансфузионной недостаточности плаценты.
Клиническая картина и диагностика
В доклинической стадии заболевания отмечаются прогрессирующие по мере развития беременности снижение числа тромбоцитов (до 1б010 /л и менее), гиперкоагуляция в клеточном и плазменном звене гемостаза, снижение уровня антикоагулянтов (эндогенный гепарин, антитромбин-Ш), лимфопения, активация СПОЛ, снижение уровня антиоксидантной активности крови, повышение уровня плазменного фибронектина и а2-макроглобулина – маркеров повреждения эндотелия, уменьшение кровотока в аркуатных артериях (по данным допплерометрии). Доклинические изменения выявляются с 13-15-й недели гестацин.
Водянка беременных проявляется стойкими отеками и является самым ранним симптомом гестоза. Задержка жидкости в организме беременных на первых этапах развития болезни связана в большей мере не с нарушением выделительной функции почек, а с расстройством водно-солевого обмена, задержкой солей натрия, повышенной проницаемостью сосудистой стенки, за счет гормональной дисфункции (увеличение активности альдостерона и антидиуретического гормона).
Различают скрытые и явные отеки. О скрытых отеках свидетельствует патологическая (300 г и более за неделю) или неравномерная еженедельная прибавка массы тела. Явные видимые отеки по их распространенности различаются по степеням: I степень – отеки нижних конечностей; II степень – отеки нижних конечностей и живота; III степень – отеки ног, стенки живота и лица; IV степень – анасарка. Вследствие снижения диуреза и задержки жидкости в организме беременной быстро нарастает масса тела, снижается диурез, отмечается никтурия. Отеки начинаются обычно с области лодыжек, затем постепенно распространяются вверх. У некоторых женщин одновременно с лодыжками начинает отекать и лицо, которое становится одутловатым. Черты лица грубеют, особенно заметны отеки на веках глаз. При их распространении на живот над лобком образуется тестоватая полушка. Нередко отекают половые губы. Утром отеки менее заметны, потому что во время ночного отдыха жидкость равномерно распределяется По всему телу. За день (в силу вертикального положения) отеки спускаются нижние конечности, низ живота. Возможно накопление жидкости в серозных полостях.
Даже при выраженных отеках общее состояние и самочувствие беремен"ых продолжает оставаться хорошим, жалоб они не предъявляют, а при Клиническом и лабораторном исследованиях не обнаруживается существенных отклонений от нормы. Зарубежные авторы относят отеки к физиологическому явлению, поскольку считается, что они не оказывают особого влияния на исход беременности, перинатальную заболеваемость и смертность при условии, если у матери не происходит развития гипертензии и протеинурии. Однако только у 8-10% пациенток отечный синдром не переходит в следующую стадию заболевания. У остальных к отекам присоединяются гипертензия и протеинурия. Поэтому отеки следует относить к патологическому явлению.
Диагностика водянки беременных основывается на обнаружении отеков во время беременности, не зависящих от экстрагенитальных заболеваний. Для правильной оценки водянки беременных необходимо исключить заболевания сердечно-сосудистой системы и почек, при которых также возможна задержка жидкости в организме.
О задержке жидкости в тканях при водянке дополнительно свидетельствует увеличение окружности голеностопного сустава на 1 см и более в течение недели, а также наличие отечности пальцев и положительного симптома кольца: кольцо, которое обычно носят на среднем или безымянном пальце, приходится надевать на мизинец. Правильное представление о накоплении в организме жидкости можно получить, сопоставляя ежедневное количество выпитой и выделенной жидкости, или измеряя в динамике массу тела беременной.
Нефропатия характеризуется триадой симптомов (отеки, гипертензия, протеинурия). Однако нередко могут отмечаться два симптома в различных сочетаниях. Нефропатия беременных обычно развивается на фоне предшествующей ей водянки. Наряду с появлением отеков повышается артериальное давление.
Гипертензия является одним из важных клинических признаков нефропатии, ибо она отражает тяжесть ангиоспазма. Гипертензией считается повышение артериального давления до 135/85 мм рт.ст. и выше. Важное значение имеют исходные значения артериального давления, О гипертензии беременных свидетельствует повышение систолического артериального давления на 30 мм рт.ст. от исходного, а диастолического – на 15 мм рт.ст. и выше. При прогрессировании нефропатии артериальное давление может быть чрезмерно выраженным – 190/100 мм рт.ст. Особое значение имеет нарастание диастолического давления и уменьшение пульсового, равного в норме в среднем 40 мм рт.ст. Значительное уменьшение его свидетельствует о выраженном спазме артериол и является неблагоприятным симптомом. Увеличение диастолического артериального давления прямо пропорционально снижению плацентарного кровотока и повышению перинатальной заболеваемости и смертности. Даже незначительное стойкое повышение систолического давления при высоком диастолическом и низком пульсовом следует рассматривать как прогностически неблагоприятный показатель. Тяжелые последствия при гестозах (кровотечение, преждевременная отслойка нормально расположенной плаценты, антенатальная гибель плода) иногда обусловлены не высоким артериальным давлением, а его резкими колебаниями.
Для правильной оценки степени гипертензии целесообразно учитывать среднее артериальное давление (САД), которое рассчитывается по формуле:
САД = (АДЛ + 2АДдиаст.)/3.
В норме САД составляет 90-100 мм рт.ст. Артериальная гипертензия диагностируется при уровне САД, равном 105 мм рт.ст. или выше.
Протеинурия (появление белка в моче) – важный прогностический признак нефропатии. Она проявляется выделением нескольких белков с различной молекулярной массой. Прогрессирующее нарастание ее свидетельствует об ухудшении течения заболевания. Выделение белка с мочой при нефропатии обычно протекает без появления осадка мочи, характерного для нефрита (эритроциты, восковидные цилиндры, лейкоциты).
Одновременно с развитием триады симптомов у беременных уменьшается диурез. Суточное количество мочи снижается до 400-600 мл и ниже. Чем меньше выделяется мочи, тем хуже прогноз заболевания. Некорригируемая олигурия может свидетельствовать о почечной недостаточности.
Кроме указанных симптомов, состояние беременных, исход беременности определяются дополнительными факторами, в частности длительностью заболевания. Длительно текущая нефропатия, симптомы которой появляются до 20-й недели, почти в 80 % случаев резистентна к проводимой терапии. Раннее начало заболевания и длительное его течение в 65 % случаев приводит к развитию внутриутробной задержки роста плода, появление которой также оказывает влияние на течение, прогрессирование и тяжесть заболевания.
Тяжесть состояния беременных при нефропатии зависит также от экстрагенитальной патологии, при наличии которой гестоз принимает затяжное течение с быстрыми рецидивами, несмотря на проведенную терапию. Оценивать состояние беременных при нефропатии необходимо по шкале, представленной в табл.14.1. Каждый признак оценивается в баллах. Нефропатия легкой степени оценивается в 7 баллов и менее, средней – 8-11 баллов, тяжелая – 12 и более. Балльная оценка может меняться на фоне терапии.Нефропатия беременных опасна для здоровья беременных, рожениц и родильниц, так как она может перейти в эклампсию, вызвать тяжелые нарушения функции жизненно важных органов, а также создает предпосылки для других осложнений (преждевременная отслойка нормально расположенной плаценты, преждевременные роды, атонические кровотечения, гипоксия плода, асфиксия новорожденных, антенатальная и интранатальная смерть плода).
Диагностика нефропатии не представляет трудностей. Характерное развитие заболевания и отчетливая симптоматика позволяют поставить правильный диагноз почти во всех случаях. Из дополнительных методов исследования важное значение имеет офтальмоскопия. Нарушение мозгового кровообращения при гестозах обычно рано находит отражение в офтальмоскопической картине при исследовании глазного дна в форме спазма артерий сетчатки (ангиопатия), приводящего к расстройству ретинального кровообращения и перекапиллярному отеку. Если наряду со значитель-ным и стойким спазмом сосудов сетчатки на ее периферии определяются отечность и темные полосы, то это свидетельствует о возможности отслойки сетчатки.
При диагностировании нефропатии необходимо путем тщательного сбора анамнеза и клинического обследования исключить хроническую патологию почек, сердечно-сосудистые заболевания, нейроэндокринные синдромы.
Преэклампсия является переходным состоянием от нефропатии к эклампсии и выражается в преимущественном нарушении микроциркуляции Центральной нервной системе.
Преэклампсию характеризуют отеки, гипертензия, наличие белка в моче, чувство тяжести в затылке или головные боли, боли в эпигастрии и правом подреберье, тошнота, рвота, нарушение зрения. Интенсивность субъективных ощущений может быть различной. Они нередко предшествуют эклампсии. Одновременно с этим могут наблюдаться расстройство памяти, бессонница или, наоборот, сонливость, раздражительность, безразличие к окружающему, вялость. Большинство симптомов в преэклампсии обусловлено нарушением мозгового кровообращения. Боли в эпигастральной области зависят от ряда причин: мелкие кровоизлияния в стенки желудка, гастралгия вследствие нарушения нервной регуляции. Наиболее часто появ-ление болей в эпигастрии и в правом подреберье свидетельствует о перерастяжении глиссоновой капсулы печени за счет отека, а в тяжелых случаях – кровоизлияния в печень. Сочетание болей в эпигастральной области с головной болью нередко свидетельствует о возможности наступления приступов эклампсии в ближайшее время. Изменения зрения проявляются ослаблением зрения, "пеленой или туманом перед глазами", мельканием мушек или искр. Расстройство зрения может быть центрального происхождения и связано с нарушением кровообращения в затылочной части коры мозга. Одновременно появление зрительных симптомов зависит от изменения сетчатки. При этом возможны поражения сетчатки в виде ретинита, кровоизлияний в нее, отслойки.
При преэклампсии существует постоянная опасность наступления при падков. Может пройти несколько дней или несколько часов, даже минут, и под влиянием различных раздражителей начинаются припадки.
Критериями тяжести состояния беременных при нефропатии и большой вероятности развития эклампсии являются следующие признаки: систолическое артериальное давление 160 мм рт.ст. и выше; диастолическое артериальное давление 110 мм рт.ст. и выше; протеинурия (содержание белка до 5 г в сутки и более); олигурия (объем мочи в сутки менее 400 мл); мозговые и зрительные нарушения, диспепсические явления; тромбоцитепения, гипокоагуляция; нарушение функции печени. Наличие хотя бы одного из этих признаков свидетельствует о тяжелом состоянии беременной, о возможности развития эклампсии.
Эклампсия (от греч. eklampsis – вспышка, воспламенение, возгорание, что указывает на быстрое течение) – тяжелая стадия гестоза, выражающаяся сложным симптомокомплексом, самым характерным симптомом которого служат приступы судорог поперечнополосатой мускулатуры всего тела. Эклампсия является конечным звеном гестоза и развивается на фоне нефропатии при наличии симптомов преэклампсии. Относительно редко наблюдаются ситуации, при которых судороги могут появиться без предвестников. Различают эклампсию беременных, эклампсию рожениц, эклампсию родильниц.
Клиническая картина типичной эклампсии заключается в судорогах, которые развиваются на фоне симптомов тяжелой нефропатии и преэклампсии. При этом появление первого судорожного припадка эклампсии нередко провоцируется каким-либо внешним раздражителем: ярким светом, резким стуком, болью (при инъекциях, влагалищных исследованиях), сильной отрицательной эмоцией и т.д. Типичный припадок судорог продолжается в среднем 1-2 мин и состоит из четырех последовательно сменяющихся моментов.
Первый момент – вводный. Характеризуется мелкими фибриллярными подергиваниями мышц лица, век. Взгляд становится неподвижным, глаза фиксируются в одном направлении, зрачки расширяются, отклоняясь кверху или в сторону. Через секунду глаза при частом подергивании век закрываются, так что зрачки уходят под верхнее веко, становится виден белок. Углы рта оттягиваются книзу; быстрые фибриллярные подергивания мимических мышц лица, в том числе век, быстро распространяются сверху вниз, с лица на верхние конечности. Кисти рук сжимаются в кулаки. Вводный период продолжается около 30 с.
Второй момент – период тонических судорог – тетанус всех мышц тела, в том числе дыхательной мускулатуры. Вслед за подергиванием верхних конечностей голова больной откидывается назад. Тело вытягивается и напрягается, позвоночник изгибается, лицо бледнеет, челюсти плотно сжимается. Больная во время припадка не дышит, быстро нарастает цианоз. Продолжительность этого периода 10-20 с. Несмотря на кратковременность, этот период самый опасный. Может наступить внезапная смерть, аЩе всего от кровоизлияния в мозг.
Третий момент – период клонических судорог. Неподвижно лежавшая Д° этого, вытянувшись в струнку, больная начинает биться в непрерывно следующих друг за другом клонических судорогах, распространяющихся по сверху вниз, вследствие чего она как бы подпрыгивает в кровати, резко Двигая руками и ногами. Больная не дышит, пульс не ощутим. Постепенно судороги становятся более редкими и слабыми и. наконец, прекращаются Больная делает глубокий шумный вдох, сопровождающийся храпом, переходящий в глубокое редкое дыхание. Продолжительность этого периода от 30 с до 1,5 мин, а иногда больше.
Четвертый момент – разрешение припадка. Изо рта выделяется пена окрашенная кровью, лицо постепенно розовеет. Начинает прощупываться пульс. Зрачки постепенно сужаются.
После припадка следует коматозное состояние. Больная лежит без сознания, громко дыша. Это состояние может скоро пройти. Больная приходит в сознание, ничего не помня о случившемся, жалуясь на головную боль и общую разбитость. Или же коматозное состояние не прерывается пробуждением, а переходит через некоторое время в следующий припадок. Число припадков может быть разное. Авторами в конце XIX – начале XX века описывались случаи эклампсии с большим количеством припадков – до 50 – 100. В настоящее время редко приходится наблюдать 3-4 припадка. Полное сознание в паузах между припадками имеет благоприятное значение. Глубокая кома знаменует тяжелое течение болезни. Если глубокая кома продолжается часами, сутками, то прогноз плохой, даже если припадки прекращаются.
Коме в большей мере соответствует отек мозга, как результат нарушения авторегуляции церебрального кровотока на фоне астрой гипертензии. При наличии внутричерепных кровоизлияний за счет разрыва мозговых сосудов прогноз заболевания ухудшается.
Дополнительно ухудшают прогноз следующие симптомы: гипертермия, тахикардия, особенно при нормальной температуре тела, моторные беспокойства, желтуха, некоординированные движения глазных яблок, олигурия.
Встречается и бессудорожная форма эклампсии – весьма редкая и чрезвычайно тяжелая форма. Картина заболевания весьма своеобразная: беременная обычно жалуется на сильную головную боль, потемнение в глазах. Неожиданно может наступить полная слепота (амавроз) и больная впадает в коматозное состояние при высоком артериальном давлении. Очень часто бессудорожная форма эклампсии связана с кровоизлиянием в мозг. При этом возможен летальный исход в связи с кровоизлиянием в стволовую часть мозга.
Как правило, распознавание эклампсии трудностей не представляет. Необходимо проводить дифференциальный диагноз с эпилепсией. Об эпилепсии свидетельствуют анамнестические данные, нормальные анализы мочи, отсутствие повышенного артериального давления, эпилептическая аура и эпилептический крик перед припадком.
Следует эклампсию дифференцировать от уремии, некоторых мозговых заболеваний (менингит, опухоли мозга, тромбозы синусов, кровоизлияния).
Диагноз гестоза ставится на основании лабораторных и клинических данных. Для своевременной диагностики заболевания необходимо исследование коагуляционных свойств крови, количества клеток крови, гематоКрита, печеночных ферментов, биохимического анализа крови, общего и биохимического анализа мочи, диуреза, измерение артериального давления в динамике на обеих руках, контроль за массой тела, концентрационной функцией почек, состоянием глазного дна. Целесообразно проводить ультразвуковое исследование, включая допплерометрию кровотока в сосудах системы мать-плацента-плод. Необходимы консультативные осмотры те-рапевта, нефролога, невропатолога, окулиста.
Осложнения гестозов. Тяжелые формы гестоза могут приводить к сердечной недостаточности; отеку легких как результату шокового легкого; острой почечной недостаточности за счет канальцевого и кортикального некроза, кровоизлияний; мозговой коме, кровоизлияниям в надпочечники, кишечник, поджелудочную железу, селезенку. Одним из частых осложнений во время беременности является преждевременная отслойка нормально расположенной плаценты. Характерным осложнением при гестозах является плацентарная недостаточность, приводящая к внутриутробной задержке роста плода, хронической и острой гипоксии плода, внутриутробной гибели плода.
В настоящее время увеличивается вероятность развития при тяжелых формах заболевания HELLP-синдрома, который впервые описан в 1982 г. Первые буквы сокращенного названия синдрома обозначают следующее; Н – (hemolysis) гемолиз; EL – (elevated liver enzymas) повышение уровня ферментов печени; LP – (low platelet count) тромбоцитопения. При тяжелой нефропатии и эклампсии он развивается в 4-12 % случаев и характеризуется высокой материнской и перинатальной смертностью.
Один из кардинальных симптомов HELLP-синдрома – гемолиз (микроангиопатическая гемолитическая анемия) характеризуется наличием в мазке крови сморщенных и деформированных эритроцитов, их разрушенных фрагментов (шистоцитов) и полихромазии. При разрушении эритроцитов освобождаются фосфолипиды, приводящие к постоянной внутрисосудистой коагуляции (хронический ДВС-синдром). Повышение уровня печеночных ферментов при HELLP-синдроме вызвано блокадой кровотока во внутрипеченочных синусоидах из-за отложения в них фибрина, что приводит к дегенерации печеночных клеток. При обструкции кровотока и дистрофических изменениях в гепатоцитах происходит перерастяжение глиссоновой капсулы, сопровождающееся типичными жалобами (боли в правом подреберье в эпигастрии). Повышение внутрипеченочного давления может привести к субкапсулярной гематоме печени, которая может разорваться при малейшем механическом повреждении (повышение внутрибрюшного давления при родоразрешении через естественные род9овые пути, применение метода Крестеллера). Тромбоцитопения (менее 9010 /л) вызвана истощением тромбоцитов вследствие образования микротромбов при нарушении сосудистого эндотелия. Считается, что в развитии HELLP-синдрома важное значение имеют аутоиммунные реакции. Этапы заболевания при этом представляются следующим образом: аутоиммунное поражение эндотелия, гиповолемия со сгущением крови, образование микротромбов с последующим фибринолизом.
HELLP-синдром, как правило, возникает в III триместре, чаще при сроке 35 нед. Такие признаки как тромбоцитопения и нарушение функции печени достигают максимума спустя 24-28 ч после родоразрешения. Клиническая картина HELLP-синдрома характеризуется агрессивным течением и стремительным нарастанием симптомов. Первоначальные проявления неспецифичны и включают головную боль, утомление, недомогание, тошноту и рвоту, боли в животе, диффузные или локшшзующиеся в правом подреберье. Наиболее характерны желтуха, рвота с примесью крови, кровоизлияния в местах инъекций, нарастающая печеночная недостаточность, судороги выраженная кома. Нередко наблюдается разрыв печени с кровотечением брюшную полость. В послеродовом периоде из-за нарушения свертывающей системы наблюдаются профузные маточные кровотечения.
Лечение
Принципы терапии гестозов заключаются в следующем; 1. создание лечебно-охранительного режима 2. восстановление функции жизненно важных органов 3. быстрое и бережное родоразрешение.
Создание лечебно-охранительного режима осуществляется за счет нормализации функции центральной нервной системы.
Нормализация функции жизненно важных органов и систем достигается в результате восстановления микроциркуляции, сосудистого тонуса, волемических, реологических, гемостатических, оксидантных свойств крови структурно-функциональных свойств клеточных мембран, водно-солевого обмена, маточно-плацентарного кровообращения.
При водянке I степени возможно проведение терапии в условиях женских консультаций. При водянке II-IV степени лечение осуществляется в условиях стационара. Беременных с нефропатией тяжелой степени, преэклампсией, эклампсией целесообразно госпитализировать в стационары многопрофильных больниц, имеющих реанимационное отделение и отделение для выхаживания недоношенных детей. При тяжелой нефропатии, преэклампсии и эклампсии терапия начинается с того момента, когда врач впервые увидел пациентку (дома, в момент транспортировки, в приемном отделении лечебного стационара).
Терапия в зависимости от степени тяжести нефропатии изложена в табл.14.1. Терапия гестозов должна проводиться под контролем ЦВД (в пределах 5-10 см вод.ст.), диуреза (не менее 35 мл/ч), концентрационных (гемоглобин не менее 70 г/л, гематокрит не менее 27 %, количество эритроцитов не менее 2500 тыс. и тромбоцитов не менее 100 тыс.) и биохимических показателей крови (общий белок не менее 60 г/л, трансаминазы ACT, АЛТ, общий билирубин, креатинин в пределах физиологической нормы в зависим+ости от методики определения), электролитов (К не более 5,5 ммоль/л, Na – 130-159 ммоль/л).
Важное значение в комплексной терапии уделяется нормализации функции ЦНС, снижению центральной и рефлекторной гиперактивности. Для этого применяются различные психотропные препараты. При водянке, нефропатии легкой степени предпочтение следует отдавать различным фитосборам, физиотерапевтическим мероприятиям.
Нормализация микрогемодинамики у беременных с гестозом осуществляется также назначением препаратов гипотензивного действия. Гипотензивная терапия осуществляется при систолическом АД, превышающем исходное до беременности на 30 мм рт.ст., а диастолическом – на 15 мм рт.ст. Правильным является сочетание препаратов с различным механизмом действия: спазмолитиков, адреноблокатеров, периферических вазодилататоров, ингибиторов вазоактивных аминов, ганглиоблокаторов. При нефропатии легкой степени используется монотерапия, при средней степени – комплексная терапия в течение 5-7 дней с последующим переходом на монотерапию при наличии эффекта.
При назначении гипотензивных средств следует помнить о том, что они, благоприятно влияя на мать, могут не приводить к существенному улучшению состояния плода, поскольку в условиях чрезмерного снижения артериального давления возможно уменьшение маточно-плацентарного кровотока.
Белково-растительная диета (количество соли до 8 г/сут, жидкости до 1200-1500, разгрузочные дни), bed rest, иглоукалывание, электротранквилизация, элсктросон, фитосборы (микстура Шарко), настойка пустырника, валерианы; один HI препаратов: триоксазин, реланиум (0,01 г 3 раза в день), нозепам (0,01 г 3 раза), радедорм (0,01 г на ночь).
Эуфиллин по 0,15 г 3 раза, папаверин по 0,4 г 3 раза, дибазол по 0,02-0,05 г 2-3 раза, адельфан 1 таблетка 3 раза, клофелин 0,15 мг 3 раза, верапамил по 0,08 г 3 раза, норвакс 5 мг в сутки
Перед началом обследования и лечения: кратковременный анальгети чески й наркоз закисно-кислородный (1:1) или в сочетании с фторотаном. Внутривенно: седуксен 2-4 мл 0,5 % раствора, дролеридол 1-2 мл 0,25 % раствора, промедол 1 мл 2 % раствора, магния сульфат одномоментно 10 мл 25 % раствора (от 2 до 4 г сухого вещества), в последу-ющем длительные введения в виде инфузий (до 10 г в сутки).
Дибазол 2-6 мл 0,5 % или 1 % раствора внутримышечно, папаверина гидрохлорида 2 мл 2 % раствора внутримышечно, эуфиллин 10 мл 2,4 % раствора внутримышечно, клофелин 1 мл 0,01 % раствора внутримышечно, лабетолол до 300 мг/сут; гидралазин по 10-25 мг 3 раза в сутки; прозазин по 1 мг 1-2 раза в сутки, непрессол 25 мл внутримышечно или внутривенно, иерапамил 2 мл 0,25 % раствора, пентамин 0,5-1 мл 5 % раствора или бензогексоний 1 мл 5 % раствора внутривенно или внутримышечно Инфузионная терапия, включающая онкоосмоактивные препараты (свежезамороженная плазма 250- 300 мл, реополиглюкин 400 мл, реоглюман 400 мл, альбумин 100-200 мл, лактосол, раствор Рингера – Локка 400 мл, изотоничес-кий раствор натрия хлорида и другие кристаллоиды)
В патогенетической терапии гестозов одно из первых мест занимает инфузионная терапия (ИТ). Цель ее – восполнение нормальной тканевой перфузии и органного кровотока, устранение гиповолемии, гемоконцентрации, гипопротеинемии, коррекция электролитных и метаболических нарушений. Показаниями к ИТ являются нефропатия легкий степени, наличие рецидивов заболевания, нефропатия средней и тяжелой степени, преэклампсия и эклампсия, ВЗРП независимо от степени тяжести заболевания. Инфузионную терапию проводят под контролем уровня гематокрита (не должен снижаться ниже 27 – 28 % и повышаться до 35 %), диуреза (не менее 50 – 35 мл/ч), центрального венозного давления (в пределах 5-60 см водст-Ь осмолярности крови (273+1,7 мосмоль/кг Н20), показателей гемостаза (антитромбин in не менее 70 %, эндогенный гепарин не ниже 0,07 ед. в 1 мл), АД, содержания белка в крови (не менее 60 г/л). В начале терапии скорость введения растворов должна превышать скорость мочеотделения; в конце – после восстановления ОЦК, скорость выделения мочи должна превышать скорость инфузии. При форсированном диурезе возможно развитие гипонатриемии, на фоне которой появляются ступор, лихорадка, хаотичные движения конечностей. Может развиться и гипокалиемия, вызывающая тяжелые аритмии. Объем ИТ определяется значениями указанных выше параметров. При отсутствии мониторинга за состоянием пациентки (гемодинамика, ЦВД, осмолярность) объем инфузий определяется степенью тяжести заболевания: при легкой и средней степени заболевания объем инфузий составляет 400-800 мл, при тяжелой – 1200-1400 мл, при эклампсии – до 2200 мл. Скорость введения составляет 20-40 кап/мин. Состав ИТ представлен в табл.14.2.
При проведении ИТ диуретики (20-40 мг лазикса) показаны при восстановлении ОЦК (ЦВД до 5-6 см вод.ст.) и низком диурезе (менее 30 мл/ч), содержании общего белка не менее 60 г/л, явлениях гипергидратации. При сохраняющейся стойкой олигурии и анурии, развитии почечной недостаточности необходимо своевременно ставить вопрос об экстракорпоральном гемодиализе.
Для нормализации реологических и гемостатических показателей крови в комплексное лечение вводят дезагреганты и гепарин. При легкой нефропатии возможно применение таблетированных дезагрегантов (трентал, агапурин, курантил), при средней и тяжелой – их периодические инфузии с перерывом 1-3 сут на фоне применения таблетированных препаратов. Длительность применения дезагрегантов должна быть не менее 3-4 нед.
Гепарин показан при нефропатии средней и тяжелой степени, наличии ВЗРП, при сроке беременности не превышающем 36-37 нед. Гепарин вводится под контролем времени свертывания крови, числа тромбоцитов. Об эффективности действия гепарина свидетельствует увеличение времени свертывания крови в 1,5 раза по сравнению с исходным. Суточная доза гепарина составляет 15 000-20 000 тыс. ЕД. При сочетанных гестозах введение гепарина одновременно с дезагрегантами должно быть длительным – 3-4 нед. Гепарин отменяют постепенно в течение 3-4 дней, снижая дозу препарата. При передозировке гепарина действие его можно быстро нейтра-лизовать внутривенным введением (струйно) 2-5 мл 1 % раствора протамина сульфата. Противопоказания к введению гепарина аналогичны противопоказаниям при любой патологии. При нефропатии легкой и средней степени применяются ингаляции гепарина.
Важное место в лечении гестоза принадлежит антиоксидантам и мембраностабил и заторам, включающим полиненасыщенные жирные кислоты. Оптимальным является одновременное их использование в комплексной терапии. При нефропатии легкой и среднетяжелой степени, если состояние плода нормальное, применяется один из антиоксидантов: витамин Е до «00 мг в сутки в течение 3-4 нед, глутаминовая кислота 1,5 г/сут, аскорбиновая кислота 0,3 мг/сут с эссенциале-форте или липостабилом. При легкой форме нефропатии показано применение таблетированных форм ссенциале-форте или липостабила (по 2 капсулы 3-4 раза в день), при Реднетяжелой – внутривенные инфузии по 5-10 мл. При необходимости относительно быстро повысить содержание незаменимых жирных кислот в мембранах (у пациенток с нефропатией среднетяжелой степени, наличии ВЗРП при сроках гестации 30-32 нед) целесообразно использовать одновременно с антиоксидантами липофундин по 100 мл 2-3 раза в неделю внутривенно. У пациенток со среднетяжелой степенью нефропатии при сочетании ВЗРП, ожирения, гипертонической болезни, заболевания почек в качестве антиоксиданта показано использование солкосерила по 2 мл внутримышечно в течение 3-4 нед.
Лечение, проводимое при гестозах, одновременно должно быть направлено на профилактику плацентарной недостаточности, при выявлении которой следует проводить дополнительную терапию в связи с нарушением маточно-плацентарного кровотока. Возможно введение р-адреномиметиков, комплекса витаминов.
Длительность лечения при наличии эффекта определяется степенью тяжести нефропатии, состоянием плода. При нефропатии легкой степени продолжительность лечения в стационаре должна составлять не менее 2 нед, при средней – 2-4 нед в зависимости от состояния плода. Пациентка может быть выписана из стационара с рекомендациями продолжить противорецидивную терапию, включающую фитосборы, спазмолитики, дезагреганты, антиоксиданты, мембраностабилизаторы, лечение экстрагенитальной патологии по показаниям до родоразрешения. При тяжелой нефропатии и наличии эффекта от лечения оптимальным является наблюдение и лечение в условиях стационара до родоразрешения. При ВЗРП тактика ведения опре-деляется рядом факторов. Если рост плода соответствует гестационному сроку, отсутствует хроническая гипоксия, отмечается эффект от терапии, беременность пролонгируется до 36-38 нед. При отсутствии роста плода или наличии хронической гипоксии плода, не купирующейся на фоне лечения, необходимо досрочное родоразрешение. Методом выбора в данной ситуации является кесарево сечение, особенно если срок гестации не превышает 35-36 нед.
Лечение тяжелой нефропатии, преэклампсии и эклампсии следует проводить совместно с реаниматологами в отделении интенсивной терапии при мониторном наблюдении за состоянием жизненно важных органов (гематокрит, центральное венозное и артериальное давление, диурез, осмолярность). При тяжелой нефропатии, преэклампсии, при наличии судорожной готовности, перед началом обследования и лечения необходим наркоз закисно-кислородный (1:1) или в сочетании с фторотаном или внутривенное введение седуксена (2,4 мл 0,5% раствора), дроперидола (1 – 2 мл 0,25% раствора), промедола (1 мл 2 % раствора). Одновременно с этим после акушерского исследования и определения дальнейшей тактики ведения показано введение магния сульфата. Методом выбора является внутривенное введение этого препарата, возможны и внутримышечные инъекции. Магния сульфат является эффективным противосудорожным и умеренно генерализованным вазодилататором за счет депрессивного влияния на ЦНС, угнетения возбудимости и сокращения гладких мышц, снижения внутриклеточного кальция, выделения нервными окончаниями ацетилхолина, угнетения выделения катехоламинов. Обладая слабым гипотензивным эффектом, магния сульфат устраняет церебральный и ренальный вазоспазм, улучшает маточный кровоток. Терапевтический уровень препарата в плазме крови матери колеблется от 4 до 8 мэкв/л, а токсический эффект наблюдается при его концентрации 10 мэкв/л. Для создания терапевтической концентрации магния сульфата в крови в начале лечения он вводится одномоментно от 2 до 4 г внутривенно, в последующем переходят на длительные (до 1-2 сут) введения его в виде инфузии со скоростью от 1 до 3 г/ч (суточная доза до Ю г сухого вещества). Токсическое влияние магния сульфата может быть результатом либо абсолютной передозировки, либо продолжительной инфу-зии при наличии сниженной функции почек. Передозировка может сопровождаться слабостью, респираторной и сердечной недостаточностью, снижением выделительной функции почек. Первым признаком передозировки является ослабление глубоких сухожильных рефлексов. Антидотом магния сульфата служат соли кальция, которые следует вводить при выявлении симптомов передозировки. Если на фоне введения нейролептиков, анальгетиков, антигистаминных препаратов, магния сульфата не устраняется судорожная готовность и продолжает иметь место выраженная гипертензия (160/110 мм рт.ст. и выше), то это является показанием для введения барбитуратов, интубации и искусственной вентиляции легких. При тяжелых формах гестоза, включающих преэклампсию и эклампсию, проводится комплексная гипотензивная терапия. Оптимальным условием проведения гипотензивной терапии при тяжелых формах гестоза является ЦВД не менее 5-8 см вод. ст. При низких цифрах ЦВД (3 см вод. ст.) гипотензивной терапии должна предшествовать инфузионно-трансфузионная. Лечение беременных при эклампсии следует проводить с учетом быстрой подготовки к родоразрешению. В момент приступа эклампсии пациентку удерживают в горизонтальном положении, поворачивая голову набок. При необходимости с помощью шпателя и роторасширителя открывают рот; применяя языкодержатель, вытягивают язык вперед, аспирируя (по показаниям) содержимое верхних дыхательных путей и полости рта. Во время беременности после приступа эклампсии пациентку переводят на искусственную вентиляцию легких и после проведения подготовительных реанимационных мероприятий оперативно родоразрешают с последующим проведением всего комплекса терапии: гипотензивная, инфузионная, мероприятия, направленные на восстановление функций жизненно важных органов, дискретный плазмаферез или ультрафильтрация плазмы.
Показаниями к плазмаферезу являются: 1. нефропатия тяжелой степени при сроках гестации до 34 нед и в отсутствие эффекта от инфузионно-трансфузионной терапии для пролонгирования беременности; 2. осложненные формы гестоза для купирования гемолиза, ДВС-синдрома, ликвидации гипербилирубинемии.
Показания к ультрафильтрации: 1. постэклампсическая кома 2. отек мозга 3. некупирующийся отек легких 4. анасарка.
При развитии HELLP-синдрома на фоне лечения гестоза необходимы плазмаферез с заменным переливанием свежезамороженной плазмы, коррекция гемостаза, применение иммунодепрессантов, гепатопротекторов.
Показанием к досрочному родоразрешению является нефропатия средней степени при отсутствии эффекта от лечения в течение 7-10 дней; тяжелые Формы гестоза при безуспешности проведения интенсивной терапии в течение 2-3 ч; нефропатия независимо от степени тяжести при наличии ЛРП и отсутствии роста плода на фоне лечения; эклампсия и ее осложнения (коматозные состояния, анурия, HELLP-синдром, кровоизлияние в озг, отслойка и кровоизлияние в сетчатку, амавроз и др.).
Способы родоразрешения, ведение родов
Показанием к кесареву сечению являются тяжелые формы гестоза, включая ггреэкламгтсию при отсутствии эффекта от терапии, эклампсия и ее осложнения. Кесарево сечение следует предпринимать также при наличии ВЗРП хронической гипоксии плода и при родоразрешении пациенток, если срок беременности не превышает 34-35 нед. В условиях эндотрахеального наркоза, обеспечивающего надежную нейровегетативную защиту больной с искусственной вентиляцией легких, оперативное родоразрешение путем кесарева сечения является наиболее бережным.
Через естественные родовые пути родоразрешение проводится при наличии соответствующих условий (удовлетворительное состояние пациентки, наличие эффекта от лечения, отсутствие внутриутробного страдания плода по данным ультразвукового и кардиомониторного исследования).
При неподготовленных родовых путях и необходимости родоразрешения, для улучшения функционального состояния матки и подготовки шейки матки к родам предварительно в течение 3-5 дней применяют эстрогенные препараты и аскорбиновую кислоту. Наиболее оптимальным для подготовки шейки матки к родам является введение в цервикальный канал или в задний свод влагалища простагландиновых гелей. При подготовленной шейке матки производится родовозбуждение со вскрытием плодного пузыря и с последующим введением утеротонических средств.
Во время родов осуществляется гипотензивная, инфузионная терапия, адекватное обезболивание. Методом выбора для обезболивания при гестозах является эпидуральная анестезия. Вопрос о родовозбуждении или активации родовой деятельности при ее слабости рассматривается в зависимости от состояния беременной и плода. При удовлетворительном состоянии беременной и плода возможно введение утеротонических препаратов. При ухудшении состояния (гипертензия, появление мозговых и диспепсических симптомов, гипоксии плода) показано оперативное родоразрешение.
При родоразрешении через естественные родовые пути во втором периоде родов при выраженной гипертензии или судорожной готовности показаны перинеоили эпизиотомия, управляемая нормотония ганглиоблокаторами или применение акушерских щипцов, при наличии мертвого плода – перфорация головки.
В третьем периоде родов у беременных с нефропатией существует угроза кровотечения. Для профилактики его необходимо продолжение инфузионной терапии, включая препараты свежезамороженной плазмы, введение утеротонических средств.
Комплексная терапия гестозов должна проводиться и в послеродовом периоде до стабилизации состояния родильницы.
Профилактика тяжелых форм гестозов
Профилактические мероприятия целесообразно проводить на доклиническом этапе у пациенток группы риска развития гестозов, в которую входят беременные с экстрагенитальной патологией (нарушение жирового обмена, гипертоническая болезнь, патология почек, эндокринопатии, частые инфекции верхних дыхательных путей, сочетанная экстрагенитальная патология)» наличием гестоза в предыдущие беременности, профессиональных вредностей и социальных факторов риска.
Профилактические мероприятия по предупреждению гестозов в группе риска должны начинаться в I триместре с 8-9 нед. При этом применяются режим с соблюдением "bed rest", диета, комплекс витаминов, лечение экстрагенитальной патологии по показаниям. Рекомендуется соответствующая диета, энергетическая ценность которой не превышает 3000 ккал, с включением продуктов молочно-растительного и животного происхождения. Пищевые продукты применяются отварными, умеренно недосоленными, с исключением острых, жареных блюд, вызывающих чувство жажды. Количество жидкости составляет 1200-1300 мл/сут. Все беременные должны получать витамины в виде травяных витаминных сборов или в таблетированном виде.
С 13-14 нед в профилактический комплекс необходимо дополнительно вводить травы, обладающие седативными свойствами (валериана, пустырник), нормализующие сосудистый тонус (боярышник) и функцию почек (почечный чай, березовые почки, толокнянка, лист брусники, спорыш, кукурузные рыльца). В указанный комплекс дополнительно по показаниям включают спазмолитики (эуфиллин, папаверин). Для исключения дефицита калия, кальция, магния используют лекарственные средства (аспаркам, панангин) или пищевые продукты (изюм, курага).
С 15-16 нед беременным группы риска развития гестоза в профилактический комплекс следует дополнительно включать дезагреганты (трентал, агапурин, курантил, аспирин), антиоксиданты (витамин Е, глутаминовая кислота), мембраностабилизаторы (эссенциале-форте, липостабил, рутин). Продолжительность применения лекарственных препаратов составляет 3-4 нед. После применения лезагрегантов, мембраностабилизаторов в течение 3-4 нед при удоатетворительном состоянии беременных и нормальных темпах роста плода возможен перерыв в приеме препаратов на 1-2 нед. В указанный период для стабилизации состояния возможно использование фитосборов с повторным назначением дезагрегантов и мембраностабилизаторов. Если, несмотря на проведение профилактических мероприятий, у беременной появляются ранние симптомы гестоза, она должна быть госпитализирована в стационар. Профилактический комплекс, включающий фитосборы, дезагреганты и мембраностабилизаторы, должен обязательно назначаться после выписки из стационара в период ремиссии гестозов.
Глава 15. Изосерологическая несовместимость крови матери и плода
Основой изосерологической несовместимости крови матери и плода является неоднородность у них антигенных факторов эритроцитов крови, чаще по системе резус, реже по системе АВО. Вследствие проникновения факторов крови плода, облагающих антигенными свойствами, в кровоток матери, у которой они отсутствуют, в ее организме вырабатываются аллоиммунные антитела, которые через плаценту проникают к плоду, и в его организме возникает реакция антиген-антитело. Подобная реакция приводит к агглютинации и гемолизу эритроцитов плода, анемии, образованию непрямого билирубина – к гемолитической болезни плода иноворожденного (ГБП и ГБН).При изосерологической несовместимости крови матери и плода заболевание может проявляться как во время беременности (ГБП), так и после рождения ребенка (ГБН).
Гемолитическая болезнь (синоним: эритробластоз) нередко является причиной смерти плода и новорожденного, повышенной заболеваемости в постнатальном периоде и последующие годы жизни.
Значительное снижение перинатальной смертности и заболеваемости детей было достигнуто благодаря применению заменного переливания крови новорожденным с ГБН, а также введением матери антирезус-иммуноглобулина (Rh IgG) после прерывания беременности любым путем (аборт, внематочная беременность, роды). Введенный Rh IgG связывает Rh-антигены, которые могут поступать в кровоток матери при прерывании беременности, и тем самым предотвращает выработку материнских антител и Rh-иммунизацию.
Издавна акушеры знали о заболеваниях (семейная желтуха, эритробластоз) новорожденных, сопровождающихся желтухой, нередко со смертельным исходом. Однако причина и патогенез гемолитической болезни стали известны только с 1940 г., когда американские ученые ^Landsteiner и A.Wiener обнаружили белковый фактор в эритроцитах, который обладал антигенными свойствами. Этими учеными в эксперименте было показано, что эритроциты обезьян (макака-резус) при введении кроликам вызывали у последних выработку антител. Реакция антиген-антитело (сыворотка иммунизированного кролика и эритроциты человека), выражающаяся в агглютинации, была обнаружена у 15 % людей. У остального населения подобный антиген, названный D-фактором, резус-фактором (Rh), содержится в эритроцитах, а также может быть в лейкоцитах, тромбоцитах и других клетках тканей. В последующем было доказано, что, помимо резус-фактора, в эритроцитах могут быть обнаружены и другие антигены, качественно отличающиеся ДРУ? от друга, – С (Rh') и Е (Rh"). Антиген С (Rh') содержится в крови 70 уо людей, антиген Е (Rh") – 30 %. По существу кровь может считаться резусотрицательной только в тех случаях, когда в ней отсутствуют все 3 разновидности резус-фактора. Резус-отрицательная кровь не лишена антигенных свойств,: в ней обнаруживают связанные с эритроцитами аллели антигенов С, D, Е' с, d, е (система Нг), из них только антиген с может иметь значение в развитии иммуноконфликта в системе мать-плод.
Сложность системы резус обусловливается большим количеством мутаций каждого гена.
Наследование резус-антигенов определяется серией аллельных генов, расположенных на одной хромосоме, причем гены D и d, Си с, Е и е находятся во взаимоисключающих отношениях. Присутствие D-антигена на эритроцитах обусловлено геном D, который имеет аллель d. Таким образом, возможны 3 генотипа: DD – гомозиготный, Dd – гетерозиготный и dd – гомозиготный. Все 3 гена одной хромосомы наследуются одновременно.
Гемолитическая болезнь плода и новорожденного может развиться также при несовместимости крови матери и плода по система АВО. Антигены А и В плода могут проникать во время беременности в кровоток матери, приводя к выработке иммунных аи р-антител соответственно и развитию у плода реакции антиген-антитело (Аа, Bp). При этом иммунологическая несовместимость проявляется в том случае, если у матери 0(1) группа крови, а у плода – А(П) или В(III).
Групповая несовместимость крови матери и плода встречается чаще (1 случай на 200-256 родов), но ГБП и ГБН протекают легче. Это объясняется защитной функцией околоплодных оболочек и околоплодных вод. Значительно реже ГБП и ГБН возникают при несовместимости крови материки плода подругам эритроцитарным антигенам: Келл (К, к), Даффи (Fy -Fy ), Кидц (Ika), MNSs, РР, Лютеран (Lua- Lu ), Льюис и др.
Гемолитическая болезнь плода.
Этиология и патогенез.
ГБП и ГБН развиваются в том случае, если кровь матери резус-отрицательная, а кровь плода резус-положительная. Однако заболевание возможно также при резус-положительной крови матери и резус-отрицательной крови плода, при сенсибилизации к антигену.
Как правило, ГБП и ГБН возникают после предшествующей резус-иммунизации, которая может наступить после попадания даже небольшого количества эритроцитов, содержащих Rh, в кровоток матери: переливание крови без учета резус-принадлежности, внутримышечное введение крови, а также попадание резус-положительных эритроцитов в кровоток матери во время предыдущей или настоящей беременности, сопровождающейся нарушением целости ворсин хориона или плаценты.
Резус-фактор формируется в ранние сроки беременности (по некоторым Данным, начиная с 3-8-го дня беременности), эритроциты плода в крови беременных могут появляться при сроке 6-8 нед. Продолжительность циркуляции эритроцитов плода в кровотоке матери точно не установлена, однако известно, что аборты в ранние сроки гестации и внематочная беременность способствуют иммунизации – выработке антител в материнском организме. Роды особенно часто являются причиной попадания антигенов в кровоток матери с ее последующей сенсибилизацией. Опасность сенсибилизации увеличивается при оперативных родах, особенно во время кесарева сечения и ручного отделения плаценты. В меньшей степени вероятно попадание эритроцитов плода в кровоток матери в процессе беременности, но это не исключено при наличии факторов, способствующих нарушению Целости ворсин хориона и плаценты: амниоцентез, угроза прерывания беременности, предлежание плаценты, отслойка плаценты, наружный поворот плода, внутриутробная смерть плода. Даже небольшое количество антигена попадающее в кровоток матери, может оказать выраженное сенсибилизирующее воздействие, вызвать выработку антител. Иммунизация может про-изойти и в процессе первой беременности, так как эритроциты плода могут попасть в кровоток матери, начиная с I триместра (6,7 % ) . Во II триместре гестации эритроциты плода обнаруживают у 15,9 %, в III – у 28,9 % беременных. Для иммунизации достаточно введения женщине с резус-отрицательной кровью 0,1 мл резус-положительной крови (этот факт доказан G.K.Cohen и соавт. в 1964 г. в экспериментах на добровольцах). Раз воз-никнув, антитела не исчезают, и чувствительность к повторному попаданию в организм резус-положительных эритроцитов велика.
После первой беременности иммунизируются 10 % женщин, но и при последующих беременностях возможна иммунизация такого же числа женщин, если она не произошла после первой беременности.
Тяжесть течения ГБП во многом зависит от вида антител, продуцируемых иммунной системой матери. Основную роль в развитии ГБП играют неполные антитела, относящиеся к IgG, которые легко проникают через плацентарный барьер. Полные антитела, относящиеся к IgM, имеют большую молекулярную массу и практически не проникают через плацентарный барьер.
Антирезус-антитела матери, попадая в кровоток плода, вызывают агглютинацию его эритроцитов или сначала их блокаду, а затем агглютинацию. В последующем независимо от варианта воздействия комплексы эритроцитов разрушаются, выделяется большое количество непрямого билирубина, возникают анемия и гипербилирубинемия. Если эритроциты не разрушаются в кровяном русле, то они накапливаются в селезенке и там подвергаются гемолизу под воздействием фагоцитов.
Обычно в том случае, если в организме появляется непрямой билирубин, он быстро переводится в прямой путем присоединения двух молекул глюкуроновой кислоты, вырабатываемой в печени. Прямой билирубин выводится почками. Непрямой билирубин плода может в определенном количестве выводиться трансплацентарно, а затем переходить в прямой в организме матери. Однако часть непрямого билирубина циркулирует в организме плода, чему способствует функциональная незрелость его печени. Кроме того, увеличение очагов эритропоэза в печени, расширение желчных про-токов желчью, подвергшейся сгущению, приводят к изменению паренхимы печени и нарушению ее архитектоники. Последствиями этого являются уменьшение продукции протеинов в печени, гипопротеинемия, портальная гипертензия, асцит и генерализованные отеки. У плода при гемолитической болезни наряду с гипербилирубинемией возникают анемия и, следовательно, тканевая гипоксия с ацидозом. Непрямой билирубин является жирорастворимым, поэтому легко проникает в ткани, богатые липидами, подавляя ферментативные процессы. В связи с этим при гипербилирубинемии часто поражается мозговая ткань, особенно ядра головного мозга.
В зависимости от степени иммунизации ГБП может развиться в различные сроки беременности, иногда очень рано, начиная с 22-23 нед. При любом сроке беременности могут отмечаться наиболее тяжелые проявления заболевания – общая водянка, отечная форма ГБП. Чаще же заболевание возникает в первые часы и дни после рождения. В зависимости от степени тяжести заболевание может проявляться в анемической, желтушной форме и форме универсального отека. При всех формах выражена анемия.
При ГБП вследствие анемии, гипербилирубинемии, тканевой гипоксии, ацидоза нередко наблюдаются нарушения сердечной деятельности и состояния ЦНС. При ГБП беременность на всем протяжении может осложняться угрозой ее прерывания (поздний выкидыш, преждевременные роды).
Диагностика основывается на выявлении ряда признаков, связанных с иммунизацией матери, развитием гипербилирубинемии, анемии и гипоксии плода.
При определении тактики врача во время беременности, выборе способа и сроков родоразрешения, помимо выявления ГБП, очень важна оценка степени тяжести заболевания.
Важным признаком является обнаружение антител в крови матери. Этот диагностический тест не является абсолютным, так как антитела не исчезают после их выработки в организме матери, даже если в последующем не развивается заболевание плода или если у плода резус-отрицательная кровь. Однако в комплексе с другими признаками наличие антител позво.чяет с некоторой долей вероятности предположить ГБП.
Определенное значение имеет динамика титра антител. Титр антител отражает наибольшее разведение сыворотки крови (1:2, 1:4, 1:8, 1:16 и т.д.), при котором еще происходит гемолиз добавляемых к ней резус-положительных эритроцитов. Во время беременности титр антител может повышаться, несколько снижаться и колебаться. Нарастание титра антител не всегда определяется повышением степени иммунизации, иногда это объясняется попаданием их в кровяное русло из других клеток, а снижение – наоборот, связыванием их клетками. Тем не менее повышение титра антител, особенно значительное (на 3-4 порядка), учитывают как косвенный признак ухудшения течения ГБП.
Гипербилирубинемия и анемия являются одними из основных признаков ГБП, поэтому чрезвычайно важно определение степени их выраженности, о чем с известной долей вероятности можно судить по оптической плотности билирубина (ОПБ) в околоплодных водах. ОПБ повышается по мере увеличения концентрации билирубина, экскретируемого почками плода. Околоплодные воды получают путем пункции передней стенки живота, матки, околоплодных оболочек (см. Амниоцентез).
В околоплодных водах определяют ОПБ, титр антител, в случае необходимости – группу крови плода. При последнем амниоцентезе перед родоразрешением околоплодные воды исследуются на степень зрелости легких плода (пенный тест по методу Клеманса или определение соотношения содержания лецитина и сфингомиелина).
ОПБ устанавливают с помощью спектрофотометрии при длине волны 450 нм по отношению к дистиллированной воде. При этом нормальная величина билирубинового пика, как правило, не превышает 0,1. При ОПБ от 0,1 до 0,15 можно предположить наличие ГБП легкой степени. В том случае, если ОПБ составляет от 0,15 до 0,2, можно ожидать рождение Ребенка со средней и тяжелой формой гемолитической болезни. ОПБ от 0,2 и выше, как правило, свидетельствует о развитии у плода тяжелой формы либо его внутриутробной гибели. При оценке ОПБ могут быть получены ложноположительные результаты вследствие попадания в иглу крови Матери (при производстве амниоцентеза), мекония, мочи или асцитической идкости плода. ОПБ может быть снижена при разведении билирубина большим количеством околоплодных вод при многоводии что нередко наблюдается при ГБН.
Более точно оценить тяжесть гемолитического процесса можно при исследовании ОПБ амниотической жидкости при различных длинах волн света – от 300 до 700 нм. В таких случаях вычисляют АЕ, наносят на график, разделенный на 3 зоны в зависимости от степени тяжести гипербилирубинемии и срока гестации. От того, в какую зону попадает установленное значение ОПБ, зависит дальнейшая тактика врача (рис. 15.1).
Важную роль в диагностике ГБП имеет УЗИ, которое целесообразно проводить в следующие сроки беременности: 20-22, 24- 26, 30 – 32, 34-36 нед и непосредственно перед родоразрешением. УЗИ позволяет выявить изменения как плаценты, так и плода. В зависимости от степени тяжести заболевания наблюдается увеличение толщины плаценты (в норме она зависит от срока гестации, составляя в III триместре в среднем 34-36 мм). Превышение нормальной для срока гестации толщины плаценты на 0,5-1,0 см и более указывает на возможное заболевание плода, в связи с чем требуется провести повторное УЗИ. При отечной форме ГБП толщина плаценты может достигать 60-80 мм.
При гемолитической болезни УЗИ позволяет выявить у плода увеличение размеров печени и селезенки. Признаками отечной формы гемолитической болезни являются выраженная гепатоспленомегалия, асцит, многоводие (рис. 15.2). При выраженной водянке плода отмечаются, кроме того, кардиомегалия и перикардиальный выпот, гидроторакс, повышенная эхогенность кишечника вследствие отека его стенки, отек подкожной жировой клетчатки в области головы и конечностей плода. Дополнительными ультразвуковыми критериями оценки степени тяжести заболевания плода могут служить расширение вены пуповины (до 10 мм и более), повышенная скорость кровотока в нисходящей части аорты плода (скорость обратно пропорциональна содержанию гемоглобина у плода).
 Рис. 15.2. Эхограмма. Отечная форма гемолитической болезни плода, а – брюшная стенка плода; б – печень; в – асцитическая жидкость.
Рис. 15.2. Эхограмма. Отечная форма гемолитической болезни плода, а – брюшная стенка плода; б – печень; в – асцитическая жидкость.
В связи с тем что плод при ГБП переносит гипоксию, степень выраженности которой увеличивается по мере нарастания тяжести заболевания, важно получить информацию о его функциональном состоянии. С этой целью проводят определение биофизического профиля по видоизмененной шкале Vintzileos (1983). В отличие от маловодия, которое является неблагоприятным фактором у беременных без изосерологической несовместимости, при наличии таковой учитывают степень многоводия, а вместо степени зрелости плаценты – ее толщину. Остальные критерии шкалы (сердечная Деятельность, дыхательные движения, двигательная активность, тонус) оцениваются по стандартной схеме (см. Дополнительные методы исследования. Определить наличие и степень тяжести ГБП возможно, проводя анализ крови плода, полученной из сосудов пуповины путем ее пункции (кордоЦентез; см. Дополнительные методы исследования).
Кордоцентез позволяет произвести непосредственное исследование пуПовинной крови с определением группы крови и резус-принадлежности плода, уровня гемоглобина, билирубина, сывороточного белка и гематокри, прямой пробы Кумбса. Наиболее важным критерием ГБП считают гематокрит (Ht), который, с одной стороны, свидетельствует о степени гемолиза, а с другой, является показателем компенсаторных возможностей гемопоэза. Снижение Hi на 10-15 % указывает на тяжелую форму ГБП (в норме Ht до 26 нед составляет 35 %, позднее – от 38 до 44 %).
Ведение беременности и родов. У всех беременных при первом посещении врача определяют (или проверяют) группу и резус-принадлежность крови.
У беременных с группой крови 0(1) в том случае, если у мужа иная группа, необходимо исследовать кровь на наличие групповых иммунных антител. У пациенток с резус-отрицательной кровью следует, начиная с ранних сроков, проводить анализ крови на наличие антител и определения их титра: до 20 нед беременности 1 раз в месяц, в последующем 1 раз в 2 "нед. Для установления предполагаемой резус-принадлежности плода выявляют наличие резус-фактора у отца. Необходимо также проведение непрямой реакции Кумбса, которая позволяет определить, какие антитела циркулируют в крови, связанные или свободные.
В отсутствие антител до 28 нед беременности многие исследователи рекомендуют беременным с резус-отрицательной кровью с профилактической целью внутримышечно вводить 300 мг Rh lg, который может блокировать резус-антитела. Важно, чтобы препарат, содержащий антитела, не проходил через плаценту.
Определение состояния плода на основании результатов оценки биофизического профиля и УЗИ проводят еженедельно, начиная с 31 – 32 нед. У беременных группы высокого риска развития ГБП (наличие в анамнезе у беременных с резус-отрицательной кровью поздних выкидышей, преждевременных родов, мертворождений, ГБН, переливания крови без учета Rh-принадлежности). УЗИ нужно проводить ежедневно или с интервалом 1-2 дня.
С целью снижения сенсибилизации матери эритроцитами плода всем беременным с резус-отрицательной кровью даже в отсутствие у них резусантител, а также при наличии АВО-сенсибилизации рекомендуется провести 3 курса неспецифической десенсибилизирующей терапии по 10-12 дней при сроке 10-12, 22-24, 32-34 нед. Женщины, у которых наблюдается осложненное течение беременности (угроза прерывания, токсикозы, гестозы), должны быть госпитализированы в отделение патологии беременных, где наряду с лечением основного заболевания проводят курс десенсибилизирующей терапии. Неспецифическая десенсибилизирующая терапия вклю-чает внутривенное введение 20 мл 40 % раствора глюкозы с 2 мл 5 % раствора аскорбиновой кислоты, 2 мл 1 % раствора сигетина и 100 мг кокарбоксилазы. Внутрь назначают рутин по 0,02 г 3 раза, теоникол по 0,15 г 3 раза или метионин по 0,25 г и кальция глюконат по 0,5 г 3 раза, препараты железа (ферроплекс по 1 – 2 драже 3 раза и др.), токоферола ацетат (витамин Е) по 1 капсуле. На ночь рекомендуется применять антигистаминные препараты (0,05 г димедрола, 0,025 г супрастина).
Беременным, в анамнезе которых имеются самопроизвольные выкидыши и роды плодом с отечной или тяжелой желтушной формой гемолитической болезни, при высоком титре резус-антител в специализированном учреждении можно проводить плазмаферез, заключающийся в изъятии У беременных определенного объема (250-300 мл) плазмы, содержащей антитела, с помощью различных аппаратов (РК-0,5 "АМИНКО" и др.). Замещение изъятой плазмы производят коллоидными, кристаллоидными и белковыми препаратами и одновременно возвращают в кровоток форменные элементы крови беременной. Плазмаферез выполняют 1 раз в неделю под контролем титра антител, начиная с 23-24 нед беременности до родоразрешения; плазмаферез можно проводить и до беременности в качестве подготовки к ней.
С целью уменьшения степени резус-сенсибилизации осуществляют гемосорбцию с использованием активированного угля для сорбции свободных антител. Применение гемосорбции оправдано у беременных с крайне отягощенным акушерским анамнезом (повторные выкидыши, рождение мертвого ребенка). Наиболее оптимальным сроком начала проведения гемосорбции считается 20-24 нед беременности. Гемосорбцию проводят в стационаре. За один сеанс гемосорбции через гемосорбент перфузируется 8-12 л крови (2 – 3 ОЦК). Интервал между сеансами – 2 нед. Курс сорбционной терапии необходимо заканчивать за 1 нед до предполагаемого срока родоразрешения.
В настоящее время широко проводят лечение ГБП путем внутриматочных гемотрансфузий под контролем ультразвука. Гемотрансфузии плоду можно проводить начиная с 18 нед беременности. Внутриутробное переливание крови создает предпосылки для пролонгирования беременности. Существуют внутрибрюшной и внутрисосудистый способы гемотрансфузии. Техника внутрибрюшной трансфузии заключается в проколе брюшной стенки матери, стенки матки, брюшной стенки плода и введении в его брюшную полость одногруппной и резус-отрицательной эритроцитной массы, которая адсорбируется лимфатической системой и достигает сосудистой системы плода.
В последние годы предпочтение отдают внутрисосудистой гемотрансфузии плоду, показаниями к которой при резус-сенсибилизации являются выраженная анемия и гематокрит менее 30 %.
С целью проведения внутрисосудистой гемотрансфузии выполняют кордоцентез, при этом вену пуповины пунктируют в непосредственной близости от ее вхождения в плаценту. Проводник извлекают из иглы и производят забор крови для определения предтрансфузионного гематокрита плода. Эритроцитную массу медленно вводят через иглу, после чего забирают вторую пробу крови для определения конечного плодового гематокрита и оценки адекватности проведенной терапии. Для остановки движений плода, вследствие которых игла может быть вытолкнута им из вены пуповины, плоду вводят ардуан (пипекуроний) внутривенно или внутримышечно. Определение необходимости и времени проведения последующих гемотрансфузий плоду основывается на результатах УЗИ, посттрансфузионных показателях гемоглобина и гематокрита у плода. Проведение амниоцентеза после внутриутробной трансфузии не имеет смысла, так как амниотическая жидкость после этой процедуры обычно окрашена кровью, что может привести к ложноположительным результатам определения оптической плотности. Эффективность лечения тяжелых форм ГБП с помощью внутрисосудистого переливания крови составляет 85-91 %, при внутрибрюшной – 66 %.
Беременных, у которых отмечается резус-сенсибилизация, следует направлять в родильный дом при сроке беременности 34 – 36 нед, при АВ0енсибилизации – 36-37 нед для дополнительного обследования и решения вопроса о родоразрешении. При наличии ГБП необходимо досрочное родоР зрешение, так как к концу беременности увеличиваетсяпоступление Резус-антител к плоду. Оптимальные срок родоразрешения – 37-38 нед беременности, так как при более раннем родоразрешении вследствие функ-циональной незрелости органов (особенно печени) гемолитическая болезнь протекает более тяжело, ребенок чаще страдает от респираторного дистресссиндрома. Однако, если объективные данные свидетельствуют о выраженном страдании плода, если женщина имеет отягощенный акушерский анамнез, родоразрешение возможно и в более ранние сроки беременности. При этом необходимо провести мероприятия, направленные на ускорение созревания легких недоношенного плода. Назначают дексаметазон по 2 мг 4 раза в сутки за 2-3 дня до предполагаемых родов.
При выраженной отечной форме ГБП беременность прерывают при любом сроке. Если к моменту родоразрешения при УЗИ определяют очень большие размеры живота плода, целесообразно выпустить асцитическую жидкость путем прокола передней брюшной стенки матери, матки и передней стенки живота плода.
Как правило, родоразрешение проводят через естественные родовые пути. Кесарево сечение выполняют при наличии дополнительных акушерских осложнений (предлежание плаценты, неправильное положение плода, рубец на матке, выпадение пуповины и т.п.).
Родовозбуждение нужно начинать с создания глюкозо-витамин но-гормонально-кальциевого фона в течение 2-3 дней (в зависимости от состояния шейки матки). При готовности шейки к родам производят амниотомию. В случае, если родовая деятельность не разовьется, через 5-6 ч после амниотомии начинают родовозбуждение окситоцином или простагландинами по общепринятой методике.
В родах проводят тщательный контроль за состоянием плода, осуществляют профилактику гипоксии. Сразу после рождения ребенка его быстро отделяют от матери во избежание массивного попадания резус-антител в кровоток новорожденного. Из пуповины берут кровь для определения содержания билирубина, гемоглобина, группы крови ребенка, его резус-принадлежности. Проводят непрямую пробу Кумбса, позволяющую обнаружить эритроциты новорожденного, связанные с антителами (реакция агглютина-ции крови ребенка со специфической сывороткой Кумбса). Учитывая склонность плода и новорожденного с гемолитической болезнью к кровоизлияниям, следует бережно вести второй период родов. Целесообразны эпидуральная анестезия и рассечение промежности. При АВ0-сенсибилизации ведение родов не имеет каких-либо особенностей.
В последующем при необходимости заменного переливания крови новорожденным с гемолитической болезнью используют пуповинные сосуды, поэтому скобку на пуповину не накладывают. Пуповину перевязывают на расстоянии 2-3 см от пупочного кольца.
Профилактика резус-сенсибилизации.
Профилактические мероприятия заключаются в следующем: любое переливание крови производить с учетом резус-принадлежности крови реципиента и донора; необходимо сохранить первую беременность у женщин с резус-отрицательной кровью; профилактика и лечение осложнений беременности; проведение десенсибилизирующей терапии; осуществление специфической профилактики резус-сенсибилизации у женщин с резус-отрицательной кровью путем введения антирезус-иммуноглобулина после любого прерывания беременности.
Иммуноглобулин-антирезус вводят по одной дозе внутримышечно однократно. Родильнице указанную дозу назначают в течение 48 ч после родов, а лучше – 24 ч, при аборте – по окончании операции. После кесарева сечения и ручного отделения плаценты дозу препарата необходимо удвоить.
Важно произвести примерный расчет количества доз иммуноглобулина для родовспомогательных учреждений. Принимая во внимание данные литературы, следует считать, что из 1000 рожающих у 170 будет резус-отрицательная кровь. Из них у 100 женщин ребенок будет резус-положительным. Следовательно, на 1000 родов необходимо 100 доз препарата, если вводить его всем женщинам с резус-отрицательной кровью, родивших детей с резусположительной кровью.
При неукоснительном выполнении методики специфической профилактики резус-сенсибилизации можно практически решить проблему резусконфликтной беременности.
Глава 16. Аномалии развития и заболевания плода, плодных оболочек, пуповины, плаценты
Эмбрио- и фетопатии
Аномалии развития и врожденные заболевания плода могут возникать в результате воздействия повреждающего фактора в различные периоды онтогенеза.Гаметопатии и бластооатин обусловлены изменениями генетического аппарата, а также могут возникать в процессе созревания половых клеток, во время оплодотворения или в начальных стадиях дробления оплодотворенной клетки (первые 15 сут) под воздействием повреждающих факторов (алкоголь, химические вещества, радиация, патология беременности, экстра генитальные и инфекционные заболевания матери и др.). Причиной наследственных заболеваний и нарушений внутриутробного развития обычно являются мутации в половых клетках родителей ребенка (спорадические мутации) или их предков (унаследованные мутации).
Конечный результат бластопатий – пустой зародышевой мешок и сросшиеся близнецы. Большая часть беременностей при гаметопатиях и бластопатиях прерывается через 3-4 нед после повреждения или гибели зародыша.
Эмбриопатии возникают в период с 16-го дня по 10-ю неделю после оплодотворения. В этот период образования зачатков всех важных органов (органогенез) происходит усиленный процесс дифференцировки клеток и тканей; зародыш обладает высокой чувствительностью к действию повреждающих факторов. Под их влиянием возникают пороки развития (истинные уродства), задержка развития или гибель зародыша. Беременность нередко завершается выкидышем, рождением ребенка с уродствами или мертворождением.
Фетопатии – заболевания и функциональные расстройства, возникающие у плода под влиянием экзогенных воздействий в период с 11-й недели беременности до рождения. В зависимости от патогенеза и этиологического фактора различают инфекционные и неинфекционные фетопатии.
Проявления ранних фетопатии обусловлены тем, что в этот период гестации происходит активное развитие органов плода и в основном завершается тканевая дифференцировка. Пороки развития (псевдотератогенный эффект) возникают в тех случаях, если образование той или иной системы либо органа не закончилось к концу I триместра беременности (микроцефалия, гидроцефалия и др.), или возникают под воздействием механических внутренних факторов (сдавление, перетяжка конечностей амниотическими тяжами). Наиболее характерны замедленное развитие (синдром задержки роста плода, гипоплазия органов), функциональные нарушения (углеводного обмена, ферментная недостаточность). С 20-24-й недели гестации плод приобретает способность отвечать воспалительной реакцией организма на возможные воздействия. В позднем феталъном периоде по мере созревания плода его реакция на действие вредных факторов близка к таковой в постнатальном периоде.
Инфекционные фетопатии возникают под влиянием любого инфекционного агента (от вирусов до простейших и грибов) и имеют тенденцию к генерализации процесса, приводя к специфическим изменениям в организме плода (врожденный сифилис, туберкулез, герпетические инфекции).
Неинфекционные фетопатии (гипотрофия и гипоксия) развиваются в результате плацентарной недостаточности и обменных нарушений у плода при патологии беременности и экстрагенитальных заболеваниях (особенно при их обострениях во время беременности). К неинфекционным фетопатиям относятся гемолитическая болезнь плода; врожденный генерализованный кальциноз артерий, фибробластоз миокарда, диабетическая, тиреотоксическая, алкогольная фетопатии.
Фетопатии любой этиологии имеют ряд общих клинико-морфологических особенностей: 1. изменение параметров длины и массы тела (увеличиваются или, чаще, уменьшаются); 2. отставание морфологического и функционального созревания органов (ЦНС, легких, почек, кроветворных органов, вилочковой железы, печени); 3. преобладание в процессах регенерации гипертрофии и гиперплазии элементов мезенхимы, что приводит к избыточному развитию соединительной ткани; 4. инфекционные и токсические фетопатии сопровождаются выраженными геморрагическим диатезом и гепатоспленомегалией.
Помимо общих черт, характерных для фетопатии, следует выделить некоторые специфические особенности поражения плода при часто встречающихся заболеваниях.
Диабетическая фетопатия (см. раздел 12.8).
Для тиреотоксической фетопатии, которая развивается при тяжелой форме диффузного токсического зоба, характерны крупные размеры плода (макросомия). У 60 % плодов наблюдаются органические и функциональные нарушения: пороки развития (у 19 %), стойкие нарушения деятельности нервной системы и щитовидной железы. Развитие врожденного зоба обусловлено как заболеванием матери, так и приемом в период гестации тиреостатических препаратов типа тиоурацила.
Лечение. При отклонениях от нормального развития зародыша и плода лечение должно быть направлено на устранение причины, вызвавшей эмбриоили фетопатию. Профилактика. Она связана с преи антенатальной охраной плода новорожденного и должна быть направлена на выявление и лечение заболеваний у матери до и во время беременности (предгравидарная подготовка, профилактика обострений заболевания во время беременности, квалифицированное применение медикаментов), профилактику патологии беременности и родов.
Врожденные пороки развития плода
Врожденные пороки развития плода занимают 2-3-е место в структуре причин перинатальной гибели плода и новорожденного. Важное значение имеет ранняя диагностика пороков развития, которая необходима для своевременного решения вопроса о возможности продолжения беременности, что определяется видом порока развития, совместимостью с жизнью и прогнозом в отношении постнатального развития.В зависимости от этиологии различают наследственные (генетические), экзогенные и мультифакториальные врожденные пороки развития плода.
К наследственным относят пороки развития, возникающие вследствие мутаций, т.е. стойких изменений наследственных структур в половых клетках (гаметах) или зиготе. В зависимости от того, на каком уровне произошла мутация (гены или хромосомы), выделяют моногенные синдромы и хромосомные болезни.
К экзогенным относят пороки, обусловленные повреждающим действием экзогенных факторов. Данные факторы, действуя в период гаметогенеза или беременности, приводят к возникновению врожденных пороков, не нарушая структуру наследственного аппарата.
Пороками мультифакториального происхождения называют пороки, возникшие под комбинированным воздействием генетических и экзогенных факторов.
Выделяют также изолированные (локализованные в одном органе), системные (в пределах одной системы органов) и множественные (в органах двух и более систем) пороки.
Пороки развития центральной нервной системы
Классификация наиболее часто встречающихся пороков развития ЦНС 1. Гидроцефалия: • стеноз водопровода мозга • открытая гидроцефалия • синдром Денди-Уокера. 2. Папиллома сосудистого сплетения. 3. Дефекты нервной трубки: • spina bifida; • анэнцефалия; • цефалоцеле. 4. Микроцефалия.
Гидроцефалия.
Гидроцефалия наблюдается с частотой 0,3-0,8 на 1000 живорожденных и проявляется обструкцией на одном из участков пути циркуляции цереброспинальной жидкости. Внечерепные аномалии при гидроцефалии встречаются в 63 %: агенезия и дисплазия почек, дефект межжелудочковой перегородки, тетрада Фалл о, менингомиелоцеле, расщепление верхней губы, твердого и мягкого неба, агенезия заднепроходного отверстия и прямой кишки, дисгенезия гонад. Гидроцефалия представлена в основном стенозом водопровода мозга (сужение сильвиева водопровода); открытой гидроцефалией (расширение желудочков мозга и субарахноидальной системы мозга в результате обструкции внежелудочковой системы путей оттока цереброспинальной жидкости); синдромом Денди-Уокера (сочетание гидроцефалии, кисты задней черепной ямки, дефектов червя мозжечка, через которые киста сообщается с полостью IV желудочка).
Папиллома сосудистого сплетения.
Это новообразование локализуется на уровне преддверия боковых желудочков. Папиллома сосудистого сплетения представлена тканью ворсин, гистологически сходной с тканью интактного сосудистого сплетения, и имеет доброкачественное течение. Как правило, она сочетается с гидроцефалией. Папиллому сосудистого сплетения диагностируют с помощью нейросонографии или компьютерной томографии.
Дефекты нервной трубки.
Данный термин объединяет анэнцефалию, цефалоцеле и spina bifida.
Spina bifida – срединный дефект дорсальных дуг позвонков, сопровождающийся обнажением содержимого спинномозгового канала. Spina bifida встречается у 4,1 из 1000 родившихся. Эта аномалия наследуется по многофакторному типу. Spina bifida может быть частью генетических синдромов (с изолированным мутантным геном) или хромосомных аномалий (трисомии по 13-й и 18-й парам хромосом, триплоидия, несбалансированная транслокация либо кольцевая хромосома), результатом воздействия на плод тератогенных факторов в период органогенеза. Различают spina bifida cystica (кистозная форма спинномозговой грыжи с образованием грыжевого мешка, содержащего оболочки мозга и/или вещество мозга) и spina bifida occulta (скрытая форма, которая не сопровождается образованием грыжевого выпячивания). Спинномозговая грыжа часто сочетается с гидроцефалией, врожденными пороками сердца и мочеполовой системы.
Прогноз зависит от уровня и степени поражения, наличия сопутствующих аномалий. Выживаемость детей, получивших лечение в раннем неонатальном периоде, не более 4 0%, причем 25% из них остаются парализованными. При выявлении патологии и наличии нежизнеспособного плода показано прерывание беременности. Показанием к досрочному прерыванию беременности является быстрое нарастание вентрикуломегалии и макрокрании.
Анэнцефалия
Анэнцефалия (псевдоцефалия, экстракраниальная дисэнцефалия) – отсутствие полушарий мозга и большей части свода черепа, при этом наблюдается дефект лобной кости выше супраорбитальной области, височная и часть затылочной кости отсутствуют. Верхняя часть головы покрыта сосудистой мембраной. Структуры среднего и промежуточного мозга частично или полностью разрушены. Гипофиз и ромбовидная ямка в основном сохранены. К типичным проявлениям можно отнести выпученные глаза, боль-шой язык и короткую шею. Данная патология встречается с частотой 3,6 на 1000 родившихся. Чаще ее обнаруживают у новорожденных девочек. Отмечаются многофакторное и аутосомно-рецессивное наследование, хромосомные аномалии. К факторам риска относят сахарный диабет у матери. В экспериментах на животных установлена тератогенность радиации, салицилауов, сульфаниламидов, повышенного содержания углекислого газа, Лхографический диагноз может быть установлен уже в 12- нед беременности. Среди родившихся 32 % являются живорожденными. При внутриутробной диагностике анэнцефалии прерывание беремен-ности показано при любом сроке.
Цефалоцеле (энцефалоцеле, краниальное или окципитальное менингоПеле, расщепление черепа) – выбухание содержимого черепной коробки Через костный дефект (рис.16.1). Термином "краниальное менингоцеле" обозначают выпячивание через дефект только менингеальных оболочек. При. нахождении в грыжевом мешке ткани мозга применяют термин "энцефалоцеле". Цефалоцеле встречается редко и является компонентом многих генетических (синдромы Меккеле, срединного расщепления лица) и негенетических (амниотические перетяжки) синдромов. Прогноз зависит от наличия ткани мозга в грыжевом мешке и сопутствующих гидроили микроцефалии. При энцефалоцеле летальность достигает 44 %, при менингоцеле – не наблюдается. Нормальное интеллектуальное развитие установлено только у 9 % детей с энцефалоцеле и у 60 % – с менингоцеле. Показано прерывание беременности при любом сроке.
 Рис. 16.1. Энцефалоцеле, диагностированное с помощью УЗИ при сроке беременности 27 нед.
1 – костный дефект; 2 – энцефалоцеле (поперечное сечение головки плода).
Рис. 16.1. Энцефалоцеле, диагностированное с помощью УЗИ при сроке беременности 27 нед.
1 – костный дефект; 2 – энцефалоцеле (поперечное сечение головки плода).
Микроцефалия (микроэнцефалия).
Микроцефалия – клинический с и т дром, для которого характерны уменьшение окружности головки и умственная отсталость; встречается с частотой 1,6 на 1000 живорожденных. Микроцефалия является полиэтиологическим заболеванием, в развитии которого важную роль играют генетические (хромосомные аберрации, моногенные дефекты) и экологические факторы. Прогноз зависит от наличия сочетанных аномалий. Трисомии по 13-й, 18-й хромосоме, синдром Меккеля относятся к фатальным поражениям. В отсутствие сопутствующих аномалий прогноз зависит от размеров головки: чем она меньше, тем ниже индекс интеллектуального развития. Микроцефалия относится к неизлечимым заболеваниям. Акушерская тактика – прерывание беременности.
Пороки развития почек и мочевыводящих путей
Поликистозная болезнь почек инфантильного типа (поликистозная болезнь почек I типа, аутосомно-рецессивное поликистозное заболевание почек) проявляется двусторонним симметричным увеличением почек в результате замещения паренхимы вторично расширенными собирательными канальцами без пролиферации соединительной ткани. Прогноз неблагоприятный. Смерть наступает от почечной недостаточности. Акушерская тактика заключается в прерывании беременности при любом сроке.
 Рис. 16.2. Поликистоз правой почки плода (срок беременности 27 нед).
Рис. 16.2. Поликистоз правой почки плода (срок беременности 27 нед).
Поликистозная болезнь почек взрослого типа (аутосомно-доминантная болезнь, гепаторенальная поликистозная болезнь взрослого типа, синдром Поттера III типа) характеризуется замещением паренхимы почки многочисленными кистами разных размеров, которые образуются вследствие расширения собирательных канальцев и других канальцевых сегментов нефрона. Почки поражены с двух сторон и увеличены, но односторонний процесс может быть первым проявлением заболевания. Печень также вовлекается в патологический процесс – развивается перипортальный фиброз, который имеет очаговый характер.
Этиология заболевания неизвестна. Однако тип наследования обусловливает 50 % риск развития болезни, а ее генетический фокус расположен в 16-й паре хромосом. Мутантный ген носит один из 1000 человек. Пенетрация гена происходит в 100 % случаев, однако течение заболевания может варьировать от тяжелых форм со смертельным исходом в неонатальном периоде до бессимптомных, обнаруживаемых только на вскрытии.
Поликистоз почек хроническое заболевание, первые симптомы его появляются в возрасте 35 лет (постоянные боли в поясничной области, увеличение почек, артериальная гипертензия, почечная недостаточность и уремия). Акушерская тактика заключается в ранней диагностике и прерывании беременности. Пренатальную диагностику осуществляют путем биопсии ворсин хориона.
Поликистоз почек (мультикистозная болезнь, кистозное заболевание почек, синдром Поттера II типа, диспластическая болезнь почек) характеризуется кистозным перерождением почечной паренхимы вследствие первичного расширения почечных канальцев (рис. 16.2). Процесс может быть двусторонним, односторонним и сегментарным. Заболевание возникает в основном спорадически и может быть вторичным в комплексе с другими синдромами. Акушерская тактика при двустороннем процессе, диагности-рованном в ранние сроки, в связи с неблагоприятным прогнозом заключается в прерывании беременности. При одностороннем процессе и нормальном кариотипе без сочетанных аномалий показано обычное родоразрешение с последующей консультацией ребенка у специалиста.
Врожденный гидронефроз (пиелоэктазия) является следствием обструкции мочевыводящих путей в месте соединения почечной лоханки и мочеточника. Частота его развития не установлена, так как эта патология представляет собой спорадический феномен. После рождения у мальчиков его диагностируют в 5 раз чаще. У 27 % детей с гидронефрозом выяапяют пузырно-мочеточниковый рефлюкс,двустороннее удвоение мочеточников, двусторонний обструктивный мегауретер, нефункционирующую контралатеральную почку и ее агенезию, у 19 % – аномалии развития различных органов. Акушерская тактика зависит от времени возникновения и длительности течения патологического процесса, а также степени нарушения функции почек.
Врожденные пороки сердца
Частота врожденных пороков сердца (ВПС) составляет от 1-2 до 8-9 на 1000 живорожденных. Наиболее распространенными из ВПС являются дефекты межпредсердной и межжелудочковой перегородок, открытый артериальный проток, стеноз легочной артерии, гипопластический синдром левых отделов сердца, единственный желудочек и др. В 90 % случаев ВПС являются результатом многофакторного повреждения (генетическая предрасположенность и средовые факторы). Риск повторения порока составляет 2-5 % после рождения одного и 10-15 % – двух больных детей. Моногенное наследование отмечается у 1-2% детей с ВПС. У 5% детей обнаруживают хромосомные аномалии, из которых основными являются трисомии. У 1-2 % новорожденных отмечено влияние различных тератогенов.
Эхо кардиографическое исследование плода представляет собой наиболее информативный метод пренатальной диагностики ВПС. Показания к пренатальной диагностике определяются состоянием матери и плода.
1. Показания, обусловленные состоянием матери: • наличие ВПС у членов семьи • сахарный диабет • прием беременной лекарственных препаратов во время органогенеза • алкоголизм • системная красная волчанка • фенилкетонурия. 2. Показания, обусловленные состоянием плода: • многоводие • неиммунная водянка • дизаритмии • экстракард и альные пороки; • хромосомные нарушения. • симметричная форма внутриутробной задержки роста плода.
Прогноз зависит от вила порока, наличия сопутствующих аномалий и хромосомных нарушений.
Акушерская тактика заключается в том, что после тщательного эхокардиографического исследования проводят кордоили амниоцентез с целью получения материала для хромосомного анализа. В случае выявления ВПС у нежизнеспособного плода показано прерывание беременности. При доношенной беременности лучше проводить родоразрешение в специализированных перинатальных центрах. При сочетанных пороках и генетических аномалиях необходимо прерывание беременности при любом сроке.
Аномалии формирования стенок брюшной полости и пороки развития желудочно-кишечного тракта
Диафрагмальная грыжа представляет собой перемещение органов брюшной полости в грудную полость через дефект диафрагмы.
Предполагают, что врожденная диафрагмальная грыжа – следствие тератогенного воздействия хинина, противоэпилептических препаратов, недостатка витамина А.
Врожденные диафрагмальные грыжи часто сочетаются с анэнцефалией, цефалоцеле, spina bifida, расщеплением губы и верхнего неба, омфалоцеле, дефектами межжелудочковой перегородки и тетрадой Фалло. Диафрагмальные грыжи всех типов, за исключением релаксации диафрагмы (заднелатеральной и позадигрудинной), могут сочетаться с хромосомными аномалиями (чаще трисомиями).
Прогноз неблагоприятный. Мертворождение отмечается в 35 % случаев, причем у 90 % мертворожденных выявляются несовместимые с жизнью сочетанные аномалии ЦНС и сердечно-сосудистой системы. Значительное число детей умирают в первые часы после рождения, из них 35 % в течение 1-го часа.
Акушерская тактика заключается в прерывании беременности до достижения плодом жизнеспособности. В случае родоразрешения в срок при доношенной беременности следует предусмотреть необходимость хирургической помощи ребенку.
Омфалоцеле (пупочная грыжа) – дефект передней брюшной стенки в области пупочного кольца, при котором образуется грыжевой мешок с енутрибрюшным содержимым, покрытый амниоперитонеальной мембраной.
Частота омфалоцеле составляет 1 на 5130-5800 родов. Данной патологии в 35-58 % случаев сопутствуют трисомии, в 47 % – врожденные пороки сердца, в 40 % – пороки развития мочеполовой системы, в 39 % – дефекты нервной трубки. Задержку внутриутробного роста плода выявляют в 20 % случаев.
Прогноз зависит от наличия сопутствующих аномалий. Перинатальные Потери чаще связаны с ВПС, хромосомными аберрациями и недоношенностью. Небольшой дефект устраняют путем одноэтапной операции, при большом производят многоэтапные операции с целью закрытия отверстия в передней брюшной стенке силиконовой или тефлоновой мембраной.
Акушерская тактика определяется сроком выявления порока, наличием °четанных аномалий и хромосомных нарушений. При обнаружении порока в ранние сроки беременности ее следует прервать. В случае выявления сопутствующих аномалий, несовместимых с жизнью, необходимо прерывать беременность при любом сроке. Метод родоразрешения зависит от жизнеспособности плода, так как в процессе родов при больших омфалоцеле могут произойти разрыв грыжевого мешка и инфицирование внутренних органов плода.
Гастрошизис – дефект передней брюшной стенки в околопупочной области с эвентрацией петель кишок, покрытых воспалительным экссудатом Частота гастрошизиса составляет 1:10 000 -1:15 ООО живорожденных. Аномалия встречается спорадически, однако отмечаются случаи семейного заболевания с аутосомно-доминантным типом наследования.
Сочетанные аномалии встречаются редко, но у 25 % детей наблюдаются вторичные изменения в ЖКТ, являющиеся следствием сосудистых нарушений, – незавершенный поворот кишечника, атрезия или стеноз его отделов. В 77 % случаев гастрошизису сопутствует задержка роста плода.
Летальность новорожденных составляет 8-28 %, а при расположении печени за пределами брюшной полости достигает 50 %.
При выявлении гастрошизиса до наступления периода жизнеспособности плода следует произвести прерывание беременности. При доношенной беременности роды проводят в учреждении, где может быть оказана хирургическая помощь.
Атрезия пищевода (с трахеопищеводным свищом и без него) – отсутствие сегмента пищевода, которое сопровождается образованием фистулы между ним и дыхательными путями. Этиология неизвестна. Частота патологии варьирует от 1:800 до 1:5000 живорожденных.
В 58 % случаев атрезии пищевода сопутствуют ВПС, генетические аномалии, пороки развития мочеполовой системы и другие аномалии ЖКТ.
Антенатальная диагностика затруднена, так как желудок содержит секрет желез или наполняется через фистулу. Вероятность установления правильного диагноза составляет 10 %. Прогноз зависит от наличия сопутствующих аномалий и респираторных осложнений, массы тела и гестационного возраста при рождении.
Для определения акушерской тактики проводят тщательную ультразвуковую оценку анатомии и топографии внутренних органов плода, включая эхокардиографию. При нежизнеспособном плоде показано прерывание беременности. Выявление сопутствующих несовместимых с жизнью аномалий является показанием к прерыванию беременности при любом сроке. При изолированной атрезии пищевода родоразрешение проводят через естест-венные родовые пути.
Атрезия двенадцатиперстной кишки – наиболее частая причина непроходимости тонкой кишки. Частота аномалии составляет 1:10.000 живорожденных. Этиология неизвестна. Возможно возникновение порока под воздействием тератогенных факторов. Описаны семейные случаи пилородуоденальной атрезии с аутосомно-рецессивным типом наследования. У 30-52 % больных аномалия изолированная, а в 37 % случаев обнаруживают пороки развития костной системы: аномальное число ребер, агенезия крестца, конская стопа, VI поясничный позвонок, двустороннее отсутствие первых цев кистей, двусторонние шейные ребра, слияние шейных позвонков. В 2 тЬ случаев диагностируют сочетанные аномалии ЖКТ: незавершенный поворот желудка, атрезия пищевода, подвздошной кишки и заднепроходного отверстия, транспозиция печени. У 8-20 % больных выявляют ВПС, приблизительно в '/з случаев атрезия двенадцатиперстной кишки сочетается с трисомией по 21-й паре хромосом.
Для определения акушерской тактики проводят детальную ультразвуковую оценку анатомии внутренних органов плода и его кариотипирование. До наступления периода жизнеспособности плода показано прерывание беременности. При обнаружении изолированной аномалии в Ш триместре возможно пролонгирование беременности с последующим родоразрешением и хирургической коррекцией порока развития.
Аномалии лицевых структур, шеи и костной системы плода
Расщелина лица (расщепление верхней губы и неба) представляет собой линейный дефект, распространяющийся от края губы до носового отверстия. Расщелина неба, сочетающаяся с расщелиной губы, через альвеолярные отростки и твердое небо может распространиться на носовую полость или даже на дно глазницы. Двусторонняя расщелина губы наблюдается в 20 % случаев, расщелина губы и неба – в 25 %. Расщелина лица составляет около 13 % от всех пороков развития и регистрируется с частотой 1:700 новорожденных.
Сочетанные аномалии обнаруживают в 50 % случаев при изолированной расщелине неба и только в 13 % – при расщелине губы и неба. Пренатальное выявление дефекта при помощи эхографии затруднено, однако благодаря проведению ультразвукового сканирования и цветного картирования возможности его диагностики расширяются. В отдельных случаях возможна диагностика аномалии с помощью фетоскопии. В отсутствие сочетанных аномалий используется общепринятая акушерская тактика независимо от срока диагностики.
Расщепление верхней губы (заячья губа) не препятствует акту сосания и представляет собой только косметический дефект. При сочетании расщепления верхней губы, челюсти и твердого неба (волчья пасть) отмечаются функциональные нарушения: при сосании молоко вытекает через нос вследствие сообщения его с полостью рта; молоко может попадать в дыхательные пути. Прогноз благоприятный: современные хирургические методы позволяют добиться коррекции косметических и функциональных дефектов.
Срединная расщелина губы (полная срединная расщелина губы, псевдомедиальная расщелина губы, премаксиллярная агенезия) – четырехугольный или треугольный дефект верхней губы, встречается в 0,2-0,7 % всех случаев расщелины губы. Аномалия встречается только как компонент двух синдромов: орбитального гипотелоризма (голопрозэнцефалия) и орбитального гипертелоризма. При эхографии проводят оценку внутричерепных структур, так как имеется связь между развитием структур лица и процессами дифференциации переднего мозга. Прогноз определяется только сочетанием с другими аномалиями. Интеллект у 80 % больных не нарушен.
Кистозная гигрома (лимфангиома или последствие обструкции яремного лимфатического ствола) представляет собой осумкованное скопление жидкости. Характеризуется наличием единичных или множественных кист мягких тканей в области шеи, образующихся вследствие нарушений в лимфатической системе. Кистозные гигромы встречаются в 1 случае на 200 спонтанных выкидышей (копчико-теменной размер плода более 30 мм). Кистозная гигрома часто сочетается с хромосомными аберрациями {синдром Тернера, трисомии по 13-й, 18-й, 21-й паре хромосом, мозаицизм). Как изолированная аномалия наследуется по аутосомно-рецессивному типу.
Прогноз: в большинстве случаев плод погибает в первые два триместра беременности. Около 90 % новорожденных нуждаются в хирургическом лечении, у 31 % развиваются нарушение глотания и обструкция дыхательных путей. Парез лицевого нерва вследствие хирургического лечения возникает у 24 % пациентов.
Акушерская тактика заключается в прерывании беременности при ранней диагностике патологии, при доношенной беременности роды ведут через естественные родовые пути.
Пороки развития костной системы.
Среди врожденных пороков костной системы наиболее часто встречаются амелия (аплазия всех конечностей) фокомелия (недоразвитие проксимальных отделов конечностей, при этом кисти и стопы соединяются непосредственно с туловищем), аплазия одной из костей голени или предплечья, полидактилия (увеличение числа пальцев на конечности), синдактилия (уменьшение числа пальцев вследствие сращения мягких тканей или костной ткани рядом расположенных пальцев), аномальная установка стоп, остеохопдродисплазии, характеризующиеся ано-малиями роста и развития хрящей и/или костей (ахондрогенез, ахондроплазия, танатоформная дисплазия, несовершенный остеогенез, гипофосфатазия и др.).
Наиболее важна диагностика пороков, несовместимых с жизнью. Многие формы скелетных дисплазий сочетаются с гипоплазией легких, обусловленной небольшими размерами грудной клетки вследствие недоразвития ребер. Развитие легочной недостаточности при этом может быть причиной смерти детей в первые часы внеутробной жизни.
Гипоксия плода
Под гипоксией плода подразумевают комплекс изменений в его организме под влиянием недостаточного снабжения кислородом тканей и органов или неадекватной утилизации ими кислорода.Терминология.
Термин "гипоксия плода" предложен ВОЗ (1995), но он не единственный: существуют также термины "дистресс плода" (от distress – страдания) и "асфиксия" (от а – без, sphyxis – пульс), при этом подразумевают удушье, т.е. недостаток кислорода и накопление углекислого газа в организме. Из этого следует, что термин "асфиксия" условный, так как кислородная недостаточность не всегда сопровождается отсутствием сердцебиения и гиперкапнией. В настоящее время термин "асфиксия" исполь-зуется для характеристики состояния новорожденных, родившихся с явлениями кислородной недостаточности.
В различные периоды беременности кислородная недостаточность имеет неодинаковые последствия для эмбриона и плода. В период органогенеза выраженная гипоксия может сопровождаться замедлением развития эмбриона и появлением аномалий развития. Кислородное голодание в период фетогенеза может привести к гипоксии, задержке роста плода, поражению ЦНС плода и новорожденного, нарушению процессов адаптации в постнатальном периоде, послужить причиной мертворожденна и гибели новорожденных в ранний неонатальный период.
Гипоксия плода отмечается в 10,5 % случаев (от общего числа родов), и этот показатель не имеет тенденции к снижению.
Гипоксия плода не является первичной нозологической формой или самостоятельным заболеванием, осложняющим внутриутробное развитие плода, а возникает как следствие различных патологических процессов в системе мать – плацента – плод.
Классификация.
Гипоксию плода классифицируют по длительности течения, интенсивности и механизму развития.
В зависимости от длительности течения различают хроническую, подострую и острую гипоксию. Хроническая гипоксия плода развивается при недостаточном снабжении плода кислородом в течение длительного периода, осложненном течении беременности и в основном связана с морфофункциональными изменениями плаценты, в частности с нарушением ее кровоснабжения вследствие дегенеративных, воспалительных и других поражений. Подострая гипоксия обычно развивается за 1-2 дня до родов и характеризуется снижением адаптационных возможностей плода. Острая гипоксия, как правило, возникает в родах и реже – во время беременности. Нередко наблюдается сочетание острой и хронической гипоксии плода, что является крайне неблагоприятным прогностическим фактором для плода.
По интенсивности гипоксия может быть функциональной (легкая форма): имеют место лишь гемодинамические нарушения; метаболической: более глубокая гипоксия с нарушениями всех видов обмена, но нарушения метаболизма обратимы; деструктивной (тяжелая форма): необратимые изменения на уровне клеток.
В зависимости от механизма развития выделяют следующие формы гипоксии: 1. артериалъно-гипоксемическую: • гипоксическую, являющуюся следствием нарушения доставки кислорода в маточно-плацентарный кровоток, • трансплацентарную – результат маточно-плацентарной или фетоплацентарной недостаточности и нарушения газообменной функции плаценты; 2. гемическую: • анемическую, в том числе гемолитическую и постгеморрагическую; • гипоксию в результате снижения сродства фетального гемоглобина к кислороду; 3. ишемическую: • гипоксию, развивающуюся как следствие низкого сердечного выброса при аномалиях развития сердца и крупных сосудов, тяжелых нарушений сердечного ритма, сниженной сократимости миокарда; • гипоксию в результате повышенного сосудистого сопротивления, в том числе из-за изменения реологических свойств крови; 4. смешанную, для которой характерно сочетание двух и более патогенетических форм кислородной недостаточности у плода.
Наиболее часто наблюда-ются артериально-гипоксемическая и смешанная формы гипоксии.
Даже при неосложненной беременности снабжение плода кислородом значительно хуже, чем взрослого человека. Однако на всех этапах развития благодаря наличию компенсаторно-приспособительных механизмов кислородное снабжение находится в полном соответствии с потребностями плода.
Устойчивость плода к гипоксии определяется следующими физиологическими особенностями его внутриутробного развития: большим минутным ^бъемом сердца, достигающим 198 мл/кг (у новорожденного 85 мл/кг, у Рослого человека 70 мл/кг); увеличением частоты сердечных сокращений до 150-160 уд/мин; значительной кислородной емкостью крови плода (в среднем 23 %) ; наличием фетального гемоглобина, составляющего 70 % от общего количества гемоглобина в эритроцитах; особенностями строения сердечно-сосудистой системы – наличием трех артериовенозных шунтов (венозный, или аранциев, проток, межпредсердное овальное отверстие и артериальный, или боталлов, проток), за счет которых почти все органы плода получают смешанную кровь (смешение различных потоков крови в желудочках сердца плода обеспечивает более медленное в случае развития гипоксии снижение Рс , чем у взрослого); большим удельным весом анаэробиоза в энергетике плода, который обеспечивается значительными запасами гликогена, энергетических и пластических продуктов обмена в жизненно важных органах. Развивающийся при этом у плода метаболический апидоз повышает его устойчивость к кислородному голоданию (табл. 16.1).
Этиология и патогенез.
Многочисленные этиологические факторы, способствующие развитию гипоксии плода, можно разделить на 3 группы. К 1-й группе относятся экстрагенитальные заболевания матери (сердечно-сосудистые, бронхолегочные и т.д.), синдром сдавления нижней полой вены, анемия, отравления, интоксикации, кровопотеря, шок различной этиологии, а также осложнения беременности и родов, при которых отмечается недостаток кислорода или избыток углекислого газа в организме матери. Наиболее обширную 2-ю группу составляют нарушения плодовоплаценгарного кровотока (гестоз, перенашивание беременности, угрожающие преждевременные роды, аномалии расположения плаценты, преждевременная отслойка нормально расположенной плаценты, инфаркты плаценты, аномалии родовой деятельности, патология пуповины: обвитие вокруг шеи и туловища, выпадение и натяжение). В 3-ю группу включены заболевания плода: гемолитическая болезнь, анемия, гипотензия, инфицирование, врожденные пороки развития, длительное сдавление головки во время родов.
Кислородная недостаточность является основным патогенетическим фактором, приводящим к нарушениям функций организма, обменных процессов и в конечном итоге – к возникновению терминального состояния.
Уменьшение насыщения крови кислородом обусловливает существенные изменения дыхательной функции крови и развитие ацидоза. В этих условиях изменяются многие параметры гомеостаза, направленность которых зависит от степени тяжести гипоксии. На ранних этапах как проявление компенсаторных реакций организма происходит активация функций большинства систем, В дальнейшем наступает их угнетение, и в конечном итоге кислородная недостаточность вызывает деструктивные процессы в жизненно важных органах. Наиболее значительными считаются изменения макрои микрогемодинамики, метаболизма.
В начальных стадиях гипоксии плода наблюдается универсальная компенсаторно-защитная реакция, направленная на сохранение функции жизненно важных органов и систем. Под влиянием дефицита кислорода происходят активация функции мозгового и коркового слоев надпочечников, выработка большого количества катехоламинов и других вазоактивных веществ, которые вызывают тахикардию и повышение тонуса периферических сосудов в органах, не имеющих жизненно важного значения. Вследствие тахикардии, централизации и перераспределения кровотока увеличиваются минутный объем сердца, кровообращение в мозге, сердце, надпочечниках, плаценте и уменьшается – в легких, почках, кишечнике, селезенке, коже, в результате чего развивается ишемия этих органов. На фоне ишемии возможны раскрытие анального сфинктера и выход мекония в околоплодные воды.
Длительная или тяжелая гипоксия, наоборот, приводит к резкому угнетению функции надпочечников, сопровождающемуся снижением уровня кортизола и катехоламинов в крови. Угнетение гормональной регуляции сопровождается угнетением жизненно важных центров, уменьшением частоты сердечных сокращений, снижением артериального давления, венозным застоем, скоплением крови в системе воротной вены.
Одновременно с изменениями макрогемодинамики происходят выраженные нарушения в системе микроциркуляции. Расстройства микрогемодинамики при кислородной недостаточности происходят по трем направлениям: снижение тонуса резистивных сосудов, повышение проницаемости стенок сосудов, изменение агрегатного состояния крови с нарушением ее текучих свойств. Снижение тонуса артериол и прекапилляров вызывает расширение сосудов и увеличение объема сосудистого русла, что в сочетании с уменьшением минутного объема сердца приводит к замедлению кровотока вплоть до стаза. В условиях ацидоза и снижения скорости кровотока повышаются вязкость крови, агрегационная активность клеток крови и коагуляционный потенциал с развитием синдрома диссеминированного внутрисосудистого свертывания крови и сладж-синдрома со снижением газообмена в эритроцитах, уменьшением адекватного газообмена в тканях. Нарушение трофики сосудистой стенки приводит к повышению ее проницаемости и выходу первоначально жидкой части крови, а затем и форменных элементов крови из сосудистого русла. Результатом этих изменений являются гиповолемия, гемоконцентрация, отек тканей, диапедезные кровоизлияния в жизненно важные органы.
Под влиянием кислородной недостаточности происходят значительные изменения параметров метаболизма: повышается активность ферментов, Участвующих в окислительно-восстановительных процессах, что приводит к Усилению тканевого дыхания и энергообразования в печени плода. Основной компенсаторно-приспособительной реакцией организма плода, способствующей меньшему повреждению его тканей при недостатке кислорода, является усиление процессов анаэробного гликолиза. В результате этого происходят уменьшение количества гликогена и накопление кислых продуктов обмена (молочная кислота, кетоновые тела, лактат) в печени, сердце, мозге, мышцах и крови плода, что приводит к метаболическому или реслираторно-метаболическому ацидозу. Одновременно происходит активация перекисного окисления липидов с высвобождением токсичных радикалов которые наряду с недоокисленными продуктами обмена при прогрессировании гипоксии угнетают ферментативные реакции, снижают активность дыхательных ферментов, нарушают структурно-функциональные свойства клеточных мембран с повышением их проницаемости для ионов. Наиболее значительны изменения баланса ионов калия, которые выходят из клеточного пространства, и уровень их в плазме крови плода повышается. Аналогичные изменения происходят в отношении ионов магния и кальция. Клиническое значение этих нарушений велико. Гиперкалиемия наряду с гипоксией и ацидозом играет важную роль в перевозбуждении парасимпатической нервной системы и развитии брадикардии. Следствием повышенной проницаемости клеточных мембран являются энергетический голод и гибель клеток.
Вследствие выраженных изменений макрои микрогемодинамики, метаболизма в тканях жизненно важных органов могут развиваться ишемия и некрозы, приводящие к необратимым деструктивным нарушениям. Эти патологические изменения не исчезают после рождения плода, а сохраняются тем дольше, чем более тяжелую гипоксию перенес плод, определяя развитие ребенка в дальнейшем. Последствия гипоксии прежде всего про-являются в головном мозге, в котором отек и микрокровоизлияния вызывают нарушение функций центров регуляции, в первую очередь дыхательного и сердечно-сосудистого. При повышении внутричерепного давления даже при физиологических родах указанные изменения могут быть фоном для кровоизлияний, в том числе массивных, что в последующем может привести к развитию церебральных параличей.
Клиническая картина и диагностика.
Клинические проявления гипоксии плода во время беременности скудны. К ним относят изменения двигательной активности плода, ощущаемые беременной. В начальной стадии внутриутробной гипоксии беременная отмечает беспокойное поведение плода, которое выражается в учащении и усилении его двигательной активности. При про фесе ирующей или длительной гипоксии происходит ослабление движений плода, вплоть до их прекращения. Уменьшение числа движений плода до 3 в течение 1 ч и менее является признаком внутриутробного страдания плода и служит показанием к проведению срочного дополнительного исследования.
Диагностика гипоксии плода во время беременности состоит в непосредственной оценке его состояния и анализе результатов применения косвенных методов, позволяющих определить функциональное состояние фето плацентарной системы (кард иото ко граф ия, эхография, допплерометрия кровотока в системе мать-плацента-плод, определение биофизического профиля плода, РО2 и РСО2 , уровня лактата и показателей КОС в крови матери, околоплодных водах и крови плода, уровня хорионического гонадотропина, плацентарного лактогена, эсгриола).
Наиболее информативными и точными методами оценки состояния плода во время беременности (в последнем триместре) являются кардиомониторный контроль и ультразвуковое сканирование. К начальным признакам гипоксии плода при кардиотокографии относятся тахикардия (до 170 уд/MHHj или умеренная брадикардия (до 100 уд/мин), понижение вариабельности сердечного ритма, кратковременная (до 50 % записи) монотонность ритма»
 Рис. 16.3. Выраженные признаки гипоксии плода: монотонность (а), парадоксальная реакция на функциональные пробы (б), синусоидальный ритм (в).
Рис. 16.3. Выраженные признаки гипоксии плода: монотонность (а), парадоксальная реакция на функциональные пробы (б), синусоидальный ритм (в).
Ослабление реакции на функциональные пробы.
Кардиограмма при этом оценивается в 5-7 баллов. При выраженном страдании плода наблюдаются значительная брадикардия (ниже 100 уд/мин) или тахикардия (более 170 уд/мин), монотонность ритма (свыше 50 % записи), парадоксальная реакция на функциональные пробы (поздние децелерации в ответ на шевеление плода при нестрессовом тесте) или ее отсутствие (рис. 16.3). О выраженной гипоксии плода свидетельствует оценка кардиотокограммы в 4 балла и менее.
Дополнительным критерием оценки состояния плода во время беременности является его биофизический профиль (БФП). При гипоксии происходит прогрессивное угнетение биофизических функций плода. Параметры БФП при гипоксии плода делят на "острые", или быстрореагирующие (нестрессовый тест, дыхательные движения, двигательная активность и Тонус плода), и "хронические" показатели длительности страдания плода, Которые возникают в результате повторяющейся или прогрессирующей гипоксии (маловодие и преждевременное созревание плаценты). В начальной стадии развития гипоксии в первую очередь осуществляют постановку неРеактивного нестрессового теста (НСТ), при котором с целью оценки степени тяжести гипоксии проводят ультразвуковое исследование и определение остальных биофизических параметров. При этом определение БФП заменяет проведение стрессового теста. Вслед за НСТ происходит снижение дыхательной активности плода вплоть до исчезновения его дыхательных движений, при прогрессирующей гипоксии исчезают движения и тонус плода Изменения биофизической активности в процессе нарастания гипоксии плода происходят в обратной последовательности от сроков созревания в эмбриои фетогенезе регулирующих центров ЦНС. Суммарная оценка БФП 6-7 баллов указывает на сомнительное состояние плода, в связи с чем требуется проведение повторного исследования, а оценка 4-5 баллов и менее свидетельствует о наличии выраженной внутриутробной гипоксии плода.
В диагностике гипоксии плода важное значение придают допплерометрической оценке кровообращения в аорте и сосудах головного мозга плода. Допплерометрия позволяет несколько раньше, чем кардиотокография, диагностировать внутриутробную гипоксию, что способствует выявлению группы беременных, подлежащих тщательному наблюдению и лечению. Гемодинамические нарушения в аорте и сосудах головного мозга плода вторичны и свидетельствуют о нарушении центральной гемодинамики плода в ответ на уменьшение плацентарной перфузии. Увеличение диастолической скорости кровотока в головном мозге плода при гипоксии указывает на сохранение церебрального кровотока плода в этих условиях за счет вазодилатацци. Компенсаторный механизм поддержания нормального кровоснабжения головного мозга при сниженной плацентарной перфузии носит название "охранный круг кровообращения". Существует коррелятивная связь между средней скоростью кровотока в аорте и средней мозговой артерии плода, рН, Рс0 и Ро в его крови. При тяжелой гипоксии уменьшение ПИ в средней мозговой артерии достигает максимума, что отражает максимальную дилатацию этого сосуда. Крайне неблагоприятный прогностический признак для плода – появление нулевых или отрицательных значений диастолического компонента кровотока в аорте, что свидетельствует о декомпенсации фетоплацентарной системы. Как правило, эти изменения сочетаются с патологическим кровотоком в артерии пуповины, однако показатели пуповинного кровотока могут быть и нормальными. В более поздних стадиях по мере прогрессирования гипоксии возникают нарушения венозного кровотока (венозный проток, печеночные вены).
С целью диагностики кислородной недостаточности у плода проводят осмотр и биохимическое исследование околоплодных вод. В случае гипоксии плода при амниоскопии обнаруживают окрашивание околоплодных вод меконием. Наиболее информативными тестами при исследовании околоплодных вод, получаемых при амниоцентезе, являются рН ниже 7,02; Рсо2 выше 55 мм рт.ст., Р°Л ниже 80 мм рт.ст., концентрация калия выше 6,5 ммоль/л. О кислородной недостаточности плода, кроме того, свидетельствуют повышение активности щелочной фосфатазы в околоплодных водах более чем в 2 раза. Определение концентрации плацентарных гормонов в сыворотке крови и моче беременных позволяет диагностировать плацентарную недостаточность, приводящую к гипоксии плода. Уровень плацентарного лактогена в сыворотке крови беременных при гипоксии плода снижается в 3 раза (норма 10 мкг/мл). Из фракций эстрогенов наиболее информативен показатель экскреции эстриола: экскреция гормона менее 12 мг/сут (в околоплодных водах менее 50 мг/100 мл) свидетельствует о плацентарной недостаточности. Заслуживает внимания используемый в настоящее время новый метод диагностики гипоксии плода на основании результатов изучения различных параметров его крови (КОС, уровень гемоглобина и др.), полученной с помощью кордоцентеза.
 Рис. 16.4. Признаки гипоксии плода в родах (Vи W-образные децелерации).
Рис. 16.4. Признаки гипоксии плода в родах (Vи W-образные децелерации).
Диагностика гипоксии плода в родах основывается на выявлении нарушений его сердечной деятельности. Помимо аускультации, наиболее доступным методом выявления гипоксии плода в родах является кардиотокография (рис. 16.4). При кардиомониторном наблюдении к начальным признакам гипоксии плода в первом периоде родов относятся брадикардия до 100 уд/мин как при головном, так и тазовом предлежании плода, периодическая монотонность сердечного ритма. Реакция на схватку проявляется кратковременными поздними децелерациями до 70 уд/мин. Во втором периоде родов начальными признаками гипоксии служат браликардия до 90 уд/мин или тахикардия до 200 уд/мин, регистрируется периодическая монотонность ритма. В ответ на потугу возникают поздние децелерации до 60 уд/мин. К выраженным признакам гипоксии плода в первом периоде родов относятся брадикардия до 80 уд/мин при головном предлежании, брадикардия ниже 80 уд/мин или тахикардия до 200 уд/мин при тазовом предлежании плода. Независимо от предлежания плода регистрируются стойкая монотонность ритма и аритмия. Реакциями на схватку являются возникновение длительных поздних W-образных децелерации при головном предлежании и комбинация акцелераций с децелерациями до 80 уд/мин при тазовом предлежании плода.
В периоде изгнания к выраженным признакам гипоксии относится появление на кард иото ко грамме выраженной брадикардии до 80 уд/мин или т11ахикардии более 190 уд/мин; регистрируется стойкая монотонность ритма аритмия, в ответ на потугу отмечаются длительные поздние децелерации До 50 уд/мин как при головном, так и тазовом предлежании плода. При головном предлежании вне схватки регистрируются W-образные децелерации до 50 уд/мин.
В процессе родов в отличие от антенатального периода прогностически неблагоприятным фактором в отношении гипоксии следует расценивать Появление дыхательной или двигательной активности плода. Регулярная Ыраженная дыхательная активность плода как в первом, так и во втором Периодах родов представляет собой большую угрозу для новорожденного, являясь причиной развития у него аспирационного синдрома.
Большое значение в выявлении гипоксии плода имеет исследование КОС крови, полученной из предлежащей части. В первом периоде родов рН ниже 7,2 свидетельствует о гипоксии, а от 7,20 до 7,24 – о преацидозе в связи с чем требуется повторное исследование. Нижняя граница нормы рН во втором периоде родов 7,14.
Выделение мекония в процессе родов не столько характеризует состояние плода, сколько заставляет обратить внимание на угрожающую ситуацию и имеет значение лишь при головном предлежании. В зависимости от длительности и глубины гипоксии примесь мекония в водах имеет разный характер: от взвешенных кусочков в начальной стадии гипоксии до образования грязной эмульсии при тяжелой гипоксии. Наличие мекония в околоплодных водах может указывать не только на острую, но и кратковременную или длительную гипоксию плода, возникшую до родов, и плод в отсутствие новых эпизодов гипоксии может родиться без асфиксии.
Лечение, Во время беременности лечение хронической гипоксии плода должно быть комплексным. Кроме лечения основного заболевания, беременной необходимо проводить терапию, направленную на нормализацию плацентарного кровообращения, улучшение снабжения плода кислородом и энергетическими веществами, повышение адаптационных возможностей в системе мать-плод и устойчивости плода к гипоксии, создание условий, благоприятствующих течению обменных процессов. Для решения этих задач в первую очередь следует воздействовать на кислородотранспортную функцию плаценты путем: 1. расширения маточно-плацентарных сосудов; 2. расслабления мускулатуры матки; 3. нормализации реокоагуляционных свойств крови; 4. активации метаболизма миометрия и плаценты.
Прежде всего беременным необходимо обеспечить покой. Постельный режим, при котором улучшается кровоснабжение матки, показан при выявлении гипоксии плода и отставании его в развитии, особенно при недоношенной беременности.
Снабжение организма матери кислородом улучшается в результате ингаляции его с помощью маски. При этом оптимальным вариантом является вдыхание беременной 40-60 % кислородно-воздушной смеси в количестве 4- 5 л/мин в течение 30-60 мин 1-2 раза в день. Выраженный эффект дает применение кислородного коктейля или кислородной пены. Кислородный коктейль всасывается медленно; его принимают по 150-200 мл в течение 5- 10 мин и более за 1,5 ч до или через 2 ч после еды. Для профилактики и лечения гипоксии у матери и плода при сердечно-сосудистых заболеваниях с успехом применяют гипербарическую оксигенацию.
С целью улучшения маточно-плацентарного кровообращения в состав комплексной терапии включают эстрогены, которые влияют на обменные процессы в эндометрии, повышают проницаемость плаценты, увеличивают переход глюкозы и питательных веществ к плоду. Одним из препаратов, оказывающих слабое эстрогенное действие и улучшающих маточно-плацентарный кровоток, является сигетин, который вводят в виде 1-2 % раствора по 2-4 мл в 20 мл 40 % раствора глюкозы. Его целесообразно применять на фоне введения сосудорасширяющих средств (2,4 % раствор эуфиллина внутривенно струйно или капельно в дозе 5-10 мл, компламин по 0,15 г 3 раза в день во время еды или по 2 мл 15 % раствора 1-2 раза в день, курантил по 0,5 мл/кг внутривенно капельно в течение 2-5 ч или перорально по 0,025 г 2-3 раза в день после инфузии).
Для нормализации маточно-плацентарного кровотока и активации метаболизма в плаценте применяют токолитики (р-адреномиметики) нового поколения – бриканил, гинипрал в виде внутривенных инфузии (на растворе глюкозы) по 0,5 мг, длительно.
С целью нормализации реокоагуляционных свойств крови используют дезагреганты (трентал, низко молекулярные декстраны) и антикоагулянты (гепарин по 20.000 ЕД/сут в виде подкожных инъекций или внутривенных инфузии).
К препаратам, влияющим непосредственно на метаболические процессы, относятся АТФ, кокарбоксилаза, фолиевая кислота, концентрированные растворы глюкозы, метионин, ударные дозы витамина В12, галаскорбин.
При лечении хронической гипоксии плода обязательно применяют мембраностабилизаторы (эссенциале-форте или липостабил по 2 капсулы 3 раза в день либо внутривенно по 5 мл) и антиоксиданты (витамин Е по 600 мг/сут, аскорбиновая кислота по 600 мг/сут, глутаминовая кислота по 0,3 г/сут).
Коррекцию баланса кислот и щелочей у беременных следует проводить под контролем параметров КОС крови, поскольку патологические состояния у них не всегда сопровождаются ацидозом. Лечение ацидоза должно быть направлено на коррекцию баланса кислот, щелочей и улучшение периферической циркуляции. Введение таких лекарственных препаратов, как глюкоза, витамин С, кокарбоксилаза, АТФ, приводит к нормализации КОС крови, поэтому проведение инфузионной терапии само по себе кор-ригирует нарушения кислотно-основного обмена, а иногда может наблюдаться тенденция к алкалозу.
Хороший эффект дают вещества, повышающие устойчивость ткани мозга к недостатку кислорода (седуксен, оксибутират натрия). Наряду с улучшением энергетического обеспечения мозга они обеспечивают снижение потребления кислорода ЦНС без существенного подавления функций ее жизненно важных центров. В условиях гипоксии выраженное защитное действие ГОМК оказывает также на клетки миокарда, печени, почек.
Особенно важны терапия и подготовка к родоразрешению при преждевременных родах, когда гипоксия плода усугубляется незрелостью легочной ткани. Для ускорения созревания легочной ткани показаны глюкокортикоиды: дексаметазон 4 раза в день в течение 2-3 сут, разовая доза 2 мг, суточная – 8 мг, курсовая – 16-24 мг.
При отсутствии эффекта от комплексной терапии хронической гипоксии плода при сроках гестации 28-32 нед и более выраженные изменения кардиото ко граммы и биофизического профиля плода, обнаружение мекония а околоплодных водах, маловодие, острая гипоксия плода являются показаниями к экстренному родоразрешению независимо от срока гестации. При этом предпочтение следует отдавать кесареву сечению.
В родах терапию изменяют в зависимости от акушерской ситуации, выбирая быстродействующие эффективные препараты (глюкоза, увлажненный кислород, эуфиллин, кокарбоксилаза, сигетин, аскорбиновая кислота), введение которых предшествует оперативному родоразрешению (кесарево сечение, акушерские щипцы, извлечение плода за тазовый конец, вакуумэкстракция, перинеоили эпизиотомия).
Профилактика гипоксии плода и асфиксии новорожденного должна основываться на ранней дородовой диагностике и состоять из следующих компонентов: 1. своевременной госпитализации беременной из группы риска развития гипоксии плода; 2. проведения интенсивной терапии акушерской и экстрагенитальной патологии беременных; 3. выбора адекватных методов родоразрешения; 4. комплексной терапии гипоксии плода, включающей коррекцию расстройств гемодинамики, микроциркуляции, нарушений метаболизма функции фетоплацентарного комплекса; 5. досрочного родоразрешения при отсутствии эффекта от проводимой терапии.
В процессе родов лечение и профилактика гипоксии плода, асфиксии новорожденного обязательны в следующих случаях: 1. слабость родовой деятельности и длительный безводный промежуток при несвоевременном излитии вод; 2. перенашивание беременности; 3. гестозы (длительно текущие или тяжелые формы); 4. тазовое предлежание плода; 5. изосерологическая несовместимость крови матери и плода; 6. сахарный диабет, сердечно-сосудистые заболевания и другие состояния, влияющие на плод.
Внутриутробная инфекция
Внутриутробная инфекция (ВУИ) занимает одно из ведущих мест в структуре причин перинатальной заболеваемости и смертности.Различают внутриутробную инфекцию и инфицирование. При внутриутробных инфекциях и инфицировании плода и новорожденного заражение происходит в перинатальном периоде или в родах и источником его является мать.
Внутриутробная инфекция – заболевание, клиническипроявляющееся в виде пиодермии, гепатита, гастроэнтерита, пневмонии, отита и другой патологии вплоть до сепсиса.
Инфицирование плода выражается лишь в проникновении в его организм возбудителя и не сопровождается клиническими проявлениями, что, возможно, объясняется мобилизацией иммунитета и защитных механизмов в системе мать-плацента-плод.
В зарубежной литературе для обозначения группы инфекций со сходными клиническими проявлениями, вызывающих в последующем стойкие структурные изменения органов и систем у детей, используют аббревиатуру TORCH: Т – токсоплазмоз, О – другие (other) инфекции (сифилис, хламидиоз, энтеровирусные инфекции, гепатиты А и В , гонорея, листериоз), R – краснуха (rubeola), С – цитомегаловирусная инфекция (cytomegaHa), Н – герпесвирусная инфекция (herpes). Среди многообразных возбудителей ВУИ значительную роль играют грамотрицательные аэробные бактерии, неспорообразующие анаэробы, микоплазмы, стрептококки группы В, дрожжеподобные грибы.
В нашей стране принята классификация ВУИ, в которой в I группу объединены все вирусные заболевания эмбриона и плода, а во 2-ю – заболевания плода, вызванные бактериальной флорой.
Клинические проявления и тяжесть течения ВУИ зависят от вида возбудителя, его вирулентности, массивности обсеменения, уровня иммунной реактивности организма и стадии инфекционного процесса у беременной, срока гестации в момент инфицирования, путей проникновения возбудителя в организм беременной.
При ВУИ, возникших в первые 3 мес беременности, соответствующие периодам органогенеза и плацентации, возникают инфекционные эмбриопатии, для которых характерны истинные пороки развития, первичная плацентарная недостаточность, неразвивающаяся беременность, самопроизвольные выкидыши. Ведущую роль в возникновении эмбриопатий играют микроорганизмы с внутриклеточным циклом развития (в частности, вирусы), обладающие высоким тропизмом к эмбриональным тканям.
В случае возникновения ВУИ после 3 мес гестации развиваются инфекционные фетопатии, которые сопровождаются внутриутробной задержкой роста плода, формированием вторичной плацентарной недостаточности, возникновением дизэмбриогенетических стигм, собственно инфекционным поражением плода. В раннем фетальном периоде еще не происходит локализации воспалительного процесса, поэтому ВУИ, как правило, протекает генерализованно, сопровождается нарушением маточно-плацентарного кровообращения, дистрофическими, некробиотическими реакциями, нарушением формообразовательных процессов с избыточным разрастанием соеди-нительной ткани (глиоз мозга, эндокардиальный фиброэластоз). Воспалительные изменения пролиферативного характера могут вызвать сужение или обтурацию существующих анатомических каналов и отверстий с последующим развитием аномалии уже сформированного органа (гидроцефалия, гидронефроз). Во второй половине фетального периода (с 6-7-го месяца) благодаря становлению клеточного и гуморального иммунитета плод приобретает способность специфически реагировать на внедрение возбудителей инфекции.
Наиболее характерными клиническими симптомами ВУИ являются многоводие, стойкая тахикардия у плода, задержка роста плода, реже встречается маловодие.
В диагностике внутриутробного инфицирования основными являются бактериологические и иммунологические методы. К ним относятся обнаружение в посевах этиологически значимых микроорганизмов в количестве, превышающем 5-10 КОЕ/мл, и более современный и специфичный метод молекулярной гибридизации, суть которого заключается в идентификации определенных фрагментов ДНК или РНК клеток возбудителя. Посевы и соскобы (для выявления внутриклеточного расположения возбудителей) берут у беременных из влагалища и канала шейки матки. Наиболее чувствительным и специфичным методом диагностики внутриутробного инфицирования является ELISA-метод, в основу которого положено определение моноклональных антител в жидкостях и средах организма с помощью тест-системы. Высокий титр антител в сочетании с выделенным антигеном (возбудителем) свидетельствует об инфицированНости плода и элементов плодного яйца.
Кроме специфических серологических и иммунологических тестов, позволяющих уточнить характер возбудителя инфекции, стадию процесса и риск инфицирования плода, немаловажное значение имеют следующие лабораторные тесты: дизиммуноглобулинемия (снижение уровня IgG до 7,9 г/л и ниже в сочетании с повышением уровня IgM до 2 г/л), увеличение содержания циркулирующих иммунных комплексов до 7,6-8,8 ед., лимфопения снижение фагоцитарной активности лейкоцитов до 60-62 %, повышение уровня средне молекулярных пептидов до 0,30 у.е., нарушения в интерфероновом статусе.
Наиболее характерными признаками ВУИ при УЗИ считают плацентит утолщение плаценты, несвоевременное созревание плода и плаценты, увеличение размеров живота плода, гепатомегалию, пиелоэктазии у плода многоводие, наличие газа в желчном пузыре.
Общие принципы профилактики и лечения ВУИ.
1. Этиотропная противомикробная терапия с учетом стадии, общих и локальных симптомов, длительности течения инфекционного воспалительного заболевания, наличия смешанной инфекции, срока гестации, клинико-лабораторных данных. 2. Профилактика (лечение) нарушений функций фетоплацентарного комплекса в 10-12, 20-22 и 28-30 нед беременности (метаболическая терапия, вазоактивные препараты и антиагреганты). 3. Коррекция и профилактика нарушений микробиоценозов организма беременной: бифидумбактерин, лактобактерин (не менее 15 доз в сутки), флоррадофилус (1 капсула 2 раза в сутки) внутрь в течение 10-14 дней, ацилакт или лактобактерин вагинально. Курсы проводят в критические сроки беременности или сочетают с курсами антибактериальной терапии. 4. Лечение половых партнеров.
Вирусные заболевания эмбриона и плода
Краснуха. Наибольшую опасность для эмбриона с точки зрения тератогенного действия представляет вирус краснухи. При беременности риск заражения краснухой существует в случае отсутствия в крови матери антител к антигену вируса краснухи. Если женщина заболевает краснухой в первые 2 мес беременности, то вероятность инфицирования эмбриона достигает 80 %, а возникновения уродства – 25 %. Поражение эмбриона вирусом краснухи может закончиться его гибелью (эмбриотоксический эффект) или возникновением врожденных пороков сердца, глухоты, катаракты, микроофтальмии, хориоретинита и микроцефалии. Инфицирование плода в более поздние сроки может сопровождаться появлением у новорожденного типичных кожных высыпаний, которые вскоре исчезают.Принимая во внимание высокий риск возникновения эмбриопатий в случае развития заболевания в первые 3 мес беременности, необходимо ее прерывать. Введение глобулина беременным, больным краснухой, приводит к незначительному снижению частоты аномалий развития плода.
Ребенок, родившийся у женщины, перенесшей во время беременности краснуху, является носителем вируса, поэтому необходима его изоляцияПри подозрении на контакт беременной с больным краснухой, в случае, если она не болела ею в детстве или более позднем возрасте, необходима вакцинация, но не ранее 8-10 нед гестации, так как с этой целью используют живую ослабленную вакцину и возможен тератогенный эффект. По рекомендации ВОЗ женщинам детородного возраста вне беременности проводят тестирование крови на наличие соответствующих антител. Мерой профилактики является иммунизация вакциной краснухи школьниц и женщин детородного возраста.
Цитомегаловирусная инфекция.
Цитомегаловирус (CMV) – наиболее распространенный из известных вирусов, передающихся плоду во внутриутробном периоде развития.
При заражении CMV увеличивается вероятность прерывания беременности, самопроизвольного выкидыша, преждевременных родов, антенатальной гибели плода, аномалий развития, многоводия, неразвивающейся беременности. В первые два триместра беременности вероятность инфицирования наименьшая – около 20 %, к концу беременности она достигает 40 % . Отмечается корреляция между титрами вирусных антигенов в крови новорожденных и выраженностью клинических проявлений цитомегаловирусной инфекции.
Выделение CMV из организма беременной не означает наличия у нее острого заболевания. В большинстве случаев формируется бессимптомное вирусоносительство или субклиническая хроническая инфекция. У 10-20 % серопозитивных беременных могут возникнуть обострение и реактивация процесса с развитием ВУИ у 1-2 % из них. Первичная CMV-инфекция возникает у 1 – 4% беременных, у 40 – 50% из которых существует риск развития ВУИ. CMV-инфекцию выявляют у 0,2-2,2 % родившихся живыми детей, в то время как клинические проявления отмечаются лишь у 10 % этих новорожденных. У детей возникает специфическое нарушение функции клеточного звена иммунитета – угнетение активности Т-хелперов, а также увеличение содержания IgM и IgG. Бессимптомное носительство вируса цитомегалии выявляют у 90 % новорожденных. Летальность при врожденной CMV-инфекции достигает 20-30 %, а у 90 % выживших детей отмечаются поздние осложнения (потеря слуха, задержка умственного и физического развития, хориоретинит, атрофия зрительного нерва, дефекты роста зубов и т.д.). При хронической или латентной CMV-инфекции показано сероиммунологическое исследование не реже 1 раза в 1,5-2 мес для выявления IgM или увеличения концентрации суммарных противоцитомегаловирусных антител. В случае реактивации инфекции и при наличии острого процесса во время беременности отдельные авторы рекомендуют определять специфические антитела класса IgM в крови плода.
Лечение заключается в проведении курсов пассивной иммунизации противоцитомегаловирусным иммуноглобулином (3 мл внутримышечно 1 раз в 3 дня, 5 инъекций на курс). Число курсов зависит от особенностей течения инфекционного процесса. Специфический противовирусный препарат ацикловир применяют по строгим жизненным показаниям, обусловленным состоянием матери и новорожденного. Перспективным является использование виферона, который представляет собой рекомбинантный а2-интерферон, ассоциированный с антиоксидантами. Он обеспечивает снижение колонизации родовых путей вирусами и бактериями, восстанавливает микро-биоценоз влагалища, в результате чего значительно уменьшается риск интранатального инфицирования плода. Виферон дает интерферонокорригирующий, иммуномодулирующий и антиоксидантный эффекты. Препарат Применяют в индивидуально подобранных дозах под контролем интерферонового статуса и функций фетоплацентарного комплекса. Препарат вводят Ректально в течение 5-10 дней, средняя курсовая доза виферона составляет 2.5 мл ME. Вопрос о медицинских показаниях к прерыванию беременности требует индивидуального подхода, базирующегося на применении ряда современных методов обследования для контроля за состоянием и развитием плода
Простой герпес.
Вирус простого герпеса (HSV) играет значительную роль в акушерской практике HSV-2. или генитальный вирус герпеса, вызывает неонатальную инфекцию в 75-80 % случаев. При хроническом течении герпеса интранатально инфицируются 0,5-1 % плодов, а при остром генитальном герпесе и явном обострении хронического (что проявляется пузырьковыми поражениями кожи и слизистых оболочек у матери) риск инфицирования плода в родах достигает 40 %.
При герпетической инфекции поражения плаценты и плода могут возникать при любом сроке беременности и приводить к формированию врожденных пороков развития, антенатальной гибели плода или преждевременным родам.
Неблагоприятные исходы для плода в основном связаны с трансплацентарным (гематогенным) путем передачи заболевания. Инфицирование восходящим путем (из шейки матки) сопровождается размножением и накоплением возбудителя в околоплодных водах и проявляется в виде многоводия. Возможно и постнатальное инфицирование новорожденных при наличии герпетических проявлений на коже у матери, других родственников или медицинского персонала.
Инфицирование плода при сроке беременности до 20 нед приводит к спонтанному аборту или аномалиям развития плода в 34 % случаев, при сроке от 20 до 32 нед – к преждевременным родам или антенатальной гибели плода в 30-40 % случаев, после 32 нед – к рождению больного ребенка с поражением кожи (герпетические высыпания, изъязвления), которое встречается достаточно редко, глаз (катаракта, мпкрофтальмия, хориоретинит) и ЦНС (микроили гидроцефалия, церебральные некрозы). Следует отметить тяжесть проявлений герпетической инфекции у новорожденных: менингоэнцефалит, сепсис. Летальность достигает 50%. У выживших детей в дальнейшем возникают тяжелые осложнения (неврологические расстройства, нарушения зрения, отставание в психомоторном развитии).
При наличии у беременной герпетической инфекции характер профилактических и лечебных мероприятий, а также акушерская тактика зависят от характера высыпаний (первичный или .рецидивирующий герпес), наличия поражений половых органов, состояния плодных оболочек.
При первичном инфицировании беременной в ранние сроки беременности необходимо ставить вопрос о ее прерывании. Если же заболевание возникает в более поздние сроки или женщина была инфицирована до наступления беременности, мероприятия заключаются в проведении динамического ультразвукового контроля за развитием и состоянием плода, назначении курсовой терапии, включающей препараты, воздействующие на метаболизм, стабилизаторы оеточных мембран, унитиол, иммуномодуляторы. Вопрос о прерывании Беременности решают в каждом случае строго индивидуально. В качестве противовирусной терапии применяют ацикловир. Назначение препарата в I триместре при псосложненном течении инфекции нежелательно. Во II триместре ацикловлр назначают по 200 мг внутрь каждые 4 ч, однако при осложненном течении заболевания (пневмония, энцефалит, коагулопатия) необходимо внутривенное введение прспарата по 7,5 мг/кг через 8 ч в течение 14 дней. Одновременно целесообразно использовать препараты интерферона, а также природные антиоксиданты (витамины Е и С). Из ннгерферонов (реаферон, полудан, виферон) предпочтение следует отдать вифероиу. Его вводят так же, ках при CMVинфекции ректально в виле свечей в течение 5- 10 дней, средняя курсовая доза составляет 2,5 мл ME.
На фоне ремиссии во время беременности необходима иммуномодулируюшая терапия с последующим использованием герпетической вакпины, дающей выраженный противорецидивный эффект. Параллельно назначают адаптогены растительного происхождения в сочетании с витаминами. В качестве и мму но модуляторов используют лазерное облучение крови, плазмаферез и энтеросорбиию.
Особого внимания заслуживает тактика ведения родов у женщин с первичным и рецидивирующим герпесом. Метол родоразрешения зависит от наличия или отсутствия поражения половых органов в конце беременности, выделения вируса герпеса и времени, прошедшего с момента разрыва плодных оболочек. В случае герпетического поражения половых органов женщины в конце беременности родоразрешение рекомендуется проводить путем кесарева сечения.
Вирусный гепатит.
Вирусный гепатит (ВГ) – тяжелое заболевание печени. Известно пять типов ВГ: гепатит А, гепатит В, гепатит дельта, вызываемый дельта-агентом, ассоциированным с вирусом гепатита В, гепатит С и гепатит Е. Гепатит С известен как гепатит ни А ни В.
Выраженная клиническая картина заболевания (тошнота, рвота, головная боль, недомогание) предшествует желтухе в течение 1-2 нед. С появлением желтухи выраженность этих симптомов уменьшается, но сохраняются боли в области печени и болезненность при ее пальпации. Уровень трансаминаз варьирует, его максимальное повышение отмечается к началу развития желтухи. Выздоровление наступает через 1-2 мес.
Летальность высокая. У 5-10 % больных гепатитом В развивается хроническая форма с циррозом печени и без него.
Гепатит А.
Вирусный гепатит А вызывается РНК-содержашим пикорнавирусом. Инфекция передается фекально-оральным путем. Инкубационный период от 2 до 7 нед. Серологически наличие гепатита подтверждается при повышении уровня трансаминаз. Раннее выявление гепатита проводят путем определения IgM как маркера острого процесса. В период выздоровления преобладают IgG, которые отвечают за иммунитет против вируса гепатита А. Эффективность вакцины против вируса гепатита А 97 %.
Беременные с легкими формами гепатита А находятся под амбулаторным наблюдением акушера-гинеколога и инфекциониста. Тератогенность вируса гепатита А не доказана. Риск передачи вируса плоду незначителен, но вертикальная передача инфекции, происходящая в момент родов, установлена. У беременных с гепатитом А часто наблюдаются преждевременные Роды.
При контакте беременных с больным гепатитом А необходимо с профилактической целью ввести у-глобулин.
Гепатит В.
Гепатит В вызывается ДНК-солержащим вирусом. Вирус гепатита В (частица Дейна), антигены HbAg, HbsAg, HbcAg и соответствующее антитела можно определить при помощи различных иммунологических -тодов. В клинической практике у беременных наиболее часто наблюдается острый гепатит. Гепатит В перелается через инфицированные препараты крови, слюну, сперму и выделения из влагалища. Маркером гепатита В является HbsAg.
При гепатите В отмечается повышенная частота преждевременных родов и самопроизвольных абортов. Транс плацентарная передача гепатита В наблюдается редко, заражение чаше происходит во время родов. Возможно также заражение гепатитом В при грудном вскармливании. Течение гепатита у новорожденных может быть бессимптомным, но иногда развивается некроз печени. Более 85 % детей – бессимптомных носителей гепатита В потенциально могут заразить других новорожденных.
Исследования по выявлению антигенных маркеров и определению количества циркулирующих частиц показали, что возможность вертикальной передачи гепатита В зависит от иммунного статуса матери. Вертикальная передача инфекции наблюдается у матерей с определяемым поверхностным Hbs-антигеном, а у матерей с позитивным НВс-антигеном и негативным поверхностным антигеном она отсутствует. Если беременная перенесла острый гепатит В, то, дети рождаются, как правило, с небольшой массой тела.
В настоящее время общепринято проведение скрининга для выявления гепатита. Если у родильницы имеется поверхностный антиген, то в первые 12 ч новорожденному вводят одну дозу (0,5 мл) иммуноглобулина внутримышечно, затем трехкратную рекомбинантную вакцину (5 мкг/0,5 мл). Вторую п третью дозы вакцины вводят на 1-м и 6-м месяце жизни. В возрасте 12 и 15 мес выполняют тестирование на HbsAg и антитела к нему.
Женщинам из группы высокого риска заражения, но с отрицательным HbsAg во время беременности с профилактической целью вводят иммуноглобулин. Не рекомендуется изолировать новорожденных от матерей, являющихся носительницами HbsAg. Однако в случае возникновения у матери трещин сосков или мастита при грудном вскармливании повышается риск передачи гепатита В.
Гепатит дельта
Вирус гепатита дельта – дефектная вирусная РНК в сочетании с поверхностным антигеном В, находится в крови только в сочетании с вирусом гепатита В. Пути передачи такие же, как при гепатите В.
Гепатит С, или ни А ни В.
Носительство антител к вирусу гепатита С отмечается у 1,5-5,2 % беременных. Вирус из группы флавовирусов, передаваемый через кровь, содержит РНК. Если при гепатите С заражение происходит при гемотрансфузии, то у 40 % больных в течение 5 лет развивается хронический гепатит, а у 20 % женщин через 10 лет – цирроз печени. Пути передачи инфекции такие же, как при гепатите В. Антитела к вирусу гепатита С не определяются в течение 15 нед после острой инфекции, а у части больных их нельзя выявить и до года.
Факторами риска являются различные внутривенные инъекции, сексуально-трансмиссивные заболевания и частая смена половых партнеров, большое количество родов в анамнезе, гемотрансфузии, введение наркотиков внутривенно.
Для гепатита С характерна вертикальная передача вируса. Установлено, что инфицируются 6 % плодов. Исследования РНК в крови показали, что Ю % новорожденных были инфицированы при наличии позитивной РНК в крови матери. Беременные, у которых получены отрицательные результаты тестов на РНК, но положительные – на антитела к вирусу гепатита С, не передавали инфекцию детям.
Гепатит Е.
Заражение вирусом гепатита Е происходит фекал ьно-оральным путем. Серологическая диагностика этого вируса гепатита находится в стадии разработки, однако данные, полученные при обследовании беременных, свидетельствуют о высокой частоте трансплацентарной передачи вируса.
Профилактика заражения персонала вирусным гепатитом заключается в использовании двух пар перчаток при приеме родов и выполнении хирургических операций.
Грипп.
При гриппе, протекающем у беременных в тяжелой форме (обычно в период эпидемий), возможно поражение эмбриона и плода. Наблюдаются самопроизвольное прерывание беременности (эмбриотоксический эффект), аномалии развития, гибель плода, рождение недоношенных и функционально незрелых детей. Перинатальная смертность повышена. Влияние гриппозной инфекции обусловлено не только прямым воздействием возбудителей на плаценту и плод, но и выраженной интоксикацией, гипертермией и нарушением маточно-плацентарного кровообращения с развитием в последующем гипоксии плода. Профилактика эмбриои фетопатии при гриппе заключается в проведении обших мероприятий, направленных на предупреждение этой инфекции. Во время вспышек гриппа беременных целесообразно иммунизировать поливалентной убитой вакциной.
Парвовирусная инфекция.
Поскольку при парвовирусной инфекции специфической терапии не существует, для профилактики тяжелых осложнений рекомендуется использовать иммуноглобулин.
Коксаки-внрусная инфекция.
Инфицирование в 1 триместре беременности происходит редко, но может приводить к формированию пороков развития желудочно-кишечного и мочеполового трактов, центральной нервной системы. При инфинировании в поздние сроки беременности у новорожденного возможны следующие клинические проявления: лихорадка, отказ от еды, рвота, гипотония, кожные высыпания, судороги. У части новорожденных отмечаются отит, назофарингит, пневмония.
ВИЧ-инфекция.
У некоторых ВИЧ-инфицированных женщин, родивших детей с синдромом приобретенного иммунодефицита, во время беременности не отмечается симптомов заболевания. Часто имеют место рожденис плода с небольшой массой тела и преждевременные роды. Возможность внутриутробного заражения плода от матери, инфицированной ВИЧ подтверждают случаи обнаружения антигенов вируса в тканях плода и амниогической жидкости. Возможны 3 пути преодоления вирусом плацентарного барьера: 1. перенос свободного вируса в результате повреждения плацентарного барьера и взаимодействия лимфоцитов плода с Т4-рецепторами 2. первично инфицируется плацента, вторично – плод; носителями вируса являются клетки Гофбауэра плаценты, посредством которых возможна гране плацентарная передача; 3. переход во время родов из пораженных клеток в области шейки матки и влагалища через слизистые оболочки плода. ВИЧ-инфекцией от матери заражаются 20-30 % новорожденных.
У детей, инфицированных ВИЧ, отмечаются кожные проявления в виде бактериальной, грибковой и вирусной экзантем. В течение первого года жизни проявления ВУИ обнаруживают в среднем у 7,9 % детей, рожденных от серопозитнвных матерей.
В настоящее время для лечения приобретенного иммунодефицита применяют зидовудин, являющийся аналогом нуклеозидов и обладающий противовирусной активностью. Фактов тератогенности данного препарата не установлено, однако применение его у ВИЧ-инфицированных в ранние сроки беременности должно быть строго обоснованным. Главная цель назначения препарата серопозитивным беременным – предотвращение пере-, дачи вируса плоду. Зидовудин назначают в дозах от 300 до 1200 мг/сут. Лечение ВИЧ-инфицированных беременных зидовудином может быть дей-ственным методом профилактики развития ВИЧ-инфекции у детей раннего возраста, поскольку передача вируса плоду возможна через плаценту, а новорожденному – при прохождении через инфицированные родовые пути и, особенно, через материнское молоко. С целью профилактики необходимо прекратить кормление ребенка грудью.
Внутриутробная бактериальная инфекция плода
Внутриутробная бактериальная инфекция плода может быть вызвана как патогенными (стафилококк, стрептококк и др.), так и условно-патогенными (энтеробактерии. клебсиеллы, протей и др.) микроорганизмами, а также микоплазмами. Возбудители инфекции могут проникать в организм плода трансплацентарно при наличии в организме матери очагов фокальной инфекции (тонзиллит, гайморит, кариес зубов, пиелонефрит и др.) и восходящим путем, главным образом при дородовом или раннем излитии околоплодных вод. Помимо нарушения целости плодного пузыря, развитию вос-ходящей инфекции способствуют наличие кольпитов, цервицитов, применение некоторых инвазивных методов оценки состояния плода (амкиоскопия, амниоцентез, кордоцентез и др.), многочисленные влагалищные исследования, проводимые во время родов, истмико-иервикальная недостаточность.При инфицировании плодного яйца в ранние сроки беременности эмбрион обычно погибает и беременность заканчивается самопроизвольным абортом. Тератогенного действия не наблюдается. В поздние сроки беременности развитию восходящей инфекции способствует разрыв плодных оболочек, однако в ряде случаев инфекция возникает и при целом плодном пузыре. Решающее значение в генерализации внутриматочной инфекции имеет микробное обсеменение околоплодных вод, которые обладают слабой антимикробной активностью, особенно в отношении кишечной палочки, клебсиеллы. золотистого стафилококка и кандид. Активность околоплодных вод проявляется кратковременным невыраженным бактериостатическим эффектом.
Аспирация инфицированных вод плодом приводит к. его внутриутробному заражению (инфекционная фетопатия). Одновременно происходит инфицирование плодных оболочек (хориоамнионит).
Клиническая картина внутриутробной бактериальной инфекции складывается из симптомов хориоамнионита (повышение температуры тела, озноб, тахикардия, гноевидные выделения из половых путей, лейкоцитоз и др.) и нарушений состояния плода (тахии брадикардия), изменений КТГ плода при мониторном контроле. Если при явлениях хориоа\гнионита не возникает самостоятельная родовая деятельность, то необходимо приступить к медикаментозному родовозбуждению с помощью простагландинов или окситоцина. Одновременно начинают интенсивную антибактериальную терапию (сочетание оксациллина с канамиинном, ампициллин, пепорин и др.). Важнейшим принципом успешной терапии внутриутробной бактериальной инфекции является создание в крови плода и амниотической жидкости эффективных антимикробных концентраций препаратов, поэтому дозы антибиотиков должны быть относительно высокими: оксациллин по 4-6 г и канамицин по 1 г внутримышечно, ампициллин по 4-6 г, цепорин по 2-3 г внутримышечно и внутривенно.
Ребенку, рожденному матерью, у которой отмечаются клинические проявления внутриутробной инфекции, назначают антибактериальную терапию первоначально теми же антибиотиками, а затем их можно заменить в зависимости от характера выделенной микробной флоры и ее чувствительности к антибиотикам.
Урогениталъный хламидиоз (УГХ). Это заболевание привлекает к себе пристальное внимание в связи со значительным числом акушерских и перинатальных осложнений. УГХ диагностируют у 3-12 % беременных, при хронических заболеваниях урогенитального тракта частота его достигает 51 – 70%. Неблагоприятное влияние УГХ на рост и развитие плода проявляется в виде хламидийной фетопатии (хроническая гипоксия и задержка роста плода). У 40-50 % новорожденных выявляют клинически выраженную ВУИ – конъюнктивит (у 35-50 %) и пневмонию (у 11 – 20%). Так называемые отсроченные конъюнктивиты развиваются в инкубационном периоде, продолжительность которою 5-14 дней. Одновременно могут проявляться и другие признаки врожденного хламидиоза: фарингит, отит, вульвовагинит, уретрит, пневмония. У недоношенных детей после пневмонии возможно развитие генерализованной инфекции и специфического миокардита, описаны случаи хламидийного менингита и энцефалита.
Лечение беременных заключается в проведении 10- 14-дневных курсов этиотропной антибактериальной терапии, количество которых зависит от выраженности инфекционного процесса и течения беременности. Антибиотиком выбора является эритромицин. Низкий индекс плацентарной проницаемости является недостатком этого препарата при лечении ВУИ, в связи с чем его назначают по 2 г в сутки в перерывах между приемом пищи. Эффективны также аналоги эритромицина – эригексал, эрик, эрацин. эритРан. Джозамицин (вильпрафен) по спектру антимикробного действия близок к эритромицину, практически не дает побочных эффектов, не разрушается в кислой среде желудка, а по эффективности воздействия на хламидии приравнивается к доксициклину. Препарат назначают по 2 г в сутки в 2-3 приема в течение 10-14 дней. При индивидуальной непереносимости природных макролидов допустимо назначение клиндамицина по 0,3-0,45 г 4 раза в день внутрь или по 0,3-0,6 г в сутки внутримышечно. В клинике доказана эффективность амоксициллина. Препарат применяют внутрь или внутримышечно по 0,5-1 г в сутки. С учетом способности хламидии образовывать L-формы при использовании полусинтетических пенициллинов широкое применение амоксициллина нецелесообразно.
Урогенитальные микоплазмозы.
Заболевания, вызываемые M.hominis и Ur.urealyticum, диагностируют у 2-8 % беременных, а у больных с хроническими урогенитальными заболеваниями и отягощенным акушерским анамнезом частота их достигает 16-40 %. У каждой четвертой больной во время беременности инфекция протекает в виде бактерионосительства. С персистенцией этой инфекции связывают такие акушерские осложнения, как невынашивание беременности, задержка роста плода, хориоамнионит, возникающий при интактных плодных оболочках. Плацентиты выявляют у 23 % беременных с микоплазмозом, причем у подавляющего большинства из них воспалительные изменения в плаценте сочетаются с многоводней. Инфи-цирование микоплазмами и уреаплазмами диагностируют у 1-3 % новорожденных. \
Наиболее частым клиническим проявлением ВУИ является пневмония. Отмечается склонность к гематогенной диссеминации инфекции, обусловливающей тяжелое течение заболевания (неврологическая симптоматика, геморрагический и гепатолиенальный синдромы, острая гидроцефалия). У недоношенных новорожденных микоплазмы вызывают развитие пневмонии, менингита, генерализованной инфекции. При запоздалых диагностике и лечении ВУИ осложнения возникают у 37-51 % новорожденных, а при своевременно проведенной этиотропной терапии они наблюдаются в 6 раз реже. Лечение беременных существенно не отличается от такового при УГХ. Достаточно эффективными антибиотиками в отношении микоплазменной инфекции являются гентамицин и линкомицин.
Гонорея.
Во время беременности гонорея характеризуется стертой клинической картиной. У 70-80 % больных очаги поражения локализуются в области уретры и цервикального канала. Беременность и роды на фоне гонореи протекают неблагоприятно. Инфицирование плода происходит преимущественно восходящим путем, чаще интранатально. Основным проявлением гонореи новорожденных является гонобленнорея с симптомами гнойного конъюнктивита. Нелеченая гонобленнорея нередко приводит к слепоте, составляя 24 % от всех причин, обусловливающих эту патологию. Часто наблюдаются внутриутробная задержка роста плода, патологическое уменьшение массы тела в раннем неонатальном периоде, нарушение адаптационных реакций, затя]гувшееся течение конъюгационной желтухи. У ослабленных и недоношенных новорожденных может развиться генерализованная гонококковая инфекция. Лечение гонореи антибиотиками пенициллин ового ряда проводят при любом сроке беременности. В случае неэффективности последних применяют эритромицин, цефалоспорины второго и третьего поколений, аминогликозиды.
Стрептококковая инфекция.
Стрептококк группы В выделяют из родовых путей у 5-35 % беременных, большинство которых являются бактерионосителями. Доказан половой путь передачи этой инфекции. Механизм развития ВУИ – восходящий. Инфицирование плода, преимущественно интранатальное, происходит в 65-72 % случаев. Несмотря на то что тяжелые формы ВУИ – пневмония, менингит, сепсис развиваются только у 1 -2 % новорожденных, при этих заболеваниях отмечается высокая летальность (до 5 %) даже при условии своевременно начатой этиотропной терапии. Антенатальный курс антибиотикотерапии препаратами из группы пенициллинов и продолжение ее в родах позволяют предотвратить развитие тяжелых форм ВУИ, вызванных стрептококком группы В.
Листериоз.
Типичной внутриутробной инфекцией является листериоз. Организм беременной обладает повышенной чувствительностью к этой инфекции. Инфицирование плода происходит трансплацентарно после васкуляризации плаценты (на III месяце внутриутробной жизни). Листерии, циркулирующие в лакунах межворсинчатого пространства, поражают ткани плаценты, где развивается воспалительный процесс с образованием специфических гранулем. Отсюда паразиты проникают в артериальный кровоток плода и разносятся по органам и тканям. Сравнительно быстро возбудители инфекции начинают выделяться с мочой и меконием в амниотическую жидкость, откуда они попадают в легкие и желудочно-кишечный тракт плода, усиливая внутриутробную бактериемию. Антенатальное заражение листериозом в ранние сроки беременности быстро приводит к гибели плода, и беременность заканчивается самопроизвольным абортом. В более поздних стадиях внутриутробного развития инфекция проявляет себя в виде сепсиса с возникновением специфических гранулем в органах и тканях. У новорожденных клиническая картина врожденного листериоза проявляется аспирационной пневмонией и нарушением мозгового кровообращения. Часто поражаются орган слуха (отит), ЦНС (менингеальные явления) и печень. Нередко выявляются характерные кожные высыпания: папулы величиной с булавочную головку или просяное зерно с красным ободком по периферии, локализующиеся на спине, ягодицах и конечностях. Подобные высыпания при осмотре можно увидеть на слизистой оболочке глотки, зева, конъюнктиве. При бактериологическом исследовании возбудителя инфекции удается получить из содержимого кожных папул, мекония, мочи и цереброспинальной жидкости. Важное значение в диагностике имеет обнаружение специфических антител в крови матери и плода.
Лечение проводят антибиотиками. Ампициллин применяют в дозе 2-3 г/сут в течение недели с повторением курса через 2-4 нед. Детям, у которых при рождении отмечались симптомы врожденного листериоза, также показано лечение этим антибиотиком.
Врожденный токсоплазмоз.
Заболевание может возникнуть только при заражении матери во время беременности. Токсоплазмоз чаще возникает у женщин, тесно контактирующих с животными (овцами, кошками). Характерны разнообразные клинические проявления: увеличение лимфатических узлов, печени и селезенки, миокардит, пневмония и др. Токсоплазмоз может сопровождаться эндометритом, поражением плаценты, угрозой прерывания беременности, задержкой внутриутробного роста плода. Передача инфекции происходит трансплацентарно. Исход внутриутробной инфекции зависит от сроков инфицирования беременной. В ранние сроки беременности инфицирование эмбриона нередко заканчивается его гибелью. В других случаях возможны аномалии развития: анэнцефалия, анофтальмия, микроцефалия, расщепление верхней губы, челюсти и неба (волчья пасть) и др. При заражении в более поздних стадиях развития плода при его рождении может быть выявлена характерная триада симптомов: гидроцефалия, хориоретинит и менингоэнцефалит с внутримозговыми петрификатами. Если заражение произошло незадолго до родов, то у плода возникают симптомы висцераль-ного генерализованного токсоплазмоза: гепатоспленомегалия, интерстициальная пневмония, миокардит и энцефалит. Внутриутробное поражение фетоплацентарного комплекса устанавливают при УЗИ: большая толщина плаценты или развитие отечного синдрома, гепатоспленомегалия.
Помимо тяжелых острых форм врожденного токсоплазмоза, могут наблюдаться легкие и даже первично-латентные формы, при которых возможны обострения заболевания спустя несколько месяцев и лет после первичного инфицирования.
Диагностика токсоплазмоза у беременных сопряжена со значительными трудностями. Заболевание диагностируют на основании обнаружения возбудителей в тканях и жидкостях больной и результатов серологических исследований, из которых наибольшее значение имеет иммунофлюоресценция специфических антител.
Профилактика и лечение врожденного токсоплазмоза заключаются в назначении беременной сульфаниламидных препаратов и антипротозойных средств. Наиболее часто используют сульфадимезин и хлоридин. Каждый., курс состоит из двух циклов. Первый курс проводят с 6-й по 12-ю неделю беременности только сульфадимезином, так как хлоридин в ранние сроки беременности противопоказан в связи с опасностью тератогенного воздействия на плод (первый цикл: сульфадимезин по 0,5 г 3 раза в день в течение 7 дней, после 10-дневного перерыва – такой же второй цикл). Второй курс лечения проводят между 12-й и 26-й неделей беременности (первый цикл: хлоридин по 0,025 г 2 раза в день в первые 5 дней, затем сульфадимезин по 0,5 г 3 раза в день в течение 7 дней; после 10-дневного перерыва необходим аналогичный второй цикл лечения). Третий курс лечения – с 26-й по 39-ю неделю беременности (см. схему второго курса).
Врожденный сифилис.
При заболевании матери сифилисом до беременности поражение плода возникает только во второй ее половине, когда бледные трепонемы начинают проникать через эпителий ворсин в вену пуповины. Большинство детей при рождении выглядят здоровыми, у некоторых имеются везикулезно-буллезные высыпания на ладонях и подошвах. Однако спустя 4 дня – 3 нед после рождения могут появляться различные симптомы заболевания: 1. Синдром, сходный с гриппом: менингеальные симптомы; слезотечение (воспаление радужки); отделяемое из носа; слизистые оболочки гиперемированные, отечные, эрозированные, изобилуют бледными трепонемами – ангина; из-за болей отсутствуют активные движения в конечностях – псевдопаралич Парро; на рентгенограмме видны явления остеохондрита, часто отмечается периостит, в частности больших берцовых костей (саблевидные голени). 2. Увеличение лимфатических узлов всех групп (шейные, локтевые, паховые, подмышечные, подколенные); гепатоспленомегалия, в тяжелых случаях – анемия, пурпура, желтуха, отеки, гипоальбуминемия. 3. Высыпания: пяти исто-папулезные; слияние папулезных поражений с образованием широких кондилом.
Лечение сифилиса во время беременности проводят в соответствии с общими принципами и методами.
Гестационная трофобластическая болезнь
Одним из заболеваний хориональной оболочки является гестационная трофобластическая болезнь (термин "гестационная" необходим, потому что трофобластическая болезнь может быть связана как с беременностью, так и с заболеваниями яичников или яичек у мужчин).Гестационная трофобластическая болезнь характеризуется пролиферативными изменениями ткани хориона, что приводит к повышенному выделению хорионического гонадотропина. При заболевании ворсин хориона в яичниках часто образуются тека-лютеиновые кисты, которые подвергаются обратному развитию после удаления очага заболевания.
Трофобластическая болезнь включает в себя пузырный занос (hydatidioform mole) и трофобластические опухоли, которые в свою очередь делятся на инвазивный, или деструируюший, пузырный занос (invasive mole) и хориокарциному (хорионэпителиома). Инвазивный пузырный занос характеризуется значительной пролиферативной активностью, но, как правило, не приводит к метастазам в отличие от хориокарциномы.
Пузырный занос.
При пузырном заносе ворсины хориона приобретают вид пузырьков, заполненных светлой жидкостью. Пузырьки величиной от просяного зерна до вишни расположены на шнуровидных стебельках, между которыми находятся участки децидуальной оболочки. Скопления пузырьковидно измененных ворсин по внешнему виду напоминают гроздья винограда. В центре пузырного заноса иногда обнаруживают остатки плодного яйца, там же могут находиться и распадающиеся ткани эмбриона (рис. 16.5). При гистологическом исследовании обнаруживают пролиферацию эпителия ворсин, отек ворсин и промежуточного вещества. Вследствие отека клеточные элементы смещаются к периферии. Кровеносные сосуды часто не просматриваются. Пузырный занос может быть полным или частичным.При полном пузырном заносе наблюдаются: 1. гидропическая дегенерация всех ворсин и отек их стромы; 2. отсутствие кровеносных сосудов; 3. пролиферация эпителия трофобласта различной степени; 4. отсутствие плода или эмбриона.
В 85-90 % случаев при полном пузырном заносе выявляют нарушение оплодотворения. Например, оплодотворяется "пустая" яйцеклетка, не содержащая хромосом, одним сперматозоидом, содержащим половинный набор хромосом (23Х), в последующем благодаря редупликации отцовский гаплоидный набор превращается в диплоидный с 46 хромосомами (46ХХ). В редких случаях "пустая" яйцеклетка оплодотворяется двумя сперматозоидами, в одном из которых содержится Х-хромосома, в другом – Y-хромосома.
При частичном пузырном заносе обычно обнаруживают триплоидный набор хромосом. Во время оплодотворения происходитсоединение одной яйцеклетки с обычным набором хромосом (23Х) с двумя сперматозоидами, в результате чего в последующем образуется триплоидный набор хромосом (69XXY или 69ХХХ). Появление экстрагаплоидного набора хромосом может быть связано с аномалией мейоза сперматозоидов во время первого или второго редукционного деления.
Нарушение оплодотворения приводит к гибели эмбриона или плода при полном пузырном заносе.
Частичный пузырный занос характеризуется частичным повреждением ворсин хориона, и плод может нормально развиваться, хотя чаще он погибает.
Этиология.
Причины возникновения заболевания до конца неясны. Возможно, определенную роль играют факторы питания. Результаты исследования, проведенного на Филиппинах, показали, что заболевание чаще встречается у женщин, живущих в плохих материально-бытовых условиях, питающихся преимущественно рисом и рыбой. Наиболее часто пузырный занос встречается в странах Юго-Восточной Азии и Латинской Америки. В Индонезии, например, один случай пузырного заноса приходится на 77 беременностей. Существуют еще две теории развития трофобластической болезни. Согласно одной из них, заболевание обусловлено патологией хориального эпителия плодного яйца. Вторая теория объясняет происхождение заболевания патологическими изменениями в организме матери, снижением его защитных сил, гормональными нарушениями. На возникновение и те чение трофобластической болезни определенное влияние оказывают особенности иммунного статуса половых партнеров.
Клиническая картина.
Для пузырного заноса характерны следующие признаки. 1. Обычно отмечаются задержка менструации, появление сомнительных признаков беременности, в связи с чем женщина считает себя беременной. 2. В I триместре беременности часто возникает маточное кровотечение:. Характер и интенсивность его могут быть различными: алого или темно-ко* ричневого цвета, скудное или обильное, требующее гемостатической, гемо* заместительной терапии. Иногда вместе с кровью выделяются пузырьки заноса. 3. Отсутствуют достоверные признаки беременности в виде определения частей, сердцебиения и движений плода, при ультразвуковом исследований в матке выявляют только мелко-кистозную ткань в отсутствие плода. 4. Увеличение матки не соответствует сроку беременности, что связано с большими размерами ворсин, скоплением крови между ними и стенкой матки. 5. В I триместре беременности могут появляться признаки гестоза в виде артериальной гипертензии, протеинурии, отеков, однако эклампсия встреч чается крайне редко. 6. В 50 % наблюдений определяются тека-лютеиновые кисты яичников.
Рождение пузырного заноса чаще происходит самостоятельно на 4-6 месяце беременности, при этом может возникнуть кровотечение различной интенсивности. При частичном пузырном заносе беременность может npoi должаться до X лунного месяца.
Опасность пузырного заноса заключается в том, что после него нередко, возникает злокачественная опухоль – хориокарцинома.
Диагностика.
Распознавание пузырного заноса основывается на описанных клинических признаках и результатах дополнительных исследований – ультразвукового, гистологического, определении высоких концентраций хорионического гонадотропина (р-субъединицы) и трофобластического (бета-глобулина в биологических жидкостях организма.
Пузырный занос следует дифференцировать от выкидыша, многоплодной беременности и хориокарциномы.
Лечение.
После установления диагноза пузырного заноса показано его удаление. Эвакуация пузырного заноса может быть осуществлена осторожно с помощью кюретки и вакуум-экскохлеатора. Выскабливание матки кюреткой опасно из-за возможности перфорации истонченной стенки матки, что исключается при использовании вакуум-экскохлеатора. При достаточном раскрытии маточного зева возможно проведение пальцевого удаления пузырного заноса. При значительном кровотечении и больших размерах матки (свыше 20 нед беременности) может быть произведена лапаротомия с гистерэктомией.
Если в течение 1-2 мес после удаления пузырного заноса показатели титра хорионического гонадотропина в крови не снижаются, то показаны проведение дополнительных исследований для исключения хориокарциномы и назначение противоопухолевых лекарственных средств (метотрексат, дактиномицин). В течение года после удаления пузырного заноса необходимо систематическое наблюдение за женщиной с определением уровня хорионического гонадотропина в крови или моче. Женщина должна предохраняться от беременности в течение 2 лет.
Инвазивный пузырный занос.
Характеризуется проникновением пузырьков заноса в толщу стенки матки (рис. 16.6).Клиническая картина характеризуется кровянистыми выделениями из матки после удаления из нее пузырного заноса, сохраняющимся увеличением размеров матки, болями внизу живота, крестце, пояснице, наличием тека-лютеиновых кист яичников, высоким уровнем хорионического гонадотропина в моче и крови.
Диагноз устанавливают при гистологическом исследовании опухоли в удаленной матке.
Лечение хирургическое: экстирпация матки с последующим назначением лекарственных препаратов, как при хориокарциноме.
Хориокарцинома.
Опухоль происходит из эпителиальных клеток ворсинок хориона, чаще локализуется в теле матки, реже – в области патологической имплантации: в маточной трубе, яичнике или брюшной полости (эктопическая хориокарцинома). Как правило, вначале хориокарцинома локализуется в области нидации плодного яйца, имеет вид опухоли различной величины синевато-багрового цвета. Рост опухоли может быть экзофитным или эндофитным. При экзофитном росте хориокарцинома выступает в по-лость матки. Эндофитный рост характеризуется внедрением опухоли в толщу миометрия вплоть до серозной оболочки матки. Редко опухоль с самого начала расположена в толще стенки матки. В матке иногда образуется несколько очагов хориокарциномы. Хориокарцинома может метастазировать во влагалище, кишечник, легкие, печень, мозг.Клиническая картина характеризуется прежде всего кровяными выделениями, обусловленными разрушением опухолью кровеносных сосудов. Вначале выделения умеренные, затем усиливаются. При расположении опухоли в толще стенки матки и разрушении серозного покрова органа возникает обильное внутрибрюшное кровотечение, как при эктопической беременности. Возможно кровотечение в брюшную полость из метастатических узлов в печени и кишечнике. Источником наружного крово-течения могут быть метастазы хориокарциномы во влагалище.
Важный симптом – быстро прогрессирущая анемия, которая является следствием как маточных кровотечений, так и интоксикации, обусловленной всасыванием продуктов распада опухоли, В связи с некрозом и инфицированием узлов хориокарциномы может развиться лихорадочное состояние.
Клиническая картина заболевания в значительной мере обусловлена возникновением метастазов. При поражении легких появляются кашель с мокротой, боли в груди. Метастазы в головном мозге вызывают боли И другие неврологические симптомы, связанные с локализацией метастатических узлов. Метастазы в органах пищеварения вызывают тошноту, рвоту, боли, кровотечения.
Стенки влагалища и шейки матки цианотичны, матка увеличена, у 50 % больных появляются тека-лютеиновые кисты. Молочные железы могут быть увеличены, из них выделяется молозиво, ареолы пигментированы.
Клетки хориокарциномы обладают выраженной способностью вырабатывать хорионический гонадотропин (ХГ), циркулирующий в крови и экскретируемый с мочой, и трофобластический р-глобулин (ТБГ), секретаруемый в кровь.
Диагноз хориокарциномы основывается на клинических данных и результатах определения уровня ХГ в крови и моче, ТБГ в сыворотке крови, гистологического исследования соскоба из матки, ангиографии, рентгенологического исследования легких.
В анамнезе больных имеются указания на появление кровотечений из половых органов после беременности и в особенности после пузырного заноса. Кожный покров и слизистые оболочки бледные, лицо становится как бы стекловидным из-за резкой анемии. Тело матки увеличено и соответствует 8 нед беременности и более, имеет мягковатую консистенцию, что симулирует беременность. При бимануальном исследовании определяют пульсацию маточных сосудов и увеличенные яичники.
Большое значение имеет осмотр шейки матки при помощи зеркал, при котором можно обнаружить метастазы опухоли во влагалище в виде темнокрасных возвышений и узелков.
Важную роль в распознавании заболевания играет определение большого содержания ХГ в моче и сыворотке крови, однако при выраженном некрозе опухоли уровень ХГ может быть низким. С успехом применяют иммунологический тест на ТБГ, который у 95 % больных оказывается положительным.
Существенное значение в диагностике хориокарциномы имеет гистологическое исследование соскоба из матки, в котором обнаруживают элементы опухоли. Отрицательные или сомнительные результаты микроскопического исследования не дают основания полностью исключить диагноз хориокарциномы, поскольку опухоль может подвергнуться некрозу на поверхности или располагаться в толще миометрия.
Окончательный диагноз может быть установлен только при гистологическом исследовании материала; в его отсутствие на основании клинической картины заболевания диагностируют трофобластическую опухоль.
Хориокарциному следует дифференцировать от неполного выкидыша, эктопической беременности, плацентарного полипа, субмукозной миомы матки и дисфункциональных маточных кровотечений.
Лечение.
Для лечения больных с хориокарциномой могут быть применены лекарственные противоопухолевые средства, оперативное вмешательство и лучевая терапия.
Маловодие, многоводие
Маловодие (oligohydramnios) – уменьшение количества околоплодных вод Д° 500 мл и менее, связанное с нарушением процессов их секреции и резорбции. Полное отсутствие околоплодных вод называют агидрамнионом.Число случаев маловодия широко варьирует (0,3-0,4 % всех родов), но при врожденных пороках развития отмечается в 10 раз чаще. Современные данные, основанные на результатах ультразвукового обследования женщин в течение II и III триместров беременности, свидетельствуют о его более частой диагностике.
При анализе течения беременности, родов и раннего неонатального периода у женщин с маловодием, возникшем на фоне различных заболеваний, выявлен ряд тяжелых осложнений. Крайне неблагоприятный прогностический признак – выраженное маловодие во II триместре беременности. При маловодий в сроки 18-26 нед происходят прерывание беременности, антенатальная гибель плода или новорожденного в первые дни жизни! Существует четкая зависимость между маловодием и частотой врожденных пороков развития плода, внутриутробной задержкой его роста и перинатальной смертностью. Наиболее часто маловодие сочетается с такими пороками развития, как двусторонняя агенезия почек, двусторонняя поликистозная дисплазия почек, синдром Поттера 1-го и 2-го типов.
При олигогидрамнионе высок риск компрессии пуповины и внутриутробной гибели плода. У беременных с маловодием возрастает опасность внутриутробного инфицирования плода. При резко выраженном маловодий между кожей плода и амнионом образуются сращения, которые по мере^ роста плода приобретают характер тяжей и нитей (симонартовы связки). Иногда тяжи обвивают части плода и пуповину, вызывая обезображивание и ампутацию конечностей или пальцев плода.
Уменьшение количества околоплодных вод приводит к повышению травматизма плода в родах: кефал о гематому диагностируют в 44,4 % случаев, нарушение гемоликвородинамики – в 13,1 %.
При маловодий часто развивается первичная слабость родовой деятельности (9,6 %), что связано с образованием плоского плодного пузыря и нарушением процессов ретракции и дистракции мышечных волокон шейки матки, чаще наблюдается преждевременная отслойка плаценты. Значительно возрастает частота (4 %) кровотечений вследствие наличия остатков плодных оболочек и плацентарной ткани в полости матки, в связи с чем требуется выполнение таких оперативных вмешательств, как ручное и инструментальное обследование матки. При уменьшении объема околоплодных вод увеличивается частота разрывов шейки матки.
Тяжелое течение основного заболевания матери, на фоне которого обычно развивается маловодие, неправильное положение плода (частота тазовых предлежании плода достигает 13 %), внутриутробная задержка роста плода приводят к увеличению частоты выполнения операций кесарева сечения до 42,7 %. При маловодий увеличивается число случаев наложения акушерских щипцов (до 16,3 %). Причинами более частого выполнения оперативных вмешательств у беременных при маловодий являются внутриутробная гипоксия плода и вторичная слабость родовой деятельности.
Среди возможных причин маловодия можно выделить следующие: 1. гестоз; 2. гипертоническая болезнь у матери, причем частота развития маловодия и степень его выраженности зависят от длительности течения сосудистой патологии и степени ее компенсации; 3. инфекционно-воспалительные заболевания матери (как причина маловодия, 40 %); 4. воспалительные заболевания женской половой сферы (34 %); 5. недостаточная выработка околоплодных вод при органических поражениях выделительной системы плода, обструктивных уропатиях, нарушениях функции почек вследствие снижения количества первичной мочи плода; 6. нарушение обменных процессов в организме беременной (ожирение III степени); 7. фетоплацентарная недостаточность.
Механизм развития олигогидрамниона при хронической гипоксии плода до конца не изучен, но, возможно, происходит индуцированное кислородной недостаточностью рефлекторное перераспределение кровотока с преимущественным шунтированием крови в жизненно важные органы (мозг, сердце, надпочечники), минуя легкие и почки, которые являются основными источниками продукции амниотической жидкости в конце беременности.
Уменьшение околоплодной жидкости при кислородной недостаточности плода происходит в среднем в течение 9-11 дней. Этим и объясняется тот факт, что при угнетении регулируемых ЦНС биофизических характеристик плода количество околоплодных вод некоторое время остается нормальным. В отсутствие лечения и своевременного родоразрешения гибель этих плодов вследствие гипоксии нередко происходит раньше, чем развивается маловодие.
Патогенез маловодия изучен недостаточно. Принято выделять две формы маловодия: 1. раннюю, обусловленную функциональной несостоятельностью плодных оболочек, которую диагностируют с помощью ультразвукового исследования в сроки от 16 до 20 нед беременности; 2. позднюю, выявляемую обычно после 26-й недели беременности, когда маловодие возникает вследствие недостаточной функциональной активности плодных оболочек или нарушений состояния плода.
Однако дифференциальная диагностика раннего и позднего маловодия возможна только при динамическом ультразвуковом наблюдении в течение беременности. Помимо этого, различают первичное маловодие (развивающееся при ненарушенных плодных оболочках) и вторичное, или травматическое, связанное с повреждением оболочек и постепенным истечением околоплодных вод (амниональная гидрорея). При этом истечение амниотической жидкости может быть постоянным или периодическим.
При маловодий в плодных оболочках вь[явлены различные структурные механизмы нарушения синтеза и резорбции околоплодных вод (обширный некроз эпителия амниона и блокирование транспорта воды и мочевины во всех слоях при воспалительном генезе маловодия; атрофия и очаговый склероз децидуальной оболочки; нарушенное или патологическое развитие ворсин хориона при пороках развития плода).
Ретроспективный анализ содержания гормонов и иммуноглобулинов в околоплодных водах свидетельствует о его изменении в течение беременности и, следовательно, о вовлечении в патологический процесс всех слоев плодных оболочек, участвующих в синтезе хорионического гонадотропина, пролактина, плацентарного лактогена и других веществ, характеризующихся высокой биологической и иммунологической активностью.
Диагностика маловодия основывается на клиническом наблюдении за течением беременности. При отставании высоты стояния дна матки и окружности живота от нормативных показателей для предполагаемого срока беременности и снижении двигательной активности плода можно предположить уменьшение объема околоплодных вод. Матка при пальпации плотная, отчетливо определяются части плода и выслушиваются сердечные тоны. При влагалищном исследовании определяется вялый плодный пузырь, передние воды практически отсутствуют, а плодные оболочки "натянуты'' на головке плода. Более точное определение степени выраженности маловодия возможно при ультразвуковом сканировании. Индекс амниотической жидкости при выраженном маловодий составляет 0-5 см, при умеренном маловодий – 5,1-8 см.
До настоящего времени способов патогенетической коррекции маловодия нет.
Ведение беременности и родов во многом зависит от времени возникновения и степени выраженности маловодия. Если маловодие возникло или диагностировано при сроке беременности до 28 нед, то показано комплексное обследование (гормональное, биохимическое, ультразвуковое) для определения состояния плода. В случае выявления порокдв развития плода беременность прерывают по медицинским показаниям. В случае выявления маловодия в начале III триместра беременности в сочетании с внутриутробной задержкой роста плода исход беременности проблематичен. Медикаментозная терапия по поводу задержки роста плода эффективна у 73 % беременных с нормальным объемом околоплодных вод и лишь у 12,1 % с маловодием. В связи с этим при маловодий, особенно сочетающемся с внутри утробной задержкой роста плода, после 32-33 нед показано досрочное родоразрешение. При маловодий, развившемся в III триместре беременности, в отсутствие нарушений роста и состояния плода и при правильном ведении беременной возможен благополучный исход родов. В случае обнаружения маловодия в процессе родов (плоский плодный пузырь) необходимо произвести вскрытие пузыря в начале первого периода родов или сразу же после его обнаружения.
Многоводие (hydramnion) – состояние, характеризующееся избыточным накоплением околоплодных вод в амниотической полости. При многоводии количество околоплодных вод превышает 1,5 л и может достигать 2-5 л, а иногда-10-12 л и более. По данным разных авторов, частота данной патологии широко варьирует от 1:60 до 1:750 беременных. Многоводие наблюдается при многоплодной беременности, сахарном диабете, резус-сенсибилизации, острой и хронической инфекции, аномалиях развития плода.
Патогенез многоводия различен. Одной из причин его возникновения является нарушение функции амниона – избыточная продукция околоплодных вод амниотическим эпителием и задержка их выведения. Предполагают, что в этом случае имеют значение инфекционные, в том числе вирусные, заболевания у беременных (сифилис, хламидиоз, микоплазмоз, цитомегаловирусная инфекция, ОРВИ). Причиной возникновения много-водия при пороках развития является нарушение или отсутствие основного механизма, регулирующего количество околоплодных вод и тем самым предотвращающего многоводие, – заглатывания амниотической жидкости плодом. Наиболее часто при многоводии встречаются врожденные пороки развития центральной нервной системы и желудочно-кишечного тракта плода.
Различают хроническое и острое многоводие. Хроническое многоводие развивается постепенно, и беременная, как правило, адаптируется к этому состоянию, не испытывая дискомфорта от увеличения матки. Острое многоводие возникает быстро, и жалобы беременной более выражены. Как правило, острое многоводие развивается в более ранние сроки беременности (в 16-20 нед). В отличие от острого многоводия при хроническом внутриматочное давление не превышает норму.
Клиническая картина многоводия характеризуется значительным увеличением матки: высота стояния дна матки и окружность живота значительно превышают таковые при предполагаемом сроке беременности. Матка напряжена, тутоэластической консистенции, при ощупывании ее определяется флюктуация. Для выявления флюктуации врач помещает ладонь руки с одной стороны матки, а с противоположной средним пальцем другой руки производит толчкообразные движения. Если имеется флюктуация (многоводие), то ладонь ощущает эти толчки. Части плода прощупываются с трудом, при пальпации плод легко меняет свое положение, предлежащая часть расположена высоко над входом в таз. Сердечные тоны плода глухие, плохо прослушиваются. Может наблюдаться чрезмерная двигательная активность плода. В родах при влагалищном исследовании определяется напряженный плодный пузырь независимо от схваток.
Важное значение в диагностике многоводия имеет ультразвуковое исследование. Для многоводия характерно наличие больших эхонегативных пространств в полости матки: при легкой степени многоводия величина вертикального кармана составляет 8 – 11 см, при средней степени – 12-15 см, при выраженном многоводии этот показатель достигает 16 см и более. При установленном диагнозе многоводия необходимо исключить возможные пороки развития плода.
Наиболее частым осложнением беременности при многоводии является невынашивание. При хронической легкой форме многоводия беременность протекает благоприятно и в большинстве случаев роды происходят в срок. При выраженном многоводии нередко наступают преждевременные роды, иногда возникает необходимость искусственного прерывания беременности в связи с нарастающим нарушением кровообращения и дыхания у беременной. Нередким осложнением беременности при многоводии является несвоевременное излитие околоплодных вод, которое может повлечь за собой выпадение пуповины и мелких частей плода, быть причиной преждевременной отслойки нормально расположенной плаценты. При сильно выраженном многоводии у беременных в положении лежа на спине чаще наблюдается синдром сдавления нижней полой вены.
Лечение.
Беременные с диагностированным многоводием подлежат госпитализации и тщательному обследованию с целью выявления причины его возникновения (наличие хронической инфекции, пороков развития плода, сахарного диабета, изосенсибилизации по резус-фактору и др.). Вид лечения многоводия зависит от характера выявленной патологии. При обнаружении пороков развития плода, несовместимых с жизнью, производят прерывание беременности независимо от срока.
Параллельно с проводимой патогенетически обоснованной терапией иногда (особенно при выраженном многоводии) прибегают к амниоцентезу с выведением части амниотической жидкости (эффективность такого вмешательства довольно низкая), лечению антибиотиками. Имеются сообщения о лечении многоводия индометацином (1,5-3 мг/сут), хотя при этом существует потенциальная опасность преждевременного закрытия артериального протока у плода.
Роды при многоводии нередко бывают осложненными. Часто наблюдается слабость родовой деятельности, что связано с перерастяжением матки снижением ее возбудимости и сократительной способности. Течение родов может быть затяжным. С учетом того что во время излития околоплодных вод нередко наблюдаются выпадение пуповины или мелких частей плода, отслойка плаценты, амниотомию необходимо производить очень осторожно и амниотическую жидкость выпускать медленно, задерживая ее поток "полурукой", введенной во влагалище.
Для профилактики гипотонического кровотечения в последовом и раннем послеродовом периодах необходимо вводить метилэргометрин или окситоцин.
Аномалии пуповины
Аномалии пуповины заключаются в неправильном развитии сосудов (единственная артерия пуповины, третья артерия пуповины, аневризмы, атипичные анастомозы, артериальные узлы и др.); в изменении длины пуповины (чрезмерно длинная, короткая); образовании истинных и ложных узлов пуповины. Кроме того, возможно патологическое (краевое и оболочечное) прикрепление пуповины.Неправильное развитие сосудов пуповины встречается крайне редко. Практическое значение имеют в основном остальные варианты патологии пуповины.
Различают абсолютно и относительно короткую пуповину. Абсолютно короткой следует считать пуповину длиной менее 40 см. Относительно короткой называется пуповина нормальной длины, но укороченная в результате ее обвития вокруг плода или вследствие образования ее истинных узлов. Чрезмерно короткая пуповина может быть причиной неправильных положений плода. Тяжелые осложнения, обусловленные короткой пуповиной, проявляются в родах: замедляется продвижение плода по родовому каналу или вследствие натяжения ее даже происходит отслойка плаценты. Иногда наблюдается разрыв пуповины с кровотечением из ее сосудов.
Диагностика короткой пуповины во время беременности затруднена. При УЗИ можно заподозрить укорочение пуповины, если обнаруживают обвитие ее вокруг шеи и туловища плода. Заподозрить чрезмерно короткую пуповину в родах можно на основании следующих признаков: медленного продвижения головки плода в период изгнания, изменения его сердечной деятельности. Все эти осложнения приводят к острой гипоксии плода. При выявлении симптомов, свидетельствующих о короткой пуповине, показано быстрое бережное родоразрешение в зависимости от акушерской ситуации.
Чрезмерно длинная пуповина (70-80 см и более) является более частой аномалией. Описаны случай, когда длина пуповины достигала 200 см и более. Самым тяжелым осложнением (для плода) при длинной пуповине является выпадение ее петель в момент излития околоплодных вод при подвижной головке плода.
Истинный узел пуповины образуется в ранние сроки беременности, когда небольшие размеры плода позволяют ему проскочить через петлю пуповины. Во время затягивания этих узлов (во время беременности или в родах) может возникнуть острая гипоксия плода, вплоть до его гибели. Ложные узлы пуповины, представляющие собой ограниченные ее утолщения вследствие варикозного расширения пупочной вены или скопления вартонова студня, практического значения не имеют.
Патологическое прикрепление пуповины бывает краевым и оболочечным (плевистое прикрепление). В последнем случае пуповина прикрепляется к оболочкам на некотором расстоянии от края плаценты. Сосуды пуповины при этом направляются к плаценте по оболочкам. Разрыв сосудов при оболочечном прикреплении пуповины чаще всего происходит при излитии околоплодных вод, при этом нередко наступает внезапная смерть плода.
Плацентарная недостаточность
Наиболее частой причиной нарушений состояния плода во время беременности является плацентарная недостаточность – клинический синдром, обусловленный морфофункциональными изменениями в плаценте и нарушениями компенсаторно-приспособительных механизмов, обеспечивающих функциональную полноценность органа. Она представляет собой результат сложной реакции плода и плаценты на различные патологические состояния материнского организма; проявляется комплексом нарушений транспортной, трофической, эндокринной и метаболической функций плаценты, лежащих в основе патологии плода и новорожденного. В процессе развития беременности функции плаценты и плода тесно связаны, поэтому нередко используют термин "фетоплацентарная система".Степень и характер влияния патологических изменений плаценты на плод определяются многими факторами: сроком беременности, длительностью воздействия, состоянием компенсаторно-приспособительных механизмов в системе мать-плацента-плод.
Классификация.
В зависимости от того, в каких структурных единицах преимущественно возникают патологические процессы, различают три формы плацентарной недостаточности: 1. гемодинамическую, проявляющуюся нарушением маточно-плацентарного и плодово-плацентарного кровообращения; 2. плацентарно-мембранную, характеризующуюся снижением способности плацентарной мембраны к транспорту метаболитов; 3. клеточно-паренхиматозиую, связанную с нарушением клеточной активности трофобласта и плаценты.
Выделяют первичную плацентарную недостаточность, возникающую до 16 нед беременности, и вторичную, наблюдающуюся в более поздние сроки.
Первичная недостаточность плаценты развивается в период имплантацйи, раннего эмбриогенеза и плацентации под влиянием разнообразных факторов (генетические, эндокринные, инфекционные и т.д.), действующих на гаметы родителей, зиготу, бластоцисту, формирующуюся плаценту и Половой аппарат женщины в целом. Первичная плацентарная недостаточность проявляется изменениями строения, расположения и прикрепления плаценты, а также дефектами васкуляризации и нарушениями созревания хориона.
Вторичная плацентарная недостаточность развивается под влиянием экзогенных факторов и наблюдается во второй половине беременности.
Плацентарная недостаточность (первичная и вторичная) имеет острое или хроническое течение.
Острая плацентарная недостаточность возникает как следствие преждевременной отслойки нормально расположенной плаценты с образованием ретроплацентарной гематомы или отслойки предлежащей плаценты, в результате чего наступает гибель плода.
Хроническая плацентарная недостаточность наблюдается у каждой третьей беременной из группы высокого риска развития перинатальной патологии. Хроническая плацентарная недостаточность развивается рано и протекает длительно вследствие нарушения компенсаторно-приспособительных механизмов в сочетании с циркуляторными расстройствами, инволютивнодистрофическими изменениями, воспалением или обострением, связанными с заболеваниями женщины во время беременности. Хроническая плацентарная недостаточность может приводить к гипоксии плода, задержке его роста и развития, возможна внутриутробная гибель плода.
Этиология и патогенез.
Плацентарная недостаточность чаще развивается при осложненном течении беременности или экстрагенитальных заболеваниях. Высокая степень риска развития плацентарной недостаточности отмечена у беременных с сочетанным гестозом, преимущественно развивающимся на фоне сердечно-сосудистой патологии (гипертоническая болезнь, некоторые пороки сердца с гипертензией), заболеваний эндокринной системы (сахарный диабет, гипери гипофункция щитовидной железы и надпочечников), почечной патологии с гипертензивным синдромом, иммуноконфликтной беременности, беременности, сопровождающейся угрозой прерывания, переношенной беременности.

 Рис. 16.5. Пузырный занос, а – препарат; б – схема.
Рис. 16.5. Пузырный занос, а – препарат; б – схема.
В группу беременных со средней степенью риска нарушений фетоплацентарной системы относятся женщины с генитальным инфантилизмом I-II степени, многоплодной беременностью.
Группу низкого риска составляют первородящие женщины до 18 лет и старше 28 лет, беременные с умеренным многоводием.
Патогенез плацентарной недостаточности определяется морфологическими изменениями и расстройствами функции плаценты. Морфологическим субстратом плацентарной недостаточности являются изменения, связанные с нарушением имплантации и плацентации: патологическое строение, расположение и прикрепление плаценты, а также дефекты васкуляризации. В развитии плацентарной недостаточности основными и нередко первоначальными причинами являются гемодинамические микроциркуляторные нарушения. Изменения плацентарного кровотока, как правило, сочетанные: 1. снижение перфузионного давления в матке, проявляющееся либо уменьшением притока крови к плаценте в результате системной гипотензии у матери (гипотензия беременных, синдром сдавления нижней полой вены, локальный спазм маточных сосудов на фоне гипертензивного синдрома), либо затруднением венозного оттока (длительные сокращения матки или ее повышенный тонус, отечны синдром); 2. инфаркты, отслойка части плаценты, ее отек; 3. нарушения капиллярного кровотока в ворсинах хориона (нарушение созревания ворсин, внутриутробное инфицирование, тератогенные факторы); 4. изменения реологических и коагуляционных свойств крови матери и плода.
В результате гемодинамических и морфологических изменений первично нарушается трофическая функция плаценты и лишь позднее изменяется газообмен на уровне плацентарного барьера.
Поддержание жизнедеятельности плода при нарушениях функции плаценты происходит с помощью компенсаторных механизмов, действующих не только на тканевом уровне (увеличение числа резорбционных ворсин, капилляров ворсин и функционирующих синцитиальных узелков, образование синцитиокапиллярньгх мембран), но и на клеточном и субклеточном уровнях (увеличение числа митохондрий и рибосом, повышение активности ферментов, переключение на анаэробный тип дыхания).
Клиническая картина плацентарной недостаточности зависит от того, развивается она остро или постепенно (хроническая плацентарная недостаточность). Острая плацентарная недостаточность является следствием преждевременной отслойки предлежащей или нормально расположенной плаценты. Считается опасным для жизни плода выключение из кровообращения более Уз площади плаценты. Клинические проявления преждевременной отслойки плаценты разнообразны и зависят от расположения плаценты (нормальное, низкое), локализации участка отслойки (центральное, по краю плаценты), размера отслоившейся части плаценты (см. разделы 21.1, 21.2).
Хроническая плацентарная недостаточность имеет некоторые общие проявления, несмотря на крайне слабовыраженную клиническую симптоматику. Как правило, жалоб беременные не предъявляют. Изменения в плаценте (структурные и функциональные) можно определить лишь с помощью объективных методов исследования.
 Рис. 16.6. Инвазивный пузырный занос, разрушивший стенку матки.
Рис. 16.6. Инвазивный пузырный занос, разрушивший стенку матки.
Основными клиническими проявлениями хронической плацентарной недостаточности являются внутриутробная задержка роста плода, внутриутробная гипоксия и их сочетание.
Диагностика.
Плацентарная недостаточность в ранние сроки беременности в основном обусловлена недостаточной гормональной активностью желтого тела, сопровождается низким уровнем прогестерона и хорион ического гонадотропина. Во II и III триместрах беременности плацентарная недостаточность сопровождается патологическими изменениями плаценты: малыми ее размерами, появлением некрозов. В последующем возникает задержка роста плода, в ряде случаев недостаточность плаценты может привести к антеили интранатальной гибели плода. Наиболее информативными в определении функции плаценты являются следующие методы: 1. определение и сопоставление уровней гормонов фетоплацентарной системы (эстрогенов, прогестерона, плацентарного лактогена); 2. определение в крови активности ферментов – окситоциназы и термостабильной щелочной фосфатазы; 3. ультразвуковое сканирование (локализация плаценты, ее структура и величина); 4. допплерометрическое исследование кровотока в маточных артериях и сосудах плода.
 Рис. 16.7. Преждевременное созревание плаценты с ее кистозной дегенерацией.
Рис. 16.7. Преждевременное созревание плаценты с ее кистозной дегенерацией.
Кроме того, необходимо проводить оценку роста плода путем тщательного измерения высоты дна матки и окружности живота беременной, ультразвуковую биометрию плода, оценку состояния плода посредством изучения его двигательной активности и сердечной деятельности.
Ранним признаком недостаточности плаценты является снижение синтеза всех гормонов фетоплацентарной системы (эстрогенов, прогестерона, плацентарного лактогена).
Наиболее ценную информацию о состоянии плаценты дает ультразвуковое исследование плаценты, которое позволяет не только определить ее локализацию, но и оценить структуру и величину. Появление III степени зрелости плаценты до 36-37 нед беременности свидетельствует о ее преждевременном старении и является признаком плацентарной недостаточности. В ряде случаев при ультразвуковом исследовании выявляют кисто я юсизменение плаценты. Кисты плаценты определяются в виде эхонегативньл образований различной формы и величины. Они чаще возникают на плодовой стороне плаценты как следствие кровоизлияний, размягчения, инфарктов и других дегенеративных изменений (рис. 16.7). Мелкие, даже множественные кисты могут не оказывать влияния на развитие плода, в то время как большие кисты нередко приводят к атрофии ткани плаценты и нарушению состояния плода.
В зависимости от патологии, осложняющей течение беременности, не-достаточность функции плаценты проявляется уменьшением или увеличением толщины плаценты.
Для гестозов, угрозы прерывания беременности, внутриутробной задержки роста плода характерна "тонкая" плацента (до 20 мм в III триместре беременности), при гемолитической болезни и сахарном диабете о плацентарной недостаточности свидетельствует "толстая" плацента (до 50 мм и более). Истончение или утолщение плаценты на 0,5 см и более указывает на необходимость проведения лечебных мероприятий и повторного ультразвукового исследования. Важным является определение площади плаценты, которая в сочетании с толщиной дает представление об ее объеме. Эти параметры дополняют сведения о состоянии плаценты, ее компенсаторных возможностях.
Не вызывает затруднений диагностика плацентарной недостаточности, сопровождающейся внутриутробной задержкой роста плода. Рост и развитие плода во время беременности определяют с помощью наружного акушерского исследования (измерение и пальпация) и ультразвукового сканирования. Скрининговым методом является сопоставление высоты дна матки (ВДМ) над лобком с окружностью живота, массой тела и ростом беременной. Однако значительно больше информации дает ультразвуковая биометрия плода, которая позволяет уточнить гестационный срок с точностью до 1/2-1 нед и определить размеры отдельных органов плода. Ультразвуковая диагностика задержки роста плода основана на сопоставлении фетометрических показателей, полученных при исследовании, с нормативными показателями для данного срока беременности.
Достоверными признаками задержки роста плода являются несоответствие размеров плода фактическому сроку беременности, а также нарушения взаимоотношений между размерами головки плода и его туловища. Различают два основных типа внутриутробной задержки роста плода. 1. Симметричная задержка роста, при которой отмечается пропорциональное уменьшение размеров плода, встречается в 10-30 % случаев. Соотношение БПР/ДЖ при этом такое же, как у здоровых плодов аналогичного гестационного возраста, и не превышает 1. Правильная диагностика симметричной задержки роста возможна при установлении точного срока беременности или при динамической эхографии. Эта форма нарушения роста плода, как правило, связана с его наследственными заболеваниями и хромосомными аберрациями (трисомия по 18-й паре хромосом, синдромы Дауна и Тернера), инфекционными заболеваниями (краснуха, токсоплазмоз, герпес, сифилис, цитомегаловирусная инфекция), аномалиями развития (микроцефалия, единственная артерия пуповины, синдром Поттера, врожденные пороки сердца и т.д.). В связи с этим для исключения наследственной и генетической патологии при выявлении симметричной формы задержки роста плода следует провести амниоцентез и соответствующие исследо-вания околоплодных вод (хромосомный анализ). Целесообразно также обследование беременной на носительство вирусной и бактериальной инфекции. Причиной развития симметричной формы задержки роста плода могут быть также вредные привычки у матери (курение, алкоголизм, наркомания), недостаточное питание и др. 2. Асимметричная задержка роста, для которой характерно отставание размеров туловища при нормальном БПР головки и, следовательно, увеличении соотношения БПР/ДЖ выше 1, наблюдается в 70 – 90% случаев Нарушений роста плода. Диагностика такого типа задержки роста плода не Представляет трудностей и возможна уже при первом ультразвуковом исследовании. В большинстве наблюдений асимметричная форма задержки роста плода развивается в более поздние сроки беременности и обусловлена заболеваниями матери и осложнениями беременности, приводящими к плацентарной недостаточности (гипертоническая болезнь, сахарный диабет, коллагеноз, гестоз, многоплодная беременность, патологические изменения плаценты, кровотечения во время беременности). На основании результатов ультразвукового исследования можно определить степень за-держки роста плода. При I степени отмечается отставание показателей фетометрии от нормативных показателей на 2 нед, при II – на 3-4 нед, при III – более чем на 4 нед. Степень внутриутробной задержки роста плода коррелирует со степенью тяжести плацентарной недостаточности и неблагоприятными перинатальными исходами. С целью контроля за ростом плода используют перцентильный подход, который позволяет в каждый конкретный срок беременности точно определить соответствие размеров плода гестационному возрасту, а также степень отклонения их от нормативных величин.
 Рис. 16.8. Перцентильные нормативы БПР.
Рис. 16.8. Перцентильные нормативы БПР.
При построении перцентильных кривых все измерения, проведенные в течение беременности (ВДМ, БПР, ДЖ, ДГ и т.д.), разбивают на интервалы по гестационному сроку (рис. 16.8). Для каждого интервала образуют и упорядочивают по возрастающим величинам вариационные ряды и определяют характерные перцентильные уровни. Уровень показателя (в сантиметрах, граммах илидругих единицах), ниже и выше которого находится 50 % всех выявленных показателей, называют медианой или 50-м (50 %) перцентилем. Соответственно уровень, ниже которого находится 25 % всех показателей, именуют 25-м перцентилем и т.д. На диаграммах приведены перцентильные нормативы БПР и ДЖ. Диагноз ВЗРП устанавливают в том случае, если размеры плода ниже 10-го перцентиля для данного срока беременности.
Определенную ценность в диагностике задержки роста плода имеет ультразвуковое исследование мочевыделительной функции почек плода по одночасовой экскреции мочи. Последнюю определяют по разнице между объемом мочевого пузыря плода во время первого обследования и повторного его измерения через 1 ч. Одночасовая экскреция мочи при внутриутробной задержке роста плода снижается до 15-18 мм (при норме 24-27 мм).
Наиболее информативным объективным методом диагностики плацентарной недостаточности и определения компенсаторных возможностей единой системы мать-плацента-плод является допплерометрия кровотока в маточно-плацентарных и плодово-плацентарных сосудах. Разработана классификация гемодинамических нарушений в системе мать-плацента-плод по оценке кривых скоростей кровотока в маточных артериях и артерии пуповины [Стрижаков А.Н. и др., 1989]. Патологическими значениями СДО в маточных артериях после 18-20 нед беременности считаются 2,4 и более, в артерии пуповины после 32 нед – 3,0 и более. При I степени нарушения отмечаются изменения только маточного (1А) или только плодового (1Б) кровотока. При П степени нарушается как маточный, так и плодовый кровоток, но не отмечаются их критические значения. При III степени нарушения кровотока в артерии пуповины достигают критического уровня, выражающегося нулевым или отрицательными значениями диастолического компонента кровотока.
Беременные с нарушениями маточно-плацентарно-плодового кровообращения 1а и II степени нуждаются в динамическом наблюдении с допплерометрическим и кардиомониторным контролем. При III степени нарушения маточно-плацентарно-плодового кровообращения в связи с декомпенсированной плацентарной недостаточностью требуется досрочное родоразрешение.
Диагностика гипоксии плода как одного из основных проявлений плацентарной недостаточности возможна при кард иото ко графи и (см. Гипоксия).
Лечение.
Основным звеном в нормализации функции плаценты является улучшение маточно-плацентарного кровотока, что достигается применением комплекса сосудорасширяющих средств и методов либо препаратов, расслабляющих матку, в сочетании с мероприятиями, направленными на нормализацию микроциркуляции и реологических свойств крови. Физические методы воздействия (электрорелаксация матки, электрофорез магния, назначение тепловых процедур на околопочечную область) рефлекторно расслабляют миометрий и приводят к расширению сосудов. Абдоминальная декомпрессия снимает излишнюю работу мускулатуры матки по преодолению тонуса мышц передней брюшной стенки, что приводит к усилению интенсивности кровотока в матке и улучшению плацентарной перфузии.
Гипербарическую оксигенацию применяют для улучшения функции плаценты и состояния плода, особенно у беременных с пороками сердца. Она обеспечивает сохранение активности дыхательных ферментов, способствует нормализации углеводного обмена.
Из сосудорасширяющих средств применяют эуфиллин, который может быть введен внутривенно струйно и капельно. С этой же целью используют ксантинола никотинат (компламин, теоникол). Следует отметить возможность повышенной чувствительности беременных к этим препаратам, в связи с чем требуется индивидуальный подбор доз. Значительное улучшение маточно-плацентарного кровотока вызывает вазоактивный препарат трентал (пентоксифиллин). Он оказывает сосудорасширяющее действие, снижает периферическое сопротивление сосудов, усиливает коллатеральное кровообращение. Трентал улучшает реологические свойства крови и микроциркуляцию, может быть применен в условиях стационара и женской консультации. В стационаре лечение тренталом следует начинать с его внутривенного введения, а затем переходить только на прием внутрь. Длительность терапии в зависимости от эффекта составляет от 4 до 6 нед. Ввиду значительного сосудорасширяющего действия возможно уменьшение кровоснабжения ряда органов, в том числе матки (синдром обкрадывания), для предотвращения которого трентал следует принимать через 30 мин после так называемой жидкостной нагрузки (предварительного введения жидкости, лучше реополиглюкина) и предварительного внутривенного введения 1 мл 0,06 % раствора коргликона. В амбулаторных условиях трентал назначают в виде таблеток.
С целью расслабления матки и улучшения плацентарного кровотока целесообразно использовать малые дозы препаратов токолитического действия (бета-миметики), которые снижают сопротивление сосудов на уровне артериол. При этом происходит перераспределение крови в организме матери и может наступить уменьшение оксигенации плода, поэтому данные препараты следует применять в сочетании с кардиотоническими средствами и инфузионной терапией. Для усиления маточно-плацентарного кровотока можно сочетать введение малых доз бета-миметиков с сигетином. Применение токолитических средств требует тщательного врачебного контроля, поскольку могут наблюдаться, особенно в начале лечения, некоторые нежелательные эффекты: нарушения деятельности сердечно-сосудистой системы в виде тахикардии, гипотензии; тремор пальцев рук, озноб, тошнота и рвота, головная боль, некоторая возбудимость. Индивидуальный подбор дозы препаратов и скорости их введения позволяет предотвратить возникновение этих побочных явлений. Одновременное применение папавериноподобных соединений, а также альфа-блокаторов приводит к уменьшению частоты возникновения побочных явлений – нарушений деятельности сердечно-сосудистой системы. Одним из условий проведения токолиза является положение женщины на боку, До начала введения препарата в течение 30 мин следует ввести один из растворов (глюкоза, реополиглюкин) и кардиотонические средства (коргликон, изоланид). Одновременно с началом приема бета-миметиков внутрь принимают 1 таблетку верапамила (изоптин, финоптин). Противопоказаниями к применению бета-миметиков являются кровотечения во время беременности, заболевания сердечно-сосудистой системы, сахарный диабет, тиреотоксикоз и нарушения свертывания крови.
Большую роль в нарушении гемодинамики плаценты играют реокоагуляционные расстройства. Для их коррекции проводят инфузию низкомолекулярных декстранов (реополиглюкин). Под влиянием инфузии реополиглюкина в конце беременности кровоток в различных органах меняется неоднозначно: он значительно увеличивается в плаценте, несколько меньше – в мозге и сердечной мышце. Лучший результат отмечается при сочетанием введении реополиглюкина и гепарина. Важным свойством гепарина является его способность расширять кровеносные сосуды. Это в значительной мере относится и к сосудам плаценты. При лечении плацентарной недостаточности гепарин используют для улучшения микроциркуляции и предотвращения избыточного отложения фибрина. Он не проходит через плаценту и не оказывает повреждающего действия на плод. Лечение следует проводить под контролем реологических и коагуляционных свойств крови в комплексе
с другой терапией. Развитию сосудистого ложа миометрия и плаценты, нормализации микроциркуляции способствует длительное подкожное введение низко молекулярного гепарина – фраксипарина в сочетании с антиагрегантами (трентал, теоникол, курантил или дипиридамол). Лечение проводят только по строгим показаниям во II-III триместрах, его длительность составляет от 10 дней до 7 нед. Используемые дозировки гепарина (15.000-20.000 ЕД в сутки) относительно безопасны в отношении геморрагических осложнений, но, несмотря на это, требуется регулярный контроль за состоянием свертывающей системы крови не реже 2 раз в неделю. За 2-3 сут до родоразрешения гепарин следует отменить. При этом кровопотеря в родах или при кесаревом сечении в случае правильного применения фраксипарина не превышает физиологическую. У новорожденных геморрагические осложнения также отсутствуют.
Для улучшения маточно-плацентарного кровотока применяют дипиридамол (курантил), который, проникая через плаценту, оказывает положительное влияние на плод. Важной особенностью препарата является его тормозящее воздействие на агрегацию эритроцитов и тромбоцитов,. Для улучшения маточно-плацентарного кровообращения используют сигетин, при этом следует учитывать кратковременность его действия. Препарат можно вводить с партусистеном и гепарином, усиливая тем самым их терапевтический эффект. В комплексную терапию плацентарной недостаточности следует включать средства, улучшающие газообмен и метаболизм в плаценте. К. ним относятся оксигенотерапия, энергетические смеси, аминокислоты, витамины и препараты железа в сочетании с нестероидными анаболическими препаратами. При этом следует отметить, что глюкоза является основным энергетическим продуктом, утилизируемым при экстремальных состояниях. Хорошее действие на метаболическую функцию плаценты оказывает калия оротат, который участвует в синтезе белковых молекул и является стимулятором белкового обмена.
Длительность терапии плацентарной недостаточности должна составлять не менее 6 нел (в стационаре с продолжением лечения в условиях женской консультации).
В случаях выраженных ВЗРП и внутриутробной гипоксии плода единственно правильным является досрочное родоразрешение. При критическом состоянии плода родоразрешение необходимо проводить путем кесарева сечения.
Схемы лечения
1. В условиях стационара • лечение основной патологии беременности; • оксигенотерапия: вдыхание увлажненной кислородно-воздушной смеси в течение 30-60 мин 2 раза в день; • препараты, влияющие на энергетический обмен: – глутаминовая кислота по 0,1 г 3 раза в день или метионин по 0,5 г 3 раза в день, – галаскорбин по 0,5 г 3 раза в день, – железо в виде ферроплекса по 2 драже 4 раза в день, – кокарбоксилаза по 100 мг внутримышечно ежедневно; • вазоактивные препараты: трентал, курантил, партусистен, эуфиллин внутривенно (на растворе натрия хлорида или глюкозы) или внутрь. Курс лечения 4 – 6 нед, из них в течение 5-7 дней проводят инфузионную терапию, в остальные дни препараты назначают внутрь; • реополиглюкин по 400-500 мл 10 % раствора внутривенно капельно 3-4 раза ежедневно или 2-3 раза в неделю; • свежезамороженная плазма – 150 мл внутривенно капельно при низком содержании белка в крови (ниже 60 г/л); • при введении больших доз глюкозы ее применяют с инсулином в количестве 1 ЕД на 4 г сухого вещества глюкозы. • В условиях женской консультации • диатермия околопочечной области (до 10 сеансов) в чередовании с УФО (10 сеансов); • диета, богатая белком (отварное мясо, рыба, творог) и витаминами; • внутривенное введение 20 мл 4 0 % раствора глюкозы с 0,5 мл 0,06 % раствора коргликона внутривенно медленно ежедневно или через день (10 инъекций); • кокарбоксилаза внутримышечно по 50 мг ежедневно в течение • 10-14 дней; • эуфиллин (или но-шпа, папаверин) по 0,15 г внутрь 2 раза в сутки и по 0,2 г в свечах на ночь в течение 14 дней; • трентал по 1 таблетке 3 раза в сутки или изадрин по 0,005 г (под язык) 3 раза в сутки в сочетании с финоптином (изоптином); • калия оротат по 0,5 г 3 раза в сутки; • ферроплекс (конферон) по 1 драже (капсуле) 3 раза в сутки, • метионин по 0,5 г 3 раза в сутки; • аскорутин по 1 таблетке 3 раза в сутки. В отсутствие эффекта в течение 10-14 дней показана госпитализация.
Профилактика плацентарной недостаточности 1. Исключение влияния вредных факторов, особенно в первые дни и недели беременности: а) курение, прием алкоголя и медикаментозных средств без назначения врача, б) до и во время беременности санация очагов инфекции, лечение хронических заболеваний. 2. С наступлением беременности разъяснение роли сбалансированного питания, полноценного и несколько более продолжительного отдыха и сна. 3. Выявление и взятие на диспансерный учет беременных из группы высокого риска развития плацентарной недостаточности. К ним относятся женщины, у которых длительно существует угроза прерывания беременности, с гестозами, миомой матки, хроническим пиелонефритом, гипертонической болезнью, сахарным диабетом, изосерологической несовместимостью крови матери и плода, многорожавшие женщины, в анамнезе которых имеется антенатальная гибель плода или рождение детей с гипотрофией, 4. Проведение профилактических мероприятий трижды в течение беременности у женщин из группы высокого риска, особенно в сроки до 12 нед и в 20-22 нед. Женщины этой группы риска должны быть направлены в стационар с целью активизации компенсаторно-приспособительных механизмов организма.
Глава 17. Аномалии костного таза
К числу наиболее частых причин нарушения физиологического течения родов относятся различные аномалии костного таза. До XVI в. существовало убеждение, что кости таза во время родов расходятся и плод рождается, упираясь ножками в дно матки. В 1543 г. анатом Везалий, впервые описавший таз, установил, что лобковые кости соединены в симфизе неподвижно. Аранций (1572) подтвердил мнение Везалия о неподвижности соединений костей таза и представил данные о его деформации. Начало учения об узком тазе принадлежит Девентеру (1701), который описал понятие общесуженный и плоский таз и отметил зависимость течения родов от формы и степени сужения таза. В дальнейшем (XVIII и XIX вв.) проблему узкого таза в нашей стране изучали Н.М.Максимович-Амбодик, А.Я.Крассовский, Н.Н.Феноменов, К.К.Скробанский, Г.Г.Гентер, М.С.Малиновский, Р.И.Калганова и др.Несмотря на значительное снижение в последнее время частоты грубо деформированных тазов и резких степеней их сужения, проблема узкого таза не потеряла своей актуальности в связи с процессом акселерации, увеличением массо-ростовых показателей населения, увеличением смешанных форм узкого таза и массы тела новорожденных.
Рациональное ведение родов при узком тазе до сих пор относится к наиболее трудным разделам практического акушерства, так как узкий таз является одной из причин материнского и детского травматизма, материнской и перинатальной смертности.
Роды при узком тазе характеризуются несвоевременным излитием околоплодных вод, аномалиями родовой деятельности, преждевременной отслойкой плаценты, кровотечениями в последовом и раннем послеродовом периодах, тяжелым родовым травматизмом матери и плода, высокими показателями оперативного родоразрешения, послеродовых гнойно-воспалительных заболеваний.
Проблема аномалий таза почти полностью относится к узкому тазу, однако известное клиническое значение имеет широкий таз. Размеры его на 2-3 см превышают нормальный таз. Широкий таз наблюдается чаще у рослых, хорошо развитых женщин, он распознается обычными методами исследования (осмотр, измерение таза и др.). При влагалищном исследовании определяют значительную емкость малого таза, недоступность мыса, увеличение расстояния между седалищными буграми, крестцом и мысом.
Роды при широком тазе в большинстве случаев протекают нормально, но период изгнания бывает ускоренным. Нередко возникают разгибательные предлежания, низкое поперечное стояние сагиттального шва, высокое прямое стояние головки. Второй период родов может протекать стремительно, в связи с чем часто возникают разрывы мягких тканей родовых путей и травмы плода. В связи с этим в родах необходимо тщательное наблюдение за состоянием роженицы и плода, характером родовых сил и особенностями механизма родов. У большинства женщин роды при широком тазе заканчиваются благоприятно и для матери, и для плода.
Узкии таз
Анатомически узким тазом принято считать таз, в котором все или хотя бы один из размеров укорочен по сравнению с нормальным на 1,5-2 см и более.Основным показателем сужения таза принято считать размер истинной конъюгаты: если она меньше 11 см, то таз считается узким.
Осложнения в родах возникают, когда головка плода несоразмерно больше, чем тазовое кольцо, что наблюдается иногда и при нормальном размере таза. В таких случаях даже при хорошей родовой деятельности продвижение головки по родовому каналу может приостановиться: таз практически оказывается узким, функционально недостаточным. Если головка плода невелика, то даже при значительном сужении таза несоответствия между головкой и тазом может и не быть и роды совершаются естественным путем без всяких осложнений. В таких случаях анатомически суженный таз оказывается функционально достаточным.
Таким образом, возникает необходимость разграничить два понятия: анатомически узкий таз и функционально узкий таз.
Функционально, или клинически, узкий таз означает несоответствие (не-соразмерность) между головкой плода и тазом матери. В литературе встречаются термины "диспропорция таза", "дистоция таза", "неадекватный (клинически узкий) таз", cephalopelvic disproportion и др.
Анатомически узкий таз встречается в 1,04-7,7 % случаев. Такой разброс показателей объясняется отсутствием единой классификации узких тазов и разными диагностическими возможностями.
Причины.
Существует много причин развития узкого таза: недостаточное питание в детском возрасте, рахит, детский церебральный паралич (ДЦП), полиомиелит и др. К деформациям таза приводят заболевания или повреждения костей и соединений таза (рахит, остеомаляция, переломы, опухоли, туберкулез, врожденные аномалии таза).
Аномалии таза возникают также в результате деформации позвоночника (кифоз, сколиоз, спондилолистез, деформация копчика). Сужение таза может быть обусловлено заболеваниями или деформациями нижних конечностей (заболевания и вывих тазобедренных суставов, атрофия и отсутствие ноги и др.).
Деформации таза возможны также в результате повреждений при автомобильных и других катастрофах, землетрясениях и т.д.
В период полового созревания формирование таза происходит под воздействием эстрогенов и андрогенов. Эстрогены стимулируют рост таза в поперечных размерах и его созревание (окостенение), а андрогены – рост скелета и таза в длину. Одним из факторов формирования поперечносуженоного таза является акселерация, приводящая к быстрому росту тела в длину в период полового созревания, когда увеличение поперечных размеров замедлено.
Значительные психоэмоциональные нагрузки, стрессовые ситуации, прием гормонов с целью блокирования менструации при усиленных занятиях спортом (спортивной гимнастикой, фигурным катанием и др.) у многих девушек вызывают "компенсаторную гиперфункцию организма", что в конечном итоге способствует формированию поперечносуженного таза (напоминающего мужской).
В современных условиях отмечается снижение числа женщин с анатомически узким тазом и различными его формами. Так, если в прошлом наиболее частыми были общеравномерносуженный и разные виды плоского таза, то в настоящее время эти патологические формы встречаются реже, а чаще выявляется таз с уменьшенными поперечными размерами. На втором месте по распространенности – таз с уменьшенным размером широкой части полости малого таза.
В настоящее время отмечается увеличение процента так называемых стертых форм узкого таза, диагностика которых представляет значительные трудности.
Классификация. Единая классификация форм анатомически узкого таза отсутствует. Классификация строится либо по этиологическому принципу, либо на основе оценки анатомически узкого таза по форме и степени сужения.
В нашей стране обычно используют классификацию, основанную на форме и степени сужения. Кроме того, различают часто и редко встречающиеся формы узкого таза.
Сравнительно часто встречающиеся формы узкого таза 1. Поперечносуженный таз. 2. Плоский таз: • простой плоский таз; • плоскорахитический таз; • таз с уменьшением прямого размера широкой части полости. 3. Общеравномерносуженный таз.
Редко встречающиеся формы узкого таза: 1. Кососмещенный и кососуженный таз. 2. Таз, суженный экзостозами, костными опухолями вследствие переломов таза со смещением. 3. Другие формы таза.
За рубежом широко используют классификацию Caldwell-Moloy (1933), Учитывающую особенности строения таза (рис. 17.1): 1. гинекоидный (женский тип таза); 2. андроидный (мужской тип); 3. антропоидный (присущий приматам); 4. платипеллоидный (плоский).
Кроме указанных четырех "чистых" форм таза, различают 14 вариантов смешанных форм". Эта классификация подразумевает характеристику переднего и заднего сегментов таза, которые играют важную роль в механизме родов. Плоскость, проходящая через наибольший поперечный диаметр входа таза и задний край седалищных остей, делит таз на передний и задний сегменты. Для разных форм таза величина и форма этих сегментов различна (см. рис. 17.1). Так, при гинекоидной форме задний сегмент больше, чем передний, и контуры его закруглены, форма входа в таз поперечно-овальная. При антропоидной форме таза передний сегмент узкий, длинный, закругленный, а задний длинный, но менее узкий, форма входа – продольноовальная. При андроидной форме таза передний сегмент также узкий, а задний широкий и плоский. Форма входа напоминает сердце. При платипеллоидной форме таза передний и задний сегмент широкие, плоские. Форма входа вытянутая, поперечно-овальная.
 Рис. 17.1. Основные формы таза.
1 – гинекоидная; 2 – антропоидная; 3 – андроидная; 4 – платипеллоидная. Линия, проходящая через самую широкую часть входа в таз, делит его на передний – anterior (А) и задний – posterior (Р) сегменты.
Рис. 17.1. Основные формы таза.
1 – гинекоидная; 2 – антропоидная; 3 – андроидная; 4 – платипеллоидная. Линия, проходящая через самую широкую часть входа в таз, делит его на передний – anterior (А) и задний – posterior (Р) сегменты.
В классификации анатомически узких тазов имеют значение не только особенности строения, но и степень сужения таза, основанная на размера истинной конъюгаты. При этом принято различать четыре степени су жения таза: 1. I – истинная конъюгата меньше 11 см и больше 9 см; 2. II – истинная конъюгата меньше 9 см и больше 7,5 см; 3. III – истинная конъюгата меньше 7,5 см и больше 6,5 см; 4. IV – истинная конъюгата меньше 6,5 см. Сужение таза III и IV степени в практике обычно не встречается.
В современном иностранном руководстве "Williams Obstetrics" (1997) приводится следующая классификация узких тазов: 1. Сужение входа в таз. 2. Сужение полости таза. 3. Сужение выхода таза. 4. Общее сужение таза (комбинация всех сужений).
Иностранные авторы рассматривают вход в таз как суженный, если прямой размер меньше 10 см, поперечный – меньше 12 см и диагональная конъюгата меньше 11,5 см. Состояние, при котором полость таза (узкая часть) при межостном размере менее 10 см, следует рассматривать как подозрение на узкий таз, а менее 8 см – как узкий таз. Сужение полости таза можно определить только при пельвиметрии. О сужении выхода таза следует говорить, если размер между седалищными буграми меньше 8 см. Сужение выхода таза без сужения полости встречается редко.
Поперечносуженный таз (рис. 17.2).
Характеризуется уменьшением поперечных размеров малого таза на 0,6-1,0 см и более, относительным укорочением или увеличением прямого размера входа и узкой части полости малого таза, отсутствием изменений размера между седалищными буграми. Вход в малый таз имеет округлую или продольно-овальную форму. Поперечносуженный таз характеризуется и другими анатомическими особенностями: малая развернутость крыльев подвздошных костей и узкая лонная дуга. Этот таз напоминает таз мужского типа и часто наблюдается у женщин при гиперандрогении.
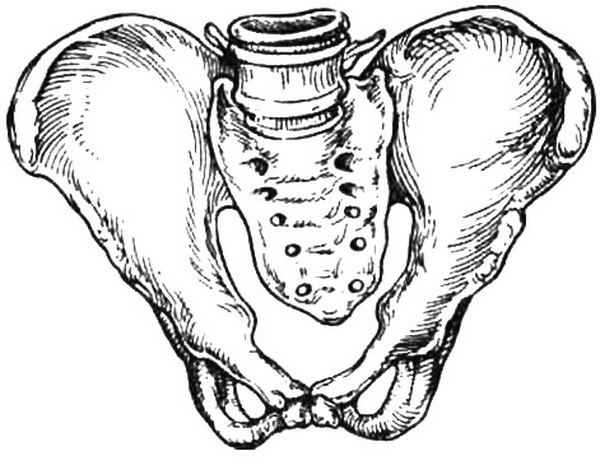 Рис. 17.2. Поперечносуженный таз.
Рис. 17.2. Поперечносуженный таз.
Исходя из величины поперечного диаметра входа, различают три степени сужения поперечносуженного таза. • I 12,4-11,5 см; • II 11,4-10,5 см; • III – менее 10,5 см. .
В диагностике поперечносуженного таза наибольшее значение имеет определение поперечного диаметра крестцового ромба (менее 10 см) и поперечного диаметра выхода таза (менее 10,5 см). При влагалищном исследовании отмечаются сближение седалищных остей, острый лонный угол. Точная диагностика данной формы таза и особенно степени его сужения возможна только при использовании рентгенопельвиметрии, компьютерной рентгенопельвиметрии, магнитно-резонансной томографии.
Плоский таз.
В плоском тазе укорочены прямые диаметры при обычной величине поперечных и косых диаметров. При этом различают три разновидности плоского таза: 1. простой плоский таз; 2. плоскорахитический таз; 3. таз с уменьшением прямого диаметра широкой части полости.
Простой плоский таз (рис. 17.3).
 Рис. 17.3. Простой плоский таз. а – вид спереди; б – сагиттальное сечение по линии прямого размера входа в таз.
Рис. 17.3. Простой плоский таз. а – вид спереди; б – сагиттальное сечение по линии прямого размера входа в таз.
Характеризуется более глубоким вдвиганием крестца в таз без изменения формы и кривизны крестца; вследствие этого крестец ближе обычного придвинут к передней стенке таза и все прямые размеры как входа, так и полости и выхода умеренно укорочены. Кривизна крестца при этом средняя, лонная дуга широкая, поперечный размер входа в таз обычно увеличен. У женщин с простым плоским тазом телосложение правильное. При наружном тазоизмерении поперечные размеры таза нормальные, а наружная конъюгата уменьшена. При влагалищном исследовании выявляется уменьшение диагональной конъюгаты.
Плоскорахитический таз.
Резко отличается по своему строению от нормального (рис. 17.4, а, б). Он является следствием заболеваний детей рахитом. При этом заболевании окостенение широких хрящевых прослоек, разделяющих отдельные костные участки, замедляется; хрящевые прослойки значительно утолщаются. В костях уменьшается количество извести. В связи с этим давление позвоночника на таз и натяжение мышечно-связочного аппарата приводят к деформации таза.
Плоскорахитический таз отличается следующими особенностями: 1. прямой размер входа в таз значительно укорочен в результате глубокого вдвигания крестца в таз мыс выступает в полость таза значительно резче, чем в нормальном тазе; 2. иногда наблюдается второй "ложный" мыс; 3. крестец уплощен и повернут кзади вокруг оси, проходящей в поперечнике пояснично-крестцового сочленения; 4. верхушка крестца отстоит от нижнего края сочленения дальше, чем в нормальном тазе; 5. копчик часто притянут седалищно-крестцовыми связками вместе с последним крестцовым позвонком кпереди (крючкообразно загнут вперед) (см. рис. 17.4, б).
 Рис. 17.4. Плоскорахитический таз. а – вид спереди; б – сагиттальное сечение по линии прямого размера входа в таз.
Рис. 17.4. Плоскорахитический таз. а – вид спереди; б – сагиттальное сечение по линии прямого размера входа в таз.
Изменяется форма подвздошных костей: слабо развитые, плоские крылья; развернутые гребни вследствие значительного вклинивания крестца в таз. Разница между distantia spinarum и distantia cristarum или меньше по сравнению с нормальным тазом, или они равны один другому; при выраженных изменениях расстояние между наружноверхними остями больше, чем между гребешками. Лонная дуга более пологая, чем в нормальном тазе. Проводная ось таза представляет собой не правильную дугу, как в норме, а ломаную линию. Большой и малый таз деформированы; особенно укорочен прямой размер входа при нормальном поперечном его размере; сильно выдающийся в полость таза мыс придает плоскости входа почковидную форму; остальные переднезадние размеры полости таза нормальные или увеличены; размеры выхода больше обычных; в некоторых случаях прямой размер выхода укорочен вследствие резкого выступания под прямым углом Копчика вместе с последним крестцовым позвонком.
При диагностике данной формы таза следует обращать внимание на признаки перенесенного в детстве рахита ("квадратная голова", искривление ног, позвоночника, грудины и др.), уменьшение вертикального размера крестцового ромба и изменение его формы (рис. 17.5). При влагалищном исследовании мыс достижим, крестец уплощен и отклонен кзади, иногда .определяется ложный мыс, прямой размер выхода увеличен.
Таз с уменьшением прямого размера широкой части полости малого таза характеризуется уплощением крестца, вплоть до отсутствия кривизны, уве-личением его длины, уменьшением прямого размера широкой части полости (менее 12 см), отсутствием разницы между прямыми размерами входа, широкой и узкой части полости. Другие размеры обычно нормальны или увеличены. Следует различать две степени сужения: I степень – прямой размер широкой части полости малого таза 12,4-11,5 см и II – размер полости меньше 11,5 см.
 Рис. 17.5. Форма крестцового ромба при узком тазе.
1 – нормальный таз; 2 – плоскорахитический; 3 – общеравномерносуженный; 4 – кососуженный.
Рис. 17.5. Форма крестцового ромба при узком тазе.
1 – нормальный таз; 2 – плоскорахитический; 3 – общеравномерносуженный; 4 – кососуженный.
 Рис. 17.6. Общеравномерносуженный таз
Рис. 17.6. Общеравномерносуженный таз
 Рис. 17.7. Кососуженный (асимметричный) таз.
Рис. 17.7. Кососуженный (асимметричный) таз.
Данную форму некоторые авторы рассматривают как стертую форму плоскорахитического таза.
Для диагностики узкого таза с уменьшением прямого размера широкой части полости информативным является измерение лонно-крестцового размерa – расстояния стояния от середины симфиза до места сочленения между II-III крестцовыми позвонками. Для анатомически нормального таза лоннокрестцовый размер составляет 21,8 см. Размер менее 20,5 см свидетельствует о наличии узкого таза, а менее 19,3 см – основание для предположения, что имеется выраженное уменьшение прямого диаметра широкой части полости малого таза (менее 11,5 см). Выявлена высокая корреляция указанного лонно-крестцового размера с величиной наружной конъюгаты.
Общеравномерносуженный таз (рис. 17.6).
Характеризуется уменьшением на одинаковую величину всех размеров таза (прямые, поперечные, косые) на 1,5-2,0 см и более.
При данном типе таза крестцовая впадина выражена, вход в таз имеет овальную форму, мыс достигается, лонная дуга уменьшена.
Данный тип таза наблюдается у женщин небольшого роста, правильного телосложения. У большинства таких женщин общеравномерносуженный таз представляет собой одно из проявлений общего инфантилизма, возникшего в детстве и в период полового созревания. Кости таза, как и кости всего скелета, обычно тонкие, поэтому полость таза оказывается достаточно просторной, несмотря на укороченные наружные размеры.
Диагностика основана на данных наружной пельвиметрии и влагалищного исследования. В табл. 17.1 представлены ориентировочные данные наружных размеров основных форм узкого таза.
Кососуженный (асимметричный) таз
Кососуженный (асимметричный) таз (рис. 17.7). Возникает после перенесенного в детстве рахита и гонита, вывиха тазобедренного сустава или неправильно сросшегося перелома бедра или костей голени. При указанных заболеваниях и последствиях травм больная наступает на здоровую ногу, и туловище находит опору в здоровом тазобедренном суставе. Постепенно область таза, соответствующая здоровому тазобедренному (коленному) суставу, вдавливается внутрь; половина таза на стороне здоровой ноги становится уже.
Причиной кососуженного таза может быть также сколиоз, при котором тяжесть туловища на конечности распределяется неравномерно, в результате чего вертлужная впадина на здоровой стороне вдавливается и таз деформируется.
Кососуженный таз не всегда препятствует течению родов, так как сужение обычно бывает небольшим. Сужение одной стороны компенсируется тем, что другая является сравнительно просторной.
Заслуживает внимания то, что роженицы, имеющие такой таз, испытывают во время родов желание принять то или иное положение, оказывающееся обычно наиболее выгодным при каждой конкретной ситуации.
Ассимиляционный ("длинный") таз.
Характеризуется увеличением высоты крестца вследствие его срастания с V поясничным позвонком ("сакрализация", "ассимиляция"). При этом происходит уменьшение прямых размеров полости таза, что Может служить препятствием для прохождения головки через родовой канал.
Воронкообразный таз.
Встречается редко; возникновение его связывают с нарушением развития таза вследствие эндокринных расстройств. Воронкообразный таз Характеризуется сужением выхода таза. Степень сужения возрастает сверху вниз, Следствие чего полость таза приобретает вид воронки, сужающейся к выходу.
Крестец удлинен, лобковая дуга узкая, поперечный размер выхода может быть значительно сужен. Роды могут закончиться самостоятельно, если плод нэкрупный и сужение выхода таза выражено нерезко.
Кифотический таз.
Относится к типу воронкообразных. Кифоз позвоночника чаще всего возникает вследствие перенесенного в детстве туберкулезного спондилита, реже рахита. При возникновении горба в нижнем отделе позвоночника центр тяжести туловища смещается кпереди; верхняя часть крестца при этом смещается кзади, истинная конъюгата увеличивается, поперечный размер может оставаться нормальным, вход в таз приобретает продольно-овальную форму. Поперечный размер выхода таза уменьшается вследствие сближения седалищных бугров; лобковый угол острый, полость таза воронкообразно сужается к выходу. Роды при кифозе нередко протекают нормально, если горб расположен в верхнем отделе позвоночника. Чем ниже расположен горб и чем больше выражена деформация таза, тем хуже прогноз родов.
Спондилолистетический таз.
Эта редкая форма таза образуется в результате соскальзывания тела L5 с основания крестца. В случае слабовыраженного соскальзывания L5 лишь немного выступает над краем крестца. При полном соскальзывании нижняя поверхность тела поясничного позвонка закрывает переднюю поверхность S1 и препятствует опусканию предлежащей части в малый таз. Самым узким размером входа является не истинная конъюгата, а расстояние от симфиза до выдающегося в таз Ly. Прогноз родов зависит от степени соскальзывания позвонка и сужения прямого размера входа в таз.
Остеомалятический таз
 Остеомалятический таз (рис. 17.8). Эта патология в нашей стране практически не встречается. Остеомаляция характеризуется размягчением костей, обусловленным декальцинацией костной ткани. Таз резко деформирован, при выраженной деформации образуется спавшийся таз. В литературе описана деформация таза, характеризующаяся резким поперечным сужением вследствие недоразвития крыльев крестца ("робертовский таз").
Остеомалятический таз (рис. 17.8). Эта патология в нашей стране практически не встречается. Остеомаляция характеризуется размягчением костей, обусловленным декальцинацией костной ткани. Таз резко деформирован, при выраженной деформации образуется спавшийся таз. В литературе описана деформация таза, характеризующаяся резким поперечным сужением вследствие недоразвития крыльев крестца ("робертовский таз").
Таз, суженный экзостозами и костными опухолями.
Экзостозы и костные опухоли в области таза наблюдаются очень редко. Экзостозы могут располагаться в области симфиза, крестцового мыса и в других местах. Опухоли, исходящие из костей и хрящей (остеосаркомы), могут занимать значительную часть полости таза. При значительных экзостозах, препятствующих продвижению предлежащей части плода, показано кесарево сечение. При наличии опухолей также показаны оперативное родоразрешение и последующее специальное лечение.
Диагностика узкого таза проводится на основании данных анамнеза, наружного осмотра, объективного исследования (наружная пельвиметрия, влагалищное исследование). При наличии возможностей и по показаниям (невозможность оценить размеры полости таза) применяются дополнительные методы исследования: УЗИ, рентгенопельвиметрия, компьютерная томографическая пельвиметрия, магнитно-резонансная томография.
При сборе анамнеза следует фиксировать внимание на наличие перенесенного в детстве рахита, травматических повреждений костей таза, на осложненное течение и неблагоприятный исход предыдущих родов, оперативное родоразрешение (акушерские щипцы, вакуум-экстракция плода, кесарево сечение), мертворождение, черепно-мозговую травму у новорожденных, нарушение неврологического статуса в раннем неонатальном периоде, •рДннкю детскую смертность.
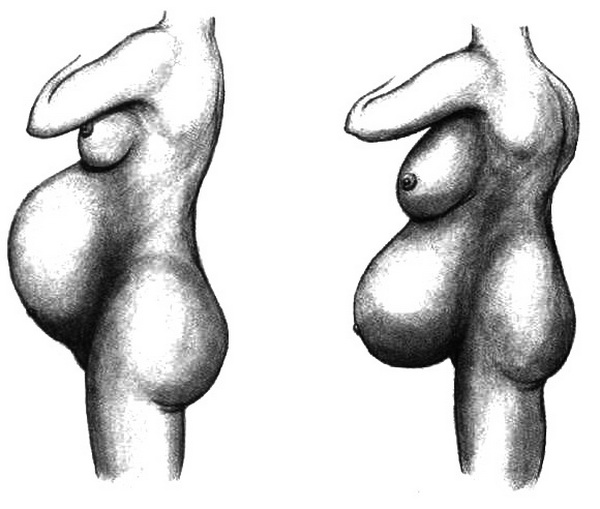 Рис. 17.9. Формы живота при узком тазе.
а – у первородящей (остроконечный живот): б – у повторнородящей (отвислый живот).
Рис. 17.9. Формы живота при узком тазе.
а – у первородящей (остроконечный живот): б – у повторнородящей (отвислый живот).
Наружный осмотр производится сначала в вертикальном положении женщины. Прежде всего определяют массу тела и рост. Рост 150 см и ниже с известной достоверностью свидетельствует об анатомическом сужении таза.
При осмотре особое внимание обращают на строение скелета – следы перенесенных заболеваний, при которых наблюдаются изменения костей и суставов (рахит, туберкулез и др.). Изучают состояние черепа (не имеет ли он квадратную форму), позвоночника (сколиоз, кифоз, лордоз), конечностей !(саблевидное искривление ног, укорочение одной ноги), суставов (анкилоз в тазобедренных, коленных и других суставах), походки (переваливающаяся "утиная" походка свидетельствует о чрезмерной подвижности сочленений тазовых костей) и т.д. Выясняют, не имеет ли живот остроконечную, как бы заостренную кверху форму у первородящих или отвислую – у многорожавших (рис. 17.9), что характерно в конце беременности для женщин с зауженным тазом.
В вертикальном положении обследуемой составляют представление об угле наклонения таза, точное определение которого возможно при помощи тазоугломера (гониометра). Для практических целей достаточны ориентировочные данные, полученные путем простого осмотра. При угле наклонения таза, превышающем 55°, крестец, ягодицы и наружные половые органы отклонены кзади, отмечается выраженный лордоз поясничной части позвоночника, внутренние поверхности бедер не соприкасаются полностью друг с другом. При меньшем угле наклонения таза (менее 5 5°) крестец расположен вертикально, лонное сочленение поднято вверх, наружные половые органы выступают вперед, лордоз поясничной части позвоночника отсутствует, внутренние поверхности бедер плотно соприкасаются друг с другом По степени изменения угла наклонения таза при различных положениях беременной можно судить о подвижности сочленений таза.
Большое значение для оценки таза имеет форма крестцового ромба. Он хорошо виден, если обнаженную спину женщины рассматривать при боковом освещении.
У инфантильных женщин с общеравномерносуженным тазом продольный и поперечный размеры ромба пропорционально уменьшены.
Чем шире крестец, а следовательно, чем больше поперечные размеры полости таза, тем дальше отстоят друг от друга боковые ямки крестцового ромба. При уменьшении поперечных размеров расстояние между боковыми ямками сближается.
При уменьшении переднезаднего размера (уплощение таза) сокращается расстояние между верхним и нижним углом ромба.
При значительном уплощении таза основание крестца сдвигается вперед и остистый отросток последнего поясничного позвонка оказывается на уровне боковых ямок, вследствие этого ромб принимает форму треугольника, основанием которого является линия, соединяющая боковые ямки, сторонами же – сходящиеся линии ягодиц. При резких деформациях таза ромб имеет неправильные очертания, которые зависят от особенностей строения таза и его размеров.
При наружном акушерском исследовании можно предположить о сужении таза в той ситуации, когда определяется высокое (над входом) стояние головки у первородящей ("подвижная головка") либо когда она отклонена от входа в таз в ту или иную сторону, что наблюдается при косом и поперечном положении плода.
Важную информацию о размерах таза можно получить при наружной пельвиметрии, хотя корреляционная зависимость между размерами большого и малого таза выявляется не всегда. Кроме измерений d.spinarum, d.cristarum, d.trochanterica, conjugata externa, следует производить определение боковых конъюгат – расстояние между переднеи задневерхними остями подвздошной кости с каждой стороны (в норме они равны 14-15 см). Уменьшение их до 13 см свидетельствует о сужении таза. Одновременно измеряют косые размеры: 1. расстояние от передне верхней ости одной стороны до задневерхней ости другой стороны (в норме равно 22,5 см); 2. расстояние от середины симфиза до задневерхних остей правой и левой подвздошных костей; 3. расстояние от надкрестцовой ямки до передневерхних остей справа и слева. Разница между правым и левым размерами свидетельствует об асимметрии таза.
Важное значение в оценке таза и прогноза родов играет также определение размеров выхода из малого таза: прямого и поперечного.
Для правильного суждения о размерах истинной конъюгаты по данным диагональной конъюгаты следует обязательно учитывать высоту лонного сочленения (в норме 4 – 5 см). Емкость малого таза в значительной степени зависит от толщины костей таза. При увеличении окружности лучезапястного сустава свыше 16 см следует предполагать большую толщину костей таза и, следовательно, уменьшение емкости малого таза.
Важное значение имеет влагалищное исследование; при котором следует подробно изучить рельеф внутренней поверхности таза. Обращают внимание на емкость таза (широкий, суженный таз), состояние крестца (вогнутый, характерный для нормального таза; плоский и отогнутый кзади по оси, идущей через сочленение между V поясничным и I крестцовым позвонками при рахитичном тазе), на наличие клювовидного или двойного мыса, состояние копчика (степень его подвижности, нет ли крючкообразного его заги-бания кпереди), состояние лонной дуги (наличие выпячиваний, шипов и наростов на внутренней поверхности лонных костей, высоту и изогнутость лонной дуги, насколько узка выемка, образованная нисходящими ветвями лонных костей), состояние лонного сочленения (плотность примыкания друг к другу лонных костей, подвижность и ширину лонного сочленения, наличие на нем плотного нароста) и т.д.
Основным показателем степени сужения таза является величина истинной конъюгаты. Во всех случаях, когда этому не мешает опустившаяся в полость таза предлежащая часть плода, необходимо измерять диагональную конъюгатуи, вычтя 1,5-2 см, определять длину истинной конъюгаты.
Рентгенопельвиметрия позволяет определить прямые и поперечные размеры малого таза во всех плоскостях, форму и наклон стенок таза, степень кривизны и наклон крестца, форму лонной дуги, ширину симфиза, экзостозы, деформации, размеры головки плода, особенности ее строения (гидроцефалия), конфигурацию, положение головки по отношению к плоскостям таза и др. Современная отечественная рентгенологическая аппаратура (цифровая сканирующая рентгенографическая установка) позволяет в 20-40 раз снизить лучевую нагрузку по сравнению с пленочной рентгенопельвиметрией.
Ультразвуковое исследование по своей информативности уступает рент-генографическому, так как при трансабдоминальном сканировании можно определить только истинную конъюгату, а также место расположения головки плода, ее размеры, особенности вставления, а в родах – степень раскрытия шейки матки.
Трансвагинальная эхография позволяет провести измерение прямых и поперечных размеров малого таза.
Весьма информативной при диагностике узкого таза является комбинация ультразвукового исследования и рентгенпельвиметрии.
При использовании магнитно-резонансной томографии обеспечивается точность измерения таза, предлежащей части плода, мягких тканей таза и при этом отсутствует ионизирующая радиация. Метод лимитирован из-за Дороговизны и трудности обучения методике.
Течение и ведение беременности при узком тазе.
Не-благоприятное влияние суженного таза на течение беременности сказывается лишь в последние ее месяцы.
У первородящих вследствие пространственных несоответствий между тазом и головкой плода последняя не вступает в таз и может оставаться подвижной над его входом в течение всей беременности, вплоть до начала родов. Высокое стояние головки у первородящих в последние месяцы беременности отражается на течении беременности. Головка плода не опускается в малый таз, а брюшная стенка беременной малоподатлива. В связи с этим растущая матка может подниматься только вверх и, подойдя к диафрагме, поднимает ее значительно выше, чем у беременных при нормальном тазе. Как следствие этого, значительно ограничивается экскурсия легких и смещается сердце. Поэтому при сужении таза одышка в конце беременности появляется раньше, держится дольше и более выражена, чем при беременности у женщин с нормальным тазом.
Головка стоит над входом в малый таз, передние и задние воды не разграничены.
 Рис. 17.10. Вставление головки во вход в малый таз при нормальном (а) и анатомически узком (б) тазе.
Рис. 17.10. Вставление головки во вход в малый таз при нормальном (а) и анатомически узком (б) тазе.
 Рис. 17.11. Выпадение петли пуповины.
Рис. 17.11. Выпадение петли пуповины.
Матка у беременных с суженным тазом отличается подвижностью. Дно ее в силу своей тяжести легко поддается всякому движению беременной, что наряду с высоким стоянием головки предрасполагает к образованию неправильных положений плода – поперечных и косых. У 25 % рожениц с установившимся поперечным и косым положением плода обычно имеется в той или иной степени выраженное сужение таза. Тазовое предлежание плода у рожениц с суженным тазом встречается в три раза чаще, чем У рожениц с нормальным тазом.
Суженный таз влияет и на характер вставления головки плода. В выраженных случаях остроконечного и отвислого живота умеренный асинклитизм, благоприятствующий физиологическому течению родов, усиливается и переходит в патологическое асинклитическое вставление, являющееся серьезным осложнением родов (рис. 17.10). Подвижность головки плода над суженным входом в таз способствует возникновению разгибательных предлежаний головки (переднеголовное, лобное и лицевое), которые сравнительно часто осложняют течение родов при суженном тазе. Одним из частых и серьезных осложнений беременности при данной патологии является преждевременное излитие околоплодных вод вследствие отсутствия пояса прилегания. При преждевременном излитии околоплодных вод (до начала родовой деятельности) нередки случаи выпадения петель пуповины (рис. 17.11).
Беременные с узким тазом относятся к группе высокого риска развития осложнений и в женской консультации должны находиться на специальном учете. Необходимо своевременное выявление аномалий положений плода и других осложнений. Важно определить срок родов, чтобы предупредить перенашивание беременности, которое при узком тазе особенно неблагоприятно. За 1-2 нед до родов беременных следует госпитализировать в отделение патологии для уточнения диагноза и выбора рационального метода родоразрешения. При наличии гестоза и других осложнений беременную направляют в родильный дом независимо от срока гестации.
Течение родов при узком тазе.
Течение родов при узком тазе зависит прежде всего от степени сужения таза. Так, при I и реже II степени сужения, средних и малых размерах плода возможны роды через естественные родовые пути. При II степени сужения таза осложнения в родах встречаются значительно чаще, чем при I степени. Что касается III и ГУ степени сужения таза, то роды в этих случаях живым доношенным плодом невозможны.При узком тазе нередко наблюдается раннее излитие околоплодных вод вследствие высокого стояния головки и отсутствия разграничения вод на передние и задние. В момент излитая вод во влагалище может выпасть петля пуповины или ручка плода. Если не оказать своевременно помощь, то пуповина прижимается головкой к стенке таза и плод погибает от гипоксии. Выпавшая ручка уменьшает объем узкого таза, создавая дополнительное препятствие для изгнания плода.
При преждевременном и раннем излитии вод процесс раскрытия шейки матки замедляется, на головке образуется родовая опухоль, нарушается маточно-плацентарный кровоток, что способствует развитию гипоксии у плода. В случае длительного безводного промежутка микробы из влагалища проникают в полость матки и могут вызвать эндометрит в родах (хориоамнионит), плацентит, инфицирование плода.
При узком тазе нередко наблюдаются аномалии родовой деятельности, которые проявляются в виде первичной и вторичной слабости, дискоординации. Роды приобретают замедленный характер, роженица утомляется, и У плода нередко возникает гипоксия.
При узком тазе характерным является замедленное раскрытие шейки Матки и в конце периода раскрытия может появиться желание тужиться – "ложные потуги", что обусловлено раздражением шейки матки вследствие ее прижатия ко входу в малый таз.
При узком тазе в периоде изгнания головка длительное время находится во всех плоскостях таза. Под влиянием родовой деятельности головка, фиксированная во входе в таз, подвергается значительной конфигурации при этом приспосабливается к форме узкого таза, что и способствует прохождению через родовые пути.
Период изгнания.
При узком тазе этот период обычно затягивается: ддя изгнания плода через узкое кольцо таза требуется хорошая родовая деятельность. При наличии значительного препятствия к изгнанию могут возникнуть бурная родовая деятельность и перерастяжение нижнего сегмента матки, что в конечном итоге может привести к разрыву матки. У некоторых рожениц после бурной родовой деятельности наступает вторичная слабость родовых сил, потуги прекращаются и плод может погибнуть от гипоксии.
При длительном стоянии головки во входе или в полости таза могут происходить сдавление мягких тканей родовых путей между костями таза и головкой плода. Кроме шейки матки и влагалища, сдавливаются мочевой пузырь и мочеиспускательный канал спереди, прямая кишка – сзади. Прижатие мягких тканей ведет к нарушению в них кровообращения; возникают цианоз и отек шейки матки, стенки мочевого пузыря, а в дальнейшем – влагалища и наружных половых органов.
В связи с прижатием мочеиспускательного канала и мочевого пузыря прекращается мочеиспускание, наступают нарушения кровообращения ив дальнейшем – некроз тканей. На 5 -7-й день после родов некротическая ткань может отторгаться и образуются мочеполовые или прямокишечно-влагалищный свищи. При общесуженном тазе возможно циркулярное ущемление шейки матки, что приводит к ее ампутации. Отек шейки матки и затрудненное мочеиспускание являются симптомами значительного сдавливания тканей. Примесь крови в моче – угрожающий признак, указывающий на несоответствие и возможность образования свища. Появление кровянистых выделений (даже умеренных) из половых путей, частые и болезненные схватки, истончение и болезненность нижнего сегмента матки свидетельствуют об угрозе ее разрыва. При затяжном и затрудненном периоде изгнания возможно сдавление нервов с последующим возникновением пареза мышц ног. Если прохождение головки через таз связано со значительными трудностями, то иногда возникает повреждение лобкового симфиза, особенно если в периоде изгнания используют прием Кристеллера.
Последовый период. В последовом периоде при узком тазе нередко возникают кровотечения в связи с нарушением отслойки плаценты. Причиной этого служит то, что при перерастянувшихся в течение длительного и трудного периода изгнания стенках матки и брюшном прессе утомленная роженица не может развить хороших последовых схваток и потуг, необходимых для физиологической отслойки и рождения плаценты. В результате наступает частичная отслойка плаценты с опасным кровотечением из матки.
Послеродовой период.
В раннем послеродовом периоде нередко наблюдается гипотоническое кровотечение из матки, так как у матки временно снижена или потеряна способность сокращаться. Может наблюдаться также кровотечение из разрывов шейки матки и других тканей родового канала.
В позднем послеродовом периоде возможны послеродовые инфекционные заболевания, а при неправильном ведении родов – мочеполовые и кишечно-половые свищи, повреждения сочленений таза и др.
Осложнения, угрожающие плоду. Такие осложнения часто возникают при узком тазе. Затяжные роды и часто наблюдающиеся аномалии родовых сил вызывают нарушения маточно-плацентарного кровотока и гипоксию плода. При этом возможны кровоизлияния в мозг и другие органы плода. Кровоизлияния в мозг усиливаются при резком сдавливании головки и чрезмерном смещении костей черепа в области швов. Разрыв сосудов может привести к кровоизлиянию под надкостницу одной или обеих теменных костей – кефалогематома. При узком тазе часто образуются большая родовая опухоль, иногда вдавление (рис. 17.12) и трещины костей черепа.
Мертворождаемость, ранняя детская смертность и заболеваемость при узком тазе значительно выше, чем при нормальном.
Нередко появившиеся в периоде раскрытия шейки матки осложнения, характерные для родов при узком тазе, через некоторое время устраняются силами природы, и в дальнейшем роды протекают физиологически. В других случаях эти осложнения начинают выявляться лишь в периоде изгнания. Несмотря на то что роды протекают с большими затруднениями, они часто заканчиваются самопроизвольно. У таких рожениц после раскрытия маточного зева и излития околоплодных вод при хороших схватках и потугах головка плода сначала прижимается ко входу в таз и затем фиксируется в нем. Несмотря на отсутствие заметного продвижения головки, она совершает медленное движение, часто вновь возвращаясь в исходное положение, как только потуга прекращается. Головка плода совершает вращательные движения, при этом изменяется взаиморасположе-ние родничков: опускается в таз попеременно то малый, то большой родничок. В результате длительных потуг головка плода все глубже вклинивается в таз. Приспосабливаясь, она изменяет свою форму, все больше соответствуя форме родового канала.
Теменные кости благодаря асинклитическому вставлению в различной степени вдаются в полость таза, поэтому одна из них на месте стреловидного шва заходит под другую. Как правило, лежащая выше теменная кость (задняя), задерживаемая мысом, заходит под лежащую ниже (переднюю). Если лежащая выше кость является передней (при заднем асинклитизме), то она вдвигается под нижележащую противодавлением лонного сочленения. Менее выраженное захождение одной кости под другую наблюдается в области лобного, венечного и ламбдовидного швов.
Такая конфигурация головки совершается очень медленно в результате длительных схваток и потуг. Незначительное уменьшение общего объема головки плода происходит за счет оттока цереброспинальной жидкости в позвоночный канал.
Если есть препятствие рождающейся головке только на входе в таз, то головка, миновав его, рождается в дальнейшем без особых затруднений. Если же сужены и другие отделы таза, то хорошо конфигурированная головка плода под действием схваток и потуг продвигается по последнему, совершая вместе с туловищем механизм родов, который различен для каждой формы сужения таза.
 Рис. 17.12. Вдавление костей черепа плода как результат родов при узком тазе.
Рис. 17.12. Вдавление костей черепа плода как результат родов при узком тазе.
Механизм родов при узком тазе отличается от механизма родов, типичного для нормального таза, и имеет характерные особенности, свойственные форме сужения.
Механизм родов при поперечносуженном тазе.
При поперечносуженном тазе и отсутствии значительного уменьшения его поперечных размеров и средних размерах головки плода механизм родов не отли-чается от такового при нормальном тазе.
Характерным при поперечносуженном тазе без увеличения прямого размера входа является асинклитическое вставление головки, когда она вставляется в одном из косых размеров плоскости входа передней теменной костью, стреловидный шов при этом смещается кзади.
Согнутая головка постепенно опускается в полость таза и в дальнейшем совершает такие же движения, как при нормальном механизме родов: внутренний поворот (затылком кпереди), разгибание, наружный поворот. Длительность родов при поперечносуженном тазе больше, чем при нормальном. Однако при сочетании поперечного сужения таза с увеличением истинной конъюгаты и других прямых размеров таза, особенно когда истинная конъюгата больше поперечного размера входа, нередко головка устанавливается стреловидным швом в прямом размере, затылком кпереди, что для данной формы сужения таза является благоприятным. При этом головка сгибается и опускается до выхода таза, не делая внутреннего поворота, и затем разгибается (рождается).
Если головка устанавливается стреловидным швом в прямом размере и затылок плода обращен кзади, то поворот согнутой головки на 180° может произойти в полости таза (при небольшой головке и энергичной родовой деятельности), и она прорезывается в переднем виде.
Если затылок плода не поворачивается кпереди, то может образоваться высокое прямое стояние головки и появляются признаки клинического несоответствия, что является показанием к кесареву сечению.
Механизм родов при плоскорахитическом тазе.
Прямой размер входа в таз уменьшен. Обусловленные этим затруднения преодолеваются в результате следующих особенностей механизма родов, имеющих приспособительный характер: 1. Продолжительное стояние головки сагиттальным швом в поперечном размере входа в таз. Вследствие сужения входа головка может находиться в таком положении несколько часов даже при хорошей родовой деятельности. 2. Небольшое разгибание головки, в результате которого большой родничок располагается на одном уровне с малым или ниже него (рис. 17.13). При таком разгибании через наименьший размер – истинную конъюгату – головка проходит малым поперечным размером (8,5 см). Большой поперечный размер (9,5 см) отклоняется в сторону, где больше пространства. Головка в таком состоянии приспосабливается ко входу в таз и потому, что размер слегка разогнутой головки (12 см) меньше поперечного размера входа (13-13,5 см). 3. Асинклитическое вставление головки. Обычно наблюдается передний – негелевский – асинклитизм (переднетеменное вставление головки) (рис. 17.14, а); при этом задняя теменная кость упирается в выступающий кпереди мыс и задерживается на этом месте, а передняя теменная кость постепенно опускается в полость таза. Сагиттальный шов располагается ближе к мысу. В таком положении (сагиттальный шов в поперечном размере таза – ближе к мысу, большой родничок ниже малого) головка плода стоит во входе в таз до тех пор, пока не произойдет достаточно сильная ее конфигурация. После этого задняя теменная кость соскальзывает с мыса, асинклитизм исчезает, головка сгибается. В дальнейшем механизм родов такой же, как при переднем виде затылочного предлежания (внутренний поворот, разгибание, наружный поворот головки). Реже наблюдается более неблагоприятный задний – литцмановский асинклитизм (рис. 17.14, б) (заднетеменное вставление головки), характеризующийся более глубоким вставлением заднетеменной кости. Иногда у новорожденного наблюдается вдавливание на кости головки вследствие длительного прижатия к мысу.
 Рис, 17.13. Механизм родов при плоском тазе. Разгибание головки во входе в малый таз.
Рис, 17.13. Механизм родов при плоском тазе. Разгибание головки во входе в малый таз.
 Рис. 17.14. Механизм родов при плоскорахитическом тазе.
а – асинклитическое вставление головки (переднетеменное); б – асинклитическое вставление головки (заднетеменное).
Рис. 17.14. Механизм родов при плоскорахитическом тазе.
а – асинклитическое вставление головки (переднетеменное); б – асинклитическое вставление головки (заднетеменное).
Механизм родов при простом плоском тазе.
Головка вступает во вход так же, как при плоскорахитическом тазе. В дальнейшем она опускается в полость таза и рождается по типу затылочного предлежания Однако нередко внутренний поворот головки не происходит потому, что наряду с прямым размером входа в таз уменьшены прямые размеры полости и выхода таза. Головка плода достигает плоскости узкой части полости таза иногда даже его дна, а сагиттальный шов находится в поперечном размере таза. Эта особенность механизма родов называется низким поперечным стоянием головки. В некоторых случаях головка плода на дне таза поворачивается затылком кпереди и рождается самостоятельно. Если поворот не произойдет возникают осложнения (вторичная слабость родовых сил, асфиксия плода и др.), являющиеся показанием к оперативному родоразрешению.
Внутренний поворот головки затылком кпереди совершается при переходе из широкой части полости в узкую, разгибание головки – в выходе таза. Иногда наблюдается косое асинклитическое вставление головки. Роды при заднем виде затылочного предлежания плода способствуют развитию клинического несоответствия таза и головки.
Механизм родов при общ еравномерносуженном тазе. К началу родов головка плода находится в слегка согнутом положении над входом в таз – стреловидным швом над поперечным или одним из косых размеров. Фиксированная во входе головка в силу испытываемого ею давления со стороны матки начинает сгибание настолько, насколько это необходимо для вступления, а затем и прохождения через вход в таз. Первая особенность механизма родов при равномерносуженном тазе – это начало выраженного сгибания головки во входе в таз (рис, 17.15, а).
Опустившись в широкую часть полости малого таза и встретив здесь противодействие со стороны стенок таза, головка медленно продолжает свое поступательное и сгибательное движение, присоединяя к ним еще одно – вращательное.
Когда головка подходит к плоскости узкой части таза, она оказывается уже в выраженном согнутом положении; стреловидный шов ее находится в косом, а иногда даже почти в прямом размере узкой части полости малого таза. Здесь головка плода встречает препятствие со стороны наиболее узкой части таза. Это препятствие преодолевается благодаря дальнейшему сгибанию головки, совершающемуся при ее переходе из широкой в узкую часть полости малого таза. Сгибание становится максимальным. При этом малый родничок занимает в полости таза центральное положение – находится на осевой линии таза. Этот признак, определяемый при влагалищном исследовании, весьма характерен для максимального сгибания головки. Благодаря такому сгибанию головка проходит через самое узкое место таза наименьшей своей окружностью, проходящей через малый косой размер.
Максимальное сгибание головки, происходящее при переходе головки из широкой части полости малого таза в узкую, составляет вторую особенность механизма родов при общеравномерносуженном тазе.
При значительном сужении таза даже такого выраженного сгибания головки оказывается недостаточно для преодоления суженного родового канала. Несоответствие между головкой плода и тазом компенсируется резкой конфигурацией головки, иногда настолько сильной, что она вытягивается в длину, в сторону малого родничка – образуется долихоцефалическая форма головки (рис. 37.15, б). Нередко головка плода, стоящая большим своим сегментом в широкой части полости малого таза или несколько выше, своим нижним полюсом находится в выходе и даже показывается из половой щели, что может привести к ошибочному заключению относительно высоты стояния головки в тазе.
Резкая долихоцефалическая конфигурация головки является третьей особенностью механизма родов при общеравномерносуженном тазе.
Подойдя к выходу таза со стреловидным швом в прямом его размере, головка начинает разгибаться, и в дальнейшем механизм родов протекает так же, как и при нормальном тазе.
Естественно, что сужение таза и необходимость добавочного движения головки – максимального сгибания и резкой ее конфигурации – требуют для прохождения головки больше времени, чем при нормальном тазе. Поэтому роды в целом и период изгнания в частности длительны. Этим объясняется возникновение большой родовой опухоли в области малого родничка, которая удлиняет и без того резко вытянутую долихоцефалическую головку плода.
Особенно неблагоприятно протекают роды при сочетании общеравномерносуженного таза с крупным плодом, с разгибательными вставлениями головки (переднеголовное, лицевое, лобное предлежание) и задним видом затылочного предлежания. В таких случаях головка плотно вколачивается в малый таз, и дальнейшее ее продвижение полностью прекращается, что требует оперативного окончания родов.
 Рис. 17.15. Механизм родов при общеравномерносуженном тазе. а сгибание головки во входе в малый таз; б – резкая конфигурация головки (долихоцефалическая головка).
Рис. 17.15. Механизм родов при общеравномерносуженном тазе. а сгибание головки во входе в малый таз; б – резкая конфигурация головки (долихоцефалическая головка).
При тазовых предлежаниях, особенно при крупном плоде, может наблюдаться несоответствие между тазовым концом и размерами таза, но чаще осложнения возникают во время рождения последующей головки вследствие преждевременного разгибания ее и запрокидывания ручек. При значительном несоответствии между тазом и головкой выведение последующей головки оказывается иногда очень затрудненным, плод гибнет и роды заканчиваются краниотомией. Но и в тех случаях, когда плод рождается живым, он нередко умирает вследствие внутричерепной травмы.
Ведение родов при узком тазе. Клинически узкий таз
Ведение родов
Издавна считалось, что ведение родов при узком тазе требует большого искусства от врача. В прошлом при узком тазе допускались "пробные роды" у первородящих, т.е., несмотря на сужение размеров таза и определенную несоразмерность головки, пытались провести роды через естественные родовые пути. Нередко при этом наблюдались серьезные травмы как матери так и ребенка.
В истории развития акушерства известны предложения преодолевать сопротивление таза с помощью акушерских щипцов, накладываемых на высоко стоящую головку. В последующем от этого отошли из-за чрезвычайно выраженного травматизма для матери и плода. Появилось даже образное выражение "щипцы для узкого таза, что кулак для глаза".
Некоторые авторы при вставившейся, или вклинившейся, в малый таз головке рекомендовали рассечение симфиза – симфизиотомию (пуботомия), что увеличивает размеры таза. Эта операция широкого распространения не имела.
В настоящее время тактика врача при ведении родов у пациенток с узким тазом изменилась, и самопроизвольные роды допускаются только тогда, когда, несмотря на уменьшение размеров таза, существенных препятствий для рождения головки он не представляет.
Оперативное родоразрешение при узком тазе может быть осуществлено в конце беременности до начала или с началом родовой деятельности.
Абсолютным показанием к кесареву сечению является анатомически узкий таз при сужении III-IV степени (встречается крайне редко); наличие экзостозов или костных опухолей в малом тазе, препятствующих прохождению плода; резкие деформации таза в результате перенесенной травмы; наличие при предыдущих родах разрывов лонного сочленения или других повреждений таза, мочеполовых и кишечно-половых свищей, обусловленных сужением таза.
При сужении таза I-II степени роды могут быть: 1. нормальными; 2. затрудненными, но заканчивающимися благоприятно при оказании адекватной помощи; 3. очень тяжелыми с опасными осложнениями для женщины и плода.
Течение родов при узком тазе зависит от следующих причин: 1. степени сужения таза; 2. размеров головки плода; 3. характера предлежания и вставления головки; 4. способности головки к конфигурации; 5. интенсивности (характера) родовой деятельности; 6. готовности женского организма к родам ("зрелость" шейки матки), 7. состояния плода.
При благоприятных сочетаниях указанных условий роды протекают нормально, особенно при I степени сужения таза.
В отсутствие таковых более целесообразным является кесарево сечение, которое производят в конце беременности или в начале родовой деятельности. Показанием к нему являются состояния, при которых возможно развитие слабости родовой деятельности или особенностей вставления головки плода, препятствующих ее прохождению через костное кольцо таза: 1. крупные размеры плода; 2. перенашивание беременности; 3. хроническая гипоксия плода; 4. газовое предлежание; 5. аномалии развития половых органов; 6. рубец на матке после кесарева сечения и других операций; 7. указание на наличие в анамнезе бесплодия; 8. возраст первородящих старше 30 лет и т.д.
У беременных с узким тазом I и реже И степени сужения и небольших размерах плода роды начинают вести через естественные родовые пути с функциональной оценкой таза. Только во время родов можно решить вопрос о том, будет ли данный анатомически узкий таз в функциональном отношении узким или нормальным.
Во время родов систематически следят за функцией важнейших органов, характером родовых сил, состоянием плода, способностью головки плода к конфигурации, за механизмом вставления и продвижения головки, за состоянием родовых путей, особенно матки и ее нижнего сегмента, расположением контракционного кольца. Тщательно следят за степенью соответствия объема головки плода и таза роженицы во время родов.
При ведении родов у рожениц с узким тазом определенное значение имеет ее положение. Для предупреждения раннего излития вод роженице не разрешают вставать, рекомендуют лежать на том боку, к которому обращены спинка и затылок плода. Подобное положение плода способствует опусканию затылка и сохранению околоплодных вод.
Раньше для предотвращения преждевременного разрыва плодного пузыря использовали кольпейринтер, вводимый во влагалище. В последующем от его применения отказались, поскольку он способствовал распространению инфекции.
В течение родов систематически производят обследование роженицы, через 2-3 ч измеряют температуру тела, особенно при раннем или преждевременном излитии вод. чтобы вовремя выявить развитие хориоамнионита. Регулярно проводят влагалищное исследование, которое обязательно после излития вол, чтобы выяснить, не произошло ли выпадение пуповины или ручки. Одновременно уточняют вариант вставления головки.
Большое значение имеет и наблюдение за состоянием мочевого пузыря. Переполнение последнего и невозможность самопроизвольного опорожнения, часто наблюдающиеся в родах при узком тазе, не всегда зависят только от механического сдавления мочеиспускательного канала между головкой плода и лонным сочленением. Довольно часто это объясняется нарушением Функции мочевого пузыря в результате расстройства иннервации, часто сопутствующего анатомическому состоянию нижнего сегмента матки. Естественно, что возможна и комбинация обеих этих причин. Переполненный Мочевой пузырь должен быть опорожнен (в случае необходимости катетером). Это стимулирует родовую деятельность, способствует продвижению головки по родовому каналу и предупреждает в известной степени образование свищей. Задержка мочеиспускания может явиться одним из признаков, указывающих на необходимость проведения кесарева сечения.
Состояние родовых сил. Во время родов тщательно следят за характером Родовой деятельности: силой и частотой схваток. При развитии слабости или дискоординации родовой деятельности часто решается вопрос о кесаревом сечении.
Активация родовой деятельности допустима только в отсутствие несоразмерности между газом и головкой. Поэтому перед тем как начать стимуляцию родовых сил, необходимо тщательно исследовать роженицу, чтобы исключить признаки несоразмерности.
Если при слабости родовой деятельности роженица утомлена, ей предоставляется медикаментозный отдых. После отдыха родовая деятельность может нормализоваться. При продолжающейся слабости родовых сил назначают средства, усиливающие сокращения матки. При узком тазе их применяют осторожно. Не рекомендуется родостимуляция с помощью малоуправляемых схем, при которых средства тономоторного действия вводятся подкожно, внутримышечно, чтобы не вызвать чрезмерной активности схваток и потуг, так как это может привести к разрыву матки, если продвижение головки затруднено.
При необходимости обезболивания родов применяют легко управляемые ингаляционные анестетики (закисно-кислородная смесь), электроаналгезию, эпидуральную анестезию.
Состояние и размеры плода.
Путем систематических исследований роженицы (наружных и влагалищных) должно быть установлено положение плода, членорасположение (разгибание и боковое склонение головки), размеры, особенно головки, ее объем и плотность костей, характер вставления предлежащей части в газ, состояние сердечных тонов плода.
Для оценки общего состояния плода большое значение имеют результаты влагалищного исследования: плотность костей черепа, их подвижность относительно друг к другу, зависящая от ширины и эластичности родничков и швов, степень захождения одной кости под другую, наличие родовой опухоли, ее месторасположение, положение большого сегмента в той или другой плоскости таза, срединное положение стреловидного шва или отклонение его к лону либо к мысу, стояние малого родничка по проводной оси таза или смещение в ту или иную сторону от нее. Все это указывает, правильно ли совершается механизм родов, в какой степени и как преодолевает головка препятствие со стороны родового канала, как последний влияет на плод. Резкая конфигурация головки способствует ее продвижению вперед и выгодна для матери – уменьшается опасность повреждения родовых путей, но она небезразлична для плода, так как усиливает опасность внутричерепной травмы.
Чрезвычайно важным является своевременная диагностика ранних признаков гипоксии плода, определяемых при мониторном наблюдении за его сердцебиением (кардиотокография).
Если не осуществляется кардиомониторное наблюдение за состоянием плода, то выслушивать сердцебиение как в первом, так и, особенно, во втором периоде родов следует как можно чаще через каждые 15 мин в первом периоде и после каждой потуги во втором.
При выявлении признаков гипоксии в первом периоде целесообразно роды закончить кесаревым сечением, во втором периоде – в зависимости от расположения головки апода – наложением акушерских щипцов, вакуум-экстракцией (вынужденные операции). Для ускорения рождения плода необходима леринеоили эпщиотомия.
Состояние родовых путей Состояние твердых родовых путей определя путем наружного осмотра, измерений таза (наружный и внутренний), и алагалишным обследованием стенок родового канала.
В родах можно несколько увеличить истинную конъюгату, изменял угол наклонения газа. Истинную конъюгату удлиняет вальхеровское положение: роженицу укладывают на край родильной кровати таким образом, чтобы ноги свободно свисали вниз. В указанном положении ноги оттягивают переднюю стенку таза книзу, в результате чего верхний край симфиза удаляется от мыса. В настоящее время это положение практически не применяется.
При заднем асинклитизме выгодно приподнять вершину крестца вверх, притягивая бедра роженицы к животу или подклалывая под крестец полушку. Этим достигается уменьшение угла наклонения таза, способствующее исправлению патологического асинклитизма. При переднетеменном асинклитизме, напротив, выгодно опустить крестец вниз. Для этого под поясницу подкладывают валик.
Состояние мягких родовых путей в родах при узком тазе имеет большое значение и должно находиться под тщательным наблюдением. Во всех случаях, когда может быть заподозрено ущемление мягких тканей между головкой плода и стенками таза, немедленно следует произвести влагалищное исследование для выяснения действительного положения и принятия мер к устранению выявленных осложнений. На начавшееся ущемление мягких тканей может указывать переполнение мочевого пузыря вследствие невозможности самопроизвольного его опорожнения при долгом стоянии головки в одной и той же плоскости таза, особенно при входе и выходе, а также отечность половых органов, в первую очередь шейки матки.
Если обнаружена отечная губа шейки матки, последняя должна быть заправлена за головку, что можно произвести без особых затруднений, если маточный зев раскрыт на 8 см и более, а головка плода располагается малым сегментом во входе в таз ми ниже.
Значительный отек наружных половых органов, появление кровяных выделений из влагалища, моча, окрашенная кровью, перерастяжение (истончение и болезненность) нижнего сегмента матки и гипоксия плода обычно указывают на далеко зашедшее ущемление тканей. В таких случаях необходимо немедленное родоразрешение, хотя эта помощь может оказаться запоздалой и не всегда предотвращает тяжелую родовую травму – мочеполовые и кишечно-половые свищи, трещины и разрывы матки и др.
Особое внимание уделяется состоянию матки, в первую очередь состоянию ее нижнего сегмента и расположению контракционного кольца.
Болезненность или значительное истончение нижнего сегмента, высокое и косое расположение пограничной борозды, несимметричность толщины к направления круглых маточных связок, болезненность последних свидетельствуют о перерастяжении нижнего сегмента – опаснейшего осложнения родов при узком тазе, В таких случаях необходимо дать роженице глубокий наркоз и родоразрешить ее оперативно.
Серьезным осложнением родов при узком тазе является инфицирование Родовых путей. Об этом можно судить по характерным (гнойным) выделениям из влагалища и необычному запаху подтекающих околоплодных вод. Повышение температуры тела, учашенне пульса, общее недомогание и другие признаки инфекции появляются позднее. При появлении первых же признаков инфицирования родовых путей следует назначить антибактериальные препараты.
Степень соответствия (соразмерности) объема головки плода и таза роженицы. Несмотря на то что головка плода отличается хорошо выраженной способностью конфигурироваться, т.е. принимать форму, соответствующую форме родового канала, а таз обладает определенной податливостью по отношению к давящей изнутри на его стенки головке плода, анатомическое их соответствие друг другу имеет большое значение для правильного течения родов. Как конфигурационная способность головки, так и растяжимость сочленений таза в состоянии привести в соответствие лишь нерезко выраженные различия между объемом головки и емкостью малого таза. Если головка плода чрезмерно велика для данного таза или способность ее к конфигурации выражена незначительно, то даже энергичная продолжительная родовая деятельность может оказаться недостаточной для преодоления головкой препятствий со стороны суженного родового канала. Поэтому своевременное распознавание степени соответствия головки плода входу в таз является чрезвычайно существенным условием правильного ведения родов. Это своевременное распознавание становится возможным после излитая околоплодных вод и при хорошо выраженной родовой деятельности.
О соответствии таза и головки позволяют судить признаки Цангмейстера, Вастена.
Цангмейстер предложил определять наличие и степень возвышения передней поверхности головки над симфизом путем измерения и сопоставления размеров наружной конъюгаты и расстояния от надкрестцовой ямки до передней поверхности головки. Измерение производят тазомером в положении роженицы на боку. При соответствии размеров головки и таза наружная конъюгата на 2-3 см больше, чем расстояние от головки до надкрестцовой ямки. Если последний размер больше наружной конъюгаты, значит, размер головки не соответствует размеру таза. Одинаковая величина обоих размеров свидетельствует о наличии определенного несоответствия между размерами таза и головкой; в этом случае прогноз родов сомнительный.
Признак Вастена (рис. 17.16) определяется при наличии регулярной родовой деятельности, после излития вод и фиксации головки во входе в таз. Исследующий располагает ладонь на поверхности симфиза и скользит ею кверху, на область предлежащей головки. Если передняя поверхность головки находится выше плоскости симфиза, значит имеется несоответствие между тазом и головкой (признак Вастена положительный) и роды самостоятельно закончиться не могут. При явном несоответствии размеров таза и головки показано оперативное родоразрешение путем кесарева сечения (при мертвом плоде – краниотомия или другие плодоразрушающие операции).
При незначительном несоответствии передняя поверхность головки находится на одном уровне с симфизом (признак Вастена вровень). В таких случаях исход родов может быть двояким: если родовая деятельность энергичная и головка хорошо конфигурируется, то роды заканчиваются самостоятельно; при слабой родовой деятельности, крупной и плотной головке, аномалиях положения и вставления роды самостоятельно закончиться не могут.
При полном соответствии между тазом и головкой передняя поверхность головки находится ниже плоскости симфиза (признак Вастена отрицательный), роды обычно заканчиваются самостоятельно.
Следует подчеркнуть, что положительный или отрицательный признак Вастена зависит от особенностей вставления головки. Так, при заднем асинклитизме признак Вастена обычно положительный, тогда как при переднем асинклитизме или заднем виде затылочного предлежания – отрицательный.
 Рис. 17.16. Определение соответствия между головкой плода и входом в таз по Вастену.
а – признак Вастена отрицательный; б – признак Вастена слабоположительный ("вровень"); в – признак Вастена положительный.
Рис. 17.16. Определение соответствия между головкой плода и входом в таз по Вастену.
а – признак Вастена отрицательный; б – признак Вастена слабоположительный ("вровень"); в – признак Вастена положительный.
Осложнения в родах при узком тазе могут наблюдаться и после того, как головка опустилась в полость таза или даже установилась в выходе. Поэтому во втором периоде родов необходимо следить за продвижением головки и своевременным началом потуг, которые возможны только при опускании головки плода на тазовое дно. Осложнениями второго периода обычно являются вторичная слабость родовых сил, долгое стояние головки в узкой части таза, внутриутробная гипоксия плода. В таких ситуациях при наличии соответствующих условий роды лучше всего закончить наложением акушерских щипцов или вакуум-экстракцией плода, хотя это очень травматично для матери и особенно для плода. Если плод погибает, то производят перфорацию головки с последующей краниоклазией.
В конце периода изгнания часто производят срединно-латеральную эпизиотомию или перинеотомию с целью уменьшения травматизма плода.
При анатомически узком тазе возможны затруднения во время рождения не только головки, но и плечевого пояса (дистоция плечиков).
Особого внимания заслуживает ведение последового и раннего послеРодового периода, когда может наблюдаться гипотоническое кровотечение. Для профилактики этого опасного осложнения применяют метилэргометрин (1 мл с 20 мл 40 % раствора глюкозы) или сочетание метилэргометрина с окситоцином (по 0,5 или 1,0 мл в равной пропорции) – внутривенно сразу после рождения плода.
В послеродовом периоде необходимо тщательно следить за инволюцией матки и при необходимости усиливать ее сокращение. Особое внимание уделяют состоянию лонного, крестцово-подвздошного сочленений, некоторое расхождение которых возможно при клинически узком тазе.
Клинически узкий таз
Если анатомически узкий таз не всегда приводит к несоразмерности таза роженицы и головки плода, то понятие "клинически узкий таз" всегда отражает ту или иную степень несоответствия плода и таза матери.
Диагноз клинически узкого таза устанавливают только в родах по совокупности признаков, позволяющих выявить несоразмерность (диспропорцию) таза и головки.
Основные причины клинически узкого таза: 1. анатомическое сужение или аномальные формы костного кольца малого таза; 2. крупные размеры плода; 3. асинклитические вставления (заднетеменное, высокое прямое стояние стреловидного шва), разгибательные преддежания головки (лобное, передний вид лицевого преддежания); 4. отсутствие достаточной конфигурации головки при переношенной беременности.
Основными признаками клинически узкого таза являются: 1. отсутствие прижатия головки ко входу в малый таз с началом родовой деятельности; 2. нарушениесократительной деятельности матки (слабость или дискоординация родовой деятельности); 3. несвоевременное излитие околоплодных вод; 4. нарушение синхронности процесса открытия шейки матки и одновременного продвижения плода; 5. отсутствие или резкое замедление продвижения головки плода при полном раскрытии шейки матки; 6. выраженная конфигурация головки, образование родовой опухоли; 7. затруднение или прекращение самопроизвольного мочеиспускания; 8. отек шейки матки, создающий ложное впечатление неполного раскрытия ее (отечная шейка не смещается за головку при полном открытии и свисает во влагалище); 9. затяжное течение родов и появление признаков гипоксии плода.
При несоответствии таза роженицы и головки плода особенно опасными признаками являются длительное стояние головки в одной плоскости, отечность шейки матки и наружных половых органов, задержка мочеиспускания и появление в моче признаков крови, растяжение нижнего сегмента матки (высокое стояние контракционного кольца), наличие непроизвольных беэрезультативных потуг, повышение температуры тела и учащение пульса. При наличии перечисленных признаков следует немедленно закончить роды! Как правило, производят кесарево сечение, а при мертвом плоде – плодоразрушающую операцию.
Р.И.Калганова (1965) предложила классификацию клинически узкого таза в зависимости от степени несоответствия между размером таза роженицы и головки плода и выделила три степени несоответствия.
Степень I (относительное несоответствие), для которой характерны: 1. особенности вставления головки и механизма родов, свойственные имеющейся форме сужения таза; 2. хорошая конфигурация головки плода.
Степень II (значительное несоответствие), для которой характерны: 1. особенности вставления головки и механизма родов, свойственные имеющейся форме сужения таза; 2. резко выраженная конфигурация головки плода; 3. длительное стояние головки в одной плоскости таза; 4. наличие признака Вастена вровень; 5. симптомы прижатия мочевого пузыря (затрудненное мо-чеиспускание, примесь крови в моче).
Степень III (абсолютное несоответствие), для которой характерны: 1. особенности вставления головки, присущие имеющейся форме сужения таза, однако часто возникает механизм вставления головки, несоответственный для данной формы анатомически узкого таза; 2. выраженная конфигурация головки или отсутствие кон-фигурационной способности головки, особенно переношенного плода; 3. положительный признак Вастена; 4. выраженные симптомы прижатия мочевого пузыря; 5. преждевременное появление непроизвольных неэффективных потуг; 6. отсутствие поступательных движений головки при полном открытии шейки матки и энергичной родовой деятельности; 7. симптомы угрожающего разрыва матки.
Степени II и Ш клинического несоответствия размеров таза и головки должны являться показанием к кесареву сечению.
Особенности вставления головки и механизм родов, свойственный имеющейся форме сужения таза, при энергичной родовой деятельности способствуют благоприятному исходу родов, а поэтому при I степени несоответствия роды протекают через естественные родовые пути.
Вопрос о степени несоответствия между тазом и головкой плода и методе родоразрешения следует решать в периоде раскрытия шейки матки. Существовавшее ранее мнение о необходимости проведения функциональной оценки таза во втором периоде родов (при полном открытии шейки матки) в течение 2 ч у первородящих и 1 ч – у повторнородящих в настоящее время считается неправильным.
При ведении родов у рожениц с узким тазом нельзя упустить благоприятный момент для производства кесарева сечения, иначе можно попасть в крайне тяжелое положение, поскольку во время операции будет очень затруднительным выведение головки, плотно вколотившейся в таз. Это обычно бывает связано с риском тяжелой внутричерепной травмы у ребенка.
Врач, ведущий роды у роженицы с узким тазом, должен своевременно отказаться от консервативной тактики в пользу кесарева сечения. При этом следует оперировать не по показаниям "угрозы разрыва матки", что свидетельствует о запоздалой диагностике, а по показаниям "клинически узкого таза".
При длительном выжидании возможно развитие эндомиометрита и как следствие перитонита после несвоевременно проведенного кесарева сечения.
Новорожденные при узком тазе относятся к группе высокого риска. У родившегося плода отмечается значительная конфигурация головки, большая родовая опухоль; у них часто наблюдаются асфиксия при рождении, нарушение мозгового кровообращения, кефалогематомы, реже кровоизлияния в мозг, травмы костей черепа и др. При рождении туловища может быть перелом ключицы и (реже) ручки плода, повреждение шейного отдела позвоночника. Новорожденным при необходимости должна быть оказана квалифицированная реанимационная помощь, а в дальнейшем интенсивное наблюдение и соответствующее обследование и лечение. У всех детей, родившихся от матерей с узким тазом, необходимо производить нейросонографию для выявления интранатальных повреждений мозга.
Рациональное ведение родов при узком тазе позволяет предотвратить такие грозные осложнения, как разрыв матки, мочеполовые и кишечные свищи, разрывы и расхождения лонного и крестцово-подвздошного сочленения, а также материнскую смертность.
Расширение показаний к кесареву сечению при узком тазе позволило значительно снизить перинатальную смертность, асфиксию и травмы плода.
Крупный плод
Крупным является плод массой при рождении 4000 г и более (до 5000 г). При массе более 5000 г плод называется гигантским, В нашей стране крупный плод встречается в 8 -10 % всех родов. Гигантские плоды встречаются редко (1 на 3000-5000 родов).Высокая частота рождения крупных детей может быть генетически обусловлена, а также связана с чрезмерным потреблением углеводов. Нередко наблюдается неоднократное рождение крупных детей у одной и той же женщины.
Крупные дети могут быть при перенашивании, ожирении, при наличии отечной формы гемолитической болезни.
Особенно большая масса плода наблюдается при сахарном диабете у матери, что определяется нарушением обмена веществ у плода.
Диагностика крупного плода базируется на особенностях анамнеза и данных объективного обследования.
Собирая анамнез, выясняют рост и телосложение мужа, массу пациентки при рождении (наследственный фактор), массу новорожденного при предыдущих ролах. Выясняют, не страдает ли пациентка сахарным диабетом, эндокринными нарушениями.
При объективном обследовании отмечается увеличенная окружность живота (свыше 100 см) и высота дна матки над лоном (более 40 см)Особенно точным "признаком" эти величины являются в отсутствие выраженных отеков и ожирения. Размер головки при пальпации обычно бывает большим, чем в норме. Уточнить наличие крупного плода возможно при УЗИ. которое позволяет определить его размеры и рассчитать предполагае-мую массу тела. Важными показателями фетометрии являются бипариетальный размер головки, окружность головки и живота, длина бедренной кости плода, которые находятся выше индивидуальных нормальных колебании соответствующего гестационного возраста. Антенатальная диагностика Крупного плода при УЗИ возможна начиная с середины III триместра. Для Крупного плода характерно также увеличение толщины плаценты (см. Ан-тенатальная диагностика состояния плода).
Течение беременности при крупном плоде, как правило, существенно не отличается от таковой при меньшей массе. Но иногда в связи с высоким стоянием диафрагмы может появляться одышка.
Роды крупным плодом в связи с перерастяжением матки и возникновением несоразмерности головки нередко осложняются несвоевременным излитием околоплодных вод, первичной и вторичной слабостью родовых сил.
При возникновении несоразмерности таза и головки роды протекают, как при клинически узком тазе. В связи со сдавливанием крупной головки костной основой родового канала во втором периоде родов могут возникать гипоксия плода, внутричерепная травма.
После рождения головки нередко наблюдается затрудненное рождение плечиков, особенно часто это бывает при сахарном диабете у матери, когда плечевой пояс значительно больше размеров головки.
В последовом и послеродовом периодах возможны осложнения, связанные с перерастяжением матки: нарушения отделения плаценты, гипотонические кровотечения. При родах крупным плодом возрастает частота травм мягких тканей родового канала, матки, влагалища, промежности.
Профилактику крупного плода осуществить трудно. Профилактика осложнений для матери и плода при крупных его размерах заключается в тщательной оценке акушерской ситуации. В случаях наличия дополнительных осложнений (сужение размеров таза, тазовые преддежания плода, пожилой возраст первородящих, рождение в анамнезе крупных травмированных детей) показано плановое кесарево сечение.
При ведении родов через естественные родовые пути необходимо своевременно выявить несоразмерность таза и головки.
Дистоция плечиков
Дистоция плечиков (shoulder dystocia) – осложнение второго периода родов, когда после рождения головки происходит задержка переднего плечика за симфизом или вколачивание (вклинивание) в таз, а заднее плечико в это время или плотно сжато в крестцовой впадине, или находится под мысом, в результате чего дальнейшее продвижение плода по родовым путям матери прекращается.Несмотря на то что головка плода родилась и ребенок делает попытки сделать вдох, его грудная клетка сильно сдавлена стенками родового канала и легкие не могут расправиться. Плацентарный кровоток нарушается вследствие уменьшения объема матки, иногда за счет сдавления пуповины, и плод может погибнуть от гипоксии в течение короткого времени.
У матерей при дистоции плечиков чаще, чем в популяции, наблюдаются разрывы шейки матки, влагалища, промежности, гипотонические маточные кровотечения, послеродовые гнойно-септические заболевания.
При дистоции плечиков отмечается высокая заболеваемость и смертность новорожденных. Среди травм плода могут быть переломы плеча или ключицы, повреждения шейного отдела позвоночника, растяжение продолговатого мозга, повреждения шейных нервных корешков и т.д. При обследовании детей в возрасте от 5 до 10 лет, у которых при рождении отмечалась дистопия плечиков, неврологические нарушения были отмечены примерно у каждого четвертого ребенка.
В отечественной литературе термин "дистопия плечиков" не используется, а идентифицируется с "затрудненным выведением плечиков", но это разные понятия. Затрудненное выведение плечиков предполагает манипуляции при вколачивании плечиков в полость таза.
Первое место среди предрасполагающих факторов дистоции плечиков занимает крупный плод (масса плода 4000 г и более).
При макросомии плода его масса обычно соответствует размеру головки но не всегда размеры плечиков соответствуют размеру головки, и поэтому предсказать дистоцию плечиков крайне сложно.
Факторы, предрасполагающие к дистоции плечиков, разделяют на: 1. наблюдаемые во время беременност 2. проявляющиеся во время родов.
К дородовым факторам относят ожирение, сахарный диабет и его скрытые формы, переношенную беременность, при которых часто наблюдается макросомия и как следствие – дистоция плечиков. Определенную роль играет узкий таз, даже при нормальных размерах плода; уродства плода в виде анэнцефалии и микроцефалии, опухоли грудной клетки плода и др.
Факторами, которые могут привести к дистоции плечиков в родах, являются: 1. вторичная слабость родовой деятельности; 2. использование окситоцина (простагландинов) с целью возбуждения и стимуляции родовой деятельности; 3. наложение полостных щипцов или вакуум-экстрактора в родах; 4. неправильное оказание ручного пособия в родах. Указанное деление в определенной степени условно.
Дистоцию плечиков в родах следует дифференцировать от других состояний, которые приводят к задержке продвижения плечиков после рождения головки плода. К ним относятся: абсолютная и относительная короткая пуповина, значительное увеличение размера туловища за счет опухоли, анасарка, опухоли шеи, сцепленные и сросшиеся близнецы.
Проводя обследование во время беременности, следует стремиться заранее определить возможность развития дистоции плечиков в родах и при значительной угрозе развития в интересах матери и плода родоразрешить путем кесарева сечения. Если решено вести роды через естественные родовые пути, то необходимо наличие: 1. опытного специалиста, владеющего приемами оказания пособия при дистоции плечиков; 2. опытного анесте-зиолога; 3. опытного неонатолога, владеющего методами реанимации.
При дистоции плечиков опасны слишком активные повороты головки при выведении плечиков и особенно тракции за головку, так как это приводит к повреждению позвоночных артерий и у новорожденного нередко наблюдается нарушение дыхания. Даже незначительные повреждения стенки позвоночной артерии могут вызвать ее спазм, нарушение вертебробазилярного кровотока и привести к молниеносной смерти плода в процессе родов или развитию паралича у новорожденного.
Очень важно, чтобы время от рождения головки плода и до рождения плечевого пояса и туловища было минимальным, но тракции за головку и ротация плечевого пояса должны быть бережными, чтобы не нанести травмы плоду.
При дистоции плечиков производится большая медиолатеральная эпйзиотомия и адекватная анестезия (пудендальная).
После рождения головки необходимо своевременно освободить нос и рот плода от содержимого, а затем бережно извлечь плечики.
Весьма эффективным является ручное выведение задней ручки плода, после чего легко извлекается переднее плечико.
Из методов, позволяющих уменьшить биакромиальный размер, выделяют метод устранения дистоции плечиков путем перелома передней или задней ключицы. Он имеет мало сторонников, но его применение допустимо, если другие методы неэффективны.
Симфизиотомия как метод лечения дистоции плечиков в настоящее время также имеет своих сторонников, прежде всего в слаборазвитых странах, где проведение операции допускается, если плод живой и другие методы неэффективны.
Выпадение пуповины
Выпадение пуповины, особенно при головном предлежании, является серьезным осложнением для плода. Встречается редко.Различают предлежание и выпадение пуповины. Под предлежанием пуповины подразумевают нахождение ее ниже предлежащей части, но при целом плодном пузыре. После излития вод подобное расположение пуповины называют выпадением ее. При выпадении пуповины петли ее (или только канатик) могут быть в зеве, во влагалище и даже вне половой щели. Выпадение пуповины способствует гипоксии плода, во-первых, из-за ее холодового раздражения (возникает брадикардия у плода) и, во-вторых, из-за возможного прижатия ее предлежащей частью. При тазовом предлежании опасность сдавления пуповины меньше, чем при головном. Головка плода может полностью пережать пуповину, прекращая кровоток и приводя к гибели плода.
Этиология.
Выпадение пуповины обусловлено, как правило, высоким расположением предлежащей части, что наблюдается при суженных размерах таза, при многоводии, многоплодии, преждевременных родах, поперечном положении плода. Выпадению пуповины способствует чрезмерная длина ее – свыше 75 см.
Диагностика предлежания пуповины может быть осуществлена при УЗИ и при влагалищном исследовании, когда имеется раскрытие шейки матки. Выпадение пуповины характеризуется стойким изменением сердцебиения плода после излития околоплодных вод. Диагноз уточняется при влагалищном исследовании.
Ведение родов.
При предлежании пуповины следует попытаться устранить это осложнение путем изменения положения тела роженицы: приподнятый таз (в постели) или коленно-локтевое положение. Если предлежание пуповины не устраняется, то при головном предлежании производят кесарево сечение. При тазовом предлежании, большом раскрытии шейки матки, особенно у повторнородящих, возможны роды через естественные родовые пути.
Выпадение пульсирующей пуповины при головном предлежании, как Правило, является показанием к кесареву сечению. Если же выпадение пуповины обнаруживается при полном открытии шейки матки и головке, находящейся в полости таза, то следует произвести операцию наложения акушерских щипцов.
Если выпадение пуповины сопровождается гибелью плода, то предпринимают плодоразрушающую операцию с целью уменьшения травмы материпри головном предлежании – краниотомию, при поперечном положении – эмбриотомию. Эти операции проводятся при наличии акушерских условий
Асинклитические вставления головки
Под асинклитическим вставлением головки подразумевают отклонение стреловидного шва от линии, проходящей на одинаковом расстоянии от лобка и крестцового мыса (промонтория) либо кпереди, либо кзади. Если сагиттальный шов оказывается ближе к мысу, то вставляется передняя теменная кость – образуется передний, или негелееский, асинклитизм (переднетеменное вставление головки). Когда же сагиттальный шов располагается ближе к симфизу, то вставляется задняя теменная кость и образуется задний, или /штцмановский, асинклитизм (заднетеменное вставление головки). Переднетеменной асинклитизм бывает при узких, главным образом плоских тазах.Возникновению асииклитизма способствуют также следующие факторы: дряблая брюшная стенка (отвислый живот), выпадение ручки рядом с головкой и другие отклонения в механизме родов.
Умеренный передний асинклитизм, являясь приспособительным явлением, благоприятствует прохождению головки через суженный вход плоского таза.
Заднетвменной асинклитизм всегда относится к патологическому, а не к приспособительному вставлению.
Выраженное асинклитическое вставление головки является патологическим и затрудняет течение родов.
Иногда стреловидный шов при переднем асинклитизме определяется у симфиза, а при заднем – под лоном. В тяжелых случаях асииклитизма прощупывается даже ухо.
Диагноз асинклитического вставления устанавливают при влагалищном исследовании. При этом руководствуются тем, что стреловидный шов отклонен от оси таза в сторону симфиза или крестца и устойчиво сохраняет такое положение.
Прогноз родов при переднем асинклитизме благоприятен в случае нерезко выраженного несоответствия между размерами таза роженицы и головки плода. Тем не менее даже при этом головка подвергается сильной конфигурации, приобретая косую форму с явлениями вдавливания в костях черепа. Под влиянием сильной родовой деятельности предлежащая теменная кость все глубже внедряется в таз и только после этого опускается другая теменная кость, задержавшаяся у мыса.
Задний асинклитизм чаще является следствием родов при общесуженном плоском и плоскорахитическом тазах. Первой вставляется заднетеменная кость в поперечном размере. При боковом сгибании головки плода стреловидный шов отклоняется к симфизу. Головка вставляется в состоянии легкого разгибания.
Выраженная степень переднего и особенно заднего асииклитизма является показанием к кесареву сечению.
Высокое прямое стояние головки
В некоторых случаях головка вступает в таз таким образом, что стреловидный шов совпадает с прямым размером входа таза. Такое отклонение от нормального механизма родов называется высоким прямым стоянием головки. При этом затылок может быть обращен к симфизу или крестцу. Если затылок обращен кпереди, образуется передний вид высокого прямого стояния головки, если же затылок повернут кзади, образуется задний вид высокого прямого стояния головки.
Возникновению высокого прямого стояния головки в значительной мере способствуют узкий таз, поперечное сужение таза, понижение тонуса матки и брюшной стенки.
Высокое прямое стояние стреловидного шва может быть приспособительным механизмом при поперечносуженном тазе, если у него увеличен прямой размер входа в малый таз. Во всех остальных случаях оно свидетельствует о нарушении механизма родов, требующего операции кесарева сечения.
При переднем виде высокого прямого стояния головки прогноз значительно лучше, чем при заднем, так как головка максимально сгибается и проходит в таком виде через все плоскости таза. Дойдя до дна таза, головка упирается подзатылочной областью в симфиз и разгибается (прорезывается).
Задний вид высокого прямого стояния головки. Если размер головки плода невелик, таз нормальный и родовая деятельность энергичная, головка в таком состоянии опускается в таз. В полости таза может произойти поворот головки на 180°, и она прорезывается в переднем виде. Если же поворот не совершится, головка прорезывается в заднем виде.
При заднем виде высокого прямого стояния головки самостоятельные роды бывают редко. В большинстве случаев приходится прибегать к оперативному родоразрешению (кесарево сечение, наложение щипцов, краниотомия).
Низкое поперечное стояние головки
Низким поперечным стоянием головки называется такое отклонение механизма родов от нормы, при котором внутренний поворот головки не совершается и ее стреловидный шов оказывается в поперечном размере выхода малого таза.
Низкое поперечное стояние головки чаще всего возникает при суженном тазе, особенно при простом плоском. Определенное значение при этом имеет расслабление мышц тазового дна.
Низкое поперечное стояние головки, являясь аномалией механизма родов, нарушает процесс изгнания плода, так как головка, остановившись стреловидным швом в поперечном размере выхода таза, прорезаться не может. Прорезывание головки может произойти только после ее поворота, когда стреловидный шов перейдет из поперечного в прямой размер выхода таза. Однако такой поворот возможен только при сильной и продолжительной родовой деятельности, а также при условии, что таз не имеет значи-тельного сужения. Если поворот не произойдет, возникают осложнения, являющиеся серьезной угрозой матери и плоду (сдавление и омертвение мягких тканей родовых путей и мочевого пузыря, восходящая инфекция, Разрыв матки, гипоксия плода). Роды необходимо закончить наложением акушерских щипцов. Если плод погиб, производят краниотомию.
Глава 18. Поперечное и косое положения плода
Поперечное и косое положения плода относятся к неправильным положениям и встречаются в среднем в 0,5-0,7 % от общего числа родов. В отличие от продольного положения ось плода образует с продольной осью маткй прямой или острый угол, предлежащая часть отсутствует. При косом поло* жении плода наиболее низкая часть (голова или тазовый конец) располагается ниже линии, соединяющей гребни подвздошных костей. При поперечном положении все крупные части плода находятся выше этой линии. Позиция плода при этих положениях определяется по головке. При распой ложении головки плода слева – первая позиция, справа – вторая позиция. Вид плода определяется так же, как и при продольном положении: по отношению спинки к передней (передний вид) или задней (задний вид) стенке матки.Причины.
Поперечное и косое положения плода могут возникнуть в результате следующих причин: 1. чрезмерная подвижность плода: при многоводии, при гипотрофичном или недоношенном плоде, при многоплодной беременности (второго плода), дряблости мышц передней брюшной стенки у повторнородящих; 2. ограниченная подвижность плода: при маловодий; крупном плоде, многоплодии; наличии миомы матки, деформирующей полость матки; повышенном тонусе матки при угрозе прерывания беременности; 3. препятствие вставлению головки: предлежание плаценты, узкий таз. наличие миомы матки в области нижнего сегмента матки; 4. аномалии развития матки: двурогая матка, седловидная, перегородка в ней; 5. аномалии развития плода: гидроцефалия, анэнцефалия.
Диагностика
. При осмотре беременной обращают на себя внимание поперечно-овальная или косоовальная форма живота, низкое стояние дна матки.
При наружном акушерском исследовании предлежащая часть плода не определяется. Крупные части (головка, тазовый конец) пальпируются в боковых отделах матки (рис. 18.1). При многоплодии и многоводии, напряжении матки определение положения и позиции плода может быть затруднительным. Сердцебиение плода лучше прослушивается в области пупка.
При влагалищном исследовании предлежащая часть плода не определяется.
 Рис. 18.1. Поперечное положение плода. Наружное акушерское исследование, а – первый прием; б – второй прием; в – третий прием; г – четвертый прием.
Рис. 18.1. Поперечное положение плода. Наружное акушерское исследование, а – первый прием; б – второй прием; в – третий прием; г – четвертый прием.
Большую помощь в диагностике неправильного положения плода оказывает ультразвуковое исследование.
После излития околоплодных вод при влагалищном исследовании можно определить плечо или ручку плода, петлю пуповины, иногда пальпируются ребра, позвоночник плода. По подмышечной впадине можно определить, где находится головка плода.
Течение беременности и родов.
Беременность при поперечных положениях плода может протекать без осложнений. Иногда при повышенной подвижности плода наблюдается частая смена его положения: продольное – поперечное – продольное и т.д. Такое состояние носит название неустойчивого положения.
Наиболее характерными осложнениями беременности при поперечном положении плода являются преждевременные роды (25 – 30 %), которые часто начинаются с дородового излития околоплодных вод ввиду отсутствия внутреннего пояса прилегания.
Дородовое излитие околоплодных вод может сопровождаться выпадением мелких частей плода: ручек (рис. 18.2), ножек и петель пуповины. Несвоевременное излитие околоплодных вод способствует инфицированию, а выпадение пуповины – гипоксии плода.
 ис. 18.2. Поперечное положение плода. Первая позиция, передний вид. Выпадение правой ручки.
ис. 18.2. Поперечное положение плода. Первая позиция, передний вид. Выпадение правой ручки.
 Рис. 18.3. Запущенное поперечное положение плода. (сдвоенным телом).
Рис. 18.3. Запущенное поперечное положение плода. (сдвоенным телом).
 Рис. 18.4. Роды в поперечном положении
Рис. 18.4. Роды в поперечном положении
Если причиной неправильного положения плода является предлежание плаценты, то возможно кровотечение.
Осложнением первого периода родов чаще всего также является несвое-временное (раннее) излитие околоплодных вод по той же причине, что и во время беременности. Длительный безводный промежуток (более 12 ч), как правило, приводит к инфицированию. Интенсивное излитие околоплодных вод в первом периоде родов ограничивает подвижность плода. Потеря подвижности плода при поперечном положении вследствие излития вод и сокращения матки носит название запущенного поперечного положения (рис. 18.3). При этом может наблюдаться выпадение пуповины, ручки, "вколачивание" в малый таз одного из плечиков. Как правило, возникает гипоксия плода вплоть до его гибели, так как в результате усиленного сокращения матки ограничивается кровоснабжение плаценты. При продолжающейся родовой деятельности и отсутствии продвижения плода могут происходить сначала перерастяжение нижнего сегмента матки, а затем и ее разрыв. Разрыв матки при запущенном поперечном положении плода является грозным осложнением для матери, вплоть до ее гибели от кровотечения или сепсиса.
Крайне редко роды при поперечном положении плода заканчиваются самопроизвольно в результате самоповорота – versia spontanea в тазовое или головное предлежание, самоизворота – evolutio spontanea или родов сдвоенным телом – conduplicatio corporis (рис. 18.4) при гипотрофичном или недоношенном плоде и при вместительном тазе. При самоизвороте после выхода из-под лобковой дуги плечика, как правило, с ручкой последовательно рождаются ягодицы, ножки, а затем весь плечевой пояс и головка. При родах сдвоенным телом плод складывается в позвоночнике вдвое и в таком состоянии происходит его рождение. Плод при этом, как правило, погибает.
Ведение беременности и родов.
Учитывая возможность серьезных осложнений при поперечном положении плода для матери и ребенка, необходимо тщательное наблюдение за женщинами в женской консультации, особенно повторнородящими, у которых в 10 раз чаще, чем у первородящих, наблюдается неправильное положение плода, и вероятность дородового излития вод у них больше в связи с тем, что нередко цервикальный канал может быть несколько приоткрыт (пропускает один палец). Необходимы ограничение физической нагрузки (полупостельный режим), профилактика запоров, рекомендации беременным больше лежать на боку одноименной позиции, а при косом положении – на стороне нижерасположенной крупной части плода. После 35 нед беременности, если положение плода остается поперечным или косым, необходима госпитализация.
Возможно исправление положения плода во время беременности (наружный поворот плода).
Беременную необходимо предупредить о том, чтобы о начале схваток или излитии околоплодных вод она немедленно сообщила акушерке или врачу.
Общепризнано, что оптимальным методом родоразрешения при поперечном или косом положениях плода является кесарево сечение.
Наиболее благоприятным временем оперативного родоразрешения является первый период родов. При появлении первых схваток в отдельных случаях происходит изменение положения плода на продольное (самоповорот). До появления родовой деятельности кесарево сечение должно быть проведено при тенденции к перенашиванию, предлежании плаценты, дородовом излитии околоплодных вод, гипоксии плода, рубце на матке, опухолях гениталий (с последующим их удалением).
При выпадении мелких частей плода (пуповина, ручка) попытка вправления не только бесполезна, но и вредна, так как способствует инфицированию и увеличивает время до оперативного родоразрешения. Ведение родов через естественные родовые пути возможно лишь при глубоконедоношенном плоде, жизнеспособность которого находится под большим сомнением.
Комбинированный поворот плода на ножку при его жизнеспособности используется крайне редко, так как он небезопасен для плода. Производят его в основном при поперечном положении второго плода у роженицы с двойней.
При поступлении роженицы с полным раскрытием шейки матки, при живом плоде и небольшой его массе, сохраненной его подвижности (последнее условие бывает крайне редким) возможно проведение комбинированного классического поворота плода на ножку с последующим его извлечением. Прогноз в этом случае для плода неблагоприятный.
Если роженица поступает с запущенным поперечным положением и мертвым плодом, показана эмбриотомия под наркозом.
При наличии инфекции на фоне длительного безводного промежутка при живом плоде показаны кесарево сечение, удаление матки, дренирование брюшной полости для профилактики развития перитонита и септического состояния, антибактериальная терапия.
Глава 19. Разгибательные предлежания плода
Разгибательные предлежания плода встречаются в 0,5 -1,0% случаев всех родов, преимущественно у повторнородящих.Различают 3 степени разгибания головки, что определяет характер ее предлежания.
Первая степень разгибания – переднеголовное предлежание (рис. 19.1,а). При этом ведущей точкой является область переднего (большого) родничка, а плоскость большого сегмента проходит через прямой размер, диаметр которого 12 см.
Вторая степень разгибания – лобное предлежание (рис. 19.1,6). Ведущая точка – надбровье, плоскость большого сегмента проходит через большой косой размер – 13 см.
Третья степень разгибания – лицевое предлежание (рис. 19.1,в). Ведущей точкой является подбородок, плоскость большого сегмента проходит через вертикальный размер – 9,5 см.
Самым неблагоприятным предлежанием является лобное.
Между этими тремя основными степенями разгибания головки существуют промежуточные переходные состояния.
Каждая из степеней разгибания головки является в то же время и переходной и, следовательно, временным состоянием. Так, переднеголовное предлежание может превратиться или в затылочное – при сгибании головки в дальнейшем течении родов, или в лобное – при ее разгибании. Лишь в отдельных, довольно редких случаях та или другая степень разгибания как бы стабилизируется, и головка проходит через родовой канал в одном из вариантов предлежания.
Разгибательные предлежания головки возникают иногда еще до родов. Обычно практического значения они не имеют и с началом родов устраняются самопроизвольно. Лишь в крайне редких случаях при большом зобе или обширной кистовидной гигроме шеи плода, равно как и при крупных подслизистых миомах матки, разгибательное состояние плода, возникшее во время беременности, может сохраниться и во время родов. В большинстве же случаев разгибательные состояния головки возникают во время родов.
Факторами, способствующими возникновению разгибательных предлежании, являются следующие: многоводие, маловодие, гипотрофия и недоношенный плод, снижение тонуса и некоординированные сокращения матки, крупный плод, узкий таз (особенно плоский), предлежание плаценты, аномалии развития матки и плода. Лобное и лицевое предлежания могут быть при опухолях шеи или при неоднократном обвитии пуповины.
Механизм родов при разгибательных предлежаниях характеризуется следующими отличительными моментами: первый момент – разгибание головки; второй момент – в процессе внутреннего поворота, как правило, обра-зование заднего вида; третий момент – сначала сгибание, потом разгибание.
 Рис. 19.1. Разгибательные предлежания головки плода, а – переднеголовное; б – лобное; в – лицевое.
Рис. 19.1. Разгибательные предлежания головки плода, а – переднеголовное; б – лобное; в – лицевое.
Образование заднего вида при разгибательных предлежаниях обеспечивает возможность использования в процессе родов крестцовой впадины.
Переднеголовное предлежание
Диагностика переднеголовного предлежания во время беременности пред-ставляет определенные трудности. При проведении наружного акушерского исследования возможно более высокое стояние дна матки, при измерении прямого размера головки он оказывается равным 12 см и более. Диагноз может быть уточнен при ультразвуковом исследовании. С началом родовой деятельности переднеголовное предлежание нередко переходит в затылочное или в более выраженную степень разгибания. Поэтому наибольшую информацию о наличии переднеголовного предлежания можно получить в процессе родовой деятельности. При влагалищном исследовании в первом периоде родов обнаруживается расположение переднего (большого) и заднего (малого) родничков на одном уровне или чаще большой родничок ниже малого. Сагиттальный (стреловидный) шов в плоскости входа малого таза находится обычно в поперечном, иногда в одном из косых размеров.Диагноз может быть уточнен и сразу после рождения плода по конфигурации головки. Родовая опухоль при переднеголовном предлежании располагается в области большого родничка и вытягивает головку вверх. Такую конфигурацию головки новорожденного называют брахицефалической (башенной) (рис. 19.2).
Механизм родов при переднеголовном предлежании начинается в плоскости входа в малый таз. Головка плода устанавливается сагиттальным (стреловидным) швом в поперечном размере таза, реже в косом (рис. 19.3).
Первый момент механизма родов – умеренное разгибание головки. Большой родни-чок располагается ниже малого, являясь вешущей точкой. Большой сегмент при данном предлежании – окружность головки, диаметром которой является прямой размер (diameter frontooccipitalis) – от надпереносья до затылочного бугра длиной 12 см (окружность равна 34-35 см). По мере продвижения по родовому каналу при переходе из шировой части в узкую происходит второй момент механизма родов – внутренний поворот головки, который заканчивается в плоскости входа. Стреловидный шов устанавливается в прямом размере, под лобковое сочленение подходит часть головки областью надпереносья (glabella), которая является точкой фиксации. Крайне редко наблюдающийся поворот головки затылком кпереди, а лицевой частью кзади является нарушением механизма родов. В этих случаях довольно часто прекращается дальнейшее продвижение головки по родовому каналу.
Третий момент механизма родов – сгибание головки. После того как точка фиксации (надпереносье) подходит под нижний край лобкового сочленения, происходит сгибание головки в шейной части позвоночника, рождаются теменные бугры и затылок.
Четвертый момент механизма родов – разгибание головки. Происходит после образования второй точки фиксации, которой является подзатылочная ямка. Головка упирается в вершину крестца (копчик при этом смещается) и совершается разгибание головки. В процессе разгибания происходит полное рождение головки.
Пятый момент механизма родов – внутренний поворот плечиков и наружный поворот головки. Совершается так же, как и при затылочном предлежании.
Течение беременности и родов.
Во время беременности при переднеголовном предлежании осложнений может и не быть, однако при подвижной над плоскостью входа в малый таз головке плода отсутствует внутренний пояс прилегания, в связи с чем может произойти дородовое излитие околоплодных вод. Первый и второй период родов, как правило, затягиваются. Роды сопровождаются повышенным травматизмом родовых путей, более часто наступающей гипоксией и травмой плода. При переношенной беременности, крупном плоде, узком тазе, пожилом возрасте первобеременной увеличивается возможность травмы плода.
 Рис. 19.2. Брахицефалическая конфигурация головки новорожденного.
Рис. 19.2. Брахицефалическая конфигурация головки новорожденного.
Ведение родов. При переднеголовном предлежании ведение родов должно быть индивидуальным. При доношенной беременности, некрупном плоде и нормальных размерах таза роды проводят через естественные родовые пути. При несвоевременном излитии око-лоплодных вод проводят профилактику сла-бости родовой деятельности и гипоксии плода.
 Рис. 19.3. Механизм родов при переднеголовном предлежании плода. а – умеренное разгибание головки; б – внутренний поворот головки; в – сгибание головки; г – разгибание головки.
Рис. 19.3. Механизм родов при переднеголовном предлежании плода. а – умеренное разгибание головки; б – внутренний поворот головки; в – сгибание головки; г – разгибание головки.
С момента полного открытия шейки матки необходима тщательная оценка соответствия головки плода размерам таза. Попытка исправления переднеголовного предлежания ручным путем результата не дает, но может нанести вред (травма плода, матки, отслойка плаценты).
Оперативное родоразрешение (кесарево сечение) показано при крупном плоде, перенашивании беременности, узком тазе, пожилом возрасте первобеременной, слабости родовой деятельности.
Во втором периоде родов при слабости родовой деятельности, гипоксии плода при головке, находящейся в полости малого таза, показано родоразрешение путем наложения акушерских щипцов или вакуумэкстракции.
В последовом и послеродовом периодах проводят профилактику кровотечений вве-дением средств, сокращающих матку.
Лобное предлежание
Лобное предлежание встречается очень редко (0,021-0,026 %). Иногда лобное предлежание является переходным состоянием от переднего лобного в лицевое.Диагностика лобного предлежания наружными приемами затруднительна. Можно лишь предполагать наличие лобного предлежания по высокому стоянию дна матки, наличию угла между затылком и спинкой плода. Сердцебиение плода лучше выслушивается со стороны грудной клетки, а не спинки. При влагалищном исследовании определяется лобная часть головки плода, можно пальпировать лобный шов, который заканчивается с одной стороны переносицей (пальпируются также надбровные дуги и глазницы), с другой – большим родничком.
После рождения по конфигурации головы новорожденного можно подтвердить диагноз лобного вставления. Родовая опухоль, расположенная в области лба, придает головке своеобразный вид пирамиды (рис. 19.4).
Существенную помощь в диагностике оказывает ультразвуковое исследование.
 Рис. 19.4. Форма головки ново-рожденного, родившегося при лобном предлежании.
Рис. 19.4. Форма головки ново-рожденного, родившегося при лобном предлежании.
Роды при лобном предлежании при нормальных размерах таза (тем более при некотором сужении) и доношенном плоде (а особенно при крупном) невозможны, так как головка должна продвигаться по родовым путям своей наибольшей окружностью. При лобном предлежании нередко возникают признаки клинически узкого таза.
 Рис. 19.5. Механизм родов при лобном предлежании плода.
а – разгибание головки; б – внутренний поворот головки; в – сгибание головки.
Рис. 19.5. Механизм родов при лобном предлежании плода.
а – разгибание головки; б – внутренний поворот головки; в – сгибание головки.
Механизм родов
Первый момент родов – разгибание в плоскости входа в малый таз. Лобный шов располагается, как правило, в поперечном размере. Ведущей точкой являются лобные кости, на которых в процессе родов образуется выраженная родовая опухоль. По мере дальнейшего продвижения головки, преимущественно при переходе из плоское ти широкой части в узкую, начинается второй момент механизма родов – внутренний поворот головки, который заканчивается в плоскости выхода При этом плод спинкой поворачивается кзади, лобный шов располагается в прямом размере. Верхняя челюсть прижимается к нижнему краю лобкового сочленения, образуя первую точку фиксации. Образование переднего вида при лобном предлежании исключает дальнейшее продвижение плода.
Третий момент механизма родов – сгибание головки. Происходит послеобразования первой точки фиксации; при этом рождаются темя и затылок плода. В результате образуется вторая точка фиксации – подзатылочная ямка, которая упирается в вершину копчика. Четвертый момент – разгибание головки. Как и при заднем виде затылочного предлежания, вокруг образованных точек фиксации происходит разгибание головки, в результате которого головка рождается полностью. Пятый момент – внутренний поворот плечиков (и наружный поворот головки) происходит так же, как и при других вариантах головного предлежания.
Течение беременности и родов.
Во время беременности и первого периода родов нередко происходит несвоевременное излитие околоплодных вод ввиду отсутствия внутреннего пояса прилегания. Во время длительного безводного промежутка может присоединиться инфекция и гипоксия плода.
Роды при нормальных размерах таза и доношенной беременности, даже при хорошей родовой деятельности, закончиться не могут. Формируется клинически узкий таз и возникает угроза разрыва матки. Самопроизвольные роды произойдут, если лобное предлежание в процессе родовой деятельности превращается в лицевое или переднеголовное, а также при некрупном плоде и вместительном тазе. В последнем случае роды часто сопровождаются тяжелыми осложнениями (травма плода, родовых путей).
Ведение беременности и родов.
При подозрении или выявлении лобного предлежания необходима госпитализация для выяснения причин его возникновения и определения тактики родоразрешения. При дородовом излитии вод показано кесарево сечение.
В течение первого периода родов при сохраненных водах может измениться положение головки плода. Если этого не происходит или излились воды, показано родоразрешение путем кесарева сечения. Если момент для кесарева сечения упущен, роженица поступила в родильный дом при головке, находящейся в полости малого таза, необходимо исключить угрозу разрыва матки, следить за состоянием плода, не допускать длительного стояния головки в одной плоскости (угроза образования свищей), производить профилактику гипоксии плода, при длительном безводном промежутке – антибактериальную терапию.
При задержке рождения плода, появлении признаков гипоксии требуется немедленное родоразрешение. Возможно наложение акушерских щипцов, однако это не всегда удается. Поэтому в таких случаях чаще приходится производить плодоразрушающую операцию (перфорацию головки) даже при живом плоде. Попытка изменить предлежание при головке, расположенной над входом в малый таз, результата, как правило, не дает.
Лицевое предлежание
Лицевое предлежание встречается чаще предыдущих двух и является максимальной степенью разгибания головки плода (0,23 %).Обычно лицевое предлежание образуется во время родов, но может возникать и задолго до них.
Причины возникновения лицевого предлежания практически такие же, как и предыдущих разгибательных предлежании. Довольно часто лицевое предлежание возникает из лобного.
Диагностика лицевого предлежания основывается на данных наружного акушерского и влагалищного исследования. Головка плода максимально разогнута, поэтому при наружном акушерском исследовании возможно определение углубления между головкой и спинкой плода, отсутствие харак-терной для других предлежании выпуклости спинки плода. Наиболее отчетливо сердечные тоны плода прослушиваются со стороны его грудной клетки.
 Рис. 19.6. Механизм родов при лицевом предлежании плода.
а – максимальное разгиба:. ние головки; б – внутренний поворот головки; в – внутренний поворот головки за-вершился.
Рис. 19.6. Механизм родов при лицевом предлежании плода.
а – максимальное разгиба:. ние головки; б – внутренний поворот головки; в – внутренний поворот головки за-вершился.
При влагалищном исследовании определяются лицевые части плода – подбородок, надбровные дуги, нос, рот с твердыми валиками десен. В этом случае необходимо дифференцировать его от ягодичного предлежания, при котором могут определяться отечные мягкие ткани, а также пропальпироваться копчик, крестец, седалищные бугры. При лицевом предлежании исследование необходимо проводить осторожно, во избежание повреждения глаз, а при ягодичном предлежании – наружных половых органов плода.
По подбородку можно определить позицию и вид плода. При подбородке, обращенном вправо, спинка располагается слева -первая позиция, при второй позиции соответственно подбородок будет определяться слева, спинка – справа.
Если при пальпации подбородок определяется спереди, спинка сзади – задний вид, соответственно при расположении подбородка сзади, спинки спереди – передний вид.
Механизм родов
Первый момент – максимальное разгибание головки, происходит в плоскости входа в малый таз. В результате ведущей точкой становится подбородок. Срединная лицевая линия устанавливается в поперечном или в одном из косых размеров. Головка проходит окружностью, диаметром которой является вертикальный размер (от подъязычной кости до середины большого родничка), равный 9,5 см.
Второй момент – внутренний поворот головки, начинается в плоскости входа, особенно активно проявляясь при переходе из широкой в узкую часть, [й заканчивается в плоскости выхода, упираясь подъязычной костью в нижний край лобкового сочленения (точки фиксации). Это способствует врезыванию головки. При образовании переднего вида дальнейшее продвижение головки прекращается (запущенное '.лицевое вставление), так как Злобная часть упирается в лобковое сочленение, а подбородок-в крестцовую впадину, плечевой пояс при этом вко-лачивается в поперечном размере в седалищные ости.
Третий момент механизма .родов при заднем виде лицевого предлежания – сгибание головки, происходит в плоскости рвыхода с образованием точки фиксации: подъязычная кость упирается в нижний край лобкового сочленения. Вслед за "родившимся подбородком последовательно' рождается вся головка плода. Этот момент клинически соответствует прорезыванию и рождению головки при переднем виде лицевого
 Рис. 19.7. Роды предлежания.
Рис. 19.7. Роды предлежания.
Четвертый момент – внутренний поворот плечиков (и наружный поворот головки) про-исходит так же, как и при других видах головных предлежаний.
 Рис. 19.8. Отек лица новорожденного, лежаний. гося в лицевом предлежании.
Рис. 19.8. Отек лица новорожденного, лежаний. гося в лицевом предлежании.
Течение беременности и родов.
Во время беременности и первого периода родов возможно несвоевременное излитие околоплодных вод ввиду неполноценного внутреннего пояса прилегания, развитие гипоксии плода в связи с сокращением объема матки и ограничения маточноплацентарного кровотока, выпадение пуповины.
Роды в заднем виде лицевого предлежания при нормальном тазе, доношенном, но некрупном плоде обычно заканчиваются благоприятно, хотя их длительность может быть несколько больше, чем при заднем виде затылочного предлежания. Чаще наблюдается разрыв промежности, так как рождение головки над промежностью происходит большим поперечным размером, возможна внутричерепная травма плода.
Серьезные осложнения наблюдаются в родах, как уже было сказано, при переднем виде лицевого предлежания (рис. 19.7). Продвижение головки прекращается. При хорошей родовой деятельности возможны разрыв матки, гибель плода. В период длительного стояния головки образуются некроз ущемленных тканей, свищи, инфицирование.
Внешний вид головки плода, родившегося в лицевом предлежании, очень характерен. Лицо отечное, багрово-красного цвета (рис. 19.8).
Ведение беременности и родов. При установлении диагноза лицевого предлежания необходимо госпитализировать беременную для обследования и выяснения причины разгибательного предлежания, создания охранительного режима как профилактики преждевременного излития околоплодных вод.
Ведение родов при лицевом предлежании при нормальном тазе и некрупном плоде должно быть консервативным, так как в большинстве случаев роды заканчиваются благоприятно. Необходимо постоянно следить за характером родовой деятельности, сердцебиением плода.
В первом периоде родов обязательно тщательное наблюдение за сохранением заднего вида, так как в случае возникновения переднего вида роды через естественные пути невозможны и необходимо произвести кесарево сечение.
Кесарево сечение показано также при появлении признаков клинически узкого таза, гипоксии плода, слабости родовой деятельности.
При выпадении пуповины необходимо попытаться заправить ее за головку, а при неудачной попытке, придерживая пуповину за головкой рукой, введенной во влагалище, и придав женщине коленно-локтевое положение, перевести в операционную для проведения кесарева сечения (врач удерживает головку плода через влагалище до момента извлечения плода, предохраняя тем самым ее от сдавления).
К оперативному родоразрешению (до родов) необходимо прибегнуть при анатомическом сужении таза, крупном плоде, перенашивании беременности, у пожилых первородящих, при переднем виде лицевого предлежания.
В случае возникновения вторичной слабости родовой деятельности, гипоксии плода, при головке, находящейся в полости малого таза (невозможность извлечения головки при кесаревом сечении), для спасения жизни роженицы показана плодоразрушающая операция (краниотомия), даже если плод живой.
Во время прорезывания головки при угрозе разрыва промежности необходимо своевременно произвести эпизиоили перинеотомию для профилактики ее разрыва.
Глава 20. Аномалии родовой деятельности (дисфункция матки)
Основными вариантами аномалий родовой деятельности являются следующие: патологический прелиминарный период, первичная слабость родовой деятельности (первичная гипотоническая дисфункция матки); вторичная слабость родовой деятельности (вторичная гипотоническая дисфункция матки), которая может быть как в первом периоде родов, так и во втором; чрезмерно сильная родовая деятельность (гиперактивность матки); гипертоническая дисфункция матки, дискоординация родовой деятельности и тетанус матки.Этиология аномалий родовой деятельности весьма разнообразна. Основными причинами являются следующие; 1. чрезмерное нервно-психическое напряжение (волнения, отрицательные эмоции, неблагоприятные следовые реакции); 2. эндокринные и обменные нарушения в организме беременной; 3. патологическое изменение миометрия: эндомиометрит, склеротические и дистрофические изменения, неполноценный рубец на матке, пороки развития, гипоплазия матки; 4. пере растяжение матки вследствие многоводия, многоплодия, крупного плода; 5. генетическая (врожденная) патология миоцитов, при которой отсутствует или резко снижена возбудимость клеток миометрия; 6. возраст первородящей 30 лет и старше и юный возраст (до 18 лет); 7. механические препятствия для раскрытия шейки матки и продвижения плода; 8. ятрогенные факторы: необоснованное или чрезмерное применение родостимулирующих, токолитических, спазмолитических и а нал тезирующих средств.
Все эти разнообразные причины вызывают следующие нарушения: 1. снижение эстрогенной насыщенности организма, в результате чего не происходит достаточного "созревания" шейки и развертывания нижнего сегмента матки; 2. нарушение образования и плотности специфических и а-адренорецепторов, что делает миометрий малочувствительным к сокращающим веществам; 3. подавление каскадного синтеза простагландинов и ритмического выброса окситоцина в организм матери и плода; 4. изменение необходимого соотношения (равновесия) между плодовыми (ПГЕ2) и материнскими (ПГF2a) простагландинами, между продукцией окситоцина и простагландинами, между медиаторами симпатической (норадреналин) и парасимпатической (ацетилхолин) вегетативной нервной системы; 5. снижение активности биохимических процессов в клетках, обеспечивающих энергетику сократительной деятельности матки, синтез и ресинтез сократительных белков; 6. изменение локализации так называемого водителя ритма; 7. нарушение нейроэндокринного и энергетического обеспечения матки, в результате чего снижается интенсивность окислительно-восстановительных и других биохимических реакций, переводящих энергию химических реакций в механическую работу матки.
Патологический подготовительный (прелиминарный) период
Свидетельством возможности развития в родах аномальной родовой деятельности может быть патологический подготовительный (прелиминарный) период.Нормальные подготовительные сокращения матки клинически незаметны, безболезненны, чаще возникают ночью и приводят к созреванию шейки матки к родам.
Патологический прелиминарный период (ППП) характеризуется значительной болезненностью и беспорядочностью подготовительных сокращений матки и отсутствием структурных изменений шейки перед родами (незрелая шейка матки к сроку родов).
При этом болезненные сокращения матки возникают не только ночью, но и днем и долгое время не переходят в родовую деятельность. Длительность ППП может длиться несколько суток, лишая женщину сна и покоя. Шейка матки остается длинной, эксцентрично расположенной, плотной; наружный и внутренний маточный зев закрыт. Иногда внутренний зев определяется в виде плотного валика. Предлежащая часть нередко остается подвижной над входом в малый таз (даже при отсутствии какой-либо диспропорции между размерами плода и тазом женщины). Из-за гипертонуса матки пальпация предлежащей части и мелких частей плода затруднена.
Частым осложнением ППП является несвоевременное излитие околоплодных вод, которое уменьшает объем матки и снижает тонус миометрия. Если при этом шейка матки имеет достаточную "зрелость", то сократительная деятельность матки может нормализоваться и перейти в нормальную родовую деятельность. Если шейка матки остается "незрелой", родовая деятельность долгое время не развивается.
Лечение ППП должно быть направлено на ускорение "созревания" шейки матки, снятие некоординированных болезненных сокращений матки. С этой целью можно использовать электроаналгезию, электрорелаксацию матки, медикаментозную терапию. На ночь вводят морадол 1 мл, димедрол 1 мл или седуксен 1 мл. При утомлении и повышенной раздражительности пациентке назначают медикаментозный сон-отдых (дипидолор 2 мл или промедол 1 мл, димедрол 1 мл, седуксен 0,5 мл, анальгин 1 мл внутривенно).
При "зрелой" шейке матки с учетом благоприятной акушерской ситуации показаны ранняя амниотомия и ведение родов через естественные родовые пути.
При отсутствии готовности шейки матки к родам вводят эстрогены с аскорбиновой кислотой (5 % раствор – 5,0 мл) и витамином В1 (1 % Раствор – 2,0 мл); спазмолитики (но-шпа 2-4 мл, баралгин 5 мл, папаверин 2-4 мл); анальгетики (промедол 20-40 мг, анальгин 2 % раствор – 2-4 мл, трамал 15-20 мг).
Для срочной подготовки шейки матки к родам используют простагландиновые гели (простенон, динопростон, препидил-гель), которые вводят в шеечный канал или задний свод влагалища.
Для лечения используют однократный токолиз, который эффективно снимает спастические сокращения миометрия, понижает базальный тонус и возбудимость матки, прекращает на некоторое время ее сократительную активность. К токолитическим (В-адреномиметическим) препаратам, используемым с этой целью, относятся партусистен, бриканил и др. Токолиз используют только с учетом отсутствия известных противопоказаний к нему (любые заболевания сердечно-сосудистой системы, артериальная гипертензия и гипотензия, патология почек и кишечника и др.). Если данные объективного исследования свидетельствуют об отсутствии изменений состояния плода и предполагается предстоящие роды провести через естественные родовые пути, то лечебные мероприятия повторяют через 8-12 ч. Далее повторно производят оценку акушерской ситуации, обращая особое внимание на изменение состояния шейки матки ("зрелая", "недостаточно зрелая", "незрелая").
Максимальная продолжительность лечения ППП не должна превышать 2-3 дней.
Адекватное лечение ППП, как правило, способствует развитию родовой деятельности. Однако у каждой третьей беременной проявляется аномалия родовой деятельности (слабость или дискоординация).
Первичная слабость родовой деятельности
Для слабости родовой деятельности характерны недостаточные сила, длительность и периодичность схваток, замедленные сглаживание шейки матки, раскрытие ее и продвижение плода по родовому каналу. Все эти отклонения могут наблюдаться, несмотря на правильные соотношения размеров плода и таза.Слабость родовых сил чаще встречается у первородящих, чем у повторнородящих.
Первичная слабость родовой деятельности – патологическое состояние, при котором схватки с самого начала родов слабые и неэффективные. Первичная слабость родовой деятельности может продолжаться в течение первого и второго периодов.
Первичная слабость родовых сил возникает обычно у беременных с гипотонусом матки (первичная гипотоническая дисфункция матки). Важное значение в ее этиологии имеет недостаточность импульсов, вызывающих, поддерживающих и регулирующих сократительную деятельность матки, а также ее неспособность воспринять эти импульсы или ответить на них достаточно мощным сокращением миометрия. Наряду с общими причинами (заболевания матери, генитальный инфантилизм) важны следующие факторы: снижение концентрации ацетилхолина, окситоцина, простагландинов, повышение в крови активности холинэстеразы, деформация (огрубение, Уплотнение, а иногда и коллагенизация) аргирофильных чехлов мышечных клеток.
Продолжительность родов при первичной слабости родовой деятельности значительно увеличивается, что приводит к утомлению роженицы. Нередко возможны несвоевременное излитие околоплодных вод, удлинение безводного промежутка, инфицирование половых путей, гипоксия и гибель плода.
Диагноз первичной слабости родовой деятельности устанавливают на основании анализа характера и частоты схваток, тонуса матки, динамики раскрытия шейки матки. О слабости родовой деятельности свидетельствуют увеличение продолжительности латентной фазы родов до 6 ч и более и снижение скорости раскрытия шейки матки во время активной фазы до 1,2 см/ч у первородящих и 1,5 см/ч у повторнородящих.
Парто грамма говорит об удлинении родового акта как в первом, так и во втором периоде родов (рис. 20.1). Для оценки степени прогрессирования родов важно проанализировать сравнительные данные двух-трех последних влагалищных исследований.
Клинический диагноз слабости родовой деятельности целесообразно подтверждать показателями объективного наблюдения (кардиотокография, гистерография).
Лечение первичной слабости родовой деятельности заключается прежде всего в правильном определении причины и выборе в соответствии с этим дифференцированных методов борьбы с ней. При слабой родовой деятельности необходим контроль за опорожнением мочевого пузыря и кишечника. У рожениц с многоводием и продольным положением плода проводят раннее искусственное вскрытие плодного пузыря при условии сглаженной шейки матки и раскрытия маточного зева не менее чем на 2-3 см.
При длительных, затянувшихся родах, усталости роженицы ей предоставляется медикаментозный отдых (сон), если нет экстренных показании к родоразрешению (гипоксия плода, угроза чрезмерного прижатия мягких тканей родовых путей), поскольку назначение утомленной роженице (без предшествующего отдыха) стимуляции родовой деятельности может еще больше осложнить течение родов.
Акушерский наркоз (сон-отдых) должен проводить врач-анестезиолог. Для этой цели внутривенно вводят натрия оксибутират (2 – 4 г) одновременно с 20-40 % раствором глюкозы. За 20-30 мин до этого проводят премедикацию: внутривенно 1,0 мл 2 % раствора промедола, 1,0 мл 1 % раствора димедрола, 0,5 мл 0,1 % раствора атропина. Следует помнить о том, что натрия оксибутират повышает артериальное давление.
Если анестезиолога нет, то внутримышечно вводят комбинацию препаратов: промедол 2 мл или морадол 1 мл, димедрол 20 мг, седуксен 20 мг. Успешным может быть применение электроаналгезии импульсными токами.
После отдыха осуществляют влагалищное исследование для оценки акушерской ситуации.
Основным методом лечения слабости родовых сил является стимуляция сократительной деятельности матки.
Перед стимуляцией родовой деятельности необходимо оценить состояние плода с помощью кардиомониторного исследования.
Для родостимуляции при первичной слабости родовых сил используют следующие методики: 1. внутривенное капельное введение окситоцина; 2. внутривенное капельное введение простагландина Е2 (простенон); 3. влагалищное введение таблеток простагландина Е2 (простин); 4. внутривенное введение простагландина (энзапрост, динопрост); 5. комбинированное внутривенное капельное введение простагландина F2a и окситоцина.
Внутривенное введение окситоцина. Окситоцин оказывает сильное утеротоническое влияние на гладкие мышечные клетки матки, повышает ее тонус, синхронизирует действие мышечных пучков, стимулирует синтез ПГЁ2а децидуальной тканью и миометрием. Реакция матки на окситоцин неоднозначна в начале и в процессе развития родовой деятельности, так как число рецепторов к окситоцину возрастает ближе к окончанию родов (конец первого, второй, третий периоды родов). Именно к периоду изгнания плода окситоцин становится сильным стимулятором для синтеза nrF2a. Окситоцин наиболее эффективен при раскрытии маточного зева на 5 см и более.
При использовании окситоцина с целью родостимуляции нужно знать, что экзогенно вводимый он снижает выработку собственного эндогенного окситоцина. Прекращение внутривенного введения препарата может вызвать вторичное ослабление родовой деятельности, а длительное многочасовое введение – гипертензивный и антидиуретический эффекты.
Окситоцин не оказывает неблагоприятного влияния на здоровый плод. При хронической гипоксии плода он подавляет сурфактантную систему легких плода, что в свою очередь способствует внутриутробной аспирации околоплодными водами, кроме того, он может приводить к нарушению кровообращения у плода и даже к его интранатальной гибели.
Целесообразно окситоцин применять при вскрытом плодном пузыре.
Введение окситоцина можно сочетать с эпидуральной анестезией или со спазмолитическими, аналгезирующими средствами: но-шпой (2-4 мл), апрофеном (1 мл 1 % раствора), промедолом (1 мл 2 % раствора).
Методика введения окситоцина: 5 ЕД окситоцина разводят в 500 мл 5 % раствора глюкозы (декстрозы) или изотонического раствора натрия хлорида. Внутривенную инфузию начинают со скорости 1 мл/мин (10 кап/мин), через каждые 15 мин дозу увеличивают на 10 капель. При этом максимальная скорость составляет 40 кап/мин. Целесообразно для введения окситоцина использовать инфузомат.
На фоне адекватной дозировки окситоцина родовая деятельность также должна достигнуть своего максимума – 3-5 схваток за 10 мин.
Для профилактики аспирационного синдрома у плода при любом виде родостимуляции вводят седуксен (10-20 мг).
Роды при введении стимулирующих родовую деятельность средств ведут под кардиомониторным контролем.
Если введение окситоцина в течение 1,5-2 ч не дает необходимого клинического эффекта или состояние плода ухудшается, то беременную следует родоразрешить кесаревым сечением.
При клиническом эффекте стимуляции родовой деятельности окситоцином во избежание гипотонического кровотечения необходимо продолжить его введение и после рождения плода – в последовом и раннем послеродовом периодах. Сразу после рождения плода следует дополнительно провести профилактику кровотечения внутривенным одномоментным введением метилэргометрина.
Внутривенное введение простагландина Е2 применяют в основном в латентную фазу родов при недостаточной "зрелости" шейки матки и первичной слабости родовых сил. В отличие от окситоцина и nrF2a ПГЕ2 обладает важными положительными для плода свойствами: 1. ПГЕ2 вызывает синхронные, координированные сокращения матки с достаточно полной ее релаксацией, что не нарушает маточно-плацентарный и плодово-плацентарный кровоток; 2. стимулирует активность симпатико-адреналовой системы, подавляя гиперактивность холинергической нервной системы, поэтому не вызывает гипертонуса нижнего сегмента или дистоции шейки матки; 3. в умеренной степени активизирует синтез П1Т2а и окситоцина, не вызывая гиперстимуляции; 4. улучшает периферический кровоток, восстанавливает микроциркуляцию; 5. эффективность простагландина Е2 не зависит от уровня эстрогенной насыщенности; при гипоэстрогении он изменяет механизм подготовки шейки матки к родам, ускоряя этот процесс в десятки раз; 6. не обладает гипертензивным и антидиуретическим действием, поэтому может быть использован у рожениц с гестозом, артериальной гипертензией и заболеваниями почек; 7. более мягкое сокращение матки без какого-либо спастического компонента устраняет венозный застой в синусовых коллекторах, что способствует лучшему артериальному кровоснабжению матки, плаценты и опосредованно – плода.
Препараты ПГЕ2 менее эффективны при слабости потуг, ослаблении родовой деятельности в конце периода раскрытия.
Методика введения препаратов ПГЕ2 сходна с родостимуляцией окситоцином: 1 мл 0,1 % или 0,5 % раствора простенона растворяют в 500 или 1000 мл 5 % раствора глюкозы или 0,9 % раствора натрия хлорида (в 1 мл раствора содержится 1 мкг активного вещества) и вводят внутривенно со скоростью 10 кап/мин, увеличивая дозу в зависимости от ответа на препарат каждые 15 мин на 8 капель. Максимальная доза составляет 40 кап/мин. Для инфузии раствора предпочтительнее использовать автоматические и полуавтоматические системы, позволяющие учитывать дозу вводимого препарата.
Противопоказанием для использования простенона являются бронхиальная астма, заболевания крови, индивидуальная непереносимость препарата, что наблюдается редко.
Влагалищные таблетки простагландин Е2. Препарат простагландина Е2 – простин, содержащий 0,5 мг динопростона, вводят в задний свод влагалища трижды с перерывом в 1 ч. Преимущество такого вида родостимуляции заключается в локальном применении, простоте и доступности введения с одновременным воздействием на недостаточно "зрелую" шейку матки и гипотоничный миометрий. Назначают в латентную фазу родов,, при целом плодном пузыре, так как иначе простерон может попасть в полость матки и вызвать гиперстимуляцию.
Если родовая деятельность усилилась и роды вступили в активную фазу, дальнейшее применение препарата нецелесообразно. Этот вид родостимуляции противопоказан при излитии околоплодных вод и при вторичной слабости родовой деятельности и слабости потуг.
Внутривенное введение простагландина FПрепараты простагландина F2a являются сильными стимуляторами сократительной активности матки. Воздействуют на сс-адренорецепторы гладких мышечных клеток, усиливают одновременно активность симпатико-адреналовой и холинергической вегетативной нервной системы, активно взаимодействуют с окситоцином и ПГЕ2. Оказывают вазоконстрикторное действие, вызывают и усиливают артериальную гипертензию, повышают свертываемость крови, агрегацию и адгезию тромбоцитов. При несвоевременном применении PgF2a или при передозировке могут возникнуть тошнота, рвота, гипертонус нижнего сегмента матки. Проявляет свое действие независимо от эстрогенной насыщенности.
Методика введения: одну ампулу простина или экзапроста, содержащую 5 мг PgF2a, разводят в изотоническом растворе натрия хлорида или 5 % растворе глюкозы из расчета 1 мг на 1000 мл (1 мкг в I мл раствора) и вводят внутривенно со скоростью 10 кап/мин, увеличивая дозу каждые 15 мин на 8 капель, но не более 40 кап/мин. Показанием к этому виду родостимуляции является слабость родовой деятельности.
Значительный эффект при лечении слабости родовых сил получен при сочетании простагландина F2a с окситоцином.
При комбинированном внутривенном введении простагландина FЛ и окситоцина дозировку обоих препаратов снижают в два раза (по 2,5 мг и 2,5 ЕД), разводят в 500 мл 5 % раствора глюкозы и вводят внутривенно капельно со скоростью 8 кап/мин, прибавляя каждые 15 мин по 8 капель, доводя до 40 кап/мин (максимальная дозировка).
При одновременном введении окситоцина и простагландина F2a отмечается потенцированное их действие.
Вторичная слабость родовой деятельности
Вторичная слабость родовых сил (вторичная гипотоническая дисфункция матки) наблюдается, как правило, на фоне нормального тонуса матки. Схватки вначале носят регулярный характер достаточной силы, а затем постепенно ослабевают, становятся все реже и короче. Раскрытие зева, достигнув 4-6 см, далее не происходит; продвижение плода по родовому каналу прекращается. Подобная аномалия родовой деятельности наблюда-ется реже, чем первичная ее слабость, но может проявляться как в первом, так и во втором периодах родов.Этиологические факторы вторичной слабости родовой деятельности те же, что и первичной, но к ним присоединяется утомление в результате длительных и болезненных схваток, несоответствие между размерами плода и таза матери.
Диагностика вторичной слабости родовой деятельности основана на тщательном наблюдении за роженицей в течение 1-2 ч, когда в конце активной фазы в периоде изгнания плода наступает ослабление частоты и силы схваток или вообще родовая деятельность на какое-то время прекращается (см. рис. 20.1).
Лечение вторичной слабости родовых сил в первом периоде родов должно быть комплексным. При отсутствии срочных показаний к родоразрешению роженице необходимо предоставить отдых (акушерский наркоз, медикаментозный сон). Если родовая деятельность после сна остается слабой, назначают родостимуляцию (препараты простагландина F2a, окситоцин или их сочетание в половинной дозировке).
Стойкая слабость родовых сил, не поддающаяся медикаментозной терапии, является показанием к кесареву сечению.
В период изгнания, если головка находится в полости малого таза или в его выходе, вводят под кожу 0,2-0,5 мл окситоцина, питуитрина. При возникновении гипоксии плода, угрозе развития инфекции производят (при наличии соответствующих условий) влагалищное родоразрешение путем наложения акушерских щипцов, вакуум-экстрактора, извлечения плода за тазовый конец. Показано рассечение промежности.
Чрезмерно сильная родовая деятельность
В результате чрезмерно сильной родовой деятельности ("гиперактивность матки") роды могут быть стремительными. Эта форма аномалий родовой деятельности наблюдается у возбудимых, нервных рожениц. Для стремительных родов характерны частые, очень сильные схватки и потуги. Процесс сглаживания шейки матки происходит очень быстро. Сразу же после излития вод начинаются бурные, стремительные потуги, изгнание плода и последа может произойти за 1-2 потуги. Длительность родов у первородящих сокращается до 1-3 ч.Такие роды представляют значительную опасность как для матери, так и для плода. У рожениц часто возникают глубокие разрывы шейки матки, влагалища и пещеристых тел клитора, промежности. Возможны преждевременная отслойка плаценты или нарушение процесса отслоения ее в последовом периоде. У плода нередко наблюдаются гипоксические и травматические повреждения.
Стремительные роды иногда застают женщину на работе, на улице, в поезде (так называемые уличные роды). При этом, кроме указанных осложнений, возможны разрыв пуповины и падение ребенка на пол, что причиняет ему тяжелую травму вплоть до смертельного исхода. Подобные случаи являются поводом для судебно-медицинской экспертизы с целью исключения насильственной смерти плода.
Лечение при сильной родовой деятельности заключается в следующем. При поступлении роженицы с очень сильными родовыми схватками необходимо срочно уложить ее на бок, противоположный позиции плода. Не следует назначать очистительную клизму. Вставать роженице не разрешают. Для ослабления потуг целесообразно внутривенное введение 10% раствора сернокислого магния и назначение токолитических препаратов в положении роженицы на боку.
Методика применения токолитиков в родах заключается в следующем: половинную лечебную дозу одного из препаратов (партусистен, ритодрин, бреканил и др.) растворяют в 300 мл изотонического раствора натрия хлорида или реополиглюкина, или 5 % раствора глюкозы и вводят первые 15 мин со скоростью 8 кап/мин, каждые 10 мин число капель увеличивают на 8, добиваясь уменьшения числа схваток до 3-5 за 10 мин. Не следует добиваться полного прекращения родовой деятельности, необходимо лишь снизить тонус матки до нормальных значений (тонус 8-10 мм рт.ст.). Максимальное число капель в минуту не должно превышать 40.
При выраженном клиническом эффекте введение токолитиков прекращают, переходя на применение препаратов спазмолитического действия (но-шпа, баралгин). Обязательным компонентом ведения таких родов является профилактика гипоксии плода современными средствами и профилактика гипотонического (атонического) кровотечения.
Гипертоническая дисфункция матки
Гипертоническая дисфункция матки (дискоординация родовой деятельности и тетанус матки) встречается реже, чем гипотоническая, но значительно чаще, чем диагностируется.Дискоординация родовой деятельности
При дискоординации родовой деятельности смещается зона генерации и распространения импульсов действия (водитель ритма) из трубного угла на середину тела или на нижний сегмент матки (смещение водителя ритма по вертикали) (рис. 20.2). Могут возникать одновременно несколько активных зон генерации и распространения импульсов действия. Сокращения матки возникают то в дне, то в теле, то в нижнем сегменте матки (миграция водителя ритма). Миометрий теряет основное и крайне необходимое в родах свойство – синхронность сокращения и расслабление отдельных участков матки.
Волны сокращения распространяются не сверху вниз с убывающей силой и продолжительностью, а снизу вверх с возрастающей силой. Исчезает период обшей релаксации матки, нарушается принцип нисходящего тройного градиента.
 Рис. 20.2. Сокращение матки при дискоординированной родовой деятельности. Вершины кривых сокращений маточной мускулатуры, записанные из разных отделов матки, не совпадают (по Кальдейро-Барсиа).
Рис. 20.2. Сокращение матки при дискоординированной родовой деятельности. Вершины кривых сокращений маточной мускулатуры, записанные из разных отделов матки, не совпадают (по Кальдейро-Барсиа).
Развивается неадекватно высокий базальный тонус миометрия, сопряженный с повышенной частотой и ослаблением эффективности схваток. При кажущихся сильных сокращениях матки раскрытия не происходит. И как итог – тяжелое состояние: тетанус матки и прекращение родовой деятельности.
Дискоординация маточных сокращений часто вызывает несвоевременное излитие околоплодных вод и дистоцию шейки матки, являющуюся функциональной патологией. К ней приводят некоординированные сокращения и недостаточное расслабление матки, которые нарушают кровои лимфообращение. Шейка становится плотной, края маточного зева остаются толстыми, тугими, не поддающимися растяжению.
При дис координации родовой деятельности возможны серьезные осложнения для плода (гипоксия, гибель) и матери. Изменение градиента давления в венах, амниотической полости и толще миометрия может привести к эмболии околоплодными водами или преждевременной отслойке плаценты.
Особый риск при этой патологии представляют такие тяжелые осложнения, как разрыв матки, а также тяжелые кровотечения в последовом и раннем послеродовом периодах, обусловленные патологией сократительной деятельности матки.
Клиническая картина характеризуется спастическим характером схваток: схватки неравномерные, очень частые (6-7 за 10 мин), длительные. Между схватками матка полностью не расслабляется. Характерна болезненность схваток. Повеление роженицы беспокойное. Могут быть тошнота и рвота. Наблюдаются затруднение мочеиспускания, олигурия. Отмечаются замедленные раскрытие шейки матки и продвижение плода, удлинение латентной и(или) активной фазы родов, периода изгнания плода.
Диагностика дискоординированной родовой деятельности основывается прежде всего на клинических признаках и результатах таких дополнительных методов исследования, как гистерография, токография. Схватки частые, ритм неравномерный, амплитуда сокращения дна матки значительно меньше, чем в нижнем сегменте. Периодически появляются тетанические сокращения матки.
Амплитуда отдельных сокращений матки при дискоординации родовых сил может варьировать в широких пределах, что подтверждает неравномерность силы схваток. На фоне гипертонуса матки и недостаточного ее расслабления интенсивность (амплитуда) схваток снижена.
Несмотря на регулярные, частые и, казалось бы, сильные болезненные схватки, раскрытие маточного зева происходит очень медленно или же, достигнув 4 – 5 см, дальше не прогрессирует; при правильных соотношениях между размерами таза роженицы и плода, плод почти не продвигается по родовым путям.
В родах необходимо дифференцировать патологию родовых сил от ригидности шейки матки.
Лечение при возникновении дискоординации родовой деятельности заключается в устранении гипертонуса матки.
При наличии дополнительных осложнений беременности и родов целесообразно избрать для родоразрешения кесарево сечение без попытки проведения корригирующей терапии.
Лечение дискоординации родовой деятельности заключается в использовании седативных и спазмолитических средств, при утомлении роженицы – акушерский наркоз. Применение стимулирующих средств ошибочно, так как это еще больше нарушает сократительную деятельность, создает опасность возникновения тетании матки, родовой травмы плода.
Спазмолитические (но-шпа, баралгин) и обезболивающие (промедол) препараты на протяжении первого и второго периодов родов вводятся постоянно внутривенно и(или) внутримышечно (каждые 3 ч).
При дискоординации родовой деятельности наиболее оптимальна эпидуральная анестезия, которую можно проводить в сочетании с седуксеном или без него. При невозможности ее проведения применяют глюкозо-новокаиновую смесь внутривенно (10% раствор глюкозы и 0,25% раствор новокаина в равных количествах) или реополиглюкин, которые улучшают микроциркуляцию и снимают патологическую чрезмерную импульсацию матки. Во втором периоде родов проводят пудендальную анестезию и рассечение промежности, чтобы уменьшить механическое воздействие на го-ловку плода. Необходима медикаментозная профилактика кровотечения с помощью одномоментного внутривенного введения 1 мл метилэргометрина.
Роды ведутся при постоянном врачебном контроле, мониторном наблюдении за сердечной деятельностью плода и сокращениями матки, с использованием наружной или внутренней токографии, партограммы.
Тетанус матки (тотальная дистония)
При этой (очень редкой) патологии матка совсем не расслабляется, а все время остается в состоянии тонического напряжения.
Одновременно возникает не один водитель ритма, а несколько (смещение пейсмекера по вертикали и горизонтали). Матка как бы разделяется на несколько зон, каждая из которых берет на себя функцию пускового центра. Каждый сегмент матки имеет свой ритм, амплитуду и частоту сокращения, не совпадающие друг с другом.
Происходит фибрилляция миометрия, подобно мерцанию и трепетанию сердца при блокаде передачи импульсов. Тонус матки все время сохраняется повышенным, все гладкие мышцы находятся в состоянии тонического напряжения. Отсутствует суммарный эффект действия. Роды замедляются и останавл иваются.
Клиническая картина перехода дискоординированной родовой деятельности в гипертоническую форму слабости весьма характерна: после спастических, очень болезненных схваток наступает период видимого ослабления родовой деятельности.
Состояние роженицы более напоминает торпидную фазу родового шока, а тотальный тетанус всего миометрия свидетельствует о парадоксальной фазе парабиоза мышечных сокращений. Кожные покровы роженицы бледные, имеют место акроцианоз, мраморность кожи. Пульс частый, слабого наполнения. Роженица самостоятельно не мочится, при катетеризации мочевого пузыря выделяются малые порции мочи, содержащие белок, эритроциты, лейкоциты, цилиндры.
При наружном акушерском исследовании определяется матка, суженная в поперечнике за счет тетанического сокращения всех циркулярно расположенных гладких мышечных волокон. Имеется выраженное контракционное кольцо. Плод плотно охватывают мышцы матки. Пальпация предлежащей части крайне затруднительна. Даже при поперечном или косом положении плода матка сохраняет форму вытянутого овоида и так сдавливает плод, что создается впечатление продольного его расположения. Напряженный плотный нижний сегмент нередко принимают за предлежащую часть. Плод страдает, сердцебиение частое или редкое, аритмичное, глухое или звонкое с металлическим оттенком.
Итог влагалищного исследования: напряженные мышцы тазового дна, спастически суженное влагалище, отечные, толстые края зева, которые при развитии тотального тетануса матки становятся еще более толстыми, плотными и ригидными. Степень раскрытия маточного зева уменьшается (по сравнению с данными предыдущего влагалищного исследования) вследствие постоянной тотальной дистонии циркулярных мышц матки.
Самопроизвольное восстановление сократительной деятельности матки без медикаментозной коррекции наблюдается редко. У роженицы иногда повышается температура тела, развивается хориоамнионит, ухудшающий прогноз для матери и плода.
При появлении тетануса матки родоразрешение необходимо проводить толькопутем кесарева сечения или плодоразрушающей операции (на мертвом плоде) под глубоким наркозом.
Если тетанус матки возник во втором периоде родов, то под наркозом извлекают плод с помощью акушерских щипцов или за ножку (при тазовом предлежании). При мертвом плоде производят краниотомию. После извлечения плода необходимы ручное отделение и удаление последа, а также ручное обследование матки, чтобы исключить ее разрыв.
Профилактика аномалий родовой деятельности
Мероприятия, направленные на профилактику аномалий родовой деятельности, заключаются в осуществлении гигиенических мероприятий в детском и школьном возрасте, сохранении физиологического течения беременности у практически здоровых и предупреждении беременности у соматически больных женщин.В процессе родов важны тщательное соблюдение лечебно-охранительного режима, бережное и безболезненное ведение родов.
Целенаправленную медикаментозную профилактику проводят при риске развития патологии сократительной деятельности матки. К факторам риска относятся: 1. юный и пожилой (30 лет и старше) возраст первородящих; 2. отягощенный акушерско-гинекологический анамнез (бесплодие, индуцированная беременность, рождение больного, травмированного ребенка или мертворождение, осложненное течение аборта или предшествующих родов); 3. указание на хроническую инфекцию (особенно опасной является беременность, развившаяся на фоне хронического эндометрита); 4. наличие соматических, нейроэндокринных и психоневрологических заболеваний, вегетативно-сосудистых нарушений, нейроциркуляторной дистонии, вегетативно-обменных нарушений, структурной неполноценности миометрия (миома, аденомиоз, дистрофия и склероз отдельных мышечных участков, рубец на матке и др.); 5. хроническая плацентарная недостаточность; перерастяжения матки в результате многоводия, многоплодия или крупного плода; 6. аномалии таза.
Следует учитывать профессию женщины, так как определенные виды производственной деятельности связаны с хроническим переутомлением, истощением функции коры надпочечников, влиянием вредных химических материалов.
Женщинам группы риска развития аномальной родовой деятельности необходимы психопрофилактическая подготовка к родам, использование аутотренинга, позволяющих обучить методам мышечной релаксации, контролю за тонусом мускулатуры, умению снимать повышенную возбудимость, активизировать внушаемость и внимание.
Физиопсихопрофилактическая подготовка, включающая физические специальные упражнения, оказывает нормализующее действие на симпатико-адреналовую активность.
Из медикаментозных препаратов женщинам с факторами риска с 36 нед беременности назначают пиридоксин (витамин В6), фолиевую и аскорбиновую кислоты.
Пиридоксина гидрохлорид назначают внутрь по 0,002-0,005 г 2 раза в день в течение 10-14 дней, фолиевую кислоту по 200 мкг 2 раза в день также в течение 10-14 дней.
Как этиотропное средство для профилактики аномалий родовой деятельности применяют спазмолитики: но-шпу (по 1-2 таблетки 3 раза в день), а также галаскорбин (по 1,0 мг 2 раза), трентал (по 200 мг 2 раза), курантил (по 50 мг 2 раза).
Очень важно обеспечить беременной женщине психоэмоциональный комфорт, внушить уверенность в благополучном исходе родов. Ночной сон должен быть пролонгирован до 8-10 ч, дневной отдых не менее 2-3 ч. Предусматриваются длительное пребывание на свежем воздухе, рациональное питание.
Глава 21. Кровотечения при поздних сроках беременности (аномалии расположения плаценты, преждевременная отслойка нормально расположенной плаценты)
Кровотечение в III триместре беременности наблюдается у 2-3 % женщин. Примерно у половины из них причинами кровотечения являются предлежание плаценты и преждевременная отслойка нормально расположенной плаценты. Кроме того, причиной кровотечения могут быть эрозии и полипы шейки матки, рак шейки матки и влагалища, разрывы варикозных узлов влагалища, травмы влагалища, разрывы сосудов пуповины при оболочечном их прикреплении.Предлежание плаценты
В норме плацента прикрепляется в области тела матки и своим нижним краем не доходит до внутреннего зева на 7-8 см и более.Предлежание плаценты (placenta praevia) – аномалия расположения плаценты, при которой она прикреплена в области нижнего маточного сегмента. При этом та или другая часть ее находится в области внутреннего маточного зева, частично или полностью перекрывая его. При указанном расположении плацента находится ниже предлежащей части плода, т.е. на пуги его рождения. Термин "praevia" состоит из двух слов "ргае" и "via", что означает "на пути".
Предлежание плаценты, по данным литературы, встречается в 0,2-0,6 % случаев. В действительности частота предлежания плаценты значительно выше, что подтверждается данными ультразвукового исследования начиная с ранних сроков беременности. Большой процент самопроизвольных абортов происходит в результате низкой плацентации (предлежания плаценты) .
Материнская летальность при предлежании плаценты колеблется от 0 до 0,9%, по данным многих авторов. Основная причина смерти – шок и кровотечение.
Материнская заболеваемость составляет 23 %, преждевременные роды отмечаются в 20 % наблюдений.
Перинатальная летальность при предлежании плаценты остается высокой и варьирует от 17 до 26 %. Она обусловлена недоношенностью и функциональной незрелостью плода, его внутриутробным страданием. Связи гибели плода с числом эпизодов кровотечений на протяжении гестации не выявлено, но имеется четкая зависимость от величины кровопотери.
Классификация. В нашей стране наиболее часто используется следующая классификация степеней предлежания плаценты: 1. центральное предлежание плаценты (placenta praevia centralis) – внутренний зев перекрыт плацентой, плодные оболочки при влагалищном исследовании в пределах зева не определяются (рис. 21.1,а)' 2. боковое предлежание плаценты (placenta praevia lateralis) – предлежат части плаценты в пределах внутреннего зева, при влагалищном исследовании определяются рядом с дольками плаценты плодные оболочки, обычно шероховатые (рис. 21.1,6); 3. краевое предлежание плаценты (placenta praevia marginalis) – нижний край плаценты находится у краев внутреннего зева, в пределах зева находятся лишь плодные оболочки (рис. 21.1,в).
Кроме того, может наблюдаться низкое прикрепление плаценты, когда плацентарная площадка находится в нижнем сегменте матки, но нижний край ее на 7-8 см не доходит до внутреннего зева (переходное состояние от краевого предлежания плаценты до физиологического расположения ее в матке) (рис. 21.1, г).
Существует и более простая классификация, при которой центральное предлежание детского места называют полным (placenta praevia totalis), а боковое и краевое – неполным, или частичным (placenta praevia partialis).
Иностранные авторы пользуются следующей классификацией: 1. полное предлежание плаценты (placenta praevia totalis) – внутренний зев полностью прикрыт плацентой; 2. частичное предлежание плаценты (placenta praevia partialis) – внутренний зев частично перекрыт плацентой; 3. краевое предлежание плаценты (placenta praevia marginalis) – край плаценты располагается у края внутреннего зева; 4. низкое предлежание плаценты – плацента имплантируется в нижнем сегменте матки, но край плаценты не достигает внутреннего зева.
Как разновидность предлежания плаценты различают шеечную плаценту (placenta praevia cervicalis), но это название неправильное, так как плацента фактически локализуется в нижнем сегменте матки, а в области внутреннего зева проникает (прорастает) в шейку матки (placenta praevia isthmica), т.е. это вариант полного предлежания плаценты.
Что касается шеечной беременности, то ее правильнее относить к эк-топической беременности, а не к аномалии прикрепления плаценты. При данной патологии плодное яйцо и плацента локализуются в шейке матки. При этом плацента прорастает в толщу шейки и клинически проявляется в виде профузного кровотечения обычно в первой половине беременности (см. главу "Внематочная беременность") (рис. 21.1, д). Классификация предлежащей плаценты в определенной степени условна.
Степень предлежания плаценты в значительной мере зависит от величины раскрытия шейки матки в момент исследования. Так, например, низкое расположение плаценты при 2 см открытия может стать частичным при 8 см открытия. И наоборот, полное предлежание плаценты в начале родов может стать частичным при 4 см открытия. Наиболее правильно определять вид предлежащей плаценты при раскрытии зева не менее чем на 4-5 см. Следует подчеркнуть, что пальцевое исследование, которое проводится для определения отношения между краем плаценты и внутренним зевом шейки, может вызвать сильное кровотечение.
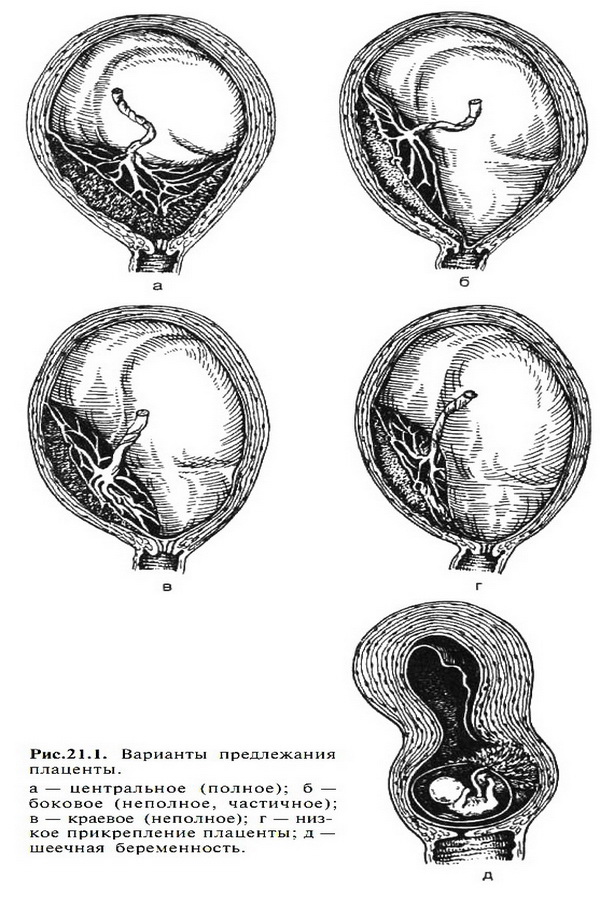 Рис.21.1. Варианты предлежания плаценты.
а – центральное (полное); б – боковое (неполное, частичное); в – краевое (неполное); г – низкое прикрепление плаценты; д шеечная беременность
Рис.21.1. Варианты предлежания плаценты.
а – центральное (полное); б – боковое (неполное, частичное); в – краевое (неполное); г – низкое прикрепление плаценты; д шеечная беременность
Этиология и патогенез.
Этиология предлежания плаценты недостаточно установлена. Существующие гипотезы важное значение придают как плодовому, так и маточному фактору развития этой патологии. При неполноценности плодного яйца, при снижении его протеолитических свойств оно не может своевременно привиться в области дна матки. В этой ситуации имплантация плодного яйца происходит после того, как оно опускается в нижние отделы матки. Подобный механизм возможен при искусственной инсеминации, экстракорпоральном оплодотворении и переносе эмбриона.
Чаще предлежанию плаценты способствуют атрофические и дистрофические процессы в слизистой оболочке матки, сопровождающиеся нарушением условий имплантации. Основными причинами дистрофических изменений слизистой оболочки! матки являются воспалительные процессы (хронический эндометрит), значительное число родов в анамнезе, перенесенные аборты, послеабортные и послеродовые септические заболевания, миома матки, деформация полости матки (рубцы после кесарева сечения и других операций), аномалии развития матки, инфантилизм, застойные явления в малом тазе при экстрагенитальной патологии. При снижении протеолитических свойств плодного яйца или при дистрофических изменениях в слизистой оболочке матки возможны нарушения развития хориона. При этом не происходит атрофии ворсин в области decidua capsularis и образования гладкого хориона. На месте его возможного расположения формируется ветвистый хорион (chorion frondosum).
По мере роста матки возможна миграция плаценты. В конце II триместра беременности 50 % плацент локализуется в нижнем сегменте матки. В первой половине беременности рост плаценты опережает рост матки. К концу II триместра и в начале III триместра, наоборот, по мере формирования нижнего сегмента матки плацента мигрирует кверху. Плацента может смещаться на 3-9 см, т.е. placenta praevia, диагностированная на ранних сроках беременности, не всегда остается до срока родов. Миграция плаценты более выражена при расположении ее на передней стенке.
Вследствие недостаточного развития децидуальной оболочки в области нижнего сегмента матки часто возникает плотное прикрепление плаценты (placenta adhaerens) или истинное ее приращение (placenta increta, или регcreta). В результате плотного прикрепления и приращения процесс отслойки плаценты в третьем периоде родов нарушается, что способствует развитию кровотечения. Нижний сегмент матки, где прикрепляется плацента, представляет собой губчатую, пещеристую ткань, которая легко травмируется при хирургических вмешательствах, плохо сокращается в раннем послеродовом периоде, являясь дополнительным источником кровотечения.
В клинической картине предлежания плаценты следует различать немую фазу, т.е. отсутствие выраженных симптомов, и выраженную фазу, когда появляется наружное кровотечение, что свидетельствует об отслойке предлежащей плаценты. Клиническая картина предлежания плаценты в конце беременности до появления кровотечения крайне скудная: высокое стояние предлежащей части плода, неустойчивое, косое, поперечное положение или тазовое предлежание плода. До использования ультразвукового исследования чаще диагноз предлежания плаценты устанавливали только при возникновении наружного кровотечения.
 Рис. 21.2. Отслойка предлежащей плаценты.
1 – пуповина; 2 – плацента; 3 – плацентарная площадка; 4, 10 – внутренний ма-точный зев; 5 – мочевой пузырь; 6 – передний свод; 7 – влагалище; 8 – наружный маточный зев; 9 – задний свод.
Рис. 21.2. Отслойка предлежащей плаценты.
1 – пуповина; 2 – плацента; 3 – плацентарная площадка; 4, 10 – внутренний ма-точный зев; 5 – мочевой пузырь; 6 – передний свод; 7 – влагалище; 8 – наружный маточный зев; 9 – задний свод.
Основным симптомом предлежания плаценты является кровотечение. Кровотечение при предлежании плаценты обусловлено ее отслойкой от стенок матки. В момент формирования нижнего сегмента происходит сокращение мышечных волокон в нижних отделах матки. Поскольку плацента не обладает способностью к сокращению, в результате смещения относительно друг друга двух поверхностей – участка нижнего сегмента матки и участки плаценты – ворсинки плаценты отрываются от стенок матки и появляется кровотечение из сосудов плацентарной площадки. Вытекающая кровь при этом материнская (рис. 21.2). Кровотечение может прекратиться лишь по окончании сокращения мышц, тромбоза сосудов и прекращения отслойки плаценты. Если сокращения матки возобновляются, кровотечение возникает снова. С начала родовой деятельности одним из факторов появления кровотечения при предлежании плаценты является натяжение оболочек в нижнем полюсе плодного яйца, которое удерживает край плаценты, и она не следует за сокращениями нижнего сегмента матки, в результате чего нарушается их связь и появляется кровотечение.
При разрыве плодных оболочек плацента, следуя за сокращениями нижнего сегмента, дальше не отслаивается. Поэтому во время родов кровотечение может прекратиться после разрыва плодных оболочек и механического прижатия края плаценты опускающейся в таз головкой плода. При полном предлежании плаценты невозможно самопроизвольное прекращение кровотечения, так как по мере сглаживания шейки матки плацента продолжает отслаиваться.
Кровотечение при предлежании плаценты имеет свои особенности. Оно чаше возникает без всякого видимого повода ночью во время сна, во время отдыха и т.д. При появлении кровотечения отсутствует болевой фактор (безболезненное кровотечение). Кровь, вытекающая из половых путей, яркого цвета. Следующей характерной особенностью кровотечений при предлежании плаценты является их повторное появление, что способствует прогрессирующей анемизации беременной. В подобных условиях даже сравнительно небольшое кровотечение во время родов может привести к клинической картине геморрагического шока и гипоксии плода.
Время появления кровотечения лишь в известной степени соответствует степени предлежания плаценты: кровотечение появляется тем раньше, чем ниже в матке расположена плацента, поэтому кровотечение во время беременности чаще возникает при полном, чем при частичном предлежании плаценты, хотя это не является правилом. Маточное кровотечение при предлежании плаценты наиболее часто возникает при сроке беременности 30-35 нед. Величина кровопотери также не всегда соответствует степени предлежания и зависит от площади отслоившейся плаценты. Теряемая при этом кровь всегда принадлежит матери, за исключением тех крайне редких случаев, когда одновременно с отслойкой плаценты почему-либо происходит ее разрыв, что может привести к потере крови и плодом.
При диагностике placenta praevia следует принимать во внимание особенности акушерско-гинекологического анамнеза, в котором имеет место наличие воспалительных процессов в матке и придатках, послеабортных и послеродовых заболеваний, аномалий развития матки, перенесенных абортов и операций (консервативная миомэктомия, кесарево сечение), дисфункций яичников.
Беременность нередко протекает с явлениями угрозы прерывания. При наружном акушерском исследовании беременной (роженицы) предлежание плаценты можно заподозрить при неправильном положении плода (поперечное, косое) или тазовом его предлежании, высоком расположении предлежащей части плода над входом в таз. При пальпации предлежащей части (головки) она ощущается менее четко, как бы через губчатую ткань (стенки матки и плацента), и ее можно принять за тазовый конец. При расположении плаценты на задней стенке в нижнем сегменте предлежащая часть нередко выступает кпереди над лобком, ее смещение кзади, к мысу, вызывает ощущение сопротивления и может вызвать урежение сердцебиения плода. Матка обычно безболезненна, и тонус ее нормальный. Однако диагностическая ценность указанных признаков относительно невелика.
Главный симптом, на основании которого врач должен заподозрить предлежание плаценты, – появление безболезненного кровотечения (очень часто повторного) из половых путей во второй половине беременности. Безболезненное кровотечение в III триместре беременности, независимо от того, выраженное оно или незначительное, должно рассматриваться как обусловленное placenta praevia до тех пор, пока диагноз не уточнен окончательно.
Наиболее информативным методом диагностики предлежания плаценты является ультразвуковое исследование. Точность метода составляет 98 %.
Ложноположительные результаты могут наблюдаться при перерастянутом мочевом пузыре, поэтому ультразвуковое исследование нужно повторить при опорожненном мочевом пузыре. Более достоверные результаты дает трансвагинальная эхография. Ультразвуковое исследование вытеснило ранее применявшиеся непрямые методы – цистографию, ангиографию, использование радиоизотопов.
Для уточнения диагноза и выявления причин кровотечения при обращении беременной в женскую консультацию с жалобами на кровотечение ограничиваются общим и наружным акушерским обследованием, при возможности осуществляют ультразвуковое исследование, которое позволяет диагностировать не только вариант предлежания плаценты, но и площадь ее отслойки. Влагалищное исследование не производят, так как при этом может усилиться кровотечение за счет непроизвольной насильственной от-слойки плаценты.
При поступлении беременной с кровотечением в стационар для уточнения диагноза при подготовленной операционной (для проведения кесарева сечения) производят осмотр шейки матки с помощью зеркал и двуручное влагалищное исследование.
При осмотре шейки матки с помощью зеркал можно определить источник кровотечения и исключить ряд заболеваний, при которых оно может иметь место: полип цервикального канала, эрозию шейки матки, варикозное расширение вен влагалища с разрывом узла.
Следует учитывать, что кровотечение из цервикального канала бывает не только при предлежащей плаценте, но и при преждевременной отслойке нормально расположенной плаценты, разрыве краевого синуса плаценты, разрыве матки, разрыве пуповинных сосудов.
При двуручном влагалищном исследовании, которое целесообразно проводить в конце беременности и в родах, при закрытом маточном зеве предполагается предлежание плаценты, если через своды удается определить как бы губчатую ткань между предлежащей головкой плода и пальцами акушера. В родах при раскрытии шейки матки на 3 см и более в случае предлежания плаценты удается прощупать губчатую ткань плаценты вместе с оболочками (обычно шероховатыми) и без них. При этом необходимо соблюдать осторожность, так как можно непроизвольно отслоить плаценту и спровоцировать кровотечение.
Отслойку предлежащей плаценты следует дифференцировать от разрыва бокового синуса, разрыва пуповинных сосудов, преждевременной отслойки нормально расположенной плаценты.
При разрыве бокового синуса (rupture sinus marginalis), происходящем в нижнем полюсе плаценты (особенно при низкой плацентации), кровотечение наступает внезапно (материнского происхождения) и обычно останавливается в течение 10 мин. У 20 % беременных может быть повторное кровотечение. Тонус матки повышен. Вытекающая кровь имеет алый цвет. По данным ультразвукового исследования определить место отслойки плаценты не удается, так как кровь не накапливается, а вытекает наружу.
У пациенток с разрывом бокового синуса часто наблюдается гестоз, а также многоплодная беременность.
Прогноз для плода благоприятный. Окончательный диагноз обычно устанавливают после родов, когда находят сгустки крови, фиксированные к краю плаценты.
При разрыве пуповинных сосудов (rapture vasa praevia) кровотечение наступает внезапно при спонтанном или искусственном вскрытии плодного пузыря. Оно умеренное, алого цвета и очень быстро приводит к гибели плода. При этом кожные покровы родившегося плода бледные вследствие кровопотери.
Пуповинные сосуды прикрепляются к оболочкам или к дополнительной дольке плаценты, при вскрытии плодного пузыря их целость нарушается. Установить диагноз крайне сложно. Но если сердцебиение плода быстро нарушается и это совпадает со вскрытием плодного пузыря и кровотечением, то можно думать о разрыве пуповинных сосудов. Диагноз устанавливают, исследовав вытекающую кровь на наличие плодовых клеток (ядерные элементы Клейхауэра), но плод часто погибает до получения результатов гематологического исследования.
Vasa praevia может быть диагностирована до кровотечения при ультразвуковом исследовании, а также путем пальпации пульсирующих сосудов, частота пульсации которых совпадает с частотой сердцебиения плода. Единственно правильным методом родоразрешения при разрыве пуповинных сосудов является кесарево сечение, но обычно провести его не успевают.
Лечение.
Выбор метода лечения при предлежании плаценты зависит от ряда обстоятельств: 1. времени возникновения кровотечения (во время беременности, в родах), 2. массивности и величины кровопотери, 3. общего состояния беременной (роженицы), 4. состояния родовых путей (степень раскрытия шейки матки), 5. вида предлежания плаценты, 6. срока беременности, 7. положения и состояния плода, 8. состояния гемостаза.
Решающим фактором, определяющим тактику ведения беременности при предлежании плаценты, является наличие или отсутствие кровотечения. В настоящее время чаще встречаются ситуации, когда предлежание плаценты впервые диагностируется при УЗИ в отсутствие клинических проявлений.
Если предлежание плаценты выявлено в первой половине беременности и отсутствуют кровяные выделения, то беременная может находиться под наблюдением врачей женской консультации. Пациентку и ее родных необходимо проинформировать о возможности кровотечения и их поведении при этом. Беременная должна четко знать, в какой стационар ей обращаться в случае появления кровотечения, должен быть предусмотрен способ транспортировки. Необходимо, чтобы дома беременная соблюдала определенный режим (исключаются физическая нагрузка, поездки, половая жизнь), следует регулярно (через 3-4 нед) проводить УЗИ для того, чтобы проследить миграцию плаценты (в 50 % случаев она может мигрировать и занять нормальное положение).
При выявлении предлежания плаценты во второй половине беременности, особенно при полном предлежании плаценты, пациентка должна находиться в стационаре.
При отсутствии кровотечения беременность целесообразно пролонгировать до 36-37 нед, а далее в зависимости от конкретной акушерской ситуации. Если предлежание плаценты сохраняется, необходимо избрать адекватный метод родоразрешения. При боковом или краевом предлежании плаценты, если нет других отягощающих обстоятельств (косое, поперечное положение плода, тазовое предлежание, многоплодие, рубец на матке, пожилая первородящая), можно подождать спонтанного начала родовой деятельности, применив раннюю амниотомию. При появлении кровотечения после амниотомии ставится вопрос об оперативном родоразрешении (кесарево сечение).
Если при предлежании плаценты во время беременности появляется кровотечение, то тактика ведения беременных определяется его выраженностью. Когда кровотечение массивное и угрожает жизни беременной, то единственно правильным методом, несмотря на срок гестации и состояние плода (плод нежизнеспособен или мертвый), является родоразрешение путем кесарева сечения. Во всех остальных случаях надо учитывать многие факторы и прежде всего срок беременности, степень предлежания плаценты, положение и состояние плода, подготовленность родовых путей.
Если кровяные выделения незначительные, то при удовлетворительном состоянии беременной и плода при сроке гестации до 36 нед рекомендуется лечение, направленное на пролонгирование беременности (до 37-38 нед). Назначают строгий постельный режим, проводят лечение, направленное на сохранение беременности (спазмолитики, (1-адреномиметики, магния сульфат), и антианемическую терапию. Рекомендуют препараты железа, поливитамины, по показаниям проводят переливание эритроцитной массы, све-жезамороженной плазмы. Одновременно назначаются дезагреганты, препараты, укрепляющие сосудистую стенку, проводится симптоматическая терапия. Если нет уверенности в пролонгировании беременности до 36 нед, то для профилактики развития дистресс-синдрома при рождении плода беременным показано введение глюкокортикоидов.
Терапия, направленная на сохранение беременности при прекращении кровотечения, проводят до 37-38 нед. В указанный срок гестации при наличии показаний выполняют кесарево сечение. Показаниями к оперативному родоразрешению при этом являются полное предлежание плаценты или сопутствующие осложнения при неполном предлежании: тазовое предлежание или неправильное положение плода, узкий таз, рубец на матке, многоводие, возраст первородящей и т.д. Если при неполном предлежании отсутствуют кровяные выделения и сопутствующая акушерская патология, при головном предлежании возможно вести роды через естественные родовые пути. Аналогичной же тактики придерживаются тогда, когда с началом родовой деятельности при неполном предлежании плаценты появляются кровяные выделения.
При установившейся родовой деятельности и прижатой головке или при появлении кровянистых выделений показано раннее вскрытие плодного пузыря. Перед вскрытием плодного пузыря необходимо уточнить, что предлежит к шейке, прижата ли головка плода, определить, есть ли плацентарная ткань, насколько она перекрывает область зева, определяются ли плодные оболочки, есть ли условия для их вскрытия. Разрыв плодных оболочек предупреждает дальнейшую отслойку плаценты, опускающаяся же в таз головка прижимает обнаженный участок плацентарной площадки к костям таза. Совокупность этих явлений приводит к прекращению кровотечения и спо-собствует в дальнейшем физиологическому течению родов.
После вскрытия плодного пузыря (искусственного или самопроизвольного) кровотечение прекращается, если головка опускается во вход в таз. При слабых схватках, глубокой недоношенности (маленькая головка) кровотечение часто про-должается и после вскрытия плодных оболочек. При слабых схватках для остановки кровотечения и усиления сократительной активности матки следует не только вскрыть плодный пузырь, но и начать капельное внутривенное введение окситоцина (5 ЕД в 500 мл изотонического раствора натрия хлорида). Если после вскрытия плодного пузыря головка плода не прижимает плотно плаценту к нижнему сегменту матки и кровотечение продолжается, показано родоразрешение путем кесарева сечения.
В случае кровяных выделений при глубоконедоношенном и нежизнеспособном плоде, если нет угрозы для жизни матери, как вынужденную меру можно применить кожно-головные щипцы по Иванову-Гауссу.
При особых обстоятельствах как исключение, когда нет условий для проведения кесарева сечения, а плод глубоконедоношенный или мертвый, можно прибегнуть к повороту плода на ножку при неполном раскрытии шейки матки (поворот по Брекстону-Гиксу). Хотя операция является сложной и опасной для матери и плода, она рассчитана на то, что после поворота плода на ножку и низведении ее ягодицы прижмут плаценту ко входу в таз и кровотечение остановится (рис. 21.3). После низведения ножки к ней прикрепляется груз массой до 400 г, при этом ни в коем случае нельзя производить экстракцию плода, так как это может привести к разрыву матки.
В третьем периоде родов имеется опасность кровотечения вследствие нарушения процесса отслойки плаценты или разрыва шейки матки. Известно, что нижний сегмент матки сокращается хуже, чем тело матки, особенно когда там прикрепляется плацента. На месте прикрепления плаценты выражены маточные сосуды. Кроме того, при предлежании плаценты часто наблюдается плотное или истинное ее приращение. С профилактической целью в момент врезывания (прорезывания) головки плода проводится внутривенное одномоментное введение окситоцина (5 ЕД) или метилэргометрина (1 мл 0,02 % раствора). Необходимо после рождения последа осмотреть шейку матки с помощью зеркал. При кровотечении из матки производят ручное отделение плаценты и выделение последа, а затем – осмотр шейки матки с помощью зеркал.
 Рис. 21.3. Тампонада кровоточа-щего участка матки ягодицами после поворота плода на ножку при предлежании плаценты (пово-рот по Брекстону-Гиксу).
Рис. 21.3. Тампонада кровоточа-щего участка матки ягодицами после поворота плода на ножку при предлежании плаценты (пово-рот по Брекстону-Гиксу).
В послеродовом периоде часто развиваются осложнения, обусловленные постгеморрагической анемией (слабость, головокружение, головные боли), субинволюция матки, гипогалактия. Ввиду анемизации родильницы, хирургических вмешательств во время родов, возможного травматизма шейки матки, низкого расположения плацентарной площадки существует реальная опасность возникновения послеродовых септических заболеваний, инфекций мочевого тракта.
Кесарево сечение при родоразрешении беременных с предлежанием плаценты. Основным методом родоразрешения беременных с предлежанием плаценты является кесарево сечение.
Показаниями к операции являются центральное предлежание плаценты, боковое или краевое предлежание плаценты при кровотечении и отсутствии условий для быстрого бережного родоразрешения. Кесарево сечение при предлежании плаценты, по данным литературы, проводят в 70-82 % случаев. Целесообразность кесарева сечения состоит, во-первых, в том, что немедленное извлечение плода и плаценты позволяет матке сократиться, останавливается кровотечение; во-вторых, кесарево сечение предупреждает повреждения шейки матки в родах и другие серьезные осложнения при полном или частичном предлежании плаценты.
При центральном предлежании плаценты единственно правильным методом родоразрешения является кесарево сечение, которое производится в плановом или экстренном порядке. Кесарево сечение в плановом порядке более целесообразно производить при сроке беременности 37 нед. Это дает возможность подготовиться к операции, иметь необходимый запас крови и инфузионных сред, избрать адекватный метод обезболивания, избежать дородовой кровопотери и получить жизнеспособный плод.
При выборе метода кесарева сечения при placenta praevia одни акушеры отдают предпочтение корпоральному кесареву сечению, а другие – операции в нижнем сегменте матки поперечным или продольным разрезом. Методом выбора следует считать корпоральное кесарево сечение, если плацента прикрепляется на передней стенке в области нижнего сегмента, где особенно развита сеть кровеносных сосудов, и женщина резко анемизирована. При продольном рассечении матки в области ее тела удается уменьшить кровопотерю, поскольку плацента не рассекается.
Если разрез матки производится в области нижнего сегмента, то обычно рассекается плацента, что может вызвать очень сильное кровотечение, при этом кровь теряют и мать, и плод. Нередко отмечаются продление разреза на матке и ранение сосудистого пучка. Поперечный разрез на матке в нижнем сегменте можно использовать в том случае, если плацента локализуется на ее задней стенке.
Во время проведения кесарева сечения возможно массивное кровотечение, так как нижний сегмент плохо сокращается вследствие того, что там, располагается плацентарная площадка и нередко наблюдается плотное прикрепление или приращение плаценты. Поэтому в случае кровотечения, не поддающегося консервативной терапии (введение утеротонических средств, массаж матки), показана экстирпация матки. Иногда приходится прибегать к перевязке подвздошных артерий с целью остановки кровотечения. При предлежании плаценты может быть коагулопатическое кровотечение. Во время операции кесарева сечения по поводу предлежания плаценты с гемостатической целью показано введение свежезамороженной плазмы, а при выраженной кровопотере – эритроцитной массы.
Методом выбора анестезии при кесаревом сечении у женщин с предлежанием плаценты является эндотрахеальный наркоз, при котором достигается хорошая мышечная релаксация, контролируется дыхание. При плановой операции можно использовать эпидуральную анестезию.
При родоразрешении женщин с предлежанием плаценты через естественные родовые пути или путем кесарева сечения необходимо присутствие неонатолога, поскольку плод может родиться в состоянии асфиксии из-за тяжести состояния матери (гиповолемический шок).
В раннем послеоперационном периоде для профилактики кровотечения показано введение утеротонических средств.
Ввиду значительной опасности развития гнойно-воспалительных заболеваний в послеоперационном периоде показано интраоперационное (после пережатия пуповины) профилактическое введение антибиотиков широкого спектра действия, которое продолжается в послеоперационном периоде (5 – 6 дней).
Профилактика предлежания плаценты заключается в снижении числа искусственных абортов (см. раздел "Планирование семьи"), своевременном лечении послеабортных, по7слеродовых и гинекологических воспалительных заболеваний, гормональных нарушений.
Преждевременная отслойка нормально расположенной плаценты
Преждевременная отслойка нормально расположенной плаценты (separatio placentae normaliter inserte spontanea, ПОНРП) – отслойка ее до рождения плода, т.е. во время беременности или родов (в первом и втором периодах). Данная патология представляет опасность для здоровья, а иногда и для жизни женщины; она крайне опасна и для плода.Плацента в течение беременности и родов в силу губчатого строения легко приспосабливается к изменениям внутриматочного давления и давления мышц маточной стенки, с которой интимно связана. Давление мышц матки на плаценту компенсируется внутриматочным давлением, что предотвращает ее отслойку. При уравновешивании двух сил, действующих в противоположном друг другу направлении, связь между плацентой и стенкой матки не нарушается. Кроме того, сохранению связи плаценты и матки способствуют значительная эластичность плацентарной ткани и небольшой интенсивности сокращения матки во время родов в области плацентарной площадки ("прогестероновый блок"). Всякое нарушение связи плаценты с маточной стенкой во время беременности и родов сопровождается кровотечением.
Преждевременная отслойка нормально расположенной плаценты, по данным литературы, встречается в 0,4-1,4 % наблюдений. Однако обычно учитывают только те случаи отслойки плаценты, которые были явно диагностированы. В действительности данная патология встречается значительно чаще, особенно при самопроизвольном преждевременном прерывании беременности в ранних и поздних сроках. Нередко при искусственном прерывании беременности можно видеть темные сгустки крови как результат отслойки плаценты. Довольно часто не учитывают случаи отслойки плаценты, которые протекают без клинических проявлений, и только после рождения на материнской поверхности плаценты находят сгустки крови или вдавления от гематомы (рис. 21.4).
Классификация. До настоящего времени единой классификации преждевременной отслойки нормально расположенной плаценты не существует.
В зависимости от степени (площади) отслойки выделяют частичную (прогрессирующую и непрогрессирующую) и полную отслойку нормально расположенной плаценты. Непрогрессирующую отслойку плаценты иностранные авторы называют хронической отслойкой плаценты.
По степени тяжести клинической картины ПОНРП различают легкую, средней тяжести и тяжелую. Тяжесть патологии зависит от кровопотери, величина которой обусловлена площадью и скоростью отслойки плаценты.
В зависимости от вида кровотече-ния различают три его формы: 1. наружное, или видимое, кровотечение, при котором наблюдается выделение крови из влагалища (рис. 21.5, а); 2. внутреннее, или скрытое, кровотечение, при котором кровь располагается между плацентой и стенкой матки (ретроплацентарная гематома) (рис. 21.5, б); 3. комбинированное, или смешанное, кровотечение, при котором кро-вотечение частично видимое и частично скрытое (рис. 21.5, в).
Этиология и патогенез.
Первопричину преждевременной отслойки нормально расположенной плаценты не всегда удается установить. Чаще к отслойке плаценты следует относиться как к завершающему этапу тяжелых, не всегда клинически выявленных патологических состояний, в патогенезе которых существенное значение имеет васкулопатия. Сосудистые нарушения в области маточно-плацентарного комплекса являются основными предрасполагающими факторами при любом другом дополнительном воздействии, приводящем к отслойке: механической травме, падении на живот, ударе в него, автоаварии и др.
 Рис. 21.4. Преждевременная отслойка нормально расположенной плаценты. Глубокое вдавление в плацентарной ткани после удаления сгустка крови.
Рис. 21.4. Преждевременная отслойка нормально расположенной плаценты. Глубокое вдавление в плацентарной ткани после удаления сгустка крови.
Во время беременности развитию преждевременной отслойки нормально расположенной плаценты способствуют экстрагенитальная патология (артериальная гипертензия различного генеза, гломерулонефриты, пиелонефриты, эндокринопатии); аутоиммунные состояния (синдромы антифосфолипидный и системной красной волчанки), способствующие иммунологическому конфликту между материнскими и плодовыми тканями с реакцией отторжения; аллергические реакции (на лекарственные вещества, плазму, декстраны, белковые препараты, гемотрансфузию); аномалии развития (двурогая, седловидная) и опухоли (миомы) матки. Вероятность ПОНРП возрастает при расположении плаценты в области локализации миоматозных узлов.
 Рис. 21.5. Варианты преждевременной отслойки нормально расположенной плаценты, а – частичная отслойка плаценты с наружным кровотечением; б – полная отслойка плаценты (ретроплацентарная гематома, внутреннее кровотечение); в – полная от-слойка плаценты с внутренним и наружным кровотечением.
Рис. 21.5. Варианты преждевременной отслойки нормально расположенной плаценты, а – частичная отслойка плаценты с наружным кровотечением; б – полная отслойка плаценты (ретроплацентарная гематома, внутреннее кровотечение); в – полная от-слойка плаценты с внутренним и наружным кровотечением.
Из осложнений беременности особенно часто к ПОНРП приводит гестоз. При этом имеют значение его длительность и тяжесть, наличие внутриутробной задержки роста плода. Особую группу риска представляют беременные с длительно текущим гестозом либо беременные с быстро нарастающей тяжестью заболевания.
Во время родов преждевременная отслойка нормально расположенной плаценты может наблюдаться при многоводии, в момент излития вод или при многоплодии после рождения первого плода, когда резко уменьшается внутриматочный объем и происходит выраженное сокращение матки; при короткой пуповине и запоздалом разрыве плодного пузыря, когда плацента отслаивается в периоде изгнания вследствие потягивания ее короткой пуповиной при продвижении плода или неразрывающимися, несмотря на полное раскрытие шейки, плодными оболочками; при гиперстимуляции матки за счет введения утеротонических средств. Преждевременную отслойку нормально расположенной плаценты могут вызывать акушерские операции: наружный акушерский поворот, амниоцентез.
Отслойка плаценты начинается с геморрагии в decidua basalis, нарушав ющих целостность всех слоев децидуальной оболочки с ее отслойкой от мышечного слоя матки. За счет прогрессирующего разрыва сосудов образуется гематома, которая ведет к отслойке, сдавлению и деструкции плаценты, прилегающей к этому участку.
Отслойка плаценты, начавшаяся на небольшом ее участке, в дальнейшем по тем или иным причинам может не распространяться дальше; кровяной сгусток постепенно уплотняется и частично рассасывается, а на месте отслойки плаценты образуются инфаркты и отложения солей, которые легко обнаруживаются после родов при внимательном осмотре плаценты.
У некоторых беременных участок отслойки плаценты может быстро увеличиваться. По мере растяжения матки вследствие нарастания гематомы снижается контрактильная способность миометрия, в результате чего разорванные сосуды плацентарной площадки в области отслоения плаценты не пережимаются и кровотечение из них может продолжаться. Скапливающаяся кровь отслаивает оболочки от стенки матки и вытекает из половых путей наружу.
Если кровь не находит выхода, то она может накапливаться между стенкой матки и плацентой в виде гематомы. Кровь при этом проникает как в плаценту, так и в толщу миометрия, что ведет к перерастяжению стенок матки. Это растяжение может быть настолько значительным, что в стенке матки образуются трещины, распространяющиеся до серозной оболочки и даже на нее. При этом вся стенка матки пропитывается кровью, которая может проникать в околоматочную клетчатку, а в ряде случаев – через трещины серозной оболочки и в брюшную полость. Такое патологическое состояние называют маточно-плацентарной апоплексией. Она была впервые описана A.Couvelaire (1911) и получила название "матка Кувелера". При матке Кувелера после родов часто нарушена сократительная способность миометрия, что приводит к гипотонии, прогрессированию ДВС-синдрома (диссеминированного внутрисосудистого свертывания крови), массивному кровотечению.
Клиническая картина и диагностика. Основными клиническими проявлениями ПОНРП являются кровотечение, боль в животе и поясничной области, болезненность и гипертонус матки, острая гипоксия плода.
Кровотечение может быть внутренним(ретроплацентарная гематома) и наружным. Степень кровотечения зависит от места и площади отслойки плаценты, гемостатических свойств крови. Кровь, вытекающая из половых путей, бывает разного цвета. Если наружное кровотечение появилось сразу после отслойки, то вытекающая кровь обычно ярко-алая; если от момента отслойки до появления крови прошел определенный промежуток времени, то кровь темного цвета, со сгустками. Если кровь проходит небольшое расстояние от нижнего полюса отслоившейся плаценты до наружного зева, то она имеет алый цвет; если же кровь вытекает из "старой" ретроплацентарной гематомы, расположенной высоко у дна матки, то выделения из влагалища часто имеют серозно-кровянистый характер.
Боль в животе является другим основным симптомом ПОНРП. Она обусловлена растяжением стенки матки, имбибицией ее стенки кровью, раздражением брюшины. Особенно выражен болевой синдром при внутреннем кровотечении. Прямая зависимость между степенью кровотечения и интенсивностью боли имеется не всегда. Иногда боли настолько сильные, что могут быть сравнимы только с болями при разрыве матки (ощущение, что что-то "разорвалось" в животе) или при разрыве трубы при внематочной беременности. Иногда боли иррадиируют в симфиз, бедро, часто бывают длительными и нередко приступообразными. При преждевременной отслойке плаценты, расположенной на задней стенке матки, отмечаются боли в поясничной области.
Гипертонус матки, как правило, наблюдается при внутреннем кровотечении и обусловлен наличием ретроплацентарной гематомы, имбибицией кровью и перерастяжением стенки матки. В ответ на постоянный раздражитель в стенке матки она сокращается и не расслабляется.
Острая гипоксия плода при ПОНРП может развиваться на ранних стадиях процесса, особенно при внутреннем кровотечении. Развитие гипоксии плода обусловлено как непосредственно самой отслойкой, так и гипертонусом матки, которые приводят к резкому снижению маточно-плацентарного кровотока. При отслойке более 1/3 материнской поверхности плаценты плод погибает от гипоксии. В очень редких случаях происходит отслойка всей плаценты, что приводит к быстрой гибели плода.
Формы ПОНРП. По клиническому течению в зависимости от площади отслойки плаценты, тяжести состояния различают легкую, средней тяжести и тяжелую формы. При легкой форме, когда имеется отслойка небольшого участка, болевые симптомы отсутствуют, матка в нормотонусе, сердцебиение плода не страдает. Видимые слизистые оболочки и кожные покровы обычного розового цвета, пульс иногда учащен, но остается хорошего наполнения.
Единственным симптомом ПОНРП могут быть скудные темные выделения из половых путей. При УЗИ возможно определение ретроплацентарной гематомы. Если кровь выделяется наружу, то установить какие-либо изменения в плаценте не удается. После родов при осмотре плаценты на материнской поверхности ее обнаруживается кратерообразное вдавление (см. рис. 23.6), образованное кровяным сгустком, и сам сгусток.
Вид и плотность сгустка зависят от времени, прошедшего после отслойки. Участок, где произошла отслойка плаценты, часто имеет белесоватый или желтоватый цвет, может быть плотным и шероховатым на ощупь за счет обызвествления. Если незначительная отслойка произошла в родах, то схватки (потуги) усиливаются или ослабевают, иногда становятся нерегулярными, обнаруживаются признаки гипоксии плода, в конце периода раскрытия или в периоде изгнания при целом плодном пузыре часто появляются кровяные выделения.
При средней тяжести имеется отслойка 1/4 поверхности плаценты. Начальные симптомы могут развиваться постепенно или внезапно с появлением постоянных болей в животе и выделением из половых путей темной крови со сгустками, иногда алой, в значительном количестве. Тонус матки повышен, полное расслабление матки между схватками отсутствует. За счет ретроплацентарной гематомы матка может иметь асимметричную форму. При пальпации матки отмечается болезненность. Из-за резко выраженного тонуса матки трудно выслушать сердцебиение плода. Плод страдает от гипоксии, может наступить его внутриутробная гибель. Могут появляться выраженные симптомы шока: бледность видимых слизистых оболочек и кожных покровов; кожа холодная, влажная на ощупь. Пульс частый, слабого наполнения и напряжения. Артериальное давление снижено, дыхание учащено. При УЗИ можно выявить участок отслойки плаценты в виде эхонегативной прослойки между стенкой матки и плацентой.
Тяжелая форма (острая плацентарная недостаточность) наблюдается при отслойке более 73 плаценты. Начало заболевания, как правило, внезапное: появляются боли в животе. Быстро развиваются симптомы геморрагического шока: слабость, головокружение, часто обморочное состояние. Больная беспокойна, стонет. Кожные покровы и слизистые оболочки бледные, лицо покрыто холодным потом. Дыхание и пульс слабого наполнения и напряжения. Артериальное давление снижено. При осмотре живот резко вздут, матка напряжена, с "локальной припухлостью", болезненная, мелкие части плода и сердцебиение не определяются. Картина внутреннего кровотечения может дополняться и наружным кровотечением. Последнее всегда наступает вторично и по сравнению с внутренним бывает менее обильным.
Тяжесть состояния при преждевременной отслойке плаценты определяется не только величиной и скоростью кровопотери, существованием очага постоянного раздражения, но и проникновением в кровоток матери большого количества активных тромбопластинов, образующихся в месте отслойки плаценты, что зачастую вызывает развитие острого синдрома внутрисосудистого свертывания крови (ДВС-синдром) с массивным потреблением факторов свертывания. В тяжелых случаях отслойки плаценты развивается почечная недостаточность, которая обусловлена как массивной кровопотерей, уменьшением сердечного выброса, гиповолемией, внутрипочечным спазмом сосудов, так и развитием диссеминированного внутрисосудистого свертывания крови. Почечная недостаточность проявляется корковым, клубочковым некрозом.
Диагностика. Диагноз преждевременной отслойки нормально расположенной плаценты устанавливается на основании жалоб, данных анамнеза, клинической картины и объективного исследования. При изучении анамнеза важное значение придается наличию таких экстрагенитальных заболеваний, как артериальная гипертензия, пиелонефрит, гломерулонефрит, травмы, гестозы и т.п. Клиническая картина ПОНРП обусловлена степенью и местом отслойки плаценты. Незначительную отслойку нормально расположенной плаценты во время беременности, если имеется незначительная боль в области матки и нет наружного кровотечения, без использования специальных методов исследования можно только заподозрить. Этот диагноз ставят лишь с помощью УЗИ или при осмотре материнской поверхности плаценты после ее рождения. При значительной отслойке плаценты диагноз выставляется с учетом клинической картины и данных УЗИ. Если преждевременная отслойка плаценты произошла в первом периоде родов, то необходимо обращать внимание на то, что схватки усиливаются или ослабевают, становятся нерегулярными; матка между схватками не расслабляется, появляются признаки острой гипоксии плода.
Довольно сложно установить диагноз отслойки нормально расположенной плаценты во втором периоде родов. При этом основными признаками отслойки являются кровяные выделения со сгустками и острая гипоксия плода. Нередко беспокоит распирающая боль в области матки.
Определенные диагностические признаки можно получить при влагалищном исследовании. Во время беременности шейка матки обычно сохранена, наружный зев закрыт, предлежащая часть плода располагается высоко. В первом периоде родов плодный пузырь при отслойке плаценты обычно напряжен, иногда появляется умеренное количество кровянистых выделений со сгустками из матки. При вскрытии плодного пузыря иногда изливаются околоплодные воды с примесью крови.
Из дополнительных методов исследования самым объективным и важным является УЗИ, которое следует проводить как можно раньше при подозрении на отслойку плаценты. Исследование при продольном и поперечном сканировании позволяет определить место и площадь отслойки плаценты, размеры и структуру ретро плацентарной гематомы. Если происходит незначительная отслойка плаценты по краю и имеется наружное кровотечение, т.е. кровь вытекает наружу, то при УЗИ отслойку можно и не обнаружить.
В случае ПОНРП происходят характерные изменения в системе гемостаза. Даже при незначительной отслойке плаценты тромбопластические субстанции тканевого и клеточного происхождения попадают в материнский кровоток, в результате чего развивается картина ДВС-синдрома. Интенсивность его зависит от размеров отслойки плаценты и времени ее развития.
У беременных с выраженными клиническими проявлениями ПОНРП наблюдаются характерные изокоагуляция или гипокоагуляция, что связано с потреблением факторов свертывания крови. При этом снижаются число тромбоцитов, концентрация фибриногена, уровень антитромбина III и повышается концентрация продуктов деградации фибрина/фибриногена.
Во время обследования беременных необходимо дифференцировать преждевременную отслойку нормально расположенной плаценты от ее предлежания, разрыва краевого синуса плаценты, разрыва сосудов пуповины, разрыва матки и др. (табл. 21.1).
Лечение.
Выбор метода терапии при ПОНРП зависит от следующих факторов: времени возникновения кровотечения (во время беременности, в родах); общего состояния беременной (роженицы); состояния плода; массивности и величины кровопотери; вида кровотечения (скрытое, наружное, смешанное); срока беременности; состояния родовых путей (степень раскрытия шейки матки); состояния гемостаза.
Во время беременности при выраженной клинической картине отслойки плаценты, когда наблюдаются болевой синдром, гипертонус матки, гипоксия плода, кровотечение (есть подозрение на маточно-плацентарную апоплексию) и ухудшение общего состояния, показано экстренное родоразрешение путем кесарева сечения, независимо от срока гестации и состояния плода.
Если состояние беременной и плода значительно не страдает, нет выраженного наружного или внутреннего кровотечения (небольшая непрогрессируюшая ретроплацентарная гематома), анемии при сроке гестации до 34-35 нед, возможна выжидательная тактика. Лечение при этом проводится под контролем УЗИ при постоянном наблюдении за состоянием плода (допплерометрия, кардиотокография) и включает постельный режим беременной, введение спазмолитических средств, дезагрегантов, поливитаминов, антианемических препаратов, переливание свежезамороженной плазмы и эритроцитной массы по показаниям.
Прогноз при начинающейся отслойке плаценты затруднителен, всегда возможны дальнейшее ее прегрессирование и переход легкой формы заболевания в тяжелую. Особенно должны насторожить даже незначительные повторные кровотечения, которые свидетельствуют о прогрессировании отслойки, что грозит жизни матери и плода. В подобных случаях следует ставить вопрос об абдоминальном родоразрешении даже при удовлетворительном состоянии беременной.
При отслойке плаценты в первом периоде родов, когда нет выраженного кровотечения, состояние роженицы удовлетворительное, тонус матки между схватками нормальный, отсутствуют признаки внутриутробного страдания плода, показана амниотомия. Рациональность амниотомии объясняется тем, что вытекание околоплодных вод ведет к уменьшению кровотечения, уменьшает поступление тромбопластина в материнский кровоток. Амниотомия ускоряет роды, особенно при доношенном плоде. Роды следует вести под постоянным мониторным наблюдением за характером сократительной деятельности матки и сердцебиения плода. Для усиления сократительной деятельности матки использовать окситоцин не рекомендуется, так как активация сократительной деятельности матки способствует поступлению тромбопластина в материнский кровоток и активации коагулопатии потребления. Если в процессе родов кровотечение усиливается, появляется гипертонус матки, отмечаются признаки страдания плода и нет условий для быстрого родоразрешения через естественные родовые пути, то в интересах матери и плода показано родоразрешение путем кесарева сечения.
При проведении кесарева сечения по поводу отслойки нормально расположенной плаценты как во время беременности, так и во время родов необходимо внимательно осмотреть не только переднюю, но и заднюю поверхность матки для выявления кровоизлияний под серозную оболочку (матка Кувелера). Фактически диагноз матки Кувелера устанавливают во время кесарева сечения.
При наличии матки Кувелера ("шоковая матка") после кесарева сечения, как правило, показана экстирпация матки без придатков в связи с опасностью кровотечения в послеоперационном периоде вследствие гипокоагуляции и гипотонии матки. Ограничиваться надвлагалищной ампутацией матки в этой ситуации нецелесообразно из-за часто возникающего кровотечения из культи шейки матки и необходимости релапаротомии для ее удаления. При повышенной кровоточивости во время операции кесарева сечения или экстирпации матки следует поставить дренажную трубку в брюшную полость для контроля за выделениями. Кесарево сечение или экстирпацию матки проводят под эндотрахеальным наркозом. В раннем послеоперационном периоде после кесарева сечения для профилактики кровотечения показаны введение утеротонических средств и контроль за данными гемостазиограммы. Одновременно с остановкой кровотечения в послеродовом периоде родильнице проводят инфузионно-трансфузионную терапию, коррекцию гемостаза.
Во втором периоде родов при выявлении отслойки нормально расположенной плаценты и наличии условий для родоразрешения через естественные родовые пути (полное раскрытие шейки матки, предлежащая часть плода в полости таза) проводят срочное родоразрешение путем наложения акушерских щипцов; при тазовом предлежании плода – его экстракцию; в отсутствие условий для вагинального родоразрешения – кесарево сечение.
Во всех случаях родоразрешения через естественные родовые пути после рождения плода необходимы ручное удаление последа (если его отслойка была неполной) и обследование матки. Ручное обследование матки, кроме того, способствует хорошему её сокращению.
Чтобы исключить повреждения, необходим также осмотр шейки матки и влагалища с помощью зеркал. Одновременно назначают сокращающие матку средства (окситоцин и др.) для предупреждения кровотечения в раннем послеродовом периоде.
При появлении позднего послеродового кровотечения для его остановки показано дополнительное введение утеротонических средств (окситоцин, простагландин) внутривенно или в шейку матки на фоне коррекции гемостаза (см. Лечение ДВС-синдрома). В отсутствие эффекта производится экстирпация матки.
Наиболее эффективным средством для остановки коагулопатического кровотечения является внутривенное введение свежезамороженной плазмы, свежей донорской крови, криопреципитата. При тромбоцитопении показано введение тромбоцитной массы.
Вопрос о введении гепарина является дискутабельным. Гепарин может быть применен в небольших дозах (1500-2000 ЕД) капельно с кровью или кровезаменителем под контролем свертывания крови через 12 ч после экстирпации матки.
Прогноз в отношении жизни матери и плода при ПОНРП весьма сложен. Материнская летальность при ПОНРП составляет 1,6-15,6%, по данным различных авторов. Основные причины гибели – шок и кровотечение.
Исход заболевания зависит от характера этиологического фактора, тяжести отслойки, состояния гемостаза, своевременности постановки диагноза, момента отслойки плаценты (во время беременности или в родах), характера кровотечения (наружное, внутреннее), выбора адекватного метода лечения, состояния материнского организма.
Перинатальная смертность при преждевременной отслойке обусловлена выраженностью внутриутробной гипоксии, возможной "незрелостью" плода и зависит от своевременности и качества оказания реанимационной неонатологической помощи.
Профилактика ПОНРП сводится к своевременной диагностике и лечению гестоза, артериальной гипертензии беременных, заболеваний почек, антифосфолипидного синдрома, синдрома красной волчанки и других заболеваний, которые являются факторами, способствующими отслойке плаценты.
Несомненную роль в профилактике ПОНРП играет правильное ведение родов: своевременное вскрытие плодного пузыря, дозированное введение утеротонических средств.
Общие принципы обследования беременных при кровотечении
Независимо от причины кровотечения во время беременности существует общий порядок обследования пациенток, поступающих в родовспомогательные учреждения с жалобами на кровяные выделения из половых путей. 1. Сбор анамнеза. 2. Пальпация матки (наружное акушерское исследование) и выслушивание сердечных тонов плода. 3. Осмотр наружных половых органов и определение характера кровяных выделений. 4. Ультразвуковое исследование. 5. Осмотр шейки матки с помощью подогретых зеркал. 6. Влагалищное исследование (только в конце беременности и в родах, бережно, при готовой операционной).При таком порядке обследования исключают возможные причины кровотечения. В первую очередь подтверждается или отвергается наличие таких грозных и опасных осложнений, как преждевременная отслойка нормально расположенной плаценты и предлежание плаценты. Наличие или отсутствие этих видов патологии выясняется при сборе анамнеза, оценке общего состояния, при пальпации матки, выслушивании сердечных тонов плода, проведении УЗИ и кардиотокографии. Во вторую очередь подтверждается или исключается патология мягких тканей родовых путей (в основном при осмотре с помощью зеркал). И только после этого при необходимости производится влагалищное исследование для решения вопроса о методе родоразрешения.
При поступлении беременной с кровотечением в смотровую следует воздержаться от постановки клизмы и душа, так как эти мероприятия могут усилить кровотечение.
В процессе сбора анамнеза обращают внимание на число предыдущих беременностей, осложнения при родах и абортах, перенесенные воспалительные заболевания матки. Как преждевременная отслойка нормально расположенной плаценты, так и ее предлежание чаще встречаются у повторнородящих. Наличие в анамнезе гестоза, гипертонической болезни и другой сосудистой патологии, врожденная недостаточность сосудов плаценты, венозный стаз, травма живота и тазовых органов указывают на возможность преждевременной отслойки нормально расположенной плаценты. К этой же патологии в родах могут приводить внезапное уменьшение объема матки (быстрое излитие околоплодной жидкости или рождение первого плода из двойни), короткая пуповина. Указания на наличие эрозии или полипа шейки матки позволяют предположить кровотечение из этих очагов.
Опрос беременной позволяет составить представление о количестве потерянной крови. При оценке общего состояния, определении пульса, измерении артериального давления выявляют степень анемизации. Если при небольшом кровотечении имеются явления выраженной анемии, это должно служить указанием на внутреннее кровотечение, свойственное преждевременной отслойке нормально расположенной плаценты.
При пальпации матки и проведении наружного акушерского исследования особое внимание обращают на тонус и болезненность матки, высоту стояния предлежащей части плода и дна матки. Плотная нерасслабляющаяся матка с болезненной припухлостью на отдельном участке характерна для преждевременной отслойки нормально расположенной плаценты. Высокое расположение предлежащей части плода и высокое стояние дна матки свидетельствуют о предлежании плаценты. При этом матка имеет нормальный тонус.
Выслушивая сердечные тоны плода, следует иметь в виду, что при преждевременной отслойке' нормально расположенной плаценты плод начинает страдать ра|ю и вскоре может погибнуть. Плод, как правило, погибает при отслойке1/3 плаценты. В случае предлежания плаценты изменения сердцебиения плода находятся обычно в прямой зависимости от степени наружного кровотечения. При патологии мягких родовых путей сердечная деятельность плода не изменяется.
С внедрением в акушерство ультразвуковой аппаратуры возможности диагностики причины кровотечения значительно повысились. УЗИ позволяет установить точную локализаций плаценты, наличие или отсутствие ретроплацентарной гематомы при любом сроке гестации.
Если в процессе обследования обнаружены клинические данные, подтверждающие отслойку нормально расположенной плаценты, то дальнейшие мероприятия по уточнению диагноза и лечению должны быть самыми экстренными и энергичными, так как малейшее промедление с лечением угрожает жизни матери и плода.
Если же ПОНРП не выявляется, то из приемного отделения беременную (роженицу) переводят на каталке в малую операционную, где проводят дальнейшее обследование (даже если было выполнено УЗИ).
Осмотр наружных половых органов позволяет исключить их травматическое повреждение. После этого производят осмотр шейки матки и стенок влагалища при помощи подогретых зеркал. Использование теплых зеркал необходимо во избежание рефлекторного сокращения матки в ответ на холодовое раздражение влагалища и, как следствие, усиления кровотечения. Ввиду возможного усиления кровотечения осмотр следует производить при полной готовности к операции. В случае обнаружения травмы, варикозных узлов, эрозии, полипа или рака шейки матки проводится соответствующее лечение. В отсутствие названных патологических состояний мягких родовых путей приступают к следующему этапу обследования – влагалищному исследованию. Влагалищное исследование производят только в конце беременности и родов и после предварительного УЗИ и постановки диагноза. Основная цель влагалищного исследования – определение готовности шейки матки к родам, уточнение тактики ведения пациентки, в том числе для проведения амниотомии. В отсутствие возможности выполнения УЗИ влагалищное исследование проводят и с диагностической целью при полной готовности к операции, а в отдельных случаях непосредственно в развернутой операционной. Эта предосторожность диктуется тем, что при влагалищном исследовании может начаться сильное кровотечение, когда окажется необходимым выполнение кесарева сечения.
Во время влагалищного исследования, при раскрытии шейки матки, диагностика предлежания плаценты является относительно нетрудной. В случаях полного предлежания весь просвет раскрытого внутреннего зева занят плацентарной тканью. При неполном предлежании в области внутреннего зева определяются часть плаценты и оболочки плодного пузыря (боковое предлежание) или только край плаценты, находящийся у самого края зева, а все пространство занято плодными оболочками (краевое предлежание). В случаях низкого прикрепления плаценты (плацента располага-ется в пределах 7 см от внутреннего зева) ее край даже при полном раскрытии шейки матки не определяется, эта аномалия расположения распознается по плотности и шероховатости оболочек вблизи от края плаценты.
Влагалищное исследование производят только в конце беременности и в родах. При недоношенной беременности и кровотечении от влагалищного исследования нужно отказаться, так как оно может усилить кровотечение и поставить врача перед необходимостью произвести кесарево сечение при глубоконедоношенной беременности. В отсутствие показаний к экстренному родоразрешению целесообразно предписать беременной строгий постельный режим, установить тщательное наблюдение за ее общим состоянием и характером выделений, назначить мероприятия, направленные на уменьше-ние кровотечения и пролонгирование беременности.
Глава 22. Патология последового и раннего послеродового периодов
Патология послеродового периода
Наиболее часто во время родов нарушается физиологическое течение третьего, последового, периода. Возможны такие осложнения, как задержка отделения плаценты и кровотечение.Задержка отделения плаценты
Задержка отделения плаценты наблюдается при гипотонии матки, полном плотном прикреплении или приращении плаценты, аномалиях строения и расположения плаценты (прикрепление в нижнем маточном сегменте, углах матки).
При гипотонии матки в связи с недостаточной сократительной способностью миометрия плацента не отделяется от плацентарной площадки. Снижение сократительной способности миометрия может быть врожденным или приобретенным, обусловленным гормональной дисфункцией, пороками развития матки, быстрым оперативным опорожнением матки, продолжительными родами, чрезмерным перерастяжением мышц матки (многоводие, двойня, крупный плод), миомой матки. При гипотонии матки последовые схватки или слабые, или отсутствуют длительное время после рождения плода. Последовый период характеризуется затяжным течением.
 Рис. 22.1. Последовый период. Полное плотное прикрепление плаценты.
Рис. 22.1. Последовый период. Полное плотное прикрепление плаценты.
Особую роль в задержке отделения плаценты играют различные виды патологического прикрепления плаценты к стенке матки: плотное прикрепление (placenta adhaerens), истинное приращение (врастание) (placenta ассгеta/increta, percreta). Приращение плаценты может быть полным (на всем протяжении плацентарной площадки) или частичным. Полное прирашение плаценты встречается крайне редко.
Наиболее частой формой патологического прикрепления плаценты является ее плотное прикрепление, когда имеется патологическое изменение губчатого слоя децидуальной оболочки, в котором при физиологических родах происходит отделение плаценты от стенки матки (рис. 22.1). В результате воспалительных или различных дистрофических изменений губчатый слой рубцово перерождается, из-за чего разрыв тканей в нем в третьем периоде родов невозможен и плацента не отделяется.
В некоторых случаях изменение децидуальной оболочки выражено настолько значительно, что компактный слой неразвит, губчатый и базальный слои атрофируются, слой Нитабух (зона фибриноидной дегенерации) отсутствует. В этих условиях один или более кателидонов плаценты непосредственно прилежат к мышечному слою матки или иногда проникают в его толщу (рис. 22.2). При этом речь идет об истинном приращении. В зависимости от степени врастания ворсин в мышечную оболочку матки различают placenta increta, когда она прорастает мышечный слой, и placenta percreta – прорастание ворсинами всей толщи мышцы и серозного слоя матки. Placenta percreta встречается очень редко: по данным различных авторов, от 5 до 7 случаев на 70 тыс. родов.
 Рис. 22.2. Последовый период. Истинное приращение плаценты (ворсины проникают в глубь миометрия).
Рис. 22.2. Последовый период. Истинное приращение плаценты (ворсины проникают в глубь миометрия).
Причинами развития дистрофических процессов в слизистом слое матки, способствующих плотному прикреплению или приращению плаценты, являются перенесенные ранее септические послеродовые и послеабортные процессы (атрофический эндометрит), специфические поражения эндометрия (гонорея, туберкулез), чрезмерные выскабливания, наличие послеоперационных рубцов, например, после консервативных миомэктомий, кесарева сечения. Вероятность приращения плаценты повышается при расположении ее в области послеоперационного рубца или в местах, мало при-способленных для нидации яйцеклетки, например, в нижнем сегменте матки (placenta praevia), а также при пороках развития матки (перегородка при двурогой матке), новообразованиях матки (подслизистые миоматозные узлы). Приращение плаценты возможно также при снижении ферментативной активности базального слоя слизистой оболочки, препятствующей в норме внедрению ворсин в мышцу матки. Вместе с тем повышение протеолитической активности ворсин хориона способствует прорастанию не только всех слоев слизистой оболочки матки, но и мышечного слоя.
Распознавание форм патологического прикрепления плаценты возможно лишь при ручном исследовании матки с целью отделения плаценты. При наличии placenta adhaerens удается, как правило, рукой удалить все доли плаценты. При плаценте accreta/increta и percreta невозможно отделить плаценту от стенки без нарушения целостности матки. Нередко истинное приращение плаценты устанавливают при патоморфологическом и гистологическом исследовании матки, удаленной в связи с гипотонией ее и массивным кровотечением в послеродовом периоде.
Существует связь нарушения отделения плаценты от плацентарной площадки с особенностями строения и прикрепления ее к стенке матки. Для отделения плаценты имеет значение площадь ее соприкосновения с поверхностью матки. При большой площади прикрепления, которая чаще наблюдается при относительно тонкой или кожистой плаценте (placenta membranacia), незначительная толщина ее препятствует физиологическому отделению от стенок матки. Такие аномальные плаценты, как лопастные, раздельные, двухдолевые или имеющие добавочные дольки (рис. 22.3), от-деляются от стенок матки с затруднениями, особенно при гипотонии матки.
 Рис. 22.3. Аномалии строения плаценты. а – плацента с добавочной долькой; б – двухдолевая плацента; в – удвоение плаценты.
Рис. 22.3. Аномалии строения плаценты. а – плацента с добавочной долькой; б – двухдолевая плацента; в – удвоение плаценты.
Нарушение отделения и выделения последа может обусловливаться местам прикрепления плаценты: в нижнем маточном сегменте (при низком расположении и предлежании ее), в углу или на боковых стенках матки, на перегородке, где мускулатура менее полноценна, не может развиться достаточная сократительная деятельность, необходимая для отделения плаценты. Возникают также нарушения при расположении плаценты над миоматозным узлом.
Клиническая картина.
Несмотря на различные причины задержки отделения плаценты, клиническое течение характеризуется общими симптомами – отсутствием признаков отделения плаценты и кровотечения. Матка при этом пальпируется в виде большого круглого образования равномерной твердой консистенции. Общее состояние роженицы не меняется.
Последовательность мероприятий при задержке отделения плаценты и отсутствии кровяных выделений из половых органов.
Роженица в третьем периоде родов нетранспортабельна. Отделение плаценты и выделение последа проводится на том же месте, где произошли роды.) 1. Катетеризация мочевого пузыря, после которой нередко происходят усиление сокращений матки и отделение плаценты. 2. Введение утеротонических препаратов через 15 мин после изгнания плода (окситоцин, внутривенно капельно 5 ЕД в 500 мл 5 % раствора глюкозы или по 0,5 мл внутримышечно через 15 мин 2 раза) для увеличения сократительной способности матки. 3. Пункция или катетеризация локтевой вены и внутривенное введение кристаллоидов с целью осуществления адекватной коррекции возможной в последующем кровопотери. 4. При появлении признаков отделения плаценты выделение ее по одному из способов удаления отделившегося последа (Абуладзе, Гентеру, Креде-Лазаревичу). 5. В случае отсутствия признаков отделения плаценты в течение 20-30 мин на фоне введения сокращающих средств производятся ручное отделение плаценты и выделение последа под наркозом. После отделения плаценты и удаления последа из матки тщательно обследуются ее внутренние стенки для выявления добавочных долек, остатков плацентарной ткани и оболочек. Одновременно удаляются сгустки крови. После удаления последа матка обычно сокращается, плотно обхватывая руку. Если тонус матки не восстанавливается, то дополнительно вводят утеротонические препараты, производится наружно-внутренний массаж матки на кулаке. После того как матка сократилась, руку выводят из полости матки. 6. При подозрении на истинное приращение плаценты необходимо прекратить попытку отделения ее и произвести удаление матки (ампутация, экстирпация матки). Последствиями чрезмерного усердия при попытках удалить ручным способом плаценту могут быть массивное кровотечение и прободение матки.
Кровотечение в последовом периоде
Наиболее опасным осложнением последового периода является кровотечение. Кровопотеря, превышающая 0,5 % от массы тела (250-400 мл), считается патологической, а 1000 мл и более (1 % и более от массы тела)- массивной.
 Рис. 22.4. Частичное плотное прикрепление плаценты.
Рис. 22.4. Частичное плотное прикрепление плаценты.
 Рис. 22.5. Ущемление плаценты в правом трубном углу.
Рис. 22.5. Ущемление плаценты в правом трубном углу.
Причинами кровотечения в третьем периоде родов являются: 1. нарушение отделения плаценты и выделения последа из матки (гипотония матки, частичное плотное прикрепление или приращение плаценты, аномалии строения и расположения плаценты, ущемление отделившегося последа в матке); 2. травмы мягких тканей родовых путей; 3. наследственные и приобретенные нарушения гемостаза (см. Нарушение системы гемостаза у беременных).
Нарушение отделения плаценты при ее частичном отделении от плацентарной площадки независимо от этиологического фактора (гипотония, плотное прикрепление или приращение) является причиной кровотечения, если доля плаценты отделилась, а остальная часть еще прикреплена к стенке матки (рис. 22.4).
При частичном отделении плаценты и задержке последа не наступает полного сокращения маточной мускулатуры. Разорванные маточно-плацентарные сосуды плацентарной площадки в области отделившейся части плаценты остаются открытыми, вследствие чего начинается кровотечение. Величина кровопотери зависит от степени сокращения маточных стенок и площади отделившейся плаценты.
Причиной кровотечения может быть не только нарушение отделения плаценты, но и нарушение выделения последа, которое наблюдается при дискоординации сокращений различных отделов матки. При этом возможна задержка уже отделившейся плаценты в матке за счет ущемления ее в одном из маточных углов или в нижнем сегменте из-за их сокращения и спазма (рис. 22.5). Матка нередко приобретает форму "песочных часов", что затрудняет выделение последа. Как правило, указанная патология наблюдается при неправильном ведении последового периода. Несвоевременные, ненужные манипуляции, грубое захватывание матки или грубый контроль за отделением плаценты, массаж матки, попытки выжимания последа по Креде-Лазаревичу при отсутствии признаков отделения плаценты, влечение за пуповину, введение больших доз утеротонических препаратов нарушают физиологическое течение третьего периода родов, правильную последовательность сокращений различных отделов матки. При преждевременном сдавлении матки рукой выжимается ретроплацентарная гематома, которая в норме способствует отделению плаценты.
Клиническая картина.
При нарушении отделения плаценты и выделения последа появляется кровотечение из родовых путей. Кровь жидкая, с примесью сгустков различной величины, вытекает не непрерывной струей, а как бы толчками, временно приостанавливаясь, чтобы через минуту-другую возобновиться с новой силой. Иногда первоначально кровь скапливается в полости матки и во влагалище, а затем выделяется сгустками, усиливаясь при применении наружных методов определения отделения плаценты. Задержка крови в матке и во влагалище нередко создает ложное представление об отсутствии кровотечения, вследствие чего мероприятия, направленные на его диагностику и остановку запаздывают. При наружном исследовании матки признаки отделения последа отсутствуют. Дно матки находится на уровне пупка или выше, отклоняясь при этом вправо. Общее состояние роженицы определяется степенью кровопотери и может быстро меняться. При отсутствии своевременной помощи развивается геморрагический шок.
Кровотечение, обусловленное травмой мягких тканей родовых путей. Кро-вотечение, появившееся к окончанию второго периода родов, чаще всего зависит от разрывов шейки матки. Небольшие травмы шейки матки не сопровождаются кровотечением, за исключением разрывов при предлежании плаценты. В этой ситуации выраженная васкуляризация шейки матки приводит к массивным кровотечениям даже при небольших травмах. Чаще кровотечение наблюдается при разрывах или расслоении тканей шейки матки, когда в них попадают веточки шеечной артерии. Кровотечение при этом начинается сразу после рождения ребенка. Кровотечение из разрыва шейки матки иногда может быть массивным, способствуя развитию геморрагического шока и гибели роженицы, если своевременно его не распознать.
Разрывы в области клитора, где имеется большая сеть венозных сосудов, также сопровождаются сильным кровотечением. При этом источник кровотечения обнаруживается без затруднений.
Возможно также кровотечение из поврежденных расширенных вен влагалища. Поскольку их повреждения могут быть множественными, остановить кровотечение из варикозных узлов бывает трудно. При наложении швов на разрыхленную стенку влагалища они легко прорезаются, что может приводить к новому травмированию вен и усилению кровотечения.
Последовательность пособий при кровотечении в III периоде родов 1. Катетеризация мочевого пузыря. Пункция или катетеризация локтевой вены с подключением внутривенных инфузии. 2. Определение признаков отделения плаценты (Шредера, Кюстнера-Чукалова, Альфельда). 3. При положительных признаках отделения плаценты выделяют послед по Креде-Лазаревичу, соблюдая следующий порядок: расположение матки по средней линии, легкий наружный массаж матки, правильное обхватывание матки (рис. 22.6), собственно выжимание. При отделении последа правильное выжимание с применением указанного метода обычно бывает успешным. Послед рождается вместе с потоком крови и сгустками. 4. При отсутствии признаков полного отделения последа следует все же применить прием Креде-Лазаревича, первоначально без наркоза, а при отсутствии эффекта – с применением наркоза, так как нельзя исключить ущемление последа в области нижнего сегмента или в одном из маточных углов. При использовании наркоза устраняется спазм циркулярной мускулатуры и создается возможность выделить отделившийся послед. 5. При отсутствии эффекта от применения наружных методов вы-деления последа необходимо произвести ручное отделение плаценты и выделение последа. В послеоперационном периоде необходимо ввести утеротонические препараты и время от времени производить наружный массаж матки и выжимание из нее сгустков по Креде-Лазаревичу. 6. Кровотечение, зависящее от разрывов шейки матки, клитора, промежности и влагалища, останавливается путем немедленного их зашивания и восстановления целостности тканей. На разрывы мягких родовых путей швы могут быть наложены только после выделения последа. Исключение составляют разрывы клитора, когда возможно восстановление его целостности сразу после рождения ребенка. Видимое кровотечение из сосудов раны промежности после эпизиотомии на первом этапе останавливают путем наложения зажимов, а после удаления последа из матки – ушиванием.
Разрывы промежности или неизмененных стенок влагалища редко вызывают массивное кровотечение, если при этом не повреждаются крупные сосуды (ветви a.vaginalis или a.pudenda). Исключение составляют высокие разрывы влагалища, проникающие в своды. При этом могут обнажаться основания широких маточных связок с массивным кровотечением при по-вреждении сосудов (маточные, влагалищные артерии и вены). Высокие разрывы влагалища чаще наблюдаются в сочетании с разрывом шейки матки. Такие разрывы встречаются, как правило, при оперативном родоразрешении, в частности при наложении акушерских щипцов.
Диагностика.
В третьем периоде родов кровотечение, обусловленное задержкой плаценты в матке, следует дифференцировать от кровотечения из разрывов мягких тканей.?
Клинически кровотечение при разрыве мягких тканей родовых путей харак-теризуется следующими признаками: 1. кровотечение возникает сразу после рождения ребенка; 2. несмотря на кровотечение, матка плотная, хорошо сократившаяся; 3. кровь не успевает свернуться и вытекает из половых путей жидкой струйкой яркого цвета.
При наличии врожденных или наследственных дефектов гемостаза в крови, вытекающей из матки, длительное время не образуются сгустки.
Лечение.
При наличии кровотечения в третьем периоде родов лечебные мероприятия должны быть четкими и быстрыми, направленными на отделение плаценты и выделение последа (см. с. 584), поскольку только при этих условиях мышцы матки сокращаются, приводя к остановке кровотечения.
Патология послеродового периода
Кровотечение в раннем послеродовом периоде
Кровотечение из половых путей в раннем послеродовом периоде (в первые 2 ч после рождения последа) может быть обусловлено: 1. задержкой части последа в полости матки; 2. гипотонией и атонией матки; 3. наследственными или приобретенными дефектами гемостаза (см. На-рушения системы гемостаза у беременных); 4. разрывом матки и мягких тканей родовых путей (см. Родовой травматизм матери).
Послеродовые кровотечения встречаются в 2,5 % случаев от общего количества родов.
 Рис. 22.6. Выделение последа по Креде – Лазаревичу.
Рис. 22.6. Выделение последа по Креде – Лазаревичу.
Задержка частей последа в полости матки. Кровотечение, которое начинается после рождения последа, нередко зависит от того, что часть его (дольки плаценты, оболочки) задержалась в матке, препятствуя тем самым ее нормальному сокращению. Причиной задержки частей последа в матке чаще всего является частичное приращение плаценты, а также неумелое ведение последового периода (чрезмерная активность). Диагностика задержки частей последа в матке не представляет трудностей. Эта патология выявляется сразу после рождения последа, при его тщательном осмотре, когда определяется дефект тканей.
Приналичии дефекта тканей плаценты, оболочек, рваного последа, а также сосудов, расположенных по краю плаценты и оторванных в месте их перехода на оболочки (возможность наличия оторвавшейся добавочной дольки, задержавшейся в полости матки), или даже при сомнении в целостности последа необходимо срочно произвести ручное обследование матки и удалить ее содержимое. Эта операция при дефектах последа производится и при отсутствии кровотечения, поскольку нахождение частей последа в матке в конечном итоге рано или поздно приводит к кровотечению, а также к инфицированию.
Гипотония и атония матки.
Наиболее частыми причинами кровотечения в раннем послеродовом периоде являются гипотония и атония матки, при которых нарушается послеродовой гемостаз и не происходит констрикции разорванных сосудов в области плацентарной площадки. Под гипотонией матки понимают такое состояние, при котором происходят значительное снижение ее тонуса и уменьшение сократительной способности; мышцы матки при этом реагируют на различные раздражители, но степень этих реакций неадекватна силе раздражения. Гипотония – обратимое состояние (рис. 22.7).
При атонии миометрий полностью теряет тонус и сократительную спо-собность. Мышцы матки не реагируют на раздражители. Наступает своеобразный "паралич" матки. Атония матки встречается чрезвычайно редко, но она может быть источником массивного кровотечения.
К гипотонии и атонии матки предрасполагают чрезмерно молодой или пожилой возраст рожениц, нейроэндокринная недостаточность, пороки развития матки, миома, дистрофические изменения мышц (перенесенные ранее воспалительные процессы, наличие рубцовой ткани, большое число предшествующих родов и абортов); перерастяжение матки во время беременности и родов (многоплодие, многоводие, крупный плод); стремительные или затянувшиеся роды при слабости родовой деятельности и длительной активации окситоцином; наличие обширной плацентарной площадки, особенно в нижнем сегменте. При сочетании нескольких из перечисленных выше причин наблюдаются выраженная гипотония матки и кровотечение.
 Рис. 22.7. Гипотония матки после выделения последа. Полость матки заполнена кровью.
Рис. 22.7. Гипотония матки после выделения последа. Полость матки заполнена кровью.
Мероприятия по остановке кровотечения при нарушении сократительной способности матки
Все мероприятия по остановке кровотечения проводят на фоне инфузионно-трансфузионной терапии в такой последовательности. 1. Опорожнение катетером мочевого пузыря. 2. При кровопотере, превышающей 350 мл, через переднюю брюшную стенку производят наружный массаж матки. Положив руку на дно матки, начинают делать легкие массирующие движения. Как только матка становится плотной, применяя прием Креде-Лазаревича, выжимают из нее скопившиеся сгустки. Одновременно вводят утеротонические препараты (окситоцин, метилэргометрин). Хорошо зарекомендовал себя отечественный препарат ораксопростол. На нижнюю часть живота кладут пузырь со льдом. 3. При продолжающемся кровотечении и потере крови более 400 мл или при большой скорости кровотечения необходимо под наркозом произвести ручное обследование матки, во время которого удаляют ее содержимое (оболочки, сгустки крови), после чего производится наружно-внутренний массаж матки на кулаке (рис. 22.8). Руку, находящуюся в матке, сжимают в кулак; на кулаке, как на подставке, наружной рукой через переднюю брюшную стенку массируют последовательно различные участки стенки матки, прижимая в то же время матку к лобковому симфизу. Одновременно с ручным обследованием матки внутривенно капельно вводят окситоцин (5 ЕД в 250 мл 5 % раствора глюкозы) с простагландинами. После того как матка сократится, руку извлекают из матки. В последующем проверяют тонус матки и внутривенно капельно вводят препараты, сокращающие матку. 4. При продолжающемся кровотечении, объем которого составил 1000-1200 мл, следует решить вопрос об оперативном лечении и удтении матки. Нельзя рассчитывать на повторное введение окситоцина, ручное обследование и массаж матки, если в первый раз они были неэффективны. Потеря времени при повторении этих методов приводит к увеличению кровопотери и ухудшению состояния родильницы: кровотечение приобретает характер массивного, нарушается гемостаз, развивается геморрагический шок и прогноз для больной становится неблагоприятным.
В процессе подготовки к операции используют ряд мероприятий, препятствующих притоку крови к матке и вызывающих ее ишемию, тем самым усиливая сокращения матки. Этого добиваются прижатием брюшной аорты к позвоночнику через переднюю брюшную стенку (рис. 22.9). Для усиления сокращений матки можно применять наложение клемм на шейку матки по Бакшееву. С этой целью шейку матки обнажают зеркалами. На ее боковые стороны накладывают по 3-4 абортцанга. При этом одну ветвь зажима располагают на внутренней поверхности шейки, вторую – на наружной. Потягивая рукоятки зажимов, матку смещают вниз.
Рефлекторное воздействие на шейку матки и возможное сдавление нисходящих ветвей маточных артерий способствуют уменьшению кровопотери. Если кровотечение прекращается, то абортцанги постепенно убирают.
Хирургическое лечение при гипотонии матки должно проводиться на фоне интенсивной комплексной терапии, инфузионнотрансфузионной терапии с применением современного наркоза, ис-кусственной вентиляции легких.
Если операция выполнена быстро при кровопотере, не превысившей 1300-1500 мл, а комплексная терапия позволила стабилизировать функции жизненно важных систем, можно ограничиться надвлагалищной ампутацией матки. При продолжающемся кровотечении с явным нарушением гемостаза, развитием ДВС-синдрома и геморрагического шока показана экстирпация матки. Во время операции (экстирпации или ампутации) следует дренировать брюшную полость, после экстирпации дополнительно оставляют незашитым влагалище. Перевязка сосудов матки как самостоятельный хирургический метод остановки кровотечения не получил распространения.
После экстирпации матки на фоне развернутой картины ДВСсиндрома возможно кровотечение из культи влагалища. В этой ситуации необходимо произвести перевязку внутренних подвздошных артерий.
Перспективным представляется метод остановки кровотечения путем эмболизации маточных сосудов.
Тяжелые формы гипотонии матки и массивные кровотечения, как правило, сочетаются с нарушениями гемостаза, протекающими по типу диссеминированного внутрисосудистого свертывания крови (ДВС-синдром). В связи с этим особое место занимают кровотечения, появляющиеся после шока различной этиологии (токсического, болевого, анафилактического), коллапса, связанного с синдромом сдавления нижней половой вены, или на фоне кислотно-аспирационного синдрома (синдром Мендельсона), при эмболии околоплодными водами. Причиной гипотонии матки при указанных патологических состояниях является блокада сократительных белков матки продуктами деградации фибрина (фибриногена) или околоплодными водами (чаще эмболия связана с проникновением небольшого количества околоплодных вод, тромбопластин которых запускает механизм ДВС-синдрома).
Массивные кровотечения после родов могут быть проявлением синдрома полиорганной недостаточности, наблюдаемого при гестозах, экстрагенитальной патологии. При этом на фоне микроциркуляторной недостаточности в мышцах матки развиваются ишемические и дистрофические изменения, кровоизлияния, характеризующие развитие синдрома шоковой матки. Существует взаимосвязь между степенью тяжести общего состояния женщины и глубиной поражения матки.
Клиническая картина.
Основным симптомом гипотонии матки является кровотечение. Кровь выделяется сгустками различной величины или вытекает струей. Кровотечение может иметь волнообразный характер: останавливается, вновь возобновляясь. Последовые схватки редкие и короткие. При осмотре матка дряблая, большого размера, верхняя граница ее доходит до пупка и выше. При проведении наружного массажа матки из нее выделяются сгустки крови, после чего тонус матки может восстанавливаться, но затем вновь возможна гипотония.
При атонии матка мягкая, тестоватая, контуры ее не определяются. Матка как бы расплывается по брюшной полости. Дно ее доходит до мечевидного отростка. Возникает непрерывное и обильное кровотечение. Если не оказать своевременную помощь, быстро развивается клиническая картина геморраги-ческого шока. Появляются бледность кожного покрова, тахикардия, гипотензия, похолодание конечностей. Количество теряемой родильницей крови не всегда соответствует тяжести заболевания. Клиническая картина во многом зависит от исходного состояния родильницы и от скорости кровотечения. При быстрой кровопотере геморрагический шок может развиться в считанные минуты.
 Рис. 22.8. Массаж матки на кулаке.
Рис. 22.8. Массаж матки на кулаке.
Диагностика.
С учетом характера кровотечения и состояния матки, диагностика гипотонии матки не представляет трудностей. В начале кровь выделяется со сгустками, в последующем она теряет способность к свертыва-нию. Степень нарушения сократительной способности матки можно уточнить при введении руки в ее полость во время ручного обследования. При нормальной моторной функции матки сила маточных сокращений отчетливо ощущается рукой, введенной в ее полость. При атонии сокращений нет, матка не реагирует на механические раздражения, в то время как при гипотонии отмечаются слабые сокращения в ответ на механические раздражения.
 Рис.22.9. Ручное прижатие аорты.
Рис.22.9. Ручное прижатие аорты.
Дифференциальная диагностика обычно проводится между гипотонией матки и травматическими повреждениями родового канала. Сильное кровотечение при расслабленной большой и плохо контурируемой через переднюю брюшную стенку матке свидетельствует о гипотоническом кровотечении; кровотечение при плотной, хорошо сократившейся матке указывает на повреждения мягких тканей, шейки матки или влагалища, которые окончательно диагностируются путем осмотра с помощью влагалищных зеркал. Мероприятия по остановке кровотечения – см. с. 587-588.
Профилактика.
В послеродовом периоде профилактика кровотечения включает в себя следующее. 1. Своевременное лечение воспалительных заболеваний, борьба с искусственными абортами и невынашиванием. 2. Рациональное ведение беременности, профилактика гестозов и осложнений беременности, полноценная психофизиопрофилактическая подготовка к родам. 3. Рациональное ведение родов: правильная оценка акушерской ситуации, оптимальная регуляция родовой деятельности, обезболивание родов и своевременное решение вопроса об оперативном родоразрешении. 4. Рациональное ведение последового периода, профилактическое введение медикаментозных средств, вызывающих сокращение матки, начиная с конца периода изгнания, включая последовый период и первые 2 ч раннего послеродового периода. 5. Повышение сократительной способности послеродовой матки.
Обязательны опорожнение мочевого пузыря после рождения ребенка, лед на низ живота после рождения последа, периодический наружный массаж матки, тщательный учет количества теряемой крови и оценка общего состояния родильницы.
Глава 23. Родовой травматизм матери
К родовому травматизму матери относят повреждения мягких тканей родового канала (наружных половых органов, влагалища, промежности), шейки и тела матки, произошедшие при патологическом течении родов, несвоевременном или неквалифицированном оказании акушерской помощи.Разрывы мягких тканей родового канала наиболее часто встречаются у первородящих женщин, разрывы матки – главным образом у многорожавших женщин. Число разрывов промежности в настоящее время относительно невелико благодаря широкому использованию профилактического рассечения последней.
Разрывы шейки матки встречаются в 6-15 % родов, по данным разных авторов. Разрывы матки составляют от 0,1 до 0,05 % от общего числа родов, или один разрыв на 3000-5000 родов.
Причинами травм мягких тканей родового канала чаше всего являются неумелая зашита промежности, роды крупным, гигантским и переношенным плодом, быстрые и стремительные роды, а также их затяжное течение, неправильные вставления головки, узкий таз, тазовое предлежание плода, ригидность, рубцовые или воспалительные изменения тканей, оперативное родоразрешение (наложение акушерских щипцов) и др.
Разрывы вульвы.
Происходят обычно в области малых половых губ, клитора и представляют собой поверхностные трещины, надрывы (рис. 23.1).Клиническая картина и диагностика.
Разрывы в области клитора сопровождаются кровотечением, иногда весьма значительным.
Лечение.
Разрывы в области малых половых губ зашивают тонким кетгутом непрерывным швом или отдельными швами без захвата подлежащих тканей во избежание кровотечения из кавернозных тел. При зашивании разрывов в области клитора в уретру предварительно необходимо ввести мочевой катетер. Наложение швов проводится под местной инфильтрационной или внутривенной анестезией.
Травмы влагалища.
Обычно сочетаются с разрывом промежности в том случае, если они локализуются в нижней ее трети. Разрывы влагалища в верхней трети промежности иногда переходят на свод влагалища и тогда сочетаются с разрывами шейки матки. Средняя треть влагалища вследствие своей растяжимости гораздо реже подвергается повреждениям. Иногда разрыв и размозжение тканей захватывают только глубокие подслизистые слои влагалища, эластическая слизистая оболочка остается целой.Клиническая картина и диагностика.
Клинически разрывы влагалища проявляются либо кровотечением из поврежденной стенки, либо – при подслизистом разрыве, когда повреждается венозный, а иногда и артериальный сосуд, – образованием гематомы, выпячивающей боковую стенку влагалища и значительно увеличивающей размеры половой губы с одной стороны. Это вызывает у родильницы чувство распирания. Размер гематомы зависит от калибра поврежденного сосуда.
Лечение.
Зашивание кровоточащей стенки влагалища отдельными или непрерывным швом; вскрытие и опорожнение большой по размеру гематомы, прошивание кровоточащих сосудов вместе с подлежащими тканями. Небольшие по объему гематомы обычно рассасываются без всякого вмешательства.
В случае локализации разрыва в верхней трети и перехода его на свод влагалища необходимо произвести ручное обследование матки для исключения разрыва матки в области ее нижнего сегмента.
Разрывы промежности.
Растяжи-мость промежности даже при самых благоприятных условиях имеет определенные пределы. Продвигающаяся по родовому каналу предлежащая часть плода, достигнув тазового дна, все сильнее давит на него и, таким образом, растягивает ткани промежности.Различают самопроизвольные и насильственные разрывы. Последние возникают при технических погрешностях проведения влагалищных родоразрешающих операций или неправильном оказании ручного пособия.
По глубине повреждения все разрывы промежности делятся на три степени.
К разрывам I степени относят разрывы кожи промежности на небольшом протяжении задней спайки и нижней трети влагалища (рис. 23.2, а); к разрывам II степени (рис. 23.2, б) – разрывы не только перечисленных тканей, но и мышц тазового дна, в основном мышцы, поднимающей задний проход (m.levator ani), кроме сфинктера прямой кишки, который остается неповрежденным; к разрывам III степени – более глубокие повреждения, куда оказывается вовлеченным сфинктер прямой кишки, а иногда и часть прямой кишки (рис. 23.2, в).
Разрыв промежности III степени относят к тяжелому виду акушерского травматизма. Неквалифицированное оказание медицинской помощи при разрыве III степени может привести к инвалидизации пациентки.
 Рис. 23.1. Разрывы наружных половых органов.
1 – мочеиспускательный канал; 2 – разрыв малой половой губы; 3 – разрыв в области клитора.
Рис. 23.1. Разрывы наружных половых органов.
1 – мочеиспускательный канал; 2 – разрыв малой половой губы; 3 – разрыв в области клитора.
К редкому виду травм относят центральный разрыв промежности, когда плод рождается не через половую щель, а через отверстие, образовавшееся в центре промежности. При этом остаются сохраненными сфинктер прямой кишки и задняя спайка, однако очень сильно повреждаются ткани, лежащие между этими двумя образованиями.
В некоторых случаях происходят глубокие повреждения мышц промежности без нарушения целости кожи.
 Рис. 23.2. Разрывы промежности I (а), II (б) и III (в) степени.
Рис. 23.2. Разрывы промежности I (а), II (б) и III (в) степени.
Клиническая картина и диагностика.
Различают 3 основных признака угрожающего разрыва промежности: 1. вследствие чрез-мерного растяжения промежности головкой плода вначале нарушается венозный отток крови, что выражается в цианозе тканей; 2. отек промежности, который проявляется блеском тканей; 3. бледность кожи промежности, свидетель-ствующая о сжатии артериальных сосудов и обескровливании тканей, которые не в состоянии противостоять дальнейшему сдавлению, вследствие чего и про-исходит разрыв промежности.
Диагностика разрывов промежности осуществляется без особых трудностей при тщательном осмотре родовых путей в первые часы после родов.
Лечение.
Проводится согласно общим принципам лечения ран: каждая рас-познанная неинфицированная рана должна быть зашита в течение первого часа после родов. Разумеется, рана в области промежности всегда инфицирована, однако усиленное кровоснабжение во время беременности обусловливает заживление, как правило, первичным натяжением.
Операцию зашивания разрывов и разрезов промежности производят на операционном столе под местной инфильтрационной, ишиоректальной или внутривенной анестезией с соблюдением всех правил асептики и антисептики. При разрывах I и II степени и разрезах промежности хирургу необходима помощь врача-ассистента, а при разрывах III степени – двух ассистентов. Зашивание разрыва III степени производят под наркозом.
При разрывах промежности III степени операцию производит опытный' хирург, ибо неправильное наложение швов и плохое заживление раны в дальнейшем приводят к опущению влагалища и матки, а иногда и к полному ее выпадению. Нарушение функции сфинктера прямой кишки может привести к недержанию газов и кала.
Техника восстановления промежности при травмах (I и II степени) представлена на рис. 23.3, а, б.
Перед наложением швов острыми ножницами следует удалить размозженные ткани в области краев разрыва. Накладывать швы необходимо таким образом, чтобы восстановить нормальные анатомические взаимоотношения.
Единого метода восстановления целости промежности при разрывах I-II степени не существует, так как в каждом случае характер и глубина разрыва могут быть различными. Однако общие принципы едины для всех видов хирургического пособия, выполняемого при этой патологии.

 Рис. 23.3. Ушивание разрывов промежности I (а) и II (б) степени.
Рис. 23.3. Ушивание разрывов промежности I (а) и II (б) степени.
 Рис. 23.4. Ушивание разры-вов промежности III степе-ни.
а – наложение швов на стенку прямой кишки; б – • наложение наружных швов на сфинктер прямой кишки; в – после восстановления целости сфинктера прямой кишки (разрыв III степени превратился в разрыв II степени).
Рис. 23.4. Ушивание разры-вов промежности III степе-ни.
а – наложение швов на стенку прямой кишки; б – • наложение наружных швов на сфинктер прямой кишки; в – после восстановления целости сфинктера прямой кишки (разрыв III степени превратился в разрыв II степени).
1. Операция должна начинаться с наложения шва (хромированный кетгут, дексон, викрил) на верхний угол разрыва влагалища, который должен быть хорошо обнажен зеркалами. Концы лигатуры берут на зажим, и помощник натягивает нить. При этом хорошо видны края раны. 2. Наложение 3-4 погружных швов (хромированный кетгут, викрил) на мышцы промежности. 3. Восстановление стенки влагалища с помощью наложения отдельных лигатур или непрерывного шва с захватыванием подлежащих тканей; ориентиром при этом служит первоначально наложенная и переданная помощнику лигатура. 5. Восстановление кожи промежности с помощью 3-4 отдельных шелковых лигатур или подкожного косметического шва. Зашивание разрывов промежности II степени. Восстанавливать рану начинают с верхнего ее угла путем наложения непрерывного викрилового шва на слизистую оболочку влагалища и заканчивают шов в области задней спайки, после чего на всю толщу раны сверху вниз накладывают восьмиобразные викриловые швы.
Таким же образом зашивают и разрезы промежности (эпизиотомия и перинеотомия).
Операция восстановления разрывов промежности III степени имеет свои особенности и складывается из следующих этапов (рис. 23.4): 1. Восстановление стенки прямой кишки и сфинктера. Вначале накладывают шелковые швы на слизистую оболочку прямой кишки с погружением узлов в ее просвет, затем тонким хромированным кетгутом сопоставляют мышечную стенку прямой кишки, узлы завязывают в просвет раны. 2. Восстановление сфинктера прямой кишки. Поскольку жом прямой кишки представляет собой круговую мышцу, один край ее при полном разрыве сокращается и уходит глубоко в ткани; второй край обычно виден, поэтому прежде всего необходимо извлечь зажимом сократившуюся часть круговой мышцы и восстановить ее целость несколькими матрацными швами (хромированный кетгут, викрил, дексон). Производят смену инструментов, обработку рук хирургов и только после этого приступают к следующему этапу операции. 3. В дальнейшем зашивание производят так же, как и при разрыве II степени (см. выше).
Разрывы шейки матки
Разрывы шейки матки чаще всего происходят в направлении снизу вверх, т.е. от наружного зева к внутреннему (рис. 23.5). В зависимости от глубины различают 3 степени разрыва шейки матки.К разрывам I степени относят разрывы шейки матки с одной или двух сторон длиной не более 2 см, к разрывам II степени – разрывы протяженностью более 2 см, но на 1 см не доходящие до свода влагалища, к разрывам III степени – разрывы, доходящие до свода влагалища или переходящие на него. Разрывы III степени – тяжелый вид акушерского травматизма, при котором невозможно исключить переход разрыва шейки матки на область ее нижнего сегмента.
Клиническая картина и диагностика. Неглубокие разрывы длиной 0,5-1 см обычно не дают симптоматики. Более глубокие разрывы шейки матки сопровождаются кровотечением той или иной интенсивности. При повреждении нисходящей шеечной ветви маточной артерии кровотечение бывает довольно обильным, начинается сразу после рождения ребенка. Кровь вытекает алой струйкой при отделившемся последе и хорошо сократившейся матке.
При размозжении тканей шейки матки вследствие ее длительного прижатия головкой к костям таза кровотечение может отсутствовать, однако повреждения шейки матки в этом случае весьма значительны.
В отсутствие кровотечения распознать разрывы шейки матки можно только при осмотре всех ее краев с помощью влагалищных зеркал и мягких зажимов. Осмотр необходимо производить всем родившим женщинам в первые 2 ч после родов. При кровотечении осмотр следует производить тотчас же после отделения и осмотра последа.
Лечение. Заключается в зашивании разрыва шейки матки сразу после родов.
Разрыв шейки матки III степени является показанием к ручному обследованию полости матки для исключения разрыва нижнего ее сегмента.
На разрывы шейки матки можно накладывать двухрядные или однорядные швы.
Техника наложения двухрядного шва на разрывы шейки матки. Края разрыва захватывают окончатыми зажимами и несколько низводят, после чего накладывают первый шов через все слои немного выше верхнего угла разрыва. Затем накладывают первый этаж отдельных кетгутовых швов со стороны цервикального канала по направлению к наружному зеву; вкол и выкол иглы производят на расстоянии 0,3-0,5 см от краев разрыва и узлы завязывают в просвет цервикального канала нетуго, только до соприкосновения раневых поверхностей. Первый этаж швов позволяет восстановить целость слизистой оболочки и мышечного слоя цервикального канала.
Второй ряд швов накладывают со стороны влагалищной части шейки матки (наружная ее поверхность) в том же порядке от верхнего угла по направлению к наружному зеву. Швы накладывают на слизистую оболочку влагалищной части шейки матки и оставшуюся часть глубжележащего мышечного слоя. Вкол и выкол производят отступя 0,5 см от края разрыва. Швы завязывают на наружной поверхности шейки матки и накладывают в промежутках между швами первого ряда.
Данный метод обеспечивает восстановление анатомически однородных тканей, что способствует правильной инволюции шейки матки в послеродовом периоде и заживлению раны первичным натяжением.
Техника наложения однорядного шва (см. рис. 23.5). Отдельные кетгутовые швы накладывают от верхнего края разрыва по направлению к наружному зеву, причем первую лигатуру (провизорную) – несколько выше места разрыва. Это дает возможность врачу без труда, не травмируя и без того поврежденную шейку матки, низводить ее, когда это требуется. Для того чтобы края разорванной шейки матки при зашивании правильно прилегали друг к другу, вкол иглы надо делать непосредственно у края, а выкол – на 0,5 см отступя от него. Переходя на противоположный край разрыва, иглу вкалывают на 0,5 см отступя от него, а выкалывают непосредственно у края. Швы при таком наложении не могут прорезываться, так как прокладкой служит вся стенка шейки матки. После сращения краев раны линия швов представляет собой тонкий, ровный, почти незаметный рубец.
 Рис. 23.5. Техника наложения од-норядного шва.
Рис. 23.5. Техника наложения од-норядного шва.
Существует методика более отсроченного зашивания разрывов шейки матки после родов (на 3-5-й день). В этих случаях сформировано мышечное кольцо циркулярного слоя, хорошо видны даже небольшие разрывы, однако при этом необходимо иссечение краев разрыва.
Профилактика разрыва мягких тканей родовых путей. Заключается в рациональном ведении родов: применение спазмолитических препаратов, адекватное обезболивание родов; недопущение преждевременных потуг, своевременная диагностика ущемления шейки матки, осторожное использование препаратов окситоцина, бережное, по строгим показаниям и с соблюдением соответствующих условий, выполнение влагалищных родораэрешаюших операций.
Профилактика разрывов промежности заключается в правильном ведении родов, особенно в периоде изгнания, выполнении целесообразных с акушерской точки зрения приемов, спокойном поведении роженицы во время прорезывания головки, чему способствует рациональная подготовка беременных к родам.
Тяжелые виды акушерского травматизма, такие как разрыв промежности III степени, центральный разрыв промежности в цивилизованной акушерской практике вообще не должны иметь место.
Для предупреждения повреждения мягких тканей родовых путей и обеспечения более бережного родоразрешения плода в родах производят рассечение промежности. Рассечение промежности по средней линии называют перинеотомией (срединная эпизиотомия), рассечение в сторону – эпизиотомией (боковая эпизиотомия). Различают срединно-латеральную и латеральную эпизиотомию. Более щадящей является срединно-латеральная эпизиотомия.
Способ рассечения промежности выбирают в зависимости от анатомотопографических особенностей промежности, состояния плода, акушерской ситуации и др.
Перинеотомию предпочтительно выполнять при угрожающем разрыве, высокой промежности, преждевременных родах. При перинеотомии разрез производят от задней спайки по средней линии длиной 2,5-3 см, не нарушая сухожильный центр промежности. При перинеотомии в разрез вовлекаются кожа, подкожная жировая клетчатка, стенка влагалища, мышцы наружного (луковично-пещеристая и поверхностная поперечная мышцы промежности) и среднего (глубокая поперечная мышца промежности) слоев тазового дна. Произведенный по средней линии разрез не нарушает кровоснабжение и иннервацию наружных половых органов. После его ушивания ткани легко восстанавливаются, а рана быстро заживает.
Срединно-латеральную эпизиотомию предпочтительно выполнять при низкой промежности, крупном плоде, анатомическом сужении таза, тазовом предлежании, наложении акушерских щипцов, вакуум-экстракции, извлечении плода за тазовый конец, рубцовых изменениях в области промежности. Разрез промежности длиной 3-4 см проходит от задней спайки по направлению к седалищному бугру и несколько ниже его, под углом 30-40°. При этом в разрез вовлекаются кожа, подкожная жировая клетчатка, стенка влагалища, мышцы тазового дна. Правильно произведенный разрез не нарушает целости периферических нервно-сосудистых образований. Разрез необходимо производить справа в связи с особенностями топографии кровеносных сосудов в этой области и расположением большой железы преддверия.
Латеральную эпизиотомию используют редко и производят только при наличии варикозно расширенных вен, опухоли и другой патологии наружных половых органов. Разрез длиной 2-3 см начинают на 1,5-2 см выше задней спайки и ведут по направлению к седалищному бугру. Латеральная эпизиотомия сопровождается пересечением сосудов и нервных волокон, травмированием мягких тканей, часто возникают гематомы, происходит повреждение большой железы преддверия и ее протоков.
Рассечение промежности следует производить при появлении первых признаков угрожающего разрыва (цианоз, бледность, блеск, отек) и врезывании или прорезывании предлежащей части плода в половую щель.
Восстановление целости промежности осуществляют под местным обезболиванием, внутривенным обезболиванием или эпидуральной анестезией, если таковая проводилась во время родов.
Анатомически правильное зашивание разрывов и разрезов промежности является профилактикой несостоятельности мышц тазового дна, опущения и выпадения стенок влагалища, нередко приводящих к инвалидизации женщин.
Разрывы матки
Разрывы матки – нарушение ее целости во время беременности или в родах. По данным различных авторов, число случаев разрывов матки составляет 0,1-0,005 % от общего числа родов. В настоящее время число разрывов матки в нашей стране исчисляется сотыми долями процента. Разрывы матки при беременности возникают значительно реже, чем во время родов, и составляют 9,1 % от всех разрывов. Особенно редко они встречаются в первой половине беременности.Материнская летальность и перинатальная смертность при этом осложнении беременности и родов чрезвычайно высоки и составляют соответственно 3-4 и 40 %.
Классификация. Существует множество классификаций разрывов матки, каждая из которых имеет достоинства и недостатки. В нашей стране получила широкое распространение классификация, предложенная Л.С.Персианиновым (1964), в которой разрывы матки подразделяются по ряду признаков.
По времени происхождения: 1. разрывы во время беременности; 2. разрывы во время родов.
По патогенетическому признаку: 1. Самопроизвольные разрывы матки (происходящие без каких-либо вме-шательств извне): • механические (при наличии механического препятствия для рождения плода); • гистопатические (при патологических изменениях маточной стенки); • механогистопатические (при сочетании механического пре-пятствия для родоразрешения и патологических изменений маточной стенки). 2. Насильственные разрывы матки: • травматические (от грубого вмешательства во время родов или во время беременности и родов от случайной травмы); • смешанные (от внешнего воздействия при наличии перерастяжения нижнего сегмента).
По клиническому течению: 1. угрожающий разрыв; 2. начавшийся разрыв; 3. совершившийся разрыв.
По характеру повреждения: 1. трещина (надрыв); 2. неполный разрыв (не проникающий в брюшную полость, захватывающий только слизистую оболочку и мышечный слой) происходит в тех местах матки, где брюшина рыхло соединена с мышечным слоем, обычно в боковых отделах нижнего сегмента матки, по ее ребру. Подобный разрыв сопровождается образованием гематомы в рыхлой клетчатке таза, чаще между листками широкой связки матки или под ее брюшинным покровом. Гематома может достигать печеночной области; 3. полный разрыв – проникающий в брюшную полость захватывает все мышечные слои. Полные разрывы встречаются в 9-10 раз' чаше, чем неполные.
По локализации: 1. разрыв в дне матки; 2. разрыв в теле матки; 3. разрыв в нижнем сегменте; 4. отрыв матки от сводов влагалища.
Наиболее часто встречаются разрывы матки в нижнем сегменте, по передней или боковой ее поверхности. Разрывы в теле и в дне матки, как правило, происходят в области старого рубца после ранее перенесенного оперативного вмешательства.
Этиология и патогенез.
Разрывы матки были известны еще в XVI в., но обстоятельно это осложнение беременности было описано в конце XIX в. В учениях о разрывах матки в родах отчетливо вырисовывались два главных направления. Представителем одного из них являлся Бандль [Bandi, 1875], создавший механическую теорию происхождения разрывов матки и описавший стадии их развития. Непременным условием разрыва матки, согласно его учению, является механическое препятствие рождению плода через естественные родовые пути на фоне бурной родовой деятельности. Описав классическую ("типичную") картину механического разрыва матки, Бандль в то же время обращал внимание на частые разрывы матки у повторнородящих. Он не мог точно объяснить причину и полагал, что возможно "микроскоп объяснит" это явление. Разрывы матки в отсутствие несоответствия размеров таза и головки считались бессимптомными.
Второе направление возникло в начале XX в., когда Н.З.Иванов (1901), а за ним Я.Ф.Вербов (1911) установили, что основными причинами разрывов матки в родах являются глубокие патологические процессы в мускулатуре последней – воспалительные, дегенеративные, возникающие до и во время беременности или даже во время текущих родов. Согласно созданной названными авторами функциональной теории самопроизвольного разрыва матки, последний возникает вследствие того, что хрупкая ткань органа не выдерживает повышения внутриматочного давления и разрывается. Однако Я.Ф.Вербов, в общем правильно разрешивший вопрос о патогенезе разрывов матки, впал в другую по сравнению с Бандлем крайность. Отрицание значения перерастяжения матки в этиологии ее разрыва привело Я.Ф.Вербова к ошибочному утверждению о невозможности распознать начинающийся разрыв матки при морфологических изменениях мышечной ткани. Скудные симптомы разрыва матки при этом обозначались как "атипичные".
В исследованиях отечественных ученых И.Ф.Жорданиа и особенно Л.С.Персианинова, проведенных в 50-е годы XX в., было установлено значение механического и гистопатического факторов как причины разрыва матки. Предполагаюсь, что при разрывах матки почти всегда имеются морфологические изменения ее мускулатуры и лишь в небольшом проценте случаев наблюдается только выраженное перерастяжение нижнего сегмента. Таким образом, многие исследователи рассматривали дегенеративные изменения мускулатуры матки как фактор, предрасполагающий к разрыву, пере-растяжение же матки – как непосредственно воздействующий. Отечественные ученые описали клиническую картину разрывов матки, связанных с гистопатическим фактором.
В настоящее время в связи с расширением показаний к абдоминальному родоразрешению, частыми ре конструктивно-пластическими операциями на матке соотношение удельного веса основных патогенетических факторов разрыва матки также изменилось- чаще наблюдаются разрывы матки по рубцу.
Современными акушерами признаются следующие этиопатогенетические факторы разрыва матки во время беременности и родов: механические препятствия рождению плода, гистопатические изменения миометрия, насильственный фактор при родоразрешающих операциях, сочетание перечисленных факторов.
Механическое препятствие рождению плода является важным фактором в патогенезе разрывов матки. В настоящее время оно встречается не более чем в 10 % (ранее 25-35 %) от общего числа разрывов. Механический фактор при разрывах матки наблюдается чаще всего в связи с клинической несоразмерностью между головкой плода и тазом матери: разгибательные предлежания, асинклитические вставления головки, гидроцефалия, крупный плод. Разрыв матки может произойти при неправильном положении плода, Рубцовых изменениях шейки матки и влагалища, наличии опухоли в малом тазе, препятствующих продвижению плода.
Разрывы матки при несоразмерности предлежащей части плода и таза происходят чаще всего при хорошей сократительной активности матки, полном открытии шейки матки и локализуются в нижнем ее сегменте. При наличии препятствия к изгнанию плода усиливающаяся работа матки обусловливает постепенное смещение основной массы мускулатуры кверху, к дну матки (ретракция). При этом масса мышечных волокон в стенках нижнего сегмента матки все более уменьшается и нижний сегмент все более истончается и перерастягивается (выраженная дистракция). Перерастяжение нижнего сегмента и разрыв матки особенно легко происходят в тех случаях, когда шейка матки (чаще передняя губа) не сместилась за головку плода и ущемилась между ней и стенками таза. Фиксация части шейки матки к стенкам таза приводит к еще большему пере растяжению нижнего сегмента за счет сокращающихся мышц тела матки. Наконец, степень растяжения и истончения нижнего сегмента матки, в который как бы рождается плод, изгоняемый телом матки, превышает максимально возможную для данной мышцы. Первоначально в области нижнего сегмента появляется трещина, при этом разрываются сосуды, и в стенке матки образуется гематома. Вслед за этим происходит непосредственно разрыв стенки. При полном разрыве матки и повреждении крупных сосудов начинается кровотечение в брюшную полость. При разрыве матки в передней части нижнего сегмента или отрыве ее от сводов влагалища в разрыв иногда вовлекается мочевой пузырь. При неполном разрыве матки образуется гематома в различных местах в зависимости от локализации повреждения: между листками широкой связки матки, под серозным покровом матки, в предпузырной клетчатке (серозный покров не поврежден).
Гистопатические изменения миометрия.
В настоящее время эти изменения являются ведущими в генезе разрыва матки. На их долю приходится более 90 % от всех разрывов. Они определяются Рубцовыми, атрофическими и дистрофическими изменениями миометрия после осложненных родов, большого числа родов (3 и более), абортов, после неоднократных выскабливаний матки по поводу нарушений менструального цикла, неразвивающихся беременностей, выкидышей, операций на матке (ушивание перфораций, миомэктомия). Наибольшее значение при таком механизме разрыва имеют неполноценные рубцы на матке после кесарева сечения, обусловленные неправильной техникой зашивания, наличием инфекции во время операции, заживлением операционной раны вторичным натяжением, гиалино зом рубца и его истончением. Расположение плаценты в области послеоперационного рубца нередко сопровождается глубокой инвазией элементов трофобласта в миометрий, что еще более усиливает угрозу разрыва матки при ее растяжении и сокращении. Инфицирование беременной матки или развитие беременности на фоне инфекции, приводящей к формированию деструктивного метроэндометрита с разрушением миометрия, увеличивает вероятность его несостоятельности в процессе осложненных родов и способствует в последующем разрывам матки. Пороки развития матки (дивертикул, рудиментарный рог матки) также могут быть причиной ее разрыва. В этих случаях разрыв происходит, как правило, в ранние сроки беременности и его клиническая картина совпадает с таковой при нарушенной эктопической беременности (см. "Внематочная беременность").
При выраженном рубцовом изменении миометрия (в первую очередь при наличии рубца на матке) во время беременности ткани не способны к растяжению под влиянием роста плода, а во время родов – перенести растяжения, имеющиеся даже при неосложненной родовой деятельности, тем более в случае применения утеротонических препаратов, что приводит к разрыву тканей.
В процессе родов при патологических изменениях маточной стенки даже незначительное несоответствие размеров таза матери и предлежащей части плода способствует разрыву матки.
Разрыв матки вследствие гистопатических ее изменений наступает незаметно: патологически измененная стенка матки не разрывается, а как бы расползается в месте наиболее глубоких очаговых ее изменений. В зависимости от локализации этих изменений местоположение разрыва может быть различным. У беременных, перенесших ранее кесарево сечение, разрыв локализуется обычно в месте бывшего рубца. У многорожавших женщин, у которых предшествовавшие роды заканчивались наложением щипцов и имелось септическое заболевание в послеродовом периоде, или у которых при предыдущих родах было (либо имеется при настоящих) предлежание плаценты, или которые страдали хроническим эндоцервицитом, наиболее патологически измененными и поэтому неустойчивыми оказываются ткани в нижнем сегменте матки и шейке, где и происходит разрыв. При этом разрыв шейки матки часто переходит на нижний сегмент или ребро матки.
Насильственный фактор при родоразрешающих операциях. В настоящее время этот фактор как основной встречается редко. К насильственным факторам относятся давление на дно матки (прием Кристеллера), применение акушерских родоразрешающих, в частности шгодоразрушающих, операций без учета имеющихся условий, с нарушением техники их выполнения; использование длительной стимуляции окситоцином – более 5 ч с превышением разовой(10 ЕД), а иногда и суточной (20 ЕД) дозы, особенно У рожениц старше 35 лет, многорожавших, при многоплодной беременности и крупном плоде. К факторам насильственного разрыва следует отнести попытку поворота плода при запущенном поперечном положении, форсированное извлечение плода за тазовый конец с освобождением запрокинутых ручек, с разогнутой головкой, родоразрешение при неполном открытии маточного зева.
 Рис. 23.6. Угрожающий разрыв матки. Перерастяжение нижнего сегмента. Высокое расположение контракционного кольца.
Рис. 23.6. Угрожающий разрыв матки. Перерастяжение нижнего сегмента. Высокое расположение контракционного кольца.
У беременных, подвергшихся механическому воздействию извне (удар в живот, дорожные катастрофы), также может наблюдаться разрыв матки.
Сочетание механических и гистопатических причин. В настоящее время разрыв матки нередко происходит при сочетании структурных ее изменений и механического препятствия рождению плода. Гистопатические изменения миометрия при этом являются фоном, на котором малейшие погрешности в ведении родов могут привести к разрыву матки.
Клиническая картина и диагностика.
Клиническая картина разрыва матки весьма разнообразна. Различают несколько вариантов. 1. "Типичный" классический разрыв матки. Происходит при несоразмерности между плодом и тазом матери. В своем клиническом развитии разрыв матки обычно проходит три стадии: угрожающего, начавшегося и совершившегося. Клинические признаки угрожающего разрыва матки обусловлены перерастяжением нижнего сегмента. Для этой стадии разрыва характерна интенсивная усиливающаяся родовая деятельность; • со временем схватки приобретают судорожный характер, паузы между ними укорачиваются. Поведение роженицы беспокойное, она кричит, держится руками за живот. Лицо испуганно, с расширенными глазами. Губы и язык пересыхают, пульс учащается, температура тела нередко повышается. В связи со сдавлением мочевого пузыря и уретры мочеиспускание затрудняется. При осмотре и объективном исследовании обнаруживаются резко болезненная в нижней части матка, напряженные, болезненные, иногда асимметрично расположенные круглые связки матки, отек наружных половых органов и влагалища. Ниже и на уровне пупка или несколько выше определяется глубокая и ясно видимая косо идущая поперек матки борозда – контракционное кольцо, представляющее собой четко выраженную границу между сокращенным телом матки и перерастянутым нижним сегментом (рис. 23.6). Матка при этом как бы разделена на две различные по консистенции и форме части – верхнюю и нижнюю и приобретает при этом форму песочных часов. Из-за напряжения живота и частых схваток сердцебиение плода нередко выслушивается с трудом; развивается острая гипоксия плода может наступить его гибель, так как сильные и длительные сокращения матки обусловливают нарушения плацентарного кровообращения. Переполняется мочевой пузырь, появляется отек наружных половых органов. При влагалищном исследовании нередко обнаруживают либо полное открытие шейки матки и родовую опухоль головки плода, либо отечную шейку матки, ущемленную между плотно прилегающей головкой плода и костями таза. В последней ситуации может создаваться ложное впечатление об отсутствии полного открытия шейки матки. В таких условиях влагалищное исследование необходимо проводить чрезвычайно осторожно, без малейшего насилия и грубых движений исследующих пальцев; не нужно пытаться оттолкнуть головку для выяснения степени ее подвижности, а также для опорожнения мочевого пузыря. Малейшее насилие, грубый прием могут привести к разрыву матки. Клиническая картина начавшегося разрыва матки определяется нарушением целости тканей нижнего сегмента, разрывом сосудов и появлением гематомы в стенке матки. На фоне симптомов перерастяжения нижнего сегмента матки появляются симптомы эректильной стадии шока: общее возбужденное состояние роженицы, громкий крик, испытываемое ею чувство сильного страха, сопровождающееся расширением зрачков. Схватки принимают судорожный характер, матка между схватками не расслабляется. Появляются болезненные потуги в отсутствие продвижения плода, высоко стоящей головке и полном открытии шейки матки. Из половых путей могут появляться сукровичные или кровяные выделения, а в моче – примесь крови. Кровяных выделений при начавшемся разрыве может и не быть, но если они появляются на фоне угрозы разрыва, то всегда служат признаком начала разрыва. Плод обычно погибает внутриутробно от гипоксии. Клиника совершившегося разрыва сопровождается рядом характерных признаков: резкой болью в животе на высоте одной из схваток, внезапным прекращением родовой деятельности (внезапное "затишье" после "бури"), симптомами торпидной стадии шока и внутреннего кровотечения. Кожные покровы роженицы бледнеют, зрачки расширяются, глаза западают, пульс учащается и слабеет, дыхание становится поверхностным, появляются тошнота, рвота, головокружение до потери сознания. При полном разрыве (рис. 23.7) плод, а нередко и послед могут перемещаться в брюшную полость. Сердцебиение плода прекращается, если он не погибает еще раньше. Предлежащая часть плода, которая до этого была плотно прижата ко входу в таз, обнаруживается теперь высоко над входом или сбоку от него; все части плода ясно определяются, а при тонкой передней брюшной стенке становятся видимыми, как будто они лежат под самой кожей. Рядом с плодом пальпируется отклонившаяся в сторону маленькая, хорошо сократившаяся матка. Наблюдается умеренное кровотечение из влагалища. В связи с проникновением в брюшную полость крови появляется болезненность при пальпации живота, развиваются явления раздражения брюшины – симптом Щеткина-Блюмберга. 2. Разрыв матки при гистопатических изменениях миометрия. Разрывы матки при гистопатических изменениях миометрия протекают без выраженной клинической картины, однако, несмотря на стертый и невыраженный характер симптомов, необходимо уметь их выявлять.
 Рис. 23.7. Полный разрыв нижнего сегмента матки.
Рис. 23.7. Полный разрыв нижнего сегмента матки.
Во время беременности разрывы матки гистопатического генеза обычно происходят при наличии рубцовой ткани в матке, которая не выдерживает перерастяжения за счет увеличивающейся массы плода.
Симптомы угрожающего разрыва матки обусловлены перерастяжением рубцовой ткани и покрывающей ее брюшины. При этом рефлекторно возникают тошнота, рвота, боли в эпигастральной области, которые затем локализуются внизу живота, иногда больше справа. При пальпации матки обращают на себя внимание болезненность в области рубца, иногда локальная, а также косвенные признаки его несостоятельности: углубления, неровности.
Клиника начавшегося разрыва матки по рубцу во время беременности определяется наличием гематомы в области рубцовой ткани и характеризуется следующими симптомами: тошнотой, рвотой, головокружением, болями в области рубца, гипертонусом матки, признаками острой гипоксии плода. Могут появиться кровяные выделения из половых путей.
Во время родов при угрожающем гистопатическом разрыве к симптомам, наблюдающимся во время беременности, при угрозе разрыва матки, присо-единяются различные варианты нарушения сократительной деятельности матки: дискоординация или слабость родовой деятельности, особенно после излития околоплодных вод, сочетание беспокойного поведения роженицы с болезненными, но слабыми и объективно непродуктивными схватками.
При начавшемся разрыве матки гистопатического генеза в первом периоде родов в связи с наличием гематомы в стенке матка между схватками не расслабляется; наблюдается постоянное ее напряжение, и она становится болезненной при пальпации. В связи с гипертонусом матки выявляются симптомы гипоксии плода. Могут быть кровяные выделения из половых путей, особенно на фоне ослабления или прекращения схваток.
Во втором периоде родов характерными симптомами разрыва матки гистопатического генеза являются беспокойство роженицы; боли внизу живота, крестце; слабые, но болезненные потуги, постепенно ослабевающие вплоть до полного прекращения; кровяные выделения из влагалища; острая гипоксия плода.
Симптомы совершившегося разрыва матки гистопатического генеза вполне сходны с наблюдающимися при механическом разрыве, с той лишь разницей, что при морфологически измененной матке они развиваются более постепенно, не так ярко выражены и не все обязательно бывают в наличии. В основном это симптомы геморрагического шока. При разрыве гистопатического типа ввиду постепенно развивающегося дефекта тканей плод может родиться живым самопроизвольно через естественные родовые пути. Предположить наличие разрыва матки в послеродовом периоде чаще всего позволяют нарастающие симптомы геморрагического шока.
Вне зависимости от этиологии разрыва матки (механической или гистопатической) в любом периоде родов может произойти неполный разрыв матки (рис. 23.8). Он чаще локализуется в нижнем сегменте матки, по ребру и обычно сопровождается образованием гематомы в рыхлой клетчатке таза, между листками широкой связки матки или под ее брюшинным покровом. Образование гематомы сопровождается болями внизу живота вплоть до резких, иногда с иррадиацией в крестцовую область и в ногу. В процессе родов при указанном виде разрыва наружное кровотечение может отсутствовать. В случае большой кровопотери возникают симптомы внутреннего кровотечения. Состояние женщины ухудшается, отмечаются бледность кожных покровов, частый пульс, снижение артериального давления. Если при неполном разрыве матки плод родится самопроизвольно через естественные родовые пути, то дефект стенки матки можно выявить при ручном ее обследовании. Однако иногда при сокращении стенок матки определить его трудно. Уточнить диагноз возможно при УЗИ.
При образовании гематомы в параметрии во время влагалищно-абдоминального исследования матка отклоняется в сторону, противоположную разрыву, а сбоку от нее пальпируется образование без четких границ и контуров, которое иногда доходит до стенок таза. В некоторых случаях неполный разрыв матки проявляется через несколько дней после родов следующими симптомами: снижением артериального давления; болями внизу живота, иррадиирующими в ногу; метеоризмом, повышением температуры тела.
Диагноз разрыва матки ставится на основании совокупности перечисленных выше клинических признаков.
Диагностические трудности возникают при разрывах матки по рубцу, а также при неполных разрывах матки, особенно в нижнем ее сегменте. Такие "атипичные" разрывы могут не сопровождаться выраженными симптомами и иногда остаются недиагностированными в течение некоторого времени после родов. В этих случаях, помимо симптомов раздражения брюшины, часто слабо выраженных, внимание врача должны привлечь нарастание метеоризма и разлитая болезненность всей области живота. Ведущими в диагностике являются признаки внутреннего кровотечения и геморрагического шока, выраженность которых определяется величиной кровопотери.
 Рис. 23.8. Неполный разрыв матки с образованием гематомы.
Рис. 23.8. Неполный разрыв матки с образованием гематомы.
Дифференциальная диагностика. Симптомы угрожающего разрыва матки по рубцу во время беременности нередко имитируют картину острого аппендицита (тошнота, рвота, боли внизу живота). Для уточнения диагноза необходимо выявить из анамнеза возможность рубцовых изменений в матке и выполнить УЗИ с тщательным изучением стенок матки, измерением толщины и оценкой структуры области предполагаемого рубца. В отличие от угрожающего разрыва матки при аппендиците язык обложен белым налетом, выявляется выраженный лейкоцитоз.
Начавшийся разрыв матки по гистопатическому типу во время беременности и родов следует также дифференцировать от преждевременной отслойки нормально расположенной плаценты, что нередко бывает затруднительным, так как имеют место схожие симптомы: боли в животе, постоянно нарастающее напряжение матки, гипоксия плода. Уточнение диагноза преждевременной отслойки нормально расположенной плаценты возможно с помощью УЗИ (см. Кровотечение при поздних сроках беременности). При невозможности отдифференцировать начавшийся разрыв матки от преждевременной отслойки плаценты следует помнить, что оба осложнения являются показаниями к чревосечению.
Лечение. Во время беременности угрожающий разрыв матки является показанием к экстренному чревосечению и кесареву сечению. В родах при угрожающем разрыве матки необходимо срочно снять родовую деятельность и закончить роды оперативным путем. Для быстрого прекращения родовой деятельности дают глубокий наркоз. При живом плоде делают операцию кесарева сечения. При мертвом плоде производят краниотомию. Однако если врач не владеет методикой плодоразрушающих операций, лучше прибегнуть к кесареву сечению, поскольку при неумелом исполнении плодоразрушающей операции в случае перерастянутого нижнего сегмента возможен насильственный разрыв матки. При поперечном положении плода вне зависимости от его состояния (живой или погибший) предпочтительнее прибегнуть к операции кесарева сечения. Категорически противопоказаны такие операции, как поворот плода на ножку с последующим его извлечением или наложение акушерских щипцов, так как при угрожающем разрыве матки указанные операции, как правило, приводят к ее разрыву. Начавшийся и совершившийся разрыв матки требует чревосечения незави-симо от состояния плода. Одновременно с операцией необходимо провести комплекс противошоковых и противоанемических мероприятий, которые продолжают и после операции. После вскрытия брюшной полости и матки удаляют плод и послед. Если разрыв матки небольшой, линейный или рваные края его могут быть легко иссечены, а также если разрыв произошел недавно и опасность инфицирования невелика, то допустимо ушивание разрыва. При обширных разрывах, особенно с размозжением тканей и наличием инфекции, как правило, производится экстирпация матки.
При неполном разрыве матки, если имеется обширная подбрюшинная гематома, необходимо сначала рассечь брюшину, удалить жидкую кровь и сгустки, наложить лигатуры на поврежденные сосуды. Швы на рану можно накладывать только после надежного гемостаза, осуществить который бывает чрезвычайно трудно, особенно если разрыв расположен по ребру матки и имеется гематома в параметрии.
В случае затруднения при остановке кровотечения во время операции рекомендуется произвести перевязку внутренней подвздошной артерии (маточную артерию найти трудно при наличии гематомы в параметрии). Отыскивают вначале общую подвздошную артерию, а затем – внутреннюю, которую перевязывают шелковой лигатурой, подведенной под сосуд.
Следует подчеркнуть, что хирургическое вмешательство по поводу разрыва матки должен осуществлять опытный хирург, так как операция может оказаться технически трудновыполнимой в связи с возможным повреждением мочевого пузыря, кишечника, обширными гематомами, иногда доходящими до паранефральной клетчатки. Анестезиологическое пособие при разрыве матки является одним из основных элементов экстренной помощи, поскольку защищает организм женшины от болевого фактора, дополнительной травмы в виде хирургического вмешательства, способствует выведению ее из тяжелого шока. В развитии геморрагического шока у рожениц и родильниц вообще, а при разрыве матки особенно, наряду с кровопотерей большая роль принадлежит болевому и травматическому компонентам.
Прогноз даже при современном состоянии родовспоможения в случае полного разрыва матки остается неблагоприятным для плода, так как связан с отслойкой плаценты. Исход для матери определяется объемом кровопотери и тяжестью шокового состояния.
Профилактика разрыва матки в основном связана с организационными мероприятиями, начинать которые необходимо еще в женской консультации. Угрожаемых в отношении разрыва матки беременных выделяют на основании тщательно собранного анамнеза и объективного обследования в особую группу повышенного риска. К ней относят беременных с узким тазом, крупным плодом, неправильным положением плода, многорожавших с пониженным тонусом брюшной стенки и матки, беременных с отягощенным акушерским анамнезом (послеабортные и послеродовые воспалительные заболевания, длительные роды, слабость родовой деятельности и другие виды патологии в родах).
В связи со значительным увеличением числа беременных, имеющих рубец на матке после кесарева сечения, ведение беременности и родов у них имеет особую специфику.
Ведение беременности и родов при наличии рубца на матке после ранее перенесенного кесарева сечения и других операций на матке
Беременные с наличием рубца на матке, в первую очередь после кесарева сечения, составляют особую группу риска в отношении разрыва матки.Заживление стенки матки после операции на ней может происходить с полным или почти полным восстановлением мышечных элементов. Обычно в таких случаях говорят о полноценном рубце. Но нередко заживление происходит с образованием на месте разреза соединительной ткани, иногда неодинаковой толщины. Такой рубец принято считать неполноценным.
Чаще неполноценный рубец формируется после корпорального кесарева сечения и вылущивания миоматозных узлов со вскрытием полости матки. Реже неполноценный рубец наблюдается после кесарева сечения в нижнем маточном сегменте или удаления поверхностно расположенных субсерозных узлов миомы.
Целесообразно выявлять неполноценный рубец вне беременности. Для характеристики маточного рубца применяют УЗИ, гистероскопию и гистерографию. Во время гистерографии при неполноценности рубца на снимках определяются ниши, изменение контуров матки, спайки и т.д.
При наступившей беременности для оценки состояния рубца на матке и выбора метода ведения родов необходимо выявить следующие анамнестические данные: 1. течение послеоперационного периода: при указаниях на длительную лихорадку и нагноение кожной раны следует предположить возможную неполноценность рубца на матке; 2. показания к предшествующему кесареву сечению; если выясняется, что показаниями к операции был узкий таз или затянувшиеся роды, то в этом случае также можно думать о несостоятельности рубца; 3. болевые ощущения в области послеоперационного рубца, которые могут свидетельствовать о неполноценном рубце.
Помимо анамнестических сведений, для определения полноценности мускулатуры матки в области бывшего разреза следует учесть объективные данные, полученные при пальпации. Для этого, сдвинув в сторону кожный рубец, пальпируют место разреза матки при предыдущей операции. В ответ на пальпацию матка обычно сокращается. Если рубец полноценный, то он не определяется и матка равномерно сокращается. При неполноценном рубце соединительная ткань не сокращается и пальпирующие пальцы ощущают углубление (выемку) в матке. Клиническими симптомами несостоятельности рубца на матке являются также локальная болезненность в области нижнего сегмента матки в процессе гестации и угроза прерывания беременности в поздние сроки.
Более объективно о состоянии рубца после кесарева сечения можно судить при УЗИ. К эхографическим признакам несостоятельности рубца на матке при беременности относятся истончение нижнего сегмента в области рубца (менее 0,3 см), значительное количество акустически плотных включений, косвенно указывающих на наличие рубцовой ткани, изменение контуров нижнего сегмента в виде ниш.
Беременные с признаками неполноценности рубца должны госпитализироваться за 4-5 нед до родов. Но и при полноценном рубце все беременные, перенесшие ранее кесарево сечение, должны быть направлены в родовспомогательные учреждения за 2-3 нед до родов. Необходимость заблаговременной госпитализации диктуется тем, что разрыв ("расползание") старого рубца может произойти еще до родов. Для предупреждения разрыва требуется особенно внимательное наблюдение, что возможно только в стационаре.
При наличии полноценного рубца допустимы самопроизвольные роды. Критериями отбора беременных с рубцом на матке после кесарева сечения для самопроизвольных родов являются удовлетворительное состояние матери и плода; отсутствие клинических и эхографических признаков несостоятельности рубца на матке; готовность организма беременной к родам ("зрелая" шейка матки); согласие беременной на самопроизвольные роды. Такие беременные внимательно наблюдаются в последние дни беременности и особенно во время родов. Роды проводят в таком акушерском стационаре, где может быть оказана экстренная квалифицированная хирургическая помощь, имеются анестезиологическая и неонатологическая службы, а операционная может быть развернута в течение 10-15 мин.
Показания к кесареву сечению при наличии рубца на матке можно разделить на три группы. Первую составляют так называемые стабильные показания, которые явились основанием для производства первого кесарева сечения (например, анатомически узкий таз, рубцовые деформации влагалища и шейки, изменения глазного дна и др.). Ко второй группе относятся показания, которые возникли при данной беременности и в родах независимо от перенесенного ранее кесарева сечения (например, предлежание плаценты, выпадение петель пуповины, тазовое предлежание, клинически узкий таз и др.). В третью группу входят показания, связанные с наличием рубца на матке. Абсолютным показанием к повторному кесареву сечению являются рубец на матке после корпорального кесарева сечения, рубцы после 2 и более операций, несостоятельный рубец по клиническим и эхографическим признакам, плацентация в области рубца на матке.
Во время повторного кесарева сечения нередко встает вопрос о стерилизации, так как опасность разрыва матки по рубцу при следующей беременности и родах возрастает. Стерилизация проводится только с согласия женщины.
Выворот матки
Выворот матки – тяжелая патология, которая встречается крайне редко.Выворот матки заключается в том, что дно матки начинает образовывать воронку, выпуклая кривизна которой обращена в полость матки, а вогнутая – в брюшную полость. Воронка постепенно углубляется, и вывороченная как бы наизнанку матка выпадает наружу' (внутренняя поверхность матки обращена наружу). Если выворот произошел в последовом периоде, то вместе с маткой выпадает прикрепленный к ней неотделившийся послед (рис. 23.9).
Этиология и патогенез.
Выворот матки, как правило, происходит при ее гипотонии. Самопроизвольные вывороты бывают редко. В основном вывороту способствует сочетание расслабленной матки и чрезмерного давления на нее сверху при попытке выжать послед по Креде без предварительного массажа, а также недозволенно резкого потягивания за пуповину при неотделившемся последе.
Клиническая картина этого грозного осложнения весьма характерна: в последовом или раннем послеродовом периоде появляются резкие сильные боли в животе, вслед за этим наступает шок (частый пульс, бледность кожных покровов, снижение АД). Причинами болей являются раздражение брюшины и натяжение связок вследствие изменения топографии органа.
Выворот может быть частичным, если вывернуто только тело или только верх-няя ее часть, и полным, когда матка целиком вывернута наружу.
Если матку не вправить, то наступает ее некроз. Распознавание является несложным благодаря характерному анамнезу и типичной клинической картине: из половой щели выдается наружу мягкая округлой формы опухоль ярко-красного цвета, через переднюю брюшную стенку вместо матки пальпируется воронкообразное углубление. Диагностика облегчается, когда с дном матки визуализируется прикрепленный послед
 Рис.23.9. Острый выворот матки с неотделившейся плацентой.
Рис.23.9. Острый выворот матки с неотделившейся плацентой.
Лечение.
Заключается в немедленном проведении противошоковых мероприятий и вправлении под глубоким наркозом вывернутой матки. Предварительно вводят спазмолитические препараты. После удавшегося вправления влагалище тампонируют стерильным бинтом, капельно вводят сокращающие матку средства.
При неудавшихся попытках вправления может встать вопрос об удалении матки предпочтительно влагалищным путем.
Послеродовые свищи
К тяжелейшим родовым травмам относятся мочеполовые и кишечно-влагалищные свищи. Наличие их ведет к утрате трудоспособности, нарушению половой, менструальной (аменорея, олигоопсоменорея и др.), генеративной и других функций; обычно возникают эмоциональные расстройства.Свищи нередко служат причиной восходящих воспалительных заболеваний половых органов и мочевыделительной системы. Частота возникновения послеродовых свищей полностью зависит от организации родовспоможения. В нашей стране этот вид родовой травмы встречается редко. Сообщения между половой и мочевой системами (и кишечником) имеет различную локализацию. Наблюдаются пузырно-влагалищные (между мочевым пузырем и каналом шейки матки), уретровагинальные, мочеточникововлагалищные, кишечно-влагалищные свищи. Наиболее часто встречаются пузырно-влагалищные свищи.
Послеродовые свищи возникают при патологических родах и бывают самопроизвольными и насильственными.
Самопроизвольные свищи образуются вследствие сдавления, некроза и последующего отторжения участков тканей мочевых путей и влагалища (или прямой кишки и влагалища). Длительное сдавление тканей происходит при продолжительном стоянии головки плода в одной плоскости малого таза. Это наблюдается в случае узкого таза (решающее значение имеет клинически узкий таз), аномалий вставления и предлежания, крупного (гигантского) плода; особое значение имеют затяжные роды при давно излившихся водах и головке плода, длительно стоящей во входе или в полости малого таза. Некротические участки тканей отторгаются на 5-7-й день после родов, и с этого времени отмечается отхождение мочи (или кала) через влагалище.
Насильственные свищи возникают вследствие повреждения влагалища, мочевых путей или прямой кишки при родоразрешающих операциях. Повреждение обычно наносится инструментами (акушерские Щипцы, перфоратор и др.) при их соскальзывании с предлежащей части плода. Насильственные свищи наблюдаются редко. Свищи, появившиеся после акушерских операций, чаще связаны с предшествующим некрозом тканей и с запоздалым оперативным вмешательством.
Диагностика свищей обычно не представляет затруднений. Характерными признаками этих травм являются недержание и отхождение мочи через влагалище при мочеполовых свищах, выхождение через влагалище газов и кала при кишечно-влагалищных свищах. При" исследовании с помощью зеркал свищи обнаруживаются довольно легко. В случае необходимости применяют цистоскопию и другие специальные методы исследования.
Профилактика свищей сводится к правильному ведению родов. Нельзя допускать длительного стояния головки плода в одной и той же плоскости малого таза после излития околоплодных вод. Если головка плода стоит в любой плоскости малого таза больше 2-3 ч, необходимо произвести влагалищное исследование, уточнить диагноз и решить вопрос о родоразрешении. Необходимо систематически следить за состоянием мочевого пузыря беременной. В случае задержки мочи надо осторожно произвести катетеризацию мочевого пузыря. Примесь крови в моче указывает на угрозу возникно-вения свища и служит показанием к родоразрешению хирургическим путем. При опасности возникновения мочеполового свища в послеродовом периоде целесообразно введение постоянного катетера, через который систематически производят промывание мочевого пузыря дезинфицирующим раствором.
Лечение свищей оперативное. Только небольшие свищи при правильном уходе иногда закрываются самопроизвольно. Уход сводится к содержанию половых органов в чистоте, смазыванию кожи наружных половых органов и слизистой оболочки влагалища вазелиновым и другим маслом, эмульсией, содержащей антибактериальные средства. Если свищ самопроизвольно не закрывается, го через 3-4 мес после родов производят операцию.
Расхождение и разрыв лонного сочленения
Во время беременности происходит умеренное размягчение сочленений таза вследствие усиленного кровенаполнения и серозного пропитывания хрящей и связок. Иногда наблюдается чрезмерное размягчение сочленений таза, особенно лонного сочленения. В таких случаях сильное давление головки плода на костное кольцо таза может привести к расхождению лонных костей (более чем на 0,5 см). Это иногда наблюдается у женщин с узким тазом или при самопроизвольных родах крупным плодом. При патологических родах и оперативных вмешательствах (наложение акушерских щипцов, извлечение плода за тазовый конец, плодоразрушающие операции), особенно у женщин с узким тазом, могут произойти значительное расхождение и разрыв лонного сочленения. Иногда при разрыве лонного сочленения одновременно повреждаются мочевой пузырь и уретра.Клиническая картина.
Родильница жалуется на боль в области лона, которая усиливается при движении ногами, особенно при разведении ног, согнутых в коленных и тазобедренных суставах. При пальпации в области лона определяются отечность, болезненность и углубление между разошедшимися концами. Для уточнения диагноза проводят рентгенографию костей таза; с этой целью возможно также использование эхографии.
Лечение.
Постельный режим в течение 3-5 нед в положении на спине, перекрестное бинтование в области таза, назначение препаратов кальция, витаминов. При наличии признаков инфекции – антибиотики. После лечения родильницы нуждаются в проведении реабилитационных мероприятий.
При расхождении или разрыве соединений таза после окончания лечения у женщины могут наблюдаться нарушения походки ("утиная походка") и болевые ощущения в области лонного сочленения.
Наличие указанной патологии является показанием к оперативному родоразрешению при последующих беременностях.
Глава 24. Нарушения системы гемостаза у беременных
Все нарушения гемостаза во время беременности можно разделить на 2 формы: первичные и вторичные.Первичные формы характеризуются преимущественно наследственным изолированным дефектом одного из гемостатических факторов. В акушерстве чаще приходится иметь дело с вторичными приобретенными дефектами коагуляции (см. ДВС-синдром).
Наследственные дефекты системы гемостаза
Наследственные дефекты системы гемостаза, связанные с повышенной кровоточиностыо, по обобщенным данным мировой литературы, встречаются редко – в 0,001 – 0,005 % случаев.Несмотря на это, они занимают значительное место в структуре причин массивных акушерских кровотечений. Возможно, что большой процент массивных акушерских кровотечений, которые проходят под маской гипотонических или атонических, связаны с дефектами гемостаза, диагностика которых до настоящего времени затруднена.
Наиболее часто встречающимися в акушерской практике наследственными коагулопатиями, обусловленными дефектами плазменных факторов гемостаза, являются болезнь Ниллебравда (дефект фактора Виллебранда), гемофилия А (дефект VJH фактора), гемофилия В (дефект IX фактора); обусловленными дефектами клеточного звена – тромбоцитолатии, характеризующиеся качественной .неполноценностью и дисфункцией кровяных пластинок. Частота их, по данным разных исследователей, колеблется в пределах 1-2 на 1000 родов.
Наследственные дефекты плазменных факторов гемостаза
Болезнь Виллебранда имеет несколько клинических и генетических вариантов. Общее для них – изменение в структуре фактора Виллебранда.
Фактор Виллебранда (ФВ) – одна из субъединиц молекулы фактора VIII, участвует в первичном гемостазе – процессе адгезии и агрегации тромбоцитов.
Выраженность геморрагического синдрома а наибольшей степени коррелирует со степенью дефицита у больных коагулянтной части фактора VIII (ФVIII:К). С прогрессированием беременности у женщин с болезнью Виллебранда нарастает уровень ФН и ФУ1Н:К, содержание которых достигает максимума перед родами. По мере увеличения этих факторов уменьшается время кровотечения, в этой ситуации роды могут протекать без осложнений. Но такой сдвиг наблюдается не у всех женщин Даже если он присутствует, то может наступить быстрое ухудшение гемостаза в ролах. Поэтому предродовая "нормализация" гемостаза при болезни Виллебранда не дает оснований для благодушия и бездеятельности в родах и в послеродовом периоде.
Несмотря на то что часто встречающиеся формы наследственных нарушений гемостаза гемофилия А и В являются прерогативой лиц мужского пола, у женщин – носительниц гена гемофилии активность факторов VIII и XI часто бывает сниженной. Но в обычных условиях такие женщины не страдают кровоточивостью. В экстремальных ситуациях во время родов возможно кровотечение, несмотря на то что во время беременности прогрессивно растет содержание фактора VIII, достигая максимума перед родами.
Клинические проявления наследственных дефектов гемостаза разнообразны. В акушерстве общим для них является кровотечение во время родов. У ряда беременных (у 91 % с болезнью Виллебранда и у 62 % с другими дефектами наследственных факторов свертывания крови) за счет компенсаторной гиперкоагуляции, свойственной гестации, происходит адаптация системы свертывания крови в преддверии родов, что снижает риск кровотечения.
В послеродовом периоде при снижении компенсаторных возможностей системы гемостаза в родах могут появиться тяжелые кровотечения из матки. Наиболее опасными в плане развития кровотечения как во время родов, так и в послеродовом периоде являются преждевременные роды, а также сочетание наследственного дефекта гемостаза с осложнениями беременности, протекающими с синдромом диссеминированного внутрисосудистого свертывания (гестоз, преждевременная отслойка нормально расположенной плаценты, гнойно-септические осложнения).
Диагностика наследственных дефектов гемостаза.
При осмотре больных с наследственными дефектами плазменных факторов гемостаза обращают на себя внимание повышенная эластичность кожи, наличие на ней петехий, экхимозов, телеангиэктазий, пурпуры. Грубые рубцы после ранее перенесенных операций свидетельствуют о плохом заживлении ран. Для предотвращения летальных кровотечений в родах у беременных с дефектом про коагулянте в важное значение имеет правильная диагностика геморрагического диатеза, которая заключается в анализе возможных клинических проявлений геморрагического синдрома вне беременности, в этапности проведения гемостазиологических исследований во время беременности.
При сборе анамнеза следует исходить из того, что больная может не знать об имеющемся у нее нарушении свертывания крови. Поэтому обращают внимание на специальные вопросы, указывающие на основные симптомы, встречающиеся при расстройствах гемостаза: различные проявления кровоточивости, характер которых может подсказать вид нарушения. Для тромбоците пат и и более характерны кровотечения из носа и десен, плохое заживление ран, быстрое появление синяков при незначительном ушибе. При болезни Виллебранда, кроме этих симптомов геморрагического диатеза, высок процент меноррагий и кровотечений при малых операциях, после абортов. Надо особо отметить, что у женщин с наследственными дефектами системы гемостаза ювенильное маточное кровотечение может быть первым проявлением заболевания.
Лабораторное исследование системы гемостаза проводится в определенной пос-ледовательности. Сначала ставят общие диагностические тесты для исключения грубых дефектов системы гемостаза. Гем оста зиологи чес кое исследование включает подсчет количества тромбоцитов, протромбинового индекса (ПИ), определение активированного частичного тромбопластинового времени (АЧТВ), активированного времени рекальцификации (АВР) – параметров, характеризующих суммарную активность плазменных факторов свертывания крови.
ПИ отражает внешний и общий пути свертывания крови. Низкий ПИ может свидетельствовать о возможном дефиците одного из факторов протромбинового комплекса (X, Vll, V, II) или фибриногена. Измерение АЧТВ помогает выявить нарушения во внутреннем и общем путях свертывания крови. Увеличение этого показателя служит сигналом к поиску дефицита одного из факторов (XII, XI, X, IX, VIM, II) или фибриногена.
Необходимо помнить, что показатели ПИ и АЧТВ остаются нормальными, если уровень одного из факторов свертывания крови находится в пределах 20 % от нормы, а содержание остальных не изменено.
Определение концентрации фибриногена проводится с целью исключения гипофибриногенемии, которая может быть связана как с нарушением синтеза фибриногена, так и с его потреблением в результате развившегося ДВС-синдрома. При оценке тромбоцитарного знена гемостаза необходимо измерять время кровотечения по Айви, особенно у беременных с болезнью Виллебранда. Измерение времени Кровотечения является лучшим тестом для определения функциональных свойств тромбоцитов.
Для экс пресс-диагностики болезни Виллебранда у постели больного можно воспроизвести качественный тест с применением высоких концентраций стимуля-торов – АДФ, адреналина и ристомицина.
В последнее время появились возможности пренатальной диагностики наслед-ственных дефектов гемостаза методом обнаружения поврежденного гена в ДНК у матери и плода. С помощью анализа ДНК плода либо по биоптату хориона, либо по амниоцитам в зависимости от срока беременности делается заключение о насле-довании мутантного гена или его отсутствии.
Лечение.
При выявлении наследственных дефектов гемостаза необходимы своевременная дородовая госпитализация и проведение заместительной терапии в родах и послеродовом периоде.
Заместительная терапия в настоящее время осуществляется переливанием свежезамороженной плазмы или крио преципитата под контролем гемостазиологических параметров. Чаще на практике количество доз гемопрепаратоэ в родах под-бирается эмпирически. При дефиците VIII фактора предпочтительнее переливание криопреципитата, так как он содержит все формы макромолекулярного комплекса фактора VIII. При дефиците фактора II (гипопротромбинемия) одновременно со свежезамороженной плазмой применяют концентрат протромбинового комплекса. При своевременном выявлении дефектов гемостаза с целью профилактики кровоте-чения во время родов или кесарева сечения заместительную терапию начинают во время беременности.
Заместительную терапию препаратами плазмы при болезни Виллебранда необ-ходимо начинать в первом периоде родов не позднее открытия маточного зева до 6-7 см. Начальная доза должна быть не менее 300 мл свежезамороженной плазмы или 3-6 доз криопреципитата.
В послеродовом периоде заместительную терапию гемоп реп арата ми проводят каждые 2 дня в течение 5 – 10 дней в объеме не менее 200 мл свежезамороженной плазмы или 2-3 доз криопреципитата.
Тромбоцитопатии
Идиопатическая тромбоцитопеничеасая пурпура (ИТП) – заболевание неизвестной этиологии, при котором имеет место аутоиммунная тромбоцитопения. Клинически болезнь характеризуется легко возникающими кровоподтеками и множественными мелкими кровоизлияниями в коже и слизистых оболочках. Верификация диагноза основана на отсутствии признаков болезни в раннем детстве; отсутствии лабораторных и морфологических признаков наследственных и врожденных форм тромбоцитопении; отсутствии признаков болезни у кровных род-ственников; положительном эффекте от применения кортикоидов; обнаружении антитромбоцитарных антител; исключении таких причин тромбоцитопенической пурпуры, как острый лейкоз, аплазия костного мозга, дефицит витамина В и фолиевой кислоты, болезни Маркьяфавы – Микели.
При частых обострениях ИТП беременность представляет опасность как для матери, так и для плода. При наступившей беременности и обострении ИТП пре-рывание беременности в I и во II триместрах представляет не меньшую опасность, чем ее продолжение. В большинстве случаев беременность протекает благополучно и не обостряет течение болезни. При этом нет необходимости применять глюкокортикоиды. Лишь в родах показано назначение преднизолона в средней дозе 15-30 мг. После родов дозу преднизолона снижают под контролем количества тромбоцитов.
Грудное вскармливание не показано ввиду угрозы перехода антител через мо-локо матери ребенку. В случаях обострения ИТП при беременности проводят лече-ние глюкокортикоидами. В редких тяжелых случаях ИТП, когда у беременных имеется выраженная кровоточивость и нет эффекта от применения глюкокортикоидов, может встать вопрос о выполнении одновременно двух операций – кесарева сечения и сплснэктомии по жизненным показаниям.
Наследственные тромбоцитопатии
Тромбастения Гланцманна характеризуется нормальным количеством тромбоцитов и отсутствием или неполной ретракцией кровяного сгустка. Отличительные лабораторные признаки – отсутствие агрегации тромбоцитов при стимуляции АДФ, адреналином, коллагеном, тромбином. Клинически геморрагический диатез проявляется носовыми кровотечениями, кровоточивостью десен, петехиями, подкожными кровоизлияниями, менометроррагиями. При беременности геморрагические симптомы могут оставаться. Роды сопряжены с большим риском для матери Эффективная профилактика кровотечения – переливание во втором и третьем периодах родов, а также при кесаревом сечении тромбоцитной массы. Пренатальный диагноз возможен, если исследовать функцию тромбоцитов в крови плода, полученной при кордоцентезе. Заболевание наследуется по аутосомнорсцессивному типу.Синдром Бернара-Сулъе – заболевание, характеризующееся кровоточивостью,обусловленной гигантскими дегенеративными формами тромбоцитов при их нор-мальном количестве, увеличением времени кровотечения.
Синдром проявляется легкостью образования синяков, кровотечениями из сли-зистых оболочек, десен, желудочно-кишечного тракта, поверхностных разрезов, а также носовыми кровотечениями.
Лабораторные признаки – гигантские тромбоциты от 2,5 до 8 мкм, примерно достигающие размеров эритроцита. Число тромбоцитов нормальное, отсутствует агрегация на ристомицин, но присутствует на все другие стимуляторы.
Заболевание наследуется по аутосомно-рсцессивному типу.
Беременность и роды опасны, если нет ремиссии. Профилактика кровотечений достигается назначением тромбоцитной массы.
Болезни недостаточности пула накопления тромбоцитов. Эти болезни стали распознаваться недавно, и не все еще идентифицированы. В основе дисфункции тромбоцитов лежит неспособность их накапливать и выделять АТФ, серотонин, адреналин, фактор IV и другие вещества при осуществлении гемостаза.
К этой группе болезней относятся синдром Германского-Пудлака, синдром Вискотта-Олдрича, синдром Чедиака-Хигаси.
Наиболее эффективным средством профилактики кровотечения в родах и во время кесарева сечения является заместительная терапия тромбоцитной массой.
Геморрагический шок
Геморрагический шок (ГШ) – комплекс изменений, возникающих в ответ на патологическую кровопотерю и характеризующийся развитием синдрома малого выброса, гипоперфузии тканей, полисистемной и полиорганной недостаточности. Акушерский геморрагический шок является одной из причин материнской смертности (2-3-е место в структуре причин материнской смертности).Геморрагический шок развивается при кровопотере более 1 % от массы тела (1000-1500 мл). На фоне экстрагенитальной патологии, гестозов, слабости родовой деятельности, при неадекватном обезболивании родов симптомы шока могут появиться при меньшей кровопотере (800-I CCD мл).
Этиология.
Причиной геморрагического шока является кровотечение, которое может быть обусловлено преждевременной отслойкой нормально расположенной и предлежащей плаценты, разрывом матки, частичным плотным прикреплением или приращением плаценты, гипотонией и атонией матки, эмболией околоплодными водами. Тяжелое маточное кровотечение возможно также при наличии мертвого плода в матке.
Патогенез.
В акушерстве патогенез ГШ сходен с таковым при травматическом шоке ввиду наличия болевого фактора во время родов при неадекватном их обезболивании и различных манипуляциях (акушерские щипцы, ручное обследование матки, ушивание разрывов родовых путей), при преждевременной отслойке нормально расположенной плаценты. Родовой травматизм и кровопотеря – два фактора, определяющих развитие акушерского шока.
В основе патогенеза ГШ лежат изменения макрои микрогемодинамики, обусловленные гиповолемией, гипоперфузией, анемической и циркуляторной гипоксией с развитием дистрофических изменений в жизненно важных органах. Нарушение гемодинамики и тканевого метаболизма зависит от величины кровопотери и интенсивности кровотечения.
Первоначально при острой кровопотере (700-1300 мл, 15-25 % ОЦК) в ответ на снижение ОЦК и сердечного выброса развиваются компенсаторные реакции, заключающиеся в активации симпатико-адреналовой системы с выделением катехоламинов, что приводит к тахикардии, повышению тонуса емкостных сосудов (венул), увеличению венозного возврата. При продолжающейся кровопотере повышается резистентность артериол. Вазоконстрикция артериол и прекапиллярных сфинктеров способствует централизации кровотока. В результате этого снижается циркуляция крови в коже, кишечнике, печени и обеспечивается оптимальный кровоток в головном мозге, сердечной мышце.
Одновременно с сосудистыми изменениями наблюдаются задержка воды в организме И приток интерстициальной жидкости в сосудистое русло за счет повышения секреции антидиуретического гормона и альдостерона. Происходящие изменения увеличивают ОЦК, и систолическое артериальное давление может оставаться на уровне выше критического. Однако компенсаторные реакции стабилизации макрогемодинамики происходят в ущерб состоянию микроциркуляции, особенно в органах, не являющихся жизненно важными. Вазоконстрикция способствует увеличению агрегационной способности эритроцитов, вязкости крови, появлению патологических форм эритроцитов, развитию гиперкоагуляции (повышение концентрации фибриногена, увеличению скорости свертывания крови). Изменения виутрисосудистого звена микроциркуляции наряду с вазоконстрикцией приводят к прогрессирующему падению скорости кровотока и нарушению перфузии тканей.
Указанные нарушения при своевременной остановке кровотечения могут компенсироваться самостоятельно.
При продолжающемся кровотечении (кровопотеря 1300-1800 мл, 25 – 45 % ОЦК) происходит усугубление нарушений макрои микрогемодинамики. Прогрессирующая гиповолемия стимулирует открытие артериовенозных шунтов. При этом кровь циркулирует из артериол по артериовенозным анастомозам, минуя капилляры, усугубляя гипоксию тканей, которая способствует локальной дилатации сосудов, что дополнительно снижает скорость кровотока и ведет к резкому падению венозного возврата к сердцу. Низкая скорость кровотока в микроциркуляторном русле создает условия для образования клеточных агрегатов и оседания их в сосудах. На эритроцитных и тромбоцитных агрегатах образуется фибрин, который первоначально растворяется благодаря активации фибринолиза. Взамен растворенного фибрина осаждается новый, что является причиной уменьшения его содержания в крови (гипофибриногенемия). Агрегаты эритроцитов, обволакиваемые белками, склеиваются, образуя большие клеточные конгломераты, что выключает из кровотока значительное количество эритроцитов. В эритроцитных агрегатах одновременно происходит гемолиз эритроцитов. Развивающийся процесс секвестрации красной крови, или сладж-феномен (появление в сосудах неподвижных патологически измененных эритроцитов и эритроцитных агрегатов), приводит к сепарации крови, появлению плазматических капилляров, свободных от эритроцитов.
На этом этапе ГШ развивается явная картина диссеминированного внутрисосудистого свертывания крови (ДВС-синдром). В кровотоке снижается уровень факторов свертывания крови. Уменьшение обусловлено как коагулопатией убыли вследствие потери факторов свертывания во время кровотечения, так и потреблением про коагулянтов в процессе активации внутрисосудистого свертывания крови и активации фибринолиза, свойственного ДВС-синдрому (коагулопатия потребления). При прогрессирующем снижении ОЦК в результате секвестрации крови, длительного артериолоспазма нарушение микроциркуляции становится генерализованным. Малый сердечный выброс не способен компенсировать значительное снижение ОЦК. В результате начинает снижаться артериальное давление. Гипотония является кардинальным симптомом, свидетельствующим о декомпенсации кровообращения.
В тканях жизненно важных органов при декомпенсации кровообращения развивается метаболический ацидоз за счет анаэробного гликолиза, в условиях которого нарушается электролитное равновесие, приводящее к внутриклеточному отеку, одновременно активируются перекисное окисление липидов и лизосомальные ферменты с разрушением мембран и гибелью клеток. В систему общей циркуляции поступает большое количество кислых метаболитов и агрессивных полипептидов высокой концентрации, обладающих токсическими свойствами. Образующиеся пол и пептиды в первую очередь угнетающе влияют на миокард, дополнительно приводя к снижению сердечного выброса.
Представленные нарушения кровообращения и метаболизма не исчезают самостоятельно даже после остановки кровотечения. Для нормализации органного кровотока необходимо проведение своевременного лечения. В отсутствие адекватной терапии или при продолжении кровотечения (2000- 2500 мл и более, свыше 50 % ОЦК) нарушения гемодинамики и метаболизма прогрессируют. Под влиянием местной гипоксии артериолы и прекапиллярные сфинктеры теряют тонус и перестают реагировать даже на высокие концентрации эндогенных катехоламинов. Атония и дилатация сосудов приводят к капилляростазу, внутрисосудистому свертыванию крови и перемещению жидкости из сосудистого и внеклеточного секторов в клеточный, что способствует необратимым дистрофическим изменениям во всех органах. Капилляростаз, атония сосудов, внутриклеточный отек – характерные признаки необратимости процесса при геморрагическом шоке.
Различные органы при ГШ поражаются неодинаково. Прежде всего нарушается кровообращение в легких (шоковое легкое), в почках (шоковая почка), в печени (центролобулярный некроз), в гипофизе с последующим возможным развитием синдрома Шихена. По мере нарушения микроциркуляции изменяется плацентарный кровоток. Обширное микроциркуляторное русло плаценты забивается клеточными агрегатами. В результате блокады сосудов перфузионный резерв плаценты сокращается, приводя к снижению фетоплацентарного кровотока и гипоксии плода. Впоследствии присоединяются структурные повреждения миометрия, в основе которых лежат вначале отек миоцитов, а затем их деструкция. Наиболее характерным признаком шоковой матки является отсутствие сократительной активности в ответ на введение утеротоников (окситоцина, простагландинов). Финальной стадией синдрома шоковой матки является матка Кувелера. При ГШ длительнее других сохраняются функции сердечно-сосудистой и нервной систем. Потеря сознания у больных в состоянии шока наступает при АД ниже 60 мм рт. ст., т.е. уже в терминальном состоянии.
Клиническая картина.
По клиническому течению в зависимости от объема кровопотери выделяют 3 стадии шока: I – легкая, II – средняя, III – тяжелая.
Особенностью акушерских кровотечений являются их внезапность и тяжесть. При этом стадийность развития ГШ не всегда четко определяется. Наиболее выраженные клинические проявления шока наблюдаются при преждевременной отслойке нормально расположенной плаценты, при разрывах матки в родах, во время которых очень быстро, уже в первые 10 мин, может возникнуть преагональное состояние. В то же время при длительном кровотечении на фоне гипотонии матки, если оно повторяется малыми порциями, трудно бывает определить грань, когда организм из стадии относительной компенсации переходит в фазу декомпенсации. Относительное благополучие в состоянии роженицы дезориентирует врача, и он может внезапно оказаться перед констатацией критического дефицита ОЦК. Для объективной оценки степени тяжести состояния при тяжелых кровотечениях необходимо учитывать следующий комплекс клинико-лабораторных данных: 1. окраска кожных покровов и слизистых оболочек, частота дыхания и пульса, уровень артериального давления (АД) и центрального венозного давления (ЦВД), шоковый индекс (отношение уровня АД к пульсу) Ачьговера (при гестозах не всегда информативен); 2. минутный диурез, относительная плотность мочи; 3. показатели клинического анализа крови: гематокрит, количество эритроцитов, содержание гемоглобина, показатель кислотно-основного состояния и газового состава крови, состояние водно-электролитного и белкового обмена; 4. показатели гемостаза: время свертываемости крови по Ли – Уайту, число и агрегация эритроцитов, концентрация фибриногена, антитромбина III, содержание продуктов деградации фибрина/фибриногена, паракоагуляционные пробы.
При развитии ГШ для раннего выявления изменений и предупреждения развития осложнений необходимо осуществлять непрерывное наблюдение за жизненно важными функциями больной. Изменение представленных показателей в зависимости От величины кровопотери и степени тяжести шока представлены в табл. 24.1..
При легкой (I) стадии шока кровопотеря компенсируется изменениями сердечно-сосудистой деятельности, при акушерских кровотечениях эта стадия по времени непродолжительна и нередко не диагностируется.
Средняя (II) стадия шока характеризуется усугублением расстройств кровообращения и метаболизма. О генерализованном спазме периферических сосудов свидетельствуют замедленное исчезновение пятна при надавливании на ногтевое ложе, холодные конечности. На первый план выступает снижение АД до критического уровня (80 мм рт.ст.). Появляются симптомы, свидетельствующие о нарушении функции жизненно важных органов: выраженная одышка как свидетельство шокового легкого, глухость сердечных тонов с появлением изменений на ЭКГ (снижение сегмента STi\ уплощение зубца 7), олигурия, связанная с расстройством почечного кровотока и снижением гидростатического давления. Появляются видимые признаки нарушения свертываемости крови: кровь, вытекающая из матки, теряет способность к свертыванию, могут появляться рвота кофейной гущей, кровянистые выделения из слизистых оболочек, кровоизлияния на коже рук, живота, лица, в местах инъекций, подкожные кровоизлияния, экхимозы; у оперированных больных возможно кровотечение из операционной раны.
Тяжелый ГШ (III стадия) развивается при тяжелой кровопотере (35 – 40 %) , характеризуется тяжелым течением, сознание нарушено. Когда период декомпенсации кровообращения продолжается более 12 ч, шок становится необратимым, несмотря на лечение. Кровопотеря при этом массивная (более 50-60 % ОЦК).
В отсутствие эффекта от лечения развиваются терминальные состояния: 1. преагональное состояние, когда пульс определяется только на сонных, бедренных артериях или по числу сердечных сокращений, АД не определяется, дыхание поверхностное, частое, сознание спутанное; 2. агональное состояние – сознание утрачено, пульс и АД не определяются, выраженные расстройства дыхания; 3. клиническая смерть – остановка сердца, дыхания в течение 5-7 мин.
Лечение должно быть комплексным и заключаться в остановке кровотечения, возмещении кровопотери и терапии ее последствий, коррекции гемостаза.
Остановка кровотечения при ГШ должна включать в себя набор эффективных методов. При гипотоническом кровотечении и неэффективности проводимых мероприятий (наружный массаж матки, введение утеротонических средств, ручное обследование матки с бережным наружно-внутренним массажем ее) при кровопотере, составляющей 1000-1200 мл, следует своевременно ставить вопрос об удалении матки, не прибегая к ее повторному исследованию. В случае прогрессирующей преждевременной отслойки нормально расположенной и предлежащей плаценты, в отсутствие условий для родоразрешения через естественные родовые пути немедленно приступают к кесареву сечению. При наличии признаков диссеминированного внутрисосудистого свертывания крови, матке Кувелера необходима экстирпация матки. В случае разрыва матки показано срочное чревосечение с удалением ее или ушиванием разрыва.
При массивной кровопотере экстренные операции следует проводить в условиях комбинированной эндотрахеальной анестезии. При кровотечениях, сопровождающихся клинической картиной коагулопатии, для полноценного хирургического гемостаза целесообразно одновременное осуществление перевязки внутренних подвздошных артерий и экстирпации матки. После операции необходимо придерживаться тактики проведения искусственной вентиляции легких на фоне лечебного наркоза и под контролем показателей кислотно-основного состояния и газов крови.
Одновременно с остановкой кровотечения терапия массивной кровопотери должна включать возмещение кровопотери и комплекс мер, направленных на поддержание системной гемодинамики, микроциркуляции, адекватного газообмена, компенсацию метаболического ацидоза, белкового и водно-электролитного обменов, восстановление адекватного диуреза, профилактику шоковой почки, создание антигипоксической защиты головного мозга, адекватного обезболивания.
Ликвидация последствий кровопотери осуществляется проведением инфузионной терапии (ИТ). При проведении ИТ важное значение имеют скорость, объем и состав вводимых растворов.
Скорость инфузий при декомпенсированном шоке должна быть высокой (темп инфузий не должен отставать от темпа кровопотери). В зависимости от объема кровопотери и тяжести состояния женщины пунктируют одну или две периферические вены либо катетеризируют центральную вену. При терминальных состояниях обнажают лучевую или заднюю большеберцовую артерию и проводят внутриартериальное нагнетание растворов. Критического АД (80 мм рт.ст.) необходимо достичь как можно быстрее. Для этого применяют струйное вливание первоначально коллоидных, а затем кристаллоидных растворов (до 200 мл/мин), иногда в две-три вены. Струйное вливание жидкости необходимо проводить до тех пор, пока АД не повысится до 100 мм рт.ст., а ЦВД – до 50-70 мм вод.ст. В первые 1-2 ч лечения кровопотеря должна быть возмещена в среднем на 70 %. Одновременно в начале лечения назначают глюкокортикоидные гормоны (до 1,5 г гидрокортизона). В случае развития критической артериальной гипотензии вводят допамин (от 1,0 до 5 мкг/мин) или добутрекс, допакард, при этом увеличивается сердечный выброс, происходят системное расширение сосудов и уменьшение перифе-рического сопротивления, значительно улучшается почечный кровоток.
Объем инфузий на первых этапах интенсивной терапии зависит от величины кровопотери, исходной патологии (ожирение, экстрагенитальная патология, анемия, ]лстоз и т.д.). Объем инфузий определяется следующими показателями: уровнем АД, частотой пульса, уровнем ЦВД, концентрационными показателями крови (Hb, Ht, количество эритроцитов), диурезом, временем свертывания крови (по Ли – Уайту).
При проведении инфузий систолическое АД не должно быть ниже 90-100 мм рт.ст., ЦВД не менее 30 мм вод.ст. и не более 100 мм вод.ст., уровень гемоглоби12на не менее 75 г/л, гематокрита – 25 %, количество эритроцитов – 2,5'10 /л, время свертывания крови по Ли – Уайту 6-10 мин. Особое значение для контроля за ИТ имеет диурез, поскольку его можно определить в любых условиях и он достаточно точно отражает органный кровоток и степень гиповолемии. Диурез должен быть не менее 30 мл/ч. На начальных этапах шока олигурия может носить функциональный характер, обусловленный дефицитом ОЦК. Коррекция гиповолемии должна устранить эту олигурию. После восстановления ОЦК возможно введение малых доз лазикса (10 – 20 мл). В отсутствие эффекта от лечения необходимо исключить другие причины олигурии, в частности перевязку мочеточника во время экстирпации матки при остановке кровотечения.
В отсутствие возможности мониторирования гемодинамических и концентрационных показателей крови следует придерживаться следующего правила: объем инфузий зависит от величины кровопотери (кровопотерю до 0,8 % от массы тела можно замещать на 80-100 %, при кровопотере более 0,8 % от массы тела объем инфузий превышает объем кровопотери). Указанное в большей мере необходимо для восполнения дефицита внеклеточного сектора и профилактики клеточной дегидратации. Объем "надтрансфузий" тем больше, чем длительнее период кровотечения и особенно артериальной гипотензии. Приблизительный объем инфузий в зависимости от кровопотери следующий: при кровопотере 0,6-0,8 % от массы тела – 80 – 100 % от кровопотери.
Важное значение для проведения адекватной ИТ имеет включение в нее компонентов крови (плазма, эритроцитная масса) и плазмозаменитедей.
В лечении ГШ важное значение принадлежит плазме. В настоящее время используется свежезамороженная плазма. Особенно целесообразно применять ее при нарушении свертывающей способности крови. Свежезамороженную плазму вводят из расчета не менее 15 мл/кг массы в сутки. После согревания плазмы до 37 °С ее вводят внутривенно струйно. Свежезамороженная плазма содержит все факторы свертывания крови и фибринолиза в естественном соотношении. Переливание плазмы требует учета групповой принадлежности. Из других препаратов крови возможно использование альбумина и тромбоцитной массы.
Тромбоцитная масса переливается с целью остановки кровотечения, обусловленного тромбоцитопенией, или для поддержания числа тромбоцитов на уровне 50-70 10 /л.
Показанием к переливанию компонентов крови является снижение уровня гемоглобина (до 80 г/л и менее), числа эритроцитов (менее 2,5]0л/п), гематокрига (менее 0,25/. Для этого используют эригроцитную массу, взвесь эритроцитов в суспензионном растворе, концентрированную взвесь отмытых эритроцитов. При гемотрансфузиях следует отдавать предпочтение эритроцитной массе, срок хранения которой не должен превышать 3 сут.
Отмытые, нативные или размороженные эритроциты переливают в тех случаях, когда имеется сенсибилизация реципиента к плазменным факторам. В этих случаях переливание отмытых эритроцитов является профилактикой осложнений: белково-плазменного синдрома, гомологичной крови иди гемолитического синдрома, вызывающего острую почечную недостаточность.
Важное значение при лечении ГШ принадлежит кровезаменителям: полиглюкину, реополиглюкину, желатинолю, а также препаратам нового класса – растворам гидрооксиэтилированного крахмала (6 и 10 % HAES – sterile, ONKONAS).
Полиглюкин является основным плазмозаменителем при лечении гиповолемического шока, поскольку представляет собой гиперосмолярный и гиперонкотический раствор, устойчиво повышающий за счет этого ОЦК и стабилизирующий систему макроииркуляции Он длительно задержи чается в сосудистом русле (! г полиглюкина связывает 20-25 мл воды). Объем суточной инфузий не должен превышать 1500 мл вследствие развития угрозы ги по кол гул я ни и Реополиглюкин быстро увеличивает ОЦП, повышает АД, улучшает не только макро-, но и микроциркуляцию. Это наиболее эффективный гемодилютант, способный быстро восстанавливать капиллярный кровоток, дезагрегировать застойные эритроциты и тромбоциты. Разовая доза препарата 500-800 мл/сут. Осторожно его следует применять при поражении почек. Доза 1200 мл способна вызвать гипокоагуляцию вследствие снижения числа тромбоцитов и концентрации плазменного фактора VIII.
Желатиноль быстро увеличивает ОЦП, но и быстро выводится из организма через 2 ч остается лишь 20 % перелитого объема. В основном используется как реологическое средство. Количество введенного препарата может достигать 2 л.
Реоглтоман представляет собой гиперосмолярный и гиперонкотический раствор с выраженным дезинтоксикационным и диуретическим эффектами. Реоглюман эффективно, но кратковременно устраняет гипово.чемию, снижает вязкость крови, снимает агглютинацию форменных элементов крови Применение реоглюмана может вызвать анафилактоидные реакции. Раствор противопоказан при геморрагических диатезах, недостаточности кровообращения, анурии и значительной дегидратации.
Растворы оксиэтилкрахмала, не обладая способностью переносить кислород, тем не менее улучшают газотранспортную функцию крови, благодаря увеличению ОПК, сердечного выброса, скорости циркуляции эритроцитов. Одновременно растворы крахмала улучшают реологические свойства крови и восстанавливают кровоток в микрососудах. Преимуществами его являются отсутствие анафилактогенных свойств, минимальное влияние на коагуляционные свойства крови, более длительная циркуляция в кровеносном русле.
Для нормализации водно-солевого обмена и кислотно-основного состояния (КОС) крови и тканей в комплекс инфузионной терапии должны быть включены кристаллоидные растворы (растворы глюкозы, Рингера, Гартмана, лактосол. халосоль н т.д.). Для коррекции сопутствующего метаболического ацидоза дополнительно применяется гидрокарбонат натрия в дозе 2 мл/кг массы тела под контролем КОС.
Соотношение коллоидов и кристаллоидов зависит от кровопотери. При относительно небольших кровотечениях соотношение их составляет 1:1, при массивных – 2:1.
Для коррекции гемостаза используется переливание свежезамороженной плазмы В ее отсутствие по жизненным показаниям целесообразно применение теплой донорской крови. Показанием к прямому переливанию крови является тяжелая кровопотеря, сопровождающаяся стойкой артериальной гипотензией и повышением кровоточивости (коагулопатическое кровотечение). Объем прямого переливания составляет 300-400 мл от одного донора в течение 10-15 мин. Одновременно необходимо использовать ингибиторы протеолитических протеаз, которые регулируют взаимоотношение между системами свертывания крови, фибринолиза и кининогенеза и повышают адаптационные возможности организма в преодолении критической нехватки кислорода. Рекомендуется использовать контрика,! в дозе 40 000-50 000 ЕД Для нейтрализации плазмина в условиях гемокоагуляционных нарушений целесообразно применять препараты трансаминовой кислоты. Трансамин в дозе 500-750 мг ингибирует рецепторы плазмина н плазминогена, препятствуя их фиксации к фибрину, что предотвращает деградацию фиб-риногена.
ИВЛ показана при нарастающей гиперкапнии, наличии симптомов дыхательной недостаточности, тахипноэ, одышка, цианоз, тахикардия).
При проведении лечения ГШ ошибкой может быть не только недостаточное, но и избыточное введение растворов, способствующее развитию тяжелых состояний: отека легких, "декстрановой почки", гипои гиперосмолярного синдрома, неуправляемой дилатации сосудов микро цирк уляторного русла.
Прекращение кровотечения, стабилизация уровня АД у родильниц не гарантируют в полной мере благоприятного исхода, особенно при тяжелых акушерских кровотечениях. Отмечено, что необратимые изменения в жизненно важных органах формируются не только в период острых циркуляторных нарушений, но и в последующем при неправильном ведении постреанимационного периода.
В постреанимационном периоде следует различать 4 стадии: 1. период нестабильных функций наблюдается в первые 6-10 ч лечения; 2. период относительной стабилизации основных функций организма (через 10-12 ч после лечения); 3. период повторного ухудшения состояния – начинается с конца первых – начала вторых суток лечения; 4. период улучшения состояния или прогрессирования осложнений, начавшихся в III стадии.
В I стадии постреанимационного периода основной задачей является поддержание системной гемодинамики и адекватного газообмена. Для поддержания системной гемодинамики с целью предотвращения критической артериальной гипотензии необходимо введение растворов гидрооксиэтилированного крахмала (6 и 10 % HAES – sterile, ONKONAS). Дополнительная коррекция глобулярного объема крови проводится введением эритроцитной массы (не более 3 сут хранения). Достаточным можно считать уровень гемоглобина не ниже 80 г/л, гематокрита не менее 25 %.
Учитывая возможность развития гипогликемии в постреанимационном периоде, целесообразно включать растворы концентрированных углеводов (10 и 20 %).
В I стадии необходимо также продолжить коррекцию гемостаза с применением заместительной терапии (свежезамороженная плазма) на фоне введения ингибиторов протеолиза.
Указанная инфузионно-трансфузионная программа реализуется на фоне глюкокортикоидной терапии (гидрокортизон не менее 10 мг/кг/ч) и введения ингибиторов протеолиза в дозе не менее 10 000 ЕД/ч.
Во II стадии постреанимационного периода (период стабилизации функций) необходимо продолжить нормализацию микроциркуляции (дезагреганты, гепарин), коррекцию гиповолемии и анемии (белковые препараты, эритроцитная масса), устранение нарушений водно-электролитного обмена, обеспечение энергетической потребности организма (парентеральное питание, глюкоза, жировые эмульсии, аминокислоты), оксигенацию под контролем КОС, коррекцию иммунитета, десенсибилизирующую терапию.
С целью профилактики гнойно-септических осложнений в постреанимационном периоде проводится терапия антибиотиками широкого спектра действия.
На фоне ИТ при восстановлении микроциркуляции в кровоток попадают недоокисленные продукты обмена и различные токсины, циркуляция которых приводит к недостаточности функций жизненно важных органов. Для профилактики этого во II стадии постреанимационного периода показано проведение дискретного плазмафереза не позже 12 ч после выполнения хирургического гемостаза. При этом эксфузируется не менее 70 % ОЦК с адекватным возмещением донорской свежезамороженной плазмой. Прове-дение плазмафереза позволяет купировать нарушение гемокоагуляционного потенциала и устранить эпдотоксемию.
Если развивается III стадия (стадия повторного ухудшения состояния больных), которая характеризуется формированием полиорганной недостаточности, то без использования экстракорпоральных методов детоксикации лечение малоэффективно. Необходимо использовать щадящие методы детоксикации. к которым относятся плазмаферез, гемофильтрация, гемодиафильтрация и гемодиализ. При сформировавшемся шоковом легком методом выбора следует считать спонтанную артериовенозную или принудительную вено-венозную гемофильтрацию.
При развитии почечно-печеночной недостаточности осуществляется комбинация дискретного плазмафереза и гемофильтрации; при острой почечной недостаточности, сопровождающейся гиперкалиемией (уровень калия выше 6 ммоль/л), – гемодиализ.
Инфузионная терапия в постреанимационном периоде должна проводиться минимум 6-7 дней в зависимости от состояния родильницы.
Терапия в III и IV стадиях постреанимационного периода проводится в специализированных отделениях.
Можно отметить следующие ошибки при лечении ГШ: недостаточная оценка кровопотери на ранних этапах, поздняя диагностика ГШ; запоздалое выполнение мероприятий, направленных на обеспечение местного гемостаза; запоздалое неадекватное по объему и вводимым средствам замещение кровопотери; нерациональное соотношение между объемом введенной концентрированной крови и плазмозаменителей; несвоевременное применение стероидных гормонов и тонизирующих средств.
У женщин, перенесших массивную кровопотерю, через 3-10 лет может наступить инвалидизация. При этом развиваются хронические заболевания внутренних органов, эндокринные нарушения.
ДВС-синдром
Синдром диссеминированного внутрисосудистого свертывания крови (ДВСсиндром) относится к вторичным нарушениям гемостаза, ДВС-синдром является важнейшим звеном в патогенезе акушерских осложнений, в том числе геморрагического шока. Впервые он был описан при преждевременной отслойке нормально расположенной плаценты.Этиология и патогенез.
ДВС-синдром относится к общепатологическим неспецифическим реакциям организма. В акушерстве он может развиваться при следующих патологических состояниях: преждевременной отслойке нормально расположенной плаценты, разрывах матки, эмболии околоплодными водами, мертвом плоде, гестозах, гипоксии, оперативных вмешательствах, сепсисе и т.д. Причины, приводящие к ДВС-синдрому при указанных акушерских осложнениях, следующие: 1. повреждение клеток крови, в результате чего из них освобождаются фосфолипиды и происходит активация внутрисосудистого свертывания; 2. поражение тканей и поступление за счет этого в кровоток тканевого тромбопластина; 3. поражение эндотелия сосудистой стенки, когда происходит активация XII фактора (фактора контакта, или Хагемана); 4. гемодинамические нарушения, сопровождающие шок, макрои микро циркуляторные нарушения в тканях с развитием в них гипоксии.
Выделение этих этиологических факторов несколько условно, так как чаще они наблюдаются в комбинации.
Независимо от причин повышения уровня тромбопластина в крови, с момента его появления начинает развиваться тромбогеморрагический синдром. Освобождение тромбопластина ведет к образованию тромбина, который в свою очередь переводит циркулирующий в крови фибриноген в свертывающий фибрин. В результате потребления (расходования) при этом тромбоцитов и факторов свертывания крови, особенно фибриновой группы (фибриноген I, V, VIII), критически уменьшается потенциал гемостаза, что само по себе ведет к геморрагическому диатезу.
Одновременно с активацией внутрисосудистого свертывания крови наблюдается активация коагулянтной и фибринолитической клеток ретикулоэндотелиальной системы (РЭС). Образующийся в результате фибринолиза плазмин ферментативно разлагает тромбы на растворимые продукты расщепления (деградации) фибрина, которые обладают антисвертывающими свойствами. В норме промежуточные продукты свертывания удаляются из кровотока клетками РЭС. При блокаде РЭС, особенно в печени, например при эмболии околоплодными водами, антикоагуляционный потенциал крови повышается. Повышение локального фибринолиза при развитии внутрисосудистого свертывания крови способствует растворению микротромбов и восстановлению циркуляции крови в сосудах. Однако при развитии ДВСсиндрома нередко процесс активации фибринолитического звена гемостаза принимает генерализованный патологический характер. В результате лизируются не только микросвертки крови, но и циркулирующие факторы свертывания крови, фибриноген. Кровь при этом полностью теряет способность к свертыванию.
Если интенсивность фибринолиза недостаточна для растворения тромбов или активация его проходит поздно, через 6 – 8 ч после появления микротромбов, диссеминированное внутрисосудистое свертывание крови может протекать без повышения кровоточивости, а проявляться некрозами паренхиматозных органов за счет нарушения микрогемодинамики в них. Из-за аноксии происходят глубокие дистрофические изменения в тканях с развитием почечной, печеночной и легочной недостаточности, отека мозга, шоковой матки.
Клиническая картина. Специальных симптомов, характерных только для ДВС-синдрома, не существует. Они неотделимы от клинических признаков основных акушерских осложнений, в развитии которых указанному синдрому принадлежит большая роль. Тем не менее наиболее частыми клиническими проявлениями ДВС-синдрома являются кровотечение, шок, тромбозы, нарушение функции жизненно важных органов (печени, почек, легких, головного мозга), признаки микрогёмолиза.
Клиническая картина ДВС-синдрома зависит от скорости развития, распространенности, выраженности компенсаторных реакций и стадии процесса. В зависимости от скорости развития синдрома различают следующие клинические формы: острую, подострую и хроническую.
Процесс носит острый характер при массивном выбросе в кровоток и воздействии на систему гемостаза тромбопластиновых субстанций, таких как околоплодные воды (при эмболии околоплодными водами), тканевые тромбопластины (при задержке мертвого плода, преждевременной отслойке нормально расположенной плаценты), бактериальные токсины (при сепсисе и септическом шоке), эритроцитарный тромбопластин (при трансфузионном осложнении, геморрагическом шоке). В зависимости от этиологии проис-ходит быстрое чередование начальных стадий ДВС-синдрома без должной активации защитно-приспособительных реакций гемостаза и в первую очередь естественных ингибиторов свертывания крови (антитромбина III, а|-антитрипсина и аз-микроглобулина). При массивных поступлениях тканевых субстанций в кровоток развивается гемодинамический шок с появлением в последующем массивных кровотечений, обусловленных гипои афибриногенемией.
При замедленном или незначительном поступлении тромбопластина (гестозы, локальные формы послеродовых гнойно-септических осложнений, невынашивание беременности, антифосфолипидный синдром, плацентарная недостаточность) приспособительные механизмы обеспечивают защиту микроциркуляции от тромбоцитарных сгустков и ДВС-синдром приобретает подострое или хроническое течение. Это состояние неустойчивого равновесия может продолжаться более или менее длительное время. Клинически подострая и хроническая формы ДВС-синдрома проявляются микротромбозами в органах, в частности в плаценте, почках с нарушением в них кровотока.
По распространенности диссеминированного внутрисосудистого свертывания крови выделяют локальную и генершшзованную формы. При локальной форме свертывание крови ограничено одним органом (плацента, почки) с нарушением их функции, а при генерализованной распространяется на целые системы или весь организм.
В зависимости от интенсивности механизмов, вызывающих ДВС-синдром, и от функциональной полноценности компенсаторных механизмов можно дифференцировать компенсированную и декомпенсированную формы синдрома.
Компенсированная форма характеризуется отсутствием клинических проявлений и выявляется только лабораторными методами (уменьшение уровня факторов свертывания крови, числа тромбоцитов). При этой форме образовавшиеся микросгустки лизируются в результате повышения фибринодиза, а возникающий дефицит факторов свертывания может покрываться за счет внесосудистых резервов и их новообразования.
Указанная форма развивается в начальных стадиях гестоза, при наличии экстрагенитальной патологии, невынашивании беременности, гипоксии плода.
Декомпенсированная форма синдрома характеризуется острым течением, при котором компенсаторные реакции организма быстро истощаются из-за протекающей цепной реакции в системе гемостаза.
Декомпенсированная форма развивается при преждевременной отслойке нормально расположенной плаценты, разрывах матки, эмболии околоплодными водами. Клинически декомпенсированная форма может проявляться кровотечением или нарушением функции органов; острой почечной недостаточностью, легочной и печеночной недостаточностью.
В развитии ДВС-синдрома различают 4 стадии.
Стадия I – стадия гиперкоагуляции, связанная с моментом поступления тромбопластина в кровоток и активацией факторов гемостаза. Эта фаза при остром течении синдрома кратковременная, трудно диагностируемая. Уловить ее можно только при хронической форме синдрома, при медленном поступлении тромбопластина в кровоток, когда она может продолжаться несколько дней. Клинически при остром течении ей соответствуют явления шока, а при хроническом течении она проявляется нарушением функций органов.
Стадия II – стадия потребления, характеризуется уменьшением уровня факторов свертывания крови и числа тромбоцитов. Их снижение происходит за счет повышенного потребления в процессе свертывания. Клинически эта стадия может проявляться кровотечениями.
Стадия III – стадия патологического фибринолиза оценивается как поздняя декомпенсированная стадия, при которой фибринолиз, компенсаторный на начальных стадиях, становится патологическим. Происходит дальнейшее выраженное снижение уровня всех факторов свертывания крови и тромбоцитов. Кровь теряет способность к свертыванию в результате афибриногенемии, повышения концентрации продуктов деградации фибрина/ фибриногена. Развивается тяжелое кровотечение.
Стадия IV – восстановительная. Период восстановления во многом зависит от состояния микроциркуляции. К числу наиболее часто наблюдаемых осложнений в этой стадии следует отнести острую ночечно-печеночную недостаточность, пневмонию, нарушение мозгового кровообращения, тромбоэмболические осложнения.
Диагностика.
В практической работе необходимо использовать простые способы диагностики, дающие возможность в короткое время создать верное представление о нарушениях гемокоагуляции.
Для острой формы ДВС-синдрома характерны выраженные нарушения свертывания крови за счет коагулопатии и тромбоцитопении потребления, потенциальная гиперактивность системы гемостаза и снижение активности естественных антитромбинов крови.
При подострой и хронической форме отмечаются положительные маркеры тромбинемии, гиперфибриногенемия, наличие высокои низкомолекулярных фрагментов продуктов деградации фибриногена, сочетающееся с гиперактивностью системы гемостаза.
При наличии соответствующей клинической акушерской ситуации и геморрагических симптомов выявление в совокупности хотя бы 2-3 лабораторных признаков указывает на развитие ДВС-синдрома.
Лечение ДВС-синдрома. При острой и подострой формах синдрома лечение начинается с устранения основной причины, вызвавшей его. Чаще всего для этого необходимо срочное родоразрешение или экстирпация матки.
Для коррекции центральной и периферической гемодинамики следует проводить инфузионно-трансфузионную терапию на фоне искусственной вентиляции легких.
Для восстановления коагуляционных свойств крови применяют препараты крови. В настоящее время предпочтение отдают введению свежезамороженной плазмы до 1 л и более в сутки. После согревания плазмы до 37 °С ее внутривенно струйно вводят в первоначальной дозе 600-800 мл с повторными инфузиями через каждые 2, 4. 6, 8 ч в зависимости от показателей гемостаза и клинической эффективности терапии. Медленное капельное введение криоплазмы малоэффективно. Эффективность применения свежезамороженной плазмы обусловлена сохранностью в ней плазменных факторов свертывания. В отсутствие свежезамороженной плазмы возможно применение теплой донорской крови и тромбоцитов.
Инфузионная заместительная терапия проводится на фоне торможения фибринолитической активности крови за счет введения контрикала (разовая доза 25.000 ЕД, суточная – 60.000 ЕД), гордокса (разовая доза 50.000-100.000 ЕД, суточная до 500.000 ЕД).
При хронической форме ДВС-синдрома лечебные мероприятия должны быть направлены в первую очередь на нормализацию микроциркуляции (низкомолекулярные декстраны, дезагреганты, вазодилататоры и т.д.). С целью прекращения продолжающегося внугрисосудистого свертывания крови в стадии гиперкоагуляции (I стадия синдрома) при хронической форме ДВСсиндрома, которая протекает более длительно (например, при гестозах), показан гепарин. При остром течении ДВС-синдрома (преждевременная отслойка нормально расположенной плаценты, эмболия околоплодными водами) I стадия очень кратковременна, и ее трудно диагностировать, что не позволяет своевременно ввести гепарин. При II и III стадиях ДВС-синдрома, приналичии раневой поверхности применение гепарина нецелесообразно, так как он может усилить кровотечение. Гепарин необходимо использовать для профилактики тромботических осложнений в послеопера-ционном периоде.
Эмболия околоплодными водами
Клиническая картина эмболии околоплодными водами впервые описана в 1926 г., а как специальный акушерский синдром выделена в 1941 г. Околоплодные воды могут проникать в кровоток матери при повреждении плодных оболочек и плаценты, когда устанавливается прямое сообщение между полостью плодного яйца и венозной системой матки.Очень часто околоплодные воды проникают в кровоток при преждевременном вскрытии плодного пузыря, особенно в случае высокого его разрыва. При своевременном излитии околоплодных вод амниотическая жидкость может поступать в сосуды матки через эндоцервикальные вены перешейка, а также через краевые синусы плаценты.
Амниотическая жидкость может проникать в сосудистую сеть матери трансплацентарно (через дефекты плаценты), трансцервикально (через поврежденные сосуды шейки), через межворсинчатое пространство, что может быть в случае преждевременной отслойки нормально расположенной плаценты и предлежании плаценты, а также через сосуды любого участка матки при ее разрывах или во время кесарева сечения.
Непременным условием попадания амниотической жидкости в кровоток матери является повышение внутриматочного давления до величин, превышающих давление в межворсинчатом пространстве. Указанная ситуация часто создается при бурной родовой деятельности, поэтому эмболия околоплодными водами чаще наблюдается при стремительных родах, протекающих с бурными схватками и потугами, переношенной беременности, крупном плоде, тазовом предлежании, несвоевременном вскрытии плодного пузыря, ригидности шейки матки.
Чаще всего картина эмболии околоплодными водами развивается остро в конце первого и во втором периодах родов. Попадание в кровоток матери амниотической жидкости вызывает быстрое развитие шока с появлением симптомов острой сердечно-легочной недостаточности, с резким падением артериального давления, со значительным повышением центрального венозного давления за счет легочной гипертензии, снижением сердечного выброса; появляются цианоз, тахиггноэ или диспноэ. Сознание нередко спутанное, часто отмечается моторное возбуждение. При тяжелом течении могут на-блюдаться тонические и клонические судороги, отек легкого, симптомы кардиогенного шока, появляются признаки острой сердечно-легочной недостаточности. Нередко возможна молниеносная смерть от легочно-сердечной недостаточности.
Патологоанатомическим подтверждением эмболии околоплодными водами является определение амниотической жидкости в артериолах и капиллярах легких. При этом могут определяться чешуйки эпидермиса, частички казеозной смазки, меконий, слизистые субстанции содержимого кишечника. При центрифугировании содержимого из правых отделов сердца возможно разделение его на 3 слоя, верхний из которых будет состоять из околоплодных вод.
Основной причиной развития шока при эмболии околоплодными водами является раздражение интерорецепторов сосудов легких элементами амниотической жидкости и внутрисосудистыми отложениями фибриновых и тромбоцитарных микросгустков за счет поступления в кровоток околоплодных вод, обладающих тромбопластиновой активностью. В результате эмболии водами происходит блокада ретикулоэндотелиальной системы, вследствие чего она неспособна выводить продукты протеолиза, которые оказывают мощное антикоагулянтное действие.
Шок является первой стадией тромбогеморрагического синдрома. Если не наступает быстрая смерть во время шока, то через 30 мин (в отдельных случаях через 9 ч) развивается выраженная коагулопатия, кровь теряет способность к свертыванию, что особенно резко проявляется после опорожнения матки. Наступает тяжелое маточное кровотечение. Одновременно появляются геморрагические диатезы, кровотечения в области десен, в местах уколов. Состояние больной становится крайне тяжелым и обусловлено сочетанием кардиогенного шока с геморрагическим.
Лечение эмболии околоплодными водами заключается в восстановлении функции дыхания, сердечно-сосудистой системы, коагуляционных свойств крови. Восстановление дыхания осуществляется путем интубации трахеи и искусственной вентиляции легких. Для нормализации функции сердечно-сосудистой системы проводится инфузионно-трансфузионная терапия (см. лечение шока). Лечение коагуляционных осложнений осуществляется согласно принципам терапии острой формы ДВС-синдрома.
После проведения неотложных мероприятий осуществляют быстрое и бережное родоразрешение (кесарево сечение, наложение акушерских щипцов, извлечение плода за тазовый конец). При маточном кровотечении производят экстирпацию матки.
Глава 25. Акушерские операции
Акушерские операции производятся во время беременности, родов и в раннем послеродовом периоде. Акушерские операции отличаются от акушерских пособий тем, что пособия применяются во время родов и обусловлены необходимостью с помощью рук ведущего роды ускорить рождение плода через родовые пути, сохраняя по возможности естественный механизм родов (см. Ручные пособия при головном, тазовом предлежании). Акушерские операции предполагают вмешательство врача при: 1. необходимости сохранения беременности (см. Невынашивание беременности) ; 2. внематочной локализации плодного яйца (см. Внематочная беременность); 3. прерывании беременности (искусственный аборт); 4. неправильном положении плода с целью изменения положения плода в матке; 5. подготовке родовых путей к родам (рассечение тканей промежности, шейки); 6. ускорении рождения ребенка в случае возникновения угрозы для его здоровья; „ 7. патологическом течении последового и послеродового периодов.При осуществлении акушерских операций используется как влагалищный, так и абдоминальный доступы.
Многие акушерские операции проводятся по экстренным показаниям либо со стороны матери, либо со стороны плода. Поэтому знание техники акушерских операций необходимо для каждого врача, особенно для акушеров-гинекологов. В некоторых ситуациях только быстро проведенная акушерская операция может спасти жизнь матери и ребенку.
Акушерские операции производятся и в плановом порядке.
Операции, направленные на извлечение плода, называются родоразрешающими. В прошлом нередко производились родоразрешающие операции для сохранения здоровья матери вне зависимости от последующего состояния ребенка. В настоящее время приоритетное значение придается, конечно, здоровью и жизни женщины, но все меры принимаются к тому, чтобы родившийся ребенок был не только жив, но и здоров. В связи с этим наибольший удельный вес (более 95 %) среди всех родоразрешаюших операций занимает абдоминальное кесарево сечение.
Исход любой акушерской операции, особенно родоразрешающей, зависит от правильной оценки показаний и противопоказании, условий, качества оперативной техники, соблюдения правил асептики и антисептики, адекватности обезболивания.
Показания и противопоказания к акушерским операциям, наличие условий для них вьочвляются при тщательном обследовании пациенток.
Под условиями для производства акушерских операций подразумевают такое состояние половых органов матери, тканей родового канала, плода, которые позволяют произвести максимально бережно то или иное вмешательство.
В каждом отделении акушерского и гинекологического профиля должны быть в полной готовности все стерильные наборы инструментов для каждого вида операций. Упаковки наборов инструментов находятся в специальных шкафах малых и больших операционных; в них также имеется список подобных упаковок, которые при необходимости легко найти.
При выполнении акушерских операций чрезвычайно важным является соблюдение всех правил асептики и антисептики в связи с особенно благоприятными условиями для распространения и проявления инфекции как в материнском, так и в детском организме.
Все операции должны проводиться с применением обезболивания (см. Обезболивание родов). Очень важно провести перед операцией беседу с пациенткой, разъясняя ей необходимость того или иного оперативного вмешательства и его смысл. Подготовка к операции пациентки заключается прежде всего в возможно полном ее обследовании. При этом должны быть оценены состояние всех органов и систем беременной, состояние плода, проведены лабораторные исследования крови, мочи, определены группа крови, резуспринадлежность. Очень важно исключить наличие сифилиса, СПИДа, туберкулеза, урогенитальной инфекции (обычно в течение беременности такие исследования проводятся неоднократно).
Перед проведением плановой операции накануне назначают гигиенический душ, удаляют волосяной покров с наружных половых органов, ставят очистительную клизму. После 6 ч вечера беременная не принимает пищу, только пьет сладкий чай.
При экстренном вмешательстве иногда отсутствует возможность достаточно полно опорожнить кишечник и особенно желудок.
В этой ситуации для профилактики ас пи рационного синдрома необходимо применение циметидина (0,2 г внутривенно) и водорастворимого антацида (30 мл раствора 0,3 М цитрата натрия) для снижения желудочной кислотности; метоклопрамида (10 мг церукала внутривенно или внутримышечно).
После профилактических мероприятий проводится быстрое и последовательное введение в наркоз: преоксигенация в течение 5 мин с последующей быстрой интубацией трахеи в положении Фовлера. Во время интубации пережимают пищевод путем надавливания на перстневидный хрящ гортани. После интубации трахеи в желудок вводят зонд.
Абдоминальные операции производятся в операционных, которые не отличаются от обычных хирургических. Пациентку в бахилах, косынке укладывают на операционный стол. В мочевой пузырь вводят катетер. Операционное поле обрабатывают дезинфицирующим раствором и ограничивают стерильным бельем.
Влагалищные операции, как правило, осуществляются в "малых операционных". При этом женщину с согнутыми в коленях ногами укладывают на гинекологическое кресло. Наружные половые органы и влагалище обрабатывают дезинфицирующими растворами. В отсутствие гинекологического кресла пациентка может быть уложена на обычный операционный стол, в специальных гнездах которого укрепляются ногодержатели. В экстренных случаях, когда влагалищные операции производятся в домашних условиях, женщину укладывают поперек кровати, а согнутые в коленях ноги фиксируют простыней к шее.
Оперирующий, ассистент и операционная сестра обрабатывают руки, как для хирургических вмешательств, и обязательно при всех операциях надевают специальные перчатки до локтя, предназначенные для введения руки в матку.
Искусственный аборт
Искусственный аборт – хирургическое или медикаментозное вмешательство, с помощью которого производится прерывание беременности до 22 нед (раньше производился до 28 нед). Искусственное прерывание беременности производится по желанию женщины или медицинским показаниям и выполняется врачом с соблюдением правил асептики и учетом противопоказаний.По желанию женщины аборт производится в ранние сроки беременности – до 12 нед. Такой срок устаноапен в связи с тем, что при этом возможно удалить плолное яйцо с меньшим риском осложнений, чем в более поздние сроки. Прерывание беременности после 13 нед носит название позднего аборта, и методы при этом используются иные. Чем меньше срок беременности, при котором она прерывается, тем менее выражены после-дующие гормональные нарушения. Прерывание беременности в любом сроке может сопровождаться большим числом осложнений, которые трудно предвидеть и избежать (воспалительные заболевания, бесплодие, нарушения менструального цикла и т.д.). Со всеми пациентками, особенно не рожавшими, имеющими резус-отрицательную кровь, следует проводить беседу о вреде аборта. Прерывание беременности в поздние сроки проводится по медицинским, а в последнее время в целях избежания внебольничных – криминальных абортов – и по социальным показаниям.
Медицинские показания к прерыванию беременности устанавливаются комиссией в составе акушера-гинеколога, врача той специальности, к которой относится заболевание беременной, и руководителя амбулаторн о-пол и клинического или стационарного учреждения.
Согласно приказу Минздрава РФ № 302 от 28 декабря 1993 г., учитывается следующий перечень медицинских показаний к прерыванию беременности: 1. инфекционные и паразитарные болезни (туберкулез различной локализации, вирусный гепатит, сифилис, ВИЧ-инфекция, краснуха и контакт с этой инфекцией в первые 3 мес беременности); 2. злокачественные новообразования всех локализаций, 3. болезни эндокринной системы (тяжелые и средней тяжести формы диффузного токсического зоба, врожденный и приобретенный гипотиреоз, осложненный сахарный диабет, гипери гипопаратиреоз, несахарный диабет, активная форма синдрома Иценко-Кушинга, феохромоцитома); 4. заболевания кроветворной системы (гипои апластическая анемия, талассеми я, острый и хронический лейкоз, лимфогранулематоз, тромбоцитопения, геморрагический капилляротоксикоз); 5. психические расстройства (алкогольные, лекарственные, шизофренические И аффективные психозы, невротические расстройства, хронический алкоголизм, токсикомания, умственная отсталость, прием психотропных средств во время беременности); 6. болезни нервной системы и органов чувств (воспалительные болезни, на-следственные и дегенеративные болезни ЦНС, рассеянный склероз, эпилепсия, миастения, сосудистые заболевания головного мозга, опухоли мозга, отслойка сетчатки, глаукома, отосклероз, врожденная глухота и глухонемота) ; 7. болезни системы кровообращения [все пороки сердца, сопровождающиеся активностью ревматического процесса, врожденные пороки сердца, болезни миокарда, эндокарда и перикарда, нарушения ритма сердца, оперированное сердце, болезни сосудов, гипертоническая болезнь I IS – III стадии (по А.Л.Мясникову), злокачественные формы гипертонической болезни); 8. болезни органов дыхания (хроническая пневмония III стадии, бронхоэктатическая болезнь, стеноз трахеи или бронхов, состояние после пневмонэктомии или лобэктомии); 9. болезни органов пищеварения (стеноз пищевода, хронический активный гепатит, язвенная болезнь желудка или двенадцатиперстной кишки, цирроз печени с признаками портальной недостаточности, острая жировая дистрофия печени, желчнокаменная болезнь с частыми обострениями, нарушения всасывания в кишечнике); 10. болезни мочеполовой системы (острый гломерулонефрит, обострение хронического гломерулонефрита, хронический пиелонефрит, протекающий с хронической почечной недостаточностью и артериальной гипертензией, двусторонний гидронефроз, гидронефроз единственной почки, поликистоз почек, стеноз почечной артерии, острая и хроническая почечная недостаточность любой этиологии); 11. осложнения беременности, родов и послеродового периода (пузырный за-нос, перенесенный не менее двух лет назад, гестоз, не поддающийся комплексному лечению в стационаре, неукротимая рвота беременных, критическое состояние маточно-плодово-плацентарного кровотока, хорионэпителиома); 12. болезни кожи и подкожной жировой клетчатки (пузырчатка, тяжелые формы дерматозов беременных); 13. заболевания опорно-двигательной системы и соединительной ткани (остеохондропатия, ампутация руки или ноги, острое или хроническое течение системной красной волчанки, узелковый полиартериит); 14. врожденные пороки развития и наследственные заболевания (врожденная патология, установленная методом пренатальной диагностики, высокий риск рождения ребенка с врожденной, наследственной патологией, прием лекарственных средств во время беременности, оказывающих эмбриои фетотоксическое действие); 15. физиологические состояния (физиологическая незрелость – несовершен-нолетие, возраст женщины 40 лет и старше);
Следует отметить, что при наличии редких заболеваний, которые угрожают жизни беременной, вопрос о прерывании беременности решается комиссией индивидуально.
Постановлением Правительства Российской Федерации № 567 от 8 мая 1996 г. утвержден перечень социальных показаний к искусственному прерыванию беремен-ности. 1. Наличие инвалидности 1- II группы у мужа. 2. Смерть мужа во время беременности у жены. 3. Пребывание женщины или ее мужа в местах лишения свободы. 4. Признание в установленном порядке безработными женщины или ее мужа, 5. Наличие решения суда о лишении или ограничении родительских прав, 6. Женщина, не состоящая в браке. 7. Расторжение брака во время беременности. 8. Беременность в результате изнасилования. 9. Отсутствие жилья, проживание в общежитии, на частной квартире. 10. Наличие у женщины статуса беженки или вынужденной переселенки. 11. Многодетность (число детей 3 и более). 12. Наличие в семье ребенка-инвалида. 13, Доход на одного члена семьи менее прожиточного минимума, установлен-ного для данного региона.
Противопоказаниями к искусственному аборту являются острые и подострые воспалительные заболевания половых органов (воспаление придатков матки, гнойный кольпит, эндоцервицит и др.) и воспалительные процессы экстрагенитальной локализации (фурункулез, пародонтоз, острый аппендицит, туберкулезный менингит, милиарный туберкулез и др.), острые инфекционные заболевания. Вопрос о прерывании беременности в последующем решается врачом в зависимости от результатов проводимого лечения и срока беременности.
Прерывание беременности до 12 нед
Во время операции женщина находится на гинекологическом кресле. Перед операцией удаляют волосы в области лобка, опорожняют мочевой пузырь и кишечник, наружные половые органы обрабатывают дезинфицирующим раствором. Обезболивание производят с использованием внутривенного или ингаляционного наркоза.
Прерывание беременности в сроке до 5 нед (тесты на беременность, УЗИ) – мини-аборт – может быть проведено путем вакуум-аспирации содержимого полости матки в операционной женской консультации. При этом расширение шейки матки не производят, а используют канюли (металлические и полиэтиленовые) диаметром 4-6 мм. После мини-аборта следует провести ультразвуковой контроль полости матки.
В ранние сроки беременности (до 6 нед беременности) может быть применена методика медикаментозного аборта с помощью аналогов простагландинов, а также введения Ru-486 для прерывания беременности малого срока. Ru-486 – стероидный гормон, который связывается с рецепторами прогестерона. После установления беременности (определение 0-субъединицы трофобластического гормона и проведение трансвагинальной эхографии) пациентка однократно принимает 3 таблетки (600 мг) Ru-486. Через 48 ч от начала приема препарата женщине вводят внутримышечно 0,5 мг сульпростона (аналог простагландина Е2). Через 4-6 ч у 96 % пациенток происходит выкидыш. Однако необходимо учитывать противопоказания к приему Ru-486: длительная терапия кортикостероидами, нарушения в системе гемостаза, хроническая недостаточность надпочечников.
Операция удаления плодного яйца кюретками состоит из 3 этапов: 1. зондирование матки; 2. расширение канала шейки матки 3. удаление плодного яйца кюреткой. В процессе операции используют влагалищные зеркала, пулевые щипцы, маточный зонд, расширители Гегара от № 4 до № 12, петлевые кюретки № 6, 4, 2, абортцанг, пинцет, стерильный материал (рис. 25.1). Все инструменты раскладывают на операционном столике в порядке, соответствующем таковому при их применении.

 Рис. 25.1. Инструментарий для искусственного аборта.
1 – расширители Гегара;
2 – кюретка;
3 – абортцанг.
Рис. 25.1. Инструментарий для искусственного аборта.
1 – расширители Гегара;
2 – кюретка;
3 – абортцанг.
После обработки наружных половых органов дезинфицирующим раствором во влагалища вводят зеркала и обрабатывают влагалищную часть матки. После этого шейку захватывают пулевыми щипцами за переднюю губу. Переднее зеркало удаляют, заднее передают ассистенту, сидящему слева, который удерживает зеркало, способствуя расширению влагалища. /Для выпрямления шеечного канала шейку подтягивают книзу и кзади (при положении матки в anteflexio) и кпереди (при положении матки в retroflexio). Затем в полость матки вводят маточный зонд для уточнения положения матки и измерения длины ее полости. Кривизна маточного зонда и глубина его введения определяют направление введения расширителей Гегара до № 11 – 12. Расширители вводят последовательно и несколько дальше внутреннего зева (рис. 25.2). Последовательное введение расширителей способствует растяжению мускулатуры шейки, однако попытка фиксированного введения расширителей может привести к разрывам и перфорации шейки и тела матки. Каждый расширитель удерживают тремя пальцами с тем, чтобы с большей осторожностью проходить внутренний зев и прекращать движение его сразу же после преодоления сопротивления зева. Если возникает трудность во введении расширителя Гегара последующего номера, следует вернуться к предыдущему, захватить пулевыми щипцами заднюю губу шейки матки и удержать в шейке некоторое время расширитель.
 Рис. 25.2. Искусственный аборт. Расширение канала шейки матки расширителями Гегара.
а – общий вид спереди; б – вид сбоку (схема).
Рис. 25.2. Искусственный аборт. Расширение канала шейки матки расширителями Гегара.
а – общий вид спереди; б – вид сбоку (схема).
 Рис. 25.3. Искусственный аборт. Удаление плодного яйца кюреткой.
Рис. 25.3. Искусственный аборт. Удаление плодного яйца кюреткой.
После расширения шейки разрушение и удаление плодного яйца производят с помощью кюреток (рис. 25.3) и абортцанга, если срок беременности не превышает 12 нед. Абортцангом удаляют части плодного яйца из полости матки. Выскабли-вание стенок матки начинают тупой кюреткой № 6 и затем по мере сокращения матки и уменьшения ее размеров используют более острые кюретки меньшего размера. Кюретку осторожно вводят до дна матки и движениями по направлению к внутреннему зеву последовательно по передней, правой, задней и левой стенкам производят отделение плодного яйца от его ложа. Одновременно отделяют и удаляют отпадающую оболочку. Проверив острой кюреткой область трубных углов, заканчивают операцию.
При отслойке плодного яйца возникает кровотечение, но кровопотеря обычно не превышает 50-75 мл. Если плодное яйцо удалено полностью, то появляется ощущение хруста, матка хорошо сокращается и кровотечение останавливается. Полноту опорожнения матки от элементов плодного яйца можно контролировать с помощью УЗИ.
Инструментальное удаление плодного яйца в сроки 6-12 нед можно производить посредством вакуум-экекохлеации. Вакуум-экскохлеацию используют при сроке беременности не более 9-10 нед. Вакуум-экскохлеатор – это система, состоящая из металлической кюретки цилиндрической формы с овальным отверстием на конце, резинового шланга, соединенного с вакуум-отсосом и резервуаром. После расширения канала шейки матки с помощью расширителей Гегара в матку вводят канюлю, включают электронасос и создают в матке отрицательное давление 0,5-0,6 атм. Осторожными круговыми движениями последовательно обходят все стенки матки. В результате плодное яйцо разрушается, отслаивается, аспирируется и через канюлю и шланг поступает в стеклянную банку. Метод вакуум-аспирации является более щадящим, чем удаление яйца кюретками петлевидной формы.
После операции женщине на низ живота кладут пузырь со льдом и вводят сокращающие матку средства. Выписка больной после операции искусственного аборта определяется врачом. При выписке из стационара производят влагалищное исследование для определения состояния матки и ее придатков.
Прерывание беременности в поздние сроки
Для прерывания беременности в поздние сроки (13-22 нед) применяют следующие методы: возбуждение сократительной деятельности матки, интраи экстраамниальное введение гипертонических растворов или простагландинов, малое абдоминальное и влагалищное кесарево сечение.
С целью возбуждения сократительной деятельности матки используют витаминоглюкозокальциевый фон. Для расширения канала шейки матки применяют также простагландины и ламинарии. Ламинарии представляют собой сухие морские водоросли, которые во влажной теплой среде значительно увеличиваются в объеме. Ламинарии в виде палочек различного диаметра вводят в цервикальный канал и оставляют на 6-8 ч. Введение в канал шейки матки простагландинов F2a и Е2 на марлевой турунде, а также в виде геля или таблеток способствует созреванию шейки матки, изменению консистенции, размягчению и растяжению ее в течение нескольких часов, сокращению матки. При этом выкидыш наступает через несколько часов.
Если изгнания плода не происходит, то для стимуляции сокращений матки внутривенно вводят окситоцин, простагландины, обезболивающие и спазмолитические средства. Через 30-40 мин от начала введения указанных растворов развиваются сокращения матки. Вскрытие плодного пузыря це-лесообразно производить при установившейся регулярной сократительной деятельности и раскрытии шеечного канала или маточного зева на 2 см и более.
Наиболее распространенным методом прерывания беременности во II триместре является внутриамниалъное введение 20 % {гипертонического) раствора хлорида натрия и простагландинов.
Гипертонический раствор вводится из расчета 10 мл на каждую неделю беременности. Более точным подсчетом необходимого количества гипертонического раствора является измерение объема выводимых околоплодных вод. Раствор следует вводить медленно, в количестве, на 20-30 мл меньшем, чем выводится. Гипертонический раствор вводят путем трансабдоминального, трансцервикального и трансвагинального амниоцентеза. Операцию производят под контролем ультразвукового сканирования. При расположении плаценты на передней стенке матки предпочтительнее использовать трансцервикальный или трансвагинальный способ. При трансвагинальном способе иглу вводят в складку у места прикрепления свода влагалища к шейке матки и проводят параллельно цервикальному каналу. Латентный период от момента введения раствора до появления схваток колеблется в среднем от 17 до 21 ч.
После рождения плода и последа производят контрольное инструментальное обследование стенок матки под контролем эхографии.
Любой способ введения гипертонического раствора не безопасен, так как известны случаи попадания раствора в ткани матки с последующим их некрозом. Противопоказаниями к введению гипертонического раствора являются заболевания почек, гипертоническая болезнь.
Более эффективным по сравнению с внутриамниальным введением раствора хлорида натрия является использование простагландинов. С этой целью тонкой иглой в околоплодные воды вводят 40-59 мг простагландина F2a: первые 5 мг медленно-для определения чувствительности к нему, остальные 35-45 мг – в течение последующих 5 мин. При введении простагландинов выведения околоплодных вод не требуется. Возможно также экстраамниальное введение простагландина – через цервикальный канал специальным катетером в область нижнего сегмента медленно заоболочечно вводят простагландин. Противопоказания к применению простагландинов те же, что и к введению гипертонического раствора.
Кесарево сечение (влагалищное и абдоминальное) применяется, когда возникают противопоказания к применению консервативного метода прерывания беременности: при сочетании беременности со злокачественными образованиями, когда после кесарева сечения удаляется матка.
Влагалищное кесарево сечение в настоящее время практически не применяется, так как является довольно травматичной операцией. Оно заключается в рассечении переднего свода влагалища, отсепаровке мочевого пузыря кверху, разрезе шеечно-перешеечного отдела матки, удалении плода и плаценты, зашивании раны матки и влагалища.
Техника абдоминального кесарева сечения (малое кесарево сечение) не отличается от таковой при поздних сроках беременности (см. Кесарево сечение). Разрез на матке проводят либо в истмикоцервикальном отделе после вскрытия пузырно-маточной складки, либо в теле матки по средней линии. Малое кесарево сечение неблагоприятно сказывается на функции матки при последующих родах, так как нередко в области разреза матки образуется рубцовая ткань.
Осложнения во время и после прерывания беременности в ранние и поздние сроки
Во время и после прерывания беременности в ранние и поздние сроки могут возникнуть следующие осложнения: 1. внутрибрюшное кровотечение, обусловленное перфорацией' Матки, иногда с ранением сосудистого пучка; 2. кровотечения из матки; 3. воспалительные заболевания органов малого таза; 4. нарушение менструального цикла; 5. бесплодие.
К наиболее опасным осложнениям искусственного аборта относятся перфорация стенки матки, приводящая к внутрибрюшному кровотечению при ранении сосудистого пучка и перитониту при ранении органов брюшной полости (мочевого пузыря, кишечника, сальника). Прободение матки может быть результатом как невнимательности и неосторожных действий врача, так и наличия факторов риска у пациентки: неоднократные, особенно частые, аборты в анамнезе, рубец на матке после кесарева сечения или вылущивания миоматозного узла, анатомические особенности полового аппарата, воспалительные заболевания матки и придатков.
При перфорации матки необходимо обратить внимание на следующие моменты: на каком этапе операции произведена перфорация, каким инструментом (зондом, расширителем, кюреткой, абортцангом), не произошло ли ранения сосудистого пучка или органов брюшной полости.
Прободение матки, как правило, диагностируется врачом во время производства аборта: инструмент легко входит на большую глубину, чем размеры матки. Но иногда перфорация матки остается незамеченной, и в последующем через несколько дней появляются симптомы перитонита. При перфорации матки абортцангом чаще наблюдается повреждение кишечника (рис. 25.4, а, б). Иногда этим инструментом извлекается петля кишки из матки. При перфорации матки в нижних отделах и повреждении сосудов образуется гематома между листками широких связок (в параметрии). При этом могут быть боли внизу живота слева или справа. При двуручном исследовании гематома пальпируется как образование с нечеткими контурами эластической консистенции, интимно прилегающее к матке. Более точные данные выявляются при УЗИ. Как только обнаружена перфорация, операция должна быть прекращена.
Помимо перфорации матки, в процессе аборта может быть нарушение целостности шейки в области внутреннего зева, что способствует образованию шеечно-влагалищного свища (последующие роды могут происходить через свищевое отверстие). Нередко происходят разрывы шейки матки в области наружного зева. Травмы шейки приводят к развитию гинекологических заболеваний, вплоть до рака шейки матки, невынашиванию беременности.
Большинство гинекологов придерживаются мнения, что во всех случаях прободения матки во время искусственного аборта показана лапароскопия или чревосечение, а объем оперативного вмешательства определяется в зависимости от ситуации в ходе операции. Если перфорация произошла незадолго до операции, то даже при значительном дефекте матки следует его ушить, сохранив матку. При длительном периоде, прошедшем с момента аборта, или при воспалительном процессе в матке ее приходится удалять. Обязательно следует осуществлять ревизию кишечника и при его повреждении произвести соответствующую операцию, лучше с участием хирурга.
 Рис. 25.4. Осложнения искусственного аборта.
а – перфорация матки кюреткой; б – перфорация матки абортцангом и захват петли кишки.
Рис. 25.4. Осложнения искусственного аборта.
а – перфорация матки кюреткой; б – перфорация матки абортцангом и захват петли кишки.
Необходимо также во время операции проверить целостность мочевого пузыря.
Гематому в параметрии лучше удалить путем пункции через задний свод влагалища под контролем УЗИ или при лапаротомии. Небольшие гематомы в последующем рассасываются. В случае нагноения гематомы производится чревосечение, и объем операции зависит от ситуации. Иногда приходится удалять матку с последующим дренированием забрюшинного пространства.
В то же время имеется и другое мнение. Если перфорация произведена зондом или расширителем малого размера и нет признаков внутрибрюшного кровотечения, то возможно наблюдение за больной без оперативного вмешательства. Следят за общим состоянием пациентки (АД, пульс, цвет кожных покровов) и состоянием живота (болезненность, симптом раздражения брюшины). На следующий день опытный врач может произвести аборт с соблюдением всех мер предосторожности и лучше с одновременным использованием УЗИ.
Кровотечения из матки в ходе выполнения искусственного аборта обусловлены нарушением сократительной функции матки, неполным удалением остатков плодного яйца, плацентарным полипом. Если кровотечение начинается в период производства аборта, то следует ввести пациентке сокращающие матку средства (внутримышечно окситоцин или внутримышечно эрготамин). Одновременно необходимо ускорить удаление плодного яйца. В редких случаях кровотечение не останавливается и переходит в профузное, приводя к геморрагическому шоку. В этих случаях требуется четкое и быстрое выполнение гинекологической операции по остановке кровотечения (перевязка подчревных сосудов, удаление матки) с параллельным оказанием анестезиологического пособия и проведением инфузионнотрансфузионной терапии.
Если при искусственном аборте в матке остаются части плодного яйца или образуется плацентарный полип из оставшихся ворсин хориона на ограниченном участке, то кровянистые выделения из половых путей (иногда в небольшом количестве, иногда обильные) продолжаются в течение длительного времени. Женщина может жаловаться на схваткообразные боли. При двуручном исследовании определяется раскрытие наружного зева шейки матки. Матка мягковатая, несколько больше, чем в норме, на пальцах исследующего могут быть обрывки тканей. В отсутствие инфицирования болезненности при исследовании нет. При УЗИ полость матки расширена и в ней определяются разрозненные структуры с различной эхоплотностью. Лечение заключается в удалении остатков плодного яйца путем выскабливания кюреткой, предпочтительнее под контролем УЗИ. Целесообразно применение антибиотиков, особенно при симптомах инфицирования.
С целью профилактики неполного удаления плодного яйца необходимо, особенно у нерожавших, относиться к аборту как к серьезному оперативному вмешательству и проводить его специалистами высокой квалификации. Если операцию проводит молодой врач, то его должен контролировать более опытный. У первобеременных аборт должен проводиться под контролем УЗИ и/или гистероскопии. В процессе аборта при сроке беременности 10-12 нед собирают на салфетке удаленные части плода: головку, конечности и т.д., чтобы убедиться в его полном удалении.
Среди инфекционных осложнений после искусственного прерывания беременности от 11 до 30 % составляет острый эндометрит, развитие которого возможно по двум вариантам: на фоне остатков плодного яйца или в отсутствие их. Более тяжелые формы клинического течения острого эндометрита, как правило, обусловлены превалированием в микрофлоре матки аэробно-анаэробных ассоциаций. Частота острого эндометрита зависит от метода и срока прерывания беременности, адекватности обезболивания, степени кровопотери. К предрасполагающим факторам относят наличие в анамнезе искусственных абортов, хронических воспалительных заболеваний половых органов, а также хронических экстрагенитальных заболеваний инфекционно-аллергической природы. Лечение острого эндометрита должно осуществляться в условиях стационара. При обнаружении остатков плодного яйца в матке на фоне антибактериальной и инфузионной терапии их удаляют и промывают полость матки 3 % раствором диоксидина. Операцию рекомендуется производить под контролем УЗИ, а еще лучше – гистероскопии. В дальнейшем продолжают интенсивную противовоспалительную, дезинтоксикационную, противоаллергическую, иммунокорригирующую терапию. При своевременно начатой терапии существенно снижается риск перехода острого процесса в хронический, а также развития последующих тяжелых инфекционных осложнений: сальпингоофоритов, параметритов, пельвиоперитонита, сепсиса, септического шока. Заболевание, при котором инфекция из матки распространяется по лимфатическим путям в околоматочную клетчатку, называют параметритом. Процесс может быть односторонним, двусторонним, при тяжелом течении может быть вовлечена вся околоматочная клетчатка. Для параметрита характерны признаки, наблюдающиеся при воспалительном процессе соединительной ткани. Постепенно распространяясь по тазовой клетчатке, воспалительный инфильтрат может достичь костей малого таза. Показана антибактериальная и инфузионная терапия. При нагноении инфильтрата производят пункцию абсцесса с последующей кольпотомией.
Распространение воспалительного процесса на тазовую брюшину после перфорации матки, а также при наличии воспалительного процесса в параметрии и придатках матки приводит к развитию пельвиоперитонита и перитонита. Необходимо дифференцировать местный пельвиоперитонит и распространенный перитонит, так как возможна принципиальная разница в тактике лечения этих состояний. При перфорации кишечника перитонит развивается быстро и течение его чрезвычайно тяжелое.
Одни из самых тяжелых процессов генерализации инфекции после аборта – сепсис и септический шок. При септическом шоке летальность достигает 20-80 %. Септический шок наступает остро (см. Септический шок).
Нарушение менструальной функции. Бесплодие. Нарушение менструальной функции после аборта может быть обусловлено как механическими, так и функциональными причинами. Механические факторы приводят к отсутствию менструаций (аменорея) в течение нескольких месяцев, а иногда и более длительного времени. Это связано либо с чрезмерным удалением слизистой оболочки и длительным ее восстановлением, либо с заращением шеечного канала. Последнее может сопровождаться гематометрой (скопление менструальной крови в матке в течение нескольких месяцев). Диагностировать заращение шеечного канала несложно: жалобы на боли внизу живота в дни менструаций, аменорея. При влагалищном исследовании и УЗИ определяется увеличение матки. На эхограмме выявляются расширенная полость матки, особенно ее переднезадний размер, скопление в полости матки структур различной эхогенности (кровь и/или сгустки). Лечение за-ключается в бужировании шеечного канала расширителями Гегара и опорожнении при этом матки. Назначают антибиотики.
Операции в последовом и послеродовом периодах
В последовом и раннем послеродовом периодах операции направлены на остановку кровотечения из половых путей и восстановление целостности поврежденных органов и тканей.К операциям, производимым в последовом и раннем послеродовом периодах, относятся: 1. ручное отделение плаценты и выделение последа; 2. ручное обследование полости матки; 3. выскабливание послеродовой матки; 4. ушивание разрывов родовых путей (см. Материнский травматизм); 5. ампутация и экстирпация матки.
Ручное отделение плаценты и выделение последа.
Показаниями к операции являются: 1. Кровотечение в третьем периоде родов, зависящее от нарушений отделения и выделения последа; 2. Задержка последа в полости матки свыше 30-40 мин даже в отсутствие кровотечения;? 3. Задержка в полости матки частей плаценты.
Техника операции. Ручное отделение плаценты и выделение последа проводят под обезболиванием (см. Обезболивание родов). Проведение операции без обезболивания способствует развитию травматического шока.
Положение беременной при этой операции на операционном столе такое же, как и при других влагалищных операциях.
Руки врача и наружные половые органы женщины обрабатывают дезинфицирующим раствором. Применяют стерильные перчатки.
После опорожнения мочевого пузыря левой рукой разводят половые губы. Во влагалище вводят сложенную конусообразно правую руку ("рука акушера"), после чего левую руку помещают на дно матки (рис. 25.5). "Внутреннюю" правую руку вводят в полость матки, следуя по пуповине до места прикрепления пуповины к плаценте, и по плодовой поверхности перемещают до ее края. Достигнув края плаценты, вытянутыми, плотно прилегающими друг к другу пальцами, ладонной поверхностью, обращенной к плаценте, тыльной – к плацентарной площадке, пилообразными движениями бережно отслаивают плаценту от плацентарной площадки до полного ее отделения. "Наружной" (левой) рукой при этом оказывают умеренное давление на отдел матки над плацентарной площадкой, где производится отслойка плаценты.
При отделении плаценты правая рука может втягивать амниотические оболочки в пространство между плацентой и плацентарной площадкой. В результате этого отслойка плаценты производится рукой, одетой оболочками.
После полного отделения плаценты левой рукой подтягиванием за пуповину удаляют послед из матки. Правой рукой, которая остается в матке, тщательно проверяют стенки матки, особенно плацентарную площадку, которая представляет собой возвышение с шероховатой поверхностью вследствие оставшихся обрывков губчатого слоя децидуальной оболочки. Остальная внутренняя поверхность матки гладкая.
 Рис. 25.5. Ручное отделение плаценты.
При обследовании стенок матки удаляют обнаруженные оставшиеся кусочки плацентарной ткани или оболочки.
Рис. 25.5. Ручное отделение плаценты.
При обследовании стенок матки удаляют обнаруженные оставшиеся кусочки плацентарной ткани или оболочки.
В случае необходимости, если сократительная способность матки нарушена, проводят наружно-внутренний массаж матки на кулаке. Послесокращения матки руку из нее удаляют.
Если в ходе операции отделение плаценты от плацентарной площадки невыполнимо из-за глубокого врастания ворсин в толщу матки, необходимо прекратить операцию и произвести надвлагалищную ампутацию или экстирпацию матки.
В послеоперационном периоде на переднюю брюшную стенку в области локализации матки кладут пузырь со льдом, назначают антибиотики, утеротонические препараты.
Ручное обследование матки.
Показаниями к операции являются: 1. Дефекты плаценты или плодных оболочек. 2. Контроль целостности матки после оперативных вмешательств, длительных родов. 3. Гипотонические и атонические кровотечения. Условия этой операции не отличаются от условий предыдущей (ручное отделение плаценты и удаление последа).
Техника операции. После катетеризации и опорожнения мочевого пузыря левой рукой раздвигают половые губы. Правую руку, сложенную в виде конуса, вводят во влагалище, а затем в полость матки. Левую руку помещают на переднюю брюшную стенку и стенку матки снаружи. Правой рукой, расположенной в матке, проводят контроль стенок, плацентарной площадки, маточных углов. При обнаружении долек, обрывков пла-центы, оболочек их удаляют рукой. При выявлении дефектов стенки матки руку выводят из полости и производят чревосечение, ушивание разрыва или удаление матки.
В послеоперационном периоде проводят те же мероприятия, что и при ручном отделении плаценты и выделении последа.
Выскабливание послеродовой матки.
Показания: позднее послеродовое кровотечение.
Техника операции. Под обезболиванием после обработки родовых путей шейку матки обнажают ложкообразными зеркалами, шейку матки фиксируют пулевыми щипцами и низводят книзу. При необходимости расширяют цервикальный канал расширителями Гегара. В полость матки вводят тупую кюретку и производят выскабливание всех стенок. Выскабливание матки в послеродовом периоде целесообразно проводить под контролем УЗИ и гистероскопии.
После выскабливания пулевые щипцы снимают с шейки матки. Во время операции проводят инфузионную терапию, гемотрансфузию по показаниям, вводят утеротонические препараты. В послеоперационном периоде назначают лед (местно), антибактериальную терапию.
Операции, подготавливающие родовые пути
Во время родов нередко прибегают к операциям, которые способствуют усилению сократительной деятельности матки, снижению травмы плода. Их условно объединяют в раздел операций, подготавливающих родовые пути.В прошлом с целью предотвращения несвоевременного излития околоплодных вод при тазовом предлежании плода и усиления сократительной деятельности матки прибегали к введению во влагалище резинового баллона (кольпейринтера), который затем заполняли стерильным изотоническим раствором хлорида натрия (физиологическим раствором). Операция называлась кольпейриз. Вследствие недостаточной эффективности и опасности инфицирования в настоящее время метод не применяют.
В нашей стране не используют также метрейриз – введение резинового баллончика (метрейринтера) через шеечный канал в полость матки. Метод эффективен в плане усиления родовой деятельности, но опасен из-за инфицирова ния.
Чрезвычайно редко используют кожно-головные щипцы для усиления сокращения матки. Их можно применить только на мертвом или нежизнеспособном плоде. Операция заключается в том, что при раскрытии зева матки не менее 2 см и в отсутствие плодного пузыря под контролем руки вводят двузубые щипцы к головке и захватывают ее ткани, к щипцам привязывают бинт, к которому подвешивают груз массой 300-500 г. Направление тяги определяется положением головки. Если она находится во входе в малый таз, то тяга осуществляется кзади (бинт опускают между польстерами кровати), если в полости – то книзу (через ножной конец кровати).
В процессе родов с целью ускорения родов и уменьшения травмы плода прибегают к рассечению шейки матки и промежности (см. Родовой травматизм).
Искуственный разрыв плодного пузыря (амниотомия)
Показания к искусственному разрыву плодного пузыря могут быть самые разнообразные. Чаще всего амниотомия осуществляется при полном или почти полном раскрытии шейки матки (плотные плодные оболочки и задержка разрыва их); перед родоразрешающими операциями; при низком расположении или краевом предлежании плаценты с целью предотвращения отслойки плаценты и кровотечения (см. предлежание плаценты); при многоводии; при необходимости родовозбуждения. Вскрывать плодный пузырь приходится иногда до начала родовой деятельности с целью родовозбуждения, когда шеечный канал пропускает 1-2 пальца.Вскрыть плодные оболочки можно либо с помощью пальца, либо с помощью бранши пулевых щипцов. Предпочтительнее для пациентки лежать на гинекологическом кресле, но возможно провести эту манипуляцию в постели, в положении пациентки на спине с приподнятым тазом и согнутыми в коленях ногами. После обработки наружных половых органов дезинфицирующим раствором вводятся два пальца в перчатках во влагалище и в период схватки вскрываются оболочки плодного пузыря. Если пальцем не удается произвести эту манипуляцию, то левой рукой берется бранша пулевых щипцов и под контролем пальцев правой руки, введенной во влагалище, инструмент подводится к нижнему полюсу пузыря, и им производится рассечение оболочек (под контролем правой руки!).
После вскрытия плодного пузыря рука остается во влагалище, чтобы в случае выпадения петли пуповины с изливающимися водами осуществлять своевременную диагностику. Кроме того, следует снять оболочки с предлежащей части и определить более точно характер предлежащей части.
Операции, исправляющие положение и предлежание плода (акушерский поворот)
Акушерский поворот направлен на обеспечение положения или предлежания плода, более выгодного для исхода родов. Различают наружный акушерский поворот и наружно-внутренний – комбинированный. Наружный акушерский поворот производят во время беременности; его называют профилактическим. Комбинированный наружно-внутренний поворот производят при наличии родовой деятельности, и он может быть осуществлен при полном (классический) и неполном (операция Брекстона-Гикса) раскрытии маточного зева.Наружный акушерский поворот. Наружный акушерский поворот на головку при тазовом предлежании прошел этапы увлечения и разочарования. Он был предложен Б.А.Архангельским (1941) и после этого обрел сначала сторонников, а затем и противников, так как при этом наблюдались такие осложнения, как преждевременная отслойка нормально расположенной плаценты, преждевременные роды. Эффективность поворота была невелика (рекомендовалось проводить его в 34-36 нед): после успешного поворота часто вновь отмечалось тазовое предлежание.
В последние годы в связи с внедрением в практику УЗИ и В-адреномиметиков вновь проявляют интерес к наружному акушерскому повороту на головку. УЗИ дает возможность проследить за перемещением плода, а введение р-адреномиметиков способствует расслаблению мускулатуры матки.
Наружный акушерский поворот, как правило, предусматривает перевод плода в головное предлежание при косом и поперечном положении его, а также при тазовом предлежании. Однако в некоторых случаях, особенно у многорожавших, при перерастянутой матке косое и поперечное положение плода легче переводится в тазовое предлежание.
При выполнении наружного акушерского поворота необходимо четко определить расположение плода в матке (это достигается с помощью УЗИ) и соблюдать условия для данной операции: 1. удовлетворительное состояние беременной и плода; 2. подвижность плода в матке; 3. наличие одного плода; 4. нормальное расположение плаценты; 5. нормальные размеры таза.
Противопоказаниями к наружному акушерскому повороту являются экстрагенитальные заболевания (артериальная гипертензия, тяжелые сердечно-сосудистые заболевания, заболевания почек), осложнения во время беременности (гестоз, угроза преждевременных родов, многоводие, маловодие, аномалии расположения плаценты, крупный плод), изменения родовых путей (сужение размеров таза, рубец на матке, миома матки). Перед проведением операции важно объяснить беременной цель и сущность производимых манипуляций.
Подготовка к операции заключается в опорожнении кишечника и мочевого пузыря. Для производства операции беременную укладывают на кушетку. Операцию наружного акушерского поворота необходимо осуществлять под контролем УЗИ. За 20 мин до проведения операции поворота на головку при тазовом предлежании плода беременной начинают внутривенное капельное введение р-адреномиметиков, которое продолжают во время поворота.
Поворот плода лучше всего осуществлять в срок 37-38 нед беременности. Если возникают трудности при повороте, то силой преодолевать их не следует.
Техника поворота на головку при тазовом предлежании плода. Операцию следует производить двумя руками. Одну руку располагают на тазовом конце, вторую – на головке (рис. 25.6, а, б).
При первой позиции плода тазовый конец отводят влево, при второй позиции – вправо. Необходимо планомерно, нежно и постепенно смещать тазовый конец плода по направлению к спинке, спинку – по направлению к головке, а головку – ко входу в таз. После успешного поворота в 80 % случаев происходят роды в головном предлежании, у остальных сохраняется тазовое предлежание.
Техника наружного поворота при поперечном и косом положении плода. Как правило, при поперечном и косом положении плода поворот осуществляется на головку. Акушер располагает руки на головке и тазовом конце, головку смещает ко входу в таз, а тазовый конец – к дну матки. Если спинка плода обращена ко входу в таз, то сначала создают тазовое предлежание (чтобы не привести к разгибательному предлежанию головки), а затем поворотом на 270° – головное.
 Рис. 25.6. Наружный профилактический поворот на головку.
а – правая рука отводит тазовый конец, левая захватывает головку, сохраняя ее в согнутом положении; б – смещение ягодиц вверх, головки вниз.
Рис. 25.6. Наружный профилактический поворот на головку.
а – правая рука отводит тазовый конец, левая захватывает головку, сохраняя ее в согнутом положении; б – смещение ягодиц вверх, головки вниз.
Комбинированный наружно-внутренний поворот в отличие от наружного называют еще внутренним. Комбинированный акушерский поворот производится на тазовый конец, чаще на ножку при использовании двух рук акушера, одну из которых вводят в матку за внутренний зев, а второй снаружи помогают этой операции. В случае полного раскрытия зева в матку вводят всю руку (классический поворот), при неполном раскрытии – 2 пальца (поворот по Брекстону Гиксу).
Классический поворот плода на ножку. Некоторые акушеры в отличие от наружного поворота относят классический поворот к внутреннему, так как одну руку акушер вводит внутрь матки. Хотя этот поворот по существу является комбинированным: одна рука внутри матки активно поворачивает плод, а вторая рука снаружи также оказывает не менее активные движения.
Классический поворот на ножку при полном открытии зева производят, как правило, при поперечном, косом положении плода и реже при головном предлежании.
В современном акушерстве при поперечном положении жизнеспособного плода чаще производят кесарево сечение, так как классический поворот является далеко не безопасной операцией для ребенка. Однако если повторнородящая с плодом небольших размеров, полным раскрытием зева и целыми или только излившимися водами поступает в родовспомогательное учреждение, то ей возможно произвести классический поворот плода на ножку. Эта операция сохраняется в акушерской практике при необходимости извлечения второго плода из двойни в случае его поперечного положения. К повороту плода на ножку второго плода из двойни приходится прибегать и при головном предлежании, если вследствие начавшейся гипоксии необходимо срочно извлечь плод из матки.
При производстве классического поворота плода на ножку чрезвычайно важно учитывать условия и противопоказания.
Условия: 1. полное или почти полное раскрытие маточного зева; 2. подвижность плода; 3. плодный пузырь либо цел, либо только что произошло его вскрытие; 4. размеры плода должны соответствовать размерам таза матери.
Противопоказаниями к классическому повороту плода на ножку являются: 1. потеря подвижности плода вследствие излития околоплодных вод – запущенное поперечное положение плода; 2. наличие рубцовых изменений на матке; 3. угрожающий разрыв матки; 4. сужение размеров таза; 5. изменения мягких родовых путей матери, препятствующие рождению ребенка (низко расположенный миоматозный узел и др.).
Операцию поворота плода на ножку производят только под наркозом, который обеспечивает расслабление мышц матери и передней брюшной стенки.
Врач обрабатывает руки, как при всех акушерских операциях, надевает длинные перчатки. Обрабатывают наружные половые органы и влагалище роженицы, которую укладывают на гинекологическое кресло.
Техника операции. Операция состоит из трех этапов: 1. введение руки врача в матку 2. нахождение и захват ножки плода 3. собственно поворот плода.
Этап I начинается с выбора руки акушера. Большинство используют руку, которая является более сильной, – чаще правую, для введения ее в полость матки. Но предлагается и другое правило: при первой позиции (головка слева) – введение левой руки, при второй (головка справа) – правой. Для облегчения введения руки в родовые пути левой рукой раздвигают малые половые губы, а правую руку с вытянутыми и собранными вместе пальцами – рука акушера (рис. 25.7, а) – вводят во влагалище, надавливая на заднюю стенку его. Во избежание травматизации тканей наружных половых органов и влагалища кисть руки вводят в прямом размере входа в таз, затем осторожно продвигают в полость матки. Руку следует вводить вне схватки. Если плодный пузырь цел, то его вскрывают и руку тут же вводят в матку, чтобы избежать выпадения пуповины. Левую руку перемещают на дно матки снаружи.
 Рис. 25.7. Комбинированный поворот плода на ножку.
а – кисть внутренней руки складывается в виде "руки акушера"; б – ножка захва-чена всей рукой; в – ножка захвачена двумя пальцами.
Рис. 25.7. Комбинированный поворот плода на ножку.
а – кисть внутренней руки складывается в виде "руки акушера"; б – ножка захва-чена всей рукой; в – ножка захвачена двумя пальцами.
Этап II состоит в нахождении ножки. Этому способствует рука, расположенная снаружи, которой при необходимости подводят к дну матки головку и подают тазовый конец к внутренней руке. Обычно захватывают одну ножку, а выбирают ее в зависимости от вида. При переднем виде (спинка кпереди) захватывают нижележащую ножку, а при заднем (спинка кзади) – вышележащую. При правильном выборе ножек поворот заканчивается образованием переднего вида тазового предлежания. Если обнаружится задний вид, то приходится переводить его в передний.
Для отыскания ножек существует короткий и длинный путь. При коротком пути врач направляет находящуюся внутри матки руку сразу же к предполагаемому месту расположения ножки. При длинном пути внутренняя рука скользит по краю туловища сначала к бедру, а от бедра к стопе. Важно отличить ножку плода от ручки. Кисть ручки от стопы отличается наличием более длинных пальцев и отстоящим от кисти большим пальцем. Если вместо ножки извлекается ручка, то на нее надевают марлевую петлю и нежно отводят в сторону головки. Ножку захватывают за голень чаще всего кистью, что более удобно в плане дальнейшей манипуляции и менее травматично для плода (рис. 25.7, б). При захвате ножки за голень большой палец руки не должен доходить до подколенной ямки, тем более ее сдавливать. Реже голень захватывают в области лодыжки II и III пальцем (рис. 25.7, в). Последний способ захвата голени может привести к перелому голени при этом рука оперирующего быстро устает.
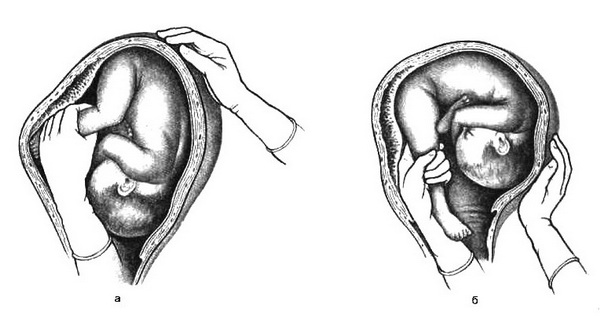 Рис. 25.8. Классический поворот плода на ножку.
а – при головном предлежании; б – при поперечном положении плода.
Рис. 25.8. Классический поворот плода на ножку.
а – при головном предлежании; б – при поперечном положении плода.
Обнаружению и захвату ножки помогают рукой, расположенной снаружи, которой отодвигают головку, а тазовый конец приближают к внутренней руке.
Этап III – непосредственно поворот плода, осуществляемый с помощью двух рук (рис. 25.8). "Внутренней" рукой подтягивают ножку сначала к внутреннему зеву матки, а затем выводят ее из влагалища, а "наружной" рукой энергично отводят головку к дну матки. Поворот считается законченным, когда ножка плода выведена из влагалища до коленного сустава, а плод принял продольное положение. Весьма целесообразно проводить комбинированный поворот плода на ножку под контролем УЗИ.
После поворота живого плода на ножку приступают к извлечению плода за тазовый конец (см. Тазовые предлежания). При мертвом и нежизнеспособном плоде роды в дальнейшем могут быть самостоятельными.
При повороте плода на ножку могут возникать осложнения как со стороны матери, так и со стороны плода: 1. разрыв матки 2. гипоксия, травма плода, вплоть до его гибели.
Во избежание разрыва матки не следует насильственно преодолевать сопротивление матки при повороте плода. Следует углубить наркоз или перейти к операции кесарева сечения. В случае гибели плода показана плодоразрушающая операция.
 Рис. 25.9. Щипцы Чемберлена.
Рис. 25.9. Щипцы Чемберлена.
 Рис. 25.10. Щипцы Пальфина.
Рис. 25.10. Щипцы Пальфина.
Акушерские щипцы
Акушерскими щипцами (forceps obstetricia) называется инструмент, предна-значенный для извлечения за головку живого доношенного или почти доношенного плода при необходимости срочно закончить второй период родов.Акушерские щипцы были изобретены П.Чемберленом (P.Chamberlen, Англия) в конце XVI столетия (рис. 25.9). Изобретение долго держалось в строгом секрете.
Спустя 125 лет (1723) щипцы были вторично изобретены Пальфином (J.Palfyn, Франция) и немедленно обнародованы в Парижской медицинской академии, поэ-тому изобретателем щипцов справедливо считается Пальфин. Инструмент и его применение быстро получили повсеместное распространение (рис. 25.10).
В России щипцы были впервые наложены в Москве И.В.Эразмусом в 1765 г. В повседневную акушерскую практику операцию наложения акушерских щипцов внедрил основоположник русского научного акушерства Нестор Максимович-Амбодик. И.П.Лазаревич создал оригинальный тип русских щипцов, основными чертами которых являются простота устройства, отсутствие тазовой кривизны, подвижность ветвей замка (рис. 25.11). Щипцы норвежского врача Ц.Килланда [Kielland С, 1916] были созданы на основе модели И.П.Лазаревича (щипцы Лазаревича-Килланда).
Н.Н.Феноменов внес принципиальные изменения в одну из самых распростра-ненных моделей щипцов – в английские щипцы Симпсона: благодаря изменениям замка сообщена большая подвижность ветвям (щипцы Симпсона-Феноменова) (рис. 25.12).
Среди родоразрешающих операций в США, Англии, Франции и России на втором месте после кесарева сечения находится операция наложения акушерских щипцов.
В Российской Федерации частота наложения акушерских щипцов за период 1990-1995 гг. составляла 0,56-0,40 %. Относительно невысокий процент наложения акушерских щипцов объясняется тем, что данная операция более травматична для плода, чем своевременно проведенное кесарево сечение.
 Рис. 25.11. Щипцы Лазаревича (а) и Килланда (б)
Рис. 25.11. Щипцы Лазаревича (а) и Килланда (б)
 Рис. 25.12. Щипцы Симпсона- (б). Феноменова.
Рис. 25.12. Щипцы Симпсона- (б). Феноменова.
Основная модель щипцов, применяемых в нашей стране, – это щипцы Симпсона-Феноменова.
Щипцы состоят из двух половин, называемых ветвями. Одна из ветвей, которую захватывают левой рукой, предназначена для введения в левую половину таза – она называется левой ветвью; вторая ветвь называется правой. В каждой ветви различают три части: ложку (cochlear), замок (pars juncture) и рукоятку (manubrium). Щипцы имеют длину 35 см и массу около 500 г.
Ложка представляет собой пластинку, имеющую посередине широкий вырез – окно – и закругленные ребра – верхнее и нижнее. Ложки искривлены соответственно кривизне головки. Внутренние поверхности ложек в сомкнутых щипцах плотно прилегают к головке плода вследствие совпадения кривизны головки и ложек. Вогнутая изнутри (и выгнутая снаружи) кривизна ложек называется головной кривизной. Наибольшее расстояние между внутренними поверхностями сложенных ложек равняется 8 см, а между верхушками сложенных ложек – 2,5 см. Ребра ложек также изогнуты в виде дуги, причем верхнее ребро вогнуто, а нижнее выгнуто. Эта вторая кривизна ложек называется тазовой кривизной, так как соответствует изгибу тазовой оси.
Замок служит для соединения ветвей. Устройство замка неодинаково в различных моделях щипцов. Замок в шипцах Симпсона – Феноменова весьма прост: на левой ветви имеется выемка, в которую вставляется правая ветвь, и ветви перекрещиваются. Существенной чертой является степень подвижности соединяемых им ветвей: замок может быть свободно подвижным (русские Щипцы), умеренно подвижным (английские шипцы), почти неподвижным (немецкие щипцы) и вовсе неподвижным (французские щипцы).
Подвижный замок позволяет расположить ложки на головке в любой Плоскости таза и предотвратить чрезмерное сжатие головки.
Рукоятки щипцов прямолинейные, внутренняя их поверхность ровная, тлоская, а наружная – ребристая, волнообразная, что предупреждает скольжение рук хирурга. На наружной поверхности рукояток близ замка имеются боковые крючки Буша, предназначенные для опоры пальцев при влечениях.
Очень важно отличать левую ветвь (ложку) от правой, так как ее необходимо вводить первой и при замыкании щипцов она должна лежать под правой, в противном случае замыкание щипцов нельзя осуществить.
Левую и правую ветви (ложки) щипцов определяют по следующим признакам: 1. если разместить ветви щипцов на горизонтальной плоскости с тазовой кривизной, обращенной книзу, то на левой ветви крючок Буша смотрит влево, а на правой – вправо; 2. на левой ветви головная кривизна отклонена влево, а на правой – вправо; 3. на левой ветви замок состоит из вырезки и пластинки, а на правой ветви имеется только истончение в области замка.
Назначение щипцов – плотно обхватить головку и заменить изгоняющую силу матки и брюшного пресса влекущей силой врача. Следовательно, щипцы являются только влекущим, но не ротационным и не компрессионным инструментом. В процессе извлечения трудно избежать известного сжатия головки, но это является недостатком щипцов, а не их назначением.
Большее или меньшее сжатие головки зависит от ее величины и правильности наложения щипцов (при затылочном виде бипариетально) и от того, соответствует ли механизму родов направление влечения. При наложении щипцов максимальное давление на головку составляет 1,08-1,28 кг/см. В США имеются специальные мониторы для оценки степени сдавления головки плода при использовании щипцов.
Выбор модели щипцов. Из огромного числа моделей щипцов достаточно иметь две: 1. щипцы Симпсона-Феноменова, которые часто называют классическими; 2. прямые щипцы Лазаревича, Гумилевского или Килланда.
Иностранные авторы при наличии конфигурации головки у первородящих считают целесообразным использовать щипцы Симпсона.
Показания к наложению щипцов могут быть как со стороны матери, так и со стороны плода (хотя это деление условно).
Показания со стороны матери: 1. тяжелые заболевания сердечно-сосудистой и дыхательной систем, почек, органов зрения и др.; 2. тяжелая нефропатия, эклампсия; 3. слабость родовой деятельности, не поддающаяся медикаментозной терапии, утомление; 4. хориоамнионит в родах, если в течение ближайших 1-2 ч не ожидается окончания родов.
Показания со стороны плода: 1. острая гипоксия плода; 2. выпадение петель пуповины; 3. преждевременная отслойка плаценты.
Следует подчеркнуть, что при слабости родовой деятельности не следует выжидать появления признаков страдания плода (гипоксии), ибо в таких случаях операция наложения щипцов более травматична для плода.
В тех случаях, когда со стороны матери показано выключение потуг (миопия высокой степени, угроза отслойки сетчатки, сердечно-легочная недостаточность и др.), целесообразно родоразрешение кесаревым сечением, чтобы избежать возможного травмирования ребенка при наложении щипцов.
Очень популярными в США являются элективные выходные щипцы, которые накладываются при использовании эпидуральной аналгезии, так как последняя может ослабить потути.
Условия для наложения щипцов. Существуют следующие условия для наложения щипцов: 1. наличие живого плода; 2. полное раскрытие маточного зева. В случае неполного открытия зева возможен захват шейки щипцами, при этом часто происходит разрыв шейки и возможен его переход на нижний сегмент матки; 3. отсутствие плодного пузыря. Влечение за оболочки может вызвать преждевременную отслойку плаценты; 4. головка не должна быть слишком мала (выраженное недонашивание) или слишком велика, она должна иметь нормальную плотность (в противном случае щипцы с головки во время влечения могут соскользнуть); 5. головка должна находиться в узкой (иногда в широкой) части полости таза стреловидным швом в прямом и одном из косых размеров таза; 6. отсутствие несоразмерности таза и головки; 7. опорожненный мочевой пузырь.
Противопоказания к наложению акушерских щипцов: 1. мертвый плод; 2. неполное раскрытие маточного зева; 3. гидроцефалия, анэнцефалия; 4. анатомически (II -Ш степень сужения) и клинически узкий таз; 5. глубоконедоношепный плод; 6. высокое расположение головки плода (головка прижата малым иди большим сегментом во входе в таз); 7. угрожающий или начинающийся разрыв матки.
Подготовка к операции. Роженицу укладывают на рахмановскую кровать или операционный стол в положении для влагалищных операций. Ноги при этом согнуты в коленных и тазобедренных суставах и разведены в стороны, чтобы обеспечить свободный доступ к области промежности. Перед операцией производят катетеризацию мочевого пузыря и обработку наружных половых органов. Следует строго соблюдать последо-вательность обработки: сначала обрабатывают область лобка, затем внутреннюю поверхность бедер, наружные половые органы и область заднепроходного отверстия. Для этого используют 1% раствор йодоната или 5% спиртовой раствор йода, октенисепт, октенидерм и др. На ноги роженицы надевают стерильные бахилы, наружные половые органы покрывают стерильным бельем, оставляя отверстие для входа во влагалище.
При наложении щипцов применяют внутривенный, реже ингаляционный наркоз. Хорошие результаты получены от применения двусторонней пудендалыюй анестезии.
В зависимости от высоты стояния головки в тазе различают щипцы выходные, полостные.
Выходными называются шипцы, накладываемые на головку, стоящую большим сегментом в выходе таза (station +3), стреловидным швом в прямом размере выхода из таза; при этом головка видна из половой щели.
Подобные шипцы за рубежом называют элективными, профилактическими; их накладывают довольно часто. В нашей стране они применяются крайне редко, ибо, если головка находится на дне таза, достаточно проведения эпизиотомии для рождения головки плода.
Полостными (типичными) называются щипцы, накладываемые на головку, находящуюся большим сегментом в узкой части полости таза (station +2), когда стреловидный шов находится в прямом или почти прямом, реже в поперечном (низкое поперечное стояние головки) размере таза.
Принципы наложения щипцов. Прежде чем перейти к технике наложения щипцов, остановимся на некоторых общих принципах, которые применимы как к типичным, так и к атипичным щипцам.
При наложении щипцов следует руководствоваться следующими тройными правилами.
Первое тройное правою. Первой вводится левая ложка, которая вводится левой рукой в левую половину таза (матери) ("три слева") под контролем правой руки; правая ложка вводится правой рукой в правую сторону таза ("три справа") под контролем левой руки.
Второе тройное правило. Верхушки ложек должны быть обращены в сторону проводной оси таза; щипцы должны захватывать головку вдоль большого косого размера (mentooccipitalis) и бипариетально, чтобы проводная точка головки находилась в плоскости щипцов.
Третье тройное правило. При головке, находящейся в широкой части полости таза, тракции (по отношению к стоящей женщине) направлены косо кзади, затем вниз и кпереди, если головка находится в узкой части, – вниз и кпереди, а если в выходе таза, – кпереди.
Операция наложения щипцов
Операция наложения акушерских щипцов слагается из 4 моментов: 1. Введение и размещение ложек, 2. Замыкание щипцов и пробная тракция. 3. Тракции или влечение (извлечение) головки. 4. Снятие щипцов.
Полостные (типичные) щипцы при переднем виде затылочного предлежания. Первый момент – введение и размещение ложек. Стоя, акушер левой рукой разводит половую щель и вводит во влагалище вдоль левой его стенки четыре пальца правой руки, так чтобы руки ладонными поверхностями плотно прилегали к головке и отделяли ее от мягких тканей родового канала (стенки влагалища, маточный зев). Врач берет левую ветвь щипцов за рукоятку, как писчее перо или как смычок. Рукоятку отводит в сторону и устанавливает почти параллельно правой паховой складке, а верхушку ложки обращает к половым органам роженицы и прижимает к ладонным поверхностям пальцев, находящихся во влагалище. Нижнее ребро ложки опирается на I палец правой руки. Ложку вводят в половую щель, подталкивая ее нижнее ребро I пальцем правой руки под контролем пальцев, введенных глубоко во влагалище. Ложка должна скользить между II и III пальцами (рис. 25.13).
 Рис. 25.13. Введение левой ложки акушерских щипцов.
Рис. 25.13. Введение левой ложки акушерских щипцов.
 Рис. 25.14. Введение правой ложки акушерских щипцов.
Рис. 25.14. Введение правой ложки акушерских щипцов.
В течение всего времени, пока ложка продвигается по родовому каналу, введенной во влагалище рукой контролируют правильность движения верхушки ложки, чтобы она не отклонилась от головки в сторону и не оказала давления на влагалищный свод (опасность его прободения в брюшную полость), на боковую стенку влагалища и не захватила края маточного зева.
По мере продвижения ложки в родовые пути рукоятка щипцов должна приближаться к средней линии и спускаться кзади. Оба эти движения должны совершаться плавно под контролем IV пальцев правой руки, введенной во влагалище. Когда левая ложка хорошо ляжет на головку, рукоятку передают ассистенту, чтобы избежать смещения ветви.
Под контролем левой руки врач, производящий операцию, вводит правой рукой правую ветвь в правую половину таза так же, как и левую ветвь (рис. 25.14).
Затем надо убедиться, правильно ли лежат ложки на головке и не захвачена ли шейка матки.
Второй момент – замыкание щипцов и пробная тракция. Каждую рукоятку захватывают одноименной рукой так, чтобы большие пальцы располагались на боковых крючках Буша. После этого рукоятки совмещают и щипцы легко замыкаются (рис. 25.15).
Правильно наложенные щипцы лежат в тазе в поперечном размере. Они плотно обхватывают головку по большому ее размеру, бипариетально (рис. 25.16). Стреловидный шов находится в прямом размере, и ведущая точка головки (малый родничок) обращена к замку. Внутренние поверхности рукояток щипцов должны прилегать вплотную (или почти вплотную). Если -укоятки не прилегают плотно друг к другу, между ними вкладывают стеильную салфетку, сложенную в 2-4 слоя. Этим достигается хорошее примыкание ложек щипцов к головке и избегается возможность чрезмерного ее сжатия в щипцах.
После этого производят пробную тракцию (рис. 25.17). Цель ее – убедиться в правильном положении щипцов и отсутствии угрозы их соскальзывания (следует ли головка за щипцами). Для этого врач садится на стул и правой рукой обхватывает рукоятки щипцов сверху так, чтобы указательный и средний пальцы лежали на боковых крючках. В это же время левую кисть он кладет на тыльную поверхность правой, причем конец вытянутого указательного или среднего пальца касается головки. Если щипцы наложены правильно, то во время влечения кончик пальца все время соприкасается с головкой. В противном случае он медленно удаляется от головки, расстояние между замком щипцов и головкой увеличивается, а рукоятки их расходятся: начинается соскальзывание.
 Рис. 25.17. Пробная тракция (схема)
Рис. 25.17. Пробная тракция (схема)
 Рис. 25.18. Начало тракции.
Рис. 25.18. Начало тракции.
 Рис. 25.19. Захватывание щипцов по Цовьянову.
Рис. 25.19. Захватывание щипцов по Цовьянову.
Третий момент – извлечение головки (тракции). Убедившись в правильном наложении щипцов, врач плотно обхватывает обеими руками рукоятки щипцов и приступает к собственно влечению. Для этого указательный и безымянный пальцы правой руки располагают на боковых крючках, средний – между расходящимися ветвями щипцов, а большой и мизинец охватывают рукоятки по сторонам. Левой рукой захватывают конец рукоятки (рис. 25.18).
Ввиду того что в щипцах с тазовой кривизной направление движения рукояток не совпадает с направлением движения ложек, Н.А.Цовьянов предложил следующий прием захвата и тракции щипцами (рис. 25.19): II и III согнутые пальцы обеих рук акушера захватывают из-под рукояток щипцов на уровне бушевских крючков их наружную и верхнюю поверхность, причем основные фаланги указательных пальцев с проходящими между ними крючками располагаются на наружной поверхности рукояток, средние фаланги тех же пальцев – на верхней поверхности, ногтевые фаланги располагаются также на верхней поверхности рукояток, но противоположной ложки щипцов. Согнутыми IV и V пальцами захватывают отходящие от замка параллельные ветви щипцов сверху и продвигаются как можно выше, ближе к головке. Большие пальцы, находясь под рукоятками, должны упираться в среднюю треть нижней поверхности рукояток. Такое захватывание позволяет одновременно производить и влечение, и отведение головки в крестцовую впадину. Все моменты операции наложения щипцов по Цовьянову производятся стоя
 Рис. 25.20. Выведение головки в щипцах и защита промежности.
Рис. 25.20. Выведение головки в щипцах и защита промежности.
 Рис. 25.21. Размыкание щипцов
Рис. 25.21. Размыкание щипцов
При использовании общепринятой методики наложения акушерских щипцов во время тракции врач сидит на стуле (редко стоит), ступни прижаты к полу (нельзя упираться в какой-нибудь предмет), а локти – к туловищу. Это положение предупреждает развитие чрезмерной силы, что может привести к стремительному извлечению головки, а иногда и всего плода, и причинить плоду и роженице тяжелую травму.
При влечении головки щипцами врач стремится подражать естественным потугам. Эти влечения должны совпадать по времени с потугами роженицы, если она не под наркозом. Сила влечения, незначительная в первые секунды, постепенно нарастает, доводится до максимума и не снижается около 20-30 с; затем она постепенно уменьшается и к концу потуги совершенно ослабевает. Продолжительность каждого влечения 2-3 мин. Между каждыми двумя смежными влечениями делается перерыв 1-1,5 мин. В это время врач расслабляет кисти руки, сжимающие рукоятку, чтобы несколько разомкнуть щипцы и этим уменьшить почти непредотвратимое сдавление головки плода ложками щипцов и восстановить внутримозговое кровообращение плода. Отдых необходим и роженице, для того чтобы расслабить напряжение промежности и восстановить в ней правильную циркуляцию крови, нарушающуюся во время тракции. Наконец, отдых нужен и врачу, так как влечение является утомительной физической нагрузкой. После отдыха влечение вновь повторяют, чередуя его с кратковременной передышкой.
Во время влечений не допускаются ни вращательные, ни качательные, ни маятникообразные движения, ни влечения рывками. Следует помнить, что щипцы являются инструментом влекущим; тракции должны производиться плавно и только в одном направлении.
Направление влечений зависит от высоты стояния головки. Это лучше всего определяется направлением рукоятки щипцов: чем выше в тазе стоит головка, тем круче обращены рукоятки кзади.
При выходных щипцах рукоятки располагаются горизонтально и тракции делают кпереди (вверх) для того, чтобы произошли разгибание и рождение головки.
При полостных (типичных) щипцах рукоятки расположены горизонтально. Врач должен производить влечения на себя – горизонтально. Головка при этом продвигается малым родничком по проводной оси таза, проделывая в щипцах те же движения, что и при самостоятельном следовании по родовому каналу. Влечение производят горизонтально до появления из-под лонной дуги подзатылочной ямки. После этого влечениям придают направление вверх, чтобы произошло разгибание головки. Для этого врач встает со стула и становится сбоку от роженицы. Захватив одной рукой рукоятки щипцов, он производит ими влечение кпереди, защищая всей ладонной поверхностью второй руки промежность от разрыва. В таком состоянии бережно выводят из половой щели теменные бугры, темя и лоб (рис. 25.20). Когда большой сегмент головки устанавливается в половой щели, врач может вывести головку из нее либо в щипцах, не снимая их, либо руками, предварительно сняв щипцы. При прорезывании головки плода показано проведение срединно-латеральной эпизиотомии, чтобы обеспечить выведение головки и избежать разрыва сфинктера прямой кишки. Направление тракции, как правило, определяют по отношению к стоящей женщине: к крестцу – кзади, к ногам – вниз, к животу кпереди. Некоторые авторы обозначают направление тракции по отношению к женщине, находящейся в положении лежа: к крестцу – вниз, к ногам – горизонтально, к животу – вверх.
Какую силу необходимо затратить при извлечении головки плода щипцами? Сила тракции должна соизмеряться с силами акушера и имеющимся сопротивлением. В этом отношении обычно достаточно силы среднего человека. Сила воздействия щипцов на головку плода слагается из тяги, сдавления щипцами и сопротивления материнских тканей. Сила тракции при наложении щипцов составляет примерно 30 кг, и она передается на основание черепа.
Четвертый момент – снятие щипцов. Щипцы снимают обычно после извлечения головки. Если щипцы снимают, когда головка начинает прорезываться, надо придержать ее во избежание стремительного прорезывания и разрыва промежности. Сначала берут рукоятки в руки и раскрывают замок; первой выводят правую ложку, причем рукоятка должна проделать обратный путь по сравнению с введением ее, второй выводят левую ложку (рис. 25.21).
Рождение плечиков и туловища плода обычно не вызывает затруднений.
Полостные (типичные) щипцы при заднем виде затылочного предлежания. Задний вид затылочного предлежания является вариантом нормального механизма родов, поэтому надо извлекать головку плода в заднем виде (рис. 25.22; 25.23).
Операция состоит из четырех моментов.
Первый момент – введение и размещение ложек. Щипцы накладывают в поперечном размере таза с тем, чтобы ложки легли на головку плода бипариетально.
Второй момент – замыкание и пробная тракция. При за-мыкании щипцов следует несколько опустить их рукоятки, стремясь захватить головку соответственно ее большому размеру. Однако это не всегда удается, так как имеется препятствие со стороны промежности. Головку ввиду недостаточного ее сгибания удается захватить в подзатылочно-подбородочном, а чаще в вертикальном размере. Многие акушеры при заднем виде затылочного предлежания рекомендуют накладывать прямые щипцы (Лазаревича-Килланда). Следует убедиться, не захвачена ли шейка матки. Затем проводится пробная тракция.
Третий момент – тракции . При извлечении надо стремиться под-ражать естественному механизму родов; делать тракции на себя почти горизонтально до того момента, пока область большого родничка не подойдет под лоно. Если к началу операции головка уже фиксирована областью большого родничка под лобком (выходные щипцы), надо осторожно производить тракции кпереди, чтобы вывести область затылка над промежностью – максимальное сгибание головки. При этом надо следить, чтобы головка была хорошо захвачена и щипцы не соскользнули, так как это грозит значительной травмой промежности и влагалища. Необходимо произвести срединно-латеральную эпизиотомию.
 Рис. 25.22. Захват головки щипца
Рис. 25.22. Захват головки щипца
 Рис. 25.23. Выведение головки в щипцах при ми при заднем виде затылочного заднем виде затылочного предлежания. предлежания.
Рис. 25.23. Выведение головки в щипцах при ми при заднем виде затылочного заднем виде затылочного предлежания. предлежания.
После выведения затылка плода акушер опускает рукоятки щипцов и выводит из-под лобка лоб, лицо и подбородок плода.
Если головка находится в узкой части полости малого таза (типичные полостные щипцы) стреловидным швом в прямом размере и затылком, обращенным кзади, тракции делают книзу, пока большой родничок не фиксируется под лобком (максимальное сгибание головки), а затем рукоятки щипцов опускают кзади и при этом выводят из-под лобка лоб, лицо и подбородок плода (разгибание головки). Разгибание головки чаще всего осуществляют ручными приемами после снятия ложек щипцов. Предварительно необходимо произвести срединно-латеральную эпизиотомию.
Четвертый момент – снятие щипцов. Щипцы снимают после размыкания замка.
Выходные щипцы при заднем виде лицевого предлежания. Операция на-ложения щипцов при заднем виде лицевого предлежания представляет большие трудности и создает угрозу повреждений влагалища и промежности, а также травмы плода. Операцию можно проводить, если головка находится на тазовом дне, лицевая линия в прямом размере, подбородок кпереди.
Идеальный захват головки соответственно ее большому косому размеру невозможен, так как подлобком нет места для замыкания рукояток. Головку захватывают по вертикальному размеру (рис. 25.24). При введении и замыкании ложек важно помнить, что щипцы накладывают не на лицо, а на череп через лицо, и поэтому необходимо приподнять рукоятки кпереди, так как основная часть головки лежит в углублении крестца. После замыкания щипцов тракции делают вниз, чтобы вывести подбородок из-под лобка; затем приподнимают рукоятки щипцов кпереди и выводят над промежностью лоб, теменные бугры и затылок.
Полостные щипцы (атипичные).
Полостные щипцы накладывают на головку, стоящую в широкой части полости малого таза (station + 1). Ввиду того что внутренний поворот головки не завершился, при затылочном предлежании сагиттальный шов может быть в одном из косых размеров или в поперечном размере таза.
При атипичных щипцах в процессе извлечения головки завершается и внутренний поворот головки на 45° и даже на 90°. Вследствие этого операция наложения полостных щипцов значительно труднее, чем типичных. Некоторые иностранные авторы рекомендуют предварительное исправление положения головки плода щипцами или ручными приемами, что является весьма травматичным как для матери, так и для плода и не всегда удается. Щипцы следует накладывать без предварительного исправления положения головки плода и, наложив щипцы, извлекать головку. Во время влечения (тракции) не следует сознательно содействовать тем поворотам, которые должна совершать головка согласно механизму родов.
Полостные, атипичные щипцы при затылочном предлежании, первой позиции, переднем виде. Щипцы необходимо наложить в бипариетальном размере головки, т.е. перпендикулярно правому косому размеру полости таза в ее левом косом размере.
Первый момент – введение и размещение ложек. Левой рукой разводят половую щель и вводят во влагалище четыре пальца правой руки. Тремя пальцами левой руки берут за рукоятку левую ветвь щипцов и поднимают рукоятку немного вправо и кпереди параллельно правой паховой складке, а верхушку ложки щипцов вводят во влагалище между рукой и головкой в заднебоковой отдел таза так, чтобы ложка легла на головку в области левого теменного бугра. Рукоятку щипцов передают ассистенту, напоминая ему о важности сохранения положения ветви. Правая ложка должна лечь на головку в области правого теменного бугра, но ввести ее сразу не удается, так как этому препятствует лобковая дуга; данное препятствие обходят при помощи так называемого перемещения ("блуждания") ложки.
Правой рукой разводят половую щель и вдоль правой стенки влагалища вводят четыре пальца левой руки. В правую руку берут рукоятку щипцов и располагают ее по направлению левой паховой складки, вводят ложку между левой рукой и головкой вдоль правой стенки влагалища. Для того чтобы щипцы замкнулись, ложки должны лечь на диаметрально противоположные точки головки; правую ложку перемещают кпереди, осторожно надавливая II пальцем левой руки на ее нижнее ребро до тех пор, пока ложка не ляжет на головку в области правого теменного бугра; рукоятку несколько смещают кзади и по ходу часовой стрелки. Такое перемещение ложек называют спиральным.
Второй момент – замыкание щипцов и пробная тракция. Когда щипцы легли на головку бипариетально и, следовательно, находятся в левом косом размере полости таза, производят замыкание щипцов и пробную тракцию.
Третий момент – тракции. Тракции вначале делают косо кзади, затем вниз и кпереди. При этом, производя тракции кзади вниз, чувствуя вращение головки, надо способствовать этому движению. При первой позиции, переднем виде малый родничок, т.е. затылок, будет вращаться против часовой стрелки – вправо и кпереди на 45°. Когда поворот совершится, малый родничок будет прощупываться под лобком, а сагиттальный шов – в прямом размере выхода из малого таза. Затем совершают тракции книзу, пока затылочный бугор не выйдет из-под лобка, а затем кпереди – разгибание головки; точкой фиксации является область подзатылочной ямки. Акушер выводит головку в щипцах, стоя справа от роженицы, и защищает промежность правой рукой.
Четвертый момент – снятие щипцов. Производится только после выведения головки и размыкания ложек. Снятие щипцов проводится в обратном порядке: первой снимается правая ложка, при этом рукоятка отводится к левому паховому сгибу, затем левая – ее рукоятка отводится к правому паховому сгибу. После рождения ребенка обращают внимание на следы ложек: при правильном их расположении следы обхватывают уши ребенка.
Полостные (атипичные) щипцы при затылочном предлежании, второй позиции, переднем виде. Щипцы необходимо наложить бипариетально, т.е. перпендикулярно левому косому размеру полости таза в правом косом размере головки.
Первый момент – введение и размещение ложек. Первой вводят левую ложку в левую половину таза. Ввиду того что сагиттальный шов находится в левом косом размере, нужно переместить левую ложку кпереди, к лобку. Держа левой рукой рукоятку щипцов, правой рукой, осторожно надавливая на нижнее ребро, перемещают левую ложку ("блуждающая") кпереди и вправо (в левый переднебоковой отдел таза) до тех пор, пока она не ляжет на левый теменной бугор головки плода; одновременно левой рукой совершают поворот рукоятки кзади и по спирали – против часовой стрелки. Правую ложку вводят (под контролем левой руки) в правый заднебоковой отдел таза так, чтобы она легла на правый теменной бугор головки плода.
Второй момент – замыкание щипцов и пробная тракция. Правая рукоятка щипцов должна быть впереди левой, иначе щипцы не замкнутся. При наложении щипцов в правом косом размере таза они хорошо замыкаются, после этого делают пробную тракцию.
Третий момент – тракции. Тракции делают косо кзади и вниз. Когда головка начнет опускаться, происходит поворот головки в щипцах малым родничком кпереди и влево, т.е. по ходу часовой стрелки на 45°. Когда поворот совершится, малый родничок пальпируется под лобком, а стреловидный шов располагается в прямом размере таза. Далее осуществляют тракции книзу (т.е. на лицо врача, сидящего перед роженицей), пока затылочный бугор не выйдет из-под лобка, а затем кпереди – разгибание головки с точкой фиксации в подзатылочной ямке. Стоя справа от роженицы, акушер осторожно выводит головку в щипцах правой рукой, защищая промежность.
Четвертый момент – снятие щипцов. Проводится как обычно.
Полостные (атипичные) щипцы при затылочном предлежании, первой позиции, заднем виде. Так как стреловидный шов находится в левом косом размере, то щипцы необходимо наложить в правом косом размере таза, чтобы они располагались по большому косому размеру и обхватили головку бипариетально.
Первой вводят левую ложку, и она является "блуждающей". Правую ложку вводят в правый заднебоковой отдел таза ("стационарная"). Производят замыкание щипцов и пробную тракцию и убеждаются, что щипцы наложены правильно.
Тракции проводят косо кзади и несколько вниз. При этом происходит поворот головки малым родничком кзади на 45° по часовой стрелке; очень редко малый родничок поворачивается кпереди (на 135° против часовой стрелки; в этих случаях надо соответственно переложить ложки щипцов). Когда сагиттальный шов поворачивается в прямой размер выхода из таза и располагается кзади, а большой родничок (или передний край волосистого покрова головки) фиксируется под лобком, поднимают кпереди рукоятки щипцов и выводят над промежностью затылок, производя дополнительное сгибание головки. Затем несколько опускают кзади рукоятки щипцов, чтобы совершить разгибание головки вокруг точки фиксации (в области подзатылочной ямки) и вывести лоб и подбородок.
Снимают щипцы обычным путем.
Полостные (атипичные) щипцы при затылочном предлежании, второй позиции, заднем виде. Для того чтобы захватить головку бипариетально, надо наложить щипцы в левом косом размере таза. Техника введения щипцов аналогична таковой при переднем виде затылочного предлежания первой позиции. Левая ложка является стационарной и располагается в левом заднебоковом отделе таза, правая – "блуждающей" и располагается в правом перед небоковом отделе таза. Тракции производят, как при полостных щипцах в заднем виде затылочного предлежания, первой позиции. Малый родничок поворачивается кзади на 45° против часовой стрелки. Если малый родничок поворачивается кпереди на 135° по часовой стрелке, то в этих случаях необходимо переложить ложки щипцов.
Тракции и снятие акушерских щипцов проводят так же, как при использовании атипичных щипцов.
Иногда акушерские щипцы приходится накладывать при низком поперечном стоянии стреловидного шва. В этом случае необходимо учитывать следующие особенности. Так как из-за наличия тазовой кривизны щипцы Симпсона-Феноменова в прямом размере таза наложить нельзя, то единственно возможным в подобных случаях является атипическое наложение щипцов – в одном из косых размеров таза.
При первой позиции щипцы накладывают в левом косом размере таза. Первой вводят левую ложку – в левый заднебоковой отдел таза, а правую – в правый переднебоковой отдел таза ("блуждающая"). Обе ложки располагаются в левом косом размере таза, друг против друга, причем обхватывают сзади и слева задний теменной бугор; верхушки ложек обращены к подбородку, а ведущая точка (малый родничок) – к замку.
Во время влечения на себя головки вместе с щипцами совершают поворот на 90° против часовой стрелки, который заканчивается переходом стреловидного шва в прямой размер плоскости выхода малого таза установлением малого родничка кпереди. После этого щипцы снимают и вновь накладывают, но уже типично – в поперечном размере таза.
В дальнейшем операцию выполняют так же, как при переднем виде затылочного предлежания.
При второй позиции левую ложку вводят в левый переднебоковой отдел таза ("блуждающая"), а правую – в правый заднебоковой отдел таза (стационарная). Ложки при этом размещаются в правом косом размере таза, причем правая ложка обхватывает теменной, а левая – лобный бугор. В дальнейшем операция производится так же, как и при первой позиции низкого поперечного стояния стреловидного шва.
Переднеголовное предлежание часто служит своего рода проявлением клинического несоответствия при поперечносуженном тазе, а поэтому правильным является родоразрешение путем операции кесарева сечения. Если в силу различных обстоятельств решаются наложить акушерские щипцы, то при этом ложки обычно располагают по вертикальному размеру головки, а не по большому косому размеру.
Тракции выполняют осторожно на себя, пока область переносицы фиксируется под лобком. Затем производят сгибание головки путем тракции кпереди, пока над промежностью не родится область затылка; после этого рукоятки щипцов опускают кзади и выводят из-под лобка личико и подбородок.
Размыкание замка и снятие ложек производят только после выведения головки.
После операции наложения полостных акушерских щипцов, особенно если операция была трудной, показаны ручное отделение и выделение плаценты и контрольное обследование стенок послеродовой матки для выяснения ее целостности.
Во всех случаях после наложения акушерских щипцов показан осмотр шейки матки и влагалища при помощи зеркал, а при нарушении их целости необходимо наложение швов. Для профилактики кровотечения в последовом и раннем послеродовом периодах необходимо внутривенное введение утеротонических средств (I мл 0,02 % раствора метилэргометрина, 5 ЕД окситоцина).
Возможные затруднения при операции наложения акушерских щипцов
При введении ложек затруднения могут возникнуть в результате неподготовленности родовых путей и узости влагалища. В этих случаях показаны наркоз и рассечение промежности (лучше срединно-латеральная эпизиотомия).
Иногда ложка щипцов встречает препятствие и не продвигается вглубь. Это затруднение может быть обусловлено попаданием верхушки ложки в складку влагалища или, что гораздо опаснее, в его свод. Необходимо тотчас прекратить введение ложки и выяснить причину; вводить ложку следует всегда под контролем пальцев. Затруднения во время введения ложек могут быть обусловлены значительной конфигурацией головки.
Препятствие может возникнуть и при неправильном введении ложек акушерских щипцов, когда преждевременно (до прилегания ложки к теменному бугру при затылочном предлежании) опускают рукоятку и верхушки ложек упираются в поверхность головки, а не обходят ее.
Если рядом с плотно стоящей в тазе головкой плода имеется выпавшая ручка или пуповина, то следует избегать их захвата ложками щипцов.
Могут встретиться трудности при замыкании ложек щипцов, что зависит от нахождения их в различных плоскостях или от неодинаковой глубины введения ложек. Если ложки щипцов лежат не в одной плоскости вследствие того, например, что одна лежит на теменном бугре, а вторая – на лобной кости, то необходимо отдать правильно введенную ветвь ассистенту, чтобы он удерживал ее, вторую ложку надо осторожно переместить рукой, введенной во влагалище. Это перемещение надо делать до тех пор, пока обе ветви не окажутся в одной плоскости и щипцы не замкнутся. Если этот прием не удается, необходимо извлечь неправильно введенную ложку и ввести вновь.
Если щипцы не замыкаются вследствие неодинаковой глубины их введения, следует несколько извлечь ту ложку, которая введена глубже (при условии, что вторая ложка хорошо обхватывает головку), и замкнуть щипцы. Вводить глубже одну ложку щипцов без контроля пальцев опасно из-за угрозы травматизации родовых путей матери.
Если рукоятки щипцов при попытке их замыкания значительно расходятся и пружинят, то это может быть вызвано следующими причинами: недостаточной глубиной введения ложек, плохим обхватом головки в невыгодном размере или чрезмерной величиной головки. При недостаточном введении ложек верхушки их давят на поверхность головки, попытки сжатия ложек приводят к тяжелым повреждениям плода вплоть до переломов костей черепа; попытка извлечения плода, несмотря на плохое замыкание щипцов, неминуемо ведет к их соскальзыванию. Неправильное замыкание щипцов может быть обусловлено их наложением в невыгодном размере головки (например, лобно-затылочном или косом размере вместо поперечного бипариетального). Затруднение это возникает в результате неправильного акушерского диагноза, как правило, вследствие выраженной родовой опухоли и конфигурации головки (ошибочно определены швы и роднички); в этом случае следует произвести повторное влагалищное исследование и соответственно переместить ложки щипцов.
В том случае, если при контрольном влаганищном исследовании выявлено, что рукоятки значительно расходятся, а щипцы лежат правильно, между обеими рукоятками вкладывают сложенную салфетку во избежание чрезмерного сжатия головки (крупный плод).
Во время тракции может наблюдаться отсутствие продвижения головки, что обусловлено неправильностью их направления, а также несоответствием между размерами таза и головки. Направление тракции должно соответствовать проводной оси таза и механизму родов, что устанавливается путем тщательной оценки состояния родовых путей и места расположения головки плода при влагалищном исследовании. Так, при общеравномерносуженном тазе угол лобковой дуги является острым, и поэтому надо производить тракцию резко кзади, пока из-под лобка не выйдет затылочный бугор (при переднем виде затылочного предлежания). Затруднения могут возникнуть при нераспознанном своевременно сужении размеров таза.
Если несмотря на тракции головка не продвигается и это обусловлено клиническим несоответствием, то щипцы снимают, чтобы не нанести серьезную травму матери и плоду.
Осложнения при операции наложения акушерских щипцов
Соскальзывание щипцов.
Среди осложнений наложения акушерских щипцов различают соскальзывания двух видов – горизонтальное и вертикальное. Причины соскальзывания щипцов – неправильный захват головки, несоответствие размеров головки (чрезмерно маленькая или большая головка). При тщательном влагалищном исследовании обычно выясняется, в чем выражается неправильность захвата (недостаточное продвижение ложек щипцов или захват головки плода в несоответствующем размере).
Диагноз угрозы соскальзывания щипцов устанавливается на основании выдвижения ложек из половой щели (хотя головка плода не продвигается) и увеличения расстояния между замком щипцов и головкой. При этом следует отказаться от попытки предупредить соскальзывание путем более сильного сжатия рукояток; подобный прием грозит смертельной травмой плоду и при этом не предупреждает опасности соскальзывания. При подозрении или угрозе соскальзывания щипцов надо прекратить тракции и произвести тщательное исследование для выяснения причины соскальзывания. Затем следует извлечь щипцы и вновь их наложить правильно.
Неудавшаяся попытка наложения щипцов.
Одним из отрицательных моментов при наложении акушерских щипцов является неудавшаяся попытка их наложения, которая наблюдается в 1,2-6,7 % случаев. Отрицательный результат объясняется недостаточным учетом акушерской ситуации, несоблюдением условий и неправильной техникой выполнения операции.
При неудавшейся попытке наложения щипцов встает вопрос о дальнейшем родоразрешении. Если головка расположена достаточно высоко, то производят кесарево сечение; если плод погибает в процессе операции наложения акушерских щипцов, то производят плодоразрушаюшую операцию.
Травматические повреждения родовых путей и плода.
При операции могут наблюдаться разрывы промежности, влагалища, больших и малых половых губ, клитора, шейки матки, нижнего сегмента матки, мочевого пузыря и мочеиспускательного канала, разрыв симфиза и травма крестцово-подвздошного сочленения. Нередким осложнением является продолжение разрыва промежности или эпизиотомии на сфинктер прямой кишки.
Другие осложнения.
После наложения щипцов отмечается повышенная кровопотеря в родах, а частота внутриматочных вмешательств достигает 70 %. Частота послеродовых заболеваний очень высока (13,5 – 96 %) и связана с затяжными родами, обширными травмами родовых путей. Значительной травматизации подвергается и плод. Диапазон этих повреждений различен – от небольших повреждений мягких тканей головки до глубоких ранений. Среди повреждений головки плода можно отметить кефалогематомы, парез лицевого нерва, перелом костей черепа, нарушения мозгового кровообращения, кровоизлияния в мозг и т.д.
Значительное число осложнений при операции наложения акушерских щипцов и не всегда благоприятные отдаленные результаты несколько снизили частоту применения этой операции в современном акушерстве.
Операции наложения акушерских щипцов и вакуум-экстракции плода не являются конкурирующими. Для каждой из этих операций существуют свои показания и условия. Многие акушеры считают, что акушерские щипцы имеют более широкий диапазон показаний, чем вакуум-экстрактор.
Акушерские пособия и операции при тазовых предлежаниях плода
При тазовых предлежаниях плода, если не было показаний к кесареву сечению в конце беременности или в первом периоде родов, в периоде изгнания может возникнуть необходимость ручного пособия или операции ручного извлечения плода. Акушерское пособие по освобождению ручек и головки плода известно под названием ручного пособия при тазовых предлежаниях плода. Пособие при тазовом предлежании отличается от операции извлечения плода за тазовый конец. При извлечении плода за тазовый конец искусственно воспроизводятся четыре этапа родов (рождение плода до пупка; от пупка до нижнего угла лопаток; рождение ручек; рождение головки), характерных для тазового предлежания, тогда как при ручном пособии плод извлекается только после рождения до нижнего угла лопаток.Ручное пособие при тазовом предлежании
Показание. Показанием к ручному пособию является замедленное изгнание плода. Если после рождения туловища до нижнего угла лопаток роды не завершаются в течение 2-3 мин, то приступают к ручному пособию, поскольку при этом головка находится в малом тазу и прижимает пуповину. Ручное пособие производится без наркоза и включает в себя освобождение ручек и головки.
Методика. Ручное пособие начинается с освобождения ручек. Все действия начинают только тогда, когда в вульварном кольце показался нижний угол лопаток – ни выше, ни ниже. В этот момент ручки доступны извлечению. Если начать освобождение ручек раньше, чем появится нижний угол лопаток, трудно будет дотянуться пальцами "внутренней" руки акушера до ручки плода, чтобы вывести ее из половой щели (рис. 25.25). Для отыскивания нижнего угла лопаток используют следующий прием: удерживая туловище плода рукой, расположенной на верхнем (переднем) бедре, врач два пальца другой руки продвигает вдоль позвоночника плода – указательный палец двигается по остистым отросткам позвонков, средний – параллельно ему на расстоянии 2-3 см, при этом врач все время старается нащупать нижний угол лопатки. Когда из половой щели покажется нижний угол лопатки, ручки становятся доступны извлечению. На этом подготовительный этап ручного пособия заканчивается. После него приступают к освобождению ручек, соблюдая следующие правила: 1. каждая ручка выводится одноименной рукой акушера – правая ручка – правой, левая ручка – левой; 2. первой всегда освобождается "задняя" ручка, расположенная у про-межности, так как здесь больше простора для манипуляций; 3. для освобождения "передней" ручки ее необходимо перевести в "заднюю", для чего туловище плода поворачивают на 180° (рис. 25.26).
Освобождение ручек осуществляют следующим образом. Туловище плода захватывают в прямом размере таза, одно из его плечиков помещают под симфизом, другое – в выемке крестцовой кости. Одной рукой (разноимен-?
ной "задней" ручке) берут ножки плода в области голеностопных суставов и отводят их вперед и в сторону, противоположную спинке плода, пока ножки не займут положение, параллельное паховому сгибу. Во влагалище по спинке плода, ближе к крестцовой впадине, вводят два пальца (II и III) соответствующей руки, затем по плечику плода продвигают пальцы до локтевого сгиба. Влечение производят за локтевой сгиб (не за плечо, так как возможен перелом) и низводят ручку таким образом, чтобы она совершила "умывательное" движение. При этом из влагалища показываются локоть, а затем предплечье и кисть. Одновременно с выведением "задней" (нижней) ручки "передняя" (верхняя) часто рождается сама. Если этого не произошло, приступают ко второму моменту освобождения плечевого пояса – освобождению "переднего" плечика и ручки. Вторую ("переднюю") ручку освобождают, предварительно переводя ее в "заднюю". Для этого захватывают двумя руками плод за грудную клетку (не касаться животика!) (4 пальца спереди, 1 палец сзади) и поворачивают его на 180°. Вращение туловища надо совершать таким образом, чтобы спинка (и затылок) прошла под симфизом (поддерживать передний вид). При таком повороте туловища плода следует придерживаться некоторых правил, которые облегчают ход операции. Положив, как указано выше, плашмя обе руки на грудку плода, расположив большие пальцы на его спинке параллельно позвоночнику, поворачивают плод вокруг его оси, никогда при этом не потягивая плод? книзу. Наоборот, захватив туловище обеими руками, его надо, поворачивая, одновременно как бы проталкивать вглубь. При этом легче повернуть плод, не ущемив ручек. После поворота туловища на 180° "передняя" ручка должна быть сзади в области крестцовой впадины. После этого приступают к ее освобождению. Вторую ручку также освобождают, захватив плод за голени, подняв ножки кпереди и в сторону, противоположную спинке, и, введя два пальца одноименной руки акушера во влагалище до локтевого сгиба плода, выводят ручку.
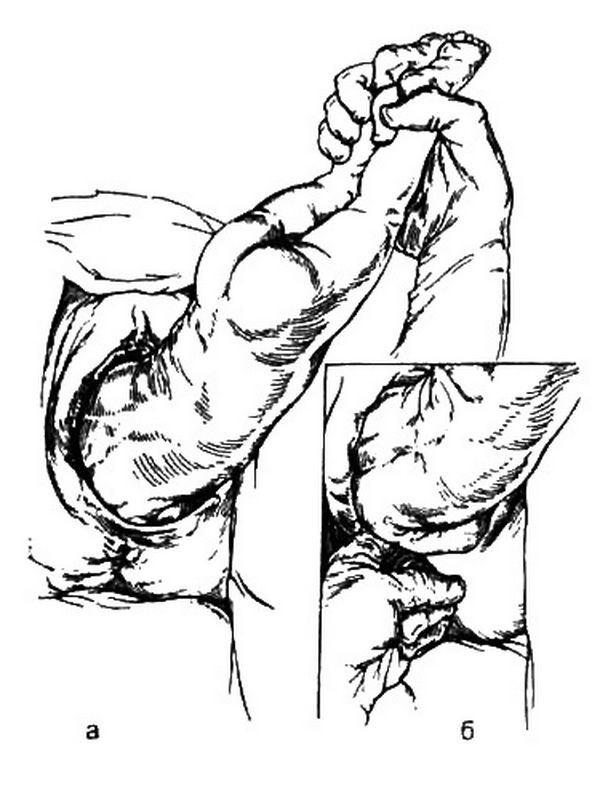 Рис. 25.25. Освобождение "задней" (левой) ручки,
а – отведение туловища плода к противоположному паху матери;
б – введение задней ручки.
Рис. 25.25. Освобождение "задней" (левой) ручки,
а – отведение туловища плода к противоположному паху матери;
б – введение задней ручки.
 Рис 25.26. Освобождение второй ручки после поворота туловища на 180°
Рис 25.26. Освобождение второй ручки после поворота туловища на 180°
В некоторых случаях такие приемы могут быть недостаточны для осво-бождения ручек. Тогда приходится вместо двух пальцев – указательного и среднего вводить четыре (кроме большого).
Некоторые акушеры рекомендуют после выведения "задней" ручки отвести туловище плода кзади в сторону промежности и вывести "переднюю" ручку из-под симфиза. Если этот прием не удался, то действуют ранее описанным способом, т.е. "переднюю" ручку переводят в "заднюю" и потом ее выводят.
При освобождении ручек надо помнить о следующих опасных моментах: 1. круговой обхват ручки большим и указательным пальцами часто ведет к перелому ручки, поэтому при освобождении ручек никогда не следует вводить большой палец во влагалище; 2. низведение ручки книзу не по личику и грудке, а через затылок, вдоль по спинке книзу обычно приводит к тяжелым повреждениям и переломам.
К освобождению головки приступают немедленно после освобождения второй ручки (рис. 25.27).
 Рис. 25.27. Извлечение последующей головки с помощью приема Морисо-Левре-Лашапелль.
Рис. 25.27. Извлечение последующей головки с помощью приема Морисо-Левре-Лашапелль.
Следует помнить, что последующая головка проходит через родовой канал точно таким же образом, как и предлежащая. При правильном механизме родов она должна проходить через таз в состоянии флексии окружностью, соответствующей малому косому размеру. Проходя через родовой канал, согнутая головка должна пройти своим прямым размером через поперечный размер входа в таз, через соответствующий косой размер полости таза и через прямой размер его выхода. При прорезывании подзатылочная ямка фиксируется под нижним краем симфиза, а вся противоположная часть головки вокруг этой точки фиксации проделывает большой круг вращения, т.е. над промежностью последовательно выкатываются подбородок, личико, лоб и, наконец, волосистая часть головки плода.
Таким образом, производя освобождение последующей головки как последний этап ручного пособия, врач должен полностью подражать всем моментам физиологического механизма родов при тазовом предлежании плода.
Для освобождения последующей головки предложено много способов. Лучшим из них является прием Морисо-Левре-Лашапелль. Выполняется он следующим образом: туловище плода акушер кладет верхом на предплечье руки и II или III палец руки, на которой находится плод, вводит во влагалище по задней его стенке, а затем в ротик плода, надавливая на нижнюю челюсть и сгибая ее; вторую руку располагают на плечиках плода, причем II и III пальцы находятся по сторонам шеи плода. Головку выводят, как отмечалось ранее, соответственно механизму родов. Если она находится во входе в таз, вначале рукой, охватывающей шею и плечи, производят влечение косо кзади и вниз. После того как головка опустилась в полость таза, тракции совершают кзади и вниз. Если головка опустилась настолько, что область подзатылочной ямки подошла под нижний край лобковой дуги, туловище плода приподнимают резко кпереди в сторону живота матери, и из половой щели показываются подбородок, лицо, а затем затылок. Рукой, вилообразно охватившей плечи и производящей влечение, нельзя сдавливать область надключичной ямки, поскольку вследствие прижатия нервного сплетения к I ребру в дальнейшем может развиться паралич Эрба. Во время освобождения головки ассистент помогает извлечению головки, оказывая на нее давление сверху через брюшную стенку.
Извлечение плода за тазовый конец
Извлечением плода за тазовый конец (extractio foetus clunibus pravis) называется операция, посредством которой плод, рождающийся в одном из вариантов тазового предлежания, искусственно выводят из родового канала. При операции извлечения плода за тазовый конец все манипуляции производят активно и начинают, когда еще весь плод или большая его часть находится в родовом канале. Таким образом, извлечение (экстракция) плода за тазовый конец производится лишь в случаях, если необходимо в интересах матери или плода (или обоих) быстро закончить роды, не применяя каких-либо инструментов.
Различают извлечение плода за ножку, за обе ножки и паховый сгиб. Показания к операции. Существуют следующие показания: 1. тяжелое состояние роженицы (кровотечение, преэклампсия, эклампсия, нарушение компенсации системы кровообращения или дыхания и др.); 2. острая внутриутробная гипоксия плода; 3. только что выполненный классический акушерский поворот плода на ножку.
Условия для операции. Для безопасного и успешного выполнения операции должны быть соблюдены следующие условия: 1. полное раскрытие шейки матки; 2. отсутствие плодного пузыря; 3. соответствие размеров таза роженицы и головки плода; 4. опорожненный мочевой пузырь.
Подготовка к операции. Операцию извлечения плода за тазовый конец необходимо выполнять в положении роженицы на спине и обязательно на операционном столе или на рахмановской кровати.
Производят обработку половых органов роженицы по общепринятым методикам.
Перед операцией внутривенно роженице вводят один из спазмолитических препаратов (1 мл 0,1 % раствора атропина сульфата; 2 мл 2 % раствора ношпы и т.д.). Операцию выполняют под наркозом – ингаляционным или внутривенным. Это предотвращает спазм внутреннего зева, нередко осложняющий операцию и приводящий при попытке насильственно извлечь головку через суженное место к внутричерепной травме новорожденного и к тяжелой травме (вплоть до разрыва матки) матери. В родильном зале должен находиться неонатолог-реаниматолог для оказания неотложной помощи ребенку.
При извлечении плода за тазовый конец условно различают четыре этапа: 1. извлечение плода до пупка; 2. извлечение его от пупка до нижнего угла лопаток; 3. выведение плечевого пояса; 4. выведение последующей головки.
 Рис. 25.28. Извлечение плода за ножку.
Рис. 25.28. Извлечение плода за ножку.
 Рис.25.29. Тракции при извлечении (проре-зывании) передней ягодицы.
Рис.25.29. Тракции при извлечении (проре-зывании) передней ягодицы.
Извлечение плода за ножку (рис. 25.28, 25.29). Первый этап. Ножку захватывают всей рукой, причем лучше в области коленного сустава, выше и ниже его, чтобы предупредить растяжение сустава. Влечение за ножку производят в зависимости от места расположения ягодиц по направлению оси родового канала. Если они находятся в широкой части полости таза, то косо кзади, вниз и кпереди. Вторую ножку не освобождают, она обычно рождается самостоятельно. После рождения ножек плод захватывают следующим образом: большие пальцы кладут сзади на ягодицы, один палец – спереди в паховый сгиб и три на бедро (но не на живот!). Извлечением плода (тракции кпереди) до пупочного кольца заканчивается первый этап операции (рис. 25.30).
Второй этап. Плод извлекают до нижнего угла лопаток. Этот момент выделяют вследствие того, что к освобождению ручек можно приступить лишь после рождения плода до нижнего угла лопаток, и со времени рождения плода до уровня пупка последующая головка, вступающая во вход в таз, может ущемить пуповину, что грозит гипоксией плода.
Третий и четвертый этапы. Освобождение ручек и головки производят так же, как при ручном пособии в случае тазового предлежания.
Извлечение плода за обе ножки.
К этому вмешательству приходится прибегать при полном предлежании ножек. Извлечение в таких случаях начинают с одновременного захватывания каждой ножки одноименной рукой. Захватывание каждой из ножек, равно как и все последующие манипуляции, производят так же, как при извлечении плода за одну ножку.
Извлечение плода за паховый сгиб.
Эта операция является одной из самых трудных в оперативном акушерстве. Для роженицы результат ее нередко бывает тяжелым вследствие травматизма, а для плода – часто роковым. Операция выполняется крайне редко – как правило, если упущено время для кесарева сечения. Это следует иметь в виду, так как способы извлечения вколотившихся в родовой канал ягодиц не всегда надежны в смысле получения желаемого эффекта. Одной из частых причин вколачивания ягодиц является клиническое несоответствие размеров таза матери размерам плода, а отсюда понятен неблагоприятный исход данной операции для матери и плода. Все способы, применяемые при экстракции плода в случаях чисто ягодичного предлежания с вколотившимися в таз ягодицами, можно разделить на две группы: ручные и инструментальные приемы извлечения.
 Рис. 25.30. Извлечение плода до пупочно-го кольца и нижнего угла лопаток.
Рис. 25.30. Извлечение плода до пупочно-го кольца и нижнего угла лопаток.
Ручное извлечение плода при чисто ягодичном предлежании представляет собой трудный, и к тому же малонадежный прием. С помощью пальцев акушер может регулировать и дозировать свою мышечную силу, поэтому при любых условиях надо начинать извлечение плода при вколотившихся ягодицах именно с ручных приемов. Ручные приемы легче выполнить в том случае, если ягодицы стоят низко, ближе к вульве. Ручные приемы еще эффективнее, если ягодицы уже прорезываются или по крайней мере, находятся в начале периода прорезывания. Тогда обычно нетрудно захватить тазовый конец пальцами обеих рук и развить достаточную силу при сравнительно малой сопротивляемости материнских тканей.
Техника извлечения плода за паховый сгиб (рис. 25.31, 25.32). Указательный палец руки, одноименной ножке плода, вводят в соответствующий паховый сгиб. При возможности ввести пальцы в оба паховых сгиба ситуация облегчается. Вводить в паховый сгиб больше одного пальца нельзя, поскольку второй введенный палец при маленьких размерах бедра ложится вне пахового сгиба – на бедро, что неизбежно приведет к его перелому. Тракции производят отвесно в зависимости от места расположения ягодиц соответственно оси родового канала с направлением влекущей силы на таз плода, а не на бедренную кость. Захватив таким образом тазовый конец плода, стараются вывести под нижний край симфиза "переднюю" ягодицу. Как только выводится "передняя" ягодица, вся подвздошная кость становится точкой вращения, вокруг которой вторая ("задняя") рука акушера вместе с "задней" ягодицей делает круговой поворот над промеж-ностью. Ножки обычно выпадают самостоятельно. Дальнейшие манипуляции производят в том же порядке, что и при извлечении плода за ножки.
Инструментальное извлечение плода за паховый сгиб (петлей, крючком, щипцами) очень часто приводит к тяжелым повреждениям плода (переломы бедра, повреждения мягких тканей, сосудов) и роженицы, поэтому в настоящее время применяется только на мертвом плоде.
Извлечение плода с помощью петли. Для того чтобы заменить быстро устающий палец, пользуются петлей, изготовленной из тесьмы, полоски марли, резинового жгута и т.д. Ее проводят через паховый сгиб так же, как и палец. Для проведения петли предлагались различные петлеводы, но они не получили распространения в практике. Некоторые акушеры предлагали накладывать петлю таким образом, чтобы она обхватывала весь таз плода в виде пояса, причем оба ее конца должны быть выведены между бедрами плода. Извлечение с помощью петли следует производить, подражая схваткам, с паузами между извлечениями. Как только ягодицы начинают прорезываться, петлю снимают и заканчивают извлечение плода с помощью ручных приемов.
К недостаткам извлечения плода с помощью петли, кроме технических трудностей ее введения, относятся часто наблюдаемые переломы бедра, протирание и размозжение мягких тканей пахового сгиба.
 Рис. 25.31. Введение указательного пальца руки в паховый сгиб.
Рис. 25.31. Введение указательного пальца руки в паховый сгиб.
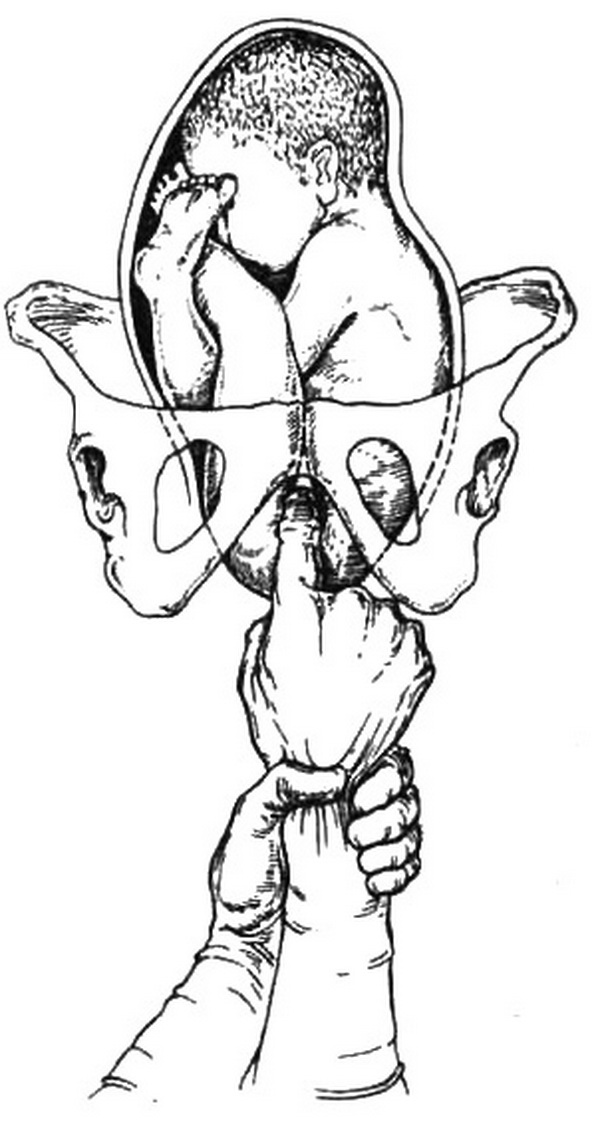 Рис. 25.32. Тракция плода за паховый сгиб.
Рис. 25.32. Тракция плода за паховый сгиб.
Извлечение ягодиц с помощью тупого крючка. Основной недостаток данного способа – серьезные повреждения плода. Техника применения крючка состоит в следующем: предварительно во влагалище вводят для контроля три (лучше четыре) пальца руки, одноименной переднему паховому сгибу плода. Кроме того, пальцы служат проводником для вводимого крючка и защищают ткани роженицы. Наружной рукой захватывают крючок таким образом, чтобы ручка вместе с кривизной крючка лежала в одной горизонтальной плоскости параллельно пальцам, введенным внутрь родового канала. Инструмент в таком виде спокойно скользит по сгибательной стороне предплечья и ладони, а затем по пальцам "внутренней" руки, пока не дойдет до тазового конца плода. Как только конец крючка доходит до переднего пахового сгиба плода, его следует повернуть таким образом, чтобы кривизна крючка совпала с паховым сгибом (рис. 25.33). Обычно крючок в таких случаях легко соскальзывает в паховый сгиб. Сначала делают пробную (легкую) тракцию, чтобы убедиться, что инструмент лежит правильно. За пробной тракцией следует операция извлечения. Потягивания за крючок необходимо производить в направлении оси таза. Как только ягодицы начинают прорезываться, крючок снимают и операцию заканчивают ручными приемами.
Извлечение плода с помощью щипцов.
Для извлечения фиксированных в тазе ягодиц предложены специальные щипцы, в большинстве случаев сконструированные по типу двух ягодичных крючков. Однако ягодичные щипцы в практике не привились как в связи с трудностями при их наложении, так и из-за травматизации плода. В акушерской практике при тазовых предлежаниях пользуются обычными щипцами, хотя есть и противники этой операции. По их мнению, щипцы сконструированы для головки и накладывание их на тазовый конец противоречит идее создания инструмента. Однако в ряде случаев правильно наложенные на тазовый конец акушерские головные щипцы помогут опытному акушеру выйти из тяжелого положения.
 Рис. 25.33. Введение и расположение крючка при извлечении плода за паховый сгиб.
Рис. 25.33. Введение и расположение крючка при извлечении плода за паховый сгиб.
Акушерские щипцы накладывают на тазовый конец только в тех случаях, если ягодицы плотно фиксированы в полости или на дне таза. Щипцы накладывают по возможности только в поперечном размере. Если ягодицы находятся еще в полости таза, то при поперечном наложении щипцов crista ossis ilei и trochanter major femoris с каждой стороны попадают в соответствующие ложки, что является лучшей гарантией правильного использования и действия щипцов. При стоянии ягодиц в прямом размере таза рекомендуется накладывать одну ложку щипцов на крестец, а другую – на заднюю поверхность бедер. Принципиально правильно применять в данном случае прямые щипцы Лазаревича, накладывая их в прямом размере выхода таза.
Профилактическое низведение ножки.
Это вмешательство грозит травмой роженицы и ребенка и часто влечет за собой гипоксию плода. Попытка извлечения ножки при опускании ягодиц в полость или выход таза должна быть категорически отвергнута. Совершенно другие условия имеются при высоко и подвижно стоящих ягодицах.
Показания к низведению ножки: аномалии развития плода (сомнительна его жизнеспособность), мертвый плод, а также низведение ножки второго плода при двойне в случае его гипоксии (и вслед за этим производят его экстракцию).
Операцию следует выполнять под наркозом для обеспечения лучшей релаксации роженицы.
Техника операции: по общему правилу низводят впереди лежащую ("переднюю") ножку, притом рукой соответственно расположению мелких частей плода (правой или левой, считая со стороны акушера). При смешанном ягодичном предлежании низведение ножки особых затруднений не вызывает. При чисто ягодичном предлежании низводить ножку значительно труднее, поскольку в этом случае ножки обычно вытянуты по длине туловища плода. В полость матки вводят соответствующую руку (при первой позиции – левую, при второй – правую). Ладонь вводимой руки должна быть обращена к животику плода. "Наружной" рукой при этом фиксируют дно матки. "Внутренней" рукой, достигнув ягодиц, слегка отталкивают их в сторону спинки плода, а затем, продвигая руку вдоль бедра, достигают голени, которую и захватывают всей кистью. Грубейшая ошибка – захватывание бедра, так как попытка его низвести неизбежно заканчивается разрывом матки или переломом бедра плода. Прежде чем низводить ножку, необходимо, вытянув ее по длине туловища, согнуть в коленном суставе. После этого с большой осторожностью производят низведение ножки, при котором происходит ее разгибание в тазобедренном суставе. После низведения ножки плод желательно извлечь, поскольку возможны его гипоксия, отслойка плаценты и т.д. Профилактическое низведение ножки в настоящее время практически не применяется.
Трудности и осложнения при акушерских пособиях и операциях при тазовых предлежаниях плода
Трудности и осложнения при извлечении плода и ручном пособии при тазовом предлежании плода. При осуществлении первого этапа извлечения плода за тазовый конец (извлечение до пупочного кольца) при выполнении тракции и давлении руками акушера не в области паховой складки, а на бедро возможны его перелом и повреждение кожных покровов, поэтому необходимо хорошо ориентироваться в правильности захвата плода за паховый сгиб. Затруднения (извлечение плода до нижнего угла лопаток) могут быть обусловлены также наличием у плода опухоли крестцовой области и увеличением размера живота вследствие асцита. В первом случае показано удаление опухоли, во втором – пункция брюшной стенки и выпускание асцитической жидкости.
Второй этап выведения тазового конца плода обычно трудностей не вызывает. Во избежание соскальзывания рук акушера таз ребенка покрывают стерильной салфеткой.
Третий этап – освобождение ручек. При освобождении ручек могут встретиться следующие трудности: 1. Ручка лежит далеко впереди головки. При этом введенными для ее освобождения со стороны спинки пальцами, продвигая их между головкой и стенкой таза, невозможно достигнуть локтевогосгиба. В этом случае можно использовать прием, известный под названием "освобождение ложной рукой". Суть его состоит в том, что со стороны грудки вводят разноименную ручке плода руку, стараясь захватить ручку и вывести ее наружу. 2. Запрокидывание ручек. К данному осложнению приводят несвоевременные или слишком энергичные попытки извлечь плод. В этих случаях ручки теряют типичное положение, отходят от грудки вверх и к личику (запрокидываются). Ручки могут располагаться либо впереди личика, либо по бокам головки, либо на затылке. Особенно трудно извлечь ручки в последнем случае. Предупреждение запрокидывания ручек заключается в предварительном тщательном обследовании роженицы и неторопливом проведении манипуляций. В некоторых случаях (в отсутствие ригидности тканей матери, при нормальных размерах таза и небольших размерах плода) освободить ручку удается путем введения всей руки со стороны спинки плода Если прием не удался, приходится прибегать к следующим манипуляциям; попытаться повернуть плод вокруг его продольной оси таким образом, чтобы этот поворот осуществлялся в направлении запрокинутой ручки. При этом, поворачивая туловище, следует одновременно вталкивать его обратно в половую щель роженицы. Прием сводится как бы к раскручиванию "скрутившегося шнура". Если запрокидывается впереди лежащая ручка, то сначала обычным путем освобождают "заднюю" ручку, после чего следует поворот туловища, но в направлении, обратном повороту при нормальных условиях, т.е. под симфизом поворачивается не спинка, а грудка плода. Если запрокинута "задняя" ручка, то плод поворачивают таким образом, чтобы под симфизом прошла его спинка. В результате незапрокинутая "передняя" ручка оказывается сзади и освобождается обычными при-емами. После этого приступают к новому повороту плода для того, чтобы ранее запрокинутая, а теперь свободно лежащая спереди ручка вновь повернулась кзади, где ее можно освободить обычными приемами. Труднее всего освободить запрокинутые на затылок обе ручки плода. Для освобождения ручек надо раскрутить "скрутившийся жгут". Все манипуляции необходимо производить быстро и достаточно бережно, помня, что времени в запасе имеется не очень много и плод может погибнуть от гипоксии. В крайнем случае можно попытаться извлечь головку вместе с ручками, однако эта операция очень травматична и не всегда успешна. Некоторые специалисты в случаях затрудненного извлечения ручек предлагают предварительно прибегнуть к перелому плечевой кости плода, что в настоящее время категорически отвергается. Перелом ручки и без того встречается достаточно часто. 3. Извлечение ручек при заднем виде тазового предлежания-. Возможность образования заднего вида должна быть предупреждена во время извлечения ножек и туловища плода. Если это произошло, необходимо осторожно попытаться повернуть плод спинкой кпереди При этом туловище плода захватывают двумя руками со стороны плечиков и поворачивают на [80°. как при освобождении ручек. Затем приступают к обычному освобождению ручек. Если поворот плода спинкой вперед не удался, немедленно приступают к освобождению ручек в заднем виде. Рекомендуется два способа: а) освобождение ручки со стороны грудки н б) освобождение ручки "ложной" рукой со стороны спинки.
Четвертый этап (извлечение головки). При извлечении последующей головки могут встретиться наибольшие и самые разнообразные затруднения и осложнения. 1. Разгибание головки. Головка разгибается, если приемы для ее извлечения начинают применяться раньше того, как произойдет фиксация области подзатылочной ямки у нижнего края симфиза. Это можно исправить следующим приемом: акушер вводит II или III палец в ротик плода, стараясь согнуть его головку, а ассистент при этом надавливает на головку сверху. 2. Поворот головки подбородком кпереди. Если предотвратить образование заднего вида не удалось, то предложенные для таких случаев способы извлечения головки редко дают благоприятные результаты. Чаще всего при этом либо происходит интранатальная гибель плода, либо ребенок погибает вскоре после родов от родовой травмы. Тем не менее можно попытаться прибегнуть к одному из следующих приемов: вводят в ротик плода II или III палец и производят сгибание головки, выводят из-под симфиза путем тракции кзади подбородок и личико до образования точки фиксации (glabella) под лобком, затем туловище плода резко отклоняют кпереди и головку выводят над промежностью. Если этот прием не удался, то, удерживая палец во рту, быстро поднимают туловище за ножки кпереди и выводят головку. В этом случае точкой фиксации являются переносица или скуловые кости. Над промежностью выкатывается затылок, а затем при опускании ножек – личико. Если подбородок находится высоко и достичь рта не удается, производят давление на подбородок снизу вверх, стремясь увеличить разгибание. В то же время захватывают пальцами второй руки плечики и поднимают их резко кпереди. При этом точка фиксации спереди находится на передней поверхности шеи, а над промежностью выкатывается затылок.
Затем ребенка поднимают кпереди и вверх параллельно передней брюшной стенке матери. При этом рождаются личико и подбородок. Если подбородок находится слева или справа от лобкового симфиза, т.е. головка находится в одном из косых размеров, то стремятся повернуть ее в передний вид.
При затруднениях в выведении головки некоторые авторы рекомендуют применять акушерские щипцы, которые накладывают по тем же правилам, что и при головном предлежании. В тех случаях, когда головка находится в полости таза затылком кпереди, тракции совершают книзу, чтобы подзатылочную ямку подвести под нижний край симфиза, после чего направление тракции изменяют кпереди, вращая головку вокруг точки фиксации. Следует отметить, что в настоящее время наложение щипцов на последующую головку применяется крайне редко. За границей используют специально раз-работанную для этих случаев модель акушерских щипиов – щипцы Piper.
Осложнения при операции извлечения плода за тазовый конец. 1. Повреждения матери. Разрывы шейки матки. Происходят в тех случаях, когда к операции прибегают в отсутствие полного открытия шейки матки. Насильственное и настойчивое извлечение плода при этом может привести к разрыву шейки матки и даже к такой серьезной травме, как отрыв шейки матки от сводов влагалища. Разрывы влагалища и промежности. Быстрое прохождение головки, введение во влагалище руки, грубые манипуляции по извлечению ручек и головки – главные причины данных осложнений. В некоторой степени мерой профилактики может служить своевременно и в достаточной мере произведенная эпизиотомия. Травматические повреждения таза. Происходят в случаях, если имеется значительное несоответствие между размерами таза матери и головки плода или применяется слишком грубая и большая сила при экстракции плода за тазовый конец. Чаще повреждается лонное (реже крестцово-подвздошное) сочленение. 2. Повреждения плода. Могут быть различного рода: от небольших ссадин и кровоподтеков до смертельно опасных (разрыв мозжечкового намета, массивные кровоизлияния в головной мозг, переломы костей свода черепа, разрывы печени, селезенки и других органов брюшной полости и т.д.). Наиболее часто наблюдаются различные переломы – плечевой кости, ключиц, предплечий, бедер. Механизм их возникновения изложен ранее и связан в основном с нарушением техники оказания пособия или выполнения операции.
Вакуум-экстракция плода
Вакуум-экстракция плода (лат. vacuum – пустота; extrahere – вытягивать) – акушерская родоразрешающая операция извлечения живого плода во время родов с помощью специального аппарата – вакуум-экстрактора, чашечка которого присасывается к предлежащей части плода (головке) за счет разрежения воздуха.В нашей стране вакуум-экстракция используется в 0,12-0,20 % всех родов и в последнее время отмечается все более редкое ее применение. Низкий процент вакуум-экстракции объясняется расширением показаний к операции кесарева сечения в интересах плода.
Устройство вакуум-экстрактора Мальмстрома (рис. 25.34,а). Аппарат снабжен комплектом (7 штук) металлических чашечек (колпачков), различающихся диаметром (от 15 до 60 мм). Для экстракции головки доношенного плода используют обычно три большие чашечки (диаметром 40-60 мм) с закругленным гладким краем и вогнутой внутренней поверхностью. В центре чашечки имеется отверстие, прикрытое тонкой металлической пластинкой, которая не закрывает отверстие. К пластинке прикрепляется цепочка, пропущенная через резиновую трубку. Цепочка соединяет чашечку с металлическим краном, служащим для закрепления цепочки. Имеется устройство с вакуумметром для создания отрицательного давления.
Наиболее целесообразно использовать эластические (силиконовые, резиновые) чашечки больших размеров, которые менее травматичны для плода и для матери.
Для создания вакуума в настоящее время созданы аппараты с регулируемым отрицательным давлением (рис. 25.34,6).
Показания к наложению вакуум-экстрактора . Показаниями к вакуум-экстракции служат: 1. слабость родовой деятельности, не поддающаяся медикаментозной терапии; 2. низкое поперечное стояние стреловидного шва; 3. начавшаяся острая гипоксия плода.
Условиями для наложения вакуум-экстрактора являются: 1. Живой плод. 2. Полное раскрытие маточного зева. 3. Отсутствие плодного пузыря. 4. Нахождение головки плода в широкой или узкой части полости малого таза. 5. Соответствие между размерами малого таза и головкой плода. 6. Точное знание топографических соотношений в малом тазе в момент наложения вакуум-экстрактора. 7. Опорожненный мочевой пузырь.
 Рис. 25.34. Вакуум-экстракторы с чашечками, а – внешний вид; б – схема.
Рис. 25.34. Вакуум-экстракторы с чашечками, а – внешний вид; б – схема.
Противопоказания к наложению вакуум-экстрактора следующие: 1. Мертвый плод. 2. Неполное раскрытие маточного зева. 3. Гидроцефалия, анэнцефалия. 4. Разгибательные предлежания и высокое прямое стояние стреловидного шва. 5. Анатомически (II -III степень сужения) и клинически узкий таз. 6. Глубоко недоношенный плод. 7. Высокое расположение головки (прижата, стоит малым или большим сегментом во входе в таз). 8. Заболевания матери, тре-бующие выключения потуг (гестоз, преэклампсия, эк-лампсия, гипертоническая болезнь, пороки сердца с явлениями декомпенсации и др.).
 Рис. 25.35. Наложение чашечек вакуумэкстрактора.
а – типы фиксации: 1 – сгибательный (идеальный), 2 – разгибательный, 3 – парамедиальный; б – локализация чашечки вакуум-экстрактора на головке плода: 1 – в области малого родничка, 2 – в области заднего угла большого родничка; 3 – парамедиальное расположение при асинклитизме.
Рис. 25.35. Наложение чашечек вакуумэкстрактора.
а – типы фиксации: 1 – сгибательный (идеальный), 2 – разгибательный, 3 – парамедиальный; б – локализация чашечки вакуум-экстрактора на головке плода: 1 – в области малого родничка, 2 – в области заднего угла большого родничка; 3 – парамедиальное расположение при асинклитизме.
Подготовка к операции. Подготовка такая же, как и при всех влагалищных операциях. Перед операцией опорожняют мочевой пузырь с помощью элас-тического катетера. Ингаляционный и внутривенный наркоз противопоказаны, так как роженица должна тужиться при экстракции. Для обезболивания, особенно у первородящих, показано проведение двусторонней новокаиновой анестезии срамных нервов, что также способствует расслаблению мышц промежности. Непосредственно перед операцией производят влагалищное исследование для выяснения акушерской ситуации.
При наложении вакуум-экстрактора обязательны наличие ассистента, присутствие анестезиолога и неонатолога, владеющего техникой реанимации новорожденных.
Техника операции. Правой рукой под контролем пальцев левой руки вводят во влагалище боковой стороной чашечку № 5-7 в зависимости от емкости влагалища, высоты промежности. Очень важно правильно фиксировать чашечку на головке плода. Прикрепление чашечки в области малого родничка способствует сгибанию головки и правильному механизму родов. Расположение чашечки на границе между малым и большим родничком способствует разгибанию при тракции. При фиксации чашечки сбоку от стреловидного шва возникает асинклитическое вставление головки (рис. 25.35).
После того как чашечка подведена к головке, надо убедиться, что не захвачены края шейки или стенка влагалища, затем следует прижать чашечку к головке. Помощник соединяет шланги от чашечки и вакуум-аппарата и медленно (в течение 2-4 мин) с помощью ручного насоса или специально2го аппарата создает отрицательное давление 520 мм рт. ст. (0,7-0,8 кг/см ). При этом под колпачком чашечки на головке образуется родовая опухоль ("шиньон"), за счет которой удерживается чашечка. Слишком быстрое создание вакуума может вызвать образование кефалогематомы.
 Рис. 25.37. Извлечение головки плода с помощью вакуум экстрактора.
Рис. 25.37. Извлечение головки плода с помощью вакуум экстрактора.
 Рис. 25.36. Наложение чашечки вакуум-экстрактора (а) и начало тракции (б).
Рис. 25.36. Наложение чашечки вакуум-экстрактора (а) и начало тракции (б).
После создания вакуума следует еще раз проверить правильность расположения чашечки вакуум-экстрактора на головке. Убедившись, что чашечка наложена правильно, приступают к тракциям. Акушер располагает пальцы руки на резиновом шланге непосредственно у самой чашечки (иногда на расстоянии) и производит тракции синхронно с потугами, соответственно проводной оси таза и механизму родов (рис. 25.36, 25.37). При неправильном направлении тракции чашечка может соскочить и нанести серьезную травму роженице. Во время тракции можно производить ротацию головки в нужном направлении.
Перед прорезыванием теменных бугров следует произвести рассечение промежности (срединно-латеральная эпизиотомия). При прорезывании теменных бугров чашечку отделяют от головки после ликвидации вакуума. Затем головку выводят ручными приемами. Длительность операции не должна превышать 15-20 мин, так как нарастает риск кровоподтека, образования кефалогематомы, травмирования головного мозга.
В случае соскальзывания чашечки ее нельзя перекладывать более 2 раз ввиду большой травматичноети для плода. Соскальзывание чашечки свидетельствует, как правило, о неправильном выборе метода родоразрешения. Если головка расположена достаточно высоко, приходится иногда прибегать к кесареву сечению. При нахождении ее в полости малого таза необходимо наложить щипцы.
Неэффективность вакуум-экстракции наблюдается в 1 – 2 7% случаев.
После операции наложения вакуум-экстрактора, особенно если операция была трудной, показаны ручное отделение последа и контрольное обследование стенок матки для выяснения ее целости. Во всех случаях после вакуум-экстракции плода показан осмотр шейки матки и влагалища при помощи зеркал, а при нарушении их целости необходимо наложение швов.
Для профилактики кровотечения в последовом и раннем послеродовом периодах необходимо внутривенное введение утеротонических средств (мегилэргометрин, окситоцин).
Осложнения.
Осложнения во время операции вакуум-экстракции могут наблюдаться со стороны как матери (разрывы промежности, влагалища, малых и больших половых губ, клитора, шейки матки и редко разрыв нижнего :егмента матки, мочевого пузыря, симфиза), так и плода (ссадины и ранения на головке, кефалогематомы, внутричерепные кровоизлияния и др.).
При наложении вакуум-экстрактора по поводу гипоксии плода у 20,2 % цетей в дальнейшем наблюдаются нарушения функции центральной нервной :истемы. Установлена связь таких нарушений с длительностью вакуумэкстракции и тяжестью асфиксии до операции.
По мнению большинства авторов, вакуум-экстракция менее травматичia для матери, но более травматична для плода, чем акушерские щипцы.
Кесарево сечение
Сесарево сечение (caesarean section) – хирургическая операция, при которой 1лод и послед извлекают через разрез брюшной стенки (лапаротомия) и латки (гистеротомия).Эта дефиниция не включает удаление плода из брюшной полости в угучаях разрыва матки или при брюшной беременности.
Различают абдоминальное кесарево сечение, производимое путем раз›еза передней брюшной стенки, и влагалищное, осуществляемое через пе›еднюю часть свода влагалища.
Абдоминальное кесарево сечение применяют главным образом в качестве родоразрешающей операции, реже его выполняют для прерывания беременкости по медицинским показаниям в сроки от 16 до 28 нед. В последнем случае операцию называют "малое кесарево сечение".
Влагалищное кесарево сечение применяется редко в связи с технической сложностью и опасностью повреждения мочевого пузыря.
Историческая справка.
Существуют разноречивые мнения о происхож-дении названия операции. Полагают, что происхождение названия операции связано с именем Гая Юлия Цезаря, который был извлечен абдоминальным путем, за что и получил имя Caesar. Имеются и другие версии названия кесарева сечения.
В термине "caesarean section" имеется тавтология. Слова "caesareum", "caesones" происходят от латинского глагола caedere – резать. В то же время слово "section" происходит тоже от латинского глагола "seco", что также означает резать, рассекать, т.е. получается термин "сечение сечением".
Началом истории кесарева сечения можно считать конец VII века до н.э., когда римский император Numa Pompilius издал закон, согласно которому запрещалось погребение беременных женщин без предварительного извлечения ребенка путем чревосечения и разреза матки. Это правило вошло затем в законодательства боль-шинства европейских стран и сохранилось до настоящего времени.
Началом научной истории кесарева сечения, ее первого этапа можно считать опубликование в 1581 г. монографии F.Rousset "Traite Nouvean de 1 Hysterotomotokie on 1 Enfantement Cesaerien", в которой дано достаточно подробное описание техники операции корпорального кесарева сечения и показаний к ней (неправильное поло-жение плода, узкий таз и др.). Автор не рекомендовал зашивать матку, что являлось источником кровотечений и инфекции, нередко заканчивалось гибелью женщины.
Первое достоверное сообщение о кесаревом сечении на живой женщине было в 1610 г. Операцию осуществил J.Trautman из Виттенборга. В России первое кесарево сечение было выполнено И.Эразмусом в г.Пернове (1756) и В.М.Рихтером (1842) в Москве. Д.Самойлович (1780) защитил диссертацию, в которой обсуждался вопрос о кесаревом сечении и симфизиотомии.
Кесарево сечение – цесарская операция, или утробосечение (показания, техника и послеоперационный уход), подробно описана в учебнике Н.М.Максимовича-Амбодика "Искусство повивания, или наука о бабичьем деле" (1784).
В доантисептический период (до 1880 г.) материнская летальность после кеса-рева сечения составляла примерно 80 %, после введения антисептики она снизилась до 50% [Шредер К., 1896].
Началом второго этапа следует считать 1876 г., когда Г.Е.Рейн и независимо от него Е.Рогго предложили после извлечения ребенка удалять тело матки, которое являлось источником кровотечения и инфекции, а культю шейки матки рекомендо-вали вшивать в брюшную рану.
Следующий этап развития кесарева сечения ознаменовался наложением маточ-ного шва на матку. В 1769 г. F.Labas для зашивания раны на матке использовал шелк, но результат оказался неудовлетворительным. Для зашивания раны на матке в 1852 г. F.E.Polin (штат Кентукки) с успехом использовал серебряную нить. В 1874 г. В.Н.Штольц первым в России произвел кесарево сечение с зашиванием раны на матке, а 7 лет спустя русский врач А.Э.Шмидт защитил диссертацию на тему: "Клинические и экспериментальные исследования о маточном шве". Введение ма-точного шва за рубежом связывают с именем F.Kehrer, который 25.09.1881 г. сделал кесарево сечение в крестьянском доме и наложил на разрез матки трехрядный шов.
F.A.Kehrer (1882) – основоположник операции кесарева сечения в нижнем сегменте матки поперечным разрезом (до этого матка рассекалась продольно в области тела).
В России П.В.Занченко (1935) и Л.А.Гусаков (1939) являются инициаторами абдоминального кесарева сечения в нижнем сегменте матки. Данная методика до настоящего времени является оптимальной.
Попыткой снижения числа гнойно-сентических осложнений при операции кесарева сечения была разработка внебрюшиннога (экстраперитонеального) доступа к матке. Его пионерами были Jordl (1806) и Ritgcn (1821), Physiks (1822).
Вновь операция экстраперитонеального кесарева сечения заинтересовала спе-циалистов в 70-е годы XX столетия [Морозов Е.Н., 1974; Персианинов Л.С. и др., 1977; Гладун ЕВ ., 1979; Комиссарова Л.М., 1979; Joschko R., 1974; Perkins R.P., 1977, и др.].
Ввиду технической сложности выполнения операции экстраперитонеального кесарева сечения и наличия других возможностей снижения послеоперационных осложнений она не нашла широкого применения.
С середины 50-х годов были достаточно разработаны и внедрены в практику переливание крови, обезболивание, использование антибактериальных препаратов (сульфаниламиды, антибиотики). Исход операции стал благоприятным для матери и плода. Это способствовало расширению показаний к кесареву сечению не только со стороны матери, но и со стороны плода в условиях снижения рождаемости в развитых странах.
Известно, что рубец на матке часто является причиной разрыва матки по рубцу. Остается проблема гнойно-септических осложнений после операции кесарева сечения, возникла проблема ведения беременности и родов при наличии рубца на матке.
В настоящее время большое внимание уделяется совершенствованию техники операции кесарева сечения, изысканию новых шовных материалов, новых антибиотиков для профилактики гнойно-септических осложнений, совершенствованию методов обезболивания, оценке состоятельности рубца на матке после кесарева сечения. Возрождена идея экстраперитонеального кесарева сечения как одного из путей снижения инфекционных осложнений после операции (перитонит).
Абдоминальное кесарево сечение
Кесарево сечение выполняется в тех случаях, когда родоразрешение через естественные родовые пути невозможно или опасно для жизни матери либо плода.
Кесарево сечение – наиболее частая операция в акушерстве. В России частота кесарева сечения за последние 10 лет выросла примерно в 3 раза (с 3,3 % в 1985 г. до 13,0 % в 1997 г.) и продолжает расти.
Причинами роста числа операций кесарева сечения являются следую щие: 1. уменьшение паритета (большинство первородящих); 2. увеличение числа пожилых первородящих; 3. мониторинг плода, ультразвуковое исследование, рентгенопельвиометрия; 4. кесарево сечение в анамнезе; 5. стремление расширить показания к кесареву сечению в интересах плода.
Усовершенствование оперативной техники, совершенствование анестезиологического пособия, правильное послеоперационное ведение родильниц после кесарева сечения позволяют считать родоразрешение абдоминальным путем зачастую операцией выбора.
Показания. К операции кесарева сечения показания могут быть со стороны матери, когда в силу того или иного заболевания роды представляют угрозу для ее здоровья, и со стороны плода, когда для него родовой акт является нагрузкой, которая может привести к гипоксии, родовой травме, рождению в асфиксии. Часто показания бывают со стороны как матери, так и плода и их четко разделить не представляется возможным.
В течение ряда столетий допускались только так называемые абсолютные показания к этой операции, т.е. такие патологические состояния, при которых невозможно извлечь через естественные родовые пути ни живой, ни мертвый (даже после эмбриотомии) доношенный плод. С конца XIX столетия акушеры начали производить кесарево сечение и по так называемым относительным показаниям, т.е. когда возможно извлечение доношенного плода через естественные родовые пути, но имеется опасность прежде всего для плода. Термин "относительные показания" является условным, так как невозможно четко разделить абсолютные и относительные показания. Целесообразно заменить прежние термины (абсолютные и относительные показания) на показания к кесареву сечению во время беременности и в родах.
Показаниями к операции кесарева сечения во время беременности являются: 1. полное предлежание плаценты; 2. неполное предлежание плаценты с выраженным кровотечением при неподготовленных родовых путях; 3. преждевременная отслойка нормально расположенной плаценты при неподготовленных родовых путях; 4. несостоятельность рубца на матке после кесарева сечения или других операций на матке; 5. два рубца на матке и более после кесаревых сечений; 6. анатомически узкий таз II-IV степени сужения (истинная коньюгата 7,5 см и меньше), опухоли или деформации костей таза; 7. пороки развития матки и влагалища; 8. опухоли шейки матки, яичников и других органов прлости малого таза, блокирующие родовые пути; 9. крупный плод в сочетании с другой патологией; 10. выраженный симфизит; 11. множественная миома матки больших размеров, дегенерация миоматозных узлов; 12. тяжелые формы гестоза в отсутствие эффекта от терапии; 13. тяжелые экстрагенитальные заболевания (заболевания сердечно-сосудистой системы с явлениями декомпенсации, заболевания нервной системы, сахарный диабет, миопия высокой степени, особенно осложненная и др.); 14. выраженные рубцовые сужения шейки матки и влагалища; 15. состояние после пластических операций на шейке матки и влагалище, после ушивания мочеполовых и кишечно-половых свищей; 16. рубец на промежности после ушивания разрыва III степени в предшествующих родах; 17. выраженное варикозное расширение вен в области влагалища и вульвы; 18. поперечное положение плода; 19. сросшаяся двойня; 20. тазовое предлежание плода в сочетании с разогнутой головкой, при массе плода более 3600 г и менее 1500 г, с сужением таза; 21. экстракорпоральное оплодотворение и перенос эмбриона, искусственная инсеминация при наличии других осложнений со стороны матери и плода; 22. хроническая гипоксия плода, гипотрофия плода, не поддающаяся медикаментозной терапии; 23. возраст первородящих старше 30 лет в сочетании с акушерской и экстрагенитальной патологией; 24. длительное бесплодие в анамнезе в сочетании с другими отягощающими факторами; 25. гемолитическая болезнь новорожденного при неподготовленности родовых путей; 26. сахарный диабет при необходимости досрочного родоразрешения и неподготовленности родовых путей; 27. переношенная беременность при отягощенном гинекологическом или акушерском анамнезе и неподготовленных родовых путях; 28. экстрагенитальный рак и рак шейки матки; 29. обострение генитального герпеса.
Показания к операции кесарева сечения в родах. 1. клинически узкий таз; 2. преждевременное излитие околоплодных вод и отсутствие эффекта от родовозбужде н ия; 3. аномалии родовой деятельности, не поддающиеся медикаментозной терапии; 4. острая гипоксия плода; 5. отслойка нормально или низко расположенной плаценты; 6. угрожающий или начинающийся разрыв матки; 7. предлежание и выпадение петель пуповины при неподготовленных родовых путях; 8. неправильные вставления и предлежания головки плода (лобное, передний вид лицевого, задний вид высокого прямого стояния стреловидного шва); 9. состояние агонии или внезапная смерть роженицы при живом плоде.
Кесарево сечение выполняется также по сочетанным показаниям. Эти показания называют также комбинированными. Они являются совокупностью нескольких осложнений беременности и родов, каждое из которых в отдельности не служит показанием к кесареву сечению, но вместе они создают реальную угрозу для жизни плода в случае родоразрешения через естественные родовые пути. К ним относят слабость родовой деятельности, дистоцию шейки матки, переношенную беременность, роды у первородящих старше 30 лет, внутриутробную гипоксию плода, мертворождаемость или невынашивание в анамнезе, предшествующее длительное бесплодие, тазовые предлежания плода, крупный плод, выпадение петель пуповины, сужение таза I степени, гестоз и др. Когда у роженицы возникают указанные осложнения, то для профилактики заболевания новорожденных и гибели детей производят кесарево сечение.
Кесарево сечение при беременности обычно выполняют в плановом порядке и реже в экстренном (кровотечение при предлежании плаценты или преждевременная отслойка нормально расположенной плаценты, угроза разрыва матки по рубцу, отсутствие эффекта от лечения гестоза, тяжелых экстрагенитальных заболеваний и др.). Кесарево сечение в родах производят по экстренным показаниям.
Более целесообразно осуществлять плановое кесарево сечение, когда имеется возможность заблаговременно провести подготовку к операции, решив вопрос о методе ее выполнения, выбрать шовный материал, наркоз и др., а также тщательно оценить состояние женщины, привлекая смежных специалистов. Важным является и то, что при наличии различных экстрагенитальных заболеваний имеется возможность провести соответствующую медикаментозную подготовительную терапию. Результаты при планово проведенных операциях значительно лучше, чем при экстренных.
Травма плода менее вероятна при кесаревом сечении, однако эта операция полностью не гарантирует его от повреждения. Возможно повреждение недоношенного плода в связи с недостаточным разрезом на матке (повреждение спинного или головного мозга). Плод может быть травмирован во время рассечения матки.
Структура показаний к кесареву сечению во всех странах изменяется, и одно из первых мест в настоящее время занимает рубец на матке после предыдущего кесарева сечения.
Противопоказания. При выполнении кесарева сечения учитывают следующие противопоказания: 1) внутриутробная смерть плода или уродство, несовместимое с жизнью; 2) глубокая недоношенность; 3) гипоксия плода, если нет уверенности в рождении живого (единичные сердцебиения) и жизнеспособного ребенка и нет неотложных показаний со стороны матери. Противопоказания теряют силу, если возникает угроза для жизни женщины (кровотечение вследствие отслойки плаценты, предлежания плаценты и др.).
Условием для выполнения кесарева сечения служит наличие живого и жизнеспособного плода.
В акушерской практике иногда возникают такие ситуации, когда при наличии потенциальных или клинически выраженных признаков инфекции (хориоамнионит, эндометрит) в организме женщины при живом и жизнеспособном плоде отсутствуют условия для быстрого родоразрешения через естественные родовые пути. Единственным методом, позволяющим получить живого ребенка и предотвратить развитие перитонита у матери в данной ситуации, является операция кесарева сечения без вскрытия брюшины, т.е. экстраперитонеально.
Для выполнения кесарева сечения необходимо согласие матери на операцию, что отражается в истории родов.
Предоперационная подготовка и обезболивание. У беременных и рожениц задачи предоперационной медикаментозной подготовки при кесаревом сечении могут быть сформулированы следующим образом: 1. достижение психического покоя и устранение страха; 2. предупреждение побочных влияний наркотических и анестезирующих средств и блокада нежелательных нейровегетативных реакций; 3. профилактика и терапия некоторых осложнений беременности и родов (гестоз, кровотечение, нарушение процессов свертывания крови и др.); 4. опорожнение желудка (опасность синдрома Мендельсона); 5. профилактика и терапия внутриутробной гипоксии плода.
В случае планового кесарева сечения беременная накануне принимает гигиенический душ; вечером и утром за 2 ч до операции назначают очистительную клизму. На ночь перед операцией дают снотворное, за час до операции делают премедикацию, непосредственно перед операцией опорожняют мочевой пузырь и оставляют в нем катетер на время операции.
При экстренном вмешательстве производят гигиеническую обработку. Если беременная принимала пищу за несколько часов до операции, то промывают желудок и оставляют зонд в желудке, чтобы избежать бронхоспазма от попадания рвотных масс в дыхательные пути (синдром Мендельсона). Проводят премедикацию, опорожняют мочевой пузырь. На операционном столе необходимо выслушать сердцебиение плода.
Обезболивающие средства, применяемые при кесаревом сечении, не должны приводить к угнетению сократительной деятельности матки во избежание гипотонического кровотечения во время и после операции.
При кесаревом сечении используется преимущественно эндотрахеальный ингаляционный наркоз или перидуральная анестезия, в редких случаях – местная (инфильтрационная) анестезия. При экстренной операции кесарева сечения, как правило, применяется эндотрахеальный ингаляционный наркоз.
За 15-20 мин до операции внутривенно вводят 0,5 мг атропина сульфата. Для основного наркоза (до и после извлечения плода) используют закись азота. Время от начала наркоза до извлечения ребенка не должно превышать 7-10 мин. После извлечения плода методика нейролептанадгезии не отличается от таковой при хирургических операциях.
При выполнении операции кесарева сечения с успехом можно использовать перидуральную анестезию лидокаином. Целесообразно оставить катетер в перидуральном пространстве и использовать в послеоперационном периоде для обезболивания.
Операция кесарева сечения является одной из самых распространенных операций в акушерской практике и относится к числу неотложных пособий, которым обязан владеть каждый акушер-гинеколог.
Кесарево сечение необходимо производить в условиях операционной специалистом, хорошо владеющим техникой абдоминального чревосечения. Только при жизненных показаниях и невозможности транспортировать беременную или роженицу операция может быть произведена в неприспособленном помещении, но с соблюдением правил асептики и антисептики.
Во время операции необходимо присутствие неонатолога, владеющего техникой реанимации, особенно в случаях внутриутробного страдания плода или недоношенности.
Виды операции. В зависимости от того, вскрывается или нет брюшная полость, и от локализации разреза на матке различают следующие виды операции: 1. Интраперитонеальное кесарево сечение: * корпоральное (классическое) кесарево сечение и его разновидности; * кесарево сечение в нижнем сегменте матки поперечным разрезом; * истмико-корпоральное. 2. Кесарево сечение в нижнем сегменте матки с временной изоляцией брюшной полости. 3. Экстраперитонеальное кесарево сечение.
Выбор метода операции должен определяться конкретной акушерской ситуацией, состоянием матери, плода и хирургической подготовкой акушера-гинеколога.
Оптимальным является кесарево сечение в нижнем сегменте матки поперечным разрезом. Преимущества данного метода по сравнению с корпоральным состоят в следующем: вскрытие матки осуществляется по направлению расположения мышечных пластов и сосудов, что способствует меньшей кровопотери, меньшей опасности атонического кровотечения и инфицированию брюшной полости. Поперечный разрез на матке легче зашивать; более удобна и совершенна перитонизация маточной раны за счет пузырно-маточной складки. При этом лучше и прочнее формируется рубец на матке, в дальнейшем реже образуются спайки в брюшной полости, реже встречаются разрывы матки по рубцу при последующих беременностях и родах, меньше нарушений менструального цикла, воспалительных заболеваний, бесплодия, меньше нарушается трудоспособность женщин.
Широко применявшееся ранее корпоральное кесарево сечение, несмотря на многие недостатки, имеет свои показания. Его выполняют при выраженном спаечном процессе в нижнем сегменте матки, при наличии неполноценного рубца после предыдущего корпорального кесарева сечения, при выраженном варикозном расширении вен в нижнем сегменте матки; при полном предлежании плаценты, когда требуется быстрое родоразрешение в интересах матери и плода (например, при профузмом маточном кровотечении); когда вслед за операцией необходимо произвести гистерэктомию; при недоношенном плоде и не развернутом нижнем сегменте матки; при сросшейся двойне; при запущенном поперечном положении плода; при наличии в области нижнего сегмента миоматозного узла.
Если нижний сегмент матки не развернут (недоношенная беременность, нет готовности к родам при доношенной беременности и др.), можно производить истмико-корпоральное кесарево сечение с продольным разрезом на матке.
У беременных с высоким риском развития послеоперационных инфекционных осложнений (длительный безводный промежуток, затяжные роды, лихорадка в родах свыше 37,6 °С, хориоамнионит, эндометрит, острый пиелонефрит и др.) при живом и жизнеспособном плоде и в отсутствие условий для быстрого родоразрешения через естественные родовые пути методом выбора, позволяющим получить живого ребенка и предотвратить развитие перитонита у матери, является операция кесарева сечения без вскрытия брюшины (экстраперитонеально) или с временной изоляцией брюшной полости.
Во время кесарева сечения независимо от методики возможны осложнения: продление разреза в разрыв, ранение сосудистого пучка, ранение мочевого пузыря, кишечника, гипотоническое кровотечение. Важно своевременно выявить осложнения, чтобы их устранить.
Корпоральное кесарево сечение.
В настоящее время при операции кесарева сечения используется три вида вскрытия передней брюшной стенки: нижнесрединный разрез, разрез по Пфанненштилю и Джоел-Кохена. При выборе способа лапаротомии при кесаревом сечении следует подходить строго индивидуально и руководствоваться величиной доступа к матке, экстренностью и скоростью проведения операции, состоянием брюшной стенки (наличие или отсутствие рубца на передней брюшной стенке в нижних отделах живота), возможностью послеоперационных осложнений (послеоперационные грыжи), косметичностью шва и др. Так, если в анамнезе было кесарево сечение с использованием нижнесрединной лапаротомии, то при повторной операции применяется тот же доступ.
При нижнесрединном разрезе хирург обычно стоит справа от беременной и скальпелем рассекает кожу и подкожную клетчатку до апоневроза по средней линии живота на протяжении от пупка до лона. Производят гемостаз, захватывая кровоточащие сосуды зажимами и перевязывая их тонким викрилом (кетгутом). При необходимости срочного родоразрешения (кровотечение, острая гипоксия плода и т.п.) кровоточащие сосуды захватывают зажимами, рану обкладывают большими марлевыми салфетками и сосуды перевязывают при зашивании брюшной стенки. Апоневроз разрезают по средней линии. При этом следует учитывать, что у беременной обычно имеется расхождение прямых мышц живота и при слишком энергичном рассечении кожи и подкожной клетчатки, особенно если последняя слабо развита, можно разрезать не только апоневроз и прилегающую к нему брюшину, но и стенку матки.
Разрез апоневроза можно полностью произвести скальпелем, но менее опытному хирургу лучше сделать сначала небольшой разрез, а затем ножницами продлить его в сторону лона и пупка до намеченного размера.
Вскрытие брюшины следует производить с большой осторожностью и начинать его ближе к пупку, так как при беременности верхушка мочевого пузыря может располагаться высоко. Особенно осторожно следует вскрывать брюшину при повторном чревосечении, при спаечной болезни из-за опасности ранить сальник, кишечник, мочевой пузырь и др. Вскрыв брюшину, операционную рану ограждают от брюшной полости салфетками, ограничивая этим попадание околоплодных вод и крови в брюшную полость.
В настоящее время переднюю брюшную стенку чаще вскрывают поперечным надлобковым разрезом по Пфанненштилю. Такой разрез редко осложняется послеоперационными грыжами и косметичен; после операции больные раньше встают, что способствует предупреждению тромбофлебита и других осложнений.
Поперечный разрез дугообразной формы проводят по надлобковой складке длиной 15-16 см (рис. 25.38). Рассекают кожу и подкожную клетчатку; последнюю целесообразно разрезать не перпендикулярно к апоневрозу, а несколько скашивая в сторону пупка, что уменьшает кровотечение из раны. Обнаженный апоневроз рассекают дугообразным разрезом на 3-4 см выше разреза кожи. Апоневроз можно разъединять тупо пальцами (при этом не нарушается целость сосудов), после чего его отслаивают от прямых и косых мышц живота вниз до лобка и вверх до пупочного кольца. Отсепарованный апоневроз отводят в сторону лобка и пупка. Такое относительно высокое (над лоном) рассечение апоневроза способствует увели-чению доступа к беременной матке. Прямые мышцы живота разъединяют пальцами в продольном направлении. Учитывая, что верхняя граница мочевого пузыря (даже опорожненного) в конце беременности и особенно в родах поднимается на 5-6 см выше лобка, следует соблюдать осторожность при вскрытии париетальной брюшины.
 Рис. 25.38. Поперечный надлобковый разрез передней брюшной стенки.
а, б – рассечены кожа и подкожная жировая клетчатка, сделаны надрезы апоневроза с обеих сторон от белой линии; в, г – апоневроз по средней линии отделяется с помощью ножниц от белой линии передней брюшной стенки и от пирамидальных мышц.
Рис. 25.38. Поперечный надлобковый разрез передней брюшной стенки.
а, б – рассечены кожа и подкожная жировая клетчатка, сделаны надрезы апоневроза с обеих сторон от белой линии; в, г – апоневроз по средней линии отделяется с помощью ножниц от белой линии передней брюшной стенки и от пирамидальных мышц.
Для лучшего доступа к матке рассечение передней брюшной стенки можно производить по методу Joel-Cohen (1972). В данной модификации лапаротомию осуществляют путем поверхностного прямолинейного поперечного разреза кожи на 2-3 см ниже линии, соединяющей передневерхние ости подвздошных костей, скальпелем углубляют разрез по средней линии в подкожной клетчатке и одновременно надсекают апоневроз. Хирург и ассистент одномоментно разводят подкожную клетчатку и прямые мышцы живота путем бережной билатеральной тракции по линии разреза кожи. Брюшину вскрывают указательным пальцем и разводят в поперечном направлении, чтобы не травмировать мочевой пузырь.
Техника корпорального кесарева сечения. В настоящее время при корпоральном кесаревом сечении беременную матку не выводят из брюшной полости, как раньше рекомендовалось при классическом кесаревом сечении.
Тело матки смещают рукой влево в связи с ее физиологической ротациейв правую сторону, чтобы избежать разреза левого ребра матки и выборе способа лапаротомии при кесаревом сечении следует подходить строго индивидуально и руководствоваться величиной доступа к матке, экстренностью и скоростью проведения операции, состоянием брюшной стенки (наличие или отсутствие рубца на передней брюшной стенке в нижних отделах живота), возможностью послеоперационных осложнений (послеоперационные грыжи), косметичностью шва и др. Так, если в анамнезе было кесарево сечение с использованием нижнесрединной лапаротомии, то при повторной операции применяется тот же доступ.
При нижнесрединном разрезе хирург обычно стоит справа от беременной и скальпелем рассекает кожу и подкожную клетчатку до апоневроза по средней линии живота на протяжении от пупка до лона. Производят гемостаз, захватывая кровоточащие сосуды зажимами и перевязывая их тонким викрилом (кетгутом). При необходимости срочного родоразрешения (кровотечение, острая гипоксия плода и т.п.) кровоточащие сосуды захватывают зажимами, рану обкладывают большими марлевыми салфетками и сосуды перевязывают при зашивании брюшной стенки. Апоневроз разрезают по средней линии. При этом следует учитывать, что у беременной обычно имеется расхождение прямых мышц живота и при слишком энергичном рассечении кожи и подкожной клетчатки, особенно если последняя слабо развита, можно разрезать не только апоневроз и прилегающую к нему брюшину, но и стенку матки.
Разрез апоневроза можно полностью произвести скальпелем, но менее опытному хирургу лучше сделать сначала небольшой разрез, а затем ножницами продлить его в сторону лона и пупка до намеченного размера.
Вскрытие брюшины следует производить с большой осторожностью и начинать его ближе к пупку, так как при беременности верхушка мочевого пузыря может располагаться высоко. Особенно осторожно следует вскрывать брюшину при повторном чревосечении, при спаечной болезни из-за опасности ранить сальник, кишечник, мочевой пузырь и др. Вскрыв брюшину, операционную рану ограждают от брюшной полости салфетками, ограничивая этим попадание околоплодных вод и крови в брюшную полость.
В настоящее время переднюю брюшную стенку чаще вскрывают поперечным надлобковым разрезом по Пфанненштилю. Такой разрез редко осложняется послеоперационными грыжами и косметичен; после операции больные раньше встают, что способствует предупреждению тромбофлебита и других осложнений.
Поперечный разрез дугообразной формы проводят по надлобковой складке длиной 15-16 см (рис. 25.38). Рассекают кожу и подкожную клетчатку; последнюю целесообразно разрезать не перпендикулярно к апоневрозу, а несколько скашивая в сторону пупка, что уменьшает кровотечение из раны. Обнаженный апоневроз рассекают дугообразным разрезом на 3-4 см выше разреза кожи. Апоневроз можно разъединять тупо пальцами (при этом не нарушается целость сосудов), после чего его отслаивают от прямых и косых мышц живота вниз до лобка и вверх до пупочного кольца. Отсепарованный апоневроз отводят в сторону лобка и пупка. Такое относительно высокое (над лоном) рассечение апоневроза способствует увели-чению доступа к беременной матке. Прямые мышцы живота разъединяют пальцами в продольном направлении. Учитывая, что верхняя граница мочевого пузыря (даже опорожненного) в конце беременности и особенно в родах поднимается на 5-6 см выше лобка, следует соблюдать осторожность при вскрытии париетальной брюшины.
Для лучшего доступа к матке рассечение передней брюшной стенки можно производить по методу Joel-Cohen (1972). В данной модификации лапаротомию осуществляют путем поверхностного прямолинейного поперечного разреза кожи на 2-3 см ниже линии, соединяющей передневерхние ости подвздошных костей, скальпелем углубляют разрез по средней линии в подкожной клетчатке и одновременно надсекают апоневроз. Хирург и ассистент одномоментно разводят подкожную клетчатку и прямые мышцы живота путем бережной билатеральной тракции по линии разреза кожи. Брюшину вскрывают указательным пальцем и разводят в поперечном направлении, чтобы не травмировать мочевой пузырь.
Техника корпорального кесарева сечения. В настоящее время при корпоральном кесаревом сечении беременную матку не выводят из брюшной полости, как раньше рекомендовалось при классическом кесаревом сечении.
Тело матки смещают рукой влево в связи с ее физиологической ротацией в правую сторону, чтобы избежать разреза левого ребра матки и ранения сосудистого пучка. Ориентиром срединного положения матки служат круглые связки. Разрез передней стенки матки должен проходить по ее средней линии, от верхнего края пузырно-маточной складки по направлению к дну и быть не менее 12 см, чтобы бережно извлечь плод и избежать продолжение разреза. Неглубокий разрез стенки матки начинают скальпелем по всей предполагаемой длине, затем на участке в 3-4 см рассекают всю толшу стенки матки до плодных оболочек. Заканчивают рассечение матки до верхнего и нижнего края, ранее намеченного скальпелем разреза, прямыми ножницами по двум введенным в рану пальцам, приподнимающим вверх ее переднюю стенку. Такой прием укорачивает время вскрытия матки, предотвращает ранение ребенка.
Если после рассечения стенки матки в рану выпячивается плодный пузырь, его рассекают скальпелем и разрывают пальцами. При предлежании в рапу плаценты ее также рассекают скальпелем или пробуравливают пальцем.
Введенной в рану правой рукой в зависимости от положения плод захватывают за ножку или головку и извлекают. Между зажимами рассекают пуповину и ребенка передают акушерке.
После пересечения пуповины для профилактической цели показано внутривенное введение матери антибиотиков широкого спектра действия (кефзол, цефазолин и др.) с повторным их введением через 12 и 24 ч после операции. Для усиления сократительной активности матки в ее толшу вводят 1 мл метилэргометрина и внутривенно капельно – 5 ЕД окситоцина.
На кровоточащие края раны накладывают зажимы Микулича. Потягиванием за пуповину удаляют послед и производят ручное обследование матки, извлекая обрывки оболочек, сгустки крови, остатки плацентарной ткани.
Если кесарево сечение выполняется в плановом порядке, до начала родовой деятельности и нет уверенности в проходимости канала шейки матки, то необходимо пройти его со стороны полости матки расширителем Гегара или пальцем, после чего сменить перчатку.
Отступя на 1 см от верхнего и нижнего углов раны, накладывают по одному узловатому викриловому шву, используя их в качестве держалок. Затем приступают к зашиванию раны матки. Очень большое значение имеют техника наложения швов на матку, шовный материал. Правильное сопоставление краев раны – одно из условий профилактики инфекционных осложнений, прочности рубца, предотвращающего разрыв матки при пос-ледующих беременностях и родах.
Наиболее целесообразным является ушивание раны на матке непрерывным двухрядным швом или однорядным (викрил, монокрил, дексон, супрамид, полисорб, капроаг, хромированный кетгут и др.).
Швы накладывают следующим образом: первый ряд (слизисто-мышечный шов) накладывают в виде непрерывного обвивного или скорняжного шва (по Шмидену), второй ряд (серозно-мышечный шов) накладывают в виде непрерывного шва либо отдельными узловыми швами со вколом и выколом иглы между швами первого ряда. Перитонизацию осуществляют за счет серозной оболочки матки непрерывным швом. Некоторые врачи перитонизацию не проводят.
После зашивания матки, убедившись в ее хорошем сокращении, производят ревизию брюшной полости, определяя состояние яичников, маточных труб, червеобразного отростка и других органов, доступных для осмотра.
После туалета брюшной полости послойно зашивают переднюю брюшную стенку наглухо. На кожу обычно накладывают отдельные шелковые или капроновые швы. Сразу же после операции на операционном столе производят влагалищное исследование, удаляют сгустки крови из влагалища и по возможности из нижнего сегмента матки, проводят туалет влагалища и осуществляют катетеризацию мочевого пузыря.
Кровопотеря при операции кесарева сечения в среднем составляет 800 мл.
Продолжительность операции в среднем равна 40-60 мин.
Во время операции кесарева сечения производится переливание изотонического раствора натрия хлорида, кровезаменителей, по показаниям – свежезамороженной плазмы и реже – эритроцитной массы. Переливание свежезамороженной плазмы показано при нарушениях в системе гемостаза и повышенной кровоточивости раны.
Осложнения. Среди осложнений во время операции корпорального кесарева сечения возможны продление разреза в сторону нижнего сегмента и мочевого пузыря, гипотоническое кровотечение.
Кесарево сечение в нижнем сегменте матки поперечным разрезом. При кесаревом сечении с поперечным разрезом нижнего сегмента матки производят обычно поперечный надлобковый разрез по Пфанненштилю. Обнажают матку и ножницами посередине вскрывают пузырно-маточную складку (на 2-3 см выше ее прикрепления к пузырю), которую рассекают в поперечном направлении до обеих круглых связок матки. Тупым путем отсепаровывают верхушку мочевого пузыря, смещают книзу и удерживают зеркалом. На уровне большого сегмента головки осторожно (не ранить головку!) производят небольшой поперечный разрез нижнего сегмента матки, разрез расширяют указательными пальцами обеих рук до крайних точек периферии головки, что соответствует ее наибольшему диаметру и составляет 10-12 см (рис. 25.39).
При крупном плоде вскрытие нижнего сегмента матки можно производить дугообразным разрезом. Вначале скальпелем проводят разрез длиной 2,5-3 см через всю толщину стенки матки, затем вправо и влево от средней линии ножницами проделывают разрез дугообразно вверх до нужной величины.
Если плодный пузырь не вскрылся во время рассечения матки, то его вскрывают скальпелем, оболочки разводят пальцами.
 Рис. 25.39. Поперечный разрез матки в нижнем сегменте.
а – вскрытие пузырно-маточной складки; б – надрез стенки нижнего сегмента матки; в – разведение краев раны тупым путем.
Рис. 25.39. Поперечный разрез матки в нижнем сегменте.
а – вскрытие пузырно-маточной складки; б – надрез стенки нижнего сегмента матки; в – разведение краев раны тупым путем.
Затем в полость матки вводят правую руку, захватывают головку плода, осторожно поворачивают ее затылком кпереди. Ассистент слегка надавливает на дно матки, при этом происходит разгибание головки и она выводится из матки (рис. 25.40). Бережным потягиванием обеими руками за головку последовательно извлекают одно и другое плечо, затем пальцы вводят в подмышечные впадины и извлекают плод. В случае затрудненного выведения головки плода вместо кисти руки под нижний полюс головки можно подвести ложку щипцов или специальный экстрактор Murless (который напоминает ложку щипцов) и, слегка надавливая на дно матки, вывести головку из матки. При тазовом предлежании плод извлекают за паховый сгиб или за ножку. В случае поперечного положения плода его обычно извлекают за ножку. Головку из полости матки выводят приемом, идентичным приему Морисо-Левре. Наиболее частыми причинами затрудненного выведения плода из матки являются недостаточный разрез на матке или передней брюшной стенке, крупные размеры плода, сросшаяся двойня и др. При не-достаточном разрезе передней брюшной стенки следует увеличить разрез, при не-достаточном разрезе на матке – сделать разрез на матке в виде перевернутой буквы Т.
 Рис. 25.40. Выведение головки плода при кесаревом сечении.
Рис. 25.40. Выведение головки плода при кесаревом сечении.
Пуповину рассекают между зажимами и ребенка отдают акушерке. После пересечения пуповины для профилактической цели матери внутривенно вводят один из антибиотиков широкого спектра действия. Для уменьшения кровопотери во время операции в мышцу матки вводят 1 мл 0,02 % раствора метилэргометрина и 1 мл (5 ЕД) окситоцина внутривенно капельно. Кроме того, необходимо захватить края раны, особенно в области углов зажимами Микулича. Потягиванием за пуповину удаляют послед. В любом случае, отделилась плацента самостоятельно или была отделена рукой, необходима последующая ревизия стенок матки рукой, чтобы исключить наличие остатков плодного яйца, подслизистой миомы матки, перегородки в матке и других патологических состояний.
Если нет уверенности в проходимости канала шейки матки, необходимо пройти его расширителем Гегара или пальцем, после чего сменить перчатку.
Рану на матке зашивают непрерывным двухрядным швом (викрил, дексон, монокрил, полисорб, капроаг, супрамид, хромированный кетгут и др.): первый ряд – слизисто-мышечный, второй ряд – мышечно-мышечный (рис. 25.41). При наложении третьего ряда восстанавливают целость пузырно-маточной складки. Непрерывный шов накладывают в виде обвивного или скорняжного (по Шмидену). Первый и последний швы при зашивании раны на матке необходимо накладывать латеральнее угла раны с гемостатической целью.
Некоторые авторы не рекомендуют прокалывать слизистую оболочку при зашивании раны на матке, но при указанной методике возможно кровотечение в послеоперационном периоде.
При развернутом нижнем сегменте матки (нет варикозного расширения вен) целесообразно накладывать непрерывный однорядный шов и перитонизировать пузырно-маточной складкой. При наложении однорядного шва на матке отмечается лучшее кровоснабжение, меньше затрачивается шовного материала, лучше заживает рана, чем при двухрядном шве.
После ревизии и туалета брюшной полости брюшную стенку зашивают наглухо. На кожу обычно накладывают непрерывный косметический шов.
 Рис. 25.41. Наложение непрерывного двухрядного шва на матке.
Рис. 25.41. Наложение непрерывного двухрядного шва на матке.
Осложнения. Во время операции кесарева сечения в нижнем сегменте поперечным разрезом возможны ранение предлежащей части плода, продление разреза матки в латеральную сторону и ранение сосудистого пучка, кровотечение из околоматочной клетчатки, ранение мочевого пузыря и кишечника, особенно при наличии спаечного процесса, гипотоническое кровотечение, гематурия вследствие сдавления мочевого пузыря (чаще зеркалом) во время операции и др.
M.Stark (1994) предложил несколько видоизмененную методику проведения операции кесарева сечения в нижнем сегменте. Автор рекомендует рассечение передней брюшной стенки производить по методу Joel-Cohen (1972). Затем рассекают пузырно-маточную складку; разрез нижнего сегмента матки производят в поперечном направлении до крайних точек периферии головки. Вскрывают плодный пузырь и обычным путем извлекают головку и весь плод. Пережимают и рассекают пуповину. Рукой удаляют плаценту. В это время анестезиолог внутривенно вводит 10 ЕД окситоцина или 0,5 мг эргометрина. Автор рекомендует выводить матку из брюшной полости и проводить ее массаж. При необходимости осуществляют расширение цервикального канала для оттока лохий. Рану на матке восстанавливают однорядным непрерывным хромированным кетгутом № 1 или викриловым швом с захлестом по Ривердену. Перитонизацию раны на матке не производят. Брюшину и мышцы передней брюшной стенки не зашивают, на апоневроз накладывают непрерывный викриловый шов по Ривердену, кожу зашивают отдельными шелковыми швами через большие интервалы (3 – 4 шва на разрез). Между швами края раны на 5-10 мин соединяют зажимами Allis и затем их снимают.
Преимущества метода заключаются в быстроте выполнения операции, меньшей кровопотере и более легком извлечении плода, меньшей болезненности после операции, меньшем риске развития тромбоза и инфекции, уменьшении койко-дня.
Истмико-корпоральное кесарево сечение с продольным разрезом матки. В некоторых случаях (недоношенная беременность, когда не развернут нижний сегмент) выполняют истмико-корпоральное кесарево сечение с продольным разрезом. Перед рассечением матки вскрывают пузырно-маточную складку и верхушку мочевого пузыря отслаивают книзу. Рассекают матку по средней линии в нижнем сегменте и теле матки длиной примерно 12 см. После извлечения плода рану на матке зашивают непрерывным двухрядным швом (викрил, монокрил, дексон и др.). Перитонизацию производят пузырно-маточной складкой.
Кесарево сечение в нижнем сегменте матки с временной изоляцией брюшной полости. Чревосечение проводят нижнесрединным разрезом или по Пфанненштилю. Париетальную брюшину рассекают в поперечном направлении над дном мочевого пузыря в непосредственной близости от нижнего сегмента матки. После вскрытия брюшной полости вставляют широкое надлобковое зеркало и обнажают пузырноматочную складку. Отступя 0,5-1 см от края мочевого пузыря, прилегающего к матке, пузырно-маточную складку брюшины рассекают ножницами в поперечном направлении почти до круглых связок матки. Нижний листок пузырно-маточной складки вместе с мочевым пузырем тупым путем отслаивают вниз от нижнего сегмента матки на расстояние 2-3 см, верхний листок брюшины, покрывающий матку, – вверх, таким образом, нижний сегмент матки обнажается на высоту 4-5 см. Далее верхний листок пузырно-маточной складки непрерывным кетгутовым швом соединяют с верхним листком париетальной брюшины передней брюшной стенки, а нижний листок пузырно-маточной складки – с нижним листком париетальной брюшины; концы этих швов (по 2 с обеих сторон) берут на два зажима. Таким образом создается изолированное от брюшной полости "окно", позволяющее манипулировать на передней стенке нижнего сегмента матки. Нижний сегмент вскрывают в поперечном направлении, извлекают плод и послед. Края маточной раны ушивают одноили двухрядным викриловым швом. Затем удаляют непрерывный кетгутовый шов, соединяющий верхний край пузырно-маточной складки и париетальной брюшины, н верхним листком пузырно-маточной складки закрывают маточный шов, сшивая 3-4 узловыми викриловыми швами края складки с нижним сегментом матки. После удаления нижнего непрерывного кетгутового шва, соединяющего нижний листок пузырно-маточной складки и париетальной брюшины, нижний листок пузырно-маточной складки непрерывным швом соединяют с брюшиной матки выше первой линии швов перитонизации, т.е. создают двойную перитонизацию операционной раны на матке. Иногда под листки пузырно-маточной складки подводят дренажную трубку и выводят ее через брюшную стенку наружу, К дистальному концу трубки присоединяют стерильную резиновую грушу в сжатом состоянии, тем самым создается отрицательное давление для активного отсасывания раневого секрета. Кроме этого, в область операционной раны через трубку можно вводить антибиотики.
Внебрюшинное (экстраперитонеальное) кесарево сечение. Операцию экстраперитонеального кесарева сечения выполняют по методике Е.Н.Морозова (1974). Перед операцией катетером выводят мочу из мочевого пузыря. Производят разрез передней брюшной стенки по надлобковой складке. Разделяют прямые мышцы живота, правую прямую мышцу отслаивают от предбрюшинной клетчатки и зеркалом отводят вправо. Обнажают правое ребро матки и переходную складку брюшины. Ниже переходной складки брюшины тупо разъединяют рыхлую соединительную ткань до fascia endopelvina, вскрывают ее ножницами и двумя пальцами проходят под пузырно-маточной складкой и верхушкой мочевого пузыря до левого ребра матки. "Мост", образованный пузырно-маточной складкой и верхушкой мочевого пузыря, отводят влево зеркалом и обнажают нижний сегмент матки. Поперечный разрез нижнего сегмента матки производят примерно на 2-3 см ниже переходной складки брюшины. Вскрывают плодный пузырь. Извлекают плод. После пересечения пуповины внутривенно вводят антибиотик широкого спектра действия. В толщу матки вводят метилэргометрин или окситоцин. Удаляют послед. Рукой обследуют полость матки. Разрез на матке восстанавливают двухили однорядным непрерывным швом (викрил, монокрил, дексон, максон и др.). Проводят гемостаз и проверяют целость брюшины. При ее нарушении последнюю восстанавливают. Пузырно-маточную складку и мочевой пузырь "укладывают" в исходное положение. Брюшную стенку восстанавливают послойно.
Преимуществом экстраперитонеального кесарева сечения перед интраперитонеальным являются меньшая длительность операции и величина кровопотери; ис-ключение попадания околоплодных вод и мекония в брюшную полость; отсутствие опасности ранения кишечника, возможности образования спаек в брюшной полости; профилактика перитонита; меньшая выраженность болевого синдрома; возможность раннего вставания после операции (через 8-10 ч); уменьшение частоты паретического состояния кишечника. При нагноении околоматочной или околопузырной клетчатки имеется легкий доступ для опорожнения.
По сравнению с интраперитонеальным кесаревым сечением операция, выпол-няемая внебрюшинным доступом, является технически более сложной и поэтому может быть рекомендована специалистам, хорошо владеющим оперативной техникой.
При выполнении данной операции возможны ранение мочевого пузыря, вскрытие брюшной полости, иногда возникают затруднения при выведении головки плода.
Противопоказания к экстраперитонеалъному кесареву сечению: 1. разрывы матки и несостоятельность послеоперационного рубца на матке; 2. преждевременная отслойка нормально расположенной плаценты; 3. предлежание плаценты; 4. наличие симптомов острого живота; 5. выраженное варикозное расширение вен нижнего сегмента матки; 6. опухоли матки и придатков; 7. аномалии развития матки; 8. необходимость проведения стерилизации.
Послеоперационное течение и уход. После кесарева сечения роженицу переводят в палату интенсивной терапии. Ведение женщин после операции кесарева сечения осуществляют с учетом кровопотери, сопутствующей акушерской и экстрагенитальной патологии, метода операции. Целесообразно соблюдение принципов ранней послеоперационной активности. По окончании операции прикладывают пузырь со льдом на нижний отдел живота на 1,5-2 ч.
В послеоперационном периоде, особенно в первые 6-8 ч после операции, необходимо следить за общим состоянием родильницы, величиной и тонусом матки, выделениями из половых путей, функцией мочевого пузыря.
После операции производят коррекцию водно-электролитного баланса, газов крови и т.д. Целесообразно мониторное наблюдение за показателями гемодинамики (пульс, АД и др.) и за дыханием (частота дыхания, минутный объем дыхания, газы крови и др.). Вводят растворы, улучшающие реологические свойства крови (реополиглкжин). Инфузионную терапию дополняют растворами глюкозы и хлорида натрия. Общее количество введенной жидкости варьирует в зависимости от исходных данных, объема кровопотери и составляет примерно 1500-2000 мл. Количество введенной жидкости корригируют в зависимости от диуреза. Применяют обезболивающие, утеротонические, спазмолитические средства, витамины, антигистаминные препараты, по показаниям антикоагулянты.
Что касается переливания крови, то показания к нему определяются исходным состоянием женщины до операции, уровнем гемоглобина и гематокритного числа, величиной кровопотери во время операции, частотой пульса, величиной АД и другими факторами. Не следует переливать цельную кровь. При необходимости переливают компоненты крови – эритроцитную массу, свежезамороженную плазму.
Для профилактики инфекционных осложнений после операции кесарева сечения, кроме случаев аллергии к антибиотикам, во время операции (после пересечения пуповины) всем женщинам вводят внутривенно один из антибиотиков широкого спектра действия (клафоран, цезолин и др.) и продолжают их введение через 12 и 24 ч после операции. Если женщина не принадлежит к группе высокого риска развития инфекции и температура тела у нее нормальная, то на этом введение антибиотиков обычно прекращают, а в остальных случаях антибиотикотерапию проводят в течение 5-7 дней.
В первые 6-8 ч после операции у родильниц могут возникать кровотечения, обусловленные гипотонией матки, нарушением свертывающей системы крови, задержкой остатков плаценты и плодных оболочек в матке. При кровотечении внутривенно вводят сокращающие матку средства, переливают плазму, проводят наружный массаж матки, ручное или инструментальное обследование стенок послеродовой матки тупой кюреткой. В случае отсутствия эффекта от проводимых мероприятий показана повторная лапаротомия с экстирпацией матки.
На 2-е сутки проводят инфузионную терапию и коррекцию электролитного баланса, применяют прозерин, ставят очистительную клизму, проводят дыхательную гимнастику.
Через несколько часов после операции рекомендуют поворачиваться в постели, двигать руками и ногами. На следующие сутки разрешают садиться и ходить по палате. После кесарева сечения по Джоелу-Кохену вставать можно через 5-6 ч.
На 6 – 7-е сутки снимают швы с брюшной стенки.
На 8-10-е сутки после операции родильница может быть выписана домой под наблюдение врача женской консультации.
Для оценки течения послеоперационного периода, кроме клинического наблюдения, лабораторных данных (анализ крови, мочи), на 5-6-е сутки рекомендуется проведение ультразвукового исследования (УЗИ), которое позволяет судить о размерах матки, величине и содержимом ее полости, состоянии швов на матке, наличии гематом и т.д. Такое ведение послеоперационного периода применяется у практически здоровых женщин, перенесших неосложненное оперативное вмешательство, с гладким послеоперационным течением. Если же у пациентки во время и после операции наблюдаются осложнения (шок, коллапс, постгеморрагическая анемия, гестоз, воспалительные процессы и т.д.), то указанные мероприятия дополняют комплексом мер, направленных на устранение этих осложнений и их последствий.
Кесарево сечение – операция, которая сама по себе приводит к условиям, способствующим подавлению множества защитных механизмов, изменению иммунологических показателей, ухудшению местного кровоснабжения вследствие травмирования сосудистой сети, механической травме матки в процессе операции, образованию местных гематом, сером, иногда значительной кровопотере.
В послеоперационном периоде могут наблюдаться следующие осложнения: раневая инфекция, эндометрит, тромбофлебит, субфебрилитет, субинволюция матки, внутренние и наружные кровотечения, гематомы различной локализации, перитонит и др.
Наиболее тяжелым и опасным осложнением является перитонит, частота которого остается довольно высокой (0,5 %) .
Ближайшие и отдаленные результаты операции кесарева сечения
Достижения медицины, правильный выбор метода родоразрешения и метода кесарева сечения, учет показаний и противопоказаний к операции, своевременность ее производства и другие мероприятия позволяют свести перинатальную и материнскую смертность после кесарева сечения к минимуму.
Причины материнской смертности можно разделить на две группы: связанные с операцией кесарева сечения (перитонит, тромбоэмболия, осложнения обезболивания, сепсис, кровотечение и др.) и не связанные с операцией кесарева сечения (дородовые кровотечения, эклампсия, заболевания сердечно-сосудистой системы, другие экстрагенитальные заболевания).
Анализ причин перинатальной смертности при абдоминальном родоразрешении показывает, что она главным образом связана с предлежанием плаценты и преждевременной отслойкой нормально расположенной плаценты, гестозом беременных, экстрагенитальной патологией, а также с осложнениями родов, которые привели к гибели плода в связи с несвоевременным выполнением абдоминального родоразрешения (клинически узкий таз, слабость родовой деятельности, аномалии положения и предлежания плода, гипоксия плода). Перинатальная смертность может быть обусловлена недоношенностью, задержкой развития плода, уродствами, гемолитической болезнью новорожденных, врожденной пневмонией новорожденных и др.
Гинекологическая заболеваемость после перенесенного кесарева сечения чаще наблюдается после корпорального и проявляется нарушением менструального цикла, хроническими воспалительными заболеваниями половых органов и спаечным процессом в брюшной полости, которые приводят к смещению матки, сращению ее с передней брюшной стенкой, что нередко сопровождается болевым синдромом.
Абдоминальное кесарево сечение с целью прерывания беременности
Этот вид кесарева сечения (малое кесарево сечение) производят при сроке беременности 16-28 нед, главным образом в тех случаях, когда продолжение ее опасно для здоровья женщины (например, не поддающиеся терапии гестозы беременных, заболевания сердечно-сосудистой системы в стадии декомпенсации, тяжелые болезни крови и др.). Обычно операцию выполняют по типу корпорального кесарева сечения, производимого с родоразрешающей целью (после вскрытия брюшной полости стенку матки рассекают в продольном направлении). Подготовка к операции, ведение послеоперационного периода и осложнения такие же, как при кесаревом сечении с целью родоразрешения.
Кесарево сечение на мертвой и умирающей беременной
В 1961 г. C.A.Behney привела сводные данные о 135 случаях операции кесарева сечения на мертвой и умирающей беременной женщине, когда удалось извлечь живого ребенка. В 1964 г. M.Vitsky приводит собственные данные о двух случаях кесарева сечения на мертвой женщине. Надо полагать, что в последующие 30 лет этот список значительно возрос. В отечественной литературе подобные сведения практически отсутствуют.
Наиболее частыми причинами смерти матери являются травма, эклампсия, заболевания сердца, кровоизлияние в мозг, тромбоэмболия, заболевания крови, спинальная анестезия и др.
Для результатов подобных операций кесарева сечения большое значение имеет время, прошедшее с момента смерти матери до извлечения ребенка. Прогноз для плода более благоприятен в случаях внезапной смерти матери и неблагоприятен в случаях смерти ее от хронического заболевания и интоксикации. Максимальное время, необходимое для извлечения живого ребенка после смерти матери, составляет 20-25 мин.
Описан случай извлечения живого ребенка через 45 мин после смерти матери от субарахноидального кровоизлияния, которой проводилась искусственная вентиляция кислородом через эндотрахеальную трубку. Кесарево сечение должно производиться корпоральным методом, так как он является наиболее быстрым.
Кесарево сечение на умирающей выполняется в тех случаях, когда заболевание матери смертельно и неизбежность близкой смерти несомненна, а плод жизнеспо-собен. Перед операцией надо убедиться в том, что родоразрешение через естествен-ные родовые пути невозможно. Если больная находится в сознании, необходимо ее согласие на операцию, а в случае бессознательного состояния следует получить (по возможности) согласие ее близких. Решение вопроса об операции принимается по возможности ex consilio.
 Рис. 25.42. Наложение кожно-головных щипцов по Иванову-Гауссу.
Рис. 25.42. Наложение кожно-головных щипцов по Иванову-Гауссу.
Операцию кесарева сечения на умирающей производят с соблюдением всех правил асептики и техники корпоральным методом.
Акушерские родоразрешающие операции
Кожно-головные щипцы Иванова – Гаусса (рис. 25.42). Показания: кровотечение при частичном предлежании плаценты, не прекращающееся после излития вод.Условия: 1. головное предлежание; 2. мертвый плод; 3. соответствие между размерами плода и таза; 4. раскрытие зева матки не менее чем на 2-3 см.
Техника операции. После обычной подготовки роженицы хирург производит влагалищное исследование и, убедившись в наличии условий к вмешательству, раскрывает влагалище путем введения зеркала с подъемником. Если плодный пузырь цел, его разрывают и, взяв в складку кожу головки, захватывают ее двузубчатыми мощными щипцами или специальным инструментом. Роженицу помещают на кровать и к ручке щипцов привязывают бинт, который перебрасывают через блок у ножного конца кровати; к бинту подвешивают груз 400-500 г. При влечении щипцами за кожу головки надо учитывать уровень стояния ее и необходимость соответствия направления влечения проводной оси таза. Таким образом, если головка находится во входе в таз, то таз роженицы должен быть значительно выше, чем блок.
Подобное вмешательство в большинстве случаев приводит к усилению схваток, прекращению кровотечения (при частичном предлежании плаценты), к скорому рождению плода.
Метрейриз. Это операция, сущность которой заключается в том, что в полость матки вводят резиновый баллон (метрейринтер), наполняют стерильным изото-ническим раствором хлорида натрия. Введенный баллон способствует постепенному расширению шейки матки.
Показания: 1. поздний искусственный аборт по медицинским показаниям; 2. неполное предлежание плаценты при несильном кровотечении; 3. преждевременное или раннее излитие вод при поперечном положении плода и недоношенной беременности.
Условия: открытие зева на 3-4 см (при закрытом зеве шейку матки расширяют с помощью расширителей Гегара), в отсутствие признаков внутриматочной инфекпии.
Техника операции. Перед операцией метрейринтер заполняют стерильным изотоническим раствором хлорида натрия, чтобы проверить его целость. Потом раствор выливают и пустой баллон, свернутый в виде сигары, с помощью корнцанга вводят в полость матки. Эти манипуляции выполняют при раскрытии шейки матки с помощью влагалищных зеркал и захвате шейки пулевыми щипцами. После введения метрейринтера за внутренний зев корнцанг снимают, а баллон с помощью большого шприца вновь наполняют стерильным изотоническим раствором хлорида натрия через отводную трубку. После наполнения метрейринтера отводную трубку закрывают зажимом и к ней подвешивают груз (до 400 г). Введенный метрейринтер вызывает усиление схваток и способствует открытию шейки матки. Обычно метрейринтер рождается сам или же его удаляют через 6 ч.
В настоящее время операция метрейриза применяется крайне редко, так как при указанных выше показаниях применяются другие вмешательства или акушерские операции.
Плодоразрушающие операции
Плодоразрушающей операцией (эмбриотомия) называется любая операция, имеющая целью разрушить части плода, уменьшить его объем и сделать возможным его извлечение через естественные родовые пути.Основным условием их производства в современных условиях является наличие мертвого плода, однако в крайне исключительных ситуациях эти операции следует предпочесть и при живом плоде. В таких случаях речь идет о тяжелых, несовместимых с жизнью или имеющих крайне неблагоприятный постнатальный прогноз, пороках развития плода (например, выраженные формы гидроцефалии). Кроме того, эмбриотомия производится в экстремальных условиях для спасения жизни матери.
Каждая эмбриотомия в родовспомогательном учреждении подлежит тщательному анализу, так как она, как правило, свидетельствует о недостаточной профилактической работе женской консультации (например, несвоевременная госпитализация беременной с узким тазом, поперечным положением плода), запоздалой диагностике, организационных дефектах или о неправильном ведении родов.
Разработаны типичные плодоразрушающие операции, К ним относятся краниотомия, клейдотомия, декапитация плода, эвисцерация, спондилотомия, а также эвентерация и экзентерация (эвисцерация).
Краниотомия.
Операция состоит из трех этапов: прободения головки (перфорация), разрушения и удаления мозга (эксцеребрация) и извлечения плода при помощи краниокласта (краниоклазия).Показания к краниотомии: 1. несоответствие между размерами таза матери и головкой плода; 2. неправильное вставление и предлежание головки (передний вид лицевого предлежания, лобное предлежание, заднетеменное вставление); 3. тяжелое состояние роженицы, требующее немедленного родоразрешения (тяжелая форма гестоза, декомпенсированный порок сердца и др.); 4. невозможность извлечь последующую головку плода при тазовом предлежании. Указанные обстоятельства являются показаниями к краниотомии, если угроза для роженицы не может быть устранена другим путем, например кесаревым сечением.
Условия для краниотомии: 1. раскрытие маточного зева не менее чем на 5-6 см; 2. таз женщины не должен быть абсолютно узким; 3. головка плода должна быть плотно фиксирована во входе в малый таз и помощник обязан также фиксировать ее сверху; 4. отсутствие плодного пузыря (возможна амниотомия).
Установлено, что перфорированная головка всегда быстро конфигурируется, опускается в малый таз и при этом значительно ускоряется раскрытие зева матки. Однако для извлечения плода после прободения его головки все же необходимо полное раскрытие зева (не меньше 10-12 см).
После краниотомии возможно извлечение плода (доношенного) через естественные родовые пути, если истинная конъюгата больше 6,5 см; если же она равна 6,5 см или меньше, доношенный плод можно извлечь только путем кесарева сечения. При оценке таза важно измерение не только входа, но и выхода из малого таза (воронкообразный таз).
Операцию производят на операционном столе под наркозом. Во время операции хирургу помогают ассистенты (врач, сестра).
Техника операции: 1. операцию начинают после введения широких зеркал и проводят под контролем зрения; 2. головка должна быть фиксирована как через переднюю брюшную стенку, так и со стороны влагалища (путем захвата кожи волосистой части головки двумя пулевыми щипцами или щипцами Мюзо).
Первый этап – прободение головки. После соответствующей подготовки вводят зеркала и обнажают волосистый покров головки плода. Фиксируют ее через переднюю брюшную стенку (если головка подвижна или прижата ко входу в малый таз) и через влагалище, захватив кожный покров головки двумя мощными двузубцами (или пулевыми щипцами).
После фиксации головки плода двузубцами скальпелем рассекают кожу (спереди назад) и производят прободение головки перфоратором, лучше через большой родничок (рис. 25.43). При лицевом предлежании прободение осуществляют через глазницу или (что труднее) через твердое небо; при лобном предлежании – через глазницу или лобную кость; при заднем виде перфоратор вводят через рот плода.
Для перфорации головки плода используют два вида перфораторов: Феноменова и Бло (рис. 25.44).
Перфорация производится осторожными буравящими движениями, пока наиболее широкая часть копья перфоратора не сравняется с краями перфорационного отверстия. Не следует производить прокалывающие или толкающие движения, так как они могут быть причиной соскальзывания копья с головки и нанести роженице опасную травму. После этого обе рукоятки перфоратора сближают, острые края копья разводятся в стороны. Сближая и раздвигая их в различных направлениях, образуют на черепе 4-5 разрезов. Раздвинув копья до отказа, производят вращательное движение на уровне краев перфорационного отверстия, которое становится проходимым для 2 пальцев.
 Рис. 25.43. Перфорация предлежащей
Рис. 25.43. Перфорация предлежащей
 Рис. 25.44. Перфораторы, головки. а – феноменова; б – Бло.
Рис. 25.44. Перфораторы, головки. а – феноменова; б – Бло.
Второй этап – разрушение и удаление головного мозга, эксцеребрация. После прободения головки производят разрушение (с помощью кюретки) и удаление мозга, так как одна перфорация свода черепа не влечет за собой значительного уменьшения объема головки. Особое внимание обращают на разрушение продолговатого мозга плода. После разрушения мозга его необходимо удалить из полости черепа. Для этого в настоящее время проводят вакуум-аспирацию.
На этом операция перфорации головки и удаления мозга заканчивается. Если она была произведена при полном или почти полном открытии зева, то пулевые щипцы снимают, зеркала выводят из влагалища и тут же производят операцию краниоклазии (см. далее). Если же перфорация была произведена при недостаточном раскрытии маточного зева, то влагалищные зеркала удаляют, пулевые же щипцы, наложенные на кожу головки, оставляют, кольца их сближают и завязывают марлевым бинтом, который перекидывают через блок, прикрепленный к кровати, и к нему подвешивают груз в 300-500 г, т.е. за перфорацией головки следует операция наложения кожно-головных щипцов по Уилт-Иванову. Эта операция позволяет ускорить раскрытие маточного зева. Пулевые щипцы, наложенные на кожу головки, прикрывают острые края перфорационного отверстия и этим защищают мягкие ткани родового канала от повреждений.
Если состояние роженицы позволяет, а родовая деятельность удовлетво-рительная, то роды можно вести самопроизвольно. В противном случае, как только наступит полное или почти полное раскрытие зева, роды заканчиваются с помощью краниоклазии.
 Рис. 25.45. Краниокласт Брауна.
Рис. 25.45. Краниокласт Брауна.
 Рис. 25.46. Краниоклазия
Рис. 25.46. Краниоклазия
Третий этап – краниоклазия. Краниоклазией называется операция извлечения перфорированной и уменьшенной в объеме головки плода с помощью специального инструмента – краниокласта.
Краниоклазия производится при наличии показаний к окончанию родов. После первых двух этапов (прободение черепа и разрушение мозга) следует приступить к извлечению плода при помощи краниокласта, если раскрытие шейки матки полное.
Краниокласт (рис. 25.45) представляет собой щипцы, состоящие из ложек, замка и рукоятки, а также двух веток (наружная и внутренняя), перекрещивающихся в центре. Обе ложки краниокласта имеют изгиб, соответствующий тазовой кривизне. Внутренняя ложка сплошная, имеет неровности (поперечные борозды) на выпуклой поверхности и предназначена для введения в полость черепа, наружная ложка – окончатая. Рукоятки снабжены сжимающим аппаратом особого устройства (винтогаечный запор).
Техника краниоклазии. Операция краниоклазии состоит из четырех моментов: 1. введение и размещение ложек; 2. замыкание ветвей; 3. извлечение головки; 4. снятие краниокласта.
Первой под контролем "полуруки", введенной во влагалище, через перфорационноеотверстие в полость черепа вводят ложку внутренней ветви и рукоятку ее передают помощнику. Ложку стараются вводить как можно глубже. Оптимальным считается такое введение, когда выпуклая ее часть обращена к лицу, ввиду того что кости лицевого черепа соединены значительно прочнее. Вместе с тем допустимо и введение, при котором выпуклая часть обращена к затылку (головка согнута и находится в заднем виде). После удаления зеркал окончатую ложку наружной ветви вводят также под контролем "полуруки" в соответствии с правилами введения, предусмотренными для введения второй ложки акушерских щипцов. Эту ложку накладывают на наружную поверхность головки и соответственно положению ложки внутренней ветви. Затем производят замыкание и сжатие ветвей, проверяют правильность наложения краниокласта (на лицевую или затылочную часть черепа) и приступают к извлечению головки (рис. 25.46). Направление тракции при извлечении головки и их характер аналогичны таковым при операции наложения акушерских щипцов (по направлению оси родового канала). Краниокласт снимают сразу же по выведении головки из половой щели. При извлечении головки и плечевого пояса обязательно используют приемы защиты промежности.
После извлечения плод надо положить в ведро с водой, накрыть салфеткой и немедленно вынести из операционной.
Осложнения. Травматические повреждения родовых путей и мочевого пузыря в результате соскальзывания перфоратора являются наиболее частыми осложнениями данной плодоразрушающей операции. Соблюдение перечисленных ниже условий позволяет их избежать: 1. дополнительная фиксация головки через влагалище двумя щипцами Мюзо за кожу волосистой части головки; 2. выполнение операции под контролем зрения (введение широких зеркал); 3. производство разреза кожи головки между щипцами Мюзо; 4. перпендикулярное к поверхности головки (а не косое) введение перфоратора.
Краниотомия последующей головки. Если попытка извлечь плод при тазовых его предлежаниях не удается и плод погиб или если затруднение с извлечением связано с гидроцефалией, необходимо прекратить дальнейшие попытки вывести головку плода из родового канала. В таких случаях производят перфорацию последующей головки с эксцеребрацией (рис. 25.47).
Техника операции. Помощник оттягивает за ножки туловище плода круто вниз, вводя пластинчатое зеркало между затылком плода и передней стенкой влагалища. Под защитой зеркала рассекают кожу головки. Пальцем руки, подведенной под участок рассеченной кожи, ее отслаивают от кости до тех пор, пока не будет обнаружено большое затылочное отверстие. К нему приставляют копье перфоратора и пробуравливают отверстие в черепе. Эта манипуляция, как и последующие, производится так же и в том же порядке, как при перфорации предлежащей головки. Если не удалось обнаружить большое затылочное отверстие, то перфорацию головки производят в месте перехода шеи в затылок. Спавшуюся после эксцеребрации головку легко удалить из родового канала.
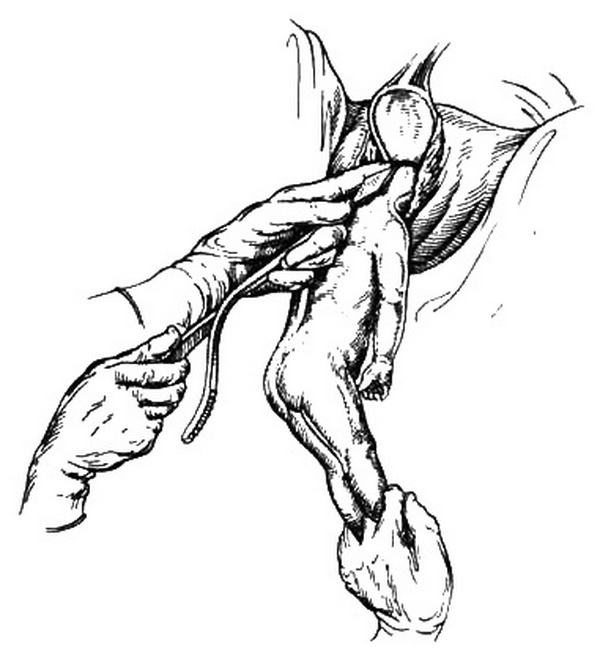 Рис. 25.47. Перфорация последующей головки.
Рис. 25.47. Перфорация последующей головки.
 Рис. 25.48. Клейдотомия.
Рис. 25.48. Клейдотомия.
Клейдотомия. Операция рассечения ключиц предназначена для уменьшения объема плечевого пояса. Техника операции была разработана Н.Н.Феноменовым, который и предложил ее название. Показания. Операция выполняется только на мертвом плоде в тех случаях, когда вследствие больших размеров плечиков они задерживаются в родовом канале и в результате рождение плода приостанавливается. Такое осложнение чаще всего наблюдается в родах при тазовом предлежании, но встречается и при головных предлежаниях.
Техника операции. Сначала при помощи 4 пальцев левой руки, введенной во влагалище, определяют положение плечевого пояса и отношение его к плоскостям таза (рис. 25.48). Затем под контролем левой руки, тупыми ножницами Феноменова производят пересечение ключицы вместе с мягкими тканями. Пересечения одной ключицы бывает, как правило, достаточно для уменьшения окружности плечевого пояса настолько (2,5- 3,0 см), чтобы устранить препятствие для его продвижения. Если этого недостаточно, то клейдотомию производят с противоположной стороны. Это в свою очередь позволяет уменьшить окружность плечевого пояса еще на 2,5-3,0 см. Операция клейдотомии крайне проста и обычно не сопровождается травматизацией родовых путей. В современных условиях используется весьма редко, причем чаще применяется в качестве вспомогательного вмешательства при декапитации плода, а не как самостоятельная операция.
Декапитация
Декапитация (обезглавливание) плода показана при запущенном поперечном положении плода и мертвом плоде. Суть операции сводится к отделению головки от туловища плода и последующему их поочередному извлечению.Из всех предложенных модификаций декапитации наиболее рациональной, простой и безопасной является операция обезглавливания при помощи декапитационного крючка Брауна по Чудановскому (рис. 25.49). Перед началом операции производят влагалищное исследование, в ходе которого убеждаются в доступности шеи плода. При выпавшей ручке предлагают ассистенту оттягивать ее вниз и вправо при первой позиции или вниз и влево при второй позиции до тех пор, пока плечевой пояс и шея плода не опустятся ниже и шея не станет доступной пальпации. После этого рукой (при первой позиции – правой, при второй позиции – левой), введенной во влагалище, захватывают шею плода так, чтобы I палец лежал на ее передней поверхности (позади лонного сочленения), а указательный – на задней. Затем ножницами подсекают кожу на шее плода и пальцем пробуравливают канал в подкожной жировой клетчатке. Изогнутый конец крючка Брауна вводят в образовавшийся канал и, когда достигается и обхватывается позвоночник, производят поворот его ручки поочередно в одну и другую сторону при умеренном потягивании вниз. Нарушение целости шейного отдела позвоночника сопровождается хрустом. В заключение рассекают кожные покровы ножницами под контролем руки, введенной во влагалище.
 Рис. 25.49. Декапитация.
Рис. 25.49. Декапитация.
После отделения головки плода от туловища производят поочередное извлечение туловища и отсеченной головки. Как правило, извлечение туловища проходит без затруднения при потягивании за выпавшую ручку. В отличие от этого извлечение головки сопряжено со значительными трудностями. Для ее извлечения рекомендуются следующие способы: 1. комбинированный прием, при котором наружной рукой с целью прижатия головки ко входу в малый таз оказывают давление на матку, а двумя пальцами внутренней руки, введенными в рот, производят извлечение; 2. культю шеи захватывают двумя щипцами Мюзо в затылочной области, а два пальца внутренней руки также вводят в рот и извлечение производят при одновременном давлении на головку сверху, в надлобковой области; 3. культю шеи захватывают двумя щипцами Мюзо, притягивая ее ко входу в таз, производят наложение краниокласта (внутреннюю ложку вводят в полость черепа через большое затылочное отверстие, наружную накладывают на лицевую или затылочную часть черепа), а затем после замыкания его ветвей и снятия щипцов – извлечение. При разогнутой головке возможно введение ложки внутренней ветви краниокласта в рот. Важным моментом при извлечении головки является четкое следование механизму родов. Третий способ извлечения отсеченной от туловища головки признан лучшим. По окончании операции декапитации обязательно производят осмотр родовых путей и контрольное ручное обследование стенок полости матки.
Эвисцерация, спондилотомия.
Рассечение позвоночника (спондилотомия) в сочетании с удалением внутренностей (эвисцерация) из брюшной или грудной полости (достаточно освободить одну из них) применяют в тех случаях, когда шея плода недоступна или труднодоступна. Для вхождения в грудную полость ножницами рассекают ребро, а для вхождения в брюшную полость – брюшную стенку. При невыпавшей ручке манипуляцию осуществляют после введения широких зеркал, при выпавшей – под контролем руки, введенной во влагалище. Внутренние органы (печень с кишечником, легкие) удаляют через перфорационное отверстие, захватывая их при этом абортцангом или костными щипцами. Рассечение позвоночника производят ножницами, введенными в перфорационное отверстие. Возможно нарушение целостности позвоночника и при помощи декапитационного крючка, однако данный способ считается не лучшим, так как высока вероятность смещения туловища плода. Затем под контролем зрения рассекают ножницами грудную (брюшную) стенку и поочередно извлекают головной и ножной концы плода.Трудности при производстве эмбриотомии возникают в случае небольшого раскрытия маточного зева, отечности ручки, узости влагалища, недоступности шеи плода. При наличии экстренных показаний к операции и малом раскрытии маточного зева прибегают к двустороннему его рассечению. При выпавшей ручке ее следует оттягивать в сторону, чтобы облегчить доступ к туловищу и шее плода. Если шея плода все же остается труднодоступной, следует, отказавшись от обезглавливания, произвести рассечение позвоночника с последующим извлечением внутренних органов из грудной или брюшной полостей.
Во избежание травматических повреждений (включая разрыв матки) при проведении плодоразрушающих операций необходимо придерживаться следующих правил: 1. не следует сильно тянуть за выпавшую ручку 2. нельзя отталкивать головку, для того чтобы облегчить захват шеи плода 3. нельзя производить манипуляции без контроля зрения или руки 4. не рекомендуется вводить крючок Брауна поверх шеи (а не подкожно) и сильно тянуть за его рукоятку. Также категорически запрещается отсекать выпавшую ручку ввиду того, что это значительно осложняет ход эмбриотомии.
Прогноз эмбриотомии для роженицы зависит от исходного состояния (до операции) и при осторожном ее выполнении в целом благоприятен. Производство осмотра шейки матки в зеркалах и контрольного ручного обследования стенок полости матки позволяет своевременно диагностировать возможные осложнения (разрыв матки).
Глава 26. Основы физиологии и патологии новорожденного
Особенности состояния новорожденных в раннем неонатальном периоде
Новорожденным (neonatus) называется ребенок с момента рождения до 4 нед жизни.Ребенок, родившийся при сроке беременности 38-42 нед, считается доношенным, 42 нед и более – переношенным, с 22-37-й недели беременности – недоношенным. Число детей, родившихся раньше срока, составляет в разных странах от 4 до 15 %.
Средние показатели массы тела доношенных новорожденных составляют 3600 г для мальчиков и 3500 г для девочек, длина тела 51 см.
Недоношенные дети имеют массу тела при рождении менее 2500 г, длину тела менее 46 см.
Голова новорожденного относительно велика. Она составляет 1/4 общей длины тела. Окружность головы 32-34 см, превышает окружность грудной клетки на 1-2 см.
Кожа розовая, бархатистая. Сальные железы развиты хорошо, потовые слабо. Защитная функция кожи недостаточно развита, в связи с чем в первые недели жизни ребенка она часто служит входными воротами инфекций.
Подкожный жировой слой развит, как правило, хорошо. Характерным для него является относительно большое содержание стеариновой и пальмитиновой и малое олеиновой кислот. В связи с этим подкожный жировой слой новорожденного значительно плотнее, чем у детей старшего возраста. Терморегулирующая функция кожного покрова у новорожденных выражена слабо, поэтому у них легко происходит перегревание и охлаждение, особенно у недоношенных детей.
Неблагоприятные условия внутриутробного развития плода вследствие соматических заболеваний матери и их обострения во время беременности, осложнений течения беременности могут явиться причиной рождения незрелого ребенка в срок, в том числе с низкой массой тела.
В связи с этим в настоящее время в неонатологии используется термин "низкая масса тела при рождении" для всех детей, родившихся с массой тела менее 2500 г, при этом в группу недоношенных включают лишь тех из них, которые родились до 37-й недели и имеют внешние признаки незрелости (тонкая кожа, выраженный сосудистый рисунок, пушковые волосы, покрывающие кожу туловища, лица, недоразвитие хрящей ушных раковин, слабая исчерченность стоп).
Мышечная система развита сравнительно слабо. Мышечная масса у новорожденного составляет 23 % от общей массы тела, в то время как у взрослых – 42 %. Непродолжительная общая мышечная гипотония, отмечаемая сразу же после рождения ребенка, сменяется гипертонией. Столь быстрая динамика обусловлена особенностями нервной системы новорожденных и в первую очередь поздним развитием пирамидных путей наряду с достаточной функцией экстрапирамидных путей, в связи с чем раздражения не достигают коры головного мозга, задерживаются в более низко расположенных центрах.
Костная система новорожденных содержит меньше плотных веществ (солей) и больше воды.
Кости мягкие, эластичные. В большей своей части по строению они близки к хрящевой ткани, вместе с тем отдельные кости не проходят хрящевую стадию – кости свода черепа, лица, ключиц и др.
Лицевые кости у новорожденных соединены прочно, а между черепными костями прощупываются щелевидные сагиттальный и венечный швы, ромбовидный передний (большой) родничок и треугольный задний (малый) родничок.
Наличие или отсутствие некоторых точек окостенения, определяемых рентгенологически, позволяет судить о зрелости новорожденных.
Грудная клетка представляет собой усеченный конус. Ребра мягкие, располагаются перпендикулярно к грудной кости. Межреберные мышцы развиты слабо.
Диафрагма располагается высоко, на уровне Тh8 справа и Th9 слева.
Позвоночник не имеет изгибов и постепенно при перемене положения тела приобретает характерную для взрослых форму.
Органы дыхания.
На момент рождения органы дыхания не достигают полного развития. Дыхание новорожденных характеризуется большим диапазоном колебаний частоты, глубины и продолжительности дыхательных циклов.
Частота дыхания у здоровых доношенных детей от 40 до 70 в 1 мин, у недоношенных – от 30 до 70 в 1 мин. Преобладающим является брюшной тип дыхания. Характерно наличие пауз в дыхании, причем если у доношенных детей их продолжительность от 1 до 5-7 с, а в 1 мин их наблюдается 1 – 2, то у недоношенных она достигает 10-12 с, а количество – от 2 до 5. Соотношение фазы вдоха и выдоха от 1:1,3 до 1:4.
Объемы легочной и альвеолярной вентиляции особенно низки в первые 2-3 сут жизни, в связи с чем высокая потребность организма новорожденного в кислороде покрывается за счет большей частоты дыхания. Минутный дыхательный объем в значительной степени зависит от зрелости детей и составляет в первые часы 500-600 мл в 1 мин с тенденцией к увеличению и нормализации к концу 1-х суток жизни.
Сердечно-сосудистая система.
После рождения ребенка характер кровообращения меняется, что обусловлено прекращением плацентарного кровообращения и началом легочного дыхания. Артериальный (боталлов) и венозный (аранциев) протоки, овальное отверстие и остатки пупочных сосудов постепенно закрываются, а позднее облитерируются.
При гипоксии плода и асфиксии новорожденного закрытие эмбриональных протоков задерживается на 2-3 нед.
В таких случаях отмечается симптом шунта со сбросом крови справа налево через открытое овальное отверстие или слева направо через артериальный проток в легочную артерию.
Клинически это проявляется цианозом, систолическим шумом.
Сердце новорожденного относительно больших размеров, его масса составляет 0,84 % от массы тела (у взрослого 0,48 %) . Оно занимает более высокое и почти горизонтальное положение. Сердечный толчок определяется на уровне четвертого межреберья, на 0,5-1 см кнаружи от средней ключичной линии.
Сердечная деятельность ускорена, частота сердечных сокращений 120- 140 в 1 мин. Тахикардия обусловлена сравнительно малым ударным объемом, который устанавливается только к концу первого года жизни.
При рождении систолическое артериальное давление равно 45 мм рт.ст., в последующие дни оно достигает 60-80 мм рт.ст. Разница между артериальным и венозным давлением невелика (диастолическое давление при рождении 36 мм рт.ст., на 1-8-е сутки жизни – 46 мм рт.ст.).
Особенности ЭКГ новорожденного проявляются в виде правограммы, так как мышечная масса правого желудочка преобладает над таковой левого, зубец Р в стандартных отведениях высокий, в правых может быть отрицательным, зубец R в /отведении низкий, а зубец выражен хорошо. Интервал PQ составляет 0,09-0,12 с.
Органы кроветворения.
Главным органом кроветворения яатяется костный мозг. Кроме того, дополнительные очаги кроветворения выявляются в печени, селезенке, лимфатических узлах и др. В период новорожденносги кроветворение сохраняет в определенной степени эмбриональный характер. Наряду со зрелыми клетками крови в костном мозге находят и молодые форменные элементы. Общее количество крови по отношению к массе тела новорожденного составляет 11 – 19%.
Концентрация гемоглобина повышена до 180-230 г/л, причем Д его представлено фетальным гемоглобином. Число эритроцитов обычно более 510 /-", цветовой показатель более 1.
Перечисленные свойства крови компенсируют гииоксемию, возникающую в родах. В течение постнатального периода отмечаются изменения в содержании эритроцитов и НЬ в периферической крови. На 4 – 7-е сутки жизни число эритроцитов составляет 5,1 10 / и НЬ 186 г/л, а на 10-е сутки жизни 4,98-10 /л и 175 г/л соответственно.
Общее количество лейкоцитов в пуповинной крови составляет 14* с постепенным уменьшением в последующем. К 8-м суткам жизни число лейкоцитов составляет 10,47*109/л
Характерный для первого дня жизни ребенка нейтрофильный лейкоцитоз со сдвигом лейкоцитарной формулы крови влево постепенно снижается и на 4-6-е сугки отмечается "перекрест" кривых нейтрофилов и лимфоцитов.
Свертываемость крови у новорожденных не отличается от нормальных показателей у взрослых (до 5 мин), то же самое относится и к длительности кровотечения (до 4 мин).
Пищеварительная система.
Как в функциональном, так и в морфологическом отношении пищеварительная система у новорожденного в значительной степени незрелая.
Полость рта мала, слюнные железы функционируют слабо. Слюна не оказывает должного влияния на начальном этапе пищеварения из-за низкого содержания амилазы и полного отсутствия муцина и мальтазы. Строение полости рта приспособлено к акту сосания. Глотательное движение происходит через каждые 3-4 сосательных движения.
Во время сосания не исключено заглатывание воздуха – аэрофагия. Длина пищевода составляет 10-12 см, мышечный слой развит слабо, эластическая ткань тоже, что может быть причиной обратного движения в ротовую полость проглоченной пищи.
Вместимость желудка в 1-й день 20 мл, но к 5-м суткам уже 50 мл, а на 10-14-е сутки – 70-80 мл.
Слизистая оболочка желудка нежная. Желудочная секреция начинается с момента поступления пищи в рот или прямо в желудок. Желудочный секрет содержит птиалин, пепсин, соляную кислоту, но активность их недостаточна.
Опорожнение желудка происходит через 2-2,5 ч. В двенадцатиперстной кишке пища подвергается воздействию панкреатического сока, в составе которого имеется трипсин, липаза, амилаза, панкреатин и др. Длина кишечника составляет 3,5 м, слизистая оболочка богато васкуляризирована. Железы кишечника и мышечный слой недоразвиты.
В первые 3 дня после рождения наблюдается отхождение мекония, образование которого в кишечнике плода начинается с 3-4-го месяца внутриутробной жизни. Затем меконий заменяется коричневыми или зеленовато-желтыми, а позднее золотисто-желтыми кашицеобразными испражнениями.
В первые 2 нед частота стула у ребенка 6-8 раз, а затем постепенно урежается до 2 раз в сутки.
Мочеполовая система. Почки новорожденного относительно велики, однако корковый слой и извитые канальцы недоразвиты, концентрационная способность их выражена слабо и составляет около 50 % таковой взрослого человека, выявлена слабая элиминационная способность солей. Мочевой пузырь располагается высоко, его объем 50-80 мл. В первые три дня число мочеиспусканий 5-7, к концу 3-й недели оно увеличивается до 12-20 раз в сутки. Реакция мочи кислая, относительная плотность 1,006-1,012.
Обмен веществ и энергия. Основной обмен у новорожденных, как правило, в два раза выше, чем у детей старшего возраста. Неустойчивость обменных процессов обусловливается в значительной степени недостаточным регулирующим действием нервной системы, а также недостаточной активностью некоторых ферментов.
Суточный основной объем в первые сутки жизни 40-50 кал/г массы тела, в последующие до 55 кал/кг (у взрослых 24 кал/кг массы тела).
Потребность новорожденного в жидкости в связи с высоким уровнем обменных процессов составляет 150-165 мл на 1 кг массы тела в сутки.
Водно-солевой обмен лабилен и нарушается при изменениях условий ухода.
Потребность в белках 2-2,5 г на 1 кг массы, углеводов 12-15 г/кг массы, жиров 5-6,5 г/кг массы тела.
Эндокринная система.
В первые дни жизни происходит катаболизм материнских гормонов в организме ребенка, в связи с чем количество кортизола снижается, однако уже к 6-7-м суткам жизни его концентрация вновь повышается и на 10-12-е сутки жизни достигает уровня взрослых.
Во время родов содержание ТТГ в крови плода повышено в Я-5 раз. Концентрация гормона продолжает нарастать и в первые часы жизни ребенка, но к концу 1-х суток жизни наблюдается ее снижение до исходного уровня.
Повышение концентрации ТТГ в 1-е сутки жизни сопровождается стимуляцией функции щитовидной железы с увеличением количества Т4 за счет биологически активной формы гормона.
Недостаток функциональной активности целого ряда эндокринных желез новорожденного ребенка компенсируется за счет материнских гормонов, поступивших в организм плода через плаценту.
Нервная система. Головной мозг новорожденных недостаточно развит. Кора большого мозга и пирамидные пути не имеют законченной дифференцировки, серое вещество мозга недостаточно ограничено от белого. Намечены большие борозды мозга, но они не всегда ясно выражены.
Некоторые малые борозды отсутствуют. Отмечается недостаточная возбудимость и быстрая утомляемость коры. Нижележащие отделы мозга частично замещают функции коры. Мозжечок развит слабо. В то же время к моменту рождения продолговатый мозг развит очень хорошо.
Вследствие незаконченного развития ЦНС у новорожденного наблюдаются такие рефлексы, которые у взрослых отмечаются только при патологических состояниях, В период новорожденное™ у ребенка можно наблюдать рефлексы, вызываемые путем раздражения губ и околоротовой области: поисковый, сосательный, хоботковый; при раздражении ладони ребенка вызываются хватательный рефлекс и рефлекс открывания рта, сопровождающийся поворотом головы (ладонно-ротоголовной рефлекс), рефлекс Ро-бинсона – хватательный рефлекс. У новорожденного имеются рефлексы опоры и ползания, а также рефлекс ходьбы.
Помимо безусловных рефлексов, вскоре после рождения появляются условные рефлексы. Самые ранние из них формируются на основе пищевых безусловных рефлексов.
Иммунная система у новорожденного еще недостаточно зрелая. Специфические иммунные факторы он получает от матери. Неспецифическая иммунная защита осуществляется клеточными и гуморальными факторами (IgA, IgM, IgG). В первые недели жизни уровень IgG у ребенка соответствует таковому у матери. Уровень IgA и IgM у новорожденных в норме очень низкий. IgA попадают в кишечник ребенка с молоком матери, особенно богато IgA молозиво. Материнский иммуноглобулин постепенно разруша-ется от 1-го к 6-му месяцу жизни, а синтез собственного IgG у ребенка достигает уровня взрослых только к 5 годам.
Пограничные (особые) состояния и заболевания новорожденных
Транзиторные состояния
Характер течения периода адаптации к внеутробной жизни новорожденных находится в прямой зависимости от степени их зрелости. Тем не менее практически у всех новорожденных в раннем неонатальном периоде выявляются те или иные пограничные с нормой состояния.
Пограничными (транзиторными) состояниями называются проявления, отражающие процесс приспособления к новым условиям жизни и, как правило, проходящие в первые дни жизни новорожденного без каких-либо терапевтических вмешательств. Частота выявления пограничных состояний, длительность их сохранения определяется множеством факторов, к основным из которых относятся "низкая масса тела при рождении", осложненное течение беременности и родов, неадекватные условия окружающей среды после рождения, характер вскармливания.
Синдром транзиторного состояния только что родившегося ребенка клинически проявляется глубоким вдохом, громким криком, возбуждением рефлексов и как следствие – флексорной позой новорожденного. Выраженная активность, расширение зрачков, несмотря даже на яркий свет, сохраняются в течение 5-10 мин с момента рождения.
Причиной описанного синдрома является обилие внешних и внутренних раздражителей в момент родов.
Транзиторная гипервентиляцня. Нарастающие в родах гипоксемия, гиперкапния, ацидоз и другие метаболические изменения активизируют ретикулярную формацию ЦНС, нисходящее влияние которой на дыхательный центр определяет возникновение первого вдоха.
Первое дыхательное движение осуществляется по типу ГАСП-дыхания с глубоким вдохом и затрудненным выдохом. У здоровых доношенных новорожденных в первые 3 ч жизни подобные дыхательные движения составляют 8-10 % от общего их числа. Спокойная экспирация, наблюдаемая через 2-3 дыхательных движения, способствует расправлению легких. Высокие параметры минутной легочной вентиляции на протяжении первых 3 сут жизни у новорожденных в сравнении с таковыми (почти в 2 раза) у более старших детей определяются как транзиторная гипервентиляция, физиологическое значение которой заключается в компенсации ацидоза при рождении.
Транзиторное кровообращение. Растяжение грудной клетки, возникающее после первого вдоха, сопровождается нарастанием отрицательного давления внутри нее. Одновременно в результате заполнения легких воздухом значительно уменьшается сопротивление в легочных сосудах, которое становится приблизительно на 20 % меньше, чем оно было до рождения и как следствие этого увеличивается кровоток в легких более чем в 5 раз.
Выравнивание давления в легочной артерии и в аорте, повышение напряжения кислорода в артериальной крови способствуют спазму гладких мышц артериального (боталлова) протока.
Процесс выравнивания давления в этих сосудах может затягиваться до 4-6 нед, что определяется не только состоянием легких (прежде всего активностью их расправления), но и состоянием гемодинамики в большом круге кровообращения, поэтому целесообразно говорить о кардиореспираторной адаптации к условиям внеутробной жизни.
Более низкое давление в легочной артерии, чем в аорте, обусловливает обратный шунт – поступление крови через открытый артериальный проток из аорты в легочную артерию. Закрытие артериального протока происходит постепенно, с первых часов жизни ребенка. Следует отметить, что к 2 мес жизни оно наблюдается только у 80 % детей.
В период функционирования артериального протока может сохраниться шунт как слева направо или справа налево, так и в обоих направлениях. Именно наличием транзиторного кровообращения и характерным сбросом крови слева направо объясняется цианоз конечностей у здоровых новорожденных в первые минуты и часы их жизни.
Транзнторные изменения кожи. Состояния, наблюдаемые практически у всех новорожденных.
Простая эритема – возникновение умеренной гиперемии сразу же после проведения туалета кожи новорожденного. В динамике ко 2-м суткам жизни эритема усиливается, а затем в течение нескольких дней практически угасает.
Физиологическое шелушение кожи наиболее характерно для детей, родившихся от переношенной беременности. На 3-5-е сутки на животе, груди появляются множественные участки шелушения, которые без каких-либо вмешательств в течение нескольких дней исчезают.
Токсическая эритема характеризуется появлением на 3-5-е сутки жизни в основном на эритематозной коже груди, ягодиц, конечностей мелких, слегка плотноватых элементов серовато-желтого цвета. Высыпания могут быть единичными и множественными. Появление сыпи не сопровождается какими-либо изменениями состояния новорожденных. Вместе с тем в случае повторных обильных высыпаний ребенок может быть беспокойным, наблюдается расстройство стула. Одной из причин возникновения токсический эритемы является аллергическая реакция на целый ряд факторов – изменение характера питания, колонизация кишечника, нарушение температурного режима в отделении (охлаждение).
Клинические проявления токсической эритемы сохраняются 2-3 дня, после чего исчезают без каких-либо следов.
Кроме дополнительного литья и назначения супрастина или тавегила 1-2 мг/кг в сутки в 2 приема, никакого лечения не требуется.
Родовая опухоль. Вследствие сжатия предлежащей части и давления при прохождении через родовые пути матери на головке плода возникает отек (пропитывание кожи и подкожной клетчатки).
Обычно родовая опухоль располагается в теменно-затылочной области и при этом голова несколько вытягивается кзади. Отек тканей в области родовой опухоли мягкий, расположен поверхностно, при его пальпации остаются вдавления. Родовая опухоль не ограничивается при своем распространении черепными швами.
Родовая опухоль, как правило, исчезает в течение первых 3-5 дней жизни и не требует вмешательства неонатолога или хирурга.
Транзиторная гипербилирубинемия. Термин "транзиторная гипербилирубинемия" в неонатологии часто ассоциируется с физиологической желтухой новорожденных. Эти понятия могут нести единое смысловое значение только при следующих условиях: 1. появление желтухи после 36 ч жизни новорожденного; 2. максимальное прокрашивание кожного покрова к 3-4-м суткам его жизни, с последующим уменьшением интенсивности желтухи и полное исчезновение к 7-10-м суткам; 3. максимальная концентрация непрямого билирубина в сыворотке крови 205 мкмоль/л, а прямого – 25 мкмоль/л.
В других случаях термин "физиологическая желтуха" не соответствует истинной причине желтухи, и врач обязан безотлагательно ее установить с целью принятия адекватных мер лечения и профилактики осложнений.
Транзиторная гипербилирубинемия отмечается практически у всех новорожденных (уровень общего билирубина в пуповинной крови у доношенных новорожденных составляет не более 51 мкмоль/л, у недоношенных – не более 34 мкмоль/л), желтушность же кожного покрова выявляется лишь у 60-75 % новорожденных.
Появление транзиторной гипербилирубинемии в раннем неонатальном периоде связывают с повышенным образованием билирубина (до 145 мкмоль/кг в сутки), снижением функциональной активности гепатоцитов за счет низкой активности глюкуронилтрансферазы, уридинфосфоглюкозодегидрогеназы, снижения их экскреторной функции.
Умеренно выраженное желтушное окрашивание кожи при физиологической желтухе новорожденных отмечается как моносимптом. Ни увеличения печени и селезенки, ни изменения цвета кала и мочи, ни отклонений в неврологическом статусе не наблюдается. Специальное лечение не проводят.
Раннее прикладывание ребенка к груди матери снижает вероятность и степень выраженности гипербилирубинемии у новорожденных.
Транзиторная потеря первоначальной массы тела. Максимальная потеря первоначальной массы тела наблюдается у всех новорожденных, как правило, на 3-4-е сутки жизни и составляет в среднем 6 %. Крайне редко она может достигать 10 %. Потеря массы тела новорожденного на первой неделе жизни более 10 % должна рассматриваться как патологическая, связанная с заболеванием или грубым дефектом ухода за ним.
Основной причиной транзиторной потери первоначальной массы тела у новорожденного является недостаточное поступление молока и воды в первые дни жизни. Частично это состояние обусловлено мумификацией и в последующем отпадением пуповинного остатка, отхождением мекония, несоблюдением температурного режима, пониженной влажностью воздуха. Но главное – это обезвоживание вследствие недостаточного поступления жидкости и ощутимой потери воды с потом, дыханием.
Восстановление массы тела при рождении наступает у большинства детей на 5-7-е сутки жизни.
Профилактика заключается в строгом соблюдении правил ухода за новорожденными, раннее прикладывание к груди, соблюдение оптимальных режимов температуры и влажности воздуха.
Транзиторное нарушение теплового баланса. Возникновению транзиторных нарушений теплового баланса способствуют несовершенство процессов терморегуляции у новорожденных, нарушение режима температуры и влажности воздуха в палатах для новорожденных.
Транзиторная гипертермия. Возникает в те же сроки, что и транзиторная потеря первоначальной массы тела, в связи с чем основной причиной транзиторной гипертермии считают недостаточное поступление воды и обезвоживание. Транзиторная гипертермия может возникнуть и вследствие перегрева ребенка в кувезе или в кроватке.
Кроме температуры, которая может достигать 39 °С и выше, у ребенка отмечаются беспокойство, сухость кожи и слизистых оболочек.
Безотлагательное устранение причин перегрева, физическое охлаждение (освобождение от пеленок), налаживание питьевого водного режима за счет дополнительного введения 5 % раствора глюкозы до 100 мл в сутки позволяют в кратчайший срок нормализовать температуру тела ребенка без применения анальгетиков.
Транзиторная гипотермия. Возникает из-за погрешностей организации ухода за новорожденными. Для профилактики транзиторной гипотермии необходимо строго выполнять требования по уходу за новорожденными как в родильном зале, так и в палате для новорожденных.
Транзиторная полицитемия. В пуповинной крови новорожденных детей показатели гемоглобина и гематокрита значительно превышают таковые у детей различных возрастных групп и составляют 180-220 г/л и 0,5-0,65 соответственно.
Ряд факторов, основными из которых можно считать нарушения условий внуттэиутробного развития в последние недели беременности, осложнения родов, объем плацентарной трансфузии, может привести к развитию полицитемии – состоянию, которое характеризуется высокими показателями гемоглобина (выше 220 г/л) и гематокрита (выше 0,65).
При много плодной беременности возможно выявление полицитемии у одного из новорожденных вследствие фето-фетальной трансфузии. Материнско-фетальное перераспределение крови может иметь место при поздней перевязке пуповины, предлежании плаценты.
Отмечаются следующие клинические проявления: тахикардия, приглушенность тонов сердца, одышка, отеки, увеличение размеров печени, цианоз кожи наряду с эритемой.
Половой криз. При половом кризе отмечаются, во-первых, нагрубание, постепенное симметричное увеличение молочных желез: с 3-4-го до 7- 10го дня жизни, без гиперемии и гипертермии. При осмотре возможно самостоятельное или как реакция на пальпацию железы выделение содержимого молочного цвУга. Из-за опасности инфицирования выдавливание содержимого молочной железы не рекомендуется. Целесообразно использование тепловых компрессов, стерильной повязки.
Во-вторых, появляется десквамативный вульвовагинит, характеризующийся слизистыми выделениями из влагалища серовато-белого цвета в первые 3 дня жизни или кровотечением из влагалища. Встречается редко, как правило, на 5 – 7-е сутки жизни. Кровянистые выделения объемом 1-2 мл в течение 1-2 сут.
Кроме перечисленных, может наблюдаться целый ряд транзиторных состояний, связанных с дисфункцией таких желез внутренней секреции, как гипофиз, надпочечники, щитовидная железа, а также почек (олигурия, альбуминурия, моче кислый инфаркт), с нарушением обмена веществ (гипокальциемия, гипои гипермагниемия, метаболический ацидоз и др.).
Заболевания новорожденных в раннем неонатальном периоде
Родовая травма. В понятие "родовая травма" принято включать повреждения плода, которые возникают исключительно во время родового акта в результате механической травмы.
Предрасполагающими причинами возникновения истинных механических родовых травм являются несоответствие размеров плода размерам костного таза матери, аномалии предлежания плода и неадекватная акушерская тактика при выборе способа родоразрешения в этих ситуациях.
Антенатальными факторами возможной травматизации плода даже при физиологически протекающих родах являются гестозы, соматические и инфекционные заболевания беременных, резус-несовместимость крови матери и плода.
Во время родов могут быть повреждены кожа, скелет, центральная и периферическая нервная система, различные органы и ткани.
Травма мягких тканей. Клинически проявляется в виде петехий, экхимозов, нарушении целости кожи различных участков тела новорожденного.
Лечение местное, с использованием антисептиков, повязок.
Перелом ключицы. Наиболее часто встречающаяся форма родовой травмы обнаруживается сразу после рождения по наличию крепитации в области ключицы и ограничению активных движений руки.
Лечение – фиксирующая повязка на плечевой пояс и руку. К концу второй недели жизни ребенка ключица срастается.
Перелом костей голени. Встречается очень редко.
Для лечения используют общепринятые методы с вытяжением конечности. Родовые травмы центральной и периферической нервной системы весьма многообразны. Они включают экстракраниальные кровоизлияния, вдавленные переломы, интракраниальные кровоизлияния, контузию мозга, контузию мозжечка, повреждения спинного мозга и несколько типов повреждений периферической нервной системы, например корешков черепных периферических нервов.
Экстракраниальные кровоизлияния. Выделяют 3 главных варианта экстракраниальных кровоизлияний: 1. родовая опухоль с геморрагическим пропитыванием или подкожной гематомой; 2. субапоневротическое кровоизлияние; 3. кефалогематома.
Эти повреждения развиваются в различных тканевых пространствах между кожей и покровными костями черепа.
Субапоневротическое кровоизлияние. Кровоизлияние ниже апоневротического покрытия скальпа и соединения лобного и затылочного компонентов затылочно-лобной мышцы.
Кровь может распространяться ниже апоневроза и даже проникать в анатомические подкожные пространства шеи. Патогенез субапоневротического кровоизлияния обусловлен комбинацией внешнего сдавления и тянущих сил при оказании акушерских инструментальных пособий. В ряде случаев развитию данного кровоизлияния способствуют нарушения гемокоагуляции (например, дефицит витамина К). Этот вид повреждений встречается гораздо реже, чем родовая опухоль, хотя точные цифры неизвестны.
Субапоневротическое кровоизлияние представляет собой относительно твердое, флюктуирующее образование, увеличивающееся после рождения и переходящее в подкожные ткани задней поверхности шеи. У новорожденного с кровоизлиянием под апоневроз могут наблюдаться признаки острой кровопотери и нарастающей гипербилирубинемии. Вопрос о необходимости неотложной гемотрансфузии решается при тщательном динамическом лабораторном контроле. По окончании острой стадии данное повреждение самопроизвольно разрешается в течение 2-3 нед.
Кефалогематома. Кефалогематома является под надкостничным кровоизлиянием, ограниченным черепными швами, встречается приблизительно у 1-2% новорожденных, почти в 2 раза чаще у мальчиков, чем у девочек, и более часто при одноплодной беременности. Использование щипцов в родах резко увеличивает этот показатель (примерно до 33 %) . Субпериостальное кровоизлияние (кефалогематома) отличается от родовой опухоли и субапоневроти чес кого кровоизлияния, расположенных над периостальной пластинкой в подкожной и подфасциевой областях тем, что, располагаясь поднадкостнично, не распространяется за пределы черепных швов. Обычно встречаются односторонние кефалогематомы в области теменной кости. При достаточно редкой локализации кефалогематомы в области затылочной кости по средней линии, ограниченной ла.мбдовидным швом, необходимо дифференцировать от энцефалоцеле (ультразвуковое ис-следование в данной ситуации наиболее информативно). Приблизительно в 10-25 % случаев кефалогематома сочетается с переломом костей черепа.
Кефалогематома во всех случаях имеет чисто травматический генез. Возникновение повреждения зависит от степени травм этичности родов.
После рождения ребенка кефалогематома может увеличиваться, становясь более напряженной при пальпации. Кефалогематома редко сопровождается неврологической симптоматикой, если не сочетается с другими интранатальными повреждениями нервной системы. Крайне редко встречаются случаи инфицирования кефалогематомы и другие осложнения. Обратное развитие кефалогематомы происходит самостоятельно в течение нескольких недель или месяцев. В случае кальцификации гематомы на голове новорож-денного ребенка формируются плотные возвышения, изменяющие форму в процессе роста черепа.
НеосложЛненная кефалогематома специфической терапии не требует. Кровопотеря редко бывает столь значительной, что требует срочного вмешательства. Удаление содержимого кефалогематомы в большинстве случаев противопоказано. Лечение редких осложнений необходимо проводить совместно схирургом.
Переломы костей черепа. Различают 3 основных вида переломов костей черепа у новорожденных: 1. линейный перелом; 2. вдавленный перелом; 3. затылочный остеодиастаз.
(Об истинном переломе костей черепа речь может идти только в случае линейного повреждения, при котором кость теряет свою целость.)
Расхождение затылочных костей (остеодиастаз). При значительном механическом давлении на затылочную кость подвижная чешуя последней может выдавливать мозжечок в сторону отверстия намета мозжечка, что часто сопровождается развитием кровоизлияний в области его четырехугольных долек. Расхождение затылочных костей, разделение чешуи и боковых частей затылочной кости может приводить к субдуральному кровоизлиянию в заднюю черепную ямку, ушибу (или контузии) мозжечка, сдавливанию (компрессии) медуллярной части мозжечка. Наиболее часто данный вид травмы встречается при ягодичном или ножном предлежании.
Повреждения спинного мозга. Повреждения спинного мозга у новорожденных возникают в процессе родов в результате чрезмерной тракции или ротации.
Выделяют 2 основных участка, где повреждения спинного мозга развиваются наиболее часто: верхний и средний отделы шейного отдела (повреждения характерны для родов в головном предлежании), нижний шейный или верхний грудной отдел (травма чаще связана с родами в ягодичном предлежании). Доминирующими при острой травме являются эпидуральное и интраспинальное кровотечения.
Клиническая картина зависит от локализации и вида повреждения. Болевой синдром, возникающий при перемене положения ребенка, характерен для травмы шейного отдела позвоночника; клинические симптомы спинального шока, гипои адинамия, мышечная, гипои атония, гипои арефлексия, расстройства дыхания различной степени выраженности указывают на повреждение верхнешейных сегментов спинного мозга (С1 – C4).
Кроме того, характерным является развитие пареза диафрагмы при травме плечевого сплетения на уровне (С3-C4), пареза и паралича Дюшенна-Эрба (C5-С6).
Клинические проявления первого – симптомокомплекс респираторного дистресс-синдрома, второго – нарушения функции верхних конечностей (снижение тонуса, затруднение отведения пораженной конечности, ее сгибания) .
Родовая травма спинного мозга в пояснично-крестцовой области проявляется развитием нижнего вялого парапареза при сохранении нормальной двигательной активности верхних конечностей. Ребенок лежит в позе лягушки, в вертикальном положении тела при осмотре на руке врача ноги новорожденного свисают как плети, рефлексы опоры, автоматической походки отсутствуют.
Диагноз устанавливается на основании данных анамнеза, клинических симптомов. Из параклинических методов диагностики используется рентгенография позвоночника, грудной клетки.
Лечение заключается в иммобилизации головы и шеи с использованием ватно-марлевых воротников. Из лекарственных препаратов назначается реланиум, седуксен, по 0,1 мг./кг 2-3 раза в день с целью снятия боли. Особое значение имеют щадящий уход, витаминотерапия, физиотерапия.
Внутричерепные родовые травмы. Данный вид интранатальной травмы практически всегда сопровождается не только различными и по локализации, и по объему кровоизлияниями, очагами ишемии и деструкции вещества головного мозга, но и, что более характерно для патологии такого рода, механическими повреждениями костей черепа, твердой мозговой оболочки и ее производных (венозные синусы, намет мозжечка).
Внутричерепные кровоизлияния при родовой травме могут быть эпидуральными, субдуральными, субарахноидальными (крупноочаговыми) и внутримозговыми.
Эпидуральное кровоизлияние – между твердой мозговой оболочкой и надкостницей на внутренней поверхности черепа – встречается редко, в основном у доношенных и переношенных новорожденных, и почти всегда сочетается с линейными переломами костей черепа. Чаще всего возникает при неправильном наложении акушерских щипцов. Твердая мозговая оболочка крепко связана с костями черепа и отслоение ее кровью происходит с трудом, поэтому эпидуральная гематома свидетельствует о тяжелой травме.
Характеризуется быстрым прогрессированием симптомов внутричерепной гипертензии в течение первых 24-72 ч после рождения, очень часто в сочетании с фокальными или очаговыми судорогами, нарушением уровня бодрствования (нарушением сознания). При значительных по объему гематомах прогноз неблагоприятный в тех случаях, когда своевременно не проводится нейрохирургическое вмешательство. Диагноз подтверждается после проведения компьютерной томографии, рентгенографии костей черепа, диафаноскопии, нейросонографии (по косвенным признакам).
Лечение на начальных этапах заключается в проведении гемостатической, противосудорожной и дегидратационной терапии, после подтверждения диагноза – нейрохирургическое лечение (удаление гематомы).
Субдуральное кровоизлияние локализуется между твердой и паутинной мозговыми оболочками. В зависимости от источника кровотечения его обнаруживают над поверхностью больших полушарий, в верхней продольной щели, на основании полушарий, а также в задней черепной ямке. Субдуральные кровоизлияния вследствие разрывов дупликатур твердой мозговой оболочки и крупных вен являются самыми частыми видами внутричерепной родовой травмы. Клинические проявления зависят от количества излившейся крови, локализации гематомы, а также от наличия других сопутствующих повреждений ЦНС. К ранним проявлениям относятся признаки внутричерепной гипертензии, довольно выраженная конъюгационная гипербилирубинемия, ранняя постгеморрагическая анемия. Отмечаются возбуждение, тахипноэ, тахикардия, тремор конечностей, срыгивания или рвота, выбухание переднего (большого) родничка, расхождение черепных швов, постепенно или резко возникающее нарушение уровня бодрствования (сознания). Иногда развиваются судороги, которые могут сопровождаться очаговыми неврологическими симптомами. Судороги часто носят очаговый или фокальный характер.
Субдуральные кровоизлияния, развивающиеся при надрыве намета мозжечка, локализуются супратенториально, а при полном его разрыве инфратенториально в задней и средней черепной ямках. Разрыв намета может быть односторонним или двусторонним, в некоторых случаях сопровождается настолько сильным кровоизлиянием, что вызывает геморрагическую деструкцию мозжечка. Очень часто у недоношенных новорожденных дан-ный вид субдуральных кровоизлияний сопровождается контузией мозжечка и развитием внутримозжечковых гематом. При полном разрыве намета мозжечка и быстром накоплении крови в ограниченном пространстве задней черепной ямки развивается компрессия ствола головного мозга, что клинически проявляется как катастрофическое ухудшение состояния с признаками грубой внутричерепной гипертензии, нарушениями уровня бодрствования, гипорефлексией, гипотонией, тоническими судорогами, опистотонусом, сосудистым коллапсом, нарушениями дыхания (по типу Биота или Чейна-Стокса). В течение нескольких часов развивается коматозное состояние с нарушениями функций дыхательного и сосудодвигательного центров.
Диагноз подтверждается на основании данных микроскопии цереброспинальной жидкости (ликвора), анализа динамики уровня гемоглобина и гематокрита в центральных сосудах, результатов компьютерной томографии, нейросонографии.
Лечение до подтверждения диагноза заключается в обеспечении максимального покоя в условиях палаты или отделения интенсивной терапии, мониторном контроле за основными жизненно важными показателями (дыхание, системное АД, частота сердечных сокращений, КОС, уровень гемоглобина и гематокрита) с осторожной коррекцией возникающих отклоне-ний, проведением симптоматической терапии (гемостатическая, противосудорожная, дегидратационная, кислородотерапия, кардиотоническая и т.д.).
После подтверждения диагноза проводится нейрохирургическое вмешательство. Прогноз для жизни при данном виде кровоизлияний неблагоприятный. Исключение составляют небольшие по объему субдуральные гематомы.
Субарахноидальное кровоизлияние локализуется под паутинной оболочкой. Выделяют также субпиальные кровоизлияния – между мягкой мозговой оболочкой и веществом мозга. Субарахноидальные и субпиальные кровоизлияния составляют лептоменингеальные кровоизлияния.
Характерными признаками для субарахноидальных кровоизлияний травматического генеза являются крупноочаговость, сочетание с субдуральными гематомами, проявлениями контузии или сотрясения головного мозга (и/или мозжечка).
Клиническая картина не имеет специфики. Одними из ранних клинических проявлений могут быть сменяющие друг друга периоды возбуждения и торможения, признаки раздражения мозговых оболочек, иногда этот симптомокомплекс включает еще и судороги, трудно поддающиеся лечению. При крупноочаговых субарахноидальных кровоизлияниях, сочетающихся с контузией мозга или субдуральными кровоизлияниями, ухудшение может носить катастрофический характер, быстро прогрессируют симптомы внутричерепной гипертензии, появляются признаки раздражения мозговых оболочек на фоне глубокого угнетения ЦНС. Прогноз зависит от обширности кровоизлияния, его локализации и наличия или отсутствия дополнительных повреждений.
Диагностика базируется на данных микроскопии ликвора (наличие измененных и неизмененных эритроцитов, смешанный нейтрофильно-лимфоцитарный цитоз, повышенный уровень белка и наличие макрофагов). В ранних стадиях изолированных субарахноидальных кровоизлияний, расположенных над поверхностью больших полушарий, компьютерная томография и нейросонография малоинформативны.
Подходы к терапии новорожденных с подтвержденным субарахноидальным кровоизлиянием практически не отличаются от тех мероприятий, которые были изложены ранее, за исключением необходимости нейрохирургического вмешательства.
Сотрясение головного мозга. Области сотрясения мозга обычно располагаются в коре, а также прилегающем подкорковом белом веществе и представлены обычно зонами некроза и участками мелкоочаговых кровоизлияний. У новорожденных сотрясение мозга, как правило, представляет собой участок небольших разрывов и кровоизлияний в белом веществе большого полушария, распространяющихся на кору мозга или стенки боковых желудочков. Участки кортикального некроза и диапедезных геморрагии – результат эффекта прямого сдавления головного мозга в родах, возникающего при быстром и значительном деформировании черепа в момент травмы. При восстановлении мозгового кровообращения в постнатальном периоде в областях разрывов и некрозов в отдельных случаях развиваются интрацеребральные кровоизлияния.
Клинически сотрясение головного мозга может проявляться как тяжелыми общемозговыми расстройствами, так и локальной неврологической симптоматикой в виде различных форм двигательных нарушений – геми-, монопарезов, насильственного отведения глаз в сторону очага повреждения ("кукольный" взгляд).
Диагноз при жизни устанавливается при помощи магнитно-резонансной томографии, а также радиоизотопного исследования интенсивности локального мозгового кровотока с применением технеция или ксенона.
Лечение заключается в обеспечении максимального покоя в условиях палаты или отделения интенсивной терапии, мониторный контроль за основными жизненно важными показателями (дыхание, температура тела, системное АД, частота сердечных сокращений, КОС, уровень гемоглобина и гсматокрита) с осторожной коррекцией возникающих отклонений. Инфузионная терапия должна проводиться только с помощью специальных инфузионных насосов, позволяющих контролировать скорость введения различных растворов и препаратов. Коррекция различных отклонений в деятельности сердечно-сосудистой системы, водно-электролитного и кислотноосновного баланса проводится с использованием только внутривенного пути введения всех лекарственных препаратов, В качестве гемостатической терапии используют этамзилат в дозе 12,5 мг/кг струйно в течение первых 2 ч жизни, а затем с 6-часовыми промежутками в той же дозе в течение 4 последующих дней; свежезамороженную плазму 10 мл/кг в сутки, Ш % раствор кальция глюконата в дозе 1-4 мл/кг.
Специфическая терапия при сотрясении головного мозга не разработана.
Кровоизлияние в мозжечок. Обширная геморрагическая деструкция мозжечка встречается относительно редко и в основном у недоношенных новорожденных. В подавляющем большинстве случаев кровоизлияния в мозжечок возникают вследствие разрыва намета мозжечка или массивного внутрижелудочкового кровоизлияния у глубоконедоношенных.
Клиническое течение кровоизлияний в мозжечок характеризуется таким же быстрым прогрессированием, как субдуральное кровоизлияние в заднюю черепную ямку. Основным методом лечения является нейрохирургическое вмешательство.
Асфиксия новорожденных. Под асфиксией новорожденных понимают патологическое состояние, которое проявляется сразу после рождения отсутствием или неэффективностью дыхания, нарушением кровообращения и угнетением нервно-рефлекторной деятельности ЦНС. Развитию данного состояния предшествует острая или хроническая гипоксия плода.
Первичное апноэ – начальный физиологический ответ на острую перинатальную гипоксию; проявляется прекращением дыхательных движений, брад и кард ией, транзиторной артериальной гипертензией.
Кратковременная вспомогательная вентиляция легких, применяемая в этих случаях, как правило, дает положительный эффект.
Вторичное апноэ вторичная остановка дыхания после гаспинг-дыхания, следовавшего за первичным апноэ. Характеризуется также падением артериального давления, брадикарлией, мышечной гипотонией. Оживление новорожденных при этом состоянии требует продолжительной искусственной вентиляции легких (ИВЛ), интенсивной терапии. Прогноз не всегда удовлетворител ьный.
Симптомокомплекс асфиксии новорожденного. Клиническая оценка степени тяжести асфиксии новорожденных осуществляется по классификации, предложенной В.Апгар в 1950 г. (см. Ведение родов).
Оценка состояния новорожденного по шкале Апгар проводится на 1-й и 5-й минутах после его рождения. Об удовлетворительном состоянии при рождении ребенка свидетельствует оценка в 8-10 баллов.
Легкая асфиксия (оценка по шкале Апгар 6-7 баллов через 1 мин после рождения). Дети, родившиеся в состоянии легкой асфиксии, специального лечения, как правило, не требуют. Наиболее частой проблемой в период ранней адаптации является синдром повышенной нервно-рефлекторной возбудимости: отмечается оживление безусловных рефлексов, спонтанный рефлекс Моро, реже горизонтальный или вертикальный нистагм глазных яблок. Указанные симптомы обратимые и в первые часы жизни не должны рассматриваться как признак церебральной патологии. У некоторых детей, помимо указанных изменений неврологического статуса, отмечаются повторные срыгивания околоплодными водами. При стабильном состоянии к концу 2-го часа жизни вопрос о его переводе должен решаться в общем порядке. Легкая асфиксия обычно не является противопоказанием к переводу ребенка в отделение совместного пребывания "мать и дитя". Асфиксия средней тяжести (оценка по шкале Апгар 4-5 баллов через 1 мин после рождения). У большинства детей, родившихся в этом состоянии, отмечается централизация кровообращения той или иной степени выраженности. Это неблагоприятно сказывается на функциональном состоянии почек, печени, желудочно-кишечного тракта. Кроме того, отме-чаются более выраженные нарушения функции ЦНС. Помимо синдрома повышенной нервно-рефлекторной возбудимости, у части детей отмечаются синдром угнетения нервно-рефлекторной деятельности и судорожный синдром. Для таких детей характерны нестабильная терморегуляция, мраморный рисунок кожного покрова, избыточная продукция слизи в дыхательных путях и желудочно-кишечном тракте, нарушение перистальтики, срыгивания, анурия или олигурия. В связи с этим течение периода адаптации таких детей к внеутробной жизни во многом зависит от создания благоприятных условий выхаживания (в кувезе), обеспечения дополнительным кислородом при нагрузке, очистительной клизмы, периодического отсасывания слизи из верхних дыхательных путей и желудка, отсрочки на 6-8 ч первого кормления, а при выраженной дезадаптации – поддерживающей инфузионной терапии и частичного парентерального питания.
Тяжелая асфиксия (оценка по шкале Апгар 0-3 балла через 1 мин после рождения). У детей этой группы можно выявить нарушения функции практически всех органов и систем организма. В первые часы жизни ребенок может находиться в прекоматозном состоянии или коме, на этом фоне часто отмечается развитие гипертензионного и судорожного синдромов. Как правило, у таких детей регистрируются синдромы дыхательной, сердечно-сосудистой и острой почечной недостаточности, геморрагический синдром, синдром срыгивания. У некоторых детей отмечается клиническая картина шока. Биохимические анализы крови позволяют выявить выраженные метаболи-ческие нарушения, требующие коррекции.
Оказание помощи новорожденным, родившимся в асфиксии, должно проводиться в соответствии с приложением 1 к Приказу министра здравоохранения и медицинской промышленности Российской Федерации № 372 от 28 декабря 1995 г. "Первичная и реанимационная помощь новорожденному в родильном зале".
При оказании реанимационной помощи новорожденному в родильном зале следует строго соблюдать следующую последовательность действий: 1. прогнозирование необходимости реанимационных мероприятий и подготовка к их выполнению; 2. оценка состояния ребенка сразу после рождения; 3. восстановление свободной проходимости дыхательных путей; 4. восстановление адекватного дыхания; 5. восстановление адекватной сердечной деятельности; 6. введение лекарственных средств.
В большинстве случаев рождение ребенка в асфиксии может быть спрогнозировано заранее на основе анализа антенатального и интранатального анамнеза, однако иногда ребенок все-таки рождается в асфиксии. В связи с этим процесс подготовки к каждым родам должен включать в себя: 1. создание оптимальной температурной среды для новорожденного ребенка; 2. подготовку оборудования для реанимационных мероприятий; 3. обеспечение присутствия при родах хотя бы одного специалиста, владеющего приемами реанимации новорожденного в полном объеме; один или два других подготовленных члена дежурной бригады должны быть наготове на случай экстренной ситуации.
Когда прогнозируется рождение ребенка в тяжелой асфиксии, в родильном зале должна присутствовать реанимационная бригада, состоящая из двух человек, обученных всем приемам реанимации новорожденных (желательно, чтобы это были неонатолог и детская медицинская сестра).
При решении вопроса о начале лечебных мероприятий следует опираться на выраженность признаков живорожденности: самостоятельное дыхание, сердцебиение (ЧСС), пульсация пуповины, произвольные движения мышц. В отсутствие всех 4 признаков живорождения ребенок считается мертворожденным и реанимации не подлежит. Если у ребенка отмечается хотя бы один из признаков живорождения, ему необходимо оказать первичную и реанимационную помощь. Объем и последовательность реанимационных мероприятий зависят от выраженности 3 основных признаков, характеризующих состояние жизненно важных функций новорожденного ребенка: самостоятельного дыхания, ЧСС и цвета кожного покрова.
Оказание первичной помощи ребенку, родившемуся в асфиксии, начинают с быстрейшего обеспечения внешнего дыхания, что достигается освобождением дыхательных путей от слизи. Осторожное отсасывание катетером содержимого полости рта начинают еще при появлении головы ребенка в родовых путях или сразу после рождения. В отсутствие самостоятельного дыхания используют метод активной тактильной стимуляции – щелчок по подошве или энергичное раздражение кожи спины.
При тяжелой асфиксии указанные методы неэффективны, в связи с чем целесообразно, не теряя времени, приступить к проведению искусственной вентиляции легких. В случае выявления в околоплодных водах или в ротоглотке мекония незамедлительно необходимо провести интубацию трахеи с последующей санацией трахеобронхиального дерева.
В конце первого этапа реанимации, который не должен превышать 25 с, необходимо оценить дыхание ребенка.
Адекватное дыхание, ЧСС более 100 в 1 мин, розовый оттенок или легкий цианоз кожных покровов свидетельствуют об эффективности проводимых мероприятий и возможности их прекращения. Тем не менее наблюдение за новорожденным должно продолжаться.
Отсутствие адекватного дыхания, цианоз, выраженные изменения основных лабораторных показателей, в первую очередь гематокрита, гемоглобина, рН и газового состава крови, определяют необходимость расширения комплекса мероприятий с проведением масочного дыхания с использованием мешка Амбу. Первоначально (первые 3-5 вдохов) давление может составлять 30-50 см вод. ст., в последующем – не более 20 см вод. ст. Частота дыхания 30-50 в I мин. Как правило, используется 60 % кислородно-воз душная смесь.
Неэффективность вентиляции мешком и маской определяет необходимость длительной дыхательной терапии и перевод на аппаратное дыхание, для чего проводится интубация трахеи. Диаметр интубационной трубки определяется массой тела новорожденного: до 1 кг – 2,5 мм, от 1 до 2,5 кг – 3 мм, более 2,5 кг – 3,5 мм.
Параметры ИВЛ: частота дыхания около 40 в 1 мин, давление на вдохе около 20 см вод. ст., на выдохе – 2-4 см вод. ст., соотношение вдох:выдох вначале 1:1 и затем 1:2.
Одновременно с ИВЛ осуществляют коррекцию гемодинамических и метаболических расстройств.
При ЧСС менее 80 в 1 мин необходимо проведение наружного массажа сердца. Если в течение 60 с непрямого массажа сердца эффекта нет, то следует стимулировать сердечную деятельность введением 0,01 % раствора адреналина (0,1 мл на 1 кг массы тела). Рассчитанную дозу адреналина разводят равным количеством изотонического раствора натрия хлорида и вводят эндотрахеально или в вену пуповины. При необходимости повторные (до 3 раз) введения осуществляют с интервалом 5 мин.
За детьми, перенесшими асфиксию средней тяжести и тяжелую, должны ухаживать наиболее опытные и квалифицированные медицинские сестры. Этим детям требуется особенно бережное отношение при выполнении основных медицинских процедур, а воздействия, стимулирующие ЦНС (горчичники, интенсивная перкуссия грудной клетки и др.), противопоказаны. Ввиду выраженных нарушений микроциркуляции в первые сутки жизни (по крайней мере в первые 12 ч) нецелесообразно проведение внутримышечного введения лекарственных препаратов и их введение в желудок. До тех пор пока ребенок находится в тяжелом состоянии, необходимо отдавать предпочтение внутривенному пути введения препаратов. При этом внутривенное введение жидкости должно осуществляться равномерно в течение суток. Растворы вводят в периферические вены головы и конечностей (пункция вен должна проводиться сразу после согревания ребенка), а при выраженном венозном застое или низком артериальном давлении – в пупочную вену. Катетеризацию пупочной вены и уход за венозным катетером необходимо проводить при строгом соблюдении правил асептики и антисептики. Однако даже при этих условиях использование для введения растворов пупочной вены может привести к ряду серьезных осложнений (тромбоэмболия, портальная гипертензия, сепсис). Поэтому, как только произойдет стабилизация гемодинамики ребенка (обычно в первые часы – в первые сутки жизни), необходимо произвести пункцию одной из периферических вен и удалить катетер из пупочной вены. В редких случаях (длительное сохранение низкого артериального давления, необходимость полного парентерального питания) производят пункцию подключичной, яремной или бедренной вен.
Необходимо, чтобы ребенок находился в нейтральной температурной среде. С этой целью используют инкубаторы (кувезы) или (при использовании детских кроваток) источники лучистого тепла и грелки. Для контроля за адекватностью температурного режима показано ректальное измерение температуры каждые 4 ч на протяжении первых нескольких суток жизни или непрерывное наблюдение за температурой тела при помощи кожного датчика.
Обычно внутривенное введение Ш % раствора глюкозы из расчета 60- 70 мд/кг/сут обеспечивает физиологическую потребность в воде, в энергии на протяжении первых 2-3 сут жизни Вместе с тем во избежание усиления отека (набухания) вещества головного мозга в первые сутки жизни доношенным и недоношенным детям с массой более 1500 г целесообразно ограничить объем вводимой жидкости до 35-120 мл/кг в сутки. В после-дующие сутки инфузионная терапия носит поддерживающий характер. Ее основная цель – поддержание биохимического гомеостаза организма новорожденного.
В отсутствие контроля за уровнем электролитов в крови парентеральное введение кальция проводят, начиная с первых суток жизни, с целью профилактики ранней гипокальциемии. Для этого используется 10 % раствор кальция глюконата. Парентеральное введение натрия начинают с момента установления адекватного диуреза (обычно не ранее 2-3-х суток жизни), парентеральное введение калия – на одни сутки позже (с 3-4-х суток жизни). Физиологическая потребность в натрии составляет 2-3 мэкв/кг в сутки (у глубоконедоношенных – до 4 мэкв/кг в сутки). Физиологическая потребность в калии – 1 – 2 мэкв/кг в сутки (у глубоконедоношенньгх до 3 мэкв/кг в сутки). Потребность в кальции составляет 0,45-0,9 мэкв/кг в сутки.
По мере стабилизации состояния ребенка (обычно ко 2-м – началу 3-х суток жизни) после проведения пробного питания водой и 5 % раствором глюкозы через зонд показано проведение энтерального питания.
Необходимо помнить, что реанимация в родильном зале является лишь первым этапом оказания помощи детям, родившимся в асфиксии. Дальнейшее наблюдение и лечение проводят по возможности в отделении (палате) интенсивной терапии, куда ребенка переводят с соблюдением необходимых правил транспортировки сразу по окончании реанимационных мероприятий. При неадекватном самостоятельном дыхании, шоке, судорогах и центральном цианозе транспортировку новорожденного в отделение (палату) интенсивной терапии осуществляют, не прекращая ИВЛ, начатую в родильном зале.
Все дети независимо от степени тяжести перенесенной асфиксии нуждаются в динамическом наблюдении в первые дни после рождения.
Инфекционные заболевания у новорожденных
Внутриутробное инфицирование нередко приводит к заболеванию новорожденных. Клиническое проявление заболевания зависит от возбудителя, времени и пути инфицирования. Инфекций, передающихся от матери к плоду, существует больше, чем включено в традиционную аббревиатуру TORCH (см. Внутриутробная инфекция).
Цитомегаловирусная инфекция.
Клиническая картина у новорожденных характеризуется значительным полиморфизмом симптомов. Наряду с острым течением заболевания, проявляющимся ранним появлением желтухи, гелатоепленомегалией, геморрагическим синдромом, выявляются случаи бессимптомного течения, для которых характерна лишь легкая неврологическая симптоматика При этом такие осложнения, как сенсорная глухота, грубая задержка нервно-психического развития ребенка, выявляются в более поздние периоды жизни.
У новорожденных с врожденной цитомегаловирусной инфекцией вирусы обнаруживаются в моче, слюне, спинномозговой жидкости. Для диагностики необходимо собрать слюну в емкость со средой для культивирования вируса. Мочу и другие материалы следует посылать в лабораторию в охлажденном виде.
С иелью диагностики проводится определение специфических ЦМВантител класса ]gM. Кроме того, используется электронно-микроскопическое исследование слюны, осадка мочи или ткани печени. Наличие частиц вируса подтверждает диагноз.
Эффективной специфической противовирусной терапии нет. Назначение ганцикловира новорожденным положительного результата не дало. Для уменьшения выраженности виремии рекомендовано использовать специфический антицитомегаловирусный иммуноглобулин по схеме.
Простой герпес.
Известны 2 ссротипа простого герпеса: I и II.
Клинически заболевание может протекать бессимптомно (очень редко), с локализованными поражениями кожи или глаз. Диссеминированный процесс может проявляться признаками, характерными для сепсиса. Для изолированного поражения ЦНС характерны лихорадка, вялость, плохой аппетит, гипогликемия, синдром повышенной нервно-рефлекторной возбудимости, за которым следуют некупирующиеся фокальные или генерализованные судороги.
Везикулярные элементы на слизистых оболочках и коже являются важным доказательством заболевания.
Для диагностики заболевания исследуют содержимое везикул или поврежденных участков кожи в мазке по Тзанку для выявления гигантских многоядерных клеток или прямым иммунофлюоресцентным методом для обнаружения антигена вируса простого герпеса.
Лечение – при всех клинических формах неонатальной герпетической инфекции, включая изолированное поражение кожи, обязательно назначается "Ацикловир".
При генерализованной форме, герпетическом поражении ЦНС или офтальмогерпесе ацикловир вводят в дозе 60-90 мг/кг массы тела в сутки внутривенно. Суточная доза делится на 3 введения через каждые 8 ч. Длительность курса не менее 14 дней.
При изолированном поражении кожи – доза 30 мг/кг массы тела в сутки внутривенно. Суточную дозу делят также на 3 введения. Курс лечения 10-14 дней.
В комплексной терапии используют реаферон в дозе 100-150 тыс. МЕ/кг 2 раза в сутки через 12 ч в течение 5 дней в свечах, иммуноглобулин с высоким титром противогерпетических антител.
Определение уровня противогерпетических антител у матери и ребенка не имеет диагностической ценности.
Токсоплазмоз.
При позднем заражении, когда первые симптомы выявляются после рождения, заболевание протекает в виде генерализованного процесса с интоксикацией, желтухой, гепатоспленомегалией.
Диагностика: выявление возбудителя в нативном или окрашенном по Романовскому-Гимзе препарате осадка спинномозговой жидкости после центрифугирования, в периферической крови, моче, мокроте; проведение серологической пробы Себи на-Фельдмана или кожной пробы с токсоплазмином.
Для лечения токсоплазмоза используют пириметамин в комбинации с сульфаниламидными препаратами.
Сульфадимезин назначают в дозе 1 г 2 раза в сутки, пириметамин (хлорифин) – 25 мг 2 раза в сутки. Проводят 2-3 курса по 7-10 дней с перерывами 10 дней.
Листериоз.
У новорожденных клиническая картина врожденного листериоза проявляется аспирационной пневмонией и нарушением мозгового кровообращения. Часто поражаются орган слуха (отит), ЦНС (менингеальные явления) и печень. Нередко выявляются характерные кожные высыпания: папулы величиной с булавочную головку или просяное зерно с красным ободком по периферии, локализующиеся на спине, ягодицах и конечностях. Подобные высыпания при осмотре можно увидеть на слизистой оболочке глотки, зева, конъюнктиве. При бактериологическом исследовании возбудителя инфекции удается получить из содержимого кожных папул, мекония, мочи и цереброспинальной жидкости. Лечение проводят антибиотиками (ампициллин).
Краснуха.
Диагноз краснухи у новорожденного ставится на основании клинических симптомов и лабораторных данных (выделение вируса из мочи и фарингеального секрета). Важным диагностическим тестом является выявление специфических краснушных IgM-антител в крови новорожденного.
Специфической терапии нет.
Инфекционные заболевания новорожденных бактериальной этиологии.
К бактериальным инфекционным заболеваниям новорожденных относятся болезни кожи, мастит, омфалит, пневмония, конъюнктивит, сепсис и менингит, реже – артрит и остеомиелит. Источниками инфекции могут быть больные мать, персонал, новорожденные, плохо обработанный инструментарий. Гнойно-воспалительные заболевания у новорожденных детей характеризуются наличием местных признаков воспаления различной степени выраженности, симптомокомплексом инфекционного токсикоза, наличием изменений, характерных для воспалительного процесса, в общем и(или) биохимическом анализах крови, общем анализе мочи (при инфекции органов мочевыводяшей системы), спинномозговой жидкости (при нейроинфекции), выявлением патологии при тех или иных инструментальных методах обследования (УЗИ, рентгенография и др.).
Наиболее распространенными инфекционными заболеваниями кожи являются стафилодермии (везикулопустулез, пузырчатка новорожденных, эксфолиативный дерматит Риттера, псевдофурункулез Фигнера, мастит новорожденных, некротическая флегмона новорожденных).
При везикулопустудезе на коже естественных складок, головы, ягодиц появляются мелкие поверхностно расположенные пузырьки размером до нескольких миллиметров, заполненные прозрачным, а затем мутноватым содержимым вследствие воспаления в устьях меракринных потовых желез. Везикулы лопаются через 2-3 дня после появления, а эрозии покрываются сухими корочками, не оставляющими после отпадения рубцов или пигментации.
При пузырчатке новорожденных на фоне эритематозных пятен появляются пузырьки до 0,5-1 см в диаметре, с серозно-гнойным содержимым, с незначительно инфильтрированным основанием и венчиком гиперемии вокруг пузыря и находящиеся в разных стадиях развития. После вскрытия пузырьков образуются эрозии. При злокачественной форме пузырчатки появляются фликтены (пузыри преимущественно больших размеров до 2-3 см в диаметре). Кожа между отдельными пузырями может слущиваться. Общее состояние новорожденного тяжелое, выражены симптомы интоксикации.
Эксфолиативный дерматит Риттера вызывается госпитальными штаммами золотистого стафилококка, продуцирующего экзотоксин эксфолиатин. В конце 1-й – начале 2-й недели жизни появляются покраснение, мокнутие кожи, образуются трещины в области пупка, паховых складок, вокруг рта. Яркая эритема быстро распространяется на кожу живота, туловища, конечностей, где впоследствии появляются вялые пузыри, трещины, слущивается эпидермис и остаются обширные эрозии. Общее состояние больных тяжелое. Через 1-2 нед от начала заболевания вся кожа новорожденного становится ги перемиро ванной, на больших участках образуются эрозии вследствие скопления экссудата под эпидермисом. Затем эпидермис отслаивается, присоединяются симптомы обезвоживания организма. При благоприятном исходе заболевания эрозивные поверхности эпителизируются без образования рубцов или пигментации.
Псевдофурункулез Фигнера может начинаться так же, как и везикулопустулез, с последующим распространением воспаления на всю потовую железу. Характеризуется появлением подкожных узлов до 1 – 1,5 см в диаметре багрово-красного цвета, в центре которых в дальнейшем появляется гнойное содержимое. Наиболее частая локализация – кожа волосистой части головы, задней поверхности шеи, спины, ягодиц, конечностей.
Мастит новорожденных обычно развивается на фоне физиологического нагрубания молочных желез. Клинически проявляется увеличением и инфильтрацией одной молочной железы, гиперемия кожи над железой может появляться несколько позже, однако без лечения усиливается; возникает флюктуация. Пальпация болезненна, из выводных протоков железы спонтанно или при пальпации выделяется гнойное содержимое.
Одним из наиболее тяжелых гнойно-воспалительных заболеваний новорожденных является некротическая флегмона, которая начинается с появления на коже плотного на ощупь красного пятна. Очаг поражения быстро распространяется, при этом гнойное расплавление подкожной клетчатки опережает скорость изменения кожи за счет богатой сети лимфатических сосудов и широких лимфатических щелей. В альтеративно-некротической стадии через 1-2 дня пораженные участки кожи приобретают багрово-си-нюшный оттенок, в центре отмечается размягчение. В стадии отторжения происходит омертвение отслоенной кожи, после ее удаления возникают раневые поверхности с подрытыми краями и гнойными карманами. В стадии репарации происходят развитие грануляций и эпителизация раневой поверхности с последующим образованием рубцов.
Среди стрептодермий наиболее часто встречаются рожистое воспаление (появление очага локальной гиперемии неправильной формы с фестончатыми краями, инфильтрация кожи и подкожной клетчатки, отграничительный валик отсутствует, измененная кожа теплая на ощупь, поражение быстро распространяется на другие участки кожи) и интертригинозная стрептодермия (резко отграниченная гиперемия за ушами и в естественных складках с трещинами, фликтенами, сменяющимися впоследствии отрубевидным шелушением).
Лечение заключается в удалении гнойничков стерильным материалом, смоченным в 70 % растворе спирта, местной обработке 1-2% спиртовыми растворами анилиновых красителей, применением гигиенических ванн с дезинфицирующими средствами (раствор калия перманганата 1:10.000), целесообразно проведение УФО. При ухудшении общего состояния ребенка, наличии инфекционного токсикоза показана антибактериальная терапия, при возникновении инфильтрации и флюктуации – консультация детского хирурга.
Среди заболеваний слизистых оболочек у новорожденных чаще всего наблюдаются конъюнктивиты. При конъюнктивитах, как правило, отмечаются двустороннее поражение с гнойным отделяемым, отек и гиперемия конъюнктивы и век. Лечение определяется типом возбудителя инфекционного процесса (стафилококки, хламидии, гонококки и др.).
Особо следует выделить инфекционные заболевания пупочной ранки. Катаральный омфалит характеризуется наличием серозного отделяемого из пупочной ранки и замедлением сроков ее эпителизации. Возможны легкая гиперемия и незначительная инфильтрация пупочного кольца. При этом состояние новорожденного ребенка обычно не нарушено, изменений в анализе крови нет, пупочные сосуды не пальпируются. Лечение местное: обработка пупочной ранки 3-4 раза в сутки 3 % раствором перекиси водорода, затем 70 % раствором этилового спирта и раствором калия перманганата, а также УФО на область пупочной ранки.
При гнойном омфалите заболевание начинается обычно к концу 1-й недели жизни с катаральных изменений в области пупочной ранки, затем появляются гнойное отделяемое из пупочной ранки, отек и гиперемия пупочного кольца, инфильтрация подкожной клетчатки вокруг пупка, а также симптомы инфекционного поражения пупочных сосудов. При тромбофлебите пупочной вены пальпируется эластичный тяж над пупком. В случае громбартериита пупочные артерии пальпируются ниже пупочного кольца, при этом на дне пупочной ранки может появляться гнойное отделяемое. Помимо местной обработки, обязательно проведение антибактериальной терапии.
Наличие инфекционного очага любой локализации обусловливает необходимость исключить у данного ребенка сепсис, при этом тактика лечения новорожденного с локализованным гнойно-воспалительным заболеванием должна быть комплексной.
Сепсис является наиболее тяжелым инфекционно-воспалительным заболеванием детей в период новорожденности Частое развитие септического процесса у новорожденных связано с анатомо-физиологическими особенностями организма, незрелостью систем и органов, в первую очередь ЦНС, особенностями гуморального и клеточного звеньев иммунитета.
Инфицирование новорожденного может произойти в анте-, интранатальном или раннем неонатальном периодах. В зависимости от срока инфицирования различают внутриутробный и постнатальный сепсис. Одним из факторов, способствующих развитию сепсиса у новорожденных, является проведение реанимационных мероприятий при рождении ребенка и в первые дни жизни. Недоношенность и незрелость представляют собой благоприятный фон для развития септического процесса.
При сепсисе у новорожденных детей входными воротами инфекции чаще всего являются пупочная ранка, кожный покров и слизистые оболочки, травмированные в месте инъекций, катетеризации, интубаций и т.д., кишечник, легкие, реже мочевыводящие пути, среднее ухо, глаза. При невозможности установить входные ворота инфекции диагностируют криптоге нный сепсис.
По клинической картине сепсис новорожденных иногда бывает трудно дифференцировать от патологических состояний не инфекционной природы. Отмечается нестабильность температуры тела (гипоили гипертермия). Дополнительными признаками могут быть вялое сосание или отсутствие сосательного рефлекса, срыгивания и рвота, учащение и разжижение стула, вздутие живота, апноэ, респираторный дистресс-синдром (признаки дыхательной недостаточности), периоральный и периорбитальный цианоз, гепатоспленомегалия (увеличение печени и селезенки), желтуха, мраморность кожи, вялость, гипотония, судороги. Выбухание, напряженность переднего (большого) родничка и ригидность затылочных мышц у новорожденных детей не являются надежными признаками (обязательными симптомами) менингита. Наиболее тяжелая форма – молниеносный сепсис (септический шок). Для недоношенных детей более типично подострое (затяжное) течение сепсиса.
При подозрении на сепсис необходимо: 1. провести микробиологические исследования с посевом на стерильность и окраской по Граму крови, спинномозговой жидкости, мочи, отделяемого из трахеи и инфекционных очагов. Положительные результаты посева крови на инфекцию у ребенка, с клиническими проявлениями гной но-воспалительного заболевания, инфекционного токсикоза, а также характерные изменения лабораторных показателей и изменений, выявленных при инструментальных исследованиях, позволяют врачу подтвердить диагноз сепсиса; 2. провести исследование спинномозговой жидкости: окраскапо Граму, определение количества клеток, содержания белка, глюкозы. Жидкость может быть мутной в результате пролиферации бактериальных клеток в отсутствие плеоцитоза. Отсутствие каких-либо патологических изменений в спинномозговой жидкости при первой люмбальной пункции встречается менее чем у 1 % новорожденных с менингитом. Низкий уровень глюкозы и повышение количества полиморфно-ядерных лейкоцитов возможно при внутри желудочковом кровоизлиянии. Для подтверждения вентрикулита у детей с гидроцефалией может потребоваться пункция желудочков мозга; 3. провести исследование аспирата из трахеи. Наличие лейкоцитов и бактерий в аспирате из трахеи в первые часы жизни позволяет предположить внутриутробное инфицирование; 4. определить количество лейкоцитов и тромбоцитов периферической крови, лейкоцитарную формулу. Отсутствие изменений этих показателей не исключает полностью диагноз сепсиса. Лейкопения и нейтропения (увеличение доли юных форм) с соотношением незрелых форм и общего числа нейтрофилов более 0,2 позволяет предположить сепсис, но может встречаться и у недоношенных новорожденных из группы высокого риска (подвергшихся тяжелому родовому стрессу). Тромбоцитопения может встречаться при сепсисе как в случае раз! вития ДВС-синдрома, так и без него. Скорость оседания эритроцитов при сепсисе может увеличиваться более 15 мм/ч, однако этот признак не является обязательным; 5. провести рентгенографию грудной клетки. Рентгенологическая картина при пневмонии может быть сходной с таковой при болезни гиалиновых мембран; 6. исследовать мочу: микроскопия и посев с определением чувствительности обнаруженной микрофлоры к антибиотикам; 7. выполнить лимулюс-лизат-тест, который позволяет верифицировать наличие эндотоксинемии при сепсисе, вызванном грамотрицательной условно-патогенной флорой, особенно при госпитальных инфекциях, развившихся после первой недели жизни.
Тактика лечения новорожденного с сепсисом заключается в организации оптимального ухода и кормления, назначении рациональной антибактериальной терапии (стартовая схема предполагает использование цефалоспоринов второго поколения в сочетании с аминогликозидами в возрастных дозировках, далее смена антибиотиков проводится в соответствии с результатами микробиологических исследований и с учетом чувствительности выделенных микроорганизмов к антибиотикам; при менингите необходимо учитывать способность антибиотиков проникать через гематоэнцефалический барьер); проведении необходимой посиндромной терапии – коррекция имеющихся синдромов дыхательной, сердечно-сосудистой, почечной, надпочечниковой, печеночной недостаточности, гематологических нарушений (наиболее часто ДВС-синдром, анемия, тромбоцитопения), неврологических синдромов; проведении адекватной гидратационной терапии с целью дезинтоксикации, частичного или полного парентерального питания, при необходимости восполнения объема циркулирующей крови, коррекции микроциркуляторных и метаболических нарушений. С целью иммунокоррекции наиболее показаны переливание свежезамороженной плазмы (при идентификации возбудителя – гипериммунной), лейкоцитной массы. Необходимы также поддержание и коррекция нормального биоценоза кишечника на фоне и после проводимой антибактериальной терапии (назначают бифидумили лактобактерии по 5 доз 2-3 раза в день, а также используют поливалентный пиобактериофаг или моновалентные бактериофаги – стрептококковый, стафилококковый, синегнойный, клебсиеллезный, коли-протейный и т.д.).
Гемолитическая болезнь новорожденных
Гемолитическая болезнь развивается вследствие изоиммунизации, вызванной несовместимостью крови матери и плода. В 80-85 % случаев причиной болезни является изо иммунизация по резус-фактору, в 20-15 % – по системе АВО.
Выделяют анемическую, желтушную и отечную формы болезни.
Анемическая форма с первых часов жизни проявляется бледностью кожного покрова, гиподинамией, увеличением печени и селезенки. В крови снижен уровень гемоглобина.
Желтушная форма клинически характеризуется ранним появлением желтухи, увеличением размеров печени и селезенки. Как правило, желтушная форма сопровождается анемией.
Наиболее тяжелой формой болезни, часто заканчивающейся внутриутробной гибелью плода, является отечная форма. Наблюдается общий отек, практически все полости (брюшная, плевральная) заполнены жидкостью, печень и селезенка больших размеров. Желтуха выражена незначительно вследствие наличия большого количества жидкости в организме.
Гемолитическая болезнь новорожденных (ГБН) по АВО-системе, как правило, не имеет специфических проявлений на момент рождения ребенка.
При первичном осмотре ребенка от женщины с резус-отрицательной кровью и при групповой несовместимости необходимо уделить особое внимание выявлению клинических признаков эритробластоза.
Непосредственно в родильном зале определяют группу крови ребенка, уровень гемоглобина и билирубина, проводят пробу Кумбса.
На основании лабораторных и клинических данных можно выделить 3 степени тяжести ГБН по резус-фактору: 1. легкая форма (I степень тяжести) характеризуется некоторой бледностью кожи, незначительным снижением концентрации гемоглобина (до 150 г/л) и умеренным повышением уровня билирубина в пуповинной крови (до 85,5 мгмоль/л), легкой пастозностью жировой клетчатки; 2. среднетяжелая форма (II степень тяжести) характеризуется бледностью кожи, снижением уровня гемоглобина (150-110 г/л), повышением содержания билирубина (85,6-136,8 мкмоль/л) в пуповинной крови, пастозностью подкожной клетчатки, увеличением печени и селезенки; 3. тяжелая форма (III степень тяжести) характеризуется резкой бледностью кожи, значительным снижением уровня гемоглобина (менее 110 г/л), значительным повышением содержания билирубина (136,9 мкмоль/л и более) в пуповинной крови, генерализованными отеками.
Билирубиновая энцефалопатия – самое тяжелое осложнение ГБН, связанное с токсическим повреждением нейронов непрямым билирубином.
К факторам, повышающим риск поражения ЦНС новорожденного непрямым билирубином, относятся недоношенность, асфиксия, гипотермия, ацидоз, гипопротеинемия, недостаточность питания.
Клинически выделяют 4 фазы течения билирубиновой энцефалопатии: 1. билирубиновая интоксикация (вялость, гипо-, адинамия, гипо-, арефлексия); 2. признаки ядерной желтухи (спастичность, судороги, "мозговой крик", симптом "заходящего солнца"); 3. мнимое благополучие (со 2-й недели уменьшение спастичности, судорог); 4. формирование клинической картины неврологических осложнений (детский церебральный паралич, атетоз, параличи, парезы, глухота).
Дети с легкой формой ГБН, как правило, рождаются в удовлетворительном состоянии и в проведении реанимационных мероприятий или интенсивной терапии в родильном блоке не нуждаются. За их состоянием должно осуществляться динамическое наблюдение. Таким детям с первых часов жизни следует начать фототерапию. Если масса тела составляет менее 2500 г, целесообразно раннее начало инфузий 10 % раствора глюкозы. У детей с массой тела более 2500 г вопрос о проведении инфузионной терапии решается индивидуально. Лечение таких детей должно осуществляться под постоянным контролем за уровнем гемоглобина, гематокритом в периферической крови, концентрацией билирубина, определение которых в 1-е сутки жизни необходимо производить каждые 12 ч.
Дети со среднетяжелой формой ГБН по резус-фактору могут родиться в состоянии асфиксии. После оказания необходимых реанимационных мероприятий они должны быть переведены в палату интенсивной терапии, где им необходимо срочно наладить адекватную инфузию 10% раствора глюкозы и фототерапию. Лечение таких детей проводится под контролем за уровнями гемоглобина, гематокрита в периферической крови, концентрацией билирубина (каждые 6 ч в 1-е сутки). При неэффективности консервативной терапии необходимо провести заменное переливание крови, исходя из расчета замены 2 объемов циркулирующей крови – ОЦК (160-180 мл/кг).
Детям с тяжелой формой ГБН, как правило, требуется проведение реанимационных мероприятий в родильном зале. После завершения первичной реанимации необходимо стабилизировать гемодинамику, выполнить катетеризацию пупочной вены и провести частичное заменное переливание крови. Для коррекции тяжелой анемии при отечно-анемической форме ГБН в родильном блоке проводится частичная замена крови ребенка на резусотрицательную донорскую эритроцитную массу (без введения плазмы) 0(1) группы из расчета 60 – 70 мл/кг. Критерием эффективности операции в данном случае служит повышение уровня гемоглобина в крови до 120-140 г/л или гематокрита до 40-45 %. К этой манипуляции необходимо подготовиться еще до рождения ребенка, для чего требуется заказать 200 мл эритроцитной массы от донора с 0(1) группой резус-отрицательной крови. Операция может выполняться либо непосредственно в родильном зале, либо в палате интенсивной терапии. По окончании операции ребенку должна быть налажена инфузия свежезамороженной плазмы из расчета 10-15 мл/кг и 10 % раствора глюкозы, с постоянной скоростью. В зависимости от выраженности симптомов дыхательной и сердечно-сосудистой недостаточности следует проводить адекватную посиндромную терапию. Операция заменного переливания крови с целью уменьшения гипербилирубинемии из расчета 2 ОЦК проводится только после стабилизации общего состояния ребенка (обычно не ранее чем через 10-12 ч после окончания частичного заменного переливания крови).
Детям с ГБН по AB0 и редким факторам крови требуются такой же уход и лечение, как и детям с ГБН по резус-фактору.
Показания к операции заменного переливания крови (ЗПК): 1. безусловным показанием к экстренному (в первые 2 ч жизни) проведению операции ЗПК является тяжелая форма ГБН (в этом случае используется техника частичного ЗПК); 2. показаниями к раннему проведению операции ЗПК (в первые 24 ч) являются следующие: • уровень общего билирубина в пуловинной крови выше 77,5 мкмоль/л ; • уровень гемоглобина пуловинной крови ниже ПО г/л (гематокрит ниже 35%); Важно отметить, что показатель содержания билирубина в пуловинной крови на практике является недостаточно надежным критерием. Поэтому при решении вопроса о проведении ЗПК необходимо сопоставлять данный показатель с другими данными. • почасовой прирост билирубина выше 8,5 мкмоль/л – быстро прогрессирующая анемия (падение уровня гемоглобина крови ниже 120 г/л в первые сутки жизни, даже при относительно невысоком приросте уровня билирубина). При этом используется техника ЗПК с замещением 2 ОЦК; 3. только в отсутствие необходимых условий для эффективного проведения комплексной консервативной терапии или при недостаточности лабораторного контроля могут быть использованы расширенные показания к раннему проведению операции ЗПК: • уровень общего билирубина пуповинной крови выше 68 мкмоль/л; • уровень гемоглобина в пуповинной крови ниже 140 г/л (гематокрит ниже 45 % ) ; • появление желтухи у ребенка в первые 6 ч; • почасовой прирост уровня билирубина выше 6,8 мкмоль/л. При этом также используется техника ЗПК с замещением 2 ОЦК; 4. в отсутствие показаний к проведению ЗПК в первые сутки жизни основаниями для проведения этой операции в более позднем возрасте служат увеличение концентрации общего билирубина в сыворотке крови более 256 мкмоль/л на 2-е сутки жизни и более 340 мкмоль/л у доношенных и более 256-340 мкмоль/л у недоношенных в последующие сутки жизни. Кроме того, клинические признаки билирубиновой интоксикации служат показанием к проведению ЗПК при любом уровне общего билирубина. При этом используется техника ЗПК с замещением 2 ОЦК.
Выбор препаратов крови и особенности их использования при ЗПК: 1. для заменного переливания крови при резус-конфликтах используется одногруппная резус-отрицательная кровь или одногруппная резус-отрицательная эритроцитная масса с одногруппной плазмой в соотношении 2:1; 2. при несовместимости по групповым факторам необходимо переливание эритроцитной массы 0(1) группы соответственно резус-принадлежности ребенка и плазмы одногруппной или AB(IV) группы в соотношении 2:1; 3. при несовместимости и по резус-фактору, и по группе крови необходимо переливать эритроцитную массу 0(1) группы резус-отрицательную и плазму AB(IV) группы в соотношении 2:1; 4. при несовместимости крови матери и крови плода по редким факторам ребенку необходимо переливать кровь от индивидуально подобранного донора; 5. для наиболее эффективного снижения билирубинемии необходимо провести ЗПК в объеме: 160-170 мл/кг • масса тела, кг – для доношенного ребенка и 170-180 мл/кг • масса тела, кг – для недоношенного ребенка; 6. при использовании эритроцитной массы и плазмы эритроцитная масса заказывается в объеме, составляющем 2/з расчетного количества, Уз объема должна составлять плазма.
Техника операции ЗПК: 1. Операцию ЗПК выполняет врач при помощи одного ассистента {можно из среднего медицинского персонала). Оператор и ассистент перед началом ЗПК проводят предоперационную обработку рук по общепринятым методам, надевают стерильные халаты и перчатки. 2. Заменное переливание крови проводится через стерильный полиэтиленовый катетер (номера 6,8,10 в зависимости от диаметра вены), введенный (после отсечения верхней части пуповинного остатка) в вену пуповины на глубину, равную расстоянию от пупочного кольца до мечевидного отростка плюс 1 см, вверх по направлению к печени. 3. До начала процедуры необходимо промыть катетер слабым раствором гепарина: не более 5-10 ЕД в 1 мл, т.е. 0,1 мл стандартного раствора (5000 ЕД в 1 мл) должен быть разведен в 50-100 мл стерильного изотонического раствора натрия хлорида. 4. В вену пуповины катетер вводится заполненным изотоническим раствором натрия хлорида или слабым раствором гепарина, так как во время крика ребенка может возникнуть отрицательное давление в вене, и из незаполненного катетера в нее может попасть воздух. 5. Первые порции крови, полученные из катетера, собирают в несколько пробирок: для определения группы крови, уровня билирубина и совместимости (на все не более 5-10 мл крови ребенка). 6. Дробными порциями по 10-20 мл (используя шприц соответствующего объема) медленно выводят кровь ребенка и замещают ее кровью или эритроцитной массой донора в том же количестве. В последнем случае на каждые 2 объема введенной эритроцитной массы вводят один объем плазмы. 7. Ассистент должен строго следить за соответствием объема введенной и выведенной крови и последовательностью введения эритроцитной массы и плазмы. 8. После введения каждых 100 мл крови (цельной или ее компонентов) для профилактики гипокальциемии необходимо добавление 2 мл 10 % раствора кальция глюконата или 2 мл 10 % раствора кальция хлорида, разведенных 2 мл 10 % раствора глюкозы. 9. После замены двух ОЦК операция может быть закончена. Средняя продолжительность операции составляет 1,5-2,5 ч. Более быстрое и более медленное проведение операции может отрицательно сказываться на общем состоянии ребенка. 10. Перед окончанием операции необходимо повторно собрать кровь в пробирку для определения уровня билирубина, В итоге операции (с учетом крови, взятой на исследование) суммарный объем выведенной крови должен быть равен или на 10-20 мл быть меньше, чем суммарный объем введенной крови и ее компонентов. 11. Операцию заканчивают внутривенным введением антибиотика широкого спектра действия (вводится половина суточной дозы). Катетер удаляют. 12. Об эффективности проведенной операции ЗПК свидетельствует разное содержание билирубина в первой и последней порциях крови, взятых для анализа (более чем в 2 раза).
При назначении лечения детям с ГБН, перенесшим операцию ЗПК, необходимо учитывать, что такие дети включены в группу риска развития гипогликемии, гипокальциемии, гиперкалиемии, метаболического ацидоза, бактериальной инфекции, гемодинамических расстройств.
Динамический контроль за основными клиническими симптомами, лабораторными показателями в период пребывания ребенка в детском отделении родильного дома позволит определить необходимость продолжения комплексной терапии и ее объем.
Синдром дыхательных расстройств
Синдром дыхательных расстройств (СДР) – патологическое состояние, возникающее у новорожденных в первые часы после рождения вследствие резкого снижения синтеза сурфактанта и незрелости структуры легочной ткани.
Сочетание таких факторов, как недоношенность, внугриутробная инфекция, перинатальная гипоксия и асфиксия, определяют не только причину, но и степень тяжести клинических проявлений СДР.
Дефицит сурфактанта – поверхностно-активного вещества, синтезируемого альвеолоцитами II типа, приводит к спадению альвеол на выдохе, в результате чего резко снижается площадь газообмена в легких и как следствие развиваются гипоксемия и гиперкапния.
Созревание системы сурфактанта завершается к 35-36-й неделе внутриутробного развития плода и стимулируется глюкокортикоидами, тиреоидными гормонами, эстрогенами, адреналином и норадреналином.
Клинические признаки СДР появляются в первые 4 – 6 ч после рождения и характеризуются одышкой – более 60 дыхательных движений в 1 мин (причем, чем тяжелее форма заболевания, тем раньше выявляется этот симптом).
Как правило, учащенное дыхание сопровождается экспираторными шумами (так называемый хрюкающий выдох).
При осмотре больного новорожденного выявляется западение грудной клетки на вдохе, отмечается втягивание мечевидного отростка грудины, межреберий, надключичных ямок.
Обращают на себя внимание напряжение крыльев носа, приступы апноэ. Если при появлении первых признаков СДР кожные покровы, как правило, розовые, то с нарастанием клинических проявлений появляются цианоз, акроцианоз, общая бледность кожи.
Аускультативно выявляется ослабленное дыхание. По мере развития болезни на вдохе и выдохе выслушиваются сухие и крепитирующие хрипы.
Все перечисленные симптомы составляют шкалу Сильвермана, которая используется для оценки тяжести дыхательных расстройств у новорожденных: 1. до 4 баллов – начинающийся СДР; 2. 5 баллов – СДР средней тяжести; 3. 6-9 баллов – тяжелый СДР; 4. 10 баллов – крайне тяжелый СДР. 5. При СДР изменяется общее состояние детей: они становятся вялыми, гипоили адинамичными, не сосут, срыгивают, не удерживают тепло, первоначальная потеря массы тела превышает физиологическую норму.
У детей, перенесших СДР и получавших интенсивную терапию в условиях отделения реанимации, нередко выявляются осложнения: сепсис, ДВСсиндром, бронхолегочная дисплазия, кровоизлияния в легкие, внутрижелудочковые кровоизлияния.
Особое значение принадлежит пренатальной диагностике СДР, для чего разработаны тесты определения фосфолипидного состава околоплодных вод.
Если соотношение уровня лецитина и сфингомиелина составляет 2:1, то вероятность развития СДР практически равна 0 %, при 2:1,5 – 50% и 1:1 75 %.
Для прогнозирования развития СДР проводят "пенный" тест: к 0,5 мл желудочного содержимого новорожденного в первые минуты, часы жизни добавляют 0,5 мл 96 % спирта. Пробирку встряхивают в течение 15 с, через 15 мин оценивают результат теста. При наличии одиночного или двойного кольца пузырьков ( + + + или + + + +) тест считается положительным, в отсутствие пузырьков тест отрицательный; при наличии мелких пузырьков, заполняющих Уз окружности или менее (соответственно ++ или +), – тест слабоположительный.
В случае положительного теста вероятность развития СДР чрезвычайно мала, при слабоположительном результате вероятность развития СДР – 20 % и при отрицательном – 60 % и более.
При развитии СДР требуется проведение мониторинга основных параметров, позволяющих контролировать деятельность сердца, дыхательной системы: число сердечных сокращений, дыхательных движений, показателей РаО2, РаСО2, КОС крови, артериальное давление, ЭКГ, биохимические параметры (уровень глюкозы, мочевины, калия, натрия, кальция, магния и др.).
С момента появления первых симптомов СДР ребенку начинают проводить оксигенотерапию, цель которой – обеспечение адекватного снабжения тканей кислородом при минимальном риске его токсического действия. Токсическое действие кислорода проявляется при гипероксемии (около 150 торр в артериальной крови) повышенной проницаемостью сосудов головного мозга и ретинопатии.
Ингаляции кислорода новорожденному можно проводить в кувезе или с помощью палаток, масок и носовых катетеров. При этом необходим строгий контроль за концентрацией кислорода, температурой и влажностью дыхательной смеси.
Оксигенотерапию у новорожденных нельзя проводить без контроля газового состава крови. Никакой клинический опыт не может заменить данных объективных исследований. При невозможности определения газов в артериальной крови необходимы мониторный контроль за уровнем РО2 и поддержание его в пределах 60-90 мм рт.ст. Снижение насыщения (Sa) на 1-2 % отражает уменьшение Рао на 6-12 %. Принято считать, что падение Sa0j ниже 90 % отражает развитие тяжелой гипоксемии (Ра0 40 мм рт.ст.), а подъем Sap выше 98 % указывает на опасный уровень гипероксемии. Поэтому при лечении новорожденных обычно стараются поддерживать SaО2 на уровне 92-96 %.
При неэффективности оксигенотерапии требуются интубация трахеи и проведение искусственной вентиляции легких.
Обеспечение адекватного поступления кислорода, так же как и все другие мероприятия проводимой комплексной терапии, должно осуществляться в оптимальных условиях окружающей среды. Прежде всего это температурный режим в кувезе 34-35 °С. Постоянный (1 раз в 2 ч) контроль за температурой тела ребенка позволяет проводить необходимую коррекцию температурного режима.
В комплекс терапевтических мероприятий входит гидратационная терапия, которая проводится в первые сутки в объеме 50-60 мл/кг массы тела с последующим увеличением до 140-150 мл/кг массы к 7-м суткам под строгим контролем диуреза.
Сроки начала энтерального питания определяются в зависимости от состояния ребенка.
В каждом конкретном случае решается вопрос об использовании свежезамороженной плазмы, 10 % раствора альбумина (препаратов для коррекции гиповолемии).
При низком артериальном давлении капельно вводится допамин в дозе 5 мкг/кг/мин.
Результаты посевов крови, содержимого трахеи, желудка на стерильность, общего анализа крови позволяют решить вопрос о необходимости антибактериальной терапии.
Последнее десятилетие ознаменовалось широким внедрением пренатальной профилактики СДР путем назначения беременным глюкокортикоидных препаратов (см. Невынашивание беременности).
В 1-е сутки после рождения для профилактики СДР и лечения используют препараты сурфактанта, наиболее известными из которых являются экзосурф (Англия) и куросурф (Италия). Они вводятся из расчета 5 мл/кг эндотрахеально капельно от 1 до 3 раз с интервалом 8-12 ч.
Уход за новорожденным
В основе ухода за новорожденным в постнатальном периоде лежат создание оптимально комфортных условий окружающей среды и обеспечение физиологических потребностей в основных ингредиентах – белках, липидах, углеводах, витаминах, а также в жидкости.Температура воздуха в родильном блоке должна составлять 24 – 26 °С, в палате же новорожденных – не ниже 22 °С.
Ежедневно утром перед первым кормлением ребенка взвешивают, измеряют температуру тела и полученные данные вносят в карту развития ребенка.
Ежедневный туалет новорожденного включает в себя обработку глаз, подмывание, обработку остатка пуповины или пупочной ранки.
Глаза обрабатывают стерильными ватными шариками, смоченными раствором калия перманганата (1:8000) от наружного угла глаза к переносице.
При ежедневном осмотре новорожденного особое внимание обращают на состояние кожного покрова, пуповинного остатка, пупочной ранки.
Культю пуповины обрабатывают 70 % этиловым спиртом, а затем 5 % раствором калия перманганата. Этиловый спирт можно заменить 3 % раствором перекиси водорода. Пупочную ранку необходимо обрабатывать большим количеством 3 % раствора перекиси водорода с обязательным удалением корочки. Затем края и дно ранки обрабатывают 5 % раствором калия перманганата.
При наличии грануляций на дне ранки целесообразно использовать ляписный карандаш с целью их прижигания.
Перед каждым кормлением ребенка подмывают проточной водой температуры 34-35 °С. Здорового новорожденного выписывают из родильного дома на 4 – 5-е сутки жизни после вакцинации БЦЖ.
Глава 27. Послеродовые гйойно-септические заболевания
Послеродовые гнойно-септические заболевания развиваются в 4 – 6 % случаев, этот показатель выше после кесарева сечения.Проблема послеродовых гнойно-воспалительных заболеваний непосредственно связана с инфицированием беременных и внутриутробной инфекцией плода.
В многочисленных источниках литературы указан очень высокий процент инфицирования беременных. Вирусами герпетической группы инфицированы 65-90 % взрослого и детского населения планеты. Около 25-30 % беременных имеют кандидоз и бактериальный вагиноз, II % – хламидиоз и т.д. Следовательно, инфекция у беременных, рожениц, плода и новорожденного носит преимущественно эндогенный характер. Обострение латентного инфекционного процесса обусловлено снижением иммунитета. При-чиной тому служат как сама беременность, так и многочисленные экстрагенитальные заболевания, экологические факторы, осложнения беременности, которые также способствуют активации латентной инфекции и проявлению патогенности эндогенной флоры.
Отрицательное антропогенное влияние на природу и условия жизни человека проявляется снижением иммунитета, изменениями состава нормальной микрофлоры кишечника, влагалища, кожи, преобразованием условно-патогенной микрофлоры в патогенную, возникновением новых видов вирусов (например, ВИЧ).
Значительные изменения в биологических процессах вызывает бесконтрольное применение антибиотиков и антисептиков.
Основными возбудителями гнойно-септических заболеваний у рожениц и родильниц являются анаэробы, энтерококки, стрептококки, стафилококки. Очень часто наблюдается смешанная инфекция. В последнее время все большую роль играют анаэробные неспорообразующие бактерии. Они относятся к группе эндогенных условно-патогенных микроорганизмов.. Анаэробная неклостридиальная инфекция встречается при различных формах перитонита (86%) , при пельвиоперитоните (56%), при тубоовариальных тазовых абсцессах (92 %) , при септическом аборте и эндометрите (73 %).
Классификация. Выделяют локализованные послеродовые гнойносептические заболевания – эндометрит, послеродовую язву, нагноение операционной раны после кесарева сечения, мастит, а также генерализованные формы – акушерский перитонит, сепсис.
Во время родов может наблюдаться хориоамнионит.
Хориоамнионит
Инфекцию амниона, или эндометрит во время родов, в настоящее время называют хориоамнионитом. В последние годы хориоамнионит встречается в 0,78 % случаев. Инфицирование чаще всего происходит при преждевременном разрыве плодных оболочек или во время диагностических манипуляций (амниоскопия или амниоцентез, кордоцентез). По мере удлинения безводного промежутка независимо от причин разрыва оболочек риск развития внутриутробной инфекции возрастает.Некоторые бактерии (стрептококк группы В) склонны внедряться в целостные оболочки, иногда без какого бы то ни было предрасполагающего фактора, особенно при наличии хронической инфекции гениталий или мочевыводящих путей.
Инфицированность околоплодных вод и оболочек плода определяется чаще, чем развиваются клинические проявления хориоамнионита у беременной или роженицы, но при этом может быть выявлена внутриутробная инфекция у плода.
Возбудителями хориоамнионита могут быть анаэробы (27,3 %) , энтерококки (18,2%), стрептококки (22%) и стафилококки (11,7%); нередко – сочетание возбудителей.
Клиническая картина и диагностика.
При внутриматочной инфекции у беременной или роженицы нередко на фоне относительно длительного безводного периода отмечаются ухудшение общего состояния, повышение температуры тела, озноб, тахикардия, гноевидные выделения из половых путей. В периферической крови нарастает лейкоцитоз. Развивается тахикардия у плода. У некоторых рожениц при пальпации определяется болезненность матки.
С момента установления диагноза хориоамнионита роды следует проводить по методике интенсивного родоразрешения.
Лечение.
Начинают терапию с применения антибиотиков; используют полусинтетические пенициллины в сочетании с метронидазолом. Необходимо назначать антиагрегантные препараты – реополиглюкин, трентал или компламин. Следует самым тщательным образом следить за динамикой артериального давления и диуреза.
С целью ускорения родоразрешения внутривенно вводят окситоцин. За 30-40 мин до введения окситоцина назначают промедол с димедролом и дипразином. Премедикация рассчитана на предупреждение внутриматочной эмболии. Второй период родов не должен быть длительным; если он превышает 1'/2 2 ч, следует применить акушерские щипцы или вакуумэкстракцию. При упорной слабости родовой деятельности можно произвести кесарево сечение (лучше экстраперитонеальное). При пропитывании матки зловонными околоплодными водами, если мышца имеет вид "вареного мяса", производят экстирпацию матки.
Во время родов или операции необходимо следить за показателями гемодинамики, функцией почек, бактериологическим анализом выделений, исследовать урои гемокультуры. Особое внимание следует обратить на состояние системы гемостаза; выявление признаков подострого ДВС-синдрома служит показанием к использованию (наряду с антиагрегантами) гепарина. При тенденции к артериальной гипотензии необходимо назначить преднизолон.
После родов или операции интенсивную терапию продолжают до стойкой нормализации температуры тела и улучшения состояния больной.
В раннем послеродовом периоде возможно акушерское кровотечение гипотонического или коагулопатического характера. Чаще кровотечение имеет смешанный генез; на фоне подострого ДВС-синдрома развивается гипотония матки. К такому кровотечению у больных с хориоамнионитом следует подготовиться. Необходимо иметь запас сухой или лучше свежезамороженной плазмы, донорской крови и эритроцитной массы.
Послеродовая язва
При послеродовой язве (гнойно-воспалительный процесс в области промежности, вульвы, влагалища, шейки матки) в отличие от послеродового эндометрита вероятность генерализации процесса значительно меньше, но не исключена. Больных с послеродовой язвой, которые являются источником заражения для здоровых родильниц, необходимо изолировать, т.е. перевести в обсервационное акушерское отделение.Лечение.
Антибактериальная и инфузионная терапия при послеродовой язве показана в случае развития интоксикации и лихорадки.
Послеродовой эндометрит
Послеродовой эндометрит чаще протекает в легкой форме и заканчивается выздоровлением. Однако у каждой 4-й родильницы он имеет тяжелое течение, при этом наблюдается гнойно-резорбтивная лихорадка; кроме того, существует реальная угроза генерализации инфекции.Клиническая картина и диагностика.
Для легкой формы заболевания характерны относительно позднее начало (на 5-12,-е сутки послеродового периода), повышение температуры тела до 38-38,5 °С, 9умеренно увеличенная СОЭ (30-35 мм/ч), лейкоцитоз в пределах 9-1210 /-", незначительный нейтрофильный сдвиг лейкоцитарной формулы крови. Общее самочувствие больных существенно не меняется, сон и аппетит остаются хорошими, головных болей нет. Матка несколько увеличена, лохии длительное время остаются кровяными. Содержание общего белка крови, остаточного азота не изменяется. Для установления степени тяжести состояния больной необходимо непрерывное наблюдение за дыханием, гемодинамикой, мочеотделением, динамикой лабораторных данных на фоне комплексного лечения в течение 24 ч. При легкой форме заболевания состояние больной на фоне терапии за сутки улучшается.
Тяжелый эндометрит начинается на 2-3-й сутки после родов. Определяется болезненность матки, лохии становятся гнойными, с ихорозным запахом, температура тела 38-39 °С, отмечаются тахикардия, озноб, слабость. Возможна "стертая" картина эндометрита, при которой на фоне невыраженных клинических проявлений происходят тяжелые морфологические изменения и как бы внезапное ухудшение состояния больной.
Гемограмма при тяжелом эндометрите изменена: снижен уровень гемоглобина, отмечается лейкоцитоз или лейкопения, увеличено число палочкоядерных лейкоцитов.
Эндометрит после кесарева сечения чаще протекает в тяжелой форме. Больную беспокоят головная боль, слабость, нарушение сна, аппетита, боли внизу живота. Характерны тахикардия (более ПО уд/мин), повышение температуры тела, нередко сопровождающееся ознобом. Количество лейкоцитов колеблется от 14-10 /л до 3010 /л, у всех больных отмечается нейтрофильный сдвиг формулы крови. Анемия развивается у каждой 3-й больной. Инволюция матки замедлена.
Для диагностики послеродового эндометрита важное значение имеет применение современных высокоинформативных методов исследования: трансвагинального ультразвукового сканирования и гистероскопии. Использование трансвагинальной эхографии у родильниц позволяет с высокой степенью точности оценить состояние полости матки, миометрия, динамику обратного развития матки и тем самым своевременно диагностировать воспалительный процесс, а также обосновать показания к применению инвазивного метода диагностики – гистероскопии.
Наиболее достоверными акустическими критериями эндометрита являются увеличение объема матки и ее переднезаднего размера. Различия в динамике инволюции матки у родильниц с неосложненным течением пуэрперия и послеродовым эндометритом наблюдаются с момента манифестации клинических признаков. Объем матки у родильниц с эндометритом в течение 3-5 сут уменьшается лишь на 11,7 % (в норме 19,2 %) , 3-7 сут – на 22,9 % (в норме 33,4 % ) , 3-9 сут на 35,5 % (в норме 46,2 % ).
Для диагностики патологических процессов в полости матки в послеродовом периоде (гематои лохиометра, задержка в матке фрагментов последа, на фоне которых формируется воспалительная реакция) важное значение имеет изучение акустического отражения от стенок полости матки. Наряду с расширением переднезаднего размера полости матки у родильниц с пуэрперальным эндометритом в ней определяются разреженные эхоструктуры без четких контуров, неправильной формы и с пониженным уровнем звукопроводимости.
Гистероскопическая картина послеродового эндометрита варьирует в широких пределах в зависимости от метода родоразрешения. Как правило, на стенках матки определяются рыхлые фибринозные отложения; слизистая оболочка отечная, цианотичная, с обилием инъецированных, легко кровоточащих сосудов. У родильниц с длительно текущей тяжелой формой эндометрита к 9-10-м суткам пуэрперия на стенках полости матки идентифицируют плотный гладкий фибринозный налет с примесью гноя от грязнобелого до желтовато-зеленого тонов. При этом отсутствуют какие-либо внутриполостные включения.
При эндометрите после кесарева сечения патологические включения в полости матки и ее расширения отмечаются реже, чем после родов через естественные родовые пути. Гистероскопическая картина характеризуется появлением гладкого фибринозного налета с большим количеством гноя и очагами кровоизлияний в слизистую оболочку. При этом наиболее выраженные воспалительные изменения локализуются в области послеопераци-онной раны. У 10,5 % больных с эндометритом после кесарева сечения во время гистероскопии может определяться частичное расхождение шва: в проекции нижнего сегмента матки – большое количество прорезавшихся лигатур со значительными фибринозными и гнойными наложениями. Подобная картина существенно осложняет визуализацию краев послеоперационной раны. Однако после санации полости матки холодными растворами антисептиков удается достаточно четко определить углубление неправильной формы и без четких контуров "нишу", в которой края раны отличаются выраженной воспалительной трансформацией: багрово-синюшная слизистая оболочка, вялые грануляции с фибринозным и гнойным налетом, резко инъецированные сосуды.
Лечение.
В первую очередь необходимо воздействовать на очаг инфекции – матку. При выявлении значительного количества содержимого в полости матки предпочтительнее произвести вакуум-аспирацию и промывание матки. Аспирацию следует производить под общим обезболиванием.
При незначительном расширении полости матки ограничиваются расширением цервикального канала для создания надежного оттока. Для уменьшения всасывания продуктов распада и токсинов промывают полость матки растворами антисептиков и антибиотиков. В повседневной работе используют принцип раннего назначения антибиотиков широкого спектра действия, как правило, не менее двух антибиотиков в максимальных дозах с учетом чувствительности микрофлоры.
В комбинацию антибиотиков включают оксациллин, метициллин по 4,0 г в сутки; цепорин, кефзол, цефамизин по 4,0 г в сутки; канамицин по 0,5 г 4 раза в сутки; гентамицин по 40 мг 2 раза в сутки.
Наиболее часто используют сочетания цепорин + оксациллин, ампициллин + гентамицин, левомицетин + линкомицин.
Одновременно с антибиотиками назначают сульфаниламидные препараты (10 % раствор этазола натрия по 10 мл 2 раза в сутки внутривенно), препараты нитрофуранового ряда (фурадонин, фуразолидон по 0,4 г 2 раза в сутки), метронидазол по 0,25 г 2 раза в сутки. Для профилактики кандидоза и дисбактериоза в схему лечения включают нистатин по 5 000 000 ЕД 4 раза в сутки, леворин по 250 000 ЕД 4 раза в сутки.
Учитывая ведущую роль анаэробной инфекции или анаэробно-аэробных ассоциаций микроорганизмов, необходимо использовать цефалоспорины (цефотаксим, цефметазон), комбинацию гентамицина с клиндамицином, полусинтетические пенициллины с метронидазолом. Целесообразно применение иммунных препаратов. Гипериммунную антимикробную плазму переливают ежедневно или через день по 250 мл (на курс лечения 4 – 5 доз); антистафилококковый гамма-глобулин или иммуноглобулин вводят внутри-мышечно или внутривенно через день по 5 мл (курс лечения 4-5 доз). Лейкоцитную взвесь здорового донора переливают через день внутривенно по 300-400 мл (2-3 дозы).
Из иммуномодуляторов может быть применен декарис, который назначают по 150 мг через 2 дня в течение 10 дней.
С целью устранения гиповолемии, осуществления детоксикации и коррекции сопутствующих нарушений коллоидно-осмотического состояния проводят многокомпонентную гидратационную терапию. Соотношение между коллоидными и кристаллоидными растворами равно 1:1. Программу •гидратационной терапии составляют следующим образом: 400 мл раствора реополиглюкина, 200 мл плазмы крови (стандартное разведение), 400 мл 10 % раствора глюкозы, 250 мл раствора Рингера. Общий объем инфузии за сутки составляет 1250 мл.
Известно, что гнойно-воспалительные заболевания сопровождаются развитием гиповитаминоза, поэтому в комплексную терапию необходимо включать препараты витаминов С и группы В (Bj, Bg, ВЛ).
Успешное лечение послеродового эндометрита составляет основу профилактики сепсиса и перитонита после кесарева сечения, так как наиболее часто первичным очагом при этих заболеваниях является эндометрит.
Инфекция операционной раны после кесарева сечения
Клиническая картина. При инфицировании операционной раны характерно наличие как местных, так и общих симптомов. У родильниц появляются слабость, озноб, снижение аппетита, болезненность в области операционной раны, температура тела повышается до 38-38,5 °С. Определяются инфильтрация операционной раны, покраснение и болезненность кожных покровов. Увеличивается содержание лейкоцитов, повышается СОЭ.Лечение.
При нагноении тканей операционной раны швы снимают и обеспечивают отток раневого отделяемого, гнойные полости дренируют. Показаны антибиотики, общеукрепляющая, гидратационная терапия, протеолитические ферменты.
Послеродовой мастит
В последние годы частота послеродового мастита несколько уменьшилась. Однако течение заболевания характеризуется большим числом гнойных форм, резистентностью к лечению, обширностью поражения молочных желез, тенденцией к генерализации. При мастите у родильниц часто инфицируются новорожденные.В этиологии мастита ведущее место занимает патогенный стафилококк.
Клиническая картина и диагностика.
Особую роль в возникновении мастита играет так называемый патологический лактостаз, который заключается в задержке отделения молока. Лактостаз сопровождается повышением температуры тела до 38-38,5 °С, равномерным нагрубанием и болезненностью молочных желез. Общее самочувствие родильницы изменяется мало. Эти явления возникают со 2-х по 6-е сутки после родов. В молоке выявляется большое число патогенных стафилококков.
При лактостазе целесообразно применять антибиотики – полусинтетические пенициллины или цефалоспорины; ультрафиолетовое облучение, согревающий компресс на 3-4 ч; временно прекратить кормление грудью и сцеживать молоко молокоотсосом.
После лечения следует повторить бактериологическое исследование молока и решить вопрос о возобновлении грудного кормления. При лактостазе не следует ограничивать прием жидкости, а также использовать мочегонные и слабительные средства.
Лактостаз можно рассматривать как латентную стадию мастита.
Классификация мастита: 1. Серозный (начинающийся). 2. Инфильтративный. 3. Гнойный: • инфильтративно-гнойный: диффузный, узловой; • абсцедирующий: фурункулез ареолы, абсцесс ареолы, абсцесс в толще железы, абсцесс позади железы (ретромаммарный); • флегмонозный, гнойно-некротический; • гангренозный.
Мастит, как правило, начинается остро. Температура тела повышается до 38,5-39 °С, лихорадочное состояние сопровождается ознобом или познабливанием, отмечаются слабость, головные боли. В молочной железе появляются боли, кожа в области поражения гиперемирована, железа несколько увеличивается в объеме. Пальпаторно в толще железы определяются уплотненные участки. Серозная форма мастита при недостаточном или безуспешном лечении в течение 1-3 дней переходит в инфильтративную.
Состояние больной при инфильтративной форме мастита остается прежним: продолжается лихорадка, нарушаются сон, аппетит. Более выражены изменения молочной железы: гиперемия ограничивается одним из ее квадрантов, под измененным участком кожи пальпируется плотный, малоподвижный инфильтрат, иногда отмечается увеличение регионарных подмышечных лимфатических узлов. Переход в гнойную стадию мастита на-блюдается через 5-10 дней. Нередко отмечается более быстрая динамика процесса: нагноение происходит через 4-5 дней.
Стадия нагноения характеризуется более тяжелой клинической картиной: высокой температурой тела (39 °С и выше), повторным ознобом, потерей аппетита, плохим сном, увеличением и болезненностью подмышечных лимфатических узлов.
При флегмонозном мастите возможна генерализация инфекции с переходом в сепсис. Особенно опасно возникновение септического шока, в связи с чем необходимы раннее выявление больных с артериальной гипотензией и проведение профилактики септического шока.
Наряду с типичным течением лактационного мастита в последние годы наблюдаются стертые и атипично протекающие формы заболевания, характеризующиеся относительно легкими клиническими симптомами при выраженных анатомических изменениях. Инфильтративный мастит может протекать с субфебрильной температурой, без озноба. Это затрудняет диагностику и определяет недостаточность терапевтических мероприятий.
Диагностика послеродового мастита не представляет особых трудностей. Заболевание начинается в послеродовом периоде, характерные жалобы и клинические проявления позволяют поставить правильный диагноз. Только в случае атипично протекающего мастита диагноз затруднителен. Из лабораторных методов исследования наиболее информативен клинический анализ крови (лейкоцитоз, нейтрофилез, увеличение СОЭ).
Существенную помощь в диагностике мастита оказывает УЗИ. При серозном мастите с помощью эхографии выявляют затушеванность рисунка альвеолярного дерева и лактостаз. Для начальной инфильтративной стадии мастита характерны участки гомогенной структуры с зоной воспаления вокруг и лактостазом. При УЗИ молочной железы, пораженной гнойным маститом, чаще всего обнаруживают расширенные протоки и альвеолы, окруженные зоной инфильтрации, – "пчелиные соты". УЗИ позволяет легко диагностировать абсцедирующую форму мастита, при этом выявляют полость с неровными краями и перемычками, окруженную зоной инфильтрации.
При мастите грудное вскармливание временно прекращают. При тяжелом мастите в ряде случаев следует прибегать к подавлению, реже – к торможению лактации. Показаниями к подавлению лактации у больных с маститом в случае его тяжелого течения и резистентности к проводимой терапии являются: 1. быстро прогрессирующий процесс – переход серозной стадии в инфильтративную в течение 1-3 дней, несмотря на активное комплексное лечение; 2. гнойный мастит с тенденцией к образованию новых очагов после хирургического вмешательства; 3. вялотекущий, резистентный к терапии гнойный мастит (после оперативного лечения); 4. флегмонозный и гангренозный мастит; 5. мастит при инфекционных заболеваниях других органов и систем. С целью подавления лактации применяют парлодел.
Лечение.
При послеродовом мастите лечение должно быть комплексным, и начинать его следует как можно раньше. Основным компонентом комплексной терапии являются антибиотики.
Широкий антимикробный спектр действия может быть достигнут при использовании сочетания препаратов: метициллина или оксациллина с канамииином, ампициллином или карбенициллином. Широким спектром антибактериального действия обладают комбинированный препарат ампиокс, а также цефалоспорины (цепорин, кефзол). При комбинированной антибиотикотерапии обеспечивается высокий лечебный эффект.
В некоторых случаях среди возбудителей гнойного мастита могут быть анаэробы, в частности бактероиды, которые чувствительны к линкомицину, клиндамицину, эритромицину, рифампицину и левомицетину. Большинство штаммов чувствительно к метронидазолу, некоторые – к бензилпенициллину.
Целесообразно сочетанное применение антибиотиков и поливалентного стафилококкового бактериофага, которые, обладая принципиально различными механизмами действия на микроорганизмы, могут дополнять друг друга, повышая тем самым лечебный эффект. В первые 3-4 дня доза бактериофага составляет 20-60 мл, затем ее снижают. В среднем на курс лечения необходимо 150-300 мл бактериофага.
В комплексном лечении больных с маститом важное место занимают средства, повышающие специфическую иммунную реактивность и неспецифическую защиту организма. Для этого применяют ряд средств. Эффективен антистафилококковый гамма-глобулин по 5 мл (100 ME) через день внутримышечно, на курс – 3-5 инъекций. Применяют антистафилококковую плазму (по 100-200 мл внутривенно), адсорбированный стафилококковый анатоксин (по 1 мл с интервалом 3-4 дня, на курс 3 инъекции). Показаны переливание плазмы по 150-300 мл, введение гамма-глобулина или поли-глобулина по 3 мл внутримышечно через день, на курс 4-6 инъекций.
Гидратационную терапию необходимо проводить всем больным с инфильтративный и гнойным маститом, при серозном – в случае наличия интоксикации. Для гидратационной терапии используют растворы на декстрановой основе: реополиглюкин, реомакродекс, полифер; синтетические коллоидные растворы: гемодез, полидез; белковые препараты: альбумин, аминопептид, гидролизин, аминокровин, желатиноль. Применяют также растворы глюкозы, изотонический раствор натрия хлорида, 4 % раствор кальция хлорида, 4-5 % раствор натрия гидрокарбоната.
Кроме того, используют антигистаминные препараты: супрастин, димедрол, дипразин; анаболические стероидные гормоны: неробол, ретаболил. При резистентных к терапии формах, а также при склонности больной к артериальной гипотензии и септическому шоку показаны глюкокортикоиды. Преднизолон, гидрокортизон назначают одновременно с антибиотиками.
Физические методы лечения следует применять дифференцированно в зависимости от формы мастита. При серозном мастите используют микроволны дециметрового или сантиметрового диапазона, ультразвук, УФ-лучи; при инфильтративном мастите – те же физические факторы, но с увеличением тепловой нагрузки. При гнойном мастите (после хирургического вмешательства) вначале используют электрическое поле УВЧ в слаботепловой дозе, в дальнейшем УФ-лучи в субэритемной, затем – в слабоэритемной дозе.
При серозном и инфильтративном мастите целесообразно применять масляно-мазевые компрессы.
При гнойном мастите показано оперативное лечение. Своевременное и правильное выполнение операции позволяет предупредить распространение процесса на другие участки молочной железы, в значительной степени способствует сохранению железистой ткани и достижению благоприятного косметического результата.
Сепсис. Септический шок
Сепсис
Общепризнанная терминология и классификация сепсиса отсутствуют. В последние годы широкое распространение получили термины "септицемия", "бактериемия", "септические состояния", "гнойно-септическое заболевание", в которые зачастую вкладывают различный смысл и смешивают понятия "инфицированность" и "генерализация инфекции".
Сепсис, как правило, возникает при наличии гнойного очага и развивается в результате истощения антиинфекционного иммунитета.
Акушерский сепсис чаще всего возникает вследствие попадания инфекции в матку в процессе родов или в послеродовом периоде. Определенную роль играет инфицирование остатков плацентарной ткани и сгустков крови. Распространение инфекции возможно гематогенным и лимфогенным путями. Этому способствуют наличие хронических или острых экстрагенитальных воспалительных заболеваний во время беременности и в родах, инфицирование во время родового акта (затяжные роды, длительный безводный промежуток, родовой травматизм, задержка частей последа в матке).
Течение сепсиса зависит не только от реакции макроорганизма, которая в основном определяется свойствами иммунной защиты, но и от характера возбудителя. Преобладание стафилококка привело к более торпидному течению патологического процесса со склонностью к поражению многих внутренних органов, устойчивости к антибактериальной терапии. Сепсис, вызванный грамотрицательной флорой, нередко осложняется инфекционно-токсическим шоком. Факультативные анаэробы и бактероиды как возбудители послеродового сепсиса чаще поражают гепатобилиарную систему, почки, вы-зывают гемолиз. Аденовирусный сепсис отличается блокадой иммунной системы женщины, что ведет к быстрому течению, отсутствию заградительной воспалительной реакции в тканях и поражению внутренних органов. Летальность установить трудно. В среднем она составляет около 15-30 %.
Диагноз основывается на трех признаках: наличии первичного гнойного очага, высокой лихорадки, обнаружении возбудителя в крови. Последний признак не обязателен, в то время как наличие первичного гнойного очага всегда должно приниматься во внимание при обосновании диагноза. Диагноз подтверждается выявлением признаков полиорганной недостаточности.
Сепсис после родов и аборта клинически проявляется септицемией или септикопиемией.
Септицемией называют наличие в кровеносном русле и во всем организме бактерий и их токсинов, которые в течение длительного времени периодически (волнообразно) поступают в общий ток крови либо из раны, либо из нарушенных зон микроциркуляции, где резко замедлен кровоток.
Клиническая картина и диагностика.
Клиническая картина проявляется как типичная и нетипичная формы. При типичной форме наблюдаются высокая температура тела (до 40-41 °С), повторные ознобы, быстро нарастающая интоксикация, вызывающая нарушения сознания: вначале наблюдается заторможенность, затем интоксикационный делирий. Одновременно наблюдаются выраженная тахикардия, тахипноэ, цианоз, артериальная гипотензия, олигурия, протеинурия. Центральное венозное давление повышено, на ЭКГ отмечаются признаки перегрузки правых отделов сердца. Гемограмма характеризуется высокими лейкоцитозом и СОЭ, нейтрофильным сдвигом формулы крови, нарастающей анемией. Редко можно наблюдать лейкопению, что обычно свидетельствует о тяжелом течении заболевания.
Как правило, у больных с септициемией отмечаются бледность кожных покровов с желтушным оттенком, цианоз губ и ногтей. Нередко у больной на конъюнктиве глаз, коже живота и спины имеется петехиальная сыпь, наблюдается частый жидкий стул, отмечаются гипонатриемия, гипои диспротеинемия, изменяется углеводный обмен, о чем свидетельствует умеренная гипогликемия. Реакция на нагрузку глюкозой остается в пределах нормы, форма гликемической кривой не изменена.
В некоторых случаях (нетипичная форма) при септицемии наблюдаются постепенное повышение температуры тела, единичные приступы озноба, значительные перепады температуры тела в течение суток.
Для больных с септицемией характерны относительно быстрое снижение температуры тела и улучшение общего состояния на фоне интенсивной, правильно подобранной комплексной терапии. Исключение составляют больные с молниеносным сепсисом, протекающим по типу инфекционнотоксического шока.
Септикопиемия чаще всего начинается на 6-9-й день после родов.
Клиническая картина и диагностика. Температура тела повышается до 40°С, отмечаются повторные ознобы. Общее состояние больных тяжелое: адинамия, слабость, заторможенное или возбужденное состояние. Кожные покровы бледные, наблюдаются цианоз видимых слизистых оболочек, боли в мышцах и суставах. У больных развивается сердечная недостаточность, проявляющаяся тахикардией (120-130 уд/мин), тахипноэ (26-30 дыханий в 1 мин), глухостью сердечных тонов. Артериальное давление, как правило, снижается, гемограмма характеризуется умеренным лейкоцитозом (10-1б*109/л). У некоторых больных количество лейкоцитов колеблется от 3до 510 /л. имеется лейкопения. У больных с септикопиемией отмечается нейтрофильный сдвиг формулы крови, СОЭ повышена до 40-65 мм/ч. может развиться анемия. При гнойных метастазах отмечается ухудшение гемограммы.
Наряду с обшей интоксикацией имеется синдром полиорганной и полисистемной недостаточности (матка, легкие, почки, печень). Явная множественность поражения – наиболее характерное проявление септикопиемии.
Наблюдается резкое снижение уровня белка, уменьшается содержание альбуминов, увеличивается количество глобулинов. У большинства больных имеются нарушения углеводного обмена, что выражается в развитии гипогликемии. Существенные изменения наблюдаются в функциональном состоянии коры надпочечников. Септикопиемия протекает на фоне сниженной глюкокортикоидной функции коры надпочечников. В остром периоде заболевания продукция АКТГ повышается в 3,5 раза, что характерно для стрессового состояния. Однако, несмотря на увеличение выработки АКТГ, содержание суммарных и связанных оксикортикостероилов не только не повышено, а, наоборот, снижено.
Возникновение вторичных гнойных очагов сопровождается усилением лихорадки, интоксикации. Наиболее часто вторичные гнойные очаги образуются в легких, ночках, печени, мозговых оболочках, мозге. Нельзя забывать, что появление микроорганизмов в крови больной является временным состоянием, а гнойные метастазы могут образоваться даже в том случае, когда попавшие в кровь возбудители будут уничтожены. Причины возникновения гнойных метастазов пока неизвестны, но одно обстоятельство следует иметь в виду: это критический уровень обсемененности. Накопление определенного количества микроорганизмов в первичном очаге способствует развитию сепсиса, а повторное их накопление в гнойном очаге снижает возможности иммунной защиты и становится одной из причин попадания микроорганизмов в кровь и образования гнойных метастазов.
Лечение.
Для успешного лечения сепсиса следует воздействовать на первичный очаг. При акушерском сепсисе первичным очагом преимущественно является воспалительно измененная матка (эндометрит); возможна и другая локализация – гнойные процессы в почках, молочных железах, абсцессы промежности, постинъекционные абсцессы.
Если первичный очаг инфекции находится в матке, то возможно несколько вариантов лечения. В случае выявления остатков последа или скопления организовавшихся сгустков крови в полости матки, что выявляют с помощью ультразвукового сканирования, гистероскопии или на основании клинических данных, показано их удаление кюреткой. В отсутствие содержимого в полости матки ее следует промыть охлажденным антисептическим раствором, используя двухпросиетный катетер.
В некоторых случаях приходится решать вопрос об экстирпации матки. Она показана при перитоните после кесарева сечения, при инфекционнотоксическом шоке и сепсисе с почечно-печеночной недостаточностью в случае неэффективной консервативной терапии. Удаление матки показано также при некротическом эндометрите.
Если первичным очагом являются гнойный процесс в молочных железах (мастит), гнойник промежности, постинъекционный абсцесс, то показано хирургическое вмешательство с эвакуацией гноя, иссечением некротизированной ткани. При тяжелом рецидивирующем мастите с интоксикацией, недостаточной эффективностью интенсивной терапии следует прекратить лактацию путем назначения парлодела.
Одновременно с воздействием на очаг инфекции необходимо приступить к комплексной антибактериальной, инфуэионно-трансфузионнон. общеукрепляющей, десенсибилизирующей, иммунокорригирующей, симптоматической, гормональной терапии.
Особого внимания и совершенствования требует лечение антибиотиками. При этом необходимо определить чувствительность к ним микроорганизмов. Однако в отсутствие условий для выявления возбудителя и определения его чувствительности к антибиотикам (что бывает весьма нередко) лечение необходимо начинать как можно раньше и назначать препараты широкого спектра действия.
Лечение антибиотиками при сепсисе продолжается в течение 14-20 дней, а в некоторых случаях и значительно дольше. Их применение можно закончить через 2-3 дня после нормализации температуры тела. При сепсисе чаще, чем при других формах послеродовой гнойно-септической инфекции, оправдано назначение нескольких антибиотиков в соответствии с особенностями их спектра и механизма действия. Микробиологическое исследование крови, мочи, содержимого полости матки, патологического материала из метастатических очагов и определение чувствительности к антибиотикам необходимо проводить повторно для контроля за эффективностью лечения.
На первом этапе лечения применяют комбинации из 2-3 препаратов. Можно использовать цефалоспорины третьего и четвертого поколений (фортум, лонгоцеф, цефметазон), обладающие супершироким спектром антимикробного действия или комбинации полусинтетических пенициллинов – ампициллина, уназина, акгементина или цефалоспоринов первого и второго поколений (кефзол, цефамандал и др.) с гентамицином и другими аминогликозидами и метронидаэолом для парентерального применения или клиндамицином.
На втором этапе лечения после выделения возбудителя и определения его чувствительности к антибиотикам при необходимости терапию антибиотиками корректируют.
Для повышения эффективности антибиотикотерапии и подавления резистентности микроорганизмов, особенно при перекрестной устойчивости, их комбинируют с сульфаниламидными и антисептическими препаратами нитрофуранового ряда (фуразолидон, еолафур, фуразолпн).
При лечении антибиотиками широкого спектра действия в результате развития дисбактериоза создаются условия для возникновения суперинфекций, вызванных протеем, синегнойной палочкой, стафилококками. Последняя проявляется энтероколитом, кишечной токсикоинфекцией, пневмонией. Большую роль играет суперинфекция, вызванная грибами (Candida albicans). Клинические проявления кандидоза разнообразны – от кандидоза кожи до микотической пневмонии и кандидозного сепсиса.
Для профилактики этих осложнений следует применять препараты, оказывающие одновременно антибактериальное и противогрибковое действие (энтеросептол, мексаформ, 5-НОК). Их назначают в сочетании с высокими дозами леворина или нистатина.
Сульфаниламидные препараты для лечения больных с сепсисом самостоятельного значения не имеют и могут назначаться при аллергической реакции на антибиотики пен ицилл и нового ряда в сочетании с бактериостатически действующими антибиотиками (тетрациклин, макролиды, левомицетин, фузидин).
Для повышения специфической и неспецифической иммунобиологической реактивности организма больным с первых дней лечения переливают гипериммунную антистафилококковую плазму в дозе 100 мл через 2 дня. Внутримышечно вводят антистафилококковый гамма-глобулин по 5 мл ежедневно (на курс от 6 до 10 доз). С целью неспецифической иммунотерапии переливают свежезамороженную плазму, а также назначают биогенные стимуляторы (левамизол).
Инфузионно-трансфузионная терапия направлена на поддержание объема циркулирующей крови, устранение анемии, гипопротеинемии, коррекцию нарушений водно-электролитного и кислотно-основного состояния, гемостаза. Проводят изо воле мичес кую гемодилюцию под контролем показателей коллоидно-осмотического давления (КОД) в сочетании со стимуляцией диуреза. В составе гидратационной терапии соотношение между коллоидами и кристаллоидами составляет в первые 6 дней 2:1, затем в течение 6 дней – 1:1, в последующие – 1:1,5. С целью ликвидации острой гипопротеинемии и гипоальбуминемии применяют растворы плазмы, протеина и альбумина. Кроме того, для повышения КОД используют растворы полиглюкина, реополиглюкина, гемодеза и желатиноля. Низкие значения КОД при сепсисе объясняются не только повышенной проницаемостью сосудистой стенки и недостаточностью лимфатического возврата белка в сосудистое русло, но и нарушением равновесия между синтезом и распадом белка и развитием так называемого септического аутоканнибализма.
В комплексное лечение больных входят также дигитализация, гепаринотерапия (до 20.000 ЕД/сут), антиагреганты (трентал, ксантинола никотинат), антипиретики, ингибиторы протеаз (гордокс), салуретики, витамины. При пневмонии соблюдают общие принципы лечения дыхательной недостаточности.
Общеукрепляющая терапия складывается из многих элементов: хорошего ухода, полноценного высококалорийного питания с большим содержанием витаминов, применения анаболических стероидных гормонов, дополнительной витаминотерапии, парентерального питания.
При сепсисе, как правило, возникает необходимость лечения кортикостероидными гормонами в связи с появлением аллергических реакций. Преднизолон или гидрокортизон лучше применять под контролем уровня гормонов. Однако можно ориентироваться и на клинические данные. Наиболее важным в этом отношении является уровень артериального давления. При склонности к артериальной гипотензии назначение кортикостероидных гормонов особенно важно для профилактики развития инфекционно-токсического шока.
В комплексное лечение необходимо включать десенсибилизирующие антигистаминные препараты типа супрастина. дипразина. Их назначение способствует предотвращению развития анафилактического шока. Показано назначение седативных средств: валерианы, пустырника и др. Нельзя забывать и о проведении симптоматической терапии (обезболивающие и спазмолитические препараты)
При развитии эмпиемы легких или плевры, карбункула почки, абсцесса печени, гнойного менингоэнцефалита, септического эндокардита больные нуждаются в специализированной помощи. Лечение больных с сепсисом необходимо осуществлять в отделении многопрофильной больницы, где обеспечена возможность участия специалистов смежных медицинских дисциплин.
В последние годы широкое распространение получили методы лимф ои гемосорбции, плазмаферез, эндолимфатическое введение антибиотиков и ультрафильтрация. Но они имеют как положительные, так и отрицательные стороны и применяются лишь в специализированных стационарах.
Септический шок
Одним из самых тяжелых осложнений гнойно-септических заболеваний в акушерстве является септический инфекционно-токсический шок.
Септический шок – внезапно возникающие и прогрессирующие нарушения функции жизненно важных систем (прежде всего доставки и потребления кислорода), причиной которых является патогенное действие любых микроорганизмов (бактерий, вирусов, грибов и др.).
Септический шок. по обобщенным данным мировой литературы, составляет 3-5 % от всех гной но-септических заболеваний в акушерстве и гинекологии.
Этиология и патогенез.
Развитие септического шока в 1 или II триместре беременности может наблюдаться при инфицированном аборте (начавшийся аборт, аборт в ходу, неполный аборт). Особенно неблагоприятны в этом аспекте криминальные аборты при больших сроках – свыше 13-14 нед гестации. Септический шок, связанный с абортом, чаще возникает при инструментальном опорожнении матки, но может развиваться вне связи с хирургической манипуляцией.
В конце беременности или во время родов при длительном безводном промежутке (свыше 15 ч) также возможно инфицирование родовых путей, приводящее в последующем к септическому шоку.
Все инфекционные послеродовые осложнения – мастит, эндометрит, перитонит и др. – могут при тяжелом течении приводить к развитию септического шока.
В 70 % случаев возбудителями септического шока являются грамотрицательные микроорганизмы – кишечная палочка, протей, клебсиелла, синегнойная палочка. Значительно реже – в 30 % случаев – в этиологии септического шока играет роль грамположительная флора: стафилококки, стрептококки, энтерококки. Кроме того, причиной развития септического шока могут быть такие анаэробы, как Clostridia perfringens, бактероиды, вирусы. Нередко септический шок развивается под действием ассоциаций микроорганизмов, например грамотрицательных и грамположительных аэробных и анаэробных бактерий.
Грамотрицательные бактерии, разрушаясь, выделяют эндотоксин, грамположительные – вырабатывают экзотоксин.
Эндотоксины представляют собой высокомолекулярный липополисахаридный комплекс, который образует часть наружной стенки грам отрицательных бактерий. Биологически активным эндотоксин становится лишь в случае гибели микроорганизмов. При этом происходят деструкция стенки и разрыв соединений между фосфолипидами, полисахаридами и протеинами. Наиболее биологически активным компонентом эндотоксина является липид А.
Эндотоксины запускают каскадные гуморальные реакции, ключевой из которых является выброс цитокинов из различных клеток организма больного.
Эндотоксины вызывают нарушение микроциркуляции: повреждение эндотелия, разрушение тромбоцитов, выход жидкости из кровяного русла в межклеточное пространство, внутри сосудистую коагуляцию и гемолиз.
Первичный механизм развития септического шока, вызванного грамположительными возбудителями, несколько иной, но в последующем происходят те же нарушения микроциркуляции.
Изменения микро циркуляции при септическом шоке соответствуют таковым при ДВС-синдроме, развитию и прегрессированию которого способствуют активация фактора XII (Хагемана), повреждение эндотелия сосудов эндои экзотоксинами с выделением тканевого тромбопластина. При агрегации тромбоцитов высвобождаются АДФ, серотонин, гистамин, тромбоксан А с одновременным ингибированием простациклина. Происходящий при нарушении кровотока в микрососудах гемолиз приводит к выбросу эритроцитарного тромбопластина. Эндои экзотоксины оказывают существенное влияние на систему комплемента и каллекреин-кининовую. Нарушения микроциркуляции при септическом шоке способствуют накоплению недоокисленных продуктов обмена в тканях различных органов, вследствие чего развивается тканевый метаболический ацидоз. Обменные нарушения, происходящие на уровне клетки, еще более нарушают капиллярный кровоток.
Компенсаторной реакцией организма на изменения периферического звена кровообращения служит повышение минутного объема кровообращения за счет тахикардии и регионарного артериовенозного шунтирования, особенно выраженное в легких и сосудах брюшной полости, – гипердинамическая фаза септического шока.
Продолжающееся повреждающее действие бактериальных токсинов приводит к углублению циркуляторных расстройств. Избирательный спазм венул в комбинации с прогресс и рованием ДВС-синдрома способствует секвестрации крови в системе микроциркуляции. Повышение проницаемости стенок сосудов ведет к пролотеванию жидкой части крови, а затем и форменных элементов в интерстициальное пространство. Эти патофизиологические изменения способствуют уменьшению OUK – развивается гиповолемия. Приток крови к сердцу значительно уменьшается. Минутный объем сердца, несмотря на резкую тахикардию, не может компенсировать нарастающего нарушения периферической гемодинамики, и происходит стойкое снижение АД – развивается гиподинамическая фаза септического шока. В эту фазу шока прогрессирующее нарушение тканевой перфузии приводит к дальнейшему углублению тканевого ацидоза на фоне резкой гипоксии, что в сочетании с токсическим действием возбудителя инфекции быстро приводит к нарушению отдельных участков тканей и функций органов, а затем и к гибели их. Жизненно важные органы подвергаются существенным морфологическим и функциональным изменениям. Принято выделять ''шоковое легкое", "шоковую почку". Другие органы (печень, желудочно-кишечный тракт, ЦНС, кожа) также подвергаются поражению.
Развитие "шокового легкого" связано с нарушением микроциркуляции, артериовенозным шунтированием, развитием интерстициального отека в легких, в результате чего нарушается соотношение между вентиляцией и перфузией легочной ткани. Микротромбоз легочных сосудов, недостаточная продукция сурфактанта ведут к развитию интраальвеолярного отека легких, микроателектазированию и формированию гичиновых мембран. Эти изменения лежат в основе развития при септическом шоке прогрессирующей дыхательной недостаточности, которая получила название "респираторный дистресс-синдром взрослых" (РДСВ).
Развитие "шоковой почки" определяется уменьшением кровоснабжения коркового слоя. Уменьшается клубочковая фильтрация, нарушается осмолярностъ мочи, развивается острая почечная недостаточность. Олигоанурия приводит к патологическим сдвигам волн о-электролитного баланса, задержке токсичных продуктов.
О поражении печени при септическом шоке свидетельствуют повышение содержания в крови органоспецифических ферментов, бил и рубин ем ия. Нарушаются гликогенобразующая функция печени и липидный обмен, повышается продукция молочной кислоты. Определенная роль в поддержании ДВС-синдрома принадлежит печени.
Нарушения микроциркуляции в желудочно-кишечном тракте приводят к развитию "стрессовых" язв желудка и язвенного энтероколита. В ЦНС гемодинамические изменения при септическом шоке проявляются в виде экстравазатов, паренхиматозных кровоизлияний.
Для септического шока характерны экстравазаты и некротические поражения кожи, связанные с нарушением микроциркуляции и с непосредственным поражением клеточных элементов токсином.
Патоморфологические изменения внутренних органов у погибших от септического шока характеризуются наличием большого количества тромбоцитарно-фибриновых тромбов в русле микроциркуляции почек, печени, надпочечников, гипофиза, желудочно-кишечного тракта, сочетающихся с многочисленными участками кровоизлияний
Клиническая картина и диагностика. Клинические проявления септического шока, который развивается на фоне имеющегося инфекционного очага поражения, довольно типичны: гипертермия до 39-40 °С, озноб. С первых часов отмечается частый, но ритмический пульс, в легких выслушиваются сухие, а иногда влажные хрипы. В более поздний период прогрессирует легочная недостаточность, сопровождающаяся развитием отека легких. Одновременно появляются парестезии, жесточайшие мышечные боли, усиливающиеся при прикосновении постельного белья. С первых часов изменяется психика больных: возникающие вначале возбуждение, чувство беспокойства через 4-6 ч сменяются безразличием к окружающему, некритическим отношением к своему состоянию, эйфорией. В первые часы шока багрово-красный цвет кожных покровов резко контрастирует с си-нюшной окраской губ, ногтевых лож и кончиков пальцев. Через 6-12 ч на коже больных могут появиться высыпания геморрагического и гипертонического характера. Обычно они локализуются на губах, носу, мочке уха. Артериальное давление в большинстве случаев бывает низким: 40-60/20-0 мм рт.ст. Однако может наблюдаться нормальное или повышенное артериальное давление в сочетании с другими явными признаками септического шока (нарушение или полное выпадение функции жизненно важного органа). Первоначально границы печени и селезенки могут быть не увеличены. По мере нарастания тяжести шока у этих больных появляются схваткообразные боли в животе, спустя 6-8 ч может появиться частый обильный стул с характером мелены. Моча кровянистая, с большим содержанием белка и разрушенных эритроцитов. Позже она становится бурой, а в последующие дни цвет ее обычный. Развиваются олигоанурия и острая почечная недоста-точность. Клиническая картина шока во многом определяется нарушениями микроциркуляции, обусловленными ДВС-синдромом: бледность, акроцианоз, олигурия и нарушение функции печени, дыхательная недостаточность, нарушение сознания, клинически выраженные гемолиз и геморрагический диатез. Последний проявляется желудочно-кишечными кровотечениями, подкожными геморрагиями, носовыми кровотечениями, кровоизлияниями в склеры глаз и метроррагиями. Независимо от причин шока проявления его носят обычно крайне тяжелый характер и отодвигают на задний план симптомы заболевания, послужившие источником его развития.
Различают 3 фазы развития септического шока. 1. Ранняя, или "теплая", гипотензивная фаза характеризуется повышением температуры тела до 38,4 – 40 °С. Лицо красное, озноб, тахикардия, снижение АД (систолическое давление 95-85 мм рт.ст.). Почасовой диурез составляет 30 мм/ч. Продолжительность этой фазы составляет несколько часов и зависит от тяжести инфекции. 2. Поздняя, или "холодная", гипотензивная фаза определяется субнормальной температурой тела, геморрагиями. Кожа на ощупь холодная, влажная. Отмечается выраженная артериальная гипотензия: систолическое давление до 70 мм рт.ст., цианоз ногтевого ложа, быстрый нитевидный пульс, нарушение чувствительности кожи, олигурия. 3. Необратимый шок (финальная фаза): падение АД, анурия, респираторный дистресс-синдром и кома. В этой фазе наблюдаются тяжелый метаболический ацидоз, быстрое нарастание содержания молочной кислоты.
Для уточнения диагноза и выбора целенаправленной терапии при септическом шоке необходимо проведение следующих мероприятий: 1. контроль артериального и центрального венозного давления, частоты дыхания каждые 30 мин; 2. измерение ректальной температуры минимум 4 раза в сутки, особенно после озноба, для сопоставления с данными температуры тела в подмышечной впадине; 3. общий анализ крови (лейкоцитарная формула, гемоглобин, гематокрит), количество тромбоцитов; 4. бактериологическое исследование крови, особенно во время ознобов, определение чувствительности микрофлоры к антибиотикам; 5. ежечасный контроль за диурезом, бактериологическое исследование мочи, определение чувствительности микрофлоры к антибиотикам; 6. определение концентрации электролитов в сыворотке, мочевины, креатинина, газов артериальной крови, рН; 7. постоянный мониторный контроль ЭКГ, частоты сердечных сокращений; 8. рентгенологическое исследование грудной клетки, брюшной полости при вертикальном положении пациентки для обнаружения свободного газа под диафрагмой, а также исключения инородного тела в брюшной полости; 9. исследование показателей свертывания крови – количество тромбоцитов, фибриногена, растворимых комплексов мономеров фибрина (РКМФ), продуктов деградации фибрина и фибриногена (ПДФ), антитромбина III, агрегации тромбоцитов.
Клиническая диагностика септического шока неотделима от диагностики диссеминированного внутрисосудистого свертывания крови: кровоточивость в одном или нескольких местах (в месте уколов, из матки, из поврежденных при операции тканей), наличие пурпуры, кровоподтеков. Геморрагический некроз кожи лица, синюшность кожи рук, ног, носа, щек и ушей также являются результатом диссеминированного внутрисосудистого свертывания.
Лечение.
1. Раннее полное удаление септического очага или дренирование гнойника, если он имеется. Инструментальная ревизия и опорожнение матки с помощью кюретажа сразу при поступлении больной в стационар, если заболевание обусловлено инфицированным абортом. Показаниями к лапаротомии и экстирпации матки с маточными трубами могут стать отсутствие эффекта от инструментального опорожнения и промывания матки, проведения интенсивной терапии в течение 4-6 ч, скудный соскоб, наличие гноя в матке, маточные кровотечения, гнойное образование в области придатков матки, большие размеры матки, при которой выполнение выскабливания опасно, обнаружение при УЗИ патологических образований в брюшной полости. 2. Проведение массивной длительной целенаправленной антибактериальной терапии, которую следует начинать с использования антибиотиков широкого спектра действия. Препаратами выбора являются цефалоспорины третьего – четвертого поколения (цзфотаксин, цефуроксин, цефпирон), карбеленемы (меронем), комбинация аминогликозидов с бета-лактамзами или фторхинолонами. Обязательным компонентом терапии должно быть применение антианаэробных антибиотиков (метронидазол или клиндамицин) и противогрибковых препаратов (дифлюкан). 3. Восполнение объема циркулирующей крови в режиме умеренной гемодилюции с использованием препаратов, улучшающих реологические свойства крови, – растворов глюкозы, солевых растворов, синтетических кровезаменителей (реополиглюкин, реоглюкан), препаратов крахмала (волекам), растворов аминокислот (аминазол, белковые гидролизаты), альбумина, сухой и нативной плазмы. 4. Коррекция дыхательной недостаточности, оксигенотерапия, кислородная маска, по показаниям трахеостомия. Искусственную вентиляцию легких следует проводить в режиме положительного давления на выдохе. 5. Введение иммунных сывороток (антиколи-сыворотка), бактериофагов; другие виды иммунотерапии (иммуноглобулин). 6. Коррекция нарушения водно-электролитного баланса и кислотно-основного состояния в зависимости от лабораторных показателей. 7. Применение противотромботических препаратов: антиагрегантов (курантил, компламин, ацетилсалициловой кислоты), антикоагулянтов – гепарин (20 000-60 000 ЕД в сутки, либо внутривенно капельно в дозе не менее 1000 ЕД в час, либо подкожно 5000-10 000 ЕД каждые 4 ч, но только под контролем показателей свертывания крови). Противотромботическую терапию необходимо сочетать с восполнением уровня антитромбина III (кибернин) и плазминогена за счет переливания нативной или свежезамороженной плазмы по 250-400 мл в сутки. Гепарин и антиагреганты воздействуют на важнейший компонент патогенеза септического шока – ДВС-синдром, а также способствует профилактике септической легочной эмболии. 8. В некоторых случаях, учитывая крайнюю степень тяжести больных септическим шоком и прогрессирующее истощение организма, целесообразно проведение энтерального зондового сбалансированного питания в режиме гипералиментапии (2000-4000 ккал). 9. В тяжелых случаях показаны плазмаферез и другие методы экстракорпоральной детоксикации (гемофильтрация, гемоили плазмосорбция).
Акушерский перитонит
Акушерский перитонит – одно из наиболее грозных осложнений послеродового периода, он развивается в 0,3-1 ,5 % случаев. Источником инфекции чаше всего являются патологические процессы в матке (хориоамнионит в родах, послеродовой эндометрит, несостоятельность швов на матке после кесарева сечения). Важная роль матки в качестве входных ворот инфекции определяется наличием в ней сгустков крови и остатков последа, являющихся прекрасной средой для роста микроорганизмов. Кроме того, беременная матка обладает большой поверхностью для резорбции бактериальных и тканевых токсинов, а особенности ее кровоснабжения способствуют массивному поступлению бактериальной флоры и токсинов в кровеносное русло.Ведущая роль в патогенезе перитонита принадлежит интоксикации, обусловленной бактериальными токсинами, тканевыми протеазами, биогенными аминами (гистамин, серотонин, кинин), а также гиповолемии ("безвозвратные" потери жидкости из кровяного русла, депонирование и секвестрация крови в сосудах брюшной и частично грудной полости), параличу (парезу) желудочно-кишечного тракта.
Характер и тяжесть изменений при перитоните определяются различным сочетанием таких факторов, как вид. вирулентность, количество проникших в брюшную полость микроорганизмов, распространенность, продолжительность патологического процесса, состояние иммунной системы организма.
Особое место в патогенезе перитонита занимает парез (паралич) кишечника. Перерастяжение кишечных петель жидкостью и газами приводит к нарушению двигательной, секреторной, всасывательной функций кишки, расстройству обмена и обезвоживанию. В связи с нарастанием пареза в просвет тонкой кишки поступают и там секвестрируются значительные объемы жидкости, содержащей большое количество белка и электролитов, в том числе ионов калин. Давление в просвете кишки повышается, возникают ее перерастяжение и нарушение внутри стен очного кровотока, ишемия стенки, еще больше увеличивается парез. Стенка кишки становится проходимой для микроорганизмов и токсинов.
Высокое стояние диафрагмы, уменьшение ее подвижности ухудшают вентиляцию легких (базальные ателектазы) и деятельность сердца. Иммобилизация мыши брюшного пресса приводит к нарушению кашлевого рефлекса.
Тяжелые потери жидкости, усугубляющиеся высокой лихорадкой, рвотой, обу-словливают вначале снижение объема циркулирующей крови, а затем и сердечного выброса и способствуют развитию эндотоксического шока. При этом особенно выражены изменения микроциркуляции, повышение активности протеолитических ферментов и внутри сосудистого свертывания крови с коагулопатией потребления.
Усиление метаболизма отмечается в связи с высокой лихорадкой и как следствие – эндогенной интоксикацией от поступления в полость брюшины и резорбции из нее через измененную стенку кишки продуктов аутолиза кишечного содержимого и клеточных элементов ишемически поврежденной слизистой оболочки кишечника, бактериальных токсинов, лизосомальных ферментов, кининов и других продуктов повышенного протеолиза.
Эндогенная интоксикация повышает потребность тканей в кислороде, снижает работу миокарда, усиливает дегидратацию. Гистамин, брадикинин, лизосомальные ферменты, бактериальные токсины подавляют сократительную активность мышц кишечной стенки, паретически расширяют капилляры и, следовательно, нарушают микроциркуляцию, секрецию и всасывание в кишечнике.
В.Н.Серов и соавт (1984) выделяют 3 возможных механизма инфицирования брюшной полости у больных, перенесших кесарево сечение. 1. Перитонит возникает вследствие инфицирования брюшины во время кесарева сечения (при сопутствующем хориоамнионите, длительном безводном промежутке). Источником инфекции является содержимое матки, попадающее в брюшную полость в процессе операции ("ранний" перитонит). 2. Источником инфицирования брюшной полости после кесарева сечения может быть также повышенная (вследствие пареза) проницаемость стенки кишечника для токсинов и бактерий. 3. Наиболее часто перитонит обусловлен инфицированием брюшной полости вследствие несостоятельности швов на матке.
Клиническая картина и диагностика.
Для акушерского перитонита характерно раннее появление симптомов интоксикации (2-3-й сутки): жажда, сухость слизистой оболочки, слабость, тахикардия. Очень важными признаками служат повышение температуры тела, парез кишечника. При анализе крови выявляются лейкоцитоз, сдвиг лейкоцитарной формулы влево – появление палочкоядерных лейкоцитов.
В отличие от "хирургического" перитонита симптомы раздражения брюшины в первые дни часто отсутствуют. В последующем (5-6-е сутки) на фоне выраженного пареза кишечника определяются сухость языка, положительный симптом Щеткина-Блюмберга, "мышечная зашита", рвота, жидкий и частый стул с резким запахом, четкая локальная болезненность при пальпации. В крови нарастает лейкоцитоз, увеличивается сдвиг лейкоцитарной формулы влево.
Диагноз устанавливают на основании характерной клинической картины: повышение температуры тела, сухость языка, стойкий парез кишечника, лейкоцитоз. Уточнить диагноз можно с помощью УЗИ, которое позволяет выявить раздутые, заполненные гипоэхогенным содержимым петли кишечника, выраженную гиперэхогенность кишечной стенки, снижение или отсутствие перистальтики. Нередко визуализируется свободная жидкость в брюшной полости между петлями кишечника, в латеральных каналах и в позади маточном пространстве. О неполноценности швов на матке свидетельствуют неравномерная толщина стенки матки в проекции шва, наличие в этой области жидкостных структур, симптомов "ниши".
При рентгенологическом исследовании органов брюшной полости также выятяются признаки пареза кишечника: вздутие его петель, утолщение стенок; при динамической паретической непроходимости определяются уровни жидкости.
Лечение.
Тактика ведения больных с перитонитом после кесарева сечения зависит от его формы, тяжести заболевания, эффективности консервативной терапии.
При симптомах перитонита в первые 3-4 сут лечебная тактика основывается на проведении комплексной консервативной терапии, и только в отсутствие эффекта и при ухудшении состояния больной (парез кишечника не разрешается и переходит в паралитическую непроходимость, появляются экссудат в брюшной полости, тахикардия, тахипноэ) показано оперативное вмешательство.
Объем оперативного лечения при перитоните заключается в экстирпации матки с трубами; дренировании брюшной полости и нижних отделов боковых каналов через влагалище и переднюю брюшную стенку; при разлитом перитоните выполняют дренирование верхних отделов живота и проточное орошение брюшной полости.
Для проведения брюшного диализа требуется опыт, необходим также динамический контроль за показателями плазмы крови и диализата. Как проточный, так и фракционный диализ обусловливает потери белка, которые необходимо восполнять.
При восстановлении функции кишечника во время операции может возникнуть необходимость в его опорожнении. Наиболее безопасным является отсасывание содержимого кишечника через зонд, введенный в желудок, а затем в тонкую кишку. Попытки опорожнить кишечник путем наложения энтеростомы следует считать нецелесообразными вследствие развития осложнений, связанных с неполноценностью швов в месте стомы.
Наряду с оперативным лечением необходима и общая терапия, которая продолжается в послеоперационном периоде. Цель комплексной терапии – компенсация патофизиологических нарушений и борьба с инфекцией и интоксикацией.
Основой проведения комплексной интенсивной терапии является инфузионно-трансфузионная терапия, которую осуществляют методом управляемой гемодилюции с широким использованием кровезаменителей направленного действия и растворов со сбалансированным ионным составом под мониторным контролем за показателями коллоидно-осмотического состояния.
Ряд мероприятий направлен на устранение нарушений микроциркуляции и ДВС-синдрома.
Для нормализации функции паренхиматозных органов и тканевого метаболизма назначают 1 % раствор глутаминовой кислоты, коферментные препараты (кокарбоксилаза, фолиееая кислота, сирепар). При перитоните рекомендуется применение ингибиторов протеаз, которые тормозят эстеразную активность эндогенных и экзогенных протеиназ (траенлол, контрикал, гордокс, пантрипин). Лечебный эффект достигается путем торможения этими препаратами кининогенеза, фибринолиза в крови, а также блокиро-вания микробных протеиназ, купирования процессов кининообразования в микроциркуляторном русле и лимфатическом русле поджелудочной железы.
Иммунотерапия включает в себя применение гамма-глобулина, сывороточного пол и глобул и на, свежезамороженной и антистафилококковой плазмы, вакцин, иммуноактивной плазмы, прямого переливания крови. Стимуляция защитных сил организма достигается применением биогенных стимуляторов (декарис).
Антибактериальную терапию необходимо проводить одновременно 2-3 препаратами. Смену антибиотиков осуществляют через Ш дней с учетом чувствительности к ним микрофлоры В комбинацию антибиотиков входят полусинтетические пенициллины (оксациллин, ампициллин), цефалоспорины (цепорин, кефзол, цефамизин), аминогликозиды (канамицин, мономицин, гентамицин). Одновременно с антибиотиками назначают сульфаниламидные препараты, препараты нитрофуранового ряда, противогрибковые средства, мексазу, колибактерин.
Анаэробные неклостридиальные микроорганизмы чувствительны к небольшой группе препаратов, к которой относятся клиндамицин, линкомицин, рифампицин, левомииетин, метронидазол, тинидазол. Одновременно назначают антибактериальные препараты, действующие на аэробный компонент ассоциации.
Важным является устранение пареза кишечника. С этой целью производится декомпрессия желудочно-кишечного тракта (дренирование желудка зондом, денитрогенизация кишечника, те. замещение кишечных газов дополнительно ингалируемым кислородом). Следующий этап заключается в усилении моторной деятельности кишечника, которую осуществляют внутривенным введением 1 мл 0,1 % раствора прозерина, 60 мл гипертонического раствора хлорида натрия, гипертонической клизмой.
В случае неэффективности проводимого лечения для устранения стойкого пареза кишечника при наличии необходимого оборудования может быть использована гипербарическая оксигенация, которая улучшает кровоснабжение стенки кишечника, что приводит к существенному повышению оксигенации и снижению проницаемости стенки для токсинов и бактерий, способствуя восстановлению перистальтики.
Профилактика перитонита складывается из нескольких моментов. Вопервых, необходима взвешенная оценка показаний и противопоказаний к производству кесарева сечения. Во-вторых, операция должна выполняться на высоком профессиональном уровне, технически правильно.
При кесаревом сечении большое значение имеют способ ушивания раны, шовный материал. Предпочтительно использовать рассасывающиеся синтетические нити.
Глава 28. Обезболивание в акушерстве
Анестезиологическую службу в родовспомогательных учреждениях должны осуществлять хорошо обученные анестезиологи и анестезистки акушерского профиля.Обезболивание родов
Роды обычно сопровождаются болевыми ощущениями разной степени выраженности. Сила болевого ощущения зависит от состояния ЦНС, правильного функционального соотношения корково-подкорковых процессов, индивидуальных особенностей, эмоциональной настроенности и отношения роженицы к предстоящему материнству.Болевое ощущение и ответные реакции на боль формируются в ЦНС (область гипоталамуса, ретикулярная формация, лим'бическая система).
Боль во время схватки обусловлена раскрытием шейки матки, гипоксией тканей матки, сдавлением нервных окончаний, натяжением маточных связок.
В начале первого периода родов причиной возникновения боли являются сокращения матки и обусловленная этим ишемия миометрия, а также сопровождающее каждую схватку натяжение связок матки. По мере прогрессирования родов все большее значение приобретает растяжение нижнего маточного сегмента. В конце первого и начале второго периода родов основную роль начинает играть давление предлежащей части плода на мягкие ткани и костное кольцо малого таза.
Периферическими нервными образованиями, проводящими болевые импульсы во время родов, являются главным образом нервные сплетения тела матки, широких связок и шейки матки (особенно важная роль принадлежит парацервикальному сплетению Франкенгаузена), Чувствительные волокна от тела и шейки матки входят в составе задних корешков в спинной мозг на уровне Th11 – Th12; от влагалища, вульвы и промежности – через срамной нерв на уровне S2-S4.
В спинном мозге передача нервных импульсов осуществляется по боковым спиноталамическим трактам, в головном мозге – через ретикулярную формацию и ядра зрительных бугров в заднюю центральную извилину.
Под воздействием родовой боли меняется функция сердечно-сосудистой системы: возникает тахикардия, увеличивается сердечный выброс, нарастает артериальное и центральное венозное давление. Возможно развитие нарушений сердечного ритма, уменьшение коронарного кровотока, изменение давления в полостях сердца, увеличение общего периферического сопротивления. Изменяется функция дыхания: развивается тахипноэ, снижается дыхательный объем, в то же время значительно возрастает минутный объем дыхания, что может привести к выраженной гипокапнии и нарушениям маточно-плацентарного кровообращения. Боль может нарушать функцию желудочно-кишечного тракта, мочевого пузыря, вызывать рефлекторный спазм мышц тазового дна, тошноту и рвоту.
Боль в родах ведет к психоэмоциональному напряжению, утомлению, нарушению сократительной активности матки и внутриутробному страданию плода.
В последнее десятилетие большое значение в генезе болевых ощущений придается природным "глушителям боли" – эндорфинам и энкефалинам, которые вырабатываются хромаффиноцитами надпочечников, головного мозга и кишечника.
К обезболиванию родов предъявляются следующие требования: снятие отрицательных эмоций, страха; хороший болеутоляющий эффект; отсутствие угнетающего действия на родовую деятельность; полная безопасность метода обезболивания для матери и плода; сохранение сознания роженицы, способность ее активно участвовать в родовом акте; отсутствие вредного влияния на лактацию и течение послеродового периода; простота и доступность для родовспомогательных учреждений любого типа.
Немедикаментозные методы.
Для обезболивания родов используются не-медикаментозные и медикаментозные методы.
Среди немедикаментозных методов обезболивания родов заслуживают внимания физиопсихопрофилактика, гипноз (см. Ведение беременности), акупунктура (иглоукалывание).
Роженицам, прошедшим психопрофилактическую подготовку к родам, требуется меньшая доза лекарственных препаратов для обезболивания родов.
Среди немедикаментозных методов обезболивания родов заслуживают внимания акупунктура и акупрессура, чрескожная электронейростимуляция, гидротерапия (теплые ванны) и др.
К недостаткам метода гидротерапии относится трудность обеспечения асептики, слежения за характером сократительной деятельности матки и плодом, за моментом излития околоплодных вод и др. Во многих клиниках для обезболивания родов используют акупунктуру и акупрессуру. При акупунктуре блокируются сенсорные и эмоциональные компоненты боли, но ее механизм недостаточно ясен. Эффективной в плане обезболивания первого периода родов является акупунктура в биологически активных точках (БАТ): на животе (VC4 – гуань-юань), в области кисти (С14 – хэгу), в верхней трети голени (E3g – цзу-сань-ли), в нижней трети голени (RPfc – сань-инь-цзяо).
Во втором периоде родов эффективно использование БАТ в области крестца (V31 и V34 – ба-ляо).
Акупрессура – это акупунктура без игл, способствующая достижению обезболивающего эффекта.
Акупунктура и акупрессура позволяют снять боль во время схватки, нормализуют родовую деятельность и не оказывают отрицательного влияния на плод. Данный метод ограничивает двигательную активность роженицы и требует внимательного контроля, в связи с чем сеанс ограничен во времени.
С успехом для обезболивания родов применяют чрескожную электроне йростимуляцию (ЧЭНС). Для этой цели используют отечественный аппарат "Дельта 101". Это одноканальный электростимулятор, генерирующий несимметричные биполярные импульсы. Частота следования импульсов 30- 120 Гц, сила тока 10-60 мА, длительность импульса 0,5-0,8 мс. Для достижения наибольшего эффекта применяют одновременно 2 аппарата "Дельт2а 101". Две пары свинцовых электродов в виде пластин площадью 20 см , обработанных электропроводной пастой, фиксируют лейкопластырем в зоне максимальной болезненности на коже передней брюшной стенки (триггерные зоны матки) и сзади паравертебрально в зоне сегментарной иннервации Th10-Th11.
При данной методике идет "бомбардирование" афферентных волокон и "закрываются ворота" для боли. Полагают, что при этом возрастает уровень эндорфинов в спинномозговой жидкости. Обезболивающий эффект достигает 80,6 %.
ЧЭНС не оказывает отрицательного влияния на сократительную функцию матки, сердечную деятельность плода, состояние новорожденного.
Медикаментозные методы. При назначении лекарственных средств для обезболивания родов следует помнить, что нет ни одного седативного или снотворного средства, ни одного анальгетика, которые не проникали бы через плаценту и не влияли бы в той или иной мере на плод. Поэтому для обезболивания родов необходим тщательный выбор лекарственных препаратов и их сочетаний с учетом состояния конкретной роженицы и плода. Важно учитывать и время (период родов) введения лекарственных средств. Боли во время схваток чаще возникают при раскрытии шейки матки на 3-4 см, максимально болезненные ощущения наступают при раскрытии шейки матки на 9-10 см, но в этот период можно применять не все препараты вследствие их действия на плод.
Схематически последовательность действий при проведении обезболивания во время родов можно представить следующим образом. 1. В начале родовой деятельности (латентная фаза родов, раскрытие шейки на 3-4 см) при относительно малоболезненных схватках для снятия страха показано применение транквилизаторов (триоксазин – 0,6 г или элениум – 0,05 г, седуксен – 0,005 г и др.). 2. При развитии регулярной родовой деятельности и появлении выраженной болезненности схваток показано сочетанное или самостоятельное применение ингаляционных либо наркотических анальгетиков в сочетании с седативными или спазмолитическими средствами. У легко внушаемых рожениц возможно применение акупунктуры, электроаналгезии, чрескожной электронейростимуляции. 3. В случае неэффективности указанных методов обезболивания родов или при наличии экстрагенитальной патологии, гестоза целесообразно применение длительной перидуральной (эпидуральной) анестезии.
Можно рекомендовать следующие комбинации препаратов: 1. 20-40 мг промедола + 20 мг димедрола + 40 мг но-шпы; 2. 20-40 мг промедола + 10 мг седуксена + 40 мг папаверина; 3. 2 мг морадола + 10 мг седуксена + 40 мг но-шпы; 4. 50-100 мг меперидина + 25 мг прометазина (применяется за рубежом).
Указанные препараты следует вводить внутримышечно для более быстрого достижения эффекта. Действие анестетиков начинается через 10-20 мин после их введения и продолжается 2 ч. Обезболивание с помощью анальгетиков следует начинать в случае выраженной болезненности схваток (обычно при открытии шейки матки на 3-4 см), а прекращать за 2-3 ч до предполагаемого момента родов из-за возможной наркотической депрессии плода. После введения препаратов в указанных комбинациях наблюдается монотонность сердечного ритма плода (по данным KIT), родовая деятельность продолжается. Значительное уменьшение боли отмечается у 30-60 % рожениц. Попытки добиться полного обезболивания с помощью значительного увеличения доз анальгетиков или уменьшения интервалов между введениями чревато опасностью развития слабости родовой деятельности, повышенной кровопотери в родах.
Лечебный акушерский наркоз.
Показаниями к лечебному акушерскому наркозу являются утомление в родах, затяжные роды, дискоординация родовой деятельности, патологический прелиминарный период, гестоз.
Для лечебного акушерского наркоза с успехом применяют 20 % раствор натрия оксибутирата, 2 % раствор промедола (1 мл) или 2,5 % раствор пипольфена (1 мл), 1 % раствор димедрола (1 мл) внутримышечно. Натрия оксибутират вводят внутривенно медленно в виде 20 % раствора из расчета 50-65 мг/кг (в среднем 4 г сухого вещества) через 5-20 мин после премедикации. Сон наступает через 3-8 мин после введения препарата и продолжается обычно в течение 2,5 ч. Акушерский наркоз назначает акушергинеколог, а проводит анестезиолог. Натрия оксибутират обладает антигипоксической активностью, вызывает стабилизацию трансмембранного градиента клетки и улучшает функцию калий-натриевого насоса. Препарат способствует более быстрому раскрытию маточного зева и уменьшению токсических явлений у плода. При лечебном акушерском наркозе снижаются интенсивность обменных процессов и потребление кислорода тканями. После отдыха уменьшается метаболический ацидоз, повышаются обменные и окислительные процессы, на фоне которых усиливается действие утеротонических препаратов. Препарат противопоказан при тяжелой форме гестоза, брадикардии, артериальной гипертензии.
Ингаляционные методы обезболивания родов.
С целью обезболивания родов в настоящее время применяют закись азота, трилен, метоксифлуран в смеси с кислородом при помощи наркозных аппаратов типа "НАПП-2". Трилен и метоксифлуран могут быть применены в смеси с воздухом с помощью специальных портативных приборов.
Наиболее распространенный вариант аутоаналгезии закисью азота с кислородом состоит в том, что после подбора в течение нескольких схваток наиболее эффективной концентрации закиси азота роженица дышит подобранной газовой смесью только во время схватки, начиная ингаляцию при возникновении ощущения приближения схватки. Возможна и постоянная ингаляция. Эта методика также не угрожает передозировкой, так как при наступлении хирургической стадии наркоза роженица перестает прижимать маску к лицу, переходит на дыхание воздухом и просыпается.
Закись азота в организме не кумулируется, поэтому она может быть применена на протяжении всех родов. Для обезболивания родов следует пользоваться смесью, содержащей 40-60 % закиси азота и 60-40 % кислорода. Роженица находится в состоянии бодрствования, может тужиться, длительность действия смеси короткая, побочные действия на организм матери и плода небольшие. В случае появления цианоза, тошноты, рвоты ингаляция закиси азота прекращается, дыхание осуществляется чистым кислородом.
Аналгезирующий эффект закиси азота может быть значительно усилен применением промедола. У возбудимых и эмоционально лабильных рожениц до начала ингаляции закиси азота целесообразно применение седуксена или дроперидола.
Трилен (трихлорэтилен) дает более выраженный, чем закись азота, анальгетический эффект. Оптимальный вариант его применения для обезболивания родов – периодическая ингаляция в концентрации не выше 1,5 % по объему. Превышение данной концентрации, а также использование трилена дольше 3-4 ч вследствие его кумулятивного эффекта могут привести к ослаблению родовой деятельности и возникновению у рожениц тахипноэ и нарушению ритма сердца.
Фторотан является одним из наиболее мощных, управляемых, но в то же время токсичных и опасных ингаляционных анестетиков. Кратковременное применение фторотана оправдано при необходимости быстро ввести больную в наркоз на фоне выраженной артериальной гипертензии (преэклампсия, эклампсия) или остановить родовую деятельность у рожениц с дискоординированными схватками, а также при угрозе разрыва матки.
В высоких концентрациях (более 2 % по объему) фторотан оказывает выраженное угнетающее действие на миокард и миометрий. Последнее свойство его может быть причиной слабости родовой деятельности и кровотечений в последовом и послеродовом периоде. Применение фторотана в качестве единственного анестетика не оправдано. Он всегда должен применяться кратковременно в смеси с закисью азота и кислорода.
Длительная перидуральная (эпидуральная) анестезия (ДПА) имеет ряд достоинств, к которым относятся высокая эффективность обезболивания (92-95 %) , простота применяемого инструментария, возможность сохранить сознание больной, наличие симпатической блокады, улучшающей кровоснабжение матки и почек, отсутствие угнетающего влияния на родовую деятельность и состояние матери и плода.
Анатомо-физиологической основой ДПА является блокада проводников от нервных сплетений матки, идущих в составе афферентных путей и входящих в спинной мозг на уровне Тh11-Th12 и L1, а также S2-S4.
ДПА показана при сильных болях в родах (отсутствие эффекта от других методов обезболивания), дискоординации родовой деятельности, дистоции шейки матки, повышении артериального давления в родах, гестозе, у беременных, страдающих выраженными заболеваниями сердца и дыхательной системы. Кроме того, ДПА может служить методом выбора обезболивания при ряде малых акушерских операций и кесаревом сечении.
Помимо общепринятых противопоказаний (наличие инфекционного поражения в месте пункции, кровотечения, неврологических заболеваний, применение антикоагулянтов, шок), специфическим акушерским противопоказанием к применению ДПА во время родов является угроза разрыва матки по рубцу.
Проводить ДПА в акушерской практике может только анестезиолог, в совершенстве овладевший этой методикой.
Начинают ДПА, как правило, при установлении регулярной родовой деятельности и открытии шейки матки на 3-4 см.
ДПА может быть использована на протяжении всех родов. В связи с тем что ДПА снимает рефлексы с тазового дна, введение анестетиков в перидуральное пространство, если нет необходимости в выключении потуг, прекращают во втором периоде родов. При ДПА отмечаются некоторое удлинение второго периода родов и связанное с этим увеличение числа возможных оперативных вмешательств (вакуум-экстракция, акушерские щипцы, эпизиотомия).
Пункцию и катетеризацию эпидурального пространства осуществляют на уровне L-U_IU-Liu-ivДозу местного анестетика (2 % раствор лидокаина, 2,5 % раствор тримекаина, 0,25-0,5 % раствор бупивакаина) для каждой роженицы подбирают индивидуально: предварительно вводят пробную дозу – 2 мл, затем в зависимости от массы тела и роста – основную дозу, величина которой колеблется от 6 до 12 мл. Интервал между введениями в начале активной фазы родов 60-90 мин, в конце первого периода родов 30-40 мин. К катетеру присоединяют перфузор и инфузию анестетика осуществляют со скоростью 6-12 мл/ч в зависимости от анальгетического эффекта.
За рубежом используют следующие анестетические вещества: лидокаин (200-300 мг), бупивакаин (50-100 мг), тетракаин (75 -150 мг). Их также используют для пудендального блока и местного обезболивания.
При ДПА возможны осложнения: головная боль, боль в спине, артериальная гипотензия, дыхательная недостаточность, нарушение функции мочевого пузыря, пункция твердой мозговой оболочки и др.
Пудендальная анестезия.
Данный вид анестезии применяется для обезболивания во втором периоде родов при операции наложения акушерских щипцов и вакуум-экстрактора, когда не требуется выключения сознания, а также при рассечении промежности и восстановлении ее целости.
Для обеспечения блокады срамного нерва, расположенного на 0,5-1 см проксимальнее spina ischii, нужно ввести по 30 мл 0,5-1,0% раствора новокаина или 10 мл 1 % лидокаина в седалищно-прямокишечное пространство с каждой стороны. Существует два метода проведения блокады: через промежность и через боковые стенки влагалища.
Обезболивание при акушерских операциях
Обезболивание при наложении акушерских щипцов. Дня успешного выполнения операции наложения акушерских щипцов следует обеспечить оптимальные обезболивание и релаксацию мышц тазового дна у роженицы. Выбор метода обезболивания определяется состоянием женщины и плода, а также экстренностью показаний к данной операции. В тех случаях, когда активное участие женщины в родах представляется целесообразным (слабость родовой деятельности, внутриутробная гипоксия плода у соматически здоровой женщины), операция может быть выполнена с использованием пудендальной анестезии или ингаляции закиси азота с кислородом, а также перидуральной анестезии (если роды проводились с применением ДПА). Роженицам, которым потуги противопоказаны (тяжелые заболевания сердечно-сосудистой системы, заболевания легких, тяжелые гестозы, гипертоническая болезнь, миопия высокой степени и др.), операцию наложения акушерских щипцов выполняют под наркозом.Наиболее приемлемым методом общей анестезии является кратковременный наркоз кетамином (калипсол, кеталар). Для этой цели вводят внутривенно кетамин по общепринятой методике из расчета 1,1 – 1,2 мг/кг массы тела женщины. Через 1-2 мин достигается оптимальный уровень наркоза, на фоне которого и осуществляют операцию. При необходимости внутривенный наркоз продлевают путем дополнительного введения дробных доз препарата или ингаляции закиси азота с кислородом (в соотношении 2:1). Сразу же после пробуждения от наркоза восстанавливается тонус поперечнополосатой и маточной мускулатуры. Вероятность наркотической депрессии плода и новорожденного минимальная, так как калипсол быстро разрушается.
При наложении акушерских щипцов не утратила своего значения и успешно продолжает применяться до сих пор закись азота с кислородом, однако глубина наркоза часто является недостаточной, и возникает необходимость во введении малых доз калипсола. Анестезия не должна заканчиваться после извлечения ребенка, так как наложение акушерских щипцов обычно сопровождается ручным обследованием стенок полости матки и восстановлением целости мягких родовых путей.
Обезболивание при вакуум-экстракции плода.
Необходимость активного участия роженицы в этой акушерской операции является основанием для отказа от общей анестезии или значительного ее ограничения, при этом нужна лишь аналгезия с одновременным обеспечением спазмолитического эффекта. Аналгезия достигается ингаляцией закиси азота с кислородом (в соотношении 2:1) с одновременным внутривенным введением спазмолити-ческого средства: 40 мг но-шпы или 0,5 мл 0,1 % раствора метацина. Ингаляция закиси азота с кислородом применяется лишь в период между тракциями.
При наличии прямых противопоказаний к общей анестезии производится пудендальная (проводниковая) анестезия.
Обезболивание при извлечении плода за тазовый конец.
Перед операцией роженице внутривенно вводят один из спазмолитических препаратов (1,0 мл 0,1 % раствора атропина сульфата, 2,0 мл 2 % раствора но-шпы и т.д.). Операцию выполняют под наркозом: ингаляционным (закись азота с кислородом в соотношении 2:1) или внутривенным (калипсол, кеталар, кетамин и др.). В результате расслабляются мышцы тазового дна, предотвращается спазм внутреннего зева, нередко осложняющий операцию.
Обезболивание при классическом внутреннем повороте плода на ножку. В наши дни данная операция применяется обычно в случае поперечного положения второго плода при двойне или при головном предлежании второго плода и наличии острой гипоксии.
Обычно вслед за поворотом плода производят его экстракцию.
Кроме обезболивания, при данной операции необходимо расслабление матки (шейки матки), мышц передней брюшной стенки и тазового дна.
Оптимальным методом обезболивания является кратковременный внутривенный наркоз калипсолом (кетамин, кеталар, кетмин), который может быть углублен закисью азота или фторотаном. Подключение фторотана обосновано при наличии частых схваток, недостаточной релаксации матки, особенно если до операции использовались утеротонические средства.
Некоторые авторы рекомендуют использование фторотана в сочетании с закисью азота и кислородом.
Обезболивание при ручном вхождении в полость матки.
Наиболее безопасным методом обезболивания в данном случае является кратковременный наркоз калипсолом по общепринятой методике. Внутривенно вводят калипсол из расчета 1,1 – 1,2 мг/кг массы тела женщины, достигается наркоз
III стадии. Премедикация решается индивидуально. При необходимости наркоз углубляют дополнительным введением малых доз калипсола или ингаляции закиси азота с кислородом (в соотношении 2:1 или 3:1). Ингаляция закиси азота с кислородом или субнаркотических доз фторотана в значительной степени расширяет возможности анестезиолога.
На фоне кровотечения более безопасным является наркоз закисью азота с кислородом в соотношении 2:1 или 3:1. Не следует использовать фторотан, который снижает сократительную способность матки.
Обезболивание при плодоразрушающих операциях.
Плодоразрушающие операции технически трудны, болезненны, всегда наносят тяжелую моральную травму матери; иногда вследствие остро возникающих осложнений требуют расширения объема вмешательства. Кроме того, эти операции обычно производят на фоне физического и эмоционального истощения роженицы, длительно находящейся в родах. В данной ситуации методом выбора анестезии становится кратковременный эндотрахеальный наркоз. После стандартной премедикации и вводного наркоза, осуществляемого с помощью калипсола (кеталара, кетамина, кетмина) и перевода больной на ИВЛ анестезию поддерживают с помощью закиси азота с кислородом с добавлением при необходимости препаратов для нейролептаналгезии.
Если операция ограничивается перфорацией головки и эксцеребрацией, как, например, при гидроцефалии, то ограничиваются внутривенным введением кеталара после премедикации атропином и препаратами нейролептаналгезии.
Можно использовать комбинированный наркоз масочным способом с сохранением спонтанного дыхания. Проводятся премедикация, вводный наркоз (тиопентал натрия, калипсол), основной наркоз поддерживается закисью азота с кислородом (в соотношении 2:1 или 3:1), при необходимости добавляется эфир или фторотан.
Обезболивание при эпизиои перинеотомни, зашивании разрывов промежности, влагалища, шейки матки. Эпизиои перинеотомия могут быть выполнены под местной инфильтрационной или пудендальной анестезией либо под продолжающейся длительной перидуральной анестезией. У многих рожениц бывает достаточно применить ингаляцию закиси азота с кислородом.
Операции, связанные с восстановлением целости влагалища и промежности, могут быть выполнены с использованием местной или пудендальной анестезии 0,5 % раствором новокаина либо 1,0 % раствором лидокаина.
Если местная или проводниковая анестезия почему-либо неприемлема (разрыв промежности III степени и др.), то возникает необходимость в общем обезболивании. Для этих целей при удовлетворительном состоянии роженицы вполне достаточно внутривенного наркоза калипсолом, кетамином по общепринятой методике. Целесообразно предварительное внутримышечное или внутривенное введение диазепама (10 мг) или дроперидола (5-10 мг), что в значительной мере позволяет углубить и продлить наркоз. При необходимости наркоз может быть продлен дополнительным дробным введением анестетика на срок, необходимый для завершения операции. Если операция затягивается более 20-25 мин, целесообразно дальнейшее поддержание наркоза осуществлять с помощью закиси азота с кислородом (в соотношении 3:1) и при необходимости углубить его внутривенным введением 10-20 мг промедола.
В особых ситуациях может быть применен эндотрахеальный наркоз.
Обезболивание при кесаревом сечении.
Метод обезболивания при кесаревом сечении определяется индивидуально с учетом состояния беременной, роженицы, плода, плановостью или экстренностью операции, наличием квалифицированного анестезиолога-реаниматолога.
К анестезии во время кесарева сечения предъявляют следующие требования: 1. Анестетик или комбинация лекарственных средств должны обеспечивать адекватную анестезию не только на момент интубации трахеи, но и в процессе операции. 2. Метод анестезии не должен оказывать депрессивного действия на плод, новорожденного и снижать сократительную активность матки. 3. Анестезия должна быть управляемой и обеспечивать максимально благоприятные условия для работы хирурга.
Эндотрахеальный наркоз.
Наиболее целесообразным методом обезболивания при кесаревом сечении является эндотрахеальный наркоз закисью азота в сочетании с нейролептическими и анальгетическими средствами. Довольно широко используется перидуральная анестезия, в редких случаях по индивидуальным показаниям может быть применена местная инфильтрационная анестезия.
Премедикация осуществляется путем внутримышечного введения 0,5-1 мл 0,1 % раствора атропина (или метацина) за 20-25 мин до начала наркоза, что способствует снижению ваготропных рефлексов, уменьшает гиперсекрецию слюнных желез и слизистой оболочки воздухоносных путей.
В случае срочной операции премедикацию проводят путем внутривенного введения атропина непосредственно перед началом вводного наркоза.
Вводный наркоз достигается внутривенным введением калипсола, оксибутирата натрия в зависимости от конкретной ситуации.
Перед началом вводного наркоза беременной (роженице) в течение 2-4 мин обязательно проводят ингаляцию закиси азота с кислородом в соотношении 2:1 или 3:1 масочным способом.
Кетамин (калипсол, кеталар, кетмин) вводят медленно внутривенно из расчета 1,1 – 1,2 мг на 1 кг массы тела женщины.
После внутривенного введения наркотической дозы эффект наступает через 30 с и длится 5-10 мин, после внутримышечного – 3-5 мин и длится 12-15 мин. При введении кетамина отмечается тенденция к повышению АД на 20-26 %, увеличению частоты сердечных сокращений на 20-30 % от исходного уровня.
Кетамин проникает через плацентарный барьер и в дозах более 1,2 мг/кг массы тела роженицы вызывает угнетение жизненно важных функций организма новорожденных.
Противопоказаниями к введению кетамина являются тяжелые формы гестоза, судорожные состояния, тяжелая сердечная недостаточность, патология мозговых сосудов, повышение давления спинномозговой жидкости, угроза разрыва матки, днекоординированная или чрезмерная родовая деятельность.
При быстром введении препарата возможна кратковременная задержка дыхания.
Оксибутират натрия. Этот препарат не оказывает отрицательного действия на миокард, функцию печени и почек, на сократительную деятельность матки. Он в значительной степени потенцирует действие других наркотических средств и анальгетиков. Препарат вводят внутривенно медленно в виде 20 % раствора в дозе 70 мг/кг массы тела женщины. Оксибутират натрия проникает через плацентарный барьер, однако не оказывает угнетающего действия на плод и новорожденного.
Противопоказан при тяжелой эпилепсии, брадикардии, артериальной гипертензии.
Барбитураты (тиопентал-натрий, гексенал). Барбитураты практически не влияют на сократительную деятельность матки, проникают через плацентарный барьер, причем степень депрессии плода прямо пропорциональна концентрации анестетика в крови матери.
Барбитураты вводят в виде 1-2 % раствора в дозе 6,8-8,0 мг/кг массы тела женщины.
Показаниями к применению являются исходная артериальная гипертензия, гестозы, судорожный синдром, заболевания ЦНС, высокая степень миопии, преждевременные роды, гипоксия плода.
Противопоказания – сердечная недостаточность, расстройства коронарной и общей гемодинамики, печеночная недостаточность, хронические заболевания почек, бронхиальная астма.
Интубацию трахеи осуществляют на фоне введения деполяризующих релаксантов (дитилин, листенон) в дозе 100-125 мг. После интубации трахеи ИВЛ возможна как аппаратом, так и ручным способом.
Пренатальная анестезия поддерживается закисью азота с кислородом в соотношении 3:1. При необходимости возможно добавление 50-70 мг калипсола или 50-100 мг барбитуратов.
Анестезия после извлечения плода осуществляется по общепринятым в анестезиологии методикам. Однако существующее мнение о том, что после извлечения плода поддержание наркоза возможно любым анестетиком в общепринятых в хирургии дозах, ошибочно. Это объясняется опасностью возникновения нарушений сократительной деятельности матки и развития гипотонического кровотечения.
Применяются следующие методы основного наркоза: 1. комбинированный эндотрахеальный наркоз с добавлением нейролептических и анальгетических средств (дроперидол в сочетании с фентанилом); 2. комбинированная атаралгезия (седуксен и фентанил); 3. комбинированная эндотрахеальная анестезия с дробным введением калипсола; 4. комбинированная эндотрахеальная анестезия с дробным введением марадола; 5. комбинированная электроаналгезия.
Во время наложения кожных швов прекращают ингаляцию закиси азота, а введение мышечных релаксантов – несколько раньше. Сразу после операции у роженицы восстанавливается самостоятельное дыхание, наступает пробуждение. При ясном сознании, адекватном дыхании, стабильных показателях гемодинамики осуществляют экстубацию и роженицу переводят в палату интенсивного наблюдения.
Нередко при проведении кесарева сечения бывает затруднена или невозможна интубация трахеи. Анестезиологу при этом необходимо обеспечить поддержание проходимости дыхательных путей и проведение оксигенации путем масочной вентиляции во время релаксации женщины. В случае неудачной попытки интубации от дальнейших попыток следует воздержаться в связи с возможным ухудшением жизненно важных функций не только у матери, но и у плода. В подобной ситуации возможно проведение внут-ривенной анестезии при спонтанном дыхании или использовании эпидуральной аналгезии при наличии времени к ее подготовке.
Осложнения эндотрахеального наркоза. Наиболее часто встречаются такие осложнения, как синдром компрессии нижней полой вены, осложнения, связанные с катетеризацией магистральных сосудов; трудные и неудачные интубации; регургитация и аспирация желудочного содержимого; развитие кислотно-аспирационного синдрома; бронхоларингоспазм; аллергические реакции; нестабильность гемодинамики; дыхательная недостаточность.
Наиболее частой причиной смерти, связанной с осложнением наркоза, является гипоксия с последующей остановкой сердца, обусловленная неудачными попытками интубации, интубацией в пищевод, развитием ларин1ои бронхоспазма. Тактика во что бы то ни стало интубировать больную порочна и чревата опасными осложнениями.
Специфическим осложнением, наблюдаемым только в акушерской анестезиологии, является нарушение гемодинамики и ритма сокращений сердца после введения в мышцу матки окситотических препаратов и простагландинов.
Эпидуральная (перидуральная) анестезия. Премедикация включает в себя введение 0,5 мл 0,1 % раствора атропина, 25-50 мг эфедрина (в отсутствие высокого АД) и 2,0 мл димедрола за 30 мин до пункции эпидурального пространства. Пункцию эпидурального пространства производят на уровне Thj(i-Thxn или Тпхц-L[ в положении женщины на правом боку. Для поддержания пролонгированной эпидуральной блокады самым простым способом является фракционное введение раствора в количестве 3-4 мл с интервалом 2-3 мин. На практике редко используют более 30 – 35 мл раствора. В дальнейшем для поддержания концентрации анестетика его дробно вводят по 10 мл через каждые 30 мин. У беременных доза уменьшается на 1/3 за счет уменьшения емкости эпидурального пространства вследствие венозного застоя в позвоночных венах.
Сон обеспечивается внутривенным (фракционным) введением барбитуратов, калипсола или седуксена.
При эпидуральной анестезии возможны осложнения: головная боль, боль в спине, артериальная гипотензия, дыхательная недостаточность, нарушение функции мочевого пузыря, прокол твердой мозговой оболочки, аллергия и др.
Глава 29. Организация акушерско-гинекологической помощи
Система организации акушерской и гинекологической помощи должна быть построена таким образом, чтобы обеспечивать лечебно-профилактической помощью беременных, рожениц, родильниц и гинекологических больных, способствовать сохранению репродуктивного здоровья женщины; кроме того, должны функционировать службы планирования семьи.В настоящее время основными задачами акушерови гинекологов являются: 1. уменьшение материнской заболеваемости и смертности; 2. снижение перинатальной и младенческой заболеваемости и смертности; 3. работа по планированию семьи, профилактике абортов, лечению бесплодия; 4. профилактика злокачественных заболеваний женских половых органов; 5. снижение гинекологической заболеваемости; 6. оказание социально-правовой помощи.
Амбулаторная акушерско-гинекологическая помощь
Женская консультация, являясь основным амбулаторным учреждением, оказывающим акушере ко-гинекологическую помощь, входит в структуру поликлиники, медико-санитарной части или родильного дома, реже является самостоятельной.Женские консультации проводят профилактические мероприятия, направленные на сохранение здоровья женщины, предупреждение осложнений беременности. Важным разделом работы женских консультаций являются предупреждение абортов, распространение знаний по контрацепции, санитарно-просветительская работа, направленная на формирование здорового образа жизни женщин.
Как правило, женские консультации объединены с родовспомогательным учреждением, гинекологическим стационаром, что дает возможность осуществлять преемственность в наблюдении за беременными, родильницами и гинекологическими больными. Данные о наблюдении за беременными (обменная карта или выписка из "Индивидуальной карты") направляются в стационар, где после лечения или родов составляется подробная выписка из истории родов (болезни), которая снова поступает в амбулаторное звено.
Учреждения по наблюдению за беременными должны быть связаны с противотуберкулезным, кожно-венерологическим, онкологическим диспансерами. В консультациях обеспечивают прием терапевта, стоматолога, венеролога, окулиста, эндокринолога, психотерапевта, проводят физиопсихопрофилактическую подготовку к родам, консультации по социально-правовым вопросам (консультации юриста).
В крупных городах выделяются базовые, лучшие по организационным формам работы и оснащению консультации, которые осуществляют консультативную помощь и распространяют передовой опыт работы.
В базовых консультациях организуются специальные кабинеты или выделяется время для приема женщин, страдающих бесплодием, экстрагенитальными (сердечно-сосудистыми, эндокринными и др.) заболеваниями во время беременности и вне ее, изосерологической несовместимостью крови матери и плода, невынашиванием.
Специальная помощь женщинам оказывается также в медико-генетических консультациях.
Задачи медико-генетической консультации следующие: 1. диагностика генетически обусловленных заболеваний; 2. выявление, учет, динамическое наблюдение за лицами с активно выраженными наследственными заболеваниями; 3. консультация больных, страдающих наследственными болезнями, и их родственников по поводу возможности выявления у них больного потомства; 4. оказание консультативной помощи сотрудникам медицинских учреждений и отдельным врачам по вопросам медицинской генетики.
Основные качественные показатели работы женской консультации – своевременность (до 12 нед) поступления беременной под наблюдение; выявление гестозов и других осложнений беременности; своевременность госпитализации беременных группы риска: с узким тазом, тазовым предлежанием, поперечным положением плода, крупным плодом, многоплодием, рубцом на матке, с резус-конфликтом, первородящие в возрасте старше 30 лет, а также с экстрагенитальными заболеваниями; процент применения специальных методов обследования и лечения; организация специализированных приемов.
Каждое амбулаторно-поликлиническое отделение для наблюдения за беременными должно быть оснащено лабораторной службой, кабинетами функциональной (УЗИ, КТГ, ЭКГ) и рентгенологической диагностики, физиотерапевтическим отделением.
Лечебно-профилактическая помощь беременным строится по диспансерному принципу, т.е. на основании активного наблюдения. Благоприятный исход беременности во многом зависит от обследования в ранние сроки, в связи с чем важна ранняя явка пациенток – до 11 – 12 нед беременности. При этом решается вопрос о возможности продолжения беременности у больных с экстрагенитальными заболеваниями или у женщин с осложненным акушерско-гинекологическим анамнезом. При первом обращении беременной в женскую консультацию на нее заводят "Индивидуальную карту беременной и родильницы", куда заносят все анамнестические и текущие данные наблюдения.
В первой половине беременности женщина посещает врача 1 раз в месяц, во второй – 2 раза в месяц. Женщины группы высокого риска должны посещать врача 1 раз в 10 дней.
Индивидуальная карта наблюдения помещается в "гнездо", которое соответствует дню ее будущей явки. Если беременная не является в назначенный срок, то ее вызывают к врачу или на дому ее посещает акушерка, т.е. осуществляется активный патронаж.
При выявлении ухудшения состояния беременной, страдающей экстрагенитальными заболеваниями, или развитии осложнений беременности пациентку на протяжении беременности необходимо госпитализировать (иногда несколько раз) либо в терапевтическое отделение, либо (чаще) в палату патологии беременных родильного дома. Для госпитализации целесообразно использовать специализированные родовспомогательные учреждения.
Развитие и исход беременности и родов в значительной степени определяются наличием факторов, которые неблагоприятно влияют на мать и плод. Своевременное выявление факторов риска нарушений состояния плода и беременности позволяет осуществлять дифференцированный подход к оказанию акушерской и неонатологической помощи, а также уменьшить перинатальные потери.
При первом обращении беременной в женскую консультацию необходимо определить степень риска развития акушерской и перинатальной патологии. Детальное обследование различными специалистами позволяет отнести беременную к определенной группе риска (или исключить его) и наметить индивидуальный план ведения пациентки в женской консультации.
Все факторы риска развития перинатальной патологии разделены на две группы – антенатальные и интранатальные. К антенатальным факторам относятся: 1. социально-биологические (юный и пожилой возраст беременных, вредные привычки, профессиональные вредности, низкий уровень культуры, конституция родителей); 2. особенности акушерско-гинекологического анамнеза; 3. экстрагенитальные заболевания; 4. осложнения настоящей беременности; 5. нарушение состояния плода.
Интранатальные факторы риска оказывают неблагоприятное влияние во время родов, их действие обусловлено состоянием матери, плода и плаценты.
По мере увеличения гестационного срока число беременных женщин группы высокого риска возможных осложнений для матери и плода возрастает более чем в 2 раза. Степень риска определяется суммой баллов. Балльная оценка факторов риска позволяет определить вероятность неблагоприятного исхода и удельный вес каждого фактора в развитии осложнений беременности. Разработанные шкалы (схемы) используются в основном для прогноза перинатальной патологии и ее предупреждения. К группе беремен-ных высокого риска относят женщин с суммарной оценкой перинатальных факторов 10 баллов и более, к группе среднего риска – 5-9 баллов, низкого – до 4 баллов.
Стационарная акушерская помощь
Организация работы в акушерских стационарах осуществляется по единому принципу в соответствии с принятыми в стране положениями. Общую врачебную помощь оказывают в участковой больнице с акушерскими койками; квалифицированную врачебную помощь – в районных, центральных районных больницах, городских родильных домах; многопрофильную квалифицированную и специализированную – в родильных отделениях многопрофильных больниц, акушерских отделениях областных больниц, межрайонных акушерских отделениях на базе крупных ЦРБ, в перинатальных центрах.Основные качественные показатели работы родильного дома: материнская заболеваемость и смертность; перинатальная заболеваемость и смертность; родовой травматизм детей и матерей.
Разнообразие типов акушерских стационаров предусматривает их диф-ференцированное использование.
Целесообразно выделить акушерские стационары 3 уровней в зависимости от степени риска развития перинатальной патологии.
В отделение участковой больницы, сельской ЦРБ (I уровень) целесообразно направлять повториорожающих (до 3 родов включительно) с неотягощенным акушерским анамнезом и первобеременных без акушерских осложнений и экстра генитальной патологии.
В родильное отделение городской ЦРБ, городской родильный дом (II уровень) направляют беременных с экстрагенитальными заболеваниями, гестозом, повышенным перинатальным риском, осложнениями во время данной или предыдущих беременностей.
В акушерские отделения областной или многопрофильной больницы, специализированный акушерский стационар, перинатальный центр (III уровень) направляются беременные с экстрагенитальными заболеваниями, тяжело протекающим гестозом, предлежанием и отслойкой плаценты.
Акушерский стационар имеет следующие основные подразделения: приемно-пропускной блок, физиологическое (первое) акушерское отделение (50-55 % от общего числа акушерских коек); отделение (палаты) патологии беременных (25 – 30 % от общего числа акушерских коек); отделение (палаты) для новорожденных в составе физиологического и обсервационного акушерских отделений; обсервационное (второе) акушерское отделение (20-25 % от общего числа акушерских коек); гинекологическое отделение (25-30 % от общего числа коек родильного дома).
Приемно-пропускное отделение предназначено для первичного обследования беременных и рожениц с последующим направлением их либо в физиологическое, либо обсервационное отделение (с признаками инфекции). Из приемно-пропускного отделения беременную можно направить в специализированный стационар при наличии мертвого плода, явного очага гнойно-воспалительной инфекции, экстрагенитальной патологии.
Отделения патологии беременных организуются в родильных домах (отделениях) на 100 акушерских коек и более.
В отделение патологии госпитализируют беременных с экстрагенитальными заболеваниями (сердца, сосудов, крови, соединительной ткани, почек и др.); осложнениями беременности (ранние токсикозы, гестозы беременных, угроза прерывания беременности, фетоплацентарная недостаточность и др.); с неправильным положением плода, отягощенным акушерским анамнезом. В отделении работают акушеры-гинекологи, терапевт родильного дома. В этом отделении предусматривается кабинет функциональной диа-гностики, оснащенный аппаратами для оценки состояния беременной и плода (ФКГ, ЭКГ, КТГ, аппарат ультразвукового сканирования и др.).
В отделении оборудована малая операционная, где выполняют кордои амниоцентез, наложение швов на шейку матки и другие малые операции.
Физиологическое (первое) отделение включает в себя санитарный пропускник, входящий в состав приемно-пропускного отделения, родовое отделение, послеродовые палаты, отделение для новорожденных, выписную комнату.
Родовое отделение состоит из предродовых палат, палаты интенсивного наблюдения, родовых палат (родильных залов), операционного блока, включающего большую операционную; предоперационную, наркозную, малые операционные, помещения для хранения донорской крови, плазмы, переносной аппаратуры и др.
Основные палаты родового отделения (предродовые, родовые, малые операционные) должны дублироваться, чтобы работа в них чередовалась с тщательной санитарной обработкой. Родовые палаты (родильные залы) должны закрываться для санитарной обработки не реже чем через 3 дня работы. Предродовые палаты целесообразнее создавать не более чем на 2 кровати. Необходимо стремиться к тому, чтобы каждая женщина рожала в отдельной палате. Предродовые палаты должны быть оборудованы подводкой кислорода, закиси азота и оснащены наркозной аппаратурой для обезболива2ния родов. На 1 койку в предродовой палате следует предусмотреть 7-9 м площади.
В родильном зале родильница 2 ч находится под наблюдением медицинского персонала в связи с опасностью раннего послеродового кровотечения, затем ее вместе с ребенком переводят в послеродовое отделение для совместного пребывания.
Палата интенсивного наблюдения и лечения предназначена для беременных и рожениц с акушерскими осложнениями (преэклампсия, эклампсия) или экстрагенитальными заболеваниями (сердечно-сосудистые заболевания, гипертоническая болезнь и др.). В палате на 1-2 койки площадью не менее 26 м с тамбуром для изоляции больных от шума должны быть централизованная подача кислорода, закиси азота, наркозная аппаратура, необходимые медикаменты.
Операционный блок состоит из большой операционной (не менее 36 м ) с предоперационной (не менее 22 м ) и наркозной, двух малых операционных и подсобных помещений. В большой операционной родового отделения производят в основном кесарево сечение и другие чревосечения. В 2малых операционных родового блока (2 комнаты площадью не менее 24 м ) выполняют акушерские операции, не связанные с чревосечением (операции наложения акушерских щипцов, вакуум-экстракции, извлечения плода за тазовый конец, осмотр родовых путей, зашивание разрывов мягких родовых путей и др.).
Послеродовое отделение имеет в своем составе палаты для родильниц, комнаты для сцеживания и сбора грудного молока, для введения вакцины БЦЖ, процедурную, бельевую, комнату гигиены, столовую и комнату дневного пребывания родильниц.
В физиологическом послеродовом отделении развертывается 45 % всех акушерских коек родильного дома (отделения).
В послеродовом отделении следует соблюдать цикличность при заполнении палат, т.е. заполнение палат родильницами "одного дня" с тем, чтобы на 5-6-й день их одновременно можно было выписать. Если по состоянию здоровья женщины задерживаются в стационаре, их переводят в "разгрузочные" палаты с тем, чтобы полностью освободить и подвергнуть санитарной обработке палату, функционировавшую в течение 5-6 дней.
Обсервационное (второе) акушерское отделение представляет собой в миниатюре самостоятельный родильный дом с соответствующим набором помещений. Каждое обсервационное отделение имеет приемно-смотровую часть, предродовую, родовую, послеродовые палаты, палаты для новорожденных (боксированные), операционную, мани пуля ционную, буфет, санитарные узлы, выписную комнату.
В обсервационном отделении оказывают медицинскую помощь беременным, роженицам, родильницам и новорожденным с заболеваниями, которые могут являться источниками инфекции и представлять опасность для окружающих.
Особое внимание обращается на организацию медицинской помощи новорожденным в акушерском стационаре. В родильном отделении организуют мани пуля ционно-туалетные комнаты при родовых палатах. В этих помещениях обрабатывают новорожденных, им оказывают реанимационную помощь. Комнаты должны быть оборудованы специальными столами с подогревом и набором дыхательной аппаратуры, инфузоматами и лекарственны-ми средствами; необходимы детский ларингоскоп, аппараты для отсасывания слизи, набор интубационных трубок и др.
В манипуляционно-туалетной комнате для новорожденных должны быть ванна для купания детей, емкости с антисептиками для обработки рук персонала.
Палаты для новорожденных выделяют в физиологическом и обсервационном отделениях. В физиологическом отделении наряду с постами для здоровых новорожденных устанавливают пост для недоношенных и детей, родившихся в асфиксии, с клинической картиной церебральных и дыхательных нарушений, перенесших хроническую внутриутробную гипоксию. Сюда же помещают детей, родившихся при оперативных родах, переношенной беременности.
В родильных домах для интенсивной терапии и выхаживания недоношенных следует выделять 15-20 % от числа коек для новорожденных. Число коек для новорожденных в обсервационном отделении должно быть не менее 20 % от общего числа коечного фонда в стационаре. В отделении новорожденных выделяют отдельные помещения для пастеризации грудного молока. При физиологическом течении послеродового периода целесообразно шире использовать совместное пребывание новорожденных вместе с родильницами.
В родильных домах имеются лаборатории, лечебно-диагностические кабинеты (физиотерапевтический, рентгеновский).
Перинатальные центры
Для повышения эффективности акушерской помощи создаются перинатальные центры, которые предназначаются для оказания амбулаторной и стационарной высококвалифицированной медицинской помощи женщинам группы высокого риска развития перинатальной патологии и их детям.В центре осуществляется пренатальная диагностика угрожаемых и патологических состояний матери и плода, при необходимости проводится корригирующая терапия, выполняется родоразрешение женщин группы высокого риска развития перинатальной патологии, своевременно и адекватно проводится интенсивная терапия новорожденным, в том числе недоношенным.
Для организации перинатального центра необходимы целенаправленное финансирование и оснащение, создание в регионе координированной, взаимодействуюшей системы акушерской и неонатальной медицинской помощи, повышение квалификации врачей и медицинского персонала. В перинатальный центр входят консультативно-диагностическое отделение, акушерский и педиатрический блоки, обязательны анестезиолого-реанимационные подразделения в акушерских и неонатологических отделениях, отделение гравитационной хирургии крови (донорство, аутодонорство).
Материнская смертность и пути ее снижения
Важнейшим показателем качества и уровня организации охраны здоровья матери и ребенка является показатель материнской смертности.Всемирная организация здравоохранения (ВОЗ) определяет понятие материнской смертности как смерть женщины во время беременности или в течение 42 дней после ее окончания независимо от причин, связанных с протеканием беременности или ее ведением, не связанных с несчастными случаями. Общепринято вычислять материнскую смертность в абсолютных числах смертей беременных, рожениц или родильниц на 100.000 родов живыми новорожденными.
Материнскую смертность классифицируют следующим образом. 1. Смерть, непосредственно вызванная акушерскими причинами, т.е. наступившая вследствие акушерских осложнении беременности, родов, послеродового периода, а также в результате неправильной тактики лечения. 2. Смерть, косвенно обусловленная акушерской причиной, т.е. наступившая в результате существовавшей ранее болезни, прямым образом не связанная с беременностью или другими акушерскими причинами, но проявления которой были усилены физиологическими эффектами беременности. 3. Случайная смерть, не связанная с беременностью, родами, послеродовым периодом или ее осложнениями и лечением.
Таким образом, показатель материнской смертности позволяет оценить все потери беременных от абортов, внематочной беременности, акушерской и экстрагенитальной патологии в течение всего периода гестации и послеродового периода.
Ежегодно у 200 млн женщин в мире наступает беременность, у 137,6 млн она заканчивается родами. Каждый год в связи с беременностью и родами умирают 509 тыс. женщин.
В развивающихся странах доля родов составляет 86 % от числа родов во всем мире, а материнская смертность – 99 % от всех материнских смертей в мире.
В разных частях света материнская смертность резко колеблется: в Северной Америке она составляет 10-12 на 100 000 родов живыми новорожденными, в Европе – 20-23.
В большинстве экономически развитых стран в настоящее время показатель материнской смертности ниже 10. Наиболее низок (в пределах 1-2) он в странах, где высокий уровень экономики сочетается с решением социальных проблем, хоро-шей защитой окружающей среды, высокими качеством оказания медицинской по-мощи и санитарной культурой населения (Канада, Швеция, Бельгия, Люксембург, Исландия, Дания, Швейцария, Израиль). В богатых странах Персидского залива, где наряду с развитой экономикой имеется мощная социальная поддержка населения (Объединенные Арабские Эмираты, Катар, Йемен, Оман), этот показатель составляет 4-12.
Следует отметить, что значительное улучшение (падение) показателя материнской смертности во всех ныне экономически развитых странах началось примерно с середины 30-х годов нынешнего столетия (в то время этот показатель в среднем составлял 500).
Главными факторами, определившими падение показателя материнской смертности почти в 100 раз, явились, кроме экономических, социальных к гигиенических факторов, успехи в профилактике и лечении инфекционных заболеваний, создание перинатальных центров и выявление пациенток групп риска развития осложнений во время беременности и родов, существенное улучшение дородовой диагностики и дородового ведения беременных, в ряде стран развитие семейной медицины, одной из важнейших задач которой является улучшение дородового наблюдения всех беременных. Важное значение имело также совершенствование служб крови – возможность ее фракционирования и использования ее компонентов для трансфузии. И наконец, к медицинским факторам, без которых немыслимо было бы улучшение охраны здоровья матерей и снижение материнской смертности, явились развитие фармацевтики (имеется в виду фармацевтическая индустрия), наличие хорошо оснащенных родильных домов.
В развивающихся странах в структуре причин материнской смертности доминируют сепсис, акушерские кровотечения, послеабортные осложнения и гестозы.
В абсолютном же большинстве высокоразвитых стран мира в структуре причин матери некой смертности главными являются легочные эмболии, гипертензивные состояния у беременных, внематочная беременность. На долю кровотечений и сепсиса приходится 5-10 %.
В Российской Федерации показатель материнской смертности остается высоким и составляет в последние годы в среднем 50 на 100 000 живорожденных. Это в 6-8 раз выше, чем в США, Англии, Франции, Германии, и в 40-50 раз выше, чем в Канаде, Швеции и Швейцарии.
В настоящее время на фоне резкого снижения рождаемости высокий показатель материнской смертности заставляет обращать особое внимание на организацию и качество медицинской помощи беременным.
Анализ структуры причин материнской смертности в России свидетельствует зачастую о недостаточной квалификации акушеров-гинекологов, а акушерские стационары не всегда имеют необходимые возможности для оказания всесторонней квалифицированной помощи при тяжелых акушерских осложнениях.
На основании экспертной оценки причин материнской смертности их можно обобщить в следующем виде: 12-15 % – тяжелая экстрагенитальная патология (заболевания сердечно-сосудистой системы, гепатит, рак и др.); 25 % – ятрогенные причины (ошибки в диагностике, акушерской тактике, интенсивной терапии); 60 % – акушерские осложнения на тяжелом преморбидном фоне.
Профилактика гнойно-септических заболеваний в акушерских стационарах
Проблема инфекции при беременности, в послеродовом периоде, инфекционные заболевания у плода и новорожденного являются наиболее актуальными для акушерства.За последние годы произошли коренные изменения в подходах к профилактике гнойно-септических заболеваний в акушерских стационарах. Если ранее ведущим этиологическим фактором была стафилококковая инфекция, а путь передачи – воздушно-капельный, то в настоящее время в родильном стационаре преобладают эндогенная инфекция и контактные пути передачи. Источником инфекции при воздушно-капельном пути передачи являются носители условно-патогенной флоры, в частности госпитальных штаммов стафилококка (персонал, больные женщины, новорожденные). При эндогенной инфекции развитие заболевания обусловлено снижением иммунитета вследствие осложненных родов или суперинфицирования через медицинские инструменты и предметы ухода.
Условно современную инфекцию в родовспомогательном стационаре можно рассмотреть на примере СПИДа. Будучи носительницей или больной в начальных стадиях, женщина с большой вероятностью инфицирует плод, поэтому у нее родится больной ребенок, т.е. возникает внутриутробная инфекция у плода. После родов на фоне возможного акушерского кровотечения и стрессовой ситуации происходит либо прогрессирование СПИДа, либо развитие бактериального заболевания вследствие снижения иммунитета. Передача инфекции другим женщинам и детям в основном зависит от использования многоразового медицинского инструментария, медицинских систем и предметов ухода за больными. Эндогенная инфекция не засоряет воздушный бассейн и не может передаваться воздушно-капельным путем.
Очень важно подготовить женщину к беременности: вылечить хламидиоз, бактериальный вагиноз, кандидоз, поддерживать иммунитет на достаточном уровне. Следует обратить особое внимание на питание беременной, ее режим, психологическую обстановку в семье, обязательно использовать витамины, при наличии анемии – препараты железа.
Особую заботу следует проявлять при стерилизации инструментов. Предпочтительно использовать одноразовый инструментарий и предметы ухода.
Перинатальная смертность и пути ее снижения
Перинатальная смертность – смертность в связи с родами: погибшие плоды до родов, начиная с 28 нед беременности (антенатальная гибель), во время родов (интранатальная) и новорожденные в течение первых 7 дней (168 ч) после рождения. Перинатальная смертность рассчитывается на 1000 живорожденных.Погибшие анте- и интранатально – мертворожденные, их число определяет понятие "мертворождаемость", а число умерших в первые 7 дней – понятие "неонатальная смертность".
Перинатальная смертность отражает социальное положение населения, здоровье нации, уровень медицинской помощи вообще и акушерской в частности и учитывается во всех странах.
В развитых странах Европы перинатальная смертность составляет меньше 1,0 %в (0,5-0,45 %).
В нашей стране в последние 5 лет перинатальная смертность составляет около 17 %о, хотя в отдельных учреждениях акушерского профиля она ниже 10 %о (перинатальная смертность в России в 1991 г. была 1-7,9 %о, в 1995 г. 16,1 Ж.).
Для правильного исчисления перинатальной смертности (ПС) чрезвычайно важной является унификация таких понятий, как живорождение, мертворождение, определение массы тела ребенка при рождении.
В течение длительного времени в СССР критерием живорожденности считалось появление у ребенка дыхания после рождения. Если он рождался с сердцебиением, но без дыхания, то его считали мертворожденным. Кроме того, рождение плодов массой от 500 до 1000 г нигде не учитывалось. Это приводило к тому, что даже при наличии признаков жизни у плодов массой до 1000 г не проводили реанимационных мероприятий.
В 1992 г. в Российской Федерации было принято положение, по которому регламентированы формы учета родившихся живыми, мертвыми, подлежащими регистрации, а следовательно, и учету. Приводим выдержки из приказа, действующего в Российской Федерации, "О переходе на рекомендованные Всемирной организацией здравоохранения критерии живорождения и мертворождения" (1992).
Новорожденные (плоды), родившиеся с массой тела до 2500 г, считаются плодами с низкой массой при рождении: до 1500 г -с очень низкой; до 1000 г -с экстремально низкой.
Учреждения здравоохранения осуществляют регистрацию в медицинской документации всех родившихся живыми и мертвыми, имеющих массу тела при рождении 500 г и более, независимо от наличия признаков жизни.
В органах загса регистрации подлежат: 1. родившиеся живыми или мертвыми с массой тела 1000 г и более (или, если масса при рождении неизвестна, длиной тела 35 см и более, или при сроке беременности 28 нед и более), включая новорожденных с массой тела 1000 г – при многоплодных родах; 2. все новорожденные, родившиеся с массой тела от 500 до 999 г, также подлежат регистрации в органах загса в тех случаях, если они прожили более 168 ч после рождения (7 сут).
На каждый случай смерти в перинатальном периоде заполняется "Свидетельство о перинатальной смерти". Плоды, родившиеся с массой тела 500 г и более, подлежат патологоанатомическому исследованию.
В целях международной сопоставимости отечественной статистики при расчете показателя перинатальной смертности используется число плодов и новорожденных с массой тела 1000 г и более (или, если масса при рождении неизвестна, длиной тела 35 см и более, или при сроке беременности 28 нед и более).
В отраслевую статистику перинатальной смертности (в соответствии с рекомендациями ВОЗ) включаются все случаи рождения плода и новорожденного с массой тела 500 г и более (или, если масса при рождении неизвестна, длиной тела 25 см и более, или при сроке беременности 22 нед и более).
В целях сопоставимости международной и отечественной статистики и в связи с переходом на критерии живорождения и мертворождения, принятые ВОЗ, органам и учреждениям здравоохранения следует придерживаться следующих определений и понятий живорождения, мертворождения, перинатального периода и параметров физического развития новорожденного (плода). 1. Живорождение. Живорождением является полное изгнание или извлечение продукта зачатия из организма матери вне зависимости от продолжительности беременности, причем плод после такого отделения дышит или проявляет другие признаки жизни, такие как сердцебиение, пульсация пуповины или произвольные движения мускулатуры, независимо от того, перерезана ли пуповина и отделилась ли плацента. Каждый продукт такого рождения рассматривается как живорожденный. 2. Мертворождение. Мертворождением является смерть продукта зачатия до его полного изгнания или извлечения из организма матери вне зависимости от продолжительности беременности. На смерть указывает отсутствие у плода после такого отделения дыхания или любых других признаков жизни, таких как сердцебиение, пульсация пуповины или произвольные движения мускулатуры. 3. Масса при рождении. Массой при рождении считается результат первого взвешивания плода или новорожденного, зарегистрированный после рождения. Эта масса должна быть установлена предпочтительно в течение первого часа жизни до того, как в постнатальном периоде произойдет значительная потеря массы. Измерение длины новорожденного (плода) должно обязательно производиться при вытянутом положении на горизонтальном ростомере.
Задачей акушеров-гинекологов всех стран мира является снижение перинатальной смертности. Однако не только перинатальная смертность имеет социальное значение. Не меньшую (если не большую) значимость представляет собой перинатальная заболеваемость, которая существенно сказывается на здоровье будущих поколений.
Здоровье новорожденных тесно связано со здоровьем родителей, особенно женщин, течением беременности, родов и раннего периода новорожденности.
Однако в данной проблеме имеются два аспекта: социальный и медицинский, которые тесно связаны между собой.
К социальным факторам, способствующим развитию заболеваний у девочек и женщин, осложненному течению беременности и родов, перинатальной патологии, относятся следующие: неблагоприятная экологическая обстановка; производственные вредности; низкий экономический уровень семей и неадекватность питания; вредные привычки родителей (алкоголизм, курение, наркомания); недостаточный уровень мероприятий по планированию семьи – неснижающаяся частота абортов; психологическая обстановка в стране; недостаточная культура населения, иногда невозможность оказания квалифицированной медицинской помощи беременным и роженицам.
Устранить неблагоприятные социальные факторы зачастую не представляется возможным. Медицинские же аспекты снижения перинатальной заболеваемости и смертности являются чрезвычайно важными для ученых, организаторов здравоохранения, для практикующих специалистов: акушеров-гинекологов, неонатологов, генетиков.
В последние годы в поликлинических условиях и в стационарах создаются службы пренатальной (ранние сроки гестации), анте-, интраи постнатальной охраны здоровья плода и новорожденного. При этом необходимо оснащение современными УЗ-аппаратам и, кардиомониторами, биохимическими лабораториями, лабораториями по определению бактериальной флоры, вирусов, иммуноглобулинов.
Начиная с ранних сроков беременности, у женщин групп риска следует пытаться выявить генетическую и инфекционную патологию для решения вопроса о дальнейшем ведении беременности. Не менее важным является определение совместимости крови матери и плода по группе и резус-фактору. Во многих крупных базовых консультациях организуются кабинеты пренатальной диагностики.
Антенатальная охрана плода заключается в систематическом наблюдении за течением беременности, состоянием плода (УЗИ, КТГ), лечении экстрагенитальных заболеваний и осложнений беременности, которые неблагоприятно влияют на фетоплацентарную систему.
Охрана здоровья ребенка в интранатальном и постнатальном периодах определяется уровнем квалификации врачей и техническим оснащением родовспомогательного стационара.
На показатель перинатальной смертности значительно влияют преждевременные роды. Рождение недоношенных детей, особенно с низкой массой (менее 1500 г), сопровождается очень высокой перинатальной смертностью.
Чрезвычайно важным для здоровья плода является репродуктивное здоровье матери, которое может нарушаться при гинекологических заболеваниях в детском и подростковом возрасте. Отсюда вытекает необходимость профилактики гинекологических заболеваний (профилактические осмотры в детских садах и школах), сексуальное воспитание молодежи.
Огромную роль в сохранении репродуктивного здоровья родителей имеют центры планирования семьи, деятельность которых направлена на предотвращение абортов, а следовательно, на сохранение репродуктивной функции женщин.
Снижение перинатальной смертности в нашей стране является особенно важным потому, что рождаемость в настоящее время чрезвычайно низкая.
Медико-генетическое консультирование и пренатальная диагностика наследственных заболеваний
Наследственные заболевания (нарушение генетического аппарата) и врожденные пороки развития (без нарушения генетического аппарата) занимают 2-3-е место среди всех причин перинатальной смертности. Известно более 2500 нозологических форм наследственных заболеваний, которые поражают все органы, системы организма и нарушают его функции. Тяжелая наследственная патология, вызывающая гибель или инвалидизацию ребенка, встречается в 1-2 % случаев.Для большинства наследственных заболеваний, как правило, отсутствует эффективная терапия, поэтому важная роль принадлежит профилактике этой патологии, которую осуществляют с помощью медико-генетического консультирования, пренатальной диагностики, определения гетерозиготного носительства и преклинической диагностики.
Существуют следующие группы наследственных заболеваний: многофакторные, моногенные и хромосомные.
Самая большая группа заболеваний, выявляемых при медико-генетическом консультировании, – это многофакторные, или полигенные, заболевания. Они обусловлены взаимодействием нескольких генов и факторов окружающей среды. В одних случаях превалирует наследственный, в других – средовой компонент.
Среди факторов окружающей среды, которые могут оказать неблагоприятное воздействие на плод, особенно в I триместре беременности, следует выделить различные химические соединения, ионизирующую радиацию, лекарственные препараты (антибластические, некоторые антибиотики и др.), вирусные заболевания (например, краснуха).
Генетическую опасность ионизирующей радиации для человека оценить очень трудно, поэтому все манипуляции, при которых происходит облучение гонад, нужно проводить по строгим показаниям. Особенно нежелательны такие исследования, как урография, гистеросальпингография в самые ранние сроки беременности. После приема цитостатических препаратов необходимо предохранение от беременности в течение 3 мес.
Генетический риск повторного появления многофакторной патологии обычно не превышает 5 %. К таким заболеваниям относятся изолированные пороки развития (например, анэнцефалия, различные грыжи и расщелины, пороки сердца), некоторые формы шизофрении, гипертоническая болезнь, атеросклероз и др.
Вторая группа – моногенные заболевания обусловлены патологией одного гена. Известны 3 типа моногенных заболеваний: с аутосомно-доминантным, аутосомно-рецессивным типом наследования и заболевания, сцепленные с полом.
Заболевания с аутосомно-доминантньш типом наследования характеризуются одинаковой частотой поражения лиц разного пола; наличием патологии у одного из родителей; передачей заболевания из поколения в поколение, т.е. по вертикали в 50 % случаев.
К этим заболеваниям относятся ахондроплазия, синдром Марфана, синдром Элерса-Данлоса, нейрофиброматоз и др. Как правило, эти заболевания жизненно не опасны, имеют высокую проявляемость (пенетрантность), четкий тип наследования.
Диагноз и прогноз для потомства не вызывают особых трудностей. Оценка степени риска усложняется, если болезнь не прослеживается в родословной, а появляется спорадически. В этом случае она возникает впервые в семье вследствие изменений (мутации) в половых клетках одного из родителей, прогноз для потомства при последующих беременностях обычно благоприятный. Рождение ребенка с ахондроплазией у фенотипически здоровых родителей не грозит повторением этого заболевания у последующих детей.
Заболевания с аутосомно-рецессивным типом наследования характеризуются одинаковой частотой поражения лиц разного пола; отсутствием болезни у родителей (они, как правило, являются гетерозиготными носителями патологического гена); передачей заболевания от здоровых родителей детям, т.е. по горизонтали в 25 % случаев; увеличением частоты их при кровнородственных браках. Эти заболевания имеют тяжелое течение и высокую летальность. Примерами подобных заболеваний являются многочисленные энзимопатии, фенилкетонурия, врожденная гиперплазия коры надпочечников (адреногенитальный синдром), гипотиреоз, муковисцидоз; некоторые наследственные заболевания кожи (буллезный эпидермолиз, ихтиозиформная эритродермия) и др.
При заболеваниях, сцепленных с полом, обычно поражаются лица мужского пола; мать является гетерозиготной носительницей патологического гена; заболевание передается 50 % сыновей; все дочери больного отца будут гетерозиготными носительницами.
Примерами заболевания этого типа являются гемофилия, миопатия Дюшенна, агамма глобул и немия и др.
Третью группу наследственных заболеваний представляют хромосомные болезни. Для них характерно наличие множественных врожденных пороков развития; нарушение функции органов и систем, в первую очередь нервной и эндокринной; отставание в умственном развитии. Клиническими симптомами хромосомных заболеваний могут явиться аменорея и бесплодие. Заболевания, обусловленные численным изменением хромосом, возникают случайно и при последующих беременностях повторяются очень редко. Их возникновению способствуют те же факторы, которые обусловливают многофакторную патологию. Наиболее распространенными заболеваниями этой группы являются болезнь Дауна (трисомия по 21-й паре хромосом), синдром Патау (трисомия по 13-й паре хромосом), синдром Эдвардса (трисомия по 18-й паре хромосом), синдром Шерешевского-Тернера (моносомия X), синдром Клайнфелтера (кариотип 47, XXY) и др. Четко установлено влияние возраста матери на рождение ребенка с болезнью Дауна. Для молодых женщин (до 35 лет) популяционный риск составляет 1:700. Для женщин в возрасте 35-40 лет он увеличивается до 1:300 – 1:100, а после 40 лет до 1:100 1:40.
Кроме количественных, возможны структурные изменения хромосом, которые характеризуются потерей (делецией) или перемещением (транслокацией) части или целой хромосомы на другую. Эти формы хромосомных заболеваний в основном имеют наследственный характер. Вероятность рождения больного ребенка в таких семьях составляет 2-20 % и зависит от характера перестройки, пола и возраста носителя.
Медико-генетическое консультирование – один из видов специализированной помощи населению, направленной главным образом на выявление генетического риска и предупреждение появления в семье больных с наследственной патологией.
Основные задачи медико-генетического консультирования: 1. установление точного диагноза наследственного заболевания; 2. определение типа наследования заболевания в данной семье; 3. расчет риска повторения болезни в семье; 4. определение наиболее эффективного способа профилактики.
Генетический риск – это вероятность появления определенной наследственной патологии у обратившегося за консультацией или у его потомков. Он определяется путем расчетов, основанных на анализе генетических закономерностей, или с помощью эмпирических данных. Возможность рассчитать генетический риск зависит в основном от точности диагноза и полноты генеалогических данных.
Генетический риск до 5 % оценивается как низкий и не считается противопоказанием к деторождению в данной семье. Риск от 6 до 20 % принято считать средним. В этом случае рекомендации относительно планирования дальнейших беременностей зависят от тяжести медицинских и социальных последствий конкретного наследственного заболевания и от возможности проведения пренатальной диагностики. Риск более 20 % считается высоким, и в отсутствие методовпренатальной диагностики соответствующей патологии дальнейшее деторождение в данной семье не рекомендуется.
Основные показания к направлению супружеских пар на медико-генетическое консультирование: 1. рождение ребенка с наследственными заболеваниями или пороками развития; 2. наличие у одного из супругов хромосомной перестройки, наследственного заболевания или порока развития; 3. кровнородственный брак; 4. возраст матери старше 35 лет; 5. неблагоприятное воздействие факторов окружающей среды в ранние сроки беременности; 6. наличие самопроизвольных выкидышей, мертворождения, первичной аменореи, первичного бесплодия супругов; 7. угроза прерывания беременности с ранних сроков; 8. прием лекарственных препаратов в ранние сроки беременности.
В зависимости от характера заболевания при консультировании используют различные методы обследования больного и его родственников, основными из которых являются клинике-генеалогический, онтогенетический, биохимический, иммунологический, молекулярно-генетический (ДНК-анализ), методы пренатальной диагностики.
Клинико-генеалогический метод, или метод сбора и анализа родословной, дает необходимую информацию для постановки диагноза или установления этиологической природы заболевания. Одной из основных задач генеалогического метода является установление наследственного характера заболевания с последующим уточнением его формы и типа передачи.
Цитогенетический метод позволяет непосредственно изучить весь хромосомный набор человека (кариотип). Определение кариотипа показано детям с множественными пороками развития или умственной отсталостью их родителей; женщинам, страдающим невынашиванием беременности, имеющим в анамнезе мертворожденных или умерших от неясных причин детей в раннем возрасте; лицам с первичной аменореей или нарушением половой дифференцировки.
Внедрение методов пренатальной диагностики значительно повысило эффективность медико-генетического консультирования и позволило перейти от вероятностного к однозначному прогнозу здоровья потомства. Применяют две группы методов пренатальной диагностики – неинвазивные и инвазивные.
Неинвазивные методы пренатальной диагностики (ультразвуковое исследование в I и II триместрах, определение альфа-фетопротеина, хорионического гонадотропина и неконъюгированного эстриола в сыворотке крови матери во II триместре беременности, выявление внутриутробного инфицирования) являются скринирующими, т.е. они могут быть использованы при обследовании всех беременных.
К инвазивным методам пренатальной диагностики относятся амниоцентез, биопсия хориона (или плаценты), кордоцентез (получение крови плода из сосудов пуповины) и биопсия кожи плода. С их помощью получают клетки плода для цитогенетического, биохимического, молекулярно-генетического и других видов анализа.
Особое место в пренатальной диагностике занимает ультразвуковое исследование (УЗИ). Существует четкая зависимость между характером порока и сроком его выявления с помощью УЗИ. Ряд пороков развития можно диагностировать в конце I – начале II триместра беременности. К таким порокам развития относятся анэнцефалия, голопрозэнцефалия, экзэнцефалия, лимфангиомы шеи, омфалоцеле, гастрошизис, неразделившиеся плоды, амелии, ахондрогенез, черепно-мозговые и спинномозговые грыжи, поликистоз почек, несовершенный остеогенез и др. Точность диагностики этих пороков развития к концу II триместра беременности приближается к 100 %. Точность диагностики врожденных пороков плода в популяции составляет 87 %, в группе повышенного риска – 90 %.
Отсутствие эхографи чес кого изображения врожденного порока развития при первом или повторном УЗИ еще не исключает его появления в более поздние сроки. Ложноотрицательные результаты в основном обусловлены проведением исследования до появления видимых анатомических изменений, наличием небольших пороков развития (чаще всего сердца, лицевой части черепа, дистальных отделов конечностей).
Для своевременной диагностики врожденных пороков развития плода необходима четкая организация ультразвукового скрининга: его необходимо проводить всем беременным не менее 3 раз в течение беременности (в 10-12, 20-22 и 30-32 нед), а по показаниям (анамнез или подозрение на порок развития) чаще (через 3-4 нед) и с тщательным исследованием всех органов и систем плода.
Определение альфа-фетопротеина и других маркеров в сыворотке крови женщины производится на 16-20-й неделе беременности.
Повышение содержания альфа-фетопротеина в сыворотке крови беременных дает возможность выделить среди них женщин с риском развития порока нервной системы плода (расщелины спинного мозга, анэнцефалия). В дальнейшем диагноз уточняется с помощью УЗИ и определения альфафетопротеина в амниотической жидкости.
Установлена связь между снижением содержания альфа-фетопротеина в сыворотке крови матери и болезнью Дауна у плода. Низкий уровень альфа-фетопротеина в сочетании с увеличением содержания хорионического гонадотропина и уменьшением уровня эстриола является показанием к проведению амниоцентеза или кордоцентеза с последующим определением кариотипа плода.
В ранние сроки беременности для пренатальной диагностики применяется биопсия хориона. Оптимальным для выполнения этой процедуры является срок 8-11 нед беременности. Получение ткани хориона показано в следующих случаях: 1. изменение кариотипа у одного из родителей; 2. возраст матери старше 35 лет; 3. наличие в семье ребенка с хромосомной патологией, сцепленными с полом заболеваниями, нарушениями обмена веществ, гемоглобинопатиями.
Иногда в качестве диагностического материала используют ткань плаценты, полученную с помощью плацентоцентеза во II триместре беременности. Показания к проведению плацентоцентеза те же, что и к биопсии хориона.
Амниоцентез во II триместре беременности как метод пренатальной диагностики получил наиболее широкое распространение. В настоящее время применяется практически только трансабдоминальный метод. Оптимальным для его проведения является срок 17-20 нед беременности. При исследовании амниотической жидкости можно определить кариотип плода, Уровень содержания различных ферментов, гормонов, альфа-фетопротеин; провести анализ ДНК и, таким образом, диагностировать хромосомную патологию плода, некоторые аутосомно-рецессивные и наследуемые сцепленные с полом заболевания, пороки развития ЦНС. В ряде случаев амниоцентез можно провести в I триместре беременности для диагностики врожденной гиперплазии коры надпочечников и хромосомной патологии.
Основным методом получения крови плода является кордоцентез (пункция сосудов пуповины). Его можно проводить в амбулаторных условиях начиная с 17 нед беременности. Исследуя кровь плода, можно диагностировать наследственные иммунодефицитные состояния, болезни крови, внутриутробное инфицирование плода, метаболические нарушения. В течение 3-4 нед можно определить кариотип плода.
Во II триместре беременности возможно проведение биопсии кожи плода. Биопсию кожи плода и последующее морфологическое исследование проводят с целью пренатальной диагностики некоторых заболеваний кожи, в первую очередь с аутосомно-рецессивным типом наследования, в частности летального буллезного эпидермолиза, ихтиозиформной эритродермии Брока. Помимо перечисленных, существуют другие инвазивные методы пренатальной диагностики, такие как фетоамниография и фетоскопия. Ранее их использо-вали для выявления некоторых пороков развития и получения крови и кожи плода во II триместре беременности. В настоящее время они практически не применяются, поскольку имеются более информативные и менее опасные методики. Вместе с тем следует отметить, что существует так называемая методика эмбриоскопии, применяемая в I триместре беременности. Для ее проведения используется специальная гибкая волоконная оптика.
В табл. 29.1 суммированы данные о возможности пренатальной диагностики наследственной патологии.
С применением современных технологий, позволяющих уточнить диагноз у плода, появилась возможность проведения внутриутробного лечения с помощью лекарственных препаратов, назначаемых беременной, или путем непосредственного их введения плоду. Кроме того, возможна и так называемая внутри маточная хирургия плода (пунктирование, шунтирование) при наличии такой патологии, как гидронефроз, гидроторакс, асцит, некоторые формы гидроцефалии.
Но главной остается профилактика наследственной патологии: 1. медико-генетическое консультирование; 2. диагностика гетерозиготных состояний у родителей; 3. пренатальная диагностика; 4. преклиническая диагностика; 5. проверка на мутагенность и гигиеническая регламентация; 6. диспансеризация; 7. пропаганда меди ко генетических знаний.
Планирование семьи
По определению экспертов ВОЗ (1970), термином "планирование семьи" называют те виды деятельности, которые имеют целью помочь отдельным лицам или супружеским парам достичь определенных результатов: избежать нежелательной беременности; произвести на свет желанных детей; регулировать интервал между беременностями; контролировать выбор времени деторождения в зависимости от возраста родителей и определять количество детей в семье. Для этой цели используются санитарное просвещение и консультирование по вопросам планирования семьи; обеспечение противозачаточными средствами; просвещение по вопросам семьи и брака, а также организация соответствующих служб и мероприятий, таких как генетические консультации.Одним из важных и актуальных аспектов планирования семьи является лечение бесплодия, дающее возможность семье иметь желанных детей.
В соответствии с медико-биологической точкой зрения на планирование семьи последнее способствует снижению младенческой смертности, укреплению здоровья матери и ребенка.
Чрезвычайно важное значение имеет работа по планированию семьи в сохранении здоровья подростков. Она включает в себя предоставление информации о вреде раннего начала половой жизни, риске наступления беременности, особенностях исходов родов и абортов, а также обеспечение контрацептивными средствами, анонимность услуг. Опыт показывает, что хорошо поставленная работа по планированию семьи с подростками при-водит в последующем к снижению показателей материнской заболеваемости и смертности, профилактике искусственных абортов, предупреждению заболеваний, связанных с ранним началом половой жизни, профилактике СПИДа и венерических заболеваний.
Современные методы контрацепции включают в себя барьерные, химические, биологические, внутри маточные, гормональные и хирургические.
Барьерные методы.
Являются традиционными и наиболее древними. Появление более эффективных методов контрацепции за последние 20 лет значительно снизило популярность барьерных методов.
Однако осложнения, которые могут возникать при применении более современных методов контрацепции, противопоказания к их использованию, а также значительная распространенность заболеваний, передаваемых половым путем, заставляют совершенствовать барьерные методы контрацепции.
Различают женские (немедикаментозные и медикаментозные барьерные средства) и мужские барьерные средства.
Принцип действия барьерных контрацептивов заключается в блокировании проникновения спермы в шеечную слизь.
Преимущества барьерных методов контрацепции: 1. применяются и действуют только местно, не вызывая системных изменений; 2. небольшое число побочных эффектов; 3. в значительной степени предохраняют от болезней, передающихся половым путем; 4. практически не имеют противопоказаний к применению; 5. не требуют привлечения высококвалифицированного медицинского персонала.
Показания к применению: 1. противопоказания к использованию оральных контрацептивов (ОК.) и внутри маточных средств (ВМС); 2. во время лактации, поскольку не влияют ни на количество, ни на качество молока; 3. в случае необходимости приема лекарственных средств, не сочетающихся с ОК или снижающих их эффективность; 4. после самопроизвольного аборта до тех пор, пока не наступит период, благоприятный для новой беременности; 5. в качестве временного средства перед производством стерилизации мужчины или женщины.
Недостатки барьерных методов: 1. менее эффективны, чем большинство ОК и ВМС; 2. у некоторых пациентов использование невозможно вследствие аллергии на резину, латекс или полиуретан; 3. для успешного применения требуется постоянное внимание; 4. применение требует выполнения определенных манипуляций на гениталиях; 5. большая часть барьерных контрацептивов применяется во время полового акта или непосредственно перед ним.
Влагалищная диафрагма, или влагалищный пессарий.
Применяется с целью контрацепции изолированно или в сочетании со спермицидами.
Диафрагма представляет собой куполообразный резиновый колпачок с гибким ободком, который вводится во влагалище до начала полового акта таким образом, чтобы задний ободок находился в заднем своде влагалища, передний касался бы лобковой кости, а купол покрывал шейку матки. Диафрагмы бывают разных размеров: от 50 до 150 мм. Нерожавшим женщинам обычно подходит влагалищная диафрагма размером 60-65 мм, а рожавшие женщины пользуются влагалищной диафрагмой 70-75 мм. После родов размер диафрагмы должен быть подобран снова.
Женщина, выбравшая диафрагму в качестве метода контрацепции, должна быть проинструктирована врачом. Врач знакомит ее с анатомией таза и половых органов для того, чтобы женщина представляла расположение диафрагмы по отношению к шейке матки и самой матке.
После этого производят осмотр женщины и подбирают диафрагму по размеру и типу. Затем женщина вводит диафрагму; для этого двумя пальцами правой руки женщина, сидя на корточках или лежа на спине, вводит во влагалище диафрагму (левой рукой женщина разводит половые губы) в сжатом виде кверху и продвигает ее по задней стенке влагалища, пока не достигнет заднего свода влагалища. После этого часть края, которая проходила последней, подталкивают кверху до соприкосновения с нижним краем лобковой кости. После введения диафрагмы женщина должна пальпаторно проверить расположение диафрагмы, покрывающей шейку матки. Извлекать влагалищную диафрагму следует указательным пальцем путем подтягивания вниз за передний край, при возникших трудностях следует потужиться. После извлечения диафрагмы ее необходимо вымыть горячей водой с мылом, вытереть и поместить на 20 мин в 50-70 % раствор спирта.
Преимущества влагалищной диафрагмы заключаются в простоте применения, возможности многократного использования, безвредности и в значительной степени защите от инфекций, передаваемых половым путем.
Противопоказания к применению – эндоцервицит, кольпит, эрозия шейки матки, аллергия к резине и спермицидам, аномалии развития гениталий, опущение стенок влагалища и матки.
Могут наблюдаться следующие побочные эффекты: 1. инфицирование мочевых путей вследствие давления диафрагмы на уретру; 2. возникновение воспалительных процессов в местах контакта диафрагмы со стенками влагалища.
Частота наступления беременности при использовании диафрагмы в сочетании со спермицидами составляет 2 беременности в год на 100 женщин, использующих этот метод в течение года регулярно и правильно, и 10 беременностей в год на 100 женщин, не прошедших консультирование.
Шеечные колпачки.
В настоящее время существует 3 типа цервикальных колпачков, изготовляемых из латексной резины.
Цервикальный колпачок Прентифа – глубокий мягкий резиновый колпачок с твердым ободком и выемкой для усиления присоса. Своим ободком плотно насаживается возле соединения шейки и влагалищных сводов. Размеры колпачка Прентифа – 22, 25, 28, 31 мм (диаметр наружного ободка).
Колпачок Вимуля имеет форму колокола, его открытый конец шире, чем тело колпачка. Устанавливается непосредственно над шейкой матки, однако его открытый конец закрывает и часть влагалищного свода. Колпачок изготавливают диаметром 42, 48 и 52 мм.
Колпачок Думса, или сводчатый колпачок, имеет конфигурацию плоского купола и напоминает диафрагму с той лишь разницей, что он изготавливается из более плотного материала и в его ободке отсутствует пружина. Колпачок выпускается размером от 50 до 75 мм. Установленный колпачок закрывает шейку матки, своды и верхнюю часть влагалища и удерживается на месте стенками влагалища, а не за счет сцепления с шейкой матки.
Соответствующий тип и размер шеечного колпачка определяются во время осмотра по форме и размеру шейки матки. Введение его через вход во влагалище облегчается за счет сжатия краев, а размещение над шейкой – за счет наклона колпачка во влагалище. Перед тем как вводить колпачок, на его внутреннюю поверхность надо нанести спермицидный препарат. После того как медицинский работник установил женщине колпачок, он должен ей объяснить, как проверить правильность установки средства и закрыта ли им шейка матки. Затем женщина извлекает колпачок и повторно его вводит, а медицинский работник проверяет, правильно ли она это выполняет. Не рекомендуется, чтобы колпачок находился во влагалище более 4 ч.
Презерватив.
Это единственное противозачаточное средство, применяемое мужчинами. Презерватив (кондом) представляет собой мешотчатое образование из толстой эластичной резины толщиной менее 1 мм, в результате чего обеспечивается возможность увеличения презерватива в зависимости от размеров полового члена. Длина презерватива 10 см, ширина 2,5 см.
Скрученный кондом надевают на половой член, находящийся в состоянии эрекции, когда головка не покрыта крайней плотью.
Теоретическая эффективность составляет 3 беременности на 100 женщин в год, клиническая эффективность равна 15-20 беременностей на 100 женщин в год.
Недостатки и побочные эффекты презерватива заключаются в возможном снижении сексуального ощущения у одного или обоих партнеров; в необходимости применения презерватива в определенной стадии полового акта; в возможном появлении аллергии к латексной резине или к смазке, применяемой в презервативе; возможен разрыв презерватива.
Но имеются и преимущества презерватива, так как он прост в употреблении. Верно то, что презерватив предохраняет от заражения заболеваниями, передающимися половым путем, и ВИЧ-инфекции.
Химические средства контрацепции.
Механизм действия спермицидов заключается в инактивации спермы и препятствии проникновения ее в матку. Основным требованием, предъявляемым к слермицидам, является способность разрушать сперматозоиды за несколько секунд.
Спермициды выпускаются в виде кремов, желе, пенных аэрозолей, тающих свечей, пенящихся свечей и таблеток.
Можно также применять после полового акта спринцевания растворами (оказывающими спермицидное действие) уксусной, борной или молочной кислот, лимонного сока. Учитывая данные о том, что через 90 с после полового акта в маточных трубах определяются сперматозоиды, спринцевание спермицидным препаратом нельзя считать надежным методом контрацепции.
Современные спермициды состоят из спермоубивающего вещества и носителя. Оба компонента играют одинаково важную роль в обеспечении контрацептивного эффекта. Носитель обеспечивает дисперсию химического вещества во влагалище, обволакивая шейку матки, вследствие чего ни один сперматозоид не может избежать контакта со спермицидным ингредиентом.
Активным ингредиентом для большинства современных спермицидов являются сильнодействующие сурфактанты, разрушающие клеточную мембрану сперматозоидов. Это нононсилон-9, менфегол, октооктинол и хлорид бензалкониум.
Спермициды могут использоваться с презервативами, диафрагмой, колпачками и самостоятельно. Спермициды вводят в верхнюю часть влагалища за 10-15 мин до полового акта. Для одного полового акта достаточно однократного использования препарата. При каждом последующем половом акте необходимо дополнительное введение спермицида.
Частота неудач изолированного использования спермицидов колеблется от 3 до 5 беременностей на 100 женщин в год при правильном применении данного метода. В среднем же она составляет около 16 беременностей на 100 женщин в год.
Биологический (ритмический, или календарный) метод.
Основан на периодическом воздержании от половой жизни в периовуляторные дни.
В настоящее время применяют 4 метода выявления периода овуляции: календарный, или ритмический, температурный, симптотермальный и метод исследования цервикальной слизи.
Календарный (ритмический) метод. Основан на том, что овуляция развивается за 14 дней до начала менструации (при 28-дневном менструальном цикле), длительности жизнеспособности сперматозоидов в организме женщины (приблизительно 8 дней) и яйцеклетки после овуляции (обычно 24 ч).
Календарный метод контрацепции неэффективен при нерегулярном менструальном цикле. Эффективность календарного метода составляет 14,4-47 беременностей на 100 женщин в год.
Температурный метод. Основан на определении времени подъема базальной температуры путем ежедневного ее измерения. Фертильным считается период от начала менструального цикла до подъема базальной температуры в течение 3 последовательных дней.
Несмотря на то что необходимость ежедневного измерения температуры и период длительного воздержания ограничивают его распространенность, эффективность метода составляет 0,3-6,6 случая беременности на 100 женщин в год.
Симптотермальный метод сочетает в себе элементы календарного, цервикального и температурного с учетом таких признаков, как появление болей йнизу живота и скудных кровянистых выделений во время овуляции.
При половых сношениях только после овуляции частота беременностей составляет 2 на 100 женщин в год, а при половых сношениях до и после овуляции частота беременностей возрастает до 12 на 100 женщин в год.
Внутриматочные средства.
Внутриматочная контрацепция заключается во введении в матку инородного тела – внутри маточного средства (ВМС). Начиная с I960 г. благодаря применению в медицинской практике инертной и гибкой пластмассы ВМС стали применяться достаточно широко для контрацепции.
Механизм контрацептивного действия ВМС сложный и многофакторный. Под влиянием ВМС происходят травматизация эндометрия, выброс простагландинов, повышается тонус мускулатуры матки, что приводит к изгнанию эмбриона в ранних стадиях имплантации. ВМС усиливает сокращения маточных труб и матки, поэтому оплодотворенная яйцеклетка попадает в матку преждевременно. Трофобласт еще неполноценный, эндометрий не подготовлен к внедрению оплодотворенной яйцеклетки, в результате чего имплантация оказывается невозможной. ВМС как инородное тело вызывает лейкоцитарную инфильтрацию эндометрия. Возникающие воспалительные изменения эндометрия препятствуют имплантации и дальнейшему развитию бластоцист. Кроме того, лейкоцитарная инфильтрация сопровождается увеличением количества макрофагов, которые осуществляют фагоцитоз сперматозоидов. Под влиянием ВМС происходит изменение содержания ферментов в эндометрии, что неблагоприятно воздействует на процессы имплантации. Добавление меди и серебра к ВМС усиливает спермато-токсический эффект.
Все изложенное приводит к довольно надежному (91-98%) предупреждению наступления беременности.
В настоящее время создано более 50 видов ВМС из пластмассы и металла, которые отличаются друг от друга по жесткости, форме и размерам. Различают 3 поколения ВМС: к первому поколению ВМС относятся так называемые инертные ВМС, ко второму – медьсодержащие ВМС, к третьему – гормонсодержащие средства.
Абсолютными противопоказаниями к использованию ВМС являются острые и подострые воспалительные процессы в гениталиях; подтвержденная или предполагаемая беременность; злокачественные новообразования гениталий, К относительным противопоказаниям относятся аномалии развития половой системы; миома матки; гип ер пластические процессы в эндометрии; гиперполименорея; фоновые и воспалительные заболевания шейки матки; анемия и другие заболевания крови.
ВМС обычно вводят на 4-6-й день менструального цикла, когда цервикальный канал приоткрыт и облегчается проведение процедуры. В этот период с большей вероятностью исключается наличие беременности. ВМС может быть введено непосредственно после аборта и в послеродовом периоде, но при этом наблюдается относительно высокая частота экспульсий в течение первых нескольких недель. Поэтому лучше производить введение ВМС через 6 нед после родов.
Методика введения ВМС заключается в следующем: в асептических условиях обнажают зеркалами шейку матки, обрабатывают ее дезинфицирующим раствором и захватывают пулевыми щипцами переднюю губу. Измеряют длину полости матки с помощью маточного зонда. С помощью проводника вводят ВМС в полость матки (рис. 29.1). Подрезают нити до длины 2-3 см. Снимают пулевые ние ВМС в полости матки. щипцы и обрабатывают шейку матки дезинфицирующим раствором. В правильном положении ВМС можно убедиться с помощью УЗИ.
 Рис. 29.1. Правильное расположе ВМС
Рис. 29.1. Правильное расположе ВМС
Первый врачебный осмотр производят через 3-5 дней после введения, после чего разрешают половую жизнь без использования какого-либо другого контрацептива. Повторные осмотры желательно производить каждые 3 мес.
Осложнения при применении ВМС – экспульсий; кровотечения; вос-палительные заболевания; "врастание" петли в толщу стенки матки, перфорация матки относится к наиболее редким (1:5000).
Гормональная контрацепция. Гормональные контрацептивные средства являются синтетическими аналогами женских половых гормонов – эстрогенов и прогестерона, а также их производных. В настоящее время синтезировано более 300 разновидностей гормональных контрацептивов.
История развития гормональной контрацепции насчитывает более 40 лет. В се-редине 50-х годов были созданы первые гормональные противозачаточные препара-ты. В 1960 г. появился первый эстроген-гестагенный контрацептив "Эновид".
В конце 60-х годов было доказано, что наиболее серьезные побочные явления данного метода контрацепции связаны с эстрогенным компонентом оральных про-тивозачаточных средств.
В 1973 г. появились гормональные контрацептивы, содержащие только прогестины – мини-пили, которые широко используют женщины, кормящие грудью; кроме того, мини-пили применяются при наличии противопоказаний к применению эстрогенов. Почти в это же время появились инъекционные контрацептивы.
Одним из основных направлений в развитии гормональной контрацепции за прошедшие годы стало уменьшение количества сначала эстрогенного, а затем и гестагенного компонентов во вновь синтезируемых препаратах. Изменилась также и фармакология гормональных контрацептивов: в качестве эстрогенного компонента чаще всего в составе новых препаратов используется этинилэстрадиол, в качестве гестагенного – левоноргестрел, дезогестрел, гестоден, норгестимат, которые прояв-ляют биологическую активность на уровне рецепторов без предварительных метабоА лических превращений и оказывают сильное гестагенное действие на эндометрий. Такое изменение структуры гормональных контрацептивов обеспечивает сохранение
высокого противозачаточного эффекта в условиях значительного снижения их дозировки, что способствует хорошей переносимости препаратов и уменьшает их побочное действие.
В зависимости от состава, дозы и метода применения гормональных контрацептивов их подразделяют на следующие группы: 1. комбинированные эстроген-гестагенные препараты, которые делятся на монои многофазные (двухи трехфазные); 2. прогестинсодержащие контрацептивы (гестагенная контрацепция) (мини-пили, пролонгированные инъекционные препараты, импланты); 3. посткоитальные препараты, содержащие большие дозы эстрогенов, гестагенов, кортикостероидов и применяемые в первые часы после незащищенного полового акта.
Согласно данным литературы, контрацептивное действие оральных препаратов может осуществляться на различных уровнях системы гипоталамусгипофиз – яичники – матка-маточные трубы. Этот механизм включает в себя следующее: 1) временное подавление гонадотропной функции гипофиза посредством торможения выработки рилизинг-гормонов, что ведет к подавлению овуляции и наступлению временной стерильности; 2) торможение функции яичников, в результате чего происходит неполноценная овуляция и развивается функционально малоактивное желтое тело, неспособное выполнять функцию протектора беременности; 3) замедление перистальтики маточных труб и соответственно прохождения по ним яйцеклетки. Установлено также влияние этих препаратов на эндометрий, который претерпевает ранние секреторные изменения. Эндометрий как бы переходит в состояние "гландулярной регрессии", что делает его непригодным для имплантации яйцеклетки. Отсутствие циклических изменений в цервикальной слизи во вторую фазу цикла делает ее высоковязкой, ухудшает процесс пенетрации сперматозоидов.
Несмотря на усовершенствование способов гормональной контрацепции, необходим индивидуальный подбор гормонального препарата с учетом показаний и противопоказаний, частоты и особенностей побочных реакций, наличия у женщины гинекологических и экстрагенитальных заболеваний, ее возраста, состояния репродуктивной системы, особенностей половой жизни и сексуальных отношений.
Абсолютные противопоказания к применению гормональных контрацептивов – тромбофлебит в прошлом и настоящем или тромбоэмболические осложнения, сосудистые нарушения ЦНС или поражение коронарных сосудов сердца, злокачественные опухоли, беременность или подозрение на беременность, кровотечения из половых путей неясной этиологии, острые заболевания печени.
К относительным противопоказаниям относятся те, которые могут увеличить опасность, связанную с приемом гормональных контрацептивов для конкретной пациентки.
К относительным противопоказаниям относятся курение, возраст женщины 35 лет и старше, артериальная гипертензия или гипертензия в анамнезе при беременности, ожирение, варикозное расширение вен, случаи семейного тромбоза в анамнезе, эпилепсия, сахарный диабет, приступы депрессии в анамнезе, олигоменорея или аменорея у нерожавших женщин, хронический холецистит или гепатит.
Комбинированные монофазные эстроген-гестагенные препараты. В их состав входят эстрогены и гестагены в различных соотношениях.
Наиболее известны в нашей стране комбинированные эстроген-гестагенные препараты с постоянной дозой гормональных компонентов в каждой таблетке, отличающиеся друг от друга различным соотношением эстрогенного и гестагенного компонентов и их структурой.
В монофазные эстроген-гестагенные препараты, такие как бисекурин, овидон, регивидон (Венгрия), диане-35, микрогинон, минизистон, фемоден (Германия), минулет, цилест (США), демулен (Англия), марвелон (Голландия), входит постоянная доза эстрогенных и гестагенных компонентов, содержащихся в одной таблетке; препарат принимается в течение всего периода индуцированного менструального цикла. До настоящего времени монофазные препараты являются наиболее распространенным методом гормональной контрацепции. Высокая надежность препаратов этой группы и выраженное лечебное действие при целом ряде гинекологических заболеваний являются большим преимуществом перед препаратами других типов.
Препарат назначают с 1-го или 5-го дня менструального цикла в течение 21 дня по 1 таблетке ежедневно в одно и то же время. После перерыва в 7 дней вновь начинают прием таблеток по той же схеме. Таким образом, устанавливается ритм: 3 нед приема, 1 нед перерыва.
Многофазные (двухи трехфазные) эстроген-гестагенные препараты. Переменное содержание стероидов в двухи трехфазных контрацептивах позволило почти на 40 % снизить общую курсовую дозу гестагенного компонента по сравнению с дозой, получаемой при применении аналогичных монофазных препаратов.
В нашей стране зарегистрированы следующие препараты: двухфазный препарат антеовин (Венгрия) и трехфазные триквилар, милване (Германия), три-регол (Венгрия).
Гестагенные контрацептивы. Этот вид контрацепции был создан в связи с необходимостью исключить эстрогенный компонент, который может иногда обусловливать метаболические нарушения, артериальную гипертензию, повышение свертывания крови. Они не содержат эстрогенного компонента и состоят только из синтетических гестагенов.
Препараты, содержащие только прогестины, являются более приемлемыми противозачаточными средствами для женщин старшего репродуктивного возраста и кормящих матерей.
Среди преимуществ этих препаратов следует отметить то, что они не повышают риск развития нарушений свертывающей системы крови, редко вызывают головные боли и повышение артериального давления, так как не содержат эстрогенного компонента.
К гестагенным методам контрацепции относятся: 1. оральные контрацептивы, содержащие только прогестаген (минипили), эксклютон (Нидерланды), микролют (Германия), континуин (Венгрия) и др.; 2. инъекционные прогестагены: депо-провера (США), мезигина (Германия) ; 3. подкожные импланты (норплант).
Гестагенные контрацептивы имеют свои преимущества и недостатки.
Преимущества: они могут применяться во время лактации, при грудном вскармливании, так как не влияют на лактацию; могут применяться уже через 6 нед после родов; лучше переносятся (отсутствие эстрогензависимых побочных реакций); незначительно влияют на липидный обмен и функцию печени, артериальное давление, факторы свертывания крови; могут применяться при наличии противопоказаний к применению эстрогенсодержащих препаратов.
Наиболее частыми побочными реакциями являются нарушения менструального цикла: межменструальные кровянистые выделения или аменорея. Редко могут отмечаться тошнота, рвота, депрессия, изменение массы тела, головные боли, нагрубание молочных желез. Чем меньше доза гестагена, тем реже встречаются перечисленные реакции.
Гестагенные пероральные контрацептивы (мини-пили). Препараты этой группы содержат минимальные дозы гестагенов. Они появились спустя 10 лет после внедрения в клиническую практику комбинированных оральных контрацептивов. В отличие от комбинированных эстроген-гестагенных контрацептивов препараты, содержащие микродозы прогестинов, следует принимать ежедневно с 1-го дня менструального цикла и непрерывно. После завершения приема препарата из одной упаковки на следующий день его прием продолжают без перерыва из другой упаковки и т.д.
Инъекционные прогестины. Наиболее часто используются такие прогестины, как 17-медроксипрогестеронацетат (депо-провера, США). Показатель неэффективности для указанных контрацептивов составляет менее одного случая беременности на 100 женщин в год.
Наиболее неблагоприятной реакцией в период введения указанных противозачаточных средств является нарушение менструального цикла по типу ациклических кровянистых выделений.
Депо-провера в качестве контрацептивного средства вводят 1 раз в 90 дней (3 мес) в дозе 150 мг внутримышечно.
Первую инъекцию производят в течение первых 5 дней от начала менструации внутримышечно. После аборта инъекцию можно производить сразу же, после родов – через 6 нед, если женщина является кормящей матерью, и сразу же после них, если она не кормит грудью.
Иногда у женщин, применяющих указанные контрацептивы, могут возникнуть такие побочные реакции, как головная боль, нагрубание молочных желез, снижение либидо, отеки, увеличение массы тела. Чаще эти побочные реакции не носят выраженного характера и исчезают самостоятельно в первые месяцы контрацепции.
Отрицательным моментом использования депо-провера является отсроченное восстановление фертильности. Восстановление репродуктивной функции после прекращения введения депо-провера наступает в среднем через 5,5 мес и позже (через 1-2 года).
Подкожные импланты. Норплант является эффективным контрацептивным средством продолжительного действия, обеспечивающим непрерывное предохранение от беременности в течение 5 лет.
Норплант состоит из 6 небольших мягких капсул из силастика. Каждая капсула содержит 36 мг левоноргестрела, диаметр ее составляет 2,4 мм, длина 34 мм. Капсулы имплантируют под кожу плеча через небольшой разрез под местной анестезией. Контрацептивный эффект обеспечивается благодаря медленному непрерывному выделению левоноргестрела в кровоток и проявляется уже через сутки. Через 5 лет капсулы подлежат удалению. Введение и удаление норпланта должно производиться специально обученным персоналом.
Наиболее частыми побочными реакциями при использовании норпланта являются нарушения менструального цикла: развитие межменструальных кровянистых выделений, скудных менструаций или аменореи.
Фертильность восстанавливается через несколько месяцев после удаления капсул.
Посткоитальные препараты.
Посткоитальную, или экстренную, контрацепцию как чрезвычайную меру предохранения от нежелательной беременности целесообразно рекомендовать женщинам, подвергшимся изнасилованию, при наличии сомнений в целости использованного презерватива, в ситуациях, когда при половом акте смещается диафрагма или когда планируемые методы контрацепции не могут быть использованы. В назначении посткоитальных методов нуждаются также женщины, редко живущие половой жизнью.
Основой механизма посткоитальной контрацепции являются десинхронизация физиологических процессов менструального цикла, подавление или отдаление овуляции, нарушения процесса оплодотворения, нарушение транспорта яйцеклетки, имплантации и дальнейшего развития эмбриона.
Назначать контрацепцию целесообразно в первые 24-72 ч после полового контакта.
Для экстренной контрацепции в мире предлагаются следующие средства: эстрогены, эстроген-гестагенные препараты, гестагены, антигонадотропины. антипрогестины.
Эстрогены. Диэтилстильбэстрол в дозе 0,25 мг, конъюгированные эстрогены до 10 мг, эстерон по 5 мг, этинилэстрадиол по 0,25 мг применяют 2 раза в день на протяжении 5 дней после полового акта. Эстрогеновая посткоитальная контрацепция признана высокоэффективной, однако при ее использовании отмечается большая частота побочных реакций в виде тошноты, рвоты, не исключены осложнения, связанные с гиперкоагуляцией.
Комбинированные эстроген-гестагенные препараты являются наиболее распространенными средствами для посткоитальной контрацепции. Этот метод заключается в назначении 200 мкг этинилэстрадиол а и 1 мг левоноргестрела по следующей схеме: в течение 72 ч после полового акта женщина принимает первую половину дозы, а через 12 ч – вторую половину.
Гестагены входят в группу препаратов, среди которых в нашей стране наиболее распространен постинор (Венгрия), содержащий 0,75 мг левоноргестрела, который рекомендуют принимать по 1 таблетке в течение 1 ч после полового акта, при повторном акте – еще 1 таблетку через 3 ч, при последующих контактах повторить прием через 24 ч.
Даназол – синтетический андроген, который рекомендуют принимать дважды по 400 мг с интервалом 12 ч или трижды в том же режиме.
Считается, что при использовании даназола с целью посткоитальной контрацепции побочных эффектов меньше, чем в случае использования комбинированных эстроген-гестагенных препаратов. Кроме того, даназол можно принимать при наличии противопоказаний к применению эстрогенгестагенных препаратов.
Мифепристон (РУ-486) – синтетический антипрогестин, известный под названием "РУ-486", является стероидным производным норэтистерона. Имеются сведения о том, что для посткоитальной контрацепции его можно применять в дозе 600 мг однократно в течение 72 ч или по 200 мг с 23-го по 27-й день менструального цикла. Препарат известен как средство для производства консервативного аборта при ранних сроках беременности. По некоторым данным, возможно применение "РУ-486" в течение 5 нед после полового контакта.
Мифепристон также может использоваться для посткоитальной контрацепции в ситуациях, когда женщине противопоказаны эстрогены. Одним из отрицательных эффектов "РУ-486" является замедление менструального цикла после отмены препарата, что обусловлено задержкой созревания фолликула.
Таким образом, посткоитальная контрацепция – это разовая контрацепция, которая не должна применяться постоянно. Не существует методов посткоитальной контрацепции, эффективность и безопасность которых позволила бы рекомендовать их для постоянного использования в течение многих менструальных циклов. Поэтому после применения экстренных средств должен быть назначен какой-либо другой метод контрацепции.
Добровольная хирургическая контрацепция (стерилизация).
Представляет собой самый эффективный метод предохранения как для мужчин, так и для женщин, является безопасным и экономным способом контрацепции. У женщин при необходимости в 50 % наблюдений удается в последующем восстановить проходимость труб хирургическим путем.
В России по желанию пациентов хирургическая стерилизация может быть произведена при соблюдении следующих условий: наличие в семье не менее 2 детей; возраст пациента не моложе 35 лет; письменное заявление.
Женская стерилизация представляет собой хирургическое блокирование проходимости маточных труб с целью воспрепятствования слиянию сперматозоида с яйцеклеткой, Это достигается путем лигирования, примененияспециальных зажимов, колец или электрокоагуляции маточных (фаллопиевых) труб. Методом выбора является лапароскопический доступ, но может быть осуществлена лапаротомия.
Мужская стерилизация, или вазэктомия, заключается в блокировании семявыносящих протоков для предотвращения проходимости спермы. Вазэктомия является простым, недорогостоящим и надежным методом мужской контрацепции.
Принципы выбора метода контрацепции у женщин с экстрагенитальной патологией. При подборе метода контрацепции женщинам с различными экстрагенитальными заболеваниями необходимо руководствоваться противопоказаниями к применению различных средств контрацепции, тщательным анализом течения заболевания и индивидуальными особенностями женщины.
Наиболее распространенными среди экстрагенитальных заболеваний являются заболевания сердечно-сосудистой системы. При тяжелых формах (пороки сердца, ишемическая болезнь сердца, острые тромбофлебиты, тромбоэмболические состояния, гипертоническая болезнь I и II степени) рекомендуется отдавать предпочтение ВМС, барьерным, физиологическому и химическим методам контрацепции; из гормональных контрацептивов – мини-пили. При наиболее тяжелых проявлениях сердечно-сосудистой патологии показана хирургическая стерилизация.
Ввиду способности эстрогенов вызывать гиперволемию, стимулировать функции миокарда, увеличивать систолический и минутный объем сердца при сердечно-сосудистых заболеваниях противопоказаны эстроген-гестагенные ОК.
При варикозном расширении вен и в отсутствие симптомов тромбофлебита, в том числе в анамнезе, допустимо применение эстроген-гестагеиных ОК с низким содержанием эстрогенов, под тщательным контролем за состоянием показателей свертывающей системы крови.
Хронические, часто рецидивирующие воспалительные заболевания органов дыхания (бронхоэктатическая болезнь, хроническая пневмония и др.) не являются противопоказанием к какому-либо методу контрацепции. Лишь в острый период заболеваний при необходимости использования антибиотиков и сульфаниламидов не рекомендуется использование эстроген-гестагенных ОК.
При заболеваниях органов пищеварения (нарушение функции печени, цирроз печени, гастрит, холецистит, опухоли печени, хронический гастрит) выбор контрацепции исключает гормональные препараты. Рекомендуется использовать ВМС, барьерные, химические и физиологический методы. Контрацепция при хронических рецидивирующих заболеваниях определяется частотой обострений и функцией почек, В период длительной ремиссии возможно применение комбинированных ОК с низким содержанием эстрогенов, ВМС, барьерных, химических и физиологического методов стерилизации.
При заболеваниях нервной системы (поражение сосудов головного мозга, эпилепсия, мигрень) и психических заболеваниях, сопровождающихся депрессией, противопоказана гормональная контрацепция, но возможно применение ВМС, барьерной и химической контрацепции, физиологического метода.
Экстракорпоральное оплодотворение
Большим достижением науки и практики XX века явилось оплодотворение яйцеклетки вне организма женщины (in vitro), выращивание эмбриона в специальных средах, а затем трансплантация его в матку.Первое сенсационное сообщение о рождении ребенка после экстракорпорального оплодотворения (ЭКО) относится к 1978 г. (Кембридж). Метод получил широкое распространение в 80-90-х годах после существенных достижений в области фармакологии, биохимии, ультразвуковых исследований.
К методам вспомогательной репродукции относятся ЭКО и перенос эмбриона (ЭКО-ПЭ), перенос гамет в маточную (фаллопиеву) трубу (GIFT – garnet intrafallopian transfer), перенос зигот в маточную трубу (ZIFT – zygot intrafallopian transfer), интрацитоплазматическая инъекция сперматозоида в яйцеклетку (ICSI – intracytoplasmic sperm injection). В последнее время широко применяются и другие программы вспомогательной репродукции: программа донации ооцитов, которая применяется у женщин в периоде перименопаузы, после двусторонней овариэктомии и других состояниях, при которых невозможно получение собственной яйцеклетки; программа суррогатного материнства, при котором вынашивается беременность, наступившая после переноса донорского эмбриона.
Вспомогательная репродукция включает в себя получение ооцитов у женщин в естественном или стимулируемом цикле. Полученные ооциты оплодотворяются и инкубируются до образования эмбрионов в специальных условиях и с использованием специальных сред, а затем переносятся в матку, где происходит имплантация.
Показаниями к ЭКО являются трубное бесплодие вследствие непроходимости труб или их отсутствия, наличие иммунологического фактора бесплодия, мужской фактор бесплодия и др.
Противопоказаниями к проведению ЭКО являются доминантно наследуемые заболевания. Метод не рекомендуется при врожденных пороках сердца, шизофрении, аффективном психозе, при наличии в семье детей с заболеваниями, передающимися аутосомно-рецессивным путем (риск повторного наследования достигает 25 %).
Возраст пациенток, подвергающихся проведению вспомогательной репродукции, в настоящее время не ограничен, хотя, безусловно, для рождения и воспитания ребенка более благоприятен возраст матери до 35-40 лет. В литературе опубликованы случаи рождения детей после ЭКО у женщин старше 50 лет.
Техника ЭКО. Чаще для ЭКО используются собственная яйцеклетка женщины и сперма желаемого партнера. Однако допустимо и широко практикуется применение донорской яйцеклетки и донорской спермы.
Для получения яйцеклетки следует добиться созревания нескольких доминантных фолликулов – суперовуляции, что повышает возможность взятия созревшей яйцеклетки. Стимуляция овуляции проводится различными способами: 1. стимуляция выделения собственных эндогенных гонадотропи нов кломифеном; 2. стимуляция экзогенными гонадотропинами [препараты из мочи женщин в период менопаузы, содержащие ЛГ и ФСГ (пергонал, неопергонал, хумегон) или ФСГ (метродин)]; 3. стимуляция экзогенными гонадотропинами на фоне блокады собственных гонадотропинов препаратами агонистов РГ ЛГ (декапептиды трипторелин, буссерелин, госерелин, нафарелин и др.). Эти препараты – синтетические аналоги гонадотропных рил изинг-гормонов. Все они в 50-100 раз активнее эндогенных рилизингов. Действие их основано на блокаде собственных гонадотропинов. На фоне снижения уровня собственных гонадотропинов введение экзогенных гонадотропинов позволяет регулировать рост доминантных фолликулов и созревание яйцеклеток.
В повседневной практике используются так называемые длинная и короткая схемы введения препаратов.
При длинной схеме введение агонистов начинают в конце фолликулярной фазы предыдущего цикла, под контролем снижения ЛГ в крови. После наступления устойчивого низкого "плато" содержания ЛГ приступают к введению гонадотропных препаратов. При короткой схеме агонисты вводят с первого дня менструального цикла, гонадотропины – с 3-го или 5-го дня цикла.
При любом методе стимуляции овуляции с помощью УЗИ постоянно контро лируют число фолликулов, темпы их роста и величину, толщину эндометрия. Гормональный мониторинг включает динамический контроль уровня эстрадиола, прогестерона, ЛГ.
При диаметре фолликула 18-20 мм и концентрации эстрадиола 600 нг/мл пациентке назначают хорионический гонадотропин (профазин, прегнил, хориогонин).
Забор ооцитов производят путем пункции фолликулов под УЗ-контролем через 36 ч после назначения хорионического гонадотропина. Технология пункции фолликулов через задний свод влагалища под УЗ-контролем заменила предыдущее использование лапароскопии для забора ооцитов при непосредственной визуализации яичников.
Через 48-72 ч после оплодотворения и дробления зиготы эмбрионы (не более 3-4) переносят в полость матки.
При развитии более 4-6 эмбрионов в среде после оплодотворения часть их подвергается криоконсервации в жидком азоте. Криоконсервации при необходимости подвергаются сперматозоиды и ооциты. Данная манипуляция позволяет в последующем вновь использовать клетки для ЭКО.
После пересадки эмбрионов рекомендуется вводить поддерживающие дозы хорионического гонадотропина и дексаметазон; последний подавляет иммунную реакцию отторжения плодного яйца. Препараты вводят до констатации беременности или до срока очередной менструации в случае неудачи.
Беременность и роды, по данным всех авторов, наступают в 25-30 % случаев.
К осложнениям ЭКО относятся внематочная беременность, многоплодная беременность, синдром гиперстимуляции яичников, прерывание беременности, возможно также сочетание маточной и внематочной беременности.
Если беременность не прерывается в ранних стадиях, то в последующем ее и ведут так же, как обычно.
Способ родоразрешения зависит от наличия акушерских осложнений. В отсутствие таковых роды можно проводить через естественные родовые пути.
Последние комментарии
5 минут 37 секунд назад
6 часов 11 минут назад
6 часов 22 минут назад
6 часов 24 минут назад
6 часов 31 минут назад
6 часов 31 минут назад